МЕТАЛЛЫ Металлы — это элементы























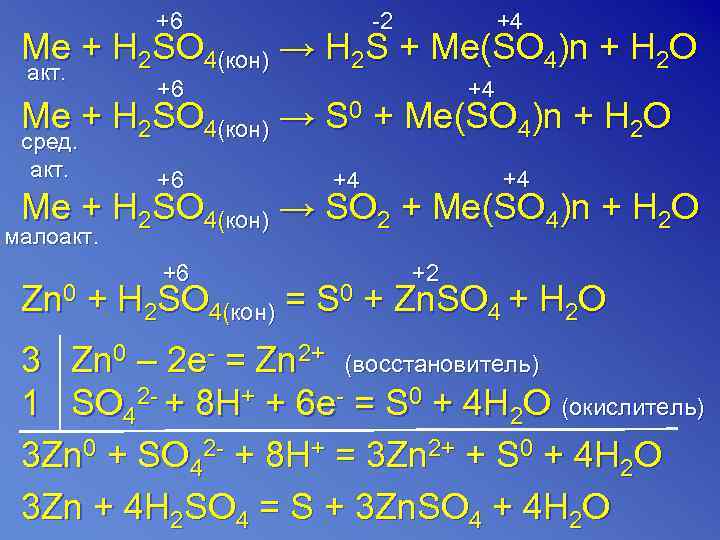
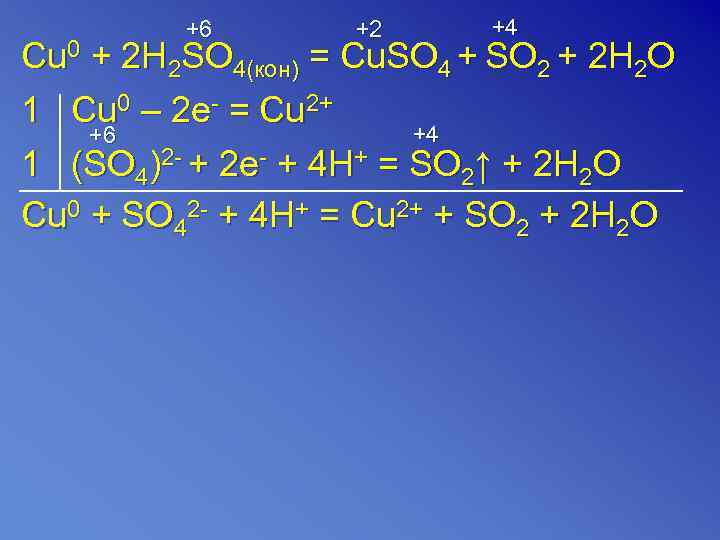



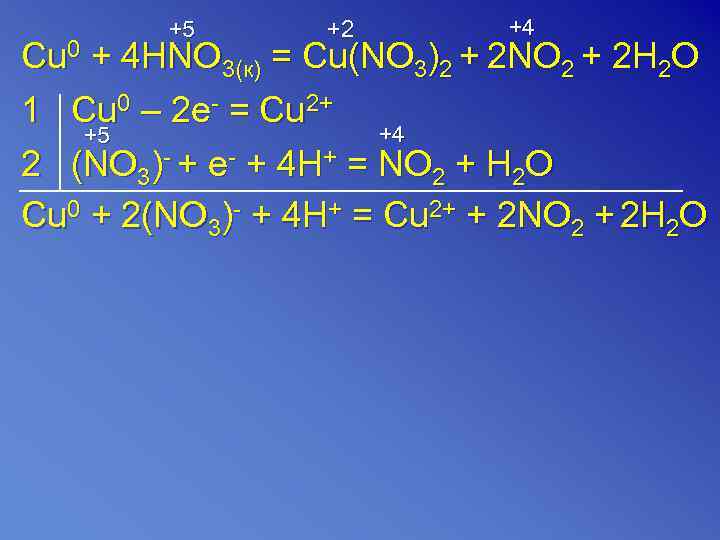
 МЕТАЛЛЫ
МЕТАЛЛЫ
 Металлы - это элементы с относительной электроотрицательностью < 2 Металлы подразделяют на группы: 1. щёлочные 2. щелочноземельные 3. подгруппа меди, скандия, иттрия, титана, лантана
Металлы - это элементы с относительной электроотрицательностью < 2 Металлы подразделяют на группы: 1. щёлочные 2. щелочноземельные 3. подгруппа меди, скандия, иттрия, титана, лантана
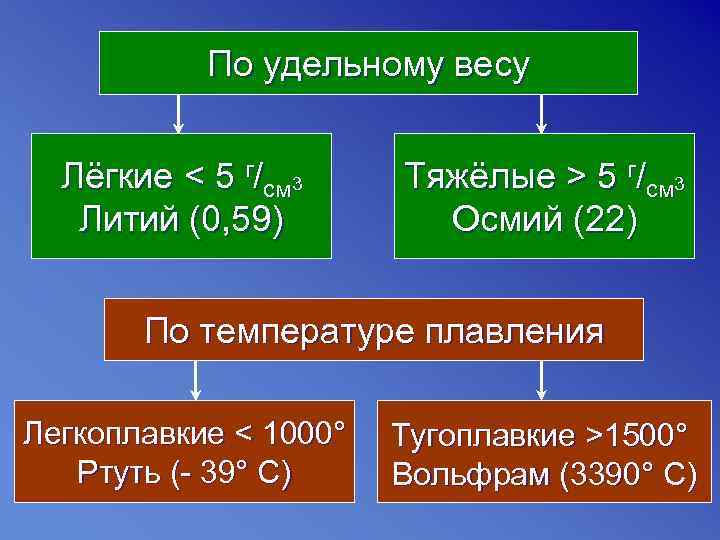
 По удельному весу Лёгкие < 5 г/см 3 Тяжёлые > 5 г/см 3 Литий (0, 59) Осмий (22) По температуре плавления Легкоплавкие < 1000° Тугоплавкие >1500° Ртуть (- 39° С) Вольфрам (3390° С)
По удельному весу Лёгкие < 5 г/см 3 Тяжёлые > 5 г/см 3 Литий (0, 59) Осмий (22) По температуре плавления Легкоплавкие < 1000° Тугоплавкие >1500° Ртуть (- 39° С) Вольфрам (3390° С)
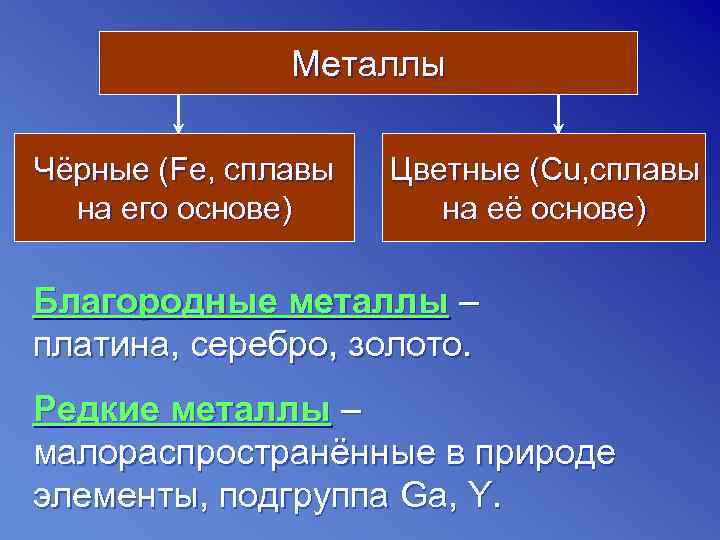
 Металлы Чёрные (Fe, сплавы Цветные (Cu, сплавы на его основе) на её основе) Благородные металлы – платина, серебро, золото. Редкие металлы – малораспространённые в природе элементы, подгруппа Ga, Y.
Металлы Чёрные (Fe, сплавы Цветные (Cu, сплавы на его основе) на её основе) Благородные металлы – платина, серебро, золото. Редкие металлы – малораспространённые в природе элементы, подгруппа Ga, Y.
 Металлы обладают рядом специфических свойств, которые объясняет теория металлического строения, характеризующаяся: 1. особым типом химической связи 2. 2. особой кристаллической структурой
Металлы обладают рядом специфических свойств, которые объясняет теория металлического строения, характеризующаяся: 1. особым типом химической связи 2. 2. особой кристаллической структурой
 Электроны внешних энергетических уровней легко удалить у металлов и получить катионы Ме+n. Металлы → проявляют высокий электроположительный характер, отрицательных ионов не образуют. В металлах осуществляется металлическая связь – это связь за счет делокализованных электронов.
Электроны внешних энергетических уровней легко удалить у металлов и получить катионы Ме+n. Металлы → проявляют высокий электроположительный характер, отрицательных ионов не образуют. В металлах осуществляется металлическая связь – это связь за счет делокализованных электронов.
 Атомы в металлах плотно упакованы и образуют правильные структуры - кристаллические решётки. I. Объёмноцентрированные кубы (щелочные Me, Ba, Fe, Cr) II. Гранецентрированные кубы (Cu, Ag, Ga, Pt) III. Гексогональной cимметрии (Me III гр, Mg, Zn)
Атомы в металлах плотно упакованы и образуют правильные структуры - кристаллические решётки. I. Объёмноцентрированные кубы (щелочные Me, Ba, Fe, Cr) II. Гранецентрированные кубы (Cu, Ag, Ga, Pt) III. Гексогональной cимметрии (Me III гр, Mg, Zn)
 Теория металлической связи объясняет специфические свойства металлов: 1. Пластичность – объясняется тем, что под действием деформирующей силы решётка может изменять свою форму. При этом не происходит разрушения кристаллов, т. к. катионы связываются делокализованными электронами.
Теория металлической связи объясняет специфические свойства металлов: 1. Пластичность – объясняется тем, что под действием деформирующей силы решётка может изменять свою форму. При этом не происходит разрушения кристаллов, т. к. катионы связываются делокализованными электронами.
 2. Электропроводность металлов. Если к концам металлического образца приложить разность потенциалов, то делокализованные электроны будут смещаться в направлении положительного потенциала. 3. Теплопроводность металлов.
2. Электропроводность металлов. Если к концам металлического образца приложить разность потенциалов, то делокализованные электроны будут смещаться в направлении положительного потенциала. 3. Теплопроводность металлов.
 4. Металлический блеск металлов. В металле образуется большое число молекулярных орбиталей , значения энергий которых лежат в широких интервалах. Число возникающих переходов между энергетическими уровнями велико, поэтому может поглощаться свет практически любой длины волны. Освещение металла возбуждает электроны. Возвращение электронов на более низкие уровни, сопровождается испусканием света.
4. Металлический блеск металлов. В металле образуется большое число молекулярных орбиталей , значения энергий которых лежат в широких интервалах. Число возникающих переходов между энергетическими уровнями велико, поэтому может поглощаться свет практически любой длины волны. Освещение металла возбуждает электроны. Возвращение электронов на более низкие уровни, сопровождается испусканием света.
 Способы получения металлов I. Карботермия Cu 2 O + C = 2 Cu + CO Cu 2 O + CO = 2 Cu + CO 2 Zn. S + O 2 = Zn. O + SO 2 Zn. O + C = Zn + CO II. Металлотермия – Al, Mg, Ca, Na Cr 2 O 3 + 2 Al = 2 Cr + Al 2 O 3 Ti. Cl 4 + 2 Mg = Ti + 2 Mg. Cl 2
Способы получения металлов I. Карботермия Cu 2 O + C = 2 Cu + CO Cu 2 O + CO = 2 Cu + CO 2 Zn. S + O 2 = Zn. O + SO 2 Zn. O + C = Zn + CO II. Металлотермия – Al, Mg, Ca, Na Cr 2 O 3 + 2 Al = 2 Cr + Al 2 O 3 Ti. Cl 4 + 2 Mg = Ti + 2 Mg. Cl 2
 III. Гидрометаллургия – способы получения металлов из растворов. Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. SO 4 + Fe = Cu + Fe. SO 4 IV. Электрометаллургия – способы получения металлов с помощью электролиза.
III. Гидрометаллургия – способы получения металлов из растворов. Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. SO 4 + Fe = Cu + Fe. SO 4 IV. Электрометаллургия – способы получения металлов с помощью электролиза.
 Химические свойства металлов Атомы металла легко отдают электроны и являются восстановителями: Me – ne- → Men+ восстановитель окисление
Химические свойства металлов Атомы металла легко отдают электроны и являются восстановителями: Me – ne- → Men+ восстановитель окисление
 Активность металлов определяется величиной стандартного электродного потенциала (Е 0). Чем он ниже, тем выше активность металла. Например: Е 0 Fe/Fe 2+ = - 0, 44 в E 0 Zn/Zn+2 = - 0, 76 в Цинк легче окисляется, чем железо.
Активность металлов определяется величиной стандартного электродного потенциала (Е 0). Чем он ниже, тем выше активность металла. Например: Е 0 Fe/Fe 2+ = - 0, 44 в E 0 Zn/Zn+2 = - 0, 76 в Цинк легче окисляется, чем железо.
 I. Взаимодействие металлов с простыми веществами. 2 Fe + 3 Cl 2 → 2 Fe. Cl 3 восстановитель 2 Fe 0 – 3 e- = Fe 3+ (окисление) окислитель 3 Cl 2 + 2 e - = 2 Cl- (восстановление) Окислительно-восстановительный процесс идет самопроизвольно в прямом направлении, если э. д. с. = Е вост. – Е окис. вел положительная.
I. Взаимодействие металлов с простыми веществами. 2 Fe + 3 Cl 2 → 2 Fe. Cl 3 восстановитель 2 Fe 0 – 3 e- = Fe 3+ (окисление) окислитель 3 Cl 2 + 2 e - = 2 Cl- (восстановление) Окислительно-восстановительный процесс идет самопроизвольно в прямом направлении, если э. д. с. = Е вост. – Е окис. вел положительная.
 II. Отношение Me к сложным веществам. Взаимодействие металлов с водой. В качестве окислителя выступают Н + , которые образуются при диссоциации Н 2 О ↔ Н+ + ОН- Н 2 О – слабый электролит. Процесс восстановления окислителя идет по уравнению: 2 Н 2 О + 2 е- → Н 2 + 2 ОН- Электродный потенциал восстановления Н+ из Н 2 О ([Н+] = 10 -7) = -0, 41 в p. H = 7 нейтральная
II. Отношение Me к сложным веществам. Взаимодействие металлов с водой. В качестве окислителя выступают Н + , которые образуются при диссоциации Н 2 О ↔ Н+ + ОН- Н 2 О – слабый электролит. Процесс восстановления окислителя идет по уравнению: 2 Н 2 О + 2 е- → Н 2 + 2 ОН- Электродный потенциал восстановления Н+ из Н 2 О ([Н+] = 10 -7) = -0, 41 в p. H = 7 нейтральная
 По отношению к воде можно выделить 3 группы металлов: I. Активные II. Металлы со значением Е 0 ниже -2, 36 в эти металлы взаимодействуют с Н 2 О. 2 Na + 2 H 2 O = H 2 + 2 Na. OH 2 Na 0 – e- = Na+ 1 2 H 2 O + 2 e- = H 2 + 2 OH- 2 2 Na + 2 H 2 O = 2 Na+ + 2 OH- + H 2 3 Э. Д. С. = -0, 41 – (-2, 71) = 2, 39 в
По отношению к воде можно выделить 3 группы металлов: I. Активные II. Металлы со значением Е 0 ниже -2, 36 в эти металлы взаимодействуют с Н 2 О. 2 Na + 2 H 2 O = H 2 + 2 Na. OH 2 Na 0 – e- = Na+ 1 2 H 2 O + 2 e- = H 2 + 2 OH- 2 2 Na + 2 H 2 O = 2 Na+ + 2 OH- + H 2 3 Э. Д. С. = -0, 41 – (-2, 71) = 2, 39 в
 II. Пассивирующие Металлы со значением Е 0 от -0, 41 в до -2, 36 в (от кадмия до магния ) эти металлы вступают в реакцию, но образующийся гидроксид металла нерастворим в воде, и образующаяся защитная пленка прекращает реакцию.
II. Пассивирующие Металлы со значением Е 0 от -0, 41 в до -2, 36 в (от кадмия до магния ) эти металлы вступают в реакцию, но образующийся гидроксид металла нерастворим в воде, и образующаяся защитная пленка прекращает реакцию.
 Пример: 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 2 Al 0 – 3 e- = Al 3+ 3 2 H 2 O + 2 e- = H 2 + 2 OH- 42 Al + 6 H 2 O = 2 Al 3+ + 6 OH- + 3 H 2 Э. Д. С. = -0, 41 – (-1, 67) = 1, 266 в Образующийся Al(OH)3 нерастворим и реакция прекращается. III. Инертные Металлы со значением Е 0 > -0, 41 в не взаимодействуют с Н 2 О.
Пример: 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 2 Al 0 – 3 e- = Al 3+ 3 2 H 2 O + 2 e- = H 2 + 2 OH- 42 Al + 6 H 2 O = 2 Al 3+ + 6 OH- + 3 H 2 Э. Д. С. = -0, 41 – (-1, 67) = 1, 266 в Образующийся Al(OH)3 нерастворим и реакция прекращается. III. Инертные Металлы со значением Е 0 > -0, 41 в не взаимодействуют с Н 2 О.
 Взаимодействие металлов с растворами щёлочей. Ряд амфотерных металлов Be, Al, Zn, Sn, Pb, Cr взаимодействуют в растворами щелочей, образуя соли слабых кислот и Н 2. Zn + 2 H 2 O + 2 Na. OH = H 2 + Na 2[Zn(OH)4] Zn + 4 OH- - 2 e- = [Zn(OH)4]2 - 2 H 2 O + 2 e- = H 2 + 2 OH- Zn + 4 OH- + 2 H 2 O = [Zn(OH)4]2 - + H 2 + 2 OH-
Взаимодействие металлов с растворами щёлочей. Ряд амфотерных металлов Be, Al, Zn, Sn, Pb, Cr взаимодействуют в растворами щелочей, образуя соли слабых кислот и Н 2. Zn + 2 H 2 O + 2 Na. OH = H 2 + Na 2[Zn(OH)4] Zn + 4 OH- - 2 e- = [Zn(OH)4]2 - 2 H 2 O + 2 e- = H 2 + 2 OH- Zn + 4 OH- + 2 H 2 O = [Zn(OH)4]2 - + H 2 + 2 OH-
 Это процесс можно рассматривать в две стадии: I Zn + 2 H 2 O = Zn(OH)2 + H 2 II Zn(OH)2 + 2 Na. OH = Na 2[Zn(OH)4] Zn + 2 H 2 O + 2 Na. OH = Na 2[Zn(OH)4] + H 2
Это процесс можно рассматривать в две стадии: I Zn + 2 H 2 O = Zn(OH)2 + H 2 II Zn(OH)2 + 2 Na. OH = Na 2[Zn(OH)4] Zn + 2 H 2 O + 2 Na. OH = Na 2[Zn(OH)4] + H 2
 Взаимодействие металлов с кислотами. При взаимодействии металлов с кислотами характер взаимодействия и состав продуктов реакции зависит от: 1. активности металлов 2. кислоты 3. концентрации кислоты
Взаимодействие металлов с кислотами. При взаимодействии металлов с кислотами характер взаимодействия и состав продуктов реакции зависит от: 1. активности металлов 2. кислоты 3. концентрации кислоты
 По отношению к кислотам металлы делятся на: 1. активные → Е 0 ниже -1, 18 В (от лития до марганца) 2. средней активности Е 0 от -1, 18 до 0, 00 (от марганца до водорода) 3. малоактивные Е 0 > 0, 00 (от водорода до золота) При действии Н 2 SO 4(разб), HCl и других кислот окислителем является ион Н + эти кислоты взаимодействуют со всеми металлами, у которых Е 0 < 0, 00
По отношению к кислотам металлы делятся на: 1. активные → Е 0 ниже -1, 18 В (от лития до марганца) 2. средней активности Е 0 от -1, 18 до 0, 00 (от марганца до водорода) 3. малоактивные Е 0 > 0, 00 (от водорода до золота) При действии Н 2 SO 4(разб), HCl и других кислот окислителем является ион Н + эти кислоты взаимодействуют со всеми металлами, у которых Е 0 < 0, 00
 Mg + H 2 SO 4(p. ) = H 2 + Mg. SO 4 1 Mg 0 – 2 e- = Mg 2+ 2 H+ + 2 e- = H 2 Mg + 2 H+ = Mg 2+ + H 2 2 H+ + 2 e- → H 2 При действии H 2 SO 4( конц. ) окислителе является сульфат-ион ( SO 4 2 - ) ; сост образующихся продуктов зависит от активности металла. Восстановление SO 4 2 - идет тем дальше, чем более активен металл.
Mg + H 2 SO 4(p. ) = H 2 + Mg. SO 4 1 Mg 0 – 2 e- = Mg 2+ 2 H+ + 2 e- = H 2 Mg + 2 H+ = Mg 2+ + H 2 2 H+ + 2 e- → H 2 При действии H 2 SO 4( конц. ) окислителе является сульфат-ион ( SO 4 2 - ) ; сост образующихся продуктов зависит от активности металла. Восстановление SO 4 2 - идет тем дальше, чем более активен металл.
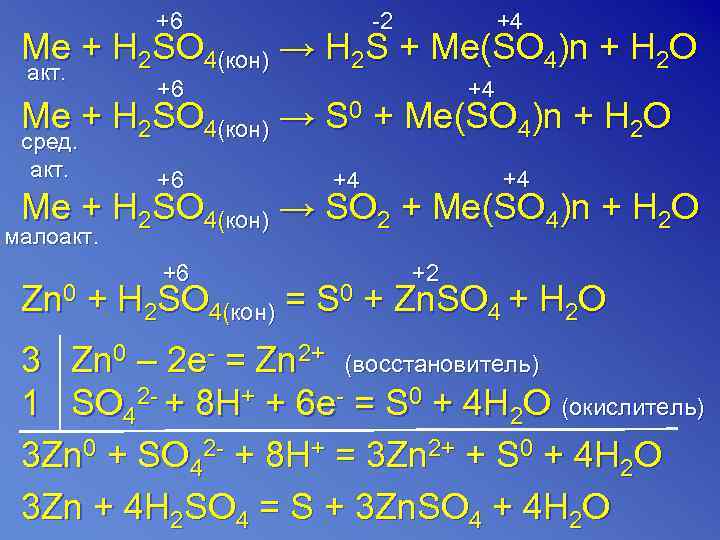 +6 -2 +4 Me + H 2 SO 4(кон) → H 2 S + Me(SO 4)n + H 2 O акт. +6 +4 Me + H 2 SO 4(кон) → S 0 + Me(SO 4)n + H 2 O сред. акт. +6 +4 Me + H 2 SO 4(кон) → SO 2 + Me(SO 4)n + H 2 O малоакт. +6 +2 Zn 0 + H 2 SO 4(кон) = S 0 + Zn. SO 4 + H 2 O 3 Zn 0 – 2 e- = Zn 2+ (восстановитель) 1 SO 42 - + 8 H+ + 6 e- = S 0 + 4 H 2 O (окислитель) 3 Zn 0 + SO 42 - + 8 H+ = 3 Zn 2+ + S 0 + 4 H 2 O 3 Zn + 4 H 2 SO 4 = S + 3 Zn. SO 4 + 4 H 2 O
+6 -2 +4 Me + H 2 SO 4(кон) → H 2 S + Me(SO 4)n + H 2 O акт. +6 +4 Me + H 2 SO 4(кон) → S 0 + Me(SO 4)n + H 2 O сред. акт. +6 +4 Me + H 2 SO 4(кон) → SO 2 + Me(SO 4)n + H 2 O малоакт. +6 +2 Zn 0 + H 2 SO 4(кон) = S 0 + Zn. SO 4 + H 2 O 3 Zn 0 – 2 e- = Zn 2+ (восстановитель) 1 SO 42 - + 8 H+ + 6 e- = S 0 + 4 H 2 O (окислитель) 3 Zn 0 + SO 42 - + 8 H+ = 3 Zn 2+ + S 0 + 4 H 2 O 3 Zn + 4 H 2 SO 4 = S + 3 Zn. SO 4 + 4 H 2 O
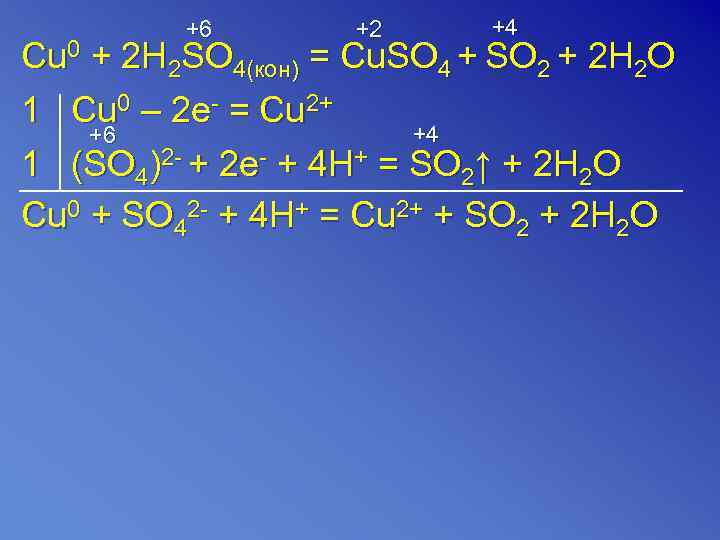 +6 +2 +4 Cu 0 + 2 H 2 SO 4(кон) = Cu. SO 4 + SO 2 + 2 H 2 O 1 Cu 0 – 2 e- = Cu 2+ +6 +4 1 (SO 4)2 - + 2 e- + 4 H+ = SO 2↑ + 2 H 2 O Cu 0 + SO 42 - + 4 H+ = Cu 2+ + SO 2 + 2 H 2 O
+6 +2 +4 Cu 0 + 2 H 2 SO 4(кон) = Cu. SO 4 + SO 2 + 2 H 2 O 1 Cu 0 – 2 e- = Cu 2+ +6 +4 1 (SO 4)2 - + 2 e- + 4 H+ = SO 2↑ + 2 H 2 O Cu 0 + SO 42 - + 4 H+ = Cu 2+ + SO 2 + 2 H 2 O
 Азотная кислота НNO 3 – является сильным окислителем и окисляет все металлы, кроме золота, платины, иридия. Н NO 3 (конц) не действует железо, хром, алюминий. Me + HNO 3(разб) → N 2 + Me(NO 3)n + H 2 O акт. Me + HNO 3(разб) → N 2 O + Me(NO 3)n + H 2 O сред. акт. Me + HNO 3 (разб) → NO + Me(NO 3)n + H 2 O малоакт. Me + HNO 3 (конц) → NO 2 + Me(NO 3)n + H 2 O HNO → NН NO + Me(NO )n + H O Me + 3 4 3 3 2 акт. (очень разб)
Азотная кислота НNO 3 – является сильным окислителем и окисляет все металлы, кроме золота, платины, иридия. Н NO 3 (конц) не действует железо, хром, алюминий. Me + HNO 3(разб) → N 2 + Me(NO 3)n + H 2 O акт. Me + HNO 3(разб) → N 2 O + Me(NO 3)n + H 2 O сред. акт. Me + HNO 3 (разб) → NO + Me(NO 3)n + H 2 O малоакт. Me + HNO 3 (конц) → NO 2 + Me(NO 3)n + H 2 O HNO → NН NO + Me(NO )n + H O Me + 3 4 3 3 2 акт. (очень разб)
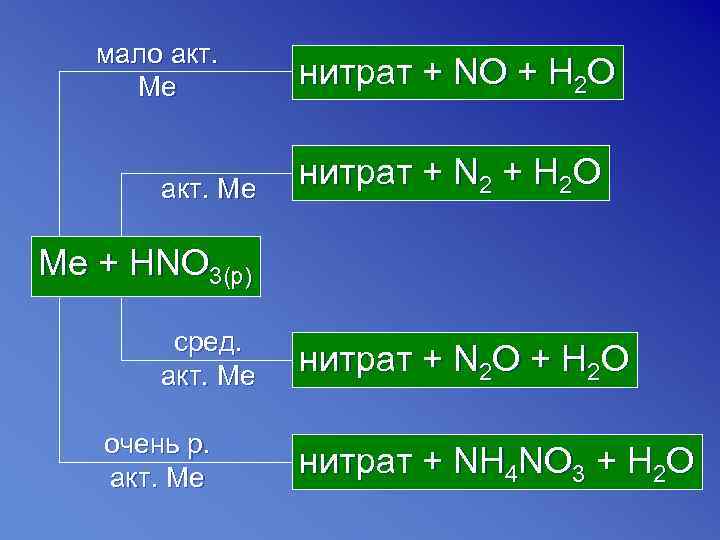
 мало акт. Ме нитрат + NO + H 2 O акт. Ме нитрат + N 2 + H 2 O Me + HNO 3(p) сред. акт. Ме нитрат + N 2 O + H 2 O очень р. акт. Ме нитрат + NH 4 NO 3 + H 2 O
мало акт. Ме нитрат + NO + H 2 O акт. Ме нитрат + N 2 + H 2 O Me + HNO 3(p) сред. акт. Ме нитрат + N 2 O + H 2 O очень р. акт. Ме нитрат + NH 4 NO 3 + H 2 O
 +5 +2 -3 4 Mg 0 + 10 HNO 3(оч. р. ) = 4 Mg(NO 3)2 + NH 4 NO 3 + 3 H 2 O 4 8 Mg 0 – 2 e- → Mg 2+ +5 -3 1 2 (NO 3)- + 8 e- + 10 H+ → (NH 4)+ + 3 H 2 O 4 Mg 0 + (NO)- + 10 H+ → 4 Mg 2+ + (NH 4)+ + 3 H 2 O
+5 +2 -3 4 Mg 0 + 10 HNO 3(оч. р. ) = 4 Mg(NO 3)2 + NH 4 NO 3 + 3 H 2 O 4 8 Mg 0 – 2 e- → Mg 2+ +5 -3 1 2 (NO 3)- + 8 e- + 10 H+ → (NH 4)+ + 3 H 2 O 4 Mg 0 + (NO)- + 10 H+ → 4 Mg 2+ + (NH 4)+ + 3 H 2 O
 +5 +1 +2 Zn 0 + HNO 3(p. ) = N 2 O + Zn(NO 3)2 + H 2 O 4 Zn 0 – 2 e- = Zn 2+ +5 +1 1 2(NO 3)- + 8 e- + 10 H+ = N 2 O + 5 H 2 O 4 Zn 0 + 2 NO 3 - + 10 H+ = 4 Zn 2+ + N 2 O + 5 H 2 O 4 Zn + 10 HNO 3 = N 2 O + 4 Zn(NO 3)2 + 5 H 2 O
+5 +1 +2 Zn 0 + HNO 3(p. ) = N 2 O + Zn(NO 3)2 + H 2 O 4 Zn 0 – 2 e- = Zn 2+ +5 +1 1 2(NO 3)- + 8 e- + 10 H+ = N 2 O + 5 H 2 O 4 Zn 0 + 2 NO 3 - + 10 H+ = 4 Zn 2+ + N 2 O + 5 H 2 O 4 Zn + 10 HNO 3 = N 2 O + 4 Zn(NO 3)2 + 5 H 2 O
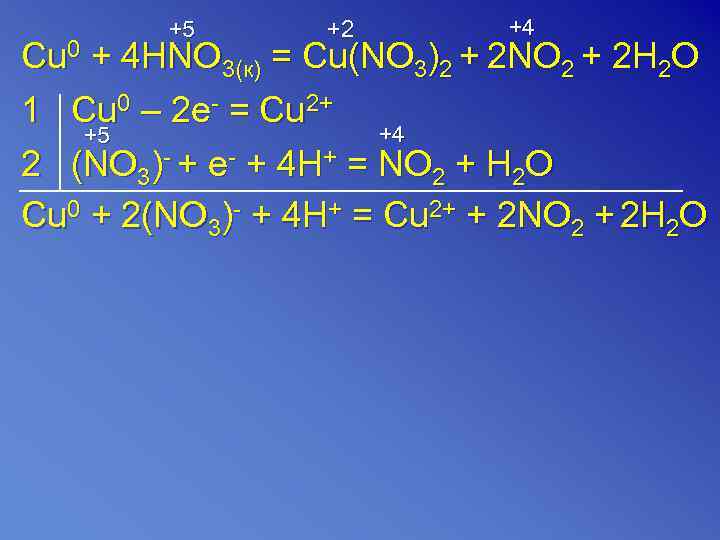 +5 +2 +4 Cu 0 + 4 HNO 3(к) = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O 1 Cu 0 – 2 e- = Cu 2+ +5 +4 2 (NO 3)- + e- + 4 H+ = NO 2 + H 2 O Cu 0 + 2(NO 3)- + 4 H+ = Cu 2+ + 2 NO 2 + 2 H 2 O
+5 +2 +4 Cu 0 + 4 HNO 3(к) = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O 1 Cu 0 – 2 e- = Cu 2+ +5 +4 2 (NO 3)- + e- + 4 H+ = NO 2 + H 2 O Cu 0 + 2(NO 3)- + 4 H+ = Cu 2+ + 2 NO 2 + 2 H 2 O

