металлы.pptx
- Количество слайдов: 50

Металлы 1

ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И НЕМЕТАЛЛОВ АТОМЫ классифицируют на Металлы имеют Строение атома: ->R - от 1 до 3 е на внешнем энергетическом уровне Неметаллы имеют Строение атома: -< R - от 4 до 7 е на внешнем энергетическом уровне проявляют Восстановительные свойства (-е ) образуют Окислительные свойства ( +е )
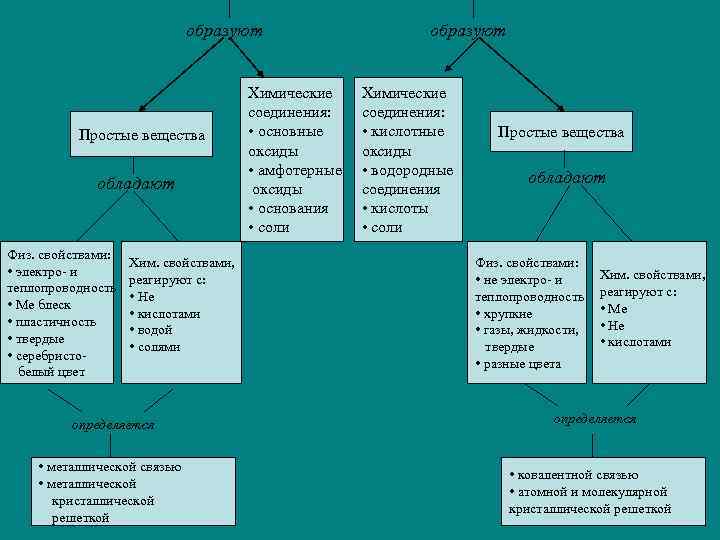
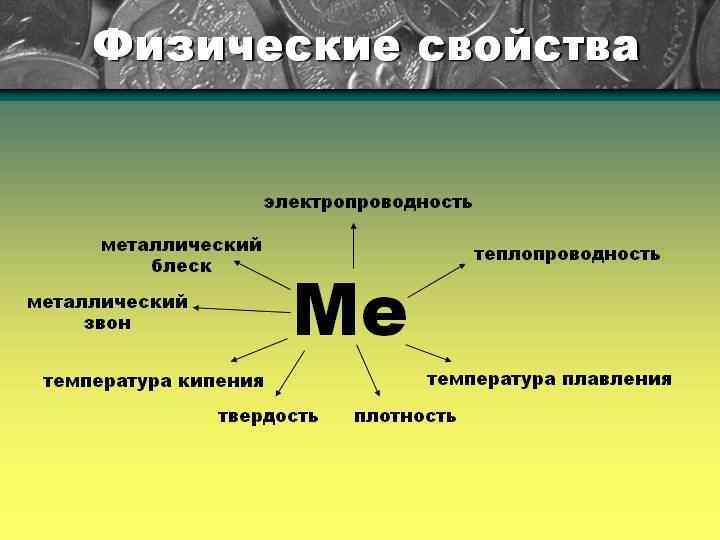
образуют Простые вещества обладают Физ. свойствами: • электро- и теплопроводность • Ме блеск • пластичность • твердые • серебристобелый цвет Хим. свойствами, реагируют с: • Не • кислотами • водой • солями определяется • металлической связью • металлической кристаллической решеткой Химические соединения: • основные оксиды • амфотерные оксиды • основания • соли образуют Химические соединения: • кислотные оксиды • водородные соединения • кислоты • соли Простые вещества обладают Физ. свойствами: • не электро- и теплопроводность • хрупкие • газы, жидкости, твердые • разные цвета Хим. свойствами, реагируют с: • Ме • Не • кислотами определяется • ковалентной связью • атомной и молекулярной кристаллической решеткой
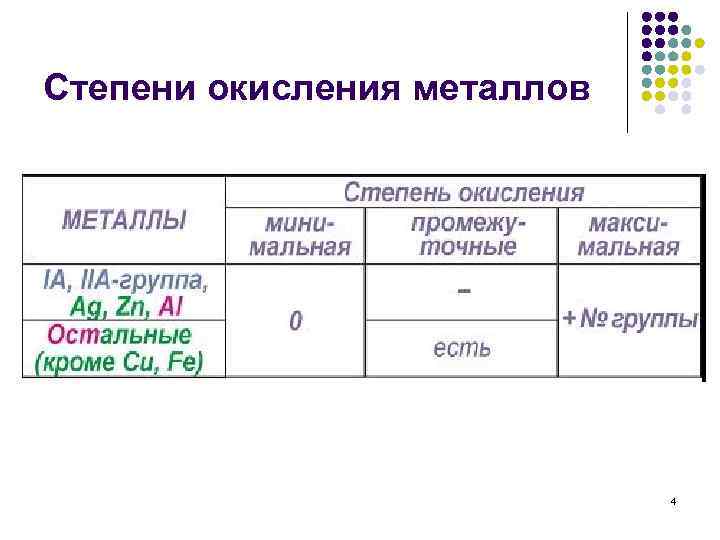
Степени окисления металлов 4
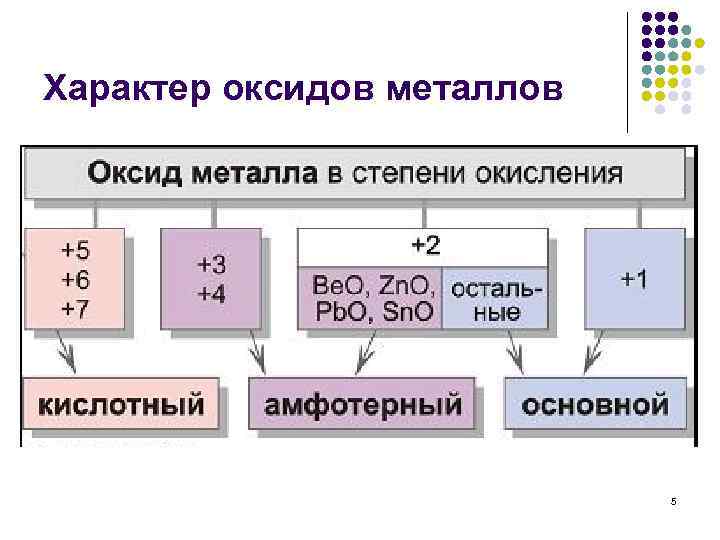
Характер оксидов металлов 5

Положение в периодической системе. Металлы – это химические элементы, атомы которых способны только отдавать электроны, имеют низкие значения электроотрицательности (от 0, 7 до 2, 0), им соответствуют простые вещества, металлы. М е т а л л ы все s-элементы некоторые р-элементы (кроме Н и Не) (III-VI групп) І-А, ІІ-А группа Аl, Sn, Bi… все d- и f-элементы Cu, Zn, Cr, Mn… Чем отличается строение атомов металлов от атомов неметаллов и как это отражается на их химических свойствах? Низшая степень окисления Ме = 0, высшая =№ группы (искл. Ι-Б и VΙΙ-Б).
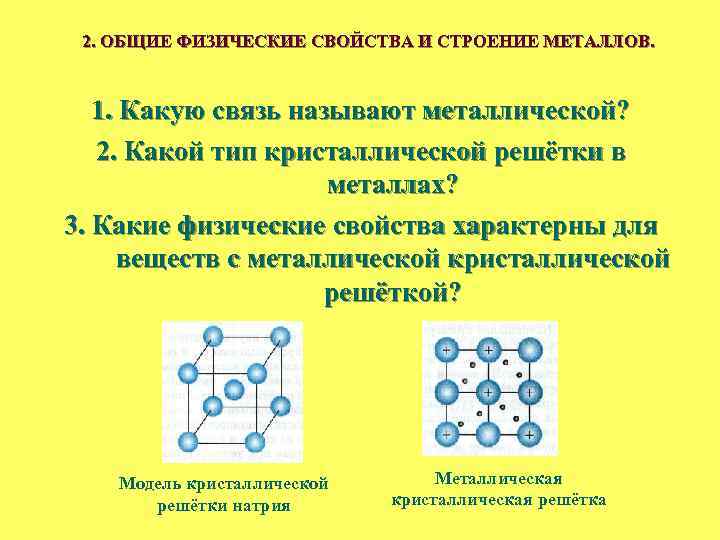
2. ОБЩИЕ ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ МЕТАЛЛОВ. 1. Какую связь называют металлической? 2. Какой тип кристаллической решётки в металлах? 3. Какие физические свойства характерны для веществ с металлической кристаллической решёткой? Модель кристаллической решётки натрия Металлическая кристаллическая решётка
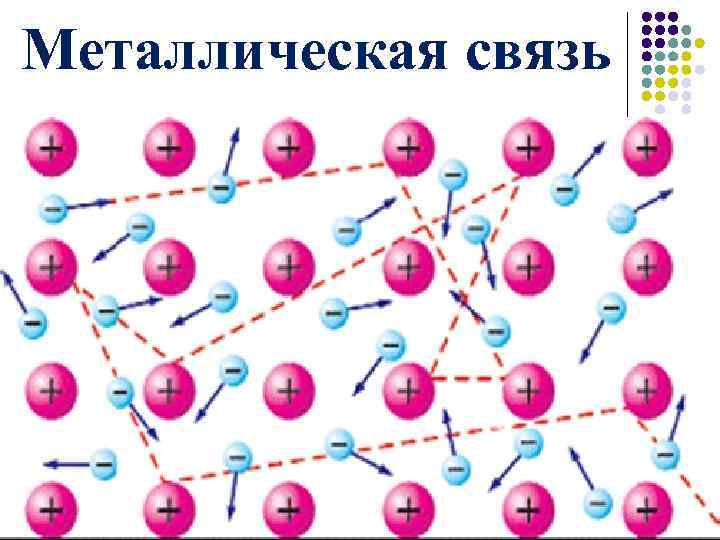
Металлическая связь
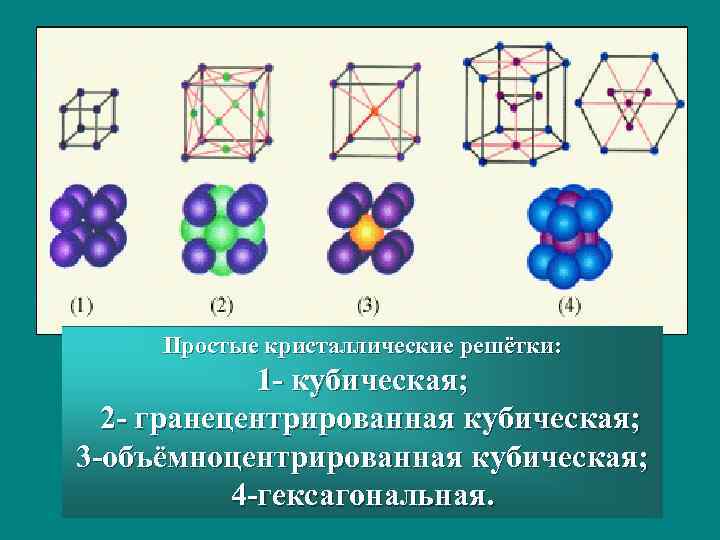
Простые кристаллические решётки: 1 - кубическая; 2 - гранецентрированная кубическая; 3 -объёмноцентрированная кубическая; 4 -гексагональная.
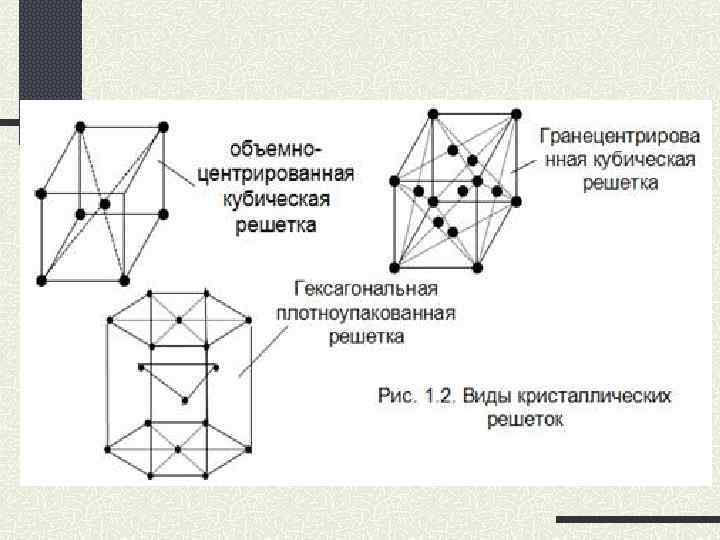

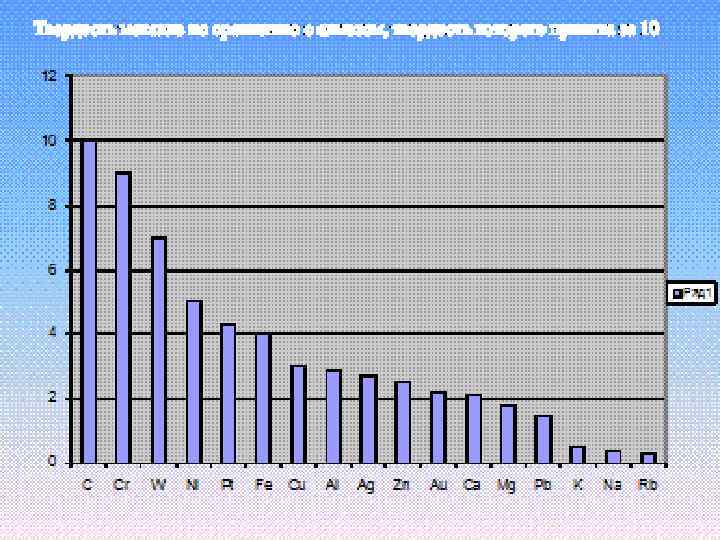
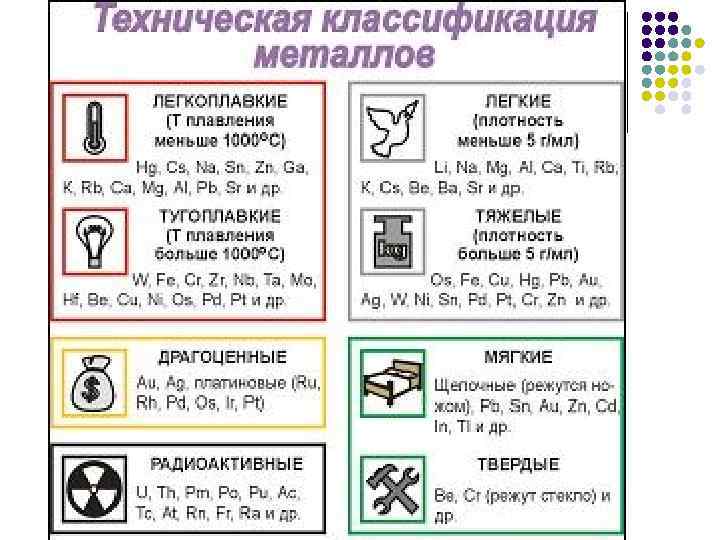
Твердые вещества, кроме ртути. (самый мягкий – калий, самый твердый – хром)

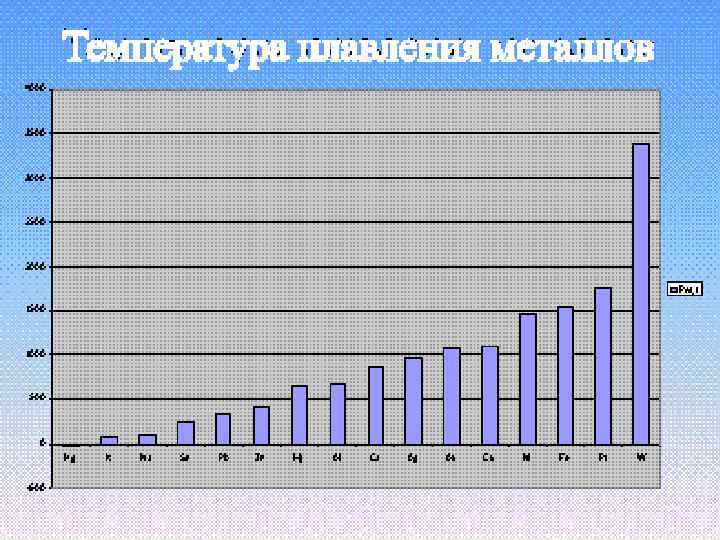
Температура плавления Легкоплавкие Hg, Ga, Cs, In, Bi тугоплавкие W, Mo, V, Cr
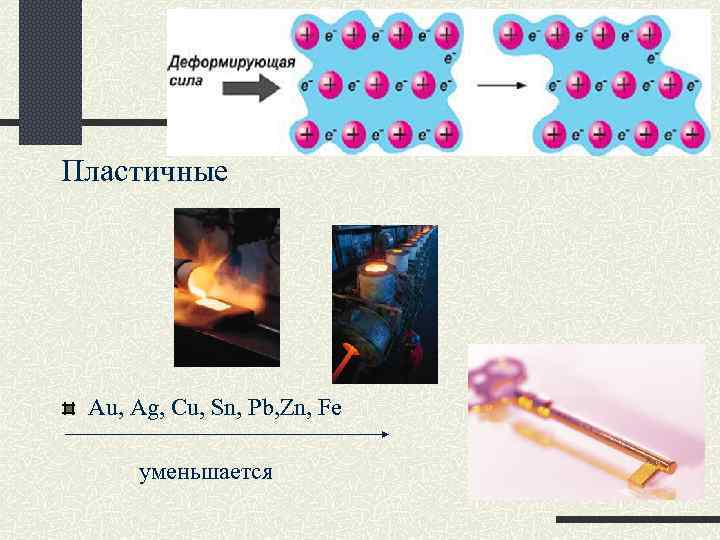
Пластичные Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается

Теплопроводность Hg, Cu, Ag, Al, Fe уменьшается Электропроводность Ag Mn уменьшается

Обладают металлическим блеском

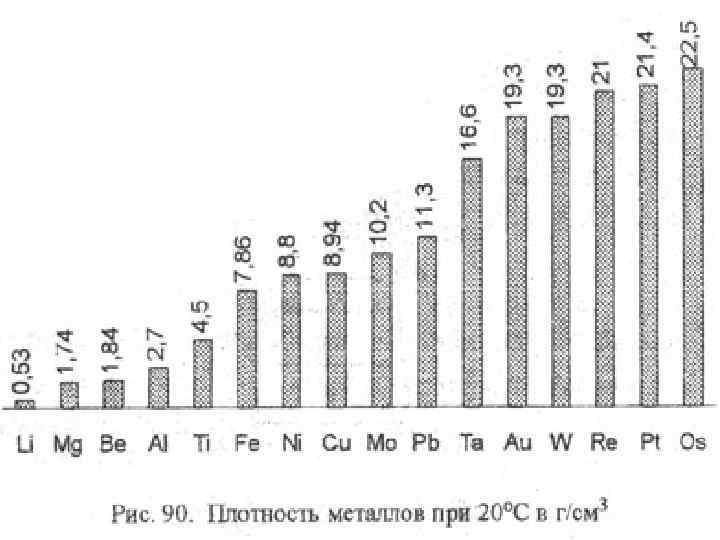
плотность легкие (Li–самый легкий, K, Na, Mg) тяжелые (осмий – самый тяжелый, Ir, Pb)

Ртуть Цезий Вольфрам 22

Тантал Церий Литий 23

Золото Платина 24 Серебро

Уран 25

Бериллий Натрий Индий 26 Хром

Образцы металлов индий кобальт хром висмут вольфрам сурьма галий германий берилий

Металлы. l Алюминий Al

ОЛОВО Оказывается, и металлы «болеют» . «Оловянной чумой» прозвали фазовый переход одной из аллотропных модификаций олова, белого олова (β-Sn), в другую — серое олово (α-Sn), при котором компактный металл рассыпается в серый порошок. Причина разрушения состоит в резком увеличении удельного объёма металла (плотность β-Sn больше, чем плотность α-Sn). Переход облегчается при контакте олова с частицами α-Sn (они действуют подобно затравке, вызывающей образование кристаллов в пересыщенном растворе) и распространяется подобно «болезни» . Наибольшую скорость распространения оловянная чума имеет при температуре – 33 °С; свинец и многие другие примеси её задерживают. В результате разрушения «чумой» паянных оловом сосудов с жидким топливом в 1912 г. погибла экспедиция Роберта Скотта к Южному полюсу. олово

ТАЛИЙ Талий - металл, белого цвета с голубоватым оттенком, похожим на свинец, но ещё более мягким. Таллий был впервые обнаружен с помощью спектроскопа, в большинстве минералов этот рассеянный элемент присутствует в столь малых количествах, что случайно напасть на его след химическим путём практически невозможно. Таллий и его соединения ядовиты. Недаром они попали в литературное произведение: в романе Агаты Кристи «Вилла ”Белый конь”» действует преступная группа, отравляющая людей соединениями таллия. Симптом отравления — выпадение волос. Другим последствием может оказаться тяжёлое нервное заболевание. талий

Металлы. l Вольфрам W

Активные металлы и металлы средней активности калий магний железо натрий цинк алюминий никель

Причины, приводящие к различию в физических свойств металлов Атомы металлов образуют разные типы кристаллических решеток

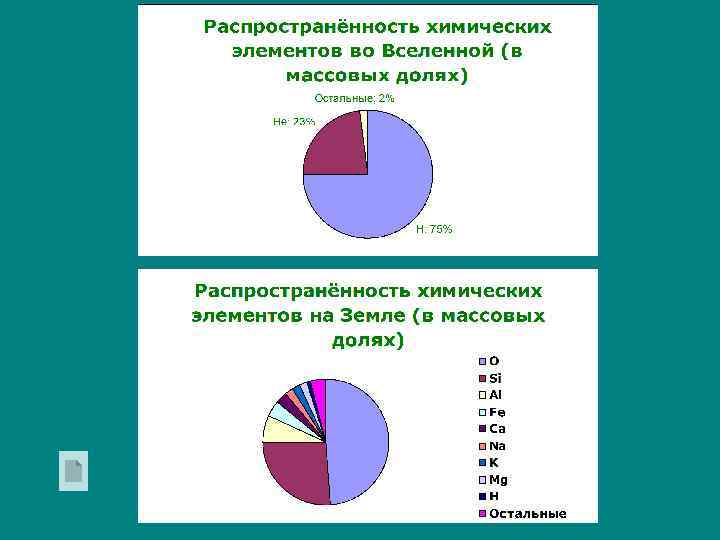
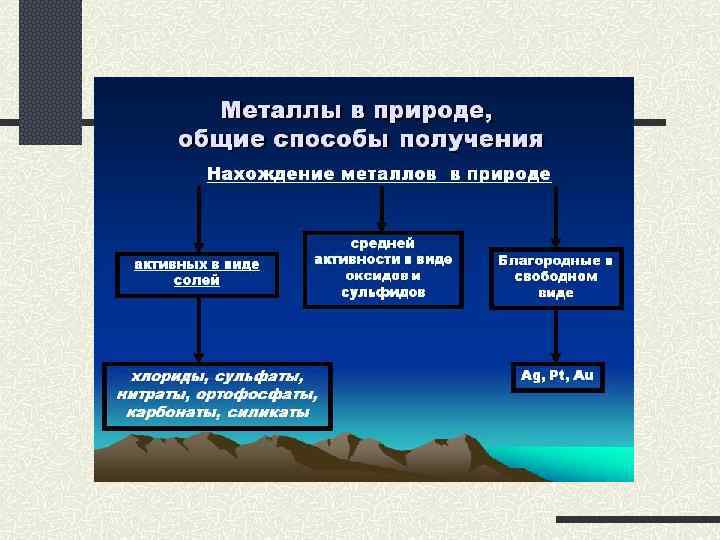
3. Ряд стандартных электродных потенциалов металлов. Распространение в природе. Положение того или иного металла в ряду напряжений характеризует его способность к окислительновосстановительным взаимодействиям в водных растворах при стандартных условиях. Чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет металл как простое вещество. Чем дальше расположен металл в ряду напряжений, тем более сильными окислителями в водном растворе являются его ионы.

платина

Химические свойства металлов Металлы в химических реакциях являются восстановителями, при этом они окисляются Mo – ne =Mn+ Al, Be, Mg, Ca, Li, Na, K, Rb, Cs Восстановительная способность возрастает

Металлы вытесняются из их соединений другими металлами Н. Н. Бекетов – создал «вытеснительный ряд» (прототип электрохимического ряда напряжения металлов) Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.

Взаимодействуют с простыми веществами - С галогенами и кислородом 2 Na + Cl 2 = 2 Na Cl Mg + O 2 = 2 Mg O - C элементами пятой группы (труднее) 3 Ca + 2 P =Ca 3 P 2

Взаимодействие со сложными веществами - С кислотами Zn + H 2 SO 4 = Zn S O 4 + H 2 - C солями Zn + Pb(NO 3)2 = Zn(NO 3)2 + Pb - C водой (активные) 2 Na + 2 H 2 O =2 Na OH + H 2

Применение металлов Станко строение Металлур гическая промышленность медиц ина Сельское хозяйство Для получени я сплавов Домашнее хозяйство

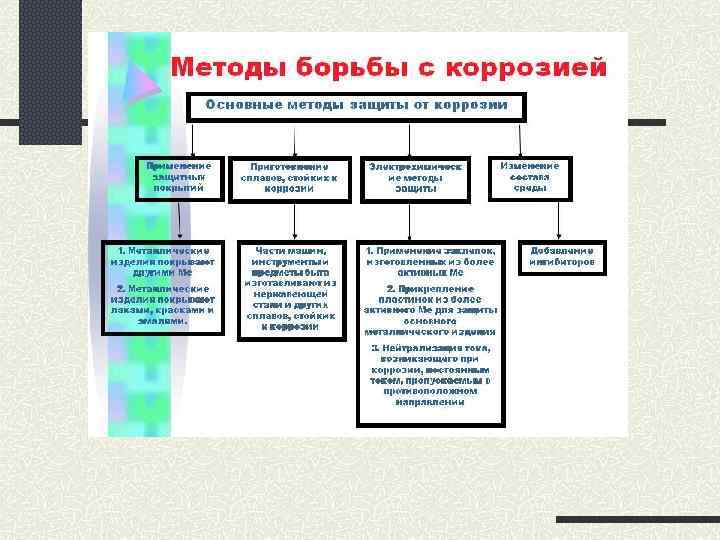
Получение металлов Пирометаллургическим способомвосстановление углеродом, оксидом углерода (II), водородом при высокой температуре. Алюминотермическим способом Гидрометаллургическим способом – получение из руды более активным металлом или из растворов Электролизом – с помощью электрического тока из расплавов или растворов






металлы.pptx