металл-яды.ppt
- Количество слайдов: 51

Металлические яды Белова М. В. Кафедра фармацевтической и токсикологической химии

РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА Токсикологическая химия. Аналитическая токсикология: Учебник. Под ред. Чл. корр. РАМН Р. У. Хабриева и Проф. Н. И. Калетиной. ГЭОТАР Медиа, 2010, 752 с. Коллектив авторов: С. А. Еремин, С. К. Еремин, Г. И. Калетин, Н. И. Калетина, А. Е. Коваленко, Е. А. Симонов, А. В. Скальный, Р. У. Хабриев. Токсикологическая химия. Учебник. Т. Х. Вергейчик, под ред. проф. Е. Н. Вергейчика. Москва, «МЕДпресс информ» , 2009, 400 с. Химико токсикологический анализ веществ, изолируемых минерализацией. «Металлические» яды. Учебное пособие для аудиторной и самостоятельной работы студентов. Под ред. Арзамасцева А. П. и Раменской Г. В. Москва, 2008, 59 с. Швайкова М. Д. Токсикологическая химия. М. : Медицина, 1975


Роль металлов в организме n n Широкое распространение в окружающей среде и организме человека Микро и макроэлементы Макроэлементы: § Органообразующие C, O, H, N, P, S – 97, 4% § ионы Са 2+, Мg 2+, Na+, CӀ более 0, 01 % v Микроэлементы : на уровне 0, 00005 0, 02% § Эссенциальные: Сu, Zn, Со, Мо, Fe, Mn § Условно необходимые: Cr, Ni, V § Примесные: Аs, Hg, Pb, и др. см. л 15, 16. v

Токсичность элементов

Соотношение времени, потраченного на пробоподготовку и времени, потраченного на анализ

Пробоподготовка при анализе «металлических ядов» Зависит от биологического объекта, элементов, которые должны быть обнаружены, и предполагаемого в дальнейшем метода исследования. n 1. 2. Ртуть, мышьяк, таллий, кадмий, свинец, барий, медь, марганец, хром, цинк, сурьма, серебро, висмут. 2. 2. Селен, теллур, олово, железо, молибден, никель, бериллий, кобальт, ванадий, литий. (Приказ МЗ СССР № 1021 от 25. 12. 1973) n n Объекты исследования – кровь, моча, органы и ткани организма, ногти, волосы, «вещдоки» , объекты окружающей среды. Методы анализа: «Дробный» химический анализ Физико химические методы (ААС, АЭС, МС, НАА, РФА, др) Иммуно химические методы

Пробоподготовка при анализе «металлических ядов» Изолирование «металлических» ядов из объектов биологического происхождения проводится методом минерализации. n Для изолирования «металлических» ядов из объектов биологического происхождения необходимо разрушить органические вещества, с которыми связаны металлы, и перевести их в ионное состояние, а затем в минерализате идентифицировать и определить количественно.

Методы минерализации n n n «Влажная минерализация (озоление)» основана на разрушении органических веществ различными окислителями (серной, азотной, хлорной кислотами, их смесями в присутствие перекиси водорода, хлората калия, нитрата аммония, или др. окислителей), находящимися в жидкой фазе, при нагревании до Т кипения Частный вариант для ртути – деструкция – разрушений смесью кислот в присутствии этанола «Сухая минерализация (озоление)» сжигание, термическое разложение или пиролиз, сплавление с солями щелочных металлов
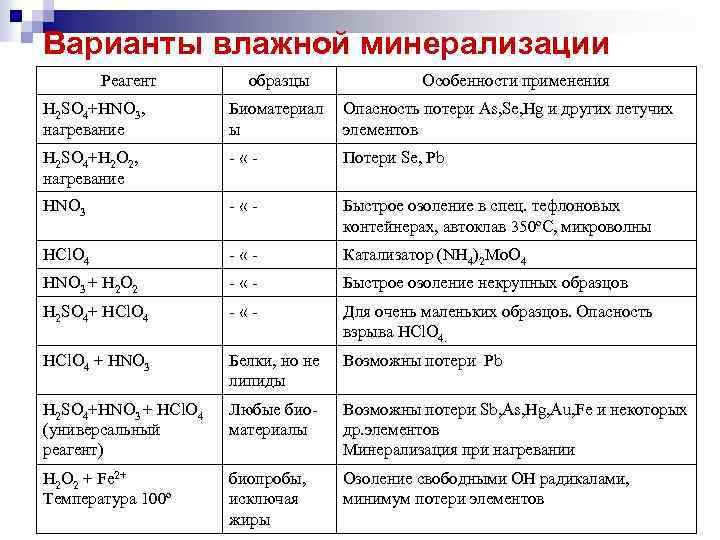
Варианты влажной минерализации Реагент образцы Особенности применения H 2 SO 4+HNO 3, нагревание Биоматериал ы Опасность потери As, Se, Hg и других летучих элементов H 2 SO 4+H 2 O 2, нагревание - «- Потери Se, Рb HNO 3 - «- Быстрое озоление в спец. тефлоновых контейнерах, автоклав 350ºС, микроволны НСl. O 4 - «- Катализатор (NH 4)2 Mo. O 4 HNO 3 + H 2 O 2 - «- Быстрое озоление некрупных образцов H 2 SO 4+ НСl. O 4 - «- Для очень маленьких образцов. Опасность взрыва НСl. O 4 + HNO 3 Белки, но не липиды Возможны потери Рb H 2 SO 4+HNO 3 + НСl. O 4 (универсальный реагент) Любые биоматериалы Возможны потери Sb, As, Hg, Au, Fe и некоторых др. элементов Минерализация при нагревании Н 2 О 2 + Fe 2+ Температура 100º биопробы, исключая жиры Озоление свободными ОН радикалами, минимум потери элементов

Стадии метода влажной минерализации 1) частичная деструкция проб (разрушение форменных элементов) под действием серной и азотной кислот n 2) глубокое окисление органических веществ (находящихся в жидкой фазе) под действием концентрированной азотной кислоты n 3) денитрация (удаление) соединений азота из минерализатов n

Минерализация смесью серной и азотной кислоты n n В колбе Кьельдаля медленное нагревание 100 г объекта + H 2 SO 4+HNO 3 +Н 20 1 стадия = Деструкция – разрушение материала клетки и форменные элементы, но не липидов. Окисление азотной кислотой. 15 – 20 минут HNO 3+ С(органический) NO 2 + СО 2 + Н 2 О (желто бурый р р) 2 стадия = глубокое окисление , в т. ч. жиров По каплям добавляется разбавленная HNO 3, температура повышается. Окисление за счет HNO 3 и Н 2 SO 4. Длится 3 4 часа H 2 SO 4+ С(органический) SO 2 + СО 2 + Н 2 О (бесцветный р р, или слабоокрашеный в присутствии хрома или меди) Денитрация удаление избытка окислов азота, азотной и азотистой кислот – добавление формалина для окисления их в летучие окислы NO, NO 2, N 2. Полноту денитрации проверяют добавлением дифениламина к аликвоте раствора по отсутствию синего окрашивания.

Химические реакции, протекающие при денитрации под действием формалина 4 HNO 3 + 5 HCHO → 2 N 2 ↑+ 5 CO 2 ↑+ 7 H 2 O 4 HNO 2 + 2 HCHO → N 2 ↑+ 2 NO↑ + 2 CO 2 ↑+ 4 H 2 O NO + [O] → NO 2 ↑ 2 NO 2 + H 2 O → HNO 2 + HNO 3

Для проверки полноты денитрации минерализата проводят реакцию с дифениламином Нитрит ион при реакции с дифениламином в среде конц. H 2 SO 4 переводит его в продукт окисления – синий дифенилдифенохинондиимин 2 C 6 H 5 NHC 6 H 5 NH C 6 H 4 NH C 6 H 5 + 2 H+ + 2 e Дифениламин дифенилбензидин (бесцветный) C 6 H 5 NH=C 6 H 4=NH C 6 H 5 + 2 H + + 2 e дифенилдифенохинондиимин синий Окончание стадии денитрации отсутствие синего окрашивания с раствором дифениламина в серной кислоте

Влажная минерализация Достоинства : Сравнительно быстрое достижение полноты разрушения § органической матрицы Пригоден для большинства металлов – универсальность § Небольшие объемы получаемого минерализата § Большая чувствительность дальнейшего анализа к ряду § катионов Недостатки: Не пригоден при анализе на ртуть Используются относительно большие объему агрессивных реагентов кислот, окислителей Выход токсичных паров и газов (окислы азота, серы и т. п. ) в окружающую среду

Минерализация для обнаружения ртути в биообъекте n v v v Деструкция. – нарушение структуры биологического материала под действием кислот , без полного разрушения органических веществ. Разрушение форменных элементов, связи ртути с белком. В колбе Кьельдаля медленное нагревание 20 г объекта + 5 мл воды + 1 мл этанола + 10 мл концентрированной HNO 3; По каплям добавляют конц. H 2 SO 4 с нагреванием, чтобы поддерживалась реакция разложения азотной кислоты с выделением тепла, но окислы не выделядись из реакционной колбы. Этанол выступает катализатором С 2 Н 5 ОН + НОNO 2<=>C 2 H 5 ONO + H 2 O <=> C 2 H 5 OH + HNO 2

v Оставляют при комнатной Т до прекращения выделения бурых паров окислов азота, затем нагревают на водяной бане 10– 15 минут. HNO 2+ С(органический) NO 2 + СО 2 + Н 2 О (желто бурый р р) n Денитрацию проводят добавлением насыщ. р ра мочевины HNO 3+ (H 2 N)2 CO N 2 + NO + СО 2 + Н 2 О HNO 2+ (H 2 N)2 CO N 2 + СО 2 + Н 2 О N 2 O 3+ (H 2 N)2 CO N 2 + СО 2 + Н 2 О Избыток мочевины удаляют нагреванием в присутствии H 2 SO 4 Полноту денитрации проверяют добавлением дифениламина к аликвоте раствора по отсутствию синего окрашивания. v

МИКРОВОЛНОВАЯ ПРОБОПОДГОТОВКА

Преимущества пробоподготовки в закрытых микроволновых системах § сокращение времени заменяются минутами пробоподготовки — часы § нет потерь легколетучих элементов — полное извлечение Hg, Se, As § нет кислотных паров — улучшение условий работы персонала § снижение вероятности загрязнения пробы уникальный дизайн сосудов и уменьшение объемов реагентов

МЕТОД «СУХОЙ» МИНЕРАЛИЗАЦИИ n n Используются при специальных исследованиях, для малого количества объекта, обычно – волос, ногтей, остатков мочи и т. п. Метод сухого озоления основан на нагревании органических веществ (1 -10 г) до высокой температуры (300 -400 о. С) при доступе воздуха. Сжигание для определения меди, марганца, висмута, цинка. Объект измельчают, высушивают на песчаной бане, нагревают при 300 400ºС. Обугленный остаток смачивают нитратом аммония, нагревают до белой золы. Обрабатывают НСl или НNО 3 Один из главных недостатков данного метода связан с частичным или полным улетучиванием «металлических» ядов при сжигании. Метод применяется при исследовании объектов на наличие ионов марганца Mn 2+, меди Cu 2+, цинка Zn 2+, висмута Вi 3+.

МЕТОД «СУХОЙ» МИНЕРАЛИЗАЦИИ (ОЗОЛЕНИЯ) n Сжигание для определения соединений фтора и кремнефторидов. Объект подщелачивают избытком Nа. OH, смачивают р ром нитрата аммония или конц. НNО 3. нагрев при 500ºС до полного сжигания. Золу анализируют.

МЕТОД СПЛАВЛЕНИЯ n Сплавление с карбонатом и нитратом натрия. Объект растирают со смесью карбоната и нитрата натрия (2: 1). В тигле расплавляют Nа. NО 3, порциями вносят смесь с образцом, нагревают до получения белой массы. Остужают, обрабатывают горячей водой n Метод сплавления применяется при исследовании на наличие ионов мышьяка As 3+, серебра Ag+ и некоторых других металлов.

ДРОБНЫЙ МЕТОД АНАЛИЗА МЕТАЛЛИЧЕСКИХ ЯДОВ

Анализ минерализата n Химические методы – «дробный анализ» на металлы (л. 16. п. 3) Основан на постадийном обнаружении каждого из ионов. v Для исключения мешающего влияния других ионов используют комплексообразование, экстракцию в органический растворитель и т. п. v Для исключения обнаружения естественного уровня элементов используют разведение и реакции разной чувствительности. v Заключение об отравлении выносят на основание использования нескольких реакций разной чувствительности и специфичности v Количественное определение титрование и фотометрия с использованием реакций окрашивания и комплексообразования n Физико-химические спектральные методы (л. 16) v Атомно адсорбционная спектрометрия v Атомно эмиссионная спектрометрия v Масс спектрометрия v Рентгенофлуоресцентный анализ v

Маскировка – процесс устранения влияния мешающих ионов, находящихся в сложной смеси, на обнаружение искомых ионов. 1. Образование устойчивых комплексов (бесцветных, не реагирующих с используемыми реактивами) Цианиды : Со(СN)6]4 , Fe(СN)6]4 Ni(СN)4]2 Zn(СN)4]2 Сu(СN)4]3 Сd(СN)4]2 Hg(СN)4]2 Ag(СN)2] легко демаскируются разложением или вытеснением 3 v Фосфаты: в кислой среде ионы Fe (III) => Fe(PO 4)2 v Тиосульфаты: для ионов Fe (III), Ag, Pb, Cu, др. 3 v Фториды: Fe (III) => Fe. F 6 v Трилон Б для ионов Со, Сd, Cu, Fe, Mn, Pb, Zn, Mg и др. в количественном анализе v Гидроксиламин – образует комплексы (Со), выступает восстановителем Fe (III), окислителем для As. O 2 , Sb. O 2 v Тиомочевина для ионов Bi, Fe (III), Ag, Sb (III), Cd, Hg, gp. 2. Изменение р. Н среды 3. Изменение валентности ионов окислением восстановлением v
![Образование внутрикомплексных соединений Слабая кислота, [p. Ka=4, 5]. При р. Н=7 не растворим в Образование внутрикомплексных соединений Слабая кислота, [p. Ka=4, 5]. При р. Н=7 не растворим в](https://present5.com/presentation/169520527_284870081/image-26.jpg)
Образование внутрикомплексных соединений Слабая кислота, [p. Ka=4, 5]. При р. Н=7 не растворим в воде (сине чёрные хлопья), и растворим при р. Н › 7 (раствор жёлто оранжевого цвета). В органических растворителях дитизон растворяется хорошо. При этом растворы дитизона окрашены в интенсивный зелёный цвет. n ДИТИЗОН=Дифенилтиокарбазон
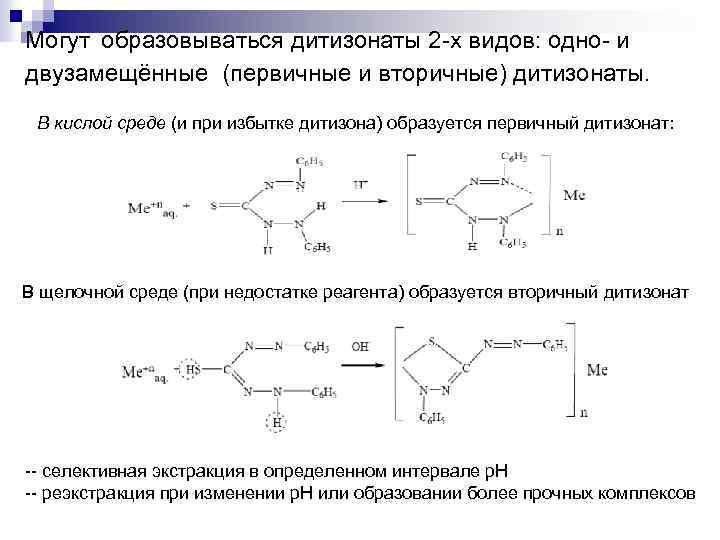
Могут образовываться дитизонаты 2 х видов: одно и двузамещённые (первичные и вторичные) дитизонаты. В кислой среде (и при избытке дитизона) образуется первичный дитизонат: В щелочной среде (при недостатке реагента) образуется вторичный дитизонат селективная экстракция в определенном интервале р. Н реэкстракция при изменении р. Н или образовании более прочных комплексов
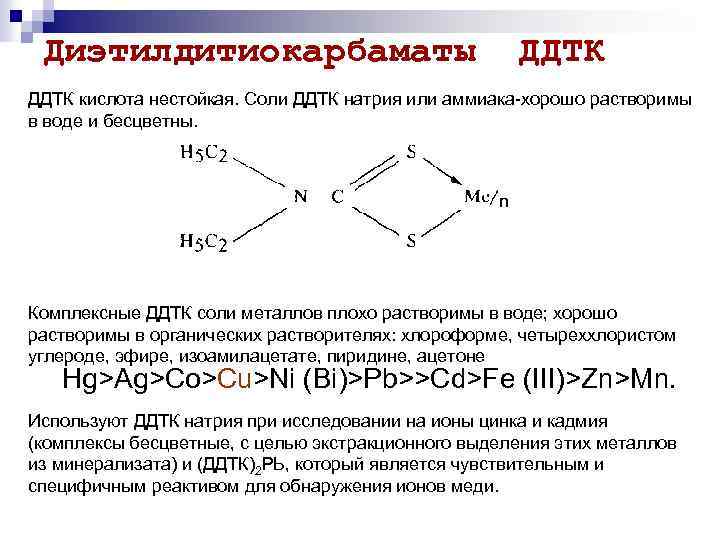
Диэтилдитиокарбаматы ДДТК кислота нестойкая. Соли ДДТК натрия или аммиака хорошо растворимы в воде и бесцветны. Комплексные ДДТК соли металлов плохо растворимы в воде; хорошо растворимы в органических растворителях: хлороформе, четыреххлористом углероде, эфире, изоамилацетате, пиридине, ацетоне Hg>Ag>Co>Cu>Ni (Bi)>Pb>>Cd>Fe (III)>Zn>Mn. Используют ДДТК натрия при исследовании на ионы цинка и кадмия (комплексы бесцветные, с целью экстракционного выделения этих металлов из минерализата) и (ДДТК)2 РЬ, который является чувствительным и специфичным реактивом для обнаружения ионов меди.

ПРОИЗВОДНЫЕ ТРИФЕНИЛМЕТАНА Трифенилметановые красители образуют ионный ассоциат с экстрагируемым ионом и противоположно заряженным ионом. В результате образуется незаряженная молекула, способная экстрагироваться органическим растворителем (бензолом, толуолом, ксилолом, изопропиловым эфиром) Sb 2(SO 4)3 +4 Na. NO 2 +12 HCl 2 HSb. Cl 6+2 Na 2 SO 4 + H 2 SO 4 + 4 H 2 O +4 NO↑ HSb. Cl 6 + малахитовый зеленый Голубой


Схема «Дробного анализа» на металлы ОБНАРУЖЕНИЕ ИОНОВ БАРИЯ n v v v Ва сульфат определяют Перекристаллизация из Н 2 SO 4 бесцвет. кристаллы в виде крестов и прямоугольников) Восстановление Ва. SO 4 до Ва. S окрашивание пламени в зеленый цвет Образование Ва (IО 3)2 сростки бесцветных кристаллов в виде сфероидов. n n Концентрации средние: плазма 50 90 мкг/л; моча 1, 5 5, 0 мкг/л; волосы 0, 2 1, 0 мкг/л Границы обнаружения бария: при реакции перекристаллиза ции из конц. серной кислоты — 0, 01 мг в 100 г органа, при реакции образования йодата бария — 0, 5 мг в 100 г органа.

Определение ионов свинца n Pb ацетат Среднее содержание РЬ: при осадке более 2 мг свинца Кровь 0, 008 0, 269 мг/л v Осаждение с КJ => Pb. J 2 желтый Кости 3, 6 250 мг/кг 2 мг/5 мл; Пр. О 6 х10 Моча 0, 025 мг/л v Осадок с Н 2 S => Pb. S 2 черный Волосы 0, 05 52 мг/кг Пр. О 6 х10 3 мг /5 мл Ногти 14 40 мг/кг v Осадок с К 2 Сr 2 О 7 => Pb Сr. О 4 Печень 0, 05 2, 5 мг/кг оранжевый Пр. О 2 х10 3 мг /5 мл при осадке менее 2 мг свинца v Реакция с дитизоном (р. Н 7 9) количеств. опред. v Микрокристаллические реакции § Образование Cs. Pb. J 2 § Образование К 2 Сu. Pb(NO 2)6 Токсические концентрации Кровь 0, 1 – 2, 28 мг/л Моча 0, 05 – 0, 08 мг/л Волосы более 25 мг/л

Выделение РЬ из минерализата Образование дитизоната свинца: v v v Выделение иона, р. Н = 7, 0 — 8, 0, хлороформ Реакция обнаружения по характерной окраске красная; Количественное определение фотометрия. Чувствительность 5 x 10 5 мг/мл Образовавшийся в хлороформной фазе однозамещенный дитизонат свинца разлагают НNO 3. При этом образуется нитрат свинца, который переходит в водную фазу,

Подтверждающие микрокристаллические реакции на ионы свинца Реакция с ацетатом меди и нитритом калия. Образование черных или коричневых кристалликов, имеющих форму куба. хлоридом цезия и иодидом калия. Реакция с Чувствительность 1 x 10 5 мг. Образуются желто-зеленые игольчатые кристаллы, собранные в виде сфероидов. Чувствительность 1 x 10 5 мг.

Анализ надосадочной жидкости Исследование на ионы серебра Реакция с дитизоном (предварительная). р. Н =2 образуется однозамещенный дитизонат Ag. HDz коричневато желтый цвет хлороформного слоя Дитизонат серебра разлагается 0, 5 Н НСl (в отличие от Нg. HDz) Осаждение серебра из минерализата Na. Cl ; Осадок отфильтровывают, промывают 0, 5 Н р р НCl ; растворяют в 0, 5 4 мл 8 Н р ра NH 4 OH

Исследование на ионы серебра n n Реакция с хлоридом натрия. Белый осадок Ag. Сl Реакция с азотной кислотой. [Ag(NH 3)2]Cl + 2 HNO 3(р. Н = 1) → Ag. Cl ↓ + 2 NH 4 NO 3 n Реакция с иодидом калия. Желтоватый осадок Ag. I [Ag(NH 3)2]Cl + KI → Ag. I↓ + KCl + 2 NH 3↑ n Реакция с тиомочевиной и пикратом калия. На сухой остаток наносят несколько капель насыщенного р-ра тиомочевины, каплю насыщенного р-ра пикрата натрия. Образование желтых призматических кристаллов или сростков из них указывает на Ag

Исследование на ионы марганца Реакция с персульфатом аммония При кипячении в кислой среде с катализатором (соль серебра) персульфат аммония окисляет ионы марганца до перманганат иона Реакция с периодатом калия КIO 4 Mn. O 4 (розовое окрашивание) в присутствии Na. H 2 PO 4 в 100 г биопробы Граница обнаружения 0, 02 мгпри нагревании на водяной бане 20 мин. Образуется окраска от розовой до красно фиолетовой. Граница обнаружения → 2 Mn. O 4 г 10 SO 42 + 16 H+ 2 Mn 2+ + 5 S 2 O 82 + 8 H 2 O 0, 02 мг в 100+ биопробы. Пр. О 0, 1 мкг/мл

Исследование на хром (Cr 3+) Реакция образования надхромовых кислот Ионы хрома Cr 3+ окисляют при помощи персульфата аммония в присутствии катализатора (соли серебра) до бихромат-ионов. После прибавления перекиси водорода к бихромату образуется надхромовая кислота, которая извлекается в слой этилацетата, и имеет голубую или сине-голубую окраску. Чувствительность 2 мкг /мл. Граница обнаружения в органах 0, 2 мг в 100 г органа

Исследование на хром (Cr 3+) Реакция с дифенилкарбазидом. Предварительно Cr 3+, находящийся в минерализате, окисляют персульфатом аммония в присутствии катализатора (ионы серебра) до бихромат-ионов. Для маскировки мешающих ионов Fe(III), Sb(III) и др. прибавляют фосфаты. Образовавшиеся дихромат-ионы реагируют с дифенилкарбазидом. Вначале дихромат-ионы окисляют дифенилкарбазид (I) до дифенилкарбазона (II), неокрашенный. При дальнейшем окислении образуется дифенилкарбадиазон (III), имеющий светло-желтую окраску: Чувствительность 2 мкг /мл. Граница обнаружения в органах 0, 1 мг в 100 г органа

Исследование на ионы Zn 2+ n Экстракции в хлороформ в виде комплекса с ДДТК Na Оптимальные условия экстракции Zn 2+: р. Н 8, 5, комплексообразование кадмия тиомочевиной (или тиосульфат ионом) при качественном исследовании. Реэкстракция проводится 1 н. НСl, n He мешают мышьяк, сурьма, олово, серебро, медь, ртуть, марганец, хром, никель, кобальт при содержании их до 20 мг в 100 г органа. Влияние Fe устраняют комплексообразованием с калия, натрия тартратом или лимонной кислотой.

Исследование на ионы Zn 2+ Образование дитизоната Zn n n Розовое или красно фиолетовое окрашивание. Предварительная реакция — обнаруживается не менее 5 мг в 100 г органа, что исключает обнаружение естественно содержащегося в организме Zn (5 мг на 100 г — средняя граница). Реакция имеет отрицательное судебно химическое значе ние. При отрицательном результате исследование заканчивают и дают заключение, что цинк не обнаружен, при положительном — проводят основные реакции.

Исследование на ионы Zn 2+ n Образование сульфида цинка, р. Н 5, избыток реактива. (чувствительность 1, 5 x 10 3 мг), Zn 2+ + Na 2 S → Zn. S↓ + 2 Na+ Образование гексацианоферроата цинка р. Н=5 чувствительность Зх10 3 мг 3 Zn 2+ + 2 K 4[Fe (CN)6] → K 2 Zn 3[Fe (CN)6]2 ↓ +6 K+ Образование тетрароданомеркуриата цинка чувствительность 2 x 10 4 мг. Zn 2+ + (NH 4)2[Hg(SCN)4] → Zn[Hg(SCN)4] + 2 NH 4+ бесцветные кристаллы в виде «дендритов» или одиночных клинообразных кристаллов
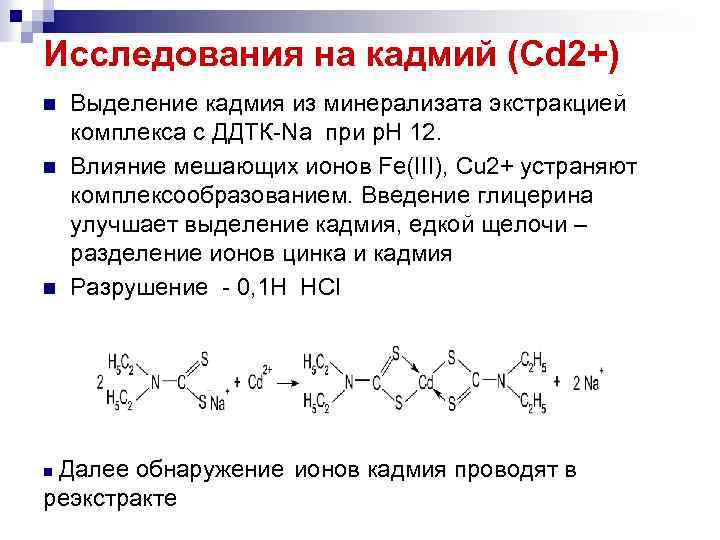
Исследования на кадмий (Cd 2+) n n n Выделение кадмия из минерализата экстракцией комплекса с ДДТК Na при р. Н 12. Влияние мешающих ионов Fe(III), Cu 2+ устраняют комплексообразованием. Введение глицерина улучшает выделение кадмия, едкой щелочи – разделение ионов цинка и кадмия Разрушение 0, 1 Н НСl Далее обнаружение ионов кадмия проводят в реэкстракте n

Исследования на кадмий (Cd 2+) 1. Образование сульфида кадмия , р. Н 5 Cd 2+ + Na 2 S → Cd. S↓ + 2 Na+ канареечно желтый 2. Реакция с раствором ферроцианида калия, р. Н 5 Cd 2+ + K 4[Fe(CN)6] = Cd 2[Fe(CN)6] + 4 K+ белый 3. Образование комплекса пиридина с бромидом кадмия Бесцветные призматические кристаллы 4. Образования комплекса бруцина с бромидом кадмия Cd 2+ + бруцин + H 2 SO 4 + KBr = H 2 Cd. Br 4(бруцин)2 ↓+ 4 K+ + SO 42 Бесцветные призматические кристаллы

Исследования на медь (Cu 2+) n Экстракция Сu 2+ в виде комплекса с Pb(ДДТК)2 в CHCl 3. р. Н = 3. цвет от желтого до коричневого в присутствии меди. n Хлороформный слой отделяют и промывают в течение 30 с 6 н. раствора НСl для разложения избытка Pb(ДДТК)2, дистиллированной водой до р. Н = 5, 0. Комплекс разрушают 1% Hg. Cl 2 (ДДТК)2 Сu + Hg. Cl 2 => Cu 2+ + (ДДТК) Hg n Водный слой отделяют для проведения подтверждающих реакций.

Исследования на медь (Cu 2+) 1. Образования тетророданомеркуриата меди и цинка Cu 2+ + Zn 2+ + 2(NH 4)2[Hg(SCN)4] = Cu. Zn[Hg(SCN)4]2 + 4 NH 4+ лиловый осадок 2. Реакция образования феррицианида меди и кадмия красно коричневый осадок, переходит в лиловый 2 Cu 2+ + Cd 2+ + 2 K 4[Fe(CN)6] → Cu 2 Cd[Fe(CN)6]2 ↓ + 8 K+ 3. Образование пиридин роданового комплекса меди изумрудно зеленый
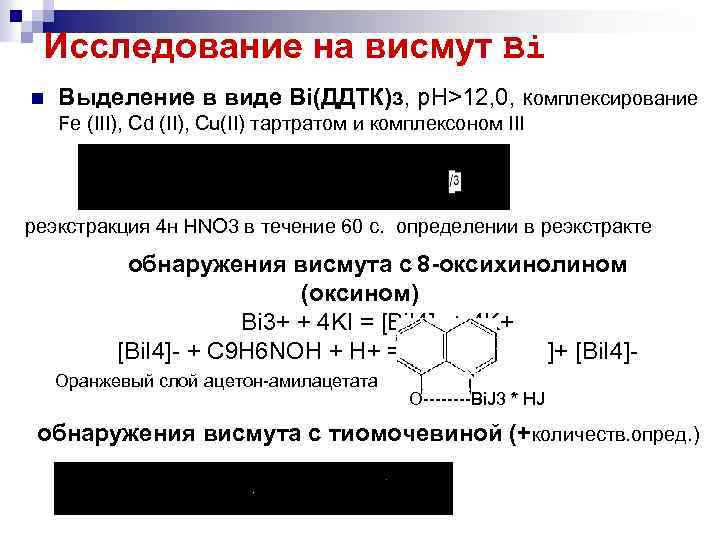
Исследование на висмут Bi n Bыделениe в виде Bi(ДДТК)з, р. Н>12, 0, комплексирование Fe (III), Cd (II), Cu(II) тартратом и комплексоном III реэкстракция 4 н HNO 3 в течение 60 с. определении в реэкстракте обнаружения висмута с 8 -оксихинолином (оксином) Bi 3+ + 4 KI = [Bi. I 4] + 4 K+ [Bi. I 4] + C 9 H 6 NOH + H+ = ]+ [Bi. I 4] Оранжевый слой ацетон амилацетата О Bi. J 3 * HJ обнаружения висмута с тиомочевиной (+количеств. опред. )
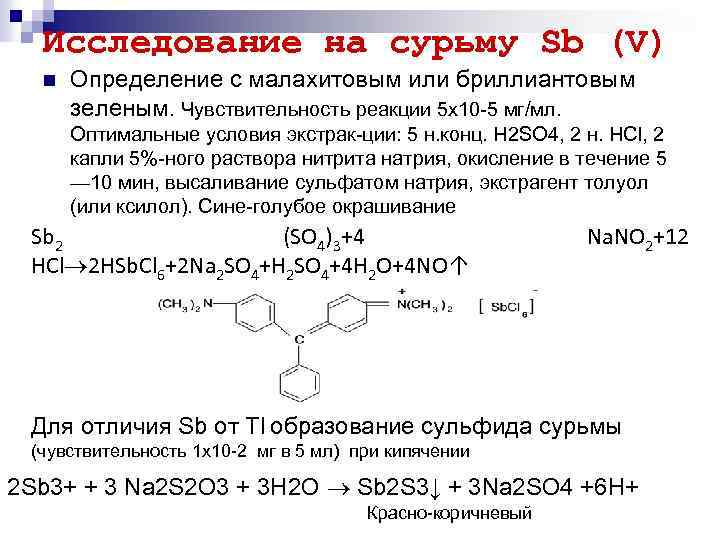
Исследование на сурьму Sb (V) n Определение с малахитовым или бриллиантовым зеленым. Чувствительность реакции 5 х10 5 мг/мл. Оптимальные условия экстрак ции: 5 н. конц. H 2 SO 4, 2 н. НСl, 2 капли 5% ного раствора нитрита натрия, окисление в течение 5 — 10 мин, высаливание сульфатом натрия, экстрагент толуол (или ксилол). Сине голубое окрашивание Sb 2 (SO 4)3+4 HCl 2 HSb. Cl 6+2 Na 2 SO 4+H 2 SO 4+4 H 2 O+4 NO↑ Na. NO 2+12 Для отличия Sb от Tl образованиe сульфида сурьмы (чувствительность 1 x 10 2 мг в 5 мл) при кипячении 2 Sb 3+ + 3 Na 2 S 2 O 3 + 3 H 2 O Sb 2 S 3↓ + 3 Na 2 SO 4 +6 H+ Красно коричневый

Исследование на мышьяк As Реакция Зангер — Блека предварительная, имеет отрицательное судебно химическое значение. • Zn + H 2 SO 4 Zn. SO 4 + 2 H • As. O 2 + 7 H => As. H 3 + 2 H 2 O 3 • As. O 3 + 9 H => As. H 3 + 2 H 2 O • As. O 4 3 - + 11 H => As. H 3 + 4 H 2 O • As. H 3 + Hg. CI 2 As. H 2(Hg. Cl)+As. H(Hg. Cl)2+As. H(Hg. Cl)3+HCl Мышьяковистый водород фиксируется реактивной бумагой, пропитанной бромидом или хлоридом ртути (II). буровато коричневый цвет. Граница обнаружения мышьяка 0, 01 мг. Мешает Sb = 2 мг на 100 г органа. n Мешает сероводород, образующийся при получении водорода. Для его связывания – вата пропитанная ацетатом свинца

Исследование на мышьяк As Исследование по методу Марша основная. В основу метода Марша положена реакция восстановления Аs до As. H 3 с последующим термическим разложением до элементарного As, далее окисление до мышьяковистого ангидрида. n I этап исследования. Обнаружение As. H 3. n n n Наблюдают при наличии мышьяковистого водорода за окрашиванием пламени у конца восстановительной трубки (синий цвет) и характерным (чесночным) запахом. Прекратив нагревание, восстановительную трубку осторожно поворачивают на 180°С и вытянутый конец опускают в колбу с 2 5% ным раствором Ag. NO 3, слабо подщелоченным аммиаком. Наблюдают потемнение раствора при наличии мышьяковистого водорода.

n IIэтап. Термическое разложение As. H 3 до Аs n Прогревают трубку Марша в течение 1 часа. В охлаждаемой части трубки появляется серо бурый налет с металлическим блеском. n IIIэтап. Образование мышьяковистого ангидрида, исследование кристаллов n восстановительную трубку прибора отделяют и осторожно (место налета) нагревают на слабом пламени горелки. На холодных частях трубки при этом осаждается мышьяковистый ангидрид в виде белого нале та, кристаллы которого исследуют под микроскопом. Кристаллы в виде октаэдров. n IV этап. Микрокристаллическая реакция с хлоридом цезия в присутствии йодида калия При n незначительном налете мышьяка <0, 05 мг). . Налет мышьяковистого ангидрида или металлического мышьяка растворяют в 2 3 каплях 50% раствора HNO 3 и переносят на предметное стекло. Упаривают досуха. Сухой остаток растворяют в 1 2 каплях 10% ного раствора НСl и вносят 1 2 кристалла Sb. Cl. При наличии Sb наблюдается выпадение осадка Cs 2 Sb. CI 5× 2, 5 H 2 O. При отсутствии осадка добавляют несколько кристаллов KJ. При наличии As выпадает осадок ярко красный Cs. As. I 2× 2, 5 H 2 O в виде шестиугольников или звездочек.
металл-яды.ppt