8-В.ppt
- Количество слайдов: 34
 Металлические элементы группы 8 -В Fe-Co-Ni Ru-Rh-Pd Os-Ir-Pt Hs-Mt-Ds
Металлические элементы группы 8 -В Fe-Co-Ni Ru-Rh-Pd Os-Ir-Pt Hs-Mt-Ds
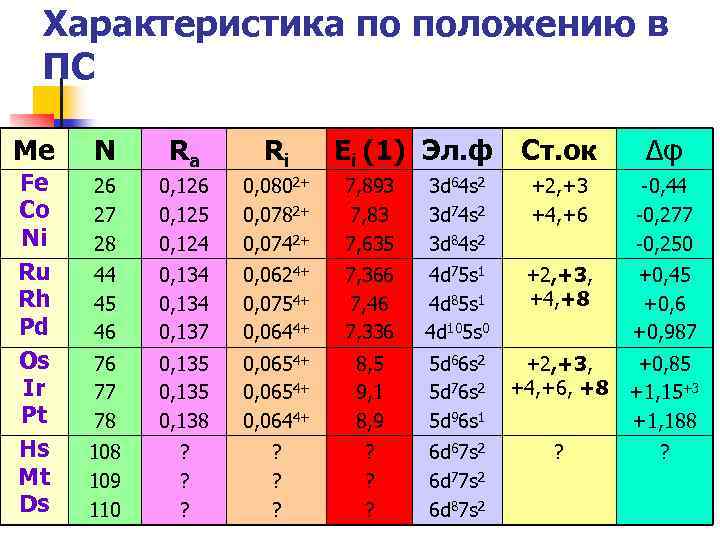 Характеристика по положению в ПС Ме N Fe Co Ni Ru Rh Pd Os Ir Pt Hs Mt Ds Ra Ri Ei (1) Эл. ф Ст. ок Δφ 26 27 28 0, 126 0, 125 0, 124 0, 0802+ 0, 0782+ 0, 0742+ 7, 893 7, 83 7, 635 3 d 64 s 2 3 d 74 s 2 3 d 84 s 2 +2, +3 +4, +6 -0, 44 -0, 277 -0, 250 44 45 46 0, 134 0, 137 0, 0624+ 0, 0754+ 0, 0644+ 7, 366 7, 46 7, 336 4 d 75 s 1 4 d 85 s 1 4 d 105 s 0 +2, +3, +4, +8 +0, 45 +0, 6 +0, 987 76 77 78 0, 135 0, 138 0, 0654+ 0, 0644+ 8, 5 9, 1 8, 9 5 d 66 s 2 5 d 76 s 2 5 d 96 s 1 +2, +3, +4, +6, +8 +0, 85 +1, 15+3 +1, 188 109 110 ? ? ? 6 d 67 s 2 6 d 77 s 2 6 d 87 s 2 ? ?
Характеристика по положению в ПС Ме N Fe Co Ni Ru Rh Pd Os Ir Pt Hs Mt Ds Ra Ri Ei (1) Эл. ф Ст. ок Δφ 26 27 28 0, 126 0, 125 0, 124 0, 0802+ 0, 0782+ 0, 0742+ 7, 893 7, 83 7, 635 3 d 64 s 2 3 d 74 s 2 3 d 84 s 2 +2, +3 +4, +6 -0, 44 -0, 277 -0, 250 44 45 46 0, 134 0, 137 0, 0624+ 0, 0754+ 0, 0644+ 7, 366 7, 46 7, 336 4 d 75 s 1 4 d 85 s 1 4 d 105 s 0 +2, +3, +4, +8 +0, 45 +0, 6 +0, 987 76 77 78 0, 135 0, 138 0, 0654+ 0, 0644+ 8, 5 9, 1 8, 9 5 d 66 s 2 5 d 76 s 2 5 d 96 s 1 +2, +3, +4, +6, +8 +0, 85 +1, 15+3 +1, 188 109 110 ? ? ? 6 d 67 s 2 6 d 77 s 2 6 d 87 s 2 ? ?
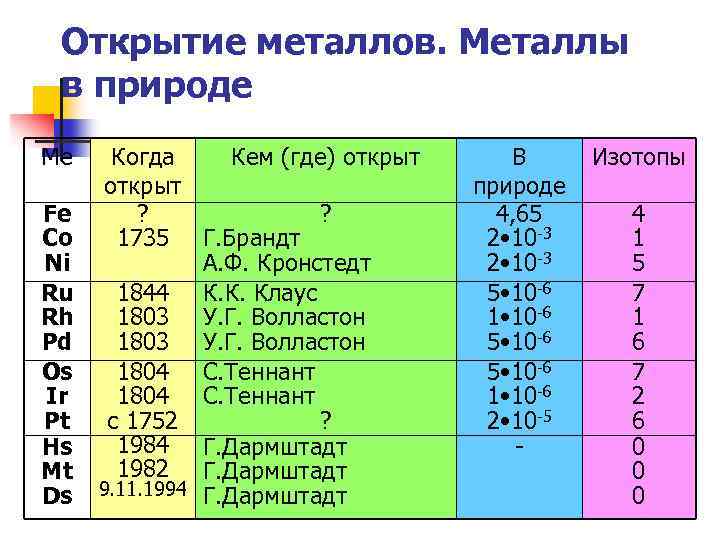 Открытие металлов. Металлы в природе Ме Fe Co Ni Ru Rh Pd Os Ir Pt Hs Mt Ds Когда Кем (где) открыт ? ? 1735 Г. Брандт А. Ф. Кронстедт 1844 К. К. Клаус 1803 У. Г. Волластон 1804 С. Теннант с 1752 ? 1984 Г. Дармштадт 1982 Г. Дармштадт 9. 11. 1994 Г. Дармштадт В природе 4, 65 2 • 10 -3 5 • 10 -6 1 • 10 -6 2 • 10 -5 - Изотопы 4 1 5 7 1 6 7 2 6 0 0 0
Открытие металлов. Металлы в природе Ме Fe Co Ni Ru Rh Pd Os Ir Pt Hs Mt Ds Когда Кем (где) открыт ? ? 1735 Г. Брандт А. Ф. Кронстедт 1844 К. К. Клаус 1803 У. Г. Волластон 1804 С. Теннант с 1752 ? 1984 Г. Дармштадт 1982 Г. Дармштадт 9. 11. 1994 Г. Дармштадт В природе 4, 65 2 • 10 -3 5 • 10 -6 1 • 10 -6 2 • 10 -5 - Изотопы 4 1 5 7 1 6 7 2 6 0 0 0
 Получение металлов n n n Железо – черная металлургия (чугун, сталь) Чугун – восстановление из оксидов углем (доменный процесс) Сталь – окисление соединений металлов кислородом (мартеновский, конверторный, электродуговой)
Получение металлов n n n Железо – черная металлургия (чугун, сталь) Чугун – восстановление из оксидов углем (доменный процесс) Сталь – окисление соединений металлов кислородом (мартеновский, конверторный, электродуговой)
 Получение металлов n n Кобальт – восстановление из оксида Никель – восстановление из оксида Платиновые металлы – разложением комплексных солей с дальнейшей очисткой Hs, Mt, Ds – не получают, т. к. не используют
Получение металлов n n Кобальт – восстановление из оксида Никель – восстановление из оксида Платиновые металлы – разложением комплексных солей с дальнейшей очисткой Hs, Mt, Ds – не получают, т. к. не используют
 Ядерные реакции
Ядерные реакции
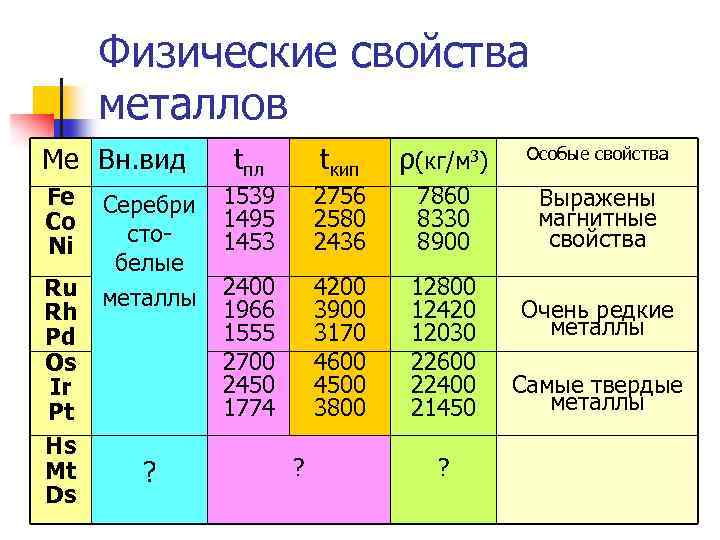 Физические свойства металлов Ме Вн. вид Fe Co Ni Ru Rh Pd Os Ir Pt Hs Mt Ds Серебри стобелые металлы ? tпл tкип ρ(кг/м 3) Особые свойства Выражены магнитные свойства 1539 1495 1453 2756 2580 2436 7860 8330 8900 2400 1966 1555 2700 2450 1774 4200 3900 3170 4600 4500 3800 12420 12030 22600 22400 21450 ? ? Очень редкие металлы Самые твердые металлы
Физические свойства металлов Ме Вн. вид Fe Co Ni Ru Rh Pd Os Ir Pt Hs Mt Ds Серебри стобелые металлы ? tпл tкип ρ(кг/м 3) Особые свойства Выражены магнитные свойства 1539 1495 1453 2756 2580 2436 7860 8330 8900 2400 1966 1555 2700 2450 1774 4200 3900 3170 4600 4500 3800 12420 12030 22600 22400 21450 ? ? Очень редкие металлы Самые твердые металлы
 Свойства простых веществ и соединений Простые вещества металлы Оксиды Гидроксиды Другие соединения
Свойства простых веществ и соединений Простые вещества металлы Оксиды Гидроксиды Другие соединения
 Железо Первое железо – метеоритное: Месопотамия – около 3000 лет до н. э. «Железный век» - 1 тысячелетие до н. э. n Выплавка – народы Кавказа или Туркмении n Вавилон, Египет – 1500 г до н. э. n Греция – 1000 г до н. э. n Рим – 600 г до н. э. n В современном Мире – основа индустрии n
Железо Первое железо – метеоритное: Месопотамия – около 3000 лет до н. э. «Железный век» - 1 тысячелетие до н. э. n Выплавка – народы Кавказа или Туркмении n Вавилон, Египет – 1500 г до н. э. n Греция – 1000 г до н. э. n Рим – 600 г до н. э. n В современном Мире – основа индустрии n
 Простое вещество железо n n n Известно 4 модификации: α, β, γ, δ α γ при 9060 С β - существует при 769 -9060 С γ δ при 14010 С β, γ, δ – парамагнитны Твердость – 4, 5 Электропроводность – 19% от серебра
Простое вещество железо n n n Известно 4 модификации: α, β, γ, δ α γ при 9060 С β - существует при 769 -9060 С γ δ при 14010 С β, γ, δ – парамагнитны Твердость – 4, 5 Электропроводность – 19% от серебра
 Химические свойства железа Fe 2+ , Fe 3+ 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 3 Fe + 2 O 2 = Fe 3 O 4 (Fe. O • Fe 2 O 3) 4 Fe + 3 O 2 +2 H 2 O = 4 Fe. O(OH) Fe+S=Fe. S 2 Fe+3 Cl 2 = 2 Fe. Cl 3 3 Fe + C = Fe 3 C Fe+Si = Fe 3 Si, Fe. Si 2 Fe+P = Fe 3 P, Fe 2 P Fe+2 HCl =Fe. Cl 2 + H 2 2 Fe + 4 КОН +3 О 2 = 2 К 2 Fe. О 4 + 2 Н 2 О Концентрированные кислоты пассивируют железо
Химические свойства железа Fe 2+ , Fe 3+ 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 3 Fe + 2 O 2 = Fe 3 O 4 (Fe. O • Fe 2 O 3) 4 Fe + 3 O 2 +2 H 2 O = 4 Fe. O(OH) Fe+S=Fe. S 2 Fe+3 Cl 2 = 2 Fe. Cl 3 3 Fe + C = Fe 3 C Fe+Si = Fe 3 Si, Fe. Si 2 Fe+P = Fe 3 P, Fe 2 P Fe+2 HCl =Fe. Cl 2 + H 2 2 Fe + 4 КОН +3 О 2 = 2 К 2 Fe. О 4 + 2 Н 2 О Концентрированные кислоты пассивируют железо
 Оксиды железа Fe. O – основный оксид Fe. O + 2 HCl =Fe. Cl 2 + H 2 О 2 Fe. O + H 2 О = Fe 2 O 3 + Н 2 Fe 2 O 3 – амфотерный оксид с преобладанием основных свойств Fe 2 O 3 + 6 HCl = 2 Fe. Cl 3+ 3 H 2 О Fe 2 O 3 + 2 КОН = 2 КFe. O 2 + H 2 О Fe 3 O 4 (Fe. O • Fe 2 O 3), Fe(Fe. O 2)2, – смешанный оксид
Оксиды железа Fe. O – основный оксид Fe. O + 2 HCl =Fe. Cl 2 + H 2 О 2 Fe. O + H 2 О = Fe 2 O 3 + Н 2 Fe 2 O 3 – амфотерный оксид с преобладанием основных свойств Fe 2 O 3 + 6 HCl = 2 Fe. Cl 3+ 3 H 2 О Fe 2 O 3 + 2 КОН = 2 КFe. O 2 + H 2 О Fe 3 O 4 (Fe. O • Fe 2 O 3), Fe(Fe. O 2)2, – смешанный оксид
 Гидроксиды железа Fe(OН)2 - основание со слабо выраженными амфотерными свойствами, выделяется из растворов в виде грязно-зеленого осадка: Fe. Cl 2 + 2 КОН = Fe(OН)2 + 2 КCl Растворяется в кислотах с образованием солей: Fe(OН)2 + H 2 SO 4 = Fe. SO 4 + 2 H 2 O Окисляется достаточно быстро: 4 Fe(OН)2 +О 2 + 2 Н 2 О = 4 Fe(OН)3 – амфотерный гидроксид, из растворов солей выделяется в виде бурого осадка: Fe. Cl 3 + 3 КОН = Fe(OН)3 + 3 КCl (Fe(OН)3 • 3 Н 2 О) Осадок растворяется в кислотах и щелочах: 2 Fe(OН)3 + 3 H 2 SO 4 = Fe 2(SO 4)3 + 6 H 2 O (Fe(OН)3 • 3 Н 2 О+3 Н+ =[ Fe(Н 2 О)6 ]3+) 2 Fe(OН)3 + 3 КОН = K 3[Fe(OH)6] (Fe(OН)3 • 3 Н 2 О+ 3 OH- = [Fe(OH)6]3 -) В кипящей щелочи происходит отщепление гидроксогрупп: 4 K 3[Fe(OH)6] = 4 К 2 Fe. O 2+ 10 Н 2 О+4 КОН+О 2
Гидроксиды железа Fe(OН)2 - основание со слабо выраженными амфотерными свойствами, выделяется из растворов в виде грязно-зеленого осадка: Fe. Cl 2 + 2 КОН = Fe(OН)2 + 2 КCl Растворяется в кислотах с образованием солей: Fe(OН)2 + H 2 SO 4 = Fe. SO 4 + 2 H 2 O Окисляется достаточно быстро: 4 Fe(OН)2 +О 2 + 2 Н 2 О = 4 Fe(OН)3 – амфотерный гидроксид, из растворов солей выделяется в виде бурого осадка: Fe. Cl 3 + 3 КОН = Fe(OН)3 + 3 КCl (Fe(OН)3 • 3 Н 2 О) Осадок растворяется в кислотах и щелочах: 2 Fe(OН)3 + 3 H 2 SO 4 = Fe 2(SO 4)3 + 6 H 2 O (Fe(OН)3 • 3 Н 2 О+3 Н+ =[ Fe(Н 2 О)6 ]3+) 2 Fe(OН)3 + 3 КОН = K 3[Fe(OH)6] (Fe(OН)3 • 3 Н 2 О+ 3 OH- = [Fe(OH)6]3 -) В кипящей щелочи происходит отщепление гидроксогрупп: 4 K 3[Fe(OH)6] = 4 К 2 Fe. O 2+ 10 Н 2 О+4 КОН+О 2
 Комплексные соединения железа n n Координационное число – 6 Образует комплексы с различными лигандами: [ Fe(Н 2 О)6 ]Cl 3 Na 3[Fe(OH)6] Ферроцианиды: K 4[Fe(CN)6] – желтая кровяная соль K 3[Fe(CN)6] – красная кровяная соль Используют в аналитической химии для обнаружения ионов железа (? )
Комплексные соединения железа n n Координационное число – 6 Образует комплексы с различными лигандами: [ Fe(Н 2 О)6 ]Cl 3 Na 3[Fe(OH)6] Ферроцианиды: K 4[Fe(CN)6] – желтая кровяная соль K 3[Fe(CN)6] – красная кровяная соль Используют в аналитической химии для обнаружения ионов железа (? )
 Биологическое значение железа Гемоглобин – красный фермент крови гем + глобин = стабильный комплекс, переносящий кислород Гем – комплексное соединение железа с порфириновым ядром (ферропротопорфирин) – сопряженная система соединение с кислородом (оксигемоглобин), углекислым газом (карбоксогемоглобин) и угарным газом (карбоксигемоглобин) происходит по принципу координации n n Fe 2+ Fe 3+ - дыхательная цепь митохондрии, ферменты цитохромы
Биологическое значение железа Гемоглобин – красный фермент крови гем + глобин = стабильный комплекс, переносящий кислород Гем – комплексное соединение железа с порфириновым ядром (ферропротопорфирин) – сопряженная система соединение с кислородом (оксигемоглобин), углекислым газом (карбоксогемоглобин) и угарным газом (карбоксигемоглобин) происходит по принципу координации n n Fe 2+ Fe 3+ - дыхательная цепь митохондрии, ферменты цитохромы
 Строение дезоксигемоглобина (а) и его окисление в окси-форму (б)
Строение дезоксигемоглобина (а) и его окисление в окси-форму (б)
 Применение железа n n n n Чугун Сталь общего назначения (С, Р, Si) Конструкционные стали – 0, 3 -0, 45 С Инструментальные стали – 0, 7 -1, 3 С Стали легированные (Cr, Mn, Ni) Стали специального назначения (V, Ti, W) Сплавы различного состава
Применение железа n n n n Чугун Сталь общего назначения (С, Р, Si) Конструкционные стали – 0, 3 -0, 45 С Инструментальные стали – 0, 7 -1, 3 С Стали легированные (Cr, Mn, Ni) Стали специального назначения (V, Ti, W) Сплавы различного состава
 Кобальт n n n Похожий на железо, твердый, тягучий металл Не подвержен действию воды и воздуха Применяется в жаростойких и жароустойчивых сплавах Со 60 – источник γ-излучения Соединения придают окраску стеклу – синий цвет различной интенсивности В живой природе – витамин В 12 цианкобаламин
Кобальт n n n Похожий на железо, твердый, тягучий металл Не подвержен действию воды и воздуха Применяется в жаростойких и жароустойчивых сплавах Со 60 – источник γ-излучения Соединения придают окраску стеклу – синий цвет различной интенсивности В живой природе – витамин В 12 цианкобаламин
 Соединения кобальта Оксиды: Со. О - устойчивый основный оксид (оливковый цвет) Со 2 О 3, - неустойчив, переходит в Со. О Со 3 О 4 – смешанный, Со. О • Со 2 О 3 Гидроксиды: Со(ОН)2 – основание, легко образуется из раствора соли Со(ОН)3 – проявляет окислительные свойства: 4 Со(ОН)3 + 4 H 2 SO 4 = 4 Co. SO 4 + 10 H 2 O + O 2 2 Со(ОН)3 + 6 HCl = 2 Co. Cl 2 +6 H 2 O Соли: Со. Cl 2 – синий Со. Cl 2 • H 2 O – сине -фиолетовый Со. Cl 2 • 2 H 2 O – розово – фиолетовый Со. Cl 2 • 4 H 2 O – красноватый Со. Cl 2 • 6 H 2 O – розовый Комплексные соединения: Со 2+ - неустойчивы Со 3+ - аналогичны соединениям железа: [Co(NH 3)6]Cl 3 , K 3[Co(NO 2)6]
Соединения кобальта Оксиды: Со. О - устойчивый основный оксид (оливковый цвет) Со 2 О 3, - неустойчив, переходит в Со. О Со 3 О 4 – смешанный, Со. О • Со 2 О 3 Гидроксиды: Со(ОН)2 – основание, легко образуется из раствора соли Со(ОН)3 – проявляет окислительные свойства: 4 Со(ОН)3 + 4 H 2 SO 4 = 4 Co. SO 4 + 10 H 2 O + O 2 2 Со(ОН)3 + 6 HCl = 2 Co. Cl 2 +6 H 2 O Соли: Со. Cl 2 – синий Со. Cl 2 • H 2 O – сине -фиолетовый Со. Cl 2 • 2 H 2 O – розово – фиолетовый Со. Cl 2 • 4 H 2 O – красноватый Со. Cl 2 • 6 H 2 O – розовый Комплексные соединения: Со 2+ - неустойчивы Со 3+ - аналогичны соединениям железа: [Co(NH 3)6]Cl 3 , K 3[Co(NO 2)6]
 Изменение окраски Co. Cl 2 при последовательном отщеплении молекул воды
Изменение окраски Co. Cl 2 при последовательном отщеплении молекул воды
 Никель n n n n Серебристый с желтоватым оттенком металл Легко пассивируется, поэтому устойчив в активных средах Применяется как легирующий компонент Входит в состав устойчивых сплавов, способен в количестве 10% погасить цвет меди Никелевые покрытия Промышленный катализатор (порошок, пористый) Лабораторная посуда
Никель n n n n Серебристый с желтоватым оттенком металл Легко пассивируется, поэтому устойчив в активных средах Применяется как легирующий компонент Входит в состав устойчивых сплавов, способен в количестве 10% погасить цвет меди Никелевые покрытия Промышленный катализатор (порошок, пористый) Лабораторная посуда
 Соединения никеля Неустойчивые соединения Ni. O 2 – выделить не удается Ni 2 O 3: Ni 2 O 3 + 6 HCl = Cl 2 + 2 Ni. Cl 2 + 3 H 2 O Ni(OH)3 – более сильный окислитель, чем Со(ОН)3 Устойчивые соединения Ni. O- серо - зеленый цвет, устойчив к действию воды и кислот Ni(OH)2 – основание, светло-зеленый осадок, окисляется до Ni(OH)3 2 Ni(OH)2 + Cl 2 + 2 КОН = 2 Ni(OH)3 + 2 КCl Ni. SO 4 • 7 H 2 O Соли Ni. F 2 Ni. Cl 2 Ni. Br 2 Ni. I 2 Комплексные соединения К 2[Ni(СN)4] –нанесение покрытий Аналитическая реакция – образование комплекса никеля с диметилглиокисмом – появляется ярко-красное окрашивание (реакция Чугаева)
Соединения никеля Неустойчивые соединения Ni. O 2 – выделить не удается Ni 2 O 3: Ni 2 O 3 + 6 HCl = Cl 2 + 2 Ni. Cl 2 + 3 H 2 O Ni(OH)3 – более сильный окислитель, чем Со(ОН)3 Устойчивые соединения Ni. O- серо - зеленый цвет, устойчив к действию воды и кислот Ni(OH)2 – основание, светло-зеленый осадок, окисляется до Ni(OH)3 2 Ni(OH)2 + Cl 2 + 2 КОН = 2 Ni(OH)3 + 2 КCl Ni. SO 4 • 7 H 2 O Соли Ni. F 2 Ni. Cl 2 Ni. Br 2 Ni. I 2 Комплексные соединения К 2[Ni(СN)4] –нанесение покрытий Аналитическая реакция – образование комплекса никеля с диметилглиокисмом – появляется ярко-красное окрашивание (реакция Чугаева)
 Платиновые металлы Ru-Rh-Pd Os-Ir-Pt
Платиновые металлы Ru-Rh-Pd Os-Ir-Pt
 Рутений n n n Назван в честь России (Ruthenia – лат. ) Хрупкий, твердый, редкий, радиоактивный, не выделен в совершенно чистом виде, многие физические параметры неясны Окисляется на воздухе: Ru +O 2 = Ru. O 2 Является катализатором промышленных (возможно, биологических процесов) Самый малоизученный из платиновых металлов Существует в 9 валентных состояниях
Рутений n n n Назван в честь России (Ruthenia – лат. ) Хрупкий, твердый, редкий, радиоактивный, не выделен в совершенно чистом виде, многие физические параметры неясны Окисляется на воздухе: Ru +O 2 = Ru. O 2 Является катализатором промышленных (возможно, биологических процесов) Самый малоизученный из платиновых металлов Существует в 9 валентных состояниях
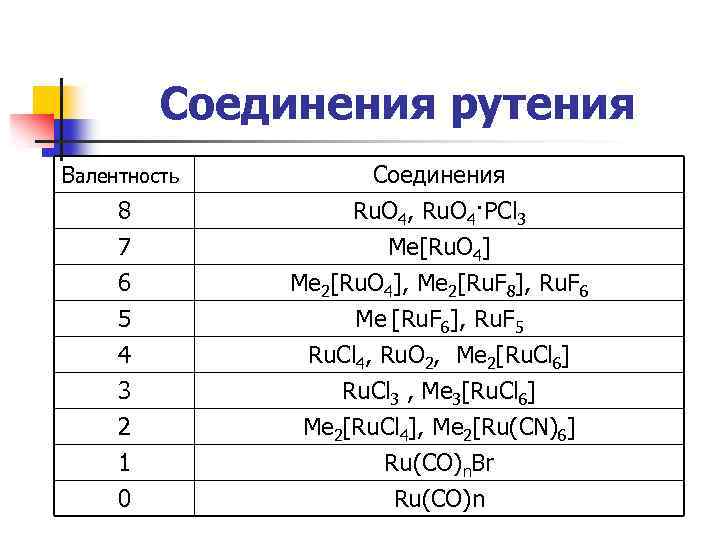 Соединения рутения Валентность 8 7 6 Соединения Ru. O 4, Ru. O 4·PCl 3 Me[Ru. O 4] Me 2[Ru. O 4], Me 2[Ru. F 8], Ru. F 6 5 4 3 2 1 0 Me [Ru. F 6], Ru. F 5 Ru. Cl 4, Ru. O 2, Me 2[Ru. Cl 6] Ru. Cl 3 , Me 3[Ru. Cl 6] Me 2[Ru. Cl 4], Me 2[Ru(CN)6] Ru(CO)n. Br Ru(CO)n
Соединения рутения Валентность 8 7 6 Соединения Ru. O 4, Ru. O 4·PCl 3 Me[Ru. O 4] Me 2[Ru. O 4], Me 2[Ru. F 8], Ru. F 6 5 4 3 2 1 0 Me [Ru. F 6], Ru. F 5 Ru. Cl 4, Ru. O 2, Me 2[Ru. Cl 6] Ru. Cl 3 , Me 3[Ru. Cl 6] Me 2[Ru. Cl 4], Me 2[Ru(CN)6] Ru(CO)n. Br Ru(CO)n
 Родий n n n n Серебристый металл с голубоватым оттенком Плохо поддается механической обработке Поверхность обладает высокой отражательной способностью Лишь мелкораздробленный растворяется в царской водке или концентрированной серной кислоте С кислородом взаимодействует медленно, при нагревании: 4 Rh + 3 O 2 = 2 Rh 2 O 3 Соединения окрашены в красный цвет (rodeos красный) Соединения: Rh. O 2 , Rh 2 O 3 • 5 Н 2 О, Rh. Cl 3 Rh. F 3 [Rh(NН 3)]Cl 3, Me 3[Rh. Cl 6]
Родий n n n n Серебристый металл с голубоватым оттенком Плохо поддается механической обработке Поверхность обладает высокой отражательной способностью Лишь мелкораздробленный растворяется в царской водке или концентрированной серной кислоте С кислородом взаимодействует медленно, при нагревании: 4 Rh + 3 O 2 = 2 Rh 2 O 3 Соединения окрашены в красный цвет (rodeos красный) Соединения: Rh. O 2 , Rh 2 O 3 • 5 Н 2 О, Rh. Cl 3 Rh. F 3 [Rh(NН 3)]Cl 3, Me 3[Rh. Cl 6]
 Палладий n n n n Серебристо-белый металл, похож на серебро Самый легкий и легкоплавкий из платиновых металлов, перед расплавлением размягчается Не тускнеет, не подвержен коррозии Обесцвечивает золото (1: 6) Единственный с полностью заполненной внешней электронной оболочкой – 18 электронов Не подвержен действию даже фтора Наиболее устойчив в двухвалентном состоянии: Pd. O, Pd(OH)2, K 2[Pd. Cl 6], K 2[Pd. Cl 4] Катализатор процессов гидрирования: поглощает до 950 объемов водорода
Палладий n n n n Серебристо-белый металл, похож на серебро Самый легкий и легкоплавкий из платиновых металлов, перед расплавлением размягчается Не тускнеет, не подвержен коррозии Обесцвечивает золото (1: 6) Единственный с полностью заполненной внешней электронной оболочкой – 18 электронов Не подвержен действию даже фтора Наиболее устойчив в двухвалентном состоянии: Pd. O, Pd(OH)2, K 2[Pd. Cl 6], K 2[Pd. Cl 4] Катализатор процессов гидрирования: поглощает до 950 объемов водорода
 Осмий n n Оловянно-белый с серовато-голубым оттенком металл, самый тяжелый и один из самых твердых Имеет запах – смесь запаха хлора и чеснока, οσμη – запах Окисляется на воздухе до Os. O 4 – источник запаха Существует в шести валентных состояниях (0, +2, +3, +4, +6, +8) n Оксиды n Os. O Os 2 O 3 Os. O 2 Os. O 4 Комплексные соединения: К 2[Os. О 4(ОН)2], Н 2 [Os. NCl 5], К 2 [Os. NCl 5]
Осмий n n Оловянно-белый с серовато-голубым оттенком металл, самый тяжелый и один из самых твердых Имеет запах – смесь запаха хлора и чеснока, οσμη – запах Окисляется на воздухе до Os. O 4 – источник запаха Существует в шести валентных состояниях (0, +2, +3, +4, +6, +8) n Оксиды n Os. O Os 2 O 3 Os. O 2 Os. O 4 Комплексные соединения: К 2[Os. О 4(ОН)2], Н 2 [Os. NCl 5], К 2 [Os. NCl 5]
 Иридий n n n Серебристо-белый, тяжелый, прочный металл Устойчив к действию активных сред: вода, газы, кислоты С галогенами при высоких температурах образует Ir. Cl 2 Ir. Cl 3 Ir. Cl 4 Ir. F 6 Оксиды и гидроксиды: Ir 2 О 3 Ir. О 2; Ir(ОН)4 Комплексные соединения [Ir(NH 3)6 ]Cl 3 , K 3[Ir. Cl 6] • 3 H 2 O Катализатор, твердые сплавы, медицинские сплавы
Иридий n n n Серебристо-белый, тяжелый, прочный металл Устойчив к действию активных сред: вода, газы, кислоты С галогенами при высоких температурах образует Ir. Cl 2 Ir. Cl 3 Ir. Cl 4 Ir. F 6 Оксиды и гидроксиды: Ir 2 О 3 Ir. О 2; Ir(ОН)4 Комплексные соединения [Ir(NH 3)6 ]Cl 3 , K 3[Ir. Cl 6] • 3 H 2 O Катализатор, твердые сплавы, медицинские сплавы
 Платина n n n n Тяжелый серебристо-белый металл Встречается в чистом виде вместе с золотом Самый инертный во всех отношениях металл «Химия платины – это химия ее комплексных соединений» Л. А. Чугаев Существует в семи валентных состояниях – 0, +2, +3, +4, +5, +6, +8 Мировая выработка невелика – менее 100 тонн в год При изучении соединений платины были сделаны выдающиеся открытия в области химии координационных соединений
Платина n n n n Тяжелый серебристо-белый металл Встречается в чистом виде вместе с золотом Самый инертный во всех отношениях металл «Химия платины – это химия ее комплексных соединений» Л. А. Чугаев Существует в семи валентных состояниях – 0, +2, +3, +4, +5, +6, +8 Мировая выработка невелика – менее 100 тонн в год При изучении соединений платины были сделаны выдающиеся открытия в области химии координационных соединений
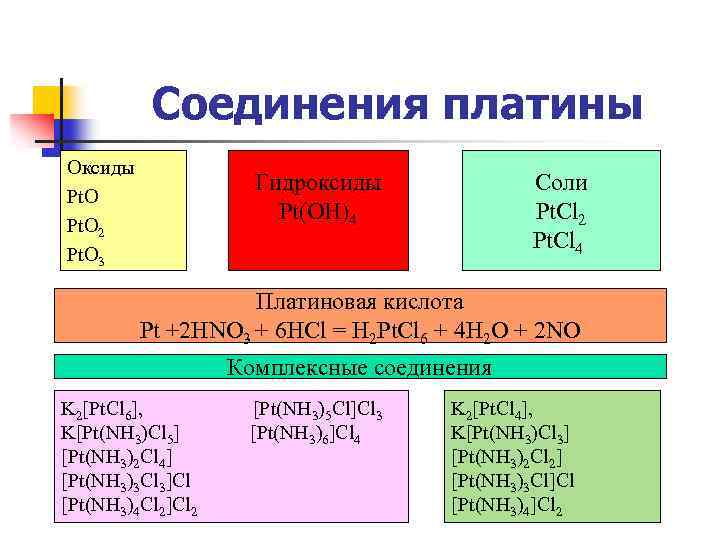 Соединения платины Оксиды Pt. O 2 Pt. O 3 Гидроксиды Pt(OН)4 Соли Pt. Cl 2 Pt. Cl 4 Платиновая кислота Pt +2 HNO 3 + 6 HCl = H 2 Pt. Cl 6 + 4 H 2 O + 2 NO Комплексные соединения K 2[Pt. Cl 6], K[Pt(NH 3)Cl 5] [Pt(NH 3)2 Cl 4] [Pt(NH 3)3 Cl 3]Cl [Pt(NH 3)4 Cl 2]Cl 2 [Pt(NH 3)5 Cl]Cl 3 [Pt(NH 3)6]Cl 4 K 2[Pt. Cl 4], K[Pt(NH 3)Cl 3] [Pt(NH 3)2 Cl 2] [Pt(NH 3)3 Cl]Cl [Pt(NH 3)4]Cl 2
Соединения платины Оксиды Pt. O 2 Pt. O 3 Гидроксиды Pt(OН)4 Соли Pt. Cl 2 Pt. Cl 4 Платиновая кислота Pt +2 HNO 3 + 6 HCl = H 2 Pt. Cl 6 + 4 H 2 O + 2 NO Комплексные соединения K 2[Pt. Cl 6], K[Pt(NH 3)Cl 5] [Pt(NH 3)2 Cl 4] [Pt(NH 3)3 Cl 3]Cl [Pt(NH 3)4 Cl 2]Cl 2 [Pt(NH 3)5 Cl]Cl 3 [Pt(NH 3)6]Cl 4 K 2[Pt. Cl 4], K[Pt(NH 3)Cl 3] [Pt(NH 3)2 Cl 2] [Pt(NH 3)3 Cl]Cl [Pt(NH 3)4]Cl 2
 Новые элементы 8 -В… и далее n n n Завершают седьмой период Восьмой период должен быть сверхбольшим – 50 элементов Должна заполняться g- оболочка, содержащая 18 электронов (октадеканиды) Самый устойчивый -№ 126, вероятно, тяжелый металл, возможно, трехвалентный в соединениях Пока можно говорить об элементах до № 118…
Новые элементы 8 -В… и далее n n n Завершают седьмой период Восьмой период должен быть сверхбольшим – 50 элементов Должна заполняться g- оболочка, содержащая 18 электронов (октадеканиды) Самый устойчивый -№ 126, вероятно, тяжелый металл, возможно, трехвалентный в соединениях Пока можно говорить об элементах до № 118…
 Таким образом n n Элементы 8 -В группы представлены четырьмя триадами В каждой триаде изменение свойств простых веществ и их соединений имеет свою закономерность Самым распространенным и значимым является железо Самым редким, дорогим и не менее значимым является платина
Таким образом n n Элементы 8 -В группы представлены четырьмя триадами В каждой триаде изменение свойств простых веществ и их соединений имеет свою закономерность Самым распространенным и значимым является железо Самым редким, дорогим и не менее значимым является платина
 Спасибо за внимание, будем ждать новых открытий!
Спасибо за внимание, будем ждать новых открытий!


