Металлические элементы 5 -В группы





















 Металлические элементы 5 -В группы V Nb Ta Db
Металлические элементы 5 -В группы V Nb Ta Db
 Характеристика металлов по положению в ПС w Не являются полными электронными аналогами – провал электрона у ниобия w Энергия ионизации сверху вниз повышается, атомы уплотняются w Свойства ниобия и тантала практически одинаковы w Отличаются разнообразием степеней окисления (+2 - +5) w Соединения в состоянии высшей степени окисления проявляют кислотные свойства 2
Характеристика металлов по положению в ПС w Не являются полными электронными аналогами – провал электрона у ниобия w Энергия ионизации сверху вниз повышается, атомы уплотняются w Свойства ниобия и тантала практически одинаковы w Отличаются разнообразием степеней окисления (+2 - +5) w Соединения в состоянии высшей степени окисления проявляют кислотные свойства 2
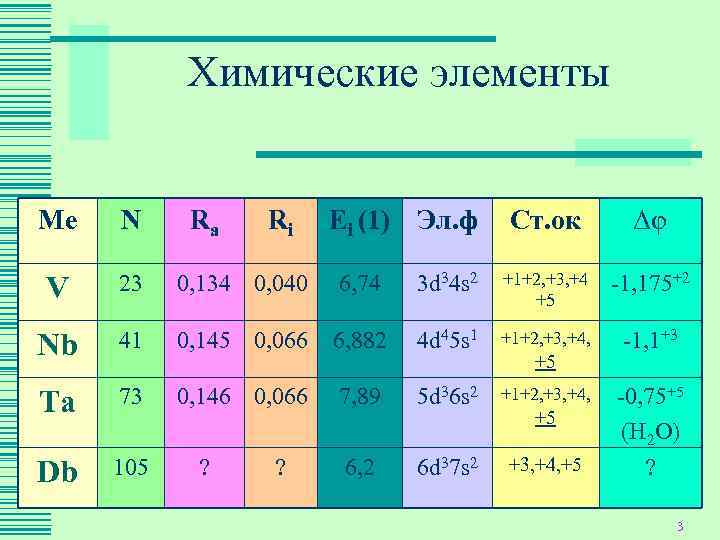
 Химические элементы Ме N Ra Ri Ei (1) Эл. ф Ст. ок Δφ 23 0, 134 0, 040 6, 74 3 d 34 s 2 +1+2, +3, +4 -1, 175+2 V +5 Nb 41 0, 145 0, 066 6, 882 4 d 45 s 1 +1+2, +3, +4, -1, 1+3 +5 Ta 73 0, 146 0, 066 7, 89 5 d 36 s 2 +1+2, +3, +4, -0, 75+5 (Н 2 О) 105 ? ? 6, 2 6 d 37 s 2 +3, +4, +5 ? Db 3
Химические элементы Ме N Ra Ri Ei (1) Эл. ф Ст. ок Δφ 23 0, 134 0, 040 6, 74 3 d 34 s 2 +1+2, +3, +4 -1, 175+2 V +5 Nb 41 0, 145 0, 066 6, 882 4 d 45 s 1 +1+2, +3, +4, -1, 1+3 +5 Ta 73 0, 146 0, 066 7, 89 5 d 36 s 2 +1+2, +3, +4, -0, 75+5 (Н 2 О) 105 ? ? 6, 2 6 d 37 s 2 +3, +4, +5 ? Db 3
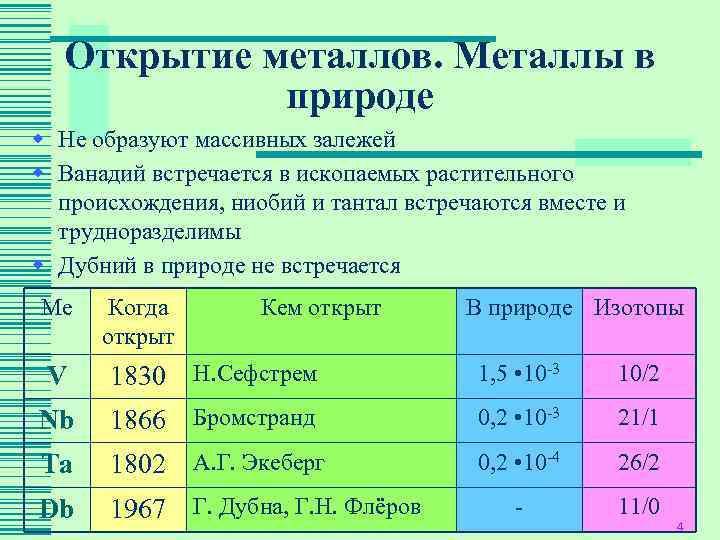
 Открытие металлов. Металлы в природе w Не образуют массивных залежей w Ванадий встречается в ископаемых растительного происхождения, ниобий и тантал встречаются вместе и трудноразделимы w Дубний в природе не встречается Ме Когда Кем открыт В природе Изотопы открыт V 1830 Н. Сефстрем 1, 5 • 10 -3 10/2 Nb 1866 Бромстранд 0, 2 • 10 -3 21/1 Ta 1802 А. Г. Экеберг 0, 2 • 10 -4 26/2 Db 1967 Г. Дубна, Г. Н. Флёров - 11/0 4
Открытие металлов. Металлы в природе w Не образуют массивных залежей w Ванадий встречается в ископаемых растительного происхождения, ниобий и тантал встречаются вместе и трудноразделимы w Дубний в природе не встречается Ме Когда Кем открыт В природе Изотопы открыт V 1830 Н. Сефстрем 1, 5 • 10 -3 10/2 Nb 1866 Бромстранд 0, 2 • 10 -3 21/1 Ta 1802 А. Г. Экеберг 0, 2 • 10 -4 26/2 Db 1967 Г. Дубна, Г. Н. Флёров - 11/0 4
 Получение металлов Металлотермия или восстановление водородом: w Ванадий – восстановление из оксида w Ниобий – восстановлением из солей w Тантал – восстановлением водородом из хлорида w Дубний : 5
Получение металлов Металлотермия или восстановление водородом: w Ванадий – восстановление из оксида w Ниобий – восстановлением из солей w Тантал – восстановлением водородом из хлорида w Дубний : 5
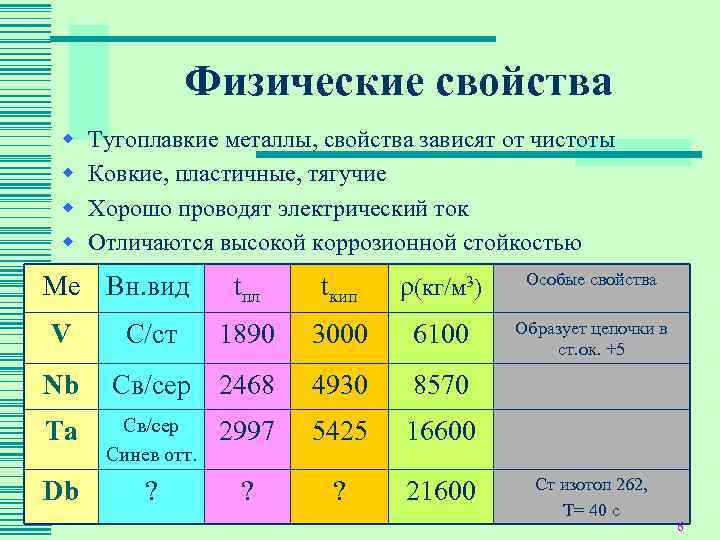
 Физические свойства w Тугоплавкие металлы, свойства зависят от чистоты w Ковкие, пластичные, тягучие w Хорошо проводят электрический ток w Отличаются высокой коррозионной стойкостью Особые свойства Ме Вн. вид tпл tкип ρ(кг/м 3) Образует цепочки в V С/ст 1890 3000 6100 ст. ок. +5 Nb Св/сер 2468 4930 8570 Ta Св/сер 2997 5425 16600 Синев отт. Ст изотоп 262, Db ? ? 21600 Т= 40 с 6
Физические свойства w Тугоплавкие металлы, свойства зависят от чистоты w Ковкие, пластичные, тягучие w Хорошо проводят электрический ток w Отличаются высокой коррозионной стойкостью Особые свойства Ме Вн. вид tпл tкип ρ(кг/м 3) Образует цепочки в V С/ст 1890 3000 6100 ст. ок. +5 Nb Св/сер 2468 4930 8570 Ta Св/сер 2997 5425 16600 Синев отт. Ст изотоп 262, Db ? ? 21600 Т= 40 с 6
 Свойства простых веществ и соединений Простые вещества металлы Оксиды Гидроксиды Другие соединения
Свойства простых веществ и соединений Простые вещества металлы Оксиды Гидроксиды Другие соединения
 Простые вещества металлы w При нагревании окисляются кислородом до Ме 2 О 5 w С галогенами : Ме +2 Gal 2 = Me. Gal 4, 2 Ме +5 Gal 2 = 2 Me. Gal 5 w Все растворяются в кислотах или их смеси при условии, что кислоты являются окислителями и протекает процесс глубокого окисления 8
Простые вещества металлы w При нагревании окисляются кислородом до Ме 2 О 5 w С галогенами : Ме +2 Gal 2 = Me. Gal 4, 2 Ме +5 Gal 2 = 2 Me. Gal 5 w Все растворяются в кислотах или их смеси при условии, что кислоты являются окислителями и протекает процесс глубокого окисления 8
 Однако… w Ванадий при нагревании растворяется в серной кислоте: V + 3 Н 2 SО 4 = (VO)SО 4 + SО 2 + 3 H 2 O w При сплавлении взаимодействуют со щелочами: 4 Ме + 4 КОН +5 О 2 = 4 КМе. О 3 + 3 H 2 O (500 -6000 С) 4 Ме + 12 КОН +5 О 2 = 4 К 3 Ме. О 4 + 6 H 2 O (800 -9000 С) w Все металлы растворяются в смеси азотной и плавиковой кислот: 3 Ме + 5 НNО 3+21 НF = 3 Н 2 [Ме. F 7] + 5 NО + 10 H 2 O w Тантал при нагревании реагирует с серой и азотом: Та + 2 S = Та. S 2 , 2 Та + N 2 = 2 Та. N 9
Однако… w Ванадий при нагревании растворяется в серной кислоте: V + 3 Н 2 SО 4 = (VO)SО 4 + SО 2 + 3 H 2 O w При сплавлении взаимодействуют со щелочами: 4 Ме + 4 КОН +5 О 2 = 4 КМе. О 3 + 3 H 2 O (500 -6000 С) 4 Ме + 12 КОН +5 О 2 = 4 К 3 Ме. О 4 + 6 H 2 O (800 -9000 С) w Все металлы растворяются в смеси азотной и плавиковой кислот: 3 Ме + 5 НNО 3+21 НF = 3 Н 2 [Ме. F 7] + 5 NО + 10 H 2 O w Тантал при нагревании реагирует с серой и азотом: Та + 2 S = Та. S 2 , 2 Та + N 2 = 2 Та. N 9
 Оксиды металлов V 2 O –нестойкий, близок к металлическому состоянию VO – нерастворим в воде, взаимодействует с кислотами, образует димер V 2 O 2 V 2 O 3 – кристаллы черного цвета, амфотерный с преобладанием основных свойств VO 2 – сине-голубые кристаллы, гигроскопичен, наиболее устойчивый из оксидов ванадия, типично амфотерный V 2 O 5 – кислотный оксид, растворяется в воде Nb. O – металлоподобный по внешнему виду и химическим свойствам Nb. O 2 – черный с голубым отливом, неустойчив, имеет кислотный характер Nb 2 O 5 – амфотерный с преобладанием кислотных свойств, меняет окраску при нагревании Та. О 2 – неустойчив, выделить невозможно Та 2 О 5 – белый порошок, не растворимый ни в воде, ни в кислотах, кроме плавиковой, амфотерный со слабо выраженными свойствами 10
Оксиды металлов V 2 O –нестойкий, близок к металлическому состоянию VO – нерастворим в воде, взаимодействует с кислотами, образует димер V 2 O 2 V 2 O 3 – кристаллы черного цвета, амфотерный с преобладанием основных свойств VO 2 – сине-голубые кристаллы, гигроскопичен, наиболее устойчивый из оксидов ванадия, типично амфотерный V 2 O 5 – кислотный оксид, растворяется в воде Nb. O – металлоподобный по внешнему виду и химическим свойствам Nb. O 2 – черный с голубым отливом, неустойчив, имеет кислотный характер Nb 2 O 5 – амфотерный с преобладанием кислотных свойств, меняет окраску при нагревании Та. О 2 – неустойчив, выделить невозможно Та 2 О 5 – белый порошок, не растворимый ни в воде, ни в кислотах, кроме плавиковой, амфотерный со слабо выраженными свойствами 10
 Оксиды металлов Оксиды ванадия: VO + H 2 SO 4 = VSO 4 + H 2 O ( фиолетовый или голубой растворы ) V 2 O 3 + 6 HNO 3 = 2 V(NO 3)3 + 3 H 2 O ( зеленый раствор) V(NO 3)3 + 3 NH 4 OH = V(OH)3 + 3 NH 4 NO 3 – зеленый осадок 2 V 2 O 3 + O 2 = 4 VO 2 (сине-голубые кристаллы) 4 VO 2 + 2 Na. OH +H 2 O = Na 2[V 4 O 9] • 7 H 2 O VO 2 + 2 HCl = VOCl 2 + H 2 O (VO 2+, V 2 O 42+ синий цвет растворов) VO 2 + Ca. O = Ca. VO 3 (Ca 2 VO 4 , Ca 3 VO 5) V 2 O 5 + H 2 O = 2 HVO 3 V 2 O 5 + 2 Na. OH (6 Na. OH) = 2 Na. VO 3 + H 2 O (2 Na 3 VO 4 + 3 H 2 O) 11
Оксиды металлов Оксиды ванадия: VO + H 2 SO 4 = VSO 4 + H 2 O ( фиолетовый или голубой растворы ) V 2 O 3 + 6 HNO 3 = 2 V(NO 3)3 + 3 H 2 O ( зеленый раствор) V(NO 3)3 + 3 NH 4 OH = V(OH)3 + 3 NH 4 NO 3 – зеленый осадок 2 V 2 O 3 + O 2 = 4 VO 2 (сине-голубые кристаллы) 4 VO 2 + 2 Na. OH +H 2 O = Na 2[V 4 O 9] • 7 H 2 O VO 2 + 2 HCl = VOCl 2 + H 2 O (VO 2+, V 2 O 42+ синий цвет растворов) VO 2 + Ca. O = Ca. VO 3 (Ca 2 VO 4 , Ca 3 VO 5) V 2 O 5 + H 2 O = 2 HVO 3 V 2 O 5 + 2 Na. OH (6 Na. OH) = 2 Na. VO 3 + H 2 O (2 Na 3 VO 4 + 3 H 2 O) 11
 Оксиды металлов Оксиды ниобия Nb 2 O 5 + 3 Na 2 CO 3 = 2 Na 3 Nb. O 4 + 3 CO 2 (при сплавлении ортониобат натрия) Na 3 Nb. O 4 + Н 2 О = Na. Nb. O 3 + 2 Na. OН Nb 2 O 5 + 3 Na. HSO 4 = +5 Nb 2 O 2(SO 4)3 + 3 Na. OH Nb 2 O 5 + 10 HF = 2 H 2[Nb. OF 5] + 3 H 2 O Nb 2 O 5 + Н 2 = Nb. O 2 , Nb. O 2 + эл. ток +t 0 = Nb. O 2 Nb. O + 3 Cl 2 = 2 Nb. OCl 3 2 Nb. O + 6 HCl 2 = 2 Nb. OCl 3 + 3 H 2 12
Оксиды металлов Оксиды ниобия Nb 2 O 5 + 3 Na 2 CO 3 = 2 Na 3 Nb. O 4 + 3 CO 2 (при сплавлении ортониобат натрия) Na 3 Nb. O 4 + Н 2 О = Na. Nb. O 3 + 2 Na. OН Nb 2 O 5 + 3 Na. HSO 4 = +5 Nb 2 O 2(SO 4)3 + 3 Na. OH Nb 2 O 5 + 10 HF = 2 H 2[Nb. OF 5] + 3 H 2 O Nb 2 O 5 + Н 2 = Nb. O 2 , Nb. O 2 + эл. ток +t 0 = Nb. O 2 Nb. O + 3 Cl 2 = 2 Nb. OCl 3 2 Nb. O + 6 HCl 2 = 2 Nb. OCl 3 + 3 H 2 12
 Оксиды металлов Оксиды тантала При сплавлении: Та 2 О 5 + 2 КОН = 2 КТа. О 3 + Н 2 О Та 2 О 5 + 3 К 2 СО 3 = 2 К 3 Та. О 4 + 3 СО 2 1. Тпл выше на 4000 С 2. Почти в 2 р. тежелее 3. Сплавление с карбонатами происходит труднее 4. Гидролиз солей протекает быстрее 5. Гель оксида легче отдает воду Та 2 О 5 + 6 HNO 3 = 2 Ta. O(NO 3)3 + 3 H 2 O Та 2 О 5 + 10 HCl 2 = 2 Та. Cl 5 + 5 Н 2 О 2 Та 2 О 5 + С = 4 Та. О 2 + СО 2 13
Оксиды металлов Оксиды тантала При сплавлении: Та 2 О 5 + 2 КОН = 2 КТа. О 3 + Н 2 О Та 2 О 5 + 3 К 2 СО 3 = 2 К 3 Та. О 4 + 3 СО 2 1. Тпл выше на 4000 С 2. Почти в 2 р. тежелее 3. Сплавление с карбонатами происходит труднее 4. Гидролиз солей протекает быстрее 5. Гель оксида легче отдает воду Та 2 О 5 + 6 HNO 3 = 2 Ta. O(NO 3)3 + 3 H 2 O Та 2 О 5 + 10 HCl 2 = 2 Та. Cl 5 + 5 Н 2 О 2 Та 2 О 5 + С = 4 Та. О 2 + СО 2 13
 Гидроксиды металлов w Ванадиевые кислоты HVO 3 H 3 VO 4 H 4 V 2 O 7 Среда р. Н Соль Кислая 4, 3 -4, 7 Ag. VO 3 Слабокислая 5, 5 -5, 8 Ag 4 V 2 O 7 Почти нейтральная 6 -6, 5 Ag 3 VO 4 14
Гидроксиды металлов w Ванадиевые кислоты HVO 3 H 3 VO 4 H 4 V 2 O 7 Среда р. Н Соль Кислая 4, 3 -4, 7 Ag. VO 3 Слабокислая 5, 5 -5, 8 Ag 4 V 2 O 7 Почти нейтральная 6 -6, 5 Ag 3 VO 4 14
 Формы иона ванадия VO 3 - Среда Форма Цвет Нейтральная [VO 4]3 - желтый Кислая [V 6 O 17]4 - [V 10 O 28]6 - желтый, оранжевый Щелочная [V 3 O 9]3 - желтый [V 2 O 7]4 - Сильно- [V 2 O 7]4 - бесцветный щелочная 15
Формы иона ванадия VO 3 - Среда Форма Цвет Нейтральная [VO 4]3 - желтый Кислая [V 6 O 17]4 - [V 10 O 28]6 - желтый, оранжевый Щелочная [V 3 O 9]3 - желтый [V 2 O 7]4 - Сильно- [V 2 O 7]4 - бесцветный щелочная 15
 Гидроксиды ванадия (+4, +3, +2) Поливанадиевые кислоты: H 2 V 4 O 9 H 2 VO 3 H 4 VO 4 H 6 VO 5 В растворе становятся производными ванадила: H 2 V 4 O 9 + 6 Н+ = 4 VO(ОH)2 + 3 Н 2 О Гидроксиды ванадия: V (ОH)2 + О 2 = 2 VO(ОH)2 4 V(ОH)3 + О 2 = 4 VO(ОH)2 +2 Н 2 О 16
Гидроксиды ванадия (+4, +3, +2) Поливанадиевые кислоты: H 2 V 4 O 9 H 2 VO 3 H 4 VO 4 H 6 VO 5 В растворе становятся производными ванадила: H 2 V 4 O 9 + 6 Н+ = 4 VO(ОH)2 + 3 Н 2 О Гидроксиды ванадия: V (ОH)2 + О 2 = 2 VO(ОH)2 4 V(ОH)3 + О 2 = 4 VO(ОH)2 +2 Н 2 О 16
 Гидриды металлов w Хрупкие, металлоподобные порошки серого или черного цвета, переменного состава w Формула соединений может быть выражена как Ме. Н w Химически устойчивы w Водой не разлагаются 17
Гидриды металлов w Хрупкие, металлоподобные порошки серого или черного цвета, переменного состава w Формула соединений может быть выражена как Ме. Н w Химически устойчивы w Водой не разлагаются 17
 Карбиды металлов w Ме. С, Ме 2 С – карбиды, образуются при непосредственном взаимодействии w Имеют очень высокие температуры плавления ~35000 C w Достаточно пластичны w Устойчивы к внешним воздействиям w Входят в состав защитных пленок и высокотемпературных сплавов Но есть и: V 3 С, V 2 С , V 3 С 2 , V 4 С 3 18
Карбиды металлов w Ме. С, Ме 2 С – карбиды, образуются при непосредственном взаимодействии w Имеют очень высокие температуры плавления ~35000 C w Достаточно пластичны w Устойчивы к внешним воздействиям w Входят в состав защитных пленок и высокотемпературных сплавов Но есть и: V 3 С, V 2 С , V 3 С 2 , V 4 С 3 18
 Нитриды металлов w Нитриды ванадия: V 3 N и VN w Нитриды ниобия: Nb 3 N и Nb. N w Нитриды тантала: Та 3 N и Та. N w Тугоплавкие, устойчивые к действию температур и химических веществ, не растворяющиеся в воде и кислотах w Nb. N – при температуре, близкой к абсолютному нулю обладает сверхпроводимостью 19
Нитриды металлов w Нитриды ванадия: V 3 N и VN w Нитриды ниобия: Nb 3 N и Nb. N w Нитриды тантала: Та 3 N и Та. N w Тугоплавкие, устойчивые к действию температур и химических веществ, не растворяющиеся в воде и кислотах w Nb. N – при температуре, близкой к абсолютному нулю обладает сверхпроводимостью 19
 Галогениды металлов w Галогениды ванадия: VGal 2 VGal 3 VGal 4 VGal 5 (VF 5) w Галогениды ниобия: Nb. Gal 4 Nb. Gal 5 w Галогениды тантала: w Та. Сl 2 Та. Сl 3 Та. Сl 4 Та. Сl 5 w Другие галогениды тантала неустойчивы и не изучены 20
Галогениды металлов w Галогениды ванадия: VGal 2 VGal 3 VGal 4 VGal 5 (VF 5) w Галогениды ниобия: Nb. Gal 4 Nb. Gal 5 w Галогениды тантала: w Та. Сl 2 Та. Сl 3 Та. Сl 4 Та. Сl 5 w Другие галогениды тантала неустойчивы и не изучены 20
 Применение металлов w Ванадий – легирующий элемент для сталей, сверхустойчивые сплавы, соединения – катализаторы (V 2 O 5 – производство серной кислоты) w Ниобий – электровакуумная техника, металлургия w Тантал – электровакуумная техника, металлургия, медицина, атомная энергетика 21
Применение металлов w Ванадий – легирующий элемент для сталей, сверхустойчивые сплавы, соединения – катализаторы (V 2 O 5 – производство серной кислоты) w Ниобий – электровакуумная техника, металлургия w Тантал – электровакуумная техника, металлургия, медицина, атомная энергетика 21
 Дубний w Изотопы с массой 255 и 256 «живут» 0, 6 и 30 секунд w 18 февраля 1970 – статья о получении в России (нильсборий) w 17 апреля 1970 – статья о получении в США (ганий) 22
Дубний w Изотопы с массой 255 и 256 «живут» 0, 6 и 30 секунд w 18 февраля 1970 – статья о получении в России (нильсборий) w 17 апреля 1970 – статья о получении в США (ганий) 22
 Спасибо за внимание и плодотворную работу! 23
Спасибо за внимание и плодотворную работу! 23

