 Металлические элементы 3 -В группы Sc Y La Ac 1
Металлические элементы 3 -В группы Sc Y La Ac 1
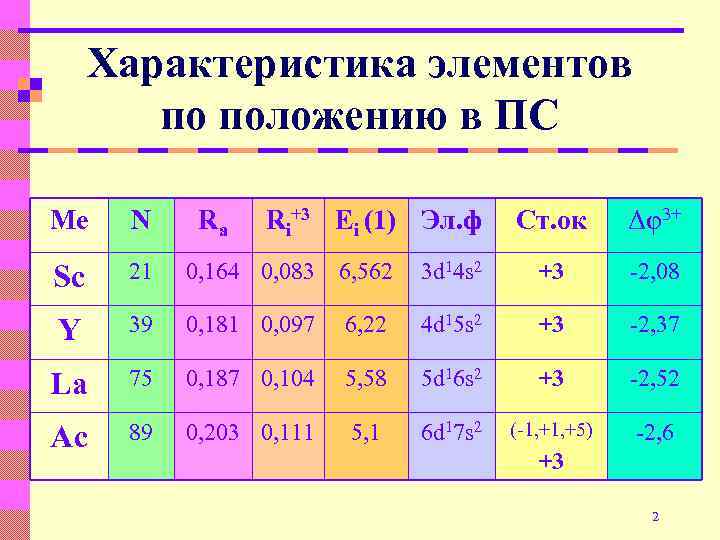 Характеристика элементов по положению в ПС Ме N Ra Ri+3 Ei (1) Эл. ф Ст. ок Δφ3+ Sc 21 0, 164 0, 083 6, 562 3 d 14 s 2 +3 -2, 08 Y 39 0, 181 0, 097 6, 22 4 d 15 s 2 +3 -2, 37 La 75 0, 187 0, 104 5, 58 5 d 16 s 2 +3 -2, 52 Ac 89 0, 203 0, 111 5, 1 6 d 17 s 2 (-1, +5) -2, 6 +3 2
Характеристика элементов по положению в ПС Ме N Ra Ri+3 Ei (1) Эл. ф Ст. ок Δφ3+ Sc 21 0, 164 0, 083 6, 562 3 d 14 s 2 +3 -2, 08 Y 39 0, 181 0, 097 6, 22 4 d 15 s 2 +3 -2, 37 La 75 0, 187 0, 104 5, 58 5 d 16 s 2 +3 -2, 52 Ac 89 0, 203 0, 111 5, 1 6 d 17 s 2 (-1, +5) -2, 6 +3 2
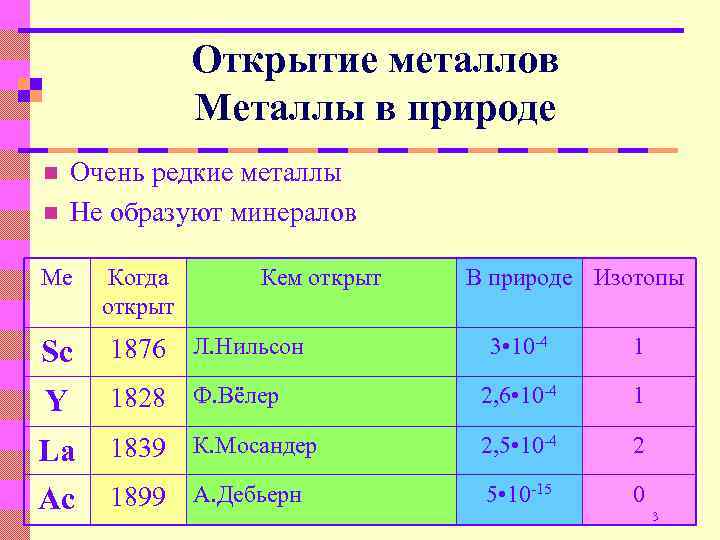 Открытие металлов Металлы в природе n n Очень редкие металлы Не образуют минералов Ме Когда открыт Кем открыт В природе Изотопы Sc 1876 Л. Нильсон 3 • 10 -4 1 Y 1828 Ф. Вёлер 2, 6 • 10 -4 1 La 1839 К. Мосандер 2, 5 • 10 -4 2 Ac 1899 А. Дебьерн 5 • 10 -15 0 3
Открытие металлов Металлы в природе n n Очень редкие металлы Не образуют минералов Ме Когда открыт Кем открыт В природе Изотопы Sc 1876 Л. Нильсон 3 • 10 -4 1 Y 1828 Ф. Вёлер 2, 6 • 10 -4 1 La 1839 К. Мосандер 2, 5 • 10 -4 2 Ac 1899 А. Дебьерн 5 • 10 -15 0 3
 Получение металлов n n n Скандий, иттрий – из примесей руд других металлов путем обжига, превращения оксида во фторид с последующим восстановлением кальцием Лантан - обработка руд кислотой и разделение полученной смеси на ионообменной колонке и последующим электролизом Актиний – облучением ядер радия в ядерном реакторе 4
Получение металлов n n n Скандий, иттрий – из примесей руд других металлов путем обжига, превращения оксида во фторид с последующим восстановлением кальцием Лантан - обработка руд кислотой и разделение полученной смеси на ионообменной колонке и последующим электролизом Актиний – облучением ядер радия в ядерном реакторе 4
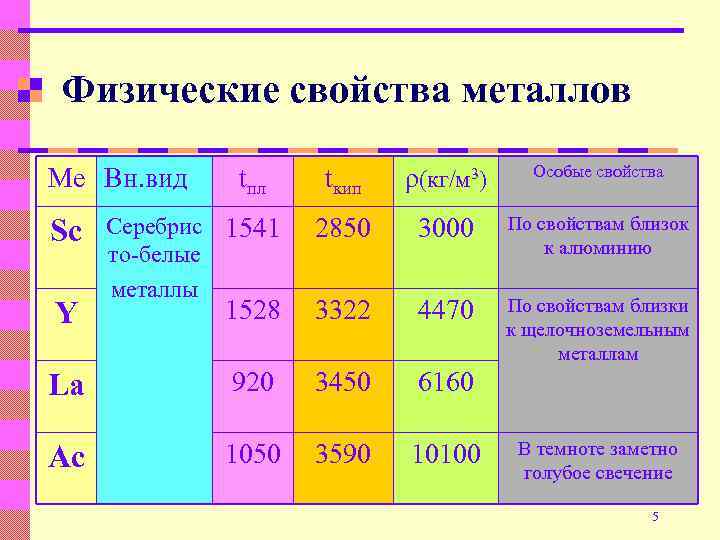 Физические свойства металлов tкип ρ(кг/м 3) Особые свойства Серебрис 1541 то-белые металлы 2850 3000 По свойствам близок к алюминию 1528 3322 4470 По свойствам близки к щелочноземельным металлам La 920 3450 6160 Ac 1050 3590 10100 Ме Вн. вид Sc Y tпл В темноте заметно голубое свечение 5
Физические свойства металлов tкип ρ(кг/м 3) Особые свойства Серебрис 1541 то-белые металлы 2850 3000 По свойствам близок к алюминию 1528 3322 4470 По свойствам близки к щелочноземельным металлам La 920 3450 6160 Ac 1050 3590 10100 Ме Вн. вид Sc Y tпл В темноте заметно голубое свечение 5
 Свойства простых веществ и соединений 6
Свойства простых веществ и соединений 6
 Скандий 1. 2. 3. 4. 5. 6. Атомная масса – 44 Плотность – 3 Образует оксид Eb 2 O с плотностью 3, 5 Оксид, фосфат и карбонат нерастворимы в воде и щелочах Сульфат труднорастворим 1. Образует двойной сульфат, который не изоморфен квасцам 6. 2. 3. 4. 5. Атомная масса – 44, 96 Плотность – 3, 1 Образует оксид Sc 2 O 3 с плотностью 3, 86 Оксид, фосфат и карбонат нерастворимы в воде и щелочах Сульфат Sc 2(SO 4)3· 6 Н 2 О труднорастворим Двойная соль Sc 2(SO 4)3· 2 К 2 SO 4 не изоморфна квасцам 7
Скандий 1. 2. 3. 4. 5. 6. Атомная масса – 44 Плотность – 3 Образует оксид Eb 2 O с плотностью 3, 5 Оксид, фосфат и карбонат нерастворимы в воде и щелочах Сульфат труднорастворим 1. Образует двойной сульфат, который не изоморфен квасцам 6. 2. 3. 4. 5. Атомная масса – 44, 96 Плотность – 3, 1 Образует оксид Sc 2 O 3 с плотностью 3, 86 Оксид, фосфат и карбонат нерастворимы в воде и щелочах Сульфат Sc 2(SO 4)3· 6 Н 2 О труднорастворим Двойная соль Sc 2(SO 4)3· 2 К 2 SO 4 не изоморфна квасцам 7
 Скандий Самый первый d-элемент n Имеет сходство с кальцием и алюминием n Обладает высокой электропроводностью в сочетании с коррозионной устойчивостью n Очень редкий и дорогой металл, что ограничивает его применение… n 8
Скандий Самый первый d-элемент n Имеет сходство с кальцием и алюминием n Обладает высокой электропроводностью в сочетании с коррозионной устойчивостью n Очень редкий и дорогой металл, что ограничивает его применение… n 8
 Свойства и соединения скандия n n n При небольшом нагревании реагирует с галогенами и другими неметаллами Галогениды получают из кислородсодержащих солей – продуктов обработки руд: Sc(NO 3)3 + 3 HF = Sc. F 3 + 3 HNO 3 [Sc(H 2 O)6]3+ При действии щелочей выпадает осадок гидроксида: Sc (NO 3)3 + 3 КОН = Sc(ОН)3 + 3 КNO 3 Гидроксид проявляет амфотерные свойства: Sc(ОН)3 + 3 КОН = К 3 [Sc(ОН)6] Sc(ОН)3 + 3 HNO 3 = Sc(NO 3)3 + 3 H 2 O Неясен вопрос со степенью окисления +2 (Sc. С 2, Sc. Н 2, Sc. Cl 2) 9
Свойства и соединения скандия n n n При небольшом нагревании реагирует с галогенами и другими неметаллами Галогениды получают из кислородсодержащих солей – продуктов обработки руд: Sc(NO 3)3 + 3 HF = Sc. F 3 + 3 HNO 3 [Sc(H 2 O)6]3+ При действии щелочей выпадает осадок гидроксида: Sc (NO 3)3 + 3 КОН = Sc(ОН)3 + 3 КNO 3 Гидроксид проявляет амфотерные свойства: Sc(ОН)3 + 3 КОН = К 3 [Sc(ОН)6] Sc(ОН)3 + 3 HNO 3 = Sc(NO 3)3 + 3 H 2 O Неясен вопрос со степенью окисления +2 (Sc. С 2, Sc. Н 2, Sc. Cl 2) 9
 Иттрий n n Название происходит от города Иттербю По свойствам близок к большинству редкоземельных элементов (лантанидов) Труднодоступный и дорогой, изучен недостаточно, возможность применения до конца не ясна По химическим свойствам имеет горизонтальное сходство со стронцием, 5 s и 4 d-орбитали сближены, но находятся дальше от ядра, чем валентные орбитали у скандия 10
Иттрий n n Название происходит от города Иттербю По свойствам близок к большинству редкоземельных элементов (лантанидов) Труднодоступный и дорогой, изучен недостаточно, возможность применения до конца не ясна По химическим свойствам имеет горизонтальное сходство со стронцием, 5 s и 4 d-орбитали сближены, но находятся дальше от ядра, чем валентные орбитали у скандия 10
 Иттрий n n n По прочности почти равен титану, по упругости – алюминию, по электропроводности- ртути На воздухе устойчив, оксидная пленка появляется при 4000 С При 7600 С происходит окисление: 4 Y+3 O 2 = 2 Y 2 O 3 Также активно взаимодействует с другими неметаллами, известны соединения: YN, YGal 3, YH 3, YB 2, YB 4, YB 6, YB 12 Оксид поглощает углекислый газ, превращается в карбонат Гидроксид обладает основными свойствами, но с концентрированными щелочами образует иттраты – КYO 2 11
Иттрий n n n По прочности почти равен титану, по упругости – алюминию, по электропроводности- ртути На воздухе устойчив, оксидная пленка появляется при 4000 С При 7600 С происходит окисление: 4 Y+3 O 2 = 2 Y 2 O 3 Также активно взаимодействует с другими неметаллами, известны соединения: YN, YGal 3, YH 3, YB 2, YB 4, YB 6, YB 12 Оксид поглощает углекислый газ, превращается в карбонат Гидроксид обладает основными свойствами, но с концентрированными щелочами образует иттраты – КYO 2 11
 Лантан n n n n Имеет «рыхлую» электронную структуру – 9 свободных «мест» на пятом уровне и 14 – на четвертом Имеет диагональное сходство по свойствам со стронцием На воздухе покрывается рыхлой пленкой оксида: 4 La + 3 O 2 = 2 La 2 O 3 Взаимодействует с водой: 2 La + 6 Н 2 О = 2 La(ОН)3 + 3 Н 2 Легко растворяется в кислотах Известны соединения практически со всеми неметаллами Комплексные соединения образуются лишь в расплавах 12
Лантан n n n n Имеет «рыхлую» электронную структуру – 9 свободных «мест» на пятом уровне и 14 – на четвертом Имеет диагональное сходство по свойствам со стронцием На воздухе покрывается рыхлой пленкой оксида: 4 La + 3 O 2 = 2 La 2 O 3 Взаимодействует с водой: 2 La + 6 Н 2 О = 2 La(ОН)3 + 3 Н 2 Легко растворяется в кислотах Известны соединения практически со всеми неметаллами Комплексные соединения образуются лишь в расплавах 12
 Актиний n Крайне редкий – на добычу 1 г необходимо переработать 7000 т руды n Является дочерним продуктом распада урана или тория, наиболее часто - 227 Ас, самый стабильный – 225 Ас, Т=10 дней Несколько мг было получено в 1950 г американскими исследователями: Ac. F 3 + 3 Li = Ac + 3 Li. F По химическим свойствам близок к щелочным металлам n n n Оксид актиния взаимодействует с кислотами и водой: Ас2 О 3 + 3 Н 2 О = 2 Ас(ОН)3 – типичное основание Получено около 10 соединений, изоструктурных соединениям лантана По свойствам резко отличается от металлов семейства актиноидов 13
Актиний n Крайне редкий – на добычу 1 г необходимо переработать 7000 т руды n Является дочерним продуктом распада урана или тория, наиболее часто - 227 Ас, самый стабильный – 225 Ас, Т=10 дней Несколько мг было получено в 1950 г американскими исследователями: Ac. F 3 + 3 Li = Ac + 3 Li. F По химическим свойствам близок к щелочным металлам n n n Оксид актиния взаимодействует с кислотами и водой: Ас2 О 3 + 3 Н 2 О = 2 Ас(ОН)3 – типичное основание Получено около 10 соединений, изоструктурных соединениям лантана По свойствам резко отличается от металлов семейства актиноидов 13
 Ученые тоже шутят… n n Актиний предсказан Д. И. Менделеевым, открыт в 1899 году Через 20 лет Фредерик Содди подвел итог: «Атомный вес – неизвестен; средняя продолжительность жизни – неизвестна; характер излучения – не испускает лучей; материнское вещество – неизвестно; исходным веществом, вероятно, является уран; продукт распада - радиоактиний» 14
Ученые тоже шутят… n n Актиний предсказан Д. И. Менделеевым, открыт в 1899 году Через 20 лет Фредерик Содди подвел итог: «Атомный вес – неизвестен; средняя продолжительность жизни – неизвестна; характер излучения – не испускает лучей; материнское вещество – неизвестно; исходным веществом, вероятно, является уран; продукт распада - радиоактиний» 14
 Элементы семейства лантана Особенности электронного строения Физические свойства Химические свойства Области возможного применения 15
Элементы семейства лантана Особенности электронного строения Физические свойства Химические свойства Области возможного применения 15
 Общая характеристика элементов n n n Лантан, актиний и еще 14 – в одну клетку… Вынести лантаноиды и актиноиды за пределы основного варианта предложил профессор Пражского университета Богуслав Францевич Браунер Очень редкие элементы, трудно разделить, трудно выделить В свободном состоянии – обычные металлы По свойствам можно разделить на две группы: Се-Gd, Tb-Lu основа – вторичная периодичность 16
Общая характеристика элементов n n n Лантан, актиний и еще 14 – в одну клетку… Вынести лантаноиды и актиноиды за пределы основного варианта предложил профессор Пражского университета Богуслав Францевич Браунер Очень редкие элементы, трудно разделить, трудно выделить В свободном состоянии – обычные металлы По свойствам можно разделить на две группы: Се-Gd, Tb-Lu основа – вторичная периодичность 16
 Вторичная периодичность n n n Заполняется 4 f-электронный подуровень: - Се-Gd – с 1 по 7 электроны, занимают свободные орбитали -Tb-Lu – новый электрон образует пару У церия сразу 2 электрона поступают на 4 f- подуровень. Далее заполнение электронами 4 f-подуровня первой семерки происходит последовательно до Gd, у которого 1 электрон уходит на 5 d-подуровень. Во второй семерке у Tb 2 новых электрона поступают на 4 f- подуровень, у элементов до Lu на 5 d-подуровне нет электронов. 17
Вторичная периодичность n n n Заполняется 4 f-электронный подуровень: - Се-Gd – с 1 по 7 электроны, занимают свободные орбитали -Tb-Lu – новый электрон образует пару У церия сразу 2 электрона поступают на 4 f- подуровень. Далее заполнение электронами 4 f-подуровня первой семерки происходит последовательно до Gd, у которого 1 электрон уходит на 5 d-подуровень. Во второй семерке у Tb 2 новых электрона поступают на 4 f- подуровень, у элементов до Lu на 5 d-подуровне нет электронов. 17
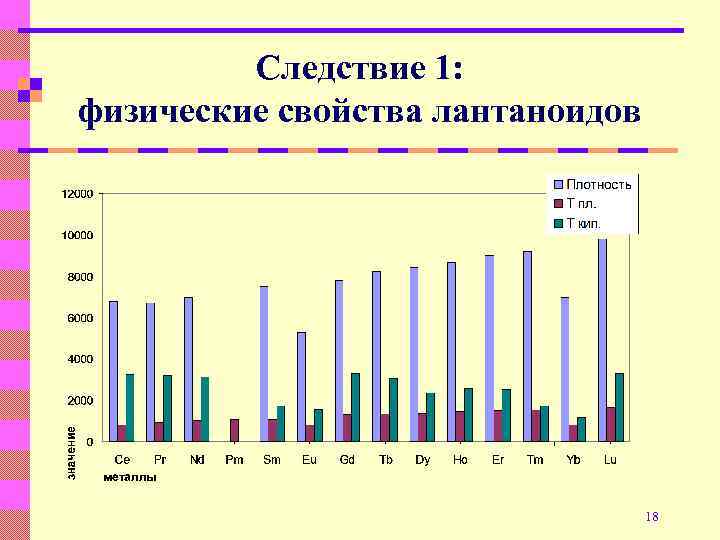 Следствие 1: физические свойства лантаноидов 18
Следствие 1: физические свойства лантаноидов 18
 Следствие 2: химические свойства n Подтверждают деление на два семейства: реакционная способность падает в каждом семействе слева направо Cе Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 19
Следствие 2: химические свойства n Подтверждают деление на два семейства: реакционная способность падает в каждом семействе слева направо Cе Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 19
 Cвойства соединений n n n n Характер оксидов – основный, изменяется аналогично свойствам простых веществ Гидроксиды – основания, характер меняется от типично основного к амфотерному Практически для всех лантаноидов известны нитриды – Ln. N, галогениды – Ln. Gal 3 Интерес представляют карбиды – электропроводны Возможно существование гидридов – Ln. Н 2 и Ln. Н 3 Получен ряд сульфидов: Ln 2 S 3, Ln 3 S 4, , Ln. S, , Ln 5 S 7 , Ln 2 O 2 S Образуют разнообразные сплавы 20
Cвойства соединений n n n n Характер оксидов – основный, изменяется аналогично свойствам простых веществ Гидроксиды – основания, характер меняется от типично основного к амфотерному Практически для всех лантаноидов известны нитриды – Ln. N, галогениды – Ln. Gal 3 Интерес представляют карбиды – электропроводны Возможно существование гидридов – Ln. Н 2 и Ln. Н 3 Получен ряд сульфидов: Ln 2 S 3, Ln 3 S 4, , Ln. S, , Ln 5 S 7 , Ln 2 O 2 S Образуют разнообразные сплавы 20
 Отдельные представители лантаноидов: группа церия Ме История Cе 1875, Церера Pr Nd Pm Sm Eu Gd Особенности Применение Пирофорность Сплавы, стекла 1885, светло-зеленый близнец 1885, новый близнец +5, двойственность Абразивные при отдаче ē материалы Цветные соединения Сплавы, абразивные материалы (Карл Ауэр фон Вельсбах) 1947, Прометей Искусственный Атомные микробатарейки 1879, уральский минерал +2, аналог щелочно. Специальная керамика (АЭ) В. Е. Самарский-Быховцев земельных Ме 1901, 1937, Европа +2, большой атом, Цветное малая плотность телевидение 1880, Юхан Гадолин Ферромагнетик Люминофоры 21
Отдельные представители лантаноидов: группа церия Ме История Cе 1875, Церера Pr Nd Pm Sm Eu Gd Особенности Применение Пирофорность Сплавы, стекла 1885, светло-зеленый близнец 1885, новый близнец +5, двойственность Абразивные при отдаче ē материалы Цветные соединения Сплавы, абразивные материалы (Карл Ауэр фон Вельсбах) 1947, Прометей Искусственный Атомные микробатарейки 1879, уральский минерал +2, аналог щелочно. Специальная керамика (АЭ) В. Е. Самарский-Быховцев земельных Ме 1901, 1937, Европа +2, большой атом, Цветное малая плотность телевидение 1880, Юхан Гадолин Ферромагнетик Люминофоры 21
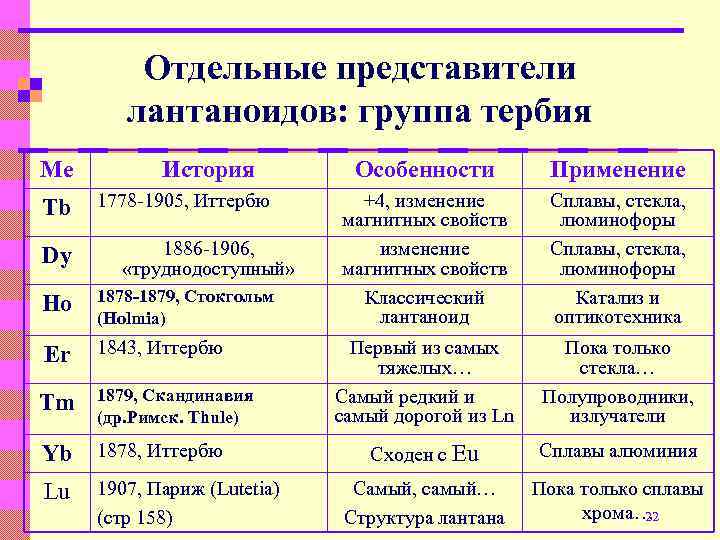 Отдельные представители лантаноидов: группа тербия Ме Tb Dy История 1778 -1905, Иттербю 1886 -1906, «труднодоступный» Ho 1878 -1879, Стокгольм (Holmia) Er 1843, Иттербю Tm 1879, Скандинавия (др. Римск. Thule) Yb 1878, Иттербю Lu 1907, Париж (Lutetia) (стр 158) Особенности Применение +4, изменение магнитных свойств Классический лантаноид Сплавы, стекла, люминофоры Катализ и оптикотехника Первый из самых тяжелых… Самый редкий и самый дорогой из Ln Пока только стекла… Полупроводники, излучатели Сходен с Eu Сплавы алюминия Самый, самый… Структура лантана Пока только сплавы хрома… 22
Отдельные представители лантаноидов: группа тербия Ме Tb Dy История 1778 -1905, Иттербю 1886 -1906, «труднодоступный» Ho 1878 -1879, Стокгольм (Holmia) Er 1843, Иттербю Tm 1879, Скандинавия (др. Римск. Thule) Yb 1878, Иттербю Lu 1907, Париж (Lutetia) (стр 158) Особенности Применение +4, изменение магнитных свойств Классический лантаноид Сплавы, стекла, люминофоры Катализ и оптикотехника Первый из самых тяжелых… Самый редкий и самый дорогой из Ln Пока только стекла… Полупроводники, излучатели Сходен с Eu Сплавы алюминия Самый, самый… Структура лантана Пока только сплавы хрома… 22
 Элементы семейства актиния Особенности электронного строения Физические свойства Химические свойства Области возможного применения 23
Элементы семейства актиния Особенности электронного строения Физические свойства Химические свойства Области возможного применения 23
 Общие свойства элементов n n n Все радиоактивны, атомы неустойчивы, трудно определить электронное строение Торий и лоуренсий можно отнести к d-элементам Можно разделить на две группы: Th-Cm, Bк-Lr Наблюдается вторичная периодичность: заполняется 5 f-электронный подуровень: -Th-Cm - с 1 по 7 электроны, занимают свободные орбитали -Bк-Lr - новый электрон образует пару Заполнение электронами 5 f-подуровня происходит с нарушениями последовательности в обеих семерках: - Th - 5 f – электрона нет -для трансурановых элементов характерно «смешение» 5 f-, 6 d- и 7 р-электронных состояний: нивелирование энергии электронов из -за релятивистского эффекта 24
Общие свойства элементов n n n Все радиоактивны, атомы неустойчивы, трудно определить электронное строение Торий и лоуренсий можно отнести к d-элементам Можно разделить на две группы: Th-Cm, Bк-Lr Наблюдается вторичная периодичность: заполняется 5 f-электронный подуровень: -Th-Cm - с 1 по 7 электроны, занимают свободные орбитали -Bк-Lr - новый электрон образует пару Заполнение электронами 5 f-подуровня происходит с нарушениями последовательности в обеих семерках: - Th - 5 f – электрона нет -для трансурановых элементов характерно «смешение» 5 f-, 6 d- и 7 р-электронных состояний: нивелирование энергии электронов из -за релятивистского эффекта 24
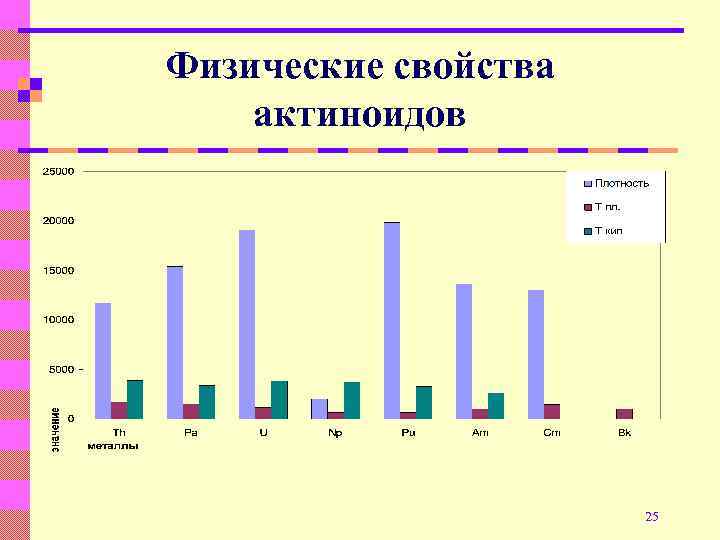 Физические свойства актиноидов 25
Физические свойства актиноидов 25
 Химические свойства n n n n Свойства до конца не изучены Трудность – изменение физических и химических свойств под действием собственной радиоактивности Возможны степени окисления +7 и +8 Известны соединения со степенями окисления +1 и +2 Наиболее характерны степени окисления +3 Получены в очень малых количествах Применение – не совсем ясно… 26
Химические свойства n n n n Свойства до конца не изучены Трудность – изменение физических и химических свойств под действием собственной радиоактивности Возможны степени окисления +7 и +8 Известны соединения со степенями окисления +1 и +2 Наиболее характерны степени окисления +3 Получены в очень малых количествах Применение – не совсем ясно… 26
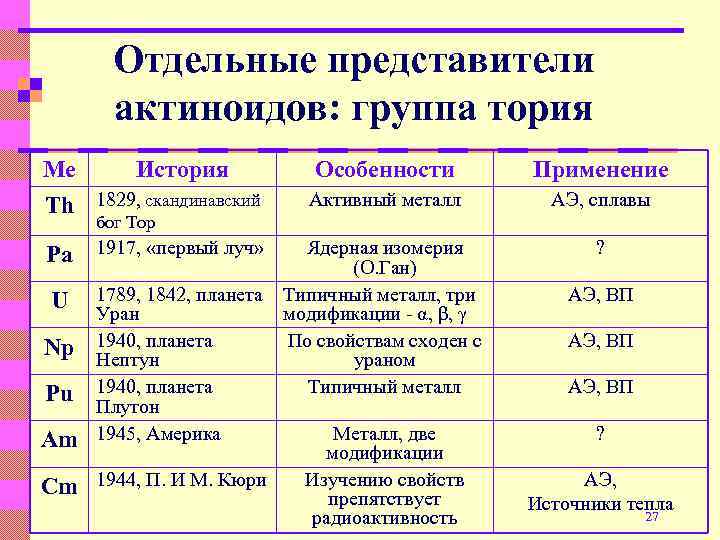 Отдельные представители актиноидов: группа тория Ме История Особенности Применение Th 1829, скандинавский Активный металл АЭ, сплавы Pa 1917, «первый луч» Ядерная изомерия (О. Ган) Типичный металл, три модификации - α, β, γ По свойствам сходен с ураном Типичный металл ? бог Тор U Np Pu Am 1789, 1842, планета Уран 1940, планета Нептун 1940, планета Плутон 1945, Америка Cm 1944, П. И М. Кюри Металл, две модификации Изучению свойств препятствует радиоактивность АЭ, ВП ? АЭ, Источники тепла 27
Отдельные представители актиноидов: группа тория Ме История Особенности Применение Th 1829, скандинавский Активный металл АЭ, сплавы Pa 1917, «первый луч» Ядерная изомерия (О. Ган) Типичный металл, три модификации - α, β, γ По свойствам сходен с ураном Типичный металл ? бог Тор U Np Pu Am 1789, 1842, планета Уран 1940, планета Нептун 1940, планета Плутон 1945, Америка Cm 1944, П. И М. Кюри Металл, две модификации Изучению свойств препятствует радиоактивность АЭ, ВП ? АЭ, Источники тепла 27
 Отдельные представители актиноидов: группа берклия Ме Bk 1949 Cf 1952 История, получение Применение ЯФ ЯФ, точечные взрывы Es 1952 Fm 1952 ЯФ Md 1955 No 1957 ЯФ Lr 1960 ЯФ ЯФ ЯФ 28
Отдельные представители актиноидов: группа берклия Ме Bk 1949 Cf 1952 История, получение Применение ЯФ ЯФ, точечные взрывы Es 1952 Fm 1952 ЯФ Md 1955 No 1957 ЯФ Lr 1960 ЯФ ЯФ ЯФ 28
 А сколько может быть элементов? n n Ю. С. Черкинский – не может быть больше 10 миллиардов Существующий элемент – время «жизни» больше того промежутка, за который бомбардирующая частица пролетит сквозь ядро Устойчивость определяется соотношением протонов и нейтронов: для возможного десятимиллиардного – N/Z=25 млн Это ядро: R=0, 01 мм, m=1 т 29
А сколько может быть элементов? n n Ю. С. Черкинский – не может быть больше 10 миллиардов Существующий элемент – время «жизни» больше того промежутка, за который бомбардирующая частица пролетит сквозь ядро Устойчивость определяется соотношением протонов и нейтронов: для возможного десятимиллиардного – N/Z=25 млн Это ядро: R=0, 01 мм, m=1 т 29
 Какие ближайшие устойчивы? № 126: 126 протонов и 184 нейтрона, элемент восьмого периода, тяжелый, трехвалентный металл, похожий на актиний n № 184 – возможно, также устойчив НО! n Существует мнение, что при числе протонов 170 -180 электроны первого слоя поглотятся ядром, уменьшив его заряд, следовательно, больше № 180 невозможно… 30
Какие ближайшие устойчивы? № 126: 126 протонов и 184 нейтрона, элемент восьмого периода, тяжелый, трехвалентный металл, похожий на актиний n № 184 – возможно, также устойчив НО! n Существует мнение, что при числе протонов 170 -180 электроны первого слоя поглотятся ядром, уменьшив его заряд, следовательно, больше № 180 невозможно… 30
 Каким будет восьмой период? Сверхбольшой – 50 элементов; кроме s-, p-, d-, f- подуровней, появится g-подуровень, содержащий 18 элементов (октадеканиды) n Сходство свойств у октадеканидов должно быть больше, чем у лантаноидов и актиноидов n Вероятно – аналоги актиния n № 126 должен войти в семейство октадеканидов, вероятная электронная формула n n Девятый период должен также содержать октадеканиды, по аналогии с лантаноидами и актиноидами 31
Каким будет восьмой период? Сверхбольшой – 50 элементов; кроме s-, p-, d-, f- подуровней, появится g-подуровень, содержащий 18 элементов (октадеканиды) n Сходство свойств у октадеканидов должно быть больше, чем у лантаноидов и актиноидов n Вероятно – аналоги актиния n № 126 должен войти в семейство октадеканидов, вероятная электронная формула n n Девятый период должен также содержать октадеканиды, по аналогии с лантаноидами и актиноидами 31
 Что дает ядерный синтез? n n n Возможно ли существование ядер со сверхизбыточным числом нейтронов? Возможно: в г Серпухов получен Пример, уже известный – изотопы водорода Полученные ранее элементы используются в качестве мишеней для получения сверхтяжелых ядер Установлено, что вспышки сверхновых – появление изотопов калифорния… 32
Что дает ядерный синтез? n n n Возможно ли существование ядер со сверхизбыточным числом нейтронов? Возможно: в г Серпухов получен Пример, уже известный – изотопы водорода Полученные ранее элементы используются в качестве мишеней для получения сверхтяжелых ядер Установлено, что вспышки сверхновых – появление изотопов калифорния… 32
 А что, если…? ? ? Академик В. И. Гольданский вычислил, что если элементов будет 10 млрд, то: n ПС будет содержать 3910 периодов n Последний будет содержать 7 659 698 элементов, 8000 элементов-близнецов n В семействе благородных газов – несколько жидких, остальные твердые n 3910 период начнется газообразным «щелочным металлом» , закончится – твердым «благородным газом» 33
А что, если…? ? ? Академик В. И. Гольданский вычислил, что если элементов будет 10 млрд, то: n ПС будет содержать 3910 периодов n Последний будет содержать 7 659 698 элементов, 8000 элементов-близнецов n В семействе благородных газов – несколько жидких, остальные твердые n 3910 период начнется газообразным «щелочным металлом» , закончится – твердым «благородным газом» 33
 Спасибо за внимание! Не проспите новые открытия! 34
Спасибо за внимание! Не проспите новые открытия! 34


