Металлические элементы 3 -А группы



















 Металлические элементы 3 -А группы
Металлические элементы 3 -А группы
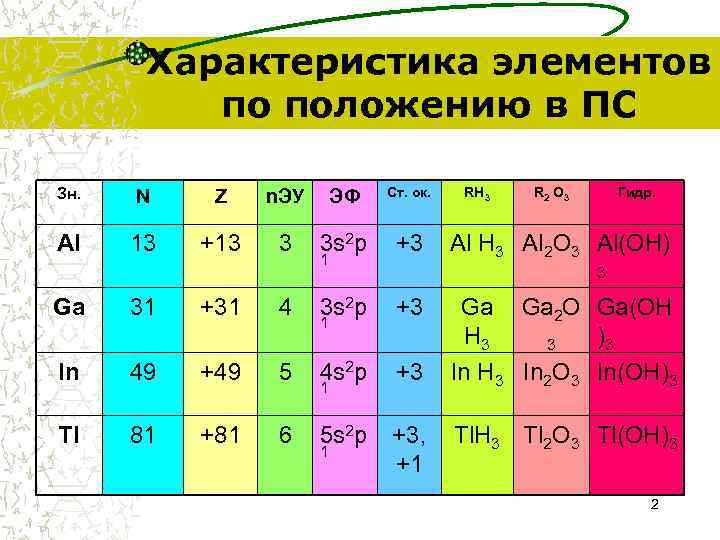
 Характеристика элементов по положению в ПС Зн. N Z n. ЭУ ЭФ Ст. ок. RH 3 R 2 O 3 Гидр. Al 13 +13 3 3 s 2 p +3 Al Н 3 Al 2 O 3 Al(ОН) 1 3 Ga 31 +31 4 3 s 2 p +3 Ga Ga 2 O Ga(ОН 1 Н 3 3 )3 In 49 +49 5 4 s 2 p +3 In Н 3 In 2 O 3 In(ОН)3 1 Tl 81 +81 6 5 s 2 p +3, Tl. Н 3 Tl 2 O 3 Tl(ОН)3 1 +1 2
Характеристика элементов по положению в ПС Зн. N Z n. ЭУ ЭФ Ст. ок. RH 3 R 2 O 3 Гидр. Al 13 +13 3 3 s 2 p +3 Al Н 3 Al 2 O 3 Al(ОН) 1 3 Ga 31 +31 4 3 s 2 p +3 Ga Ga 2 O Ga(ОН 1 Н 3 3 )3 In 49 +49 5 4 s 2 p +3 In Н 3 In 2 O 3 In(ОН)3 1 Tl 81 +81 6 5 s 2 p +3, Tl. Н 3 Tl 2 O 3 Tl(ОН)3 1 +1 2
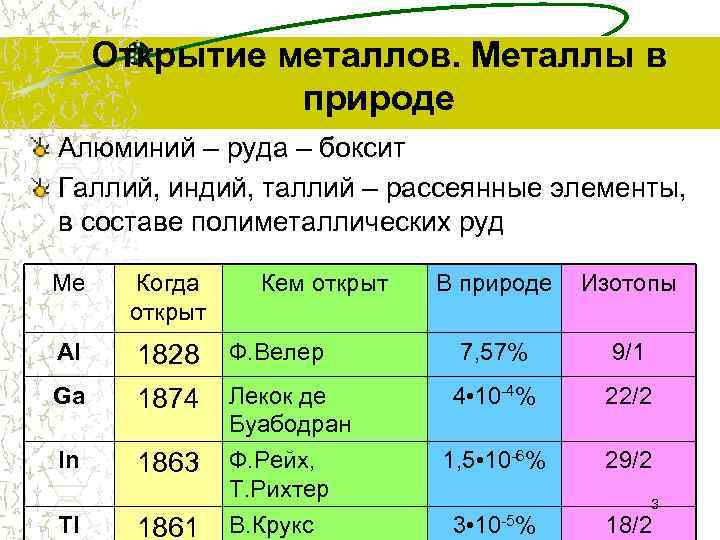
 Открытие металлов. Металлы в природе Алюминий – руда – боксит Галлий, индий, таллий – рассеянные элементы, в составе полиметаллических руд Ме Когда Кем открыт В природе Изотопы открыт Al 1828 Ф. Велер 7, 57% 9/1 Ga 1874 Лекок де 4 • 10 -4% 22/2 Буабодран In 1863 Ф. Рейх, 1, 5 • 10 -6% 29/2 Т. Рихтер 3 Tl 1861 В. Крукс 3 • 10 -5% 18/2
Открытие металлов. Металлы в природе Алюминий – руда – боксит Галлий, индий, таллий – рассеянные элементы, в составе полиметаллических руд Ме Когда Кем открыт В природе Изотопы открыт Al 1828 Ф. Велер 7, 57% 9/1 Ga 1874 Лекок де 4 • 10 -4% 22/2 Буабодран In 1863 Ф. Рейх, 1, 5 • 10 -6% 29/2 Т. Рихтер 3 Tl 1861 В. Крукс 3 • 10 -5% 18/2
 Получение металлов Al – электролиз расплава оксида с добавлением криолита Na 3[Al. F 6] Ga, In, Tl - рассеянные элементы, для выделения используют пирометаллургические, гидрометаллургические и электролитические методы 4
Получение металлов Al – электролиз расплава оксида с добавлением криолита Na 3[Al. F 6] Ga, In, Tl - рассеянные элементы, для выделения используют пирометаллургические, гидрометаллургические и электролитические методы 4
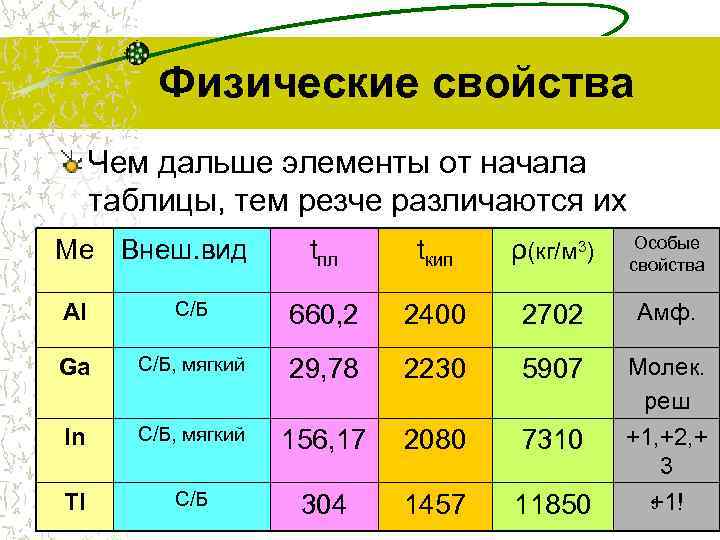
 Физические свойства Чем дальше элементы от начала таблицы, тем резче различаются их свойства… Ме Внеш. вид t t ρ(кг/м 3) Особые пл кип свойства Al С/Б 660, 2 2400 2702 Амф. Ga С/Б, мягкий 29, 78 2230 5907 Молек. реш In С/Б, мягкий 156, 17 2080 7310 +1, +2, + 3 Tl С/Б 304 1457 11850 +1! 5
Физические свойства Чем дальше элементы от начала таблицы, тем резче различаются их свойства… Ме Внеш. вид t t ρ(кг/м 3) Особые пл кип свойства Al С/Б 660, 2 2400 2702 Амф. Ga С/Б, мягкий 29, 78 2230 5907 Молек. реш In С/Б, мягкий 156, 17 2080 7310 +1, +2, + 3 Tl С/Б 304 1457 11850 +1! 5
 Характеристика химических свойств элементов и их соединений Алюминий Галлий Индий Таллий
Характеристика химических свойств элементов и их соединений Алюминий Галлий Индий Таллий
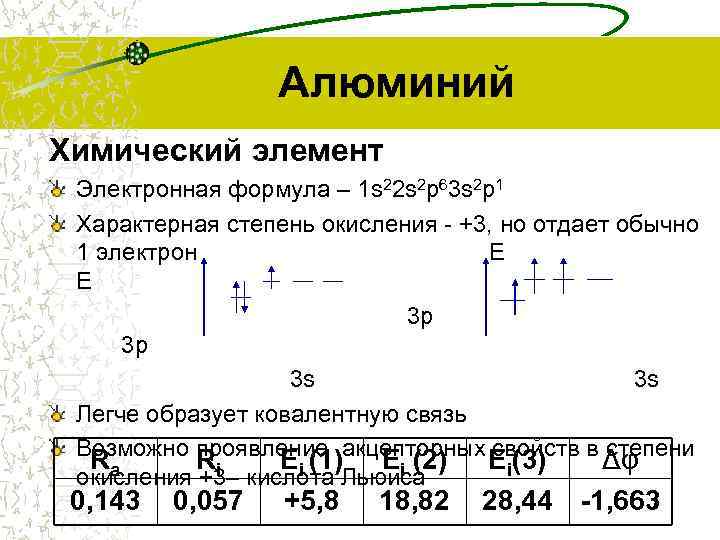
 Алюминий Химический элемент Электронная формула – 1 s 22 s 2 p 63 s 2 p 1 Характерная степень окисления - +3, но отдает обычно 1 электрон E E 3 p 3 p 3 s Легче образует ковалентную связь Возможно проявление акцепторных свойств в степени Ra Ri Ei (1) Ei (2) Ei(3) Δφ окисления +3– кислота Льюиса 0, 143 0, 057 +5, 8 18, 82 28, 44 -1, 663 7
Алюминий Химический элемент Электронная формула – 1 s 22 s 2 p 63 s 2 p 1 Характерная степень окисления - +3, но отдает обычно 1 электрон E E 3 p 3 p 3 s Легче образует ковалентную связь Возможно проявление акцепторных свойств в степени Ra Ri Ei (1) Ei (2) Ei(3) Δφ окисления +3– кислота Льюиса 0, 143 0, 057 +5, 8 18, 82 28, 44 -1, 663 7
 Алюминий Простое вещество 1. Взаимодействие с кислотами: 2 Al + 6 H+ = Al 3+ + 3 H 2 2. Взаимодействие с водой: 2 Al + 6 H 2 О = 2 Al(ОН)3 + 3 H 2 3. Взаимодействие с кислородом: 4 Al + 3 О 2 = 2 Al 2 О 3; ΔН = -1676 к. Дж/моль, tпл = 20500 С 4. Взаимодействие с галогенами: 2 Al +3 Gal 2 = 2 Al. Gal 3 5. Взаимодействие с оксидами металлов: 2 Al +Fe 2 O 3 = 2 Fe + Al 2 O 3 8
Алюминий Простое вещество 1. Взаимодействие с кислотами: 2 Al + 6 H+ = Al 3+ + 3 H 2 2. Взаимодействие с водой: 2 Al + 6 H 2 О = 2 Al(ОН)3 + 3 H 2 3. Взаимодействие с кислородом: 4 Al + 3 О 2 = 2 Al 2 О 3; ΔН = -1676 к. Дж/моль, tпл = 20500 С 4. Взаимодействие с галогенами: 2 Al +3 Gal 2 = 2 Al. Gal 3 5. Взаимодействие с оксидами металлов: 2 Al +Fe 2 O 3 = 2 Fe + Al 2 O 3 8
 Оксид алюминия Al 2 O 3 – типичный амфотерный оксид С кислотами образует соли: Al 2 О 3 + 6 H+ = 2 Al 3+ + 3 H 2 О, в растворе – [Al(H 2 О)3 ]3+ С растворами щелочей образует комплексные соединения: Al 2 О 3 + 2 Na. OH + 7 H 2 О = 2 Na[Al(OH)4 (H 2 О)2 ] При сплавлении со щелочами образует безводные метаалюминаты: Al 2 О 3 + 2 Na. OH = 2 Na. Al. О 2 Взаимодействует с кислотными и основными оксидами с образованием солей: Al 2 О 3 + 3 N 2 O 5 = 2 Al(NO 3)3 ; Al 2 О 3 + Сa. O = Сa(Al. О)2 Взаимодействует с солями, растворы которых имеют кислую или 9 щелочную среду:
Оксид алюминия Al 2 O 3 – типичный амфотерный оксид С кислотами образует соли: Al 2 О 3 + 6 H+ = 2 Al 3+ + 3 H 2 О, в растворе – [Al(H 2 О)3 ]3+ С растворами щелочей образует комплексные соединения: Al 2 О 3 + 2 Na. OH + 7 H 2 О = 2 Na[Al(OH)4 (H 2 О)2 ] При сплавлении со щелочами образует безводные метаалюминаты: Al 2 О 3 + 2 Na. OH = 2 Na. Al. О 2 Взаимодействует с кислотными и основными оксидами с образованием солей: Al 2 О 3 + 3 N 2 O 5 = 2 Al(NO 3)3 ; Al 2 О 3 + Сa. O = Сa(Al. О)2 Взаимодействует с солями, растворы которых имеют кислую или 9 щелочную среду:
 Гидроксид алюминия Типичный амфотерный гидроксид С кислотами образует соли: Al(ОН)3 + 3 H+ = [Al(H 2 О)3 ]3+ С растворами щелочей образует соли: Al(ОН)3 + 3 Na. OH = Na 3[Al(OH)6 ] Термически неустойчив: Al(ОН)3 = Al. О(ОН) + Н 2 О – метагироксид, t = 2000 С 2 Al. О(ОН) = Al 2 О 3 + Н 2 О, t = 4000 С При сплавлении со щелочами образуются соли орто- и метаалюминиевых кислот: Al(ОН)3 + КОН = К Al. О 2 + 2 Н 2 О 10
Гидроксид алюминия Типичный амфотерный гидроксид С кислотами образует соли: Al(ОН)3 + 3 H+ = [Al(H 2 О)3 ]3+ С растворами щелочей образует соли: Al(ОН)3 + 3 Na. OH = Na 3[Al(OH)6 ] Термически неустойчив: Al(ОН)3 = Al. О(ОН) + Н 2 О – метагироксид, t = 2000 С 2 Al. О(ОН) = Al 2 О 3 + Н 2 О, t = 4000 С При сплавлении со щелочами образуются соли орто- и метаалюминиевых кислот: Al(ОН)3 + КОН = К Al. О 2 + 2 Н 2 О 10
 Соли алюминия Галогениды – белые кристаллические, хорошо растворимы в воде, гидролизуются по катиону, Al. Cl 3 – промышленный катализатор Сульфат алюминия - Al 2(SО 4)3 • 18 Н 2 О – бесцветное кристаллическое вещечство, хорошо растворим, используется для протравки тканей перед крашением и для удаления из воды взвешенных примесей (коагулянт) 11 Природные алюмосиликаты – драгоценные
Соли алюминия Галогениды – белые кристаллические, хорошо растворимы в воде, гидролизуются по катиону, Al. Cl 3 – промышленный катализатор Сульфат алюминия - Al 2(SО 4)3 • 18 Н 2 О – бесцветное кристаллическое вещечство, хорошо растворим, используется для протравки тканей перед крашением и для удаления из воды взвешенных примесей (коагулянт) 11 Природные алюмосиликаты – драгоценные
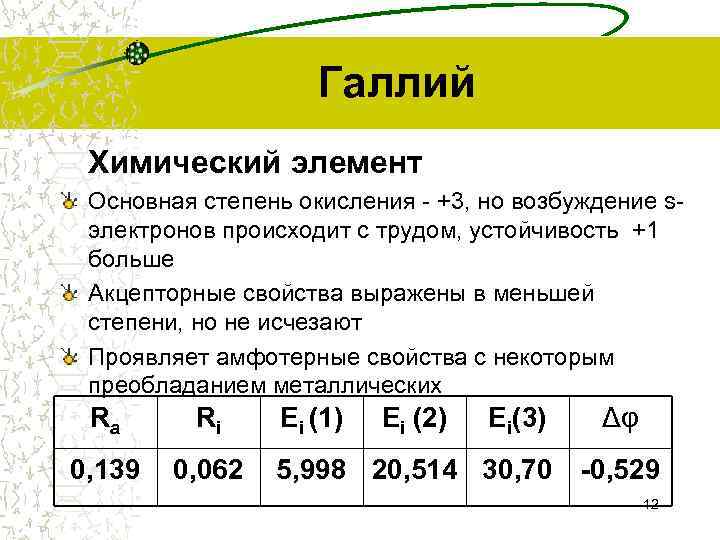
 Галлий Химический элемент Основная степень окисления - +3, но возбуждение s- электронов происходит с трудом, устойчивость +1 больше Акцепторные свойства выражены в меньшей степени, но не исчезают Проявляет амфотерные свойства с некоторым преобладанием металлических Ra Ri Ei (1) Ei (2) Ei(3) Δφ 0, 139 0, 062 5, 998 20, 514 30, 70 -0, 529 12
Галлий Химический элемент Основная степень окисления - +3, но возбуждение s- электронов происходит с трудом, устойчивость +1 больше Акцепторные свойства выражены в меньшей степени, но не исчезают Проявляет амфотерные свойства с некоторым преобладанием металлических Ra Ri Ei (1) Ei (2) Ei(3) Δφ 0, 139 0, 062 5, 998 20, 514 30, 70 -0, 529 12
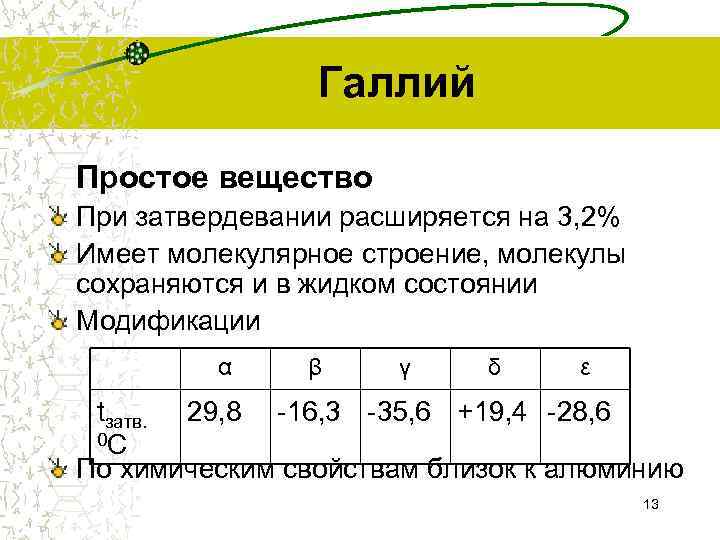
 Галлий Простое вещество При затвердевании расширяется на 3, 2% Имеет молекулярное строение, молекулы сохраняются и в жидком состоянии Модификации α β γ δ ε tзатв. 29, 8 -16, 3 -35, 6 +19, 4 -28, 6 0 С По химическим свойствам близок к алюминию 13
Галлий Простое вещество При затвердевании расширяется на 3, 2% Имеет молекулярное строение, молекулы сохраняются и в жидком состоянии Модификации α β γ δ ε tзатв. 29, 8 -16, 3 -35, 6 +19, 4 -28, 6 0 С По химическим свойствам близок к алюминию 13
 Оксиды галлия Ga 2 O 3 – типичный амфотерный оксид, по свойствам аналогичен оксиду алюминия (К. Ч. =4), получается непосредственным взаимодействием с кислородом, образует пленку на поверхности металла Ga 2 O – темно-коричневый, почти черный: Ga 2 O 3 + 4 Ga = 3 Ga 2 O Сильный восстановитель: 2 Ga 2 O + 7 H 2 SO 4 = 2 Ga 2(SO 4)3 + H 2 S +146
Оксиды галлия Ga 2 O 3 – типичный амфотерный оксид, по свойствам аналогичен оксиду алюминия (К. Ч. =4), получается непосредственным взаимодействием с кислородом, образует пленку на поверхности металла Ga 2 O – темно-коричневый, почти черный: Ga 2 O 3 + 4 Ga = 3 Ga 2 O Сильный восстановитель: 2 Ga 2 O + 7 H 2 SO 4 = 2 Ga 2(SO 4)3 + H 2 S +146
 Гидроксид галлия Ga(OН)3 – идеально амфотерен, осадок белого цвета, аналог гидроксида алюминия При взаимодействии с растворами щелочей образует галлаты (координационные соединения), причем осадок должен быть свежим, координационное число равно 4 Может быть получен взаимодействием оксида с водой 15
Гидроксид галлия Ga(OН)3 – идеально амфотерен, осадок белого цвета, аналог гидроксида алюминия При взаимодействии с растворами щелочей образует галлаты (координационные соединения), причем осадок должен быть свежим, координационное число равно 4 Может быть получен взаимодействием оксида с водой 15
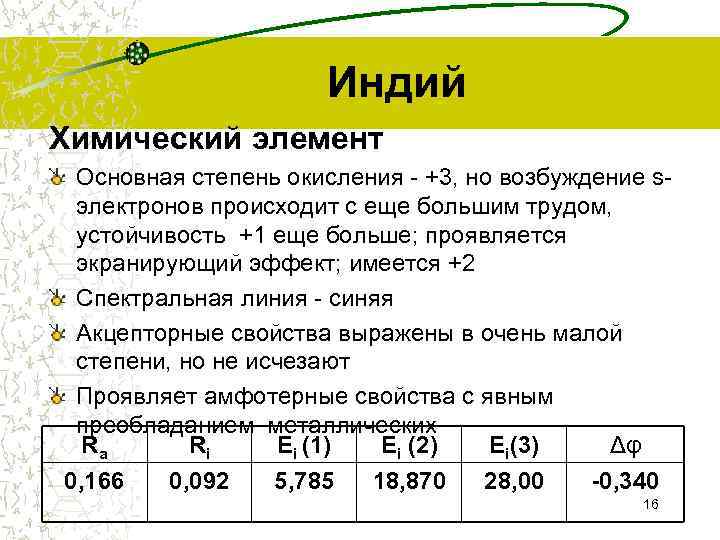
 Индий Химический элемент Основная степень окисления - +3, но возбуждение s- электронов происходит с еще большим трудом, устойчивость +1 еще больше; проявляется экранирующий эффект; имеется +2 Спектральная линия - синяя Акцепторные свойства выражены в очень малой степени, но не исчезают Проявляет амфотерные свойства с явным преобладанием металлических Ra Ri Ei (1) Ei (2) Ei(3) Δφ 0, 166 0, 092 5, 785 18, 870 28, 00 -0, 340 16
Индий Химический элемент Основная степень окисления - +3, но возбуждение s- электронов происходит с еще большим трудом, устойчивость +1 еще больше; проявляется экранирующий эффект; имеется +2 Спектральная линия - синяя Акцепторные свойства выражены в очень малой степени, но не исчезают Проявляет амфотерные свойства с явным преобладанием металлических Ra Ri Ei (1) Ei (2) Ei(3) Δφ 0, 166 0, 092 5, 785 18, 870 28, 00 -0, 340 16
 Индий Простое вещество 1. Неординарное сочетание мягкости, прочности и хрупкости: в 20 раз пластичнее золота как графит, оставляет черную черту на бумаге при ударе может разрушаться, прочность на разрыв в 6 раз меньше, чем у свинца 2. По химическим свойствам – металл, расположен в РАМ между железом и оловом, взаимодействует с кислотами: 2 In + 6 HCl =2 In. Cl 3 + 3 H 2 3. Со щелочами образует индаты – Ме 3[In(OH)6] • 2 H 2 O 4. С кислородом и неметаллами взаимодействует при 17 +3
Индий Простое вещество 1. Неординарное сочетание мягкости, прочности и хрупкости: в 20 раз пластичнее золота как графит, оставляет черную черту на бумаге при ударе может разрушаться, прочность на разрыв в 6 раз меньше, чем у свинца 2. По химическим свойствам – металл, расположен в РАМ между железом и оловом, взаимодействует с кислотами: 2 In + 6 HCl =2 In. Cl 3 + 3 H 2 3. Со щелочами образует индаты – Ме 3[In(OH)6] • 2 H 2 O 4. С кислородом и неметаллами взаимодействует при 17 +3
 Оксиды индия Трем степеням окисления соответствуют три оксида: In 2 О 3 , In. О, In 2 О 3: 4 In + 3 О 2 = 2 In 2 О 3; ΔН = -928 к. Дж/моль вещество желтого цвета, при 8500 С переходит в In 3 О 4 In. О – в твердом состоянии не обнаружен, не изучен, получается в 18 парáх: In О = In. О + О
Оксиды индия Трем степеням окисления соответствуют три оксида: In 2 О 3 , In. О, In 2 О 3: 4 In + 3 О 2 = 2 In 2 О 3; ΔН = -928 к. Дж/моль вещество желтого цвета, при 8500 С переходит в In 3 О 4 In. О – в твердом состоянии не обнаружен, не изучен, получается в 18 парáх: In О = In. О + О
 Гидроксид индия In(ОН)3 По внешнему виду похож на гидроксид алюминия Обладает амфотерными свойствами, но в кислотах растворяется легче, в щелочах – при высоких концентрациях и нагревании При нагревании разлагается с образованием оксида 19
Гидроксид индия In(ОН)3 По внешнему виду похож на гидроксид алюминия Обладает амфотерными свойствами, но в кислотах растворяется легче, в щелочах – при высоких концентрациях и нагревании При нагревании разлагается с образованием оксида 19
 Соединения индия Используются редко, только в лабораторной практике Ионы индия – In 3+ - бесцветны, в растворах гидратированы (К. Ч. =6) Соли подвергаются гидролизу по катиону Наиболее интересны: 1. Нитрат – In(NO 3)3 – при нагревании разлагается с образованием оксида, возгоняется 2. Хлорид – In. Cl 3 – возгоняется без разложения 3. Сульфат – In 2(SO 4)3 – образует 20 кристаллогидраты – квасцы со щелочными
Соединения индия Используются редко, только в лабораторной практике Ионы индия – In 3+ - бесцветны, в растворах гидратированы (К. Ч. =6) Соли подвергаются гидролизу по катиону Наиболее интересны: 1. Нитрат – In(NO 3)3 – при нагревании разлагается с образованием оксида, возгоняется 2. Хлорид – In. Cl 3 – возгоняется без разложения 3. Сульфат – In 2(SO 4)3 – образует 20 кристаллогидраты – квасцы со щелочными
 Таллий Химический элемент Основная степень окисления - +1, но имеется и +3 причина – сильное не только d- но и f- сжатие Акцепторные свойства. Eприсутствуют, к. ч. Ra Ri Ei (1) i (2) Ei(3) Δφ =6, 7, 8 0, 166 Проявляет металлические свойства -0, 340 0, 136 6, 108 20, 428 29, 80 0, 105 21
Таллий Химический элемент Основная степень окисления - +1, но имеется и +3 причина – сильное не только d- но и f- сжатие Акцепторные свойства. Eприсутствуют, к. ч. Ra Ri Ei (1) i (2) Ei(3) Δφ =6, 7, 8 0, 166 Проявляет металлические свойства -0, 340 0, 136 6, 108 20, 428 29, 80 0, 105 21
 Таллий Простое вещество 1. Белый металл с голубоватым оттенком: 2. По химическим свойствам – металл, расположен в РАМ до водорода, сравним со щелочными металлами: взаимодействует с водой: Tl + H 2 O + O = Tl. OH вытесняет водород из спиртов: Tl +C 2 H 5 OH + O = C 2 H 5 OTl + H 2 O взаимодействует с кислотами (кроме соляной, хлорид не растворим) 3. Со щелочами не взаимодействует 4. С кислородом и неметаллами взаимодействует при 22 нагревании с образованием соединений In +1
Таллий Простое вещество 1. Белый металл с голубоватым оттенком: 2. По химическим свойствам – металл, расположен в РАМ до водорода, сравним со щелочными металлами: взаимодействует с водой: Tl + H 2 O + O = Tl. OH вытесняет водород из спиртов: Tl +C 2 H 5 OH + O = C 2 H 5 OTl + H 2 O взаимодействует с кислотами (кроме соляной, хлорид не растворим) 3. Со щелочами не взаимодействует 4. С кислородом и неметаллами взаимодействует при 22 нагревании с образованием соединений In +1
 Оксиды и гидроксиды таллия Оксиды 1. Tl 2 O – вещество черного цвета, основный оксид 2. Tl 2 O 3 – вещество бурого цвета, основный оксид 3. Tl 3 O 4 – промежуточный оксид Tl 2 O + О 2 Tl 2 O 3 Гидроксиды Tl. OН – аналогичен гидроксидам щелочных металлов; вещество желтого цвета, устойчив, раствор поглощает СО 2 Tl(OН)3 – неустойчив, осадок бурого цвета, основание Из соединений интересны галогениды – образуют 23 комплексы между собой: 3 Tl. Cl = Tl[Tl. Cl ]+Cl
Оксиды и гидроксиды таллия Оксиды 1. Tl 2 O – вещество черного цвета, основный оксид 2. Tl 2 O 3 – вещество бурого цвета, основный оксид 3. Tl 3 O 4 – промежуточный оксид Tl 2 O + О 2 Tl 2 O 3 Гидроксиды Tl. OН – аналогичен гидроксидам щелочных металлов; вещество желтого цвета, устойчив, раствор поглощает СО 2 Tl(OН)3 – неустойчив, осадок бурого цвета, основание Из соединений интересны галогениды – образуют 23 комплексы между собой: 3 Tl. Cl = Tl[Tl. Cl ]+Cl
 Применение 1. Алюминий – сплавы, электротехника 2. Галлий – полупроводники, оптика 3. Индий – полупроводники, легкоплавкие сплавы, отражатели, атомная энергетика 4. Таллий – яды-зооциды, оптика, низкотемпературные сплавы, кислотоустойчивые сплавы 24
Применение 1. Алюминий – сплавы, электротехника 2. Галлий – полупроводники, оптика 3. Индий – полупроводники, легкоплавкие сплавы, отражатели, атомная энергетика 4. Таллий – яды-зооциды, оптика, низкотемпературные сплавы, кислотоустойчивые сплавы 24
 Спасибо за внимание! 25
Спасибо за внимание! 25

