Метали 13.ppt
- Количество слайдов: 28
 Метали
Метали
 План 1. Положення металічних елементів у періодичній системі 2. Особливості будови атомів металічних елементів 3. Металічний зв’язок 4. Кристалічні ґратки металів 5. Загальні фізичні властивості металів 6. Хронологія відкриття хімічних єлементів 7. Метали в природі.
План 1. Положення металічних елементів у періодичній системі 2. Особливості будови атомів металічних елементів 3. Металічний зв’язок 4. Кристалічні ґратки металів 5. Загальні фізичні властивості металів 6. Хронологія відкриття хімічних єлементів 7. Метали в природі.
 1. Розташування металічних елементів у Періодичній системі Д. І. Менделєєва
1. Розташування металічних елементів у Періодичній системі Д. І. Менделєєва
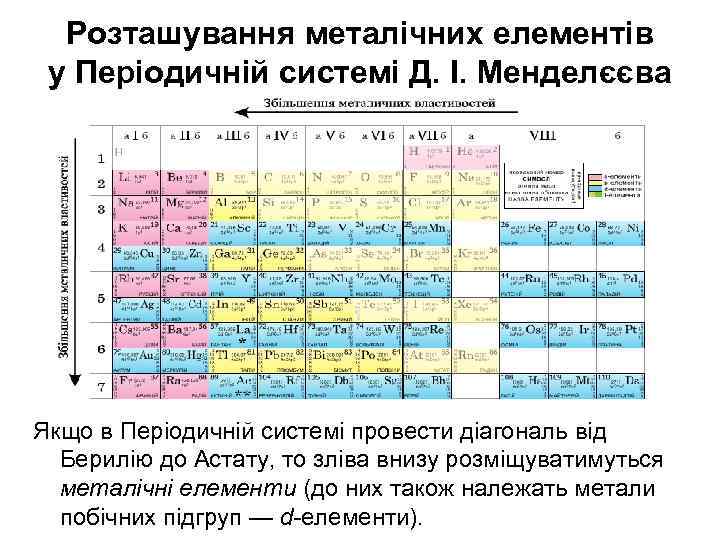 Розташування металічних елементів у Періодичній системі Д. І. Менделєєва Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться металічні елементи (до них також належать метали побічних підгруп — d-елементи).
Розташування металічних елементів у Періодичній системі Д. І. Менделєєва Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться металічні елементи (до них також належать метали побічних підгруп — d-елементи).
 Лужні елементи Літій, Натрій, Калій, Рубідій, Цезій і Францій утворюють головну підгрупу першої групи Періодичної системи елементів. Усі періоди (за винятком першого) починаються з лужних елементів. На зовнішньому електронному шарі атомів лужних елементів міститься один валентний електрон, тому лужні елементи — сильні відновники: всі вони легко окиснюються, вступаючи в реакції з киснем, галогенами і з сіркою та ін.
Лужні елементи Літій, Натрій, Калій, Рубідій, Цезій і Францій утворюють головну підгрупу першої групи Періодичної системи елементів. Усі періоди (за винятком першого) починаються з лужних елементів. На зовнішньому електронному шарі атомів лужних елементів міститься один валентний електрон, тому лужні елементи — сильні відновники: всі вони легко окиснюються, вступаючи в реакції з киснем, галогенами і з сіркою та ін.
 Лужноземельні елементи Елементи Кальцій, Стронцій, Барій називаються лужноземельними елементами. Назва виникла за часів алхімії і пояснюється тим, що оксиди цих металів ( «землі» алхіміків) проявляють у водних розчинах лужні властивості.
Лужноземельні елементи Елементи Кальцій, Стронцій, Барій називаються лужноземельними елементами. Назва виникла за часів алхімії і пояснюється тим, що оксиди цих металів ( «землі» алхіміків) проявляють у водних розчинах лужні властивості.
 Розташування металічних елементів у Періодичній системі Д. І. Менделєєва Перехідні метали виділяють на підставі незавершеності внутрішніх електронних оболонок їх атомів. Термін «перехідні» пов'язаний з тим, що в періодах ці елементи розташовуються між s- та р-елементами. Перехідні метали, у свою чергу, підрозділяють на d-елементи, у яких відбувається заповнення 3 d-, 4 d-, 5 d- і 6 d-підоболонок, і f-елементи, у яких заповнюється 4 f- (лантаноїди) або 5 fпідоболонка (актиноїди). Таким чином більшість елементів в Періодичній системі — металічні елементи.
Розташування металічних елементів у Періодичній системі Д. І. Менделєєва Перехідні метали виділяють на підставі незавершеності внутрішніх електронних оболонок їх атомів. Термін «перехідні» пов'язаний з тим, що в періодах ці елементи розташовуються між s- та р-елементами. Перехідні метали, у свою чергу, підрозділяють на d-елементи, у яких відбувається заповнення 3 d-, 4 d-, 5 d- і 6 d-підоболонок, і f-елементи, у яких заповнюється 4 f- (лантаноїди) або 5 fпідоболонка (актиноїди). Таким чином більшість елементів в Періодичній системі — металічні елементи.
 2. Особливості будови атомів металічних елементів Металічні властивості Атоми металів порівняно легко віддають електрони, перетворюючись на позитивно заряджені йони. Це пояснюється тим, що в атомів металів: — мале число електронів на зовнішньому енергетичному рівні та є вільні валентні орбіталі (лужні, лужноземельні метали, метали III групи); — електрони розміщуються відносно далеко від ядра (Полоній, Бісмут, Стибій).
2. Особливості будови атомів металічних елементів Металічні властивості Атоми металів порівняно легко віддають електрони, перетворюючись на позитивно заряджені йони. Це пояснюється тим, що в атомів металів: — мале число електронів на зовнішньому енергетичному рівні та є вільні валентні орбіталі (лужні, лужноземельні метали, метали III групи); — електрони розміщуються відносно далеко від ядра (Полоній, Бісмут, Стибій).
 3. Металічний зв’язок У простих речовинах — металах та їх сплавах існує особливий вид зв’язку — металічний. При утворенні металічного зв’язку атоми металів зближуються і їх валентні орбіталі перекриваються. Як наслідок, електрони зовнішніх рівнів вільно переходять від одного атома до іншого, переміщуючись по всьому зразку металу (утворюючи так званий «електронний газ» ). Зв’язок, який утворюється внаслідок взаємодії відносно вільних електронів з йонами металів, називають металічним зв’язком.
3. Металічний зв’язок У простих речовинах — металах та їх сплавах існує особливий вид зв’язку — металічний. При утворенні металічного зв’язку атоми металів зближуються і їх валентні орбіталі перекриваються. Як наслідок, електрони зовнішніх рівнів вільно переходять від одного атома до іншого, переміщуючись по всьому зразку металу (утворюючи так званий «електронний газ» ). Зв’язок, який утворюється внаслідок взаємодії відносно вільних електронів з йонами металів, називають металічним зв’язком.
 Металічний хімічний зв’язок Вузли
Металічний хімічний зв’язок Вузли
 4. Кристалічні ґратки металів Атоми металічних елементів перетворюються в позитивно заряджені йони — катіони. Катіони металічних елементів і їхні атоми розташовані в певному порядку і складають вузли металічних кристалічних ґраток. Між ними постійно рухаються електрони. За рахунок електростатичного притягання між йонами та електронами забезпечується певна стабільність кристалічних граток металів.
4. Кристалічні ґратки металів Атоми металічних елементів перетворюються в позитивно заряджені йони — катіони. Катіони металічних елементів і їхні атоми розташовані в певному порядку і складають вузли металічних кристалічних ґраток. Між ними постійно рухаються електрони. За рахунок електростатичного притягання між йонами та електронами забезпечується певна стабільність кристалічних граток металів.
 Кристалічні ґратки металів Основні типи кристалічних граток металів: а – кубічна об’ємноцентрована; б – кубічна гранецентрована; в – гексагональна.
Кристалічні ґратки металів Основні типи кристалічних граток металів: а – кубічна об’ємноцентрована; б – кубічна гранецентрована; в – гексагональна.
 Металічні кристалічні ґратки Гранецентричні кристалічні ґратки міді • Об’ємоцентричні кристалічні ґратки заліза
Металічні кристалічні ґратки Гранецентричні кристалічні ґратки міді • Об’ємоцентричні кристалічні ґратки заліза
 5. Загальні фізичні властивості металів електропровідность металічний блиск теплопровідность Ме металічний дзвін температура кипіння твердість температура плавлення густина
5. Загальні фізичні властивості металів електропровідность металічний блиск теплопровідность Ме металічний дзвін температура кипіння твердість температура плавлення густина
 Фізичні властивості металів • Металічний блиск внаслідок розсіювання світла електронами. Найкраще відбивають світло індій In та срібло Ag; • Кристалічна будова, крім ртуті Hg та францію Fr; • Сріблясто-білий колір (Ag, Al, Ni) або сріблясто-сірий (Fe, Pb), за винятком золота Au та міді Cu. За забарвленням метали умовно поділяють на чорні й кольорові. • Тепло- й електропровідність, що зумовлена постійним рухом електронів у кристалі. Найбільшу електропровідність мають срібло і мідь. За ними - золото, алюміній, залізо. • Твердість металів порівнюють із твердістю алмазу. • Пластичність металів, їхня здатність необоротно деформуватися під дією механічних навантажень пояснюється можливістю переміщення (ковзання) одних шарів йонів металів відносно інших завдяки наявності “електронного газу” • Розчинність. Усі метали не розчинні у воді, але розчиняються один в одному у розплавах. • Густина. За густиною метали поділяють на легкі ρ < 5 г/см 3 і важкі ρ > 5 г/см 3
Фізичні властивості металів • Металічний блиск внаслідок розсіювання світла електронами. Найкраще відбивають світло індій In та срібло Ag; • Кристалічна будова, крім ртуті Hg та францію Fr; • Сріблясто-білий колір (Ag, Al, Ni) або сріблясто-сірий (Fe, Pb), за винятком золота Au та міді Cu. За забарвленням метали умовно поділяють на чорні й кольорові. • Тепло- й електропровідність, що зумовлена постійним рухом електронів у кристалі. Найбільшу електропровідність мають срібло і мідь. За ними - золото, алюміній, залізо. • Твердість металів порівнюють із твердістю алмазу. • Пластичність металів, їхня здатність необоротно деформуватися під дією механічних навантажень пояснюється можливістю переміщення (ковзання) одних шарів йонів металів відносно інших завдяки наявності “електронного газу” • Розчинність. Усі метали не розчинні у воді, але розчиняються один в одному у розплавах. • Густина. За густиною метали поділяють на легкі ρ < 5 г/см 3 і важкі ρ > 5 г/см 3
 Фізичні властивості металів Пластичність. Механічна дія на кристал із металічним зв’язком викликає зсув шарів атомів, але завдяки переміщенню валентних електронів по всьому зразку металу розриву зв’язків не відбувається. Найпластичніший метал — золото. Марганець і бісмут — крихкі метали. Металічний блиск, непрозорість. Вільні електрони взаємодіють із квантами світла, які падають на метал. Електропровідність. Вільні електрони під впливом різниці потенціалів набувають направленого руху від негативного полюса до позитивного. Найбільшу електричну провідність мають срібло і мідь. Теплопровідність. Зумовлена рухом вільних електронів. Найбільша теплопровідність у срібла й міді, найменша — у бісмуту та ртуті.
Фізичні властивості металів Пластичність. Механічна дія на кристал із металічним зв’язком викликає зсув шарів атомів, але завдяки переміщенню валентних електронів по всьому зразку металу розриву зв’язків не відбувається. Найпластичніший метал — золото. Марганець і бісмут — крихкі метали. Металічний блиск, непрозорість. Вільні електрони взаємодіють із квантами світла, які падають на метал. Електропровідність. Вільні електрони під впливом різниці потенціалів набувають направленого руху від негативного полюса до позитивного. Найбільшу електричну провідність мають срібло і мідь. Теплопровідність. Зумовлена рухом вільних електронів. Найбільша теплопровідність у срібла й міді, найменша — у бісмуту та ртуті.
 Фізичні властивості металів Густина, температури плавлення і кипіння, твердість металів різні. Метали з густиною, меншою за 5 г/см 3, називаються легкими, інші — важкими. Метали з температурою плавлення понад 1000 °С називаються тугоплавкими, нижче — легкоплавкими. Метали ковкі, що дозволяє надавати виробам з них потрібну форму і розкатувати в плоскі пластинки, пластичні, що дає можливість витягати тонкий дріт.
Фізичні властивості металів Густина, температури плавлення і кипіння, твердість металів різні. Метали з густиною, меншою за 5 г/см 3, називаються легкими, інші — важкими. Метали з температурою плавлення понад 1000 °С називаються тугоплавкими, нижче — легкоплавкими. Метали ковкі, що дозволяє надавати виробам з них потрібну форму і розкатувати в плоскі пластинки, пластичні, що дає можливість витягати тонкий дріт.
 6. Хронологія відкриття хімічних єлементів (за О. Є. Ферсманом) Стародавні N, Al, Fe, Au, K, Ca, O, Si, Cu, Na, Hg, Pb, Ag, 18 віки S, C, Cl, Zn елементів До XVIII ст. Крім того ще - As, Mg, Bi, Co, B, Ni, P 25 елементів XVIII ст. Крім того ще - H, Pb, Ir, J 29 елементів ХІХ ст. Крім того ще - Ba, Br, V, W, Cd, Mn, Mo, Os, 47 Pd, Ra, Sr, Ta, F, Th, U, Cr, Zr елементів ХХ ст. Крім того ще - Ne, Li, He, Ti, Ac, Ru, Rh 54 елементи ХХ ст. Крім того ще - Be, Ar, Cs, Ga, Se, Rb, Y, In, Nb, Te, Hf, Re, Tl 67 елементів
6. Хронологія відкриття хімічних єлементів (за О. Є. Ферсманом) Стародавні N, Al, Fe, Au, K, Ca, O, Si, Cu, Na, Hg, Pb, Ag, 18 віки S, C, Cl, Zn елементів До XVIII ст. Крім того ще - As, Mg, Bi, Co, B, Ni, P 25 елементів XVIII ст. Крім того ще - H, Pb, Ir, J 29 елементів ХІХ ст. Крім того ще - Ba, Br, V, W, Cd, Mn, Mo, Os, 47 Pd, Ra, Sr, Ta, F, Th, U, Cr, Zr елементів ХХ ст. Крім того ще - Ne, Li, He, Ti, Ac, Ru, Rh 54 елементи ХХ ст. Крім того ще - Be, Ar, Cs, Ga, Se, Rb, Y, In, Nb, Te, Hf, Re, Tl 67 елементів
 В середні віки були відомі тільки сім металів. Це число відносилось з числом відомих на той час планет.
В середні віки були відомі тільки сім металів. Це число відносилось з числом відомих на той час планет.

 7. Метали в природі У повітрі у вигляді часточок пилу Аl Са K Fe Na У воді у розчинених в ній солях Mg O Si У земній корі у самородному та зв’язаному вигляді
7. Метали в природі У повітрі у вигляді часточок пилу Аl Са K Fe Na У воді у розчинених в ній солях Mg O Si У земній корі у самородному та зв’язаному вигляді
 Перші метали, які люди почали використовувати Cu Аu Ag У самородному стані існує в природі платина, іноді - ртуть, олово Pt Активних металів на Землі немає. Їх добувають із природної сировини хімічним способом
Перші метали, які люди почали використовувати Cu Аu Ag У самородному стані існує в природі платина, іноді - ртуть, олово Pt Активних металів на Землі немає. Їх добувають із природної сировини хімічним способом
 Метали в природі У природі метали існують переважно у вигляді сполук: оксидів, сульфідів, сульфатів, хлоридів, карбонатів і т. д. У вільному стані в земній корі зустрічаються найменш активні метали — золото, платина. Мідь, ртуть, срібло, олово можуть траплятися як у саморідному стані, так і в складі сполук. Мінерали й гірські породи, що містять метали та їх сполуки та є придатними для промислового добування металів, називаються рудами. Деякі різновиди металічних руд: оксидні руди; сульфідні руди; хлоридні руди — Na. Cl; карбонатні руди.
Метали в природі У природі метали існують переважно у вигляді сполук: оксидів, сульфідів, сульфатів, хлоридів, карбонатів і т. д. У вільному стані в земній корі зустрічаються найменш активні метали — золото, платина. Мідь, ртуть, срібло, олово можуть траплятися як у саморідному стані, так і в складі сполук. Мінерали й гірські породи, що містять метали та їх сполуки та є придатними для промислового добування металів, називаються рудами. Деякі різновиди металічних руд: оксидні руди; сульфідні руди; хлоридні руди — Na. Cl; карбонатні руди.




 Домашнє завдання
Домашнє завдання


