4_bioenergetica_ru.ppt
- Количество слайдов: 107

МЕТАБОЛИЗМ. БИОЭНЕРГЕТИКА

Метаболизм (обмен веществ) совокупность превращений веществ, начиная с их поступления в организм до образования конечных продуктов (СО 2, Н 2 О и NH 3). • Внешний метаболизм (внеклеточный) – включает превращения веществ на путях их поступления и выделения из организма. • Промежуточный метаболизм (внутриклеточный).

Функции метаболизма • Обеспечение организма доступной энергией в виде макроэргических соединений. • Расщепление макромолекул на «строительные блоки» для синтеза необходимых организму веществ. • Синтез необходимых веществ (белков, углеводов, липидов, нуклеиновых кислот). • Синтез и расщепление специализированных биологически активных веществ (гормонов, биогенных аминов).

Метаболические пути • Метаболизм состоит из метаболических реакций и метаболических путей. • Метаболический путь – последовательность химических реакций, в ходе которых субстрат превращается в конечный продукт. • Каждая реакция метаболического пути катализируется отдельным ферментом.

Метаболические пути • Центральные – общие для синтеза и расщепления основных классов веществ (белков, углеводов, липидов). • Специфические – характерные для синтеза и расщепления индивидуального вещества (гормон, биогенный амин).

Метаболические пути • Линейные. Примеры: гликолиз, глюконеогенез. • Циклические. Примеры: цикл Кребса, синтез мочевины. • Разветвленные. Примеры: синтез триглицеридов и фосфолипидов, синтез холестерола и кетоновых тел.

Фазы метаболизма • Катаболизм – расщепление сложных веществ до простых конечных продуктов (СО 2, Н 2 О и NH 3). Катаболические процессы сопровождаются выделением энергии (экзергонические процессы). • Анаболизм – синтез сложных веществ из простых веществ. В анаболических процессах используется энергия (эндергонические процессы).

Этапы катаболизма • I этап – расщепление полимеров до мономеров, протекает в ЖКТ, не сопровождается образованием полезной энергии. • II этап – расщепление мономеров до общего метаболита – ацетил-Со. А. Образуется ≈20% энергии. • III этап – расщепление ацетил-Со. А до конечных продуктов (СО 2 и Н 2 О). Включает цикл Кребса, дыхательную цепь и окислительное фосфорилирование. Образуется ≈80% энергии.
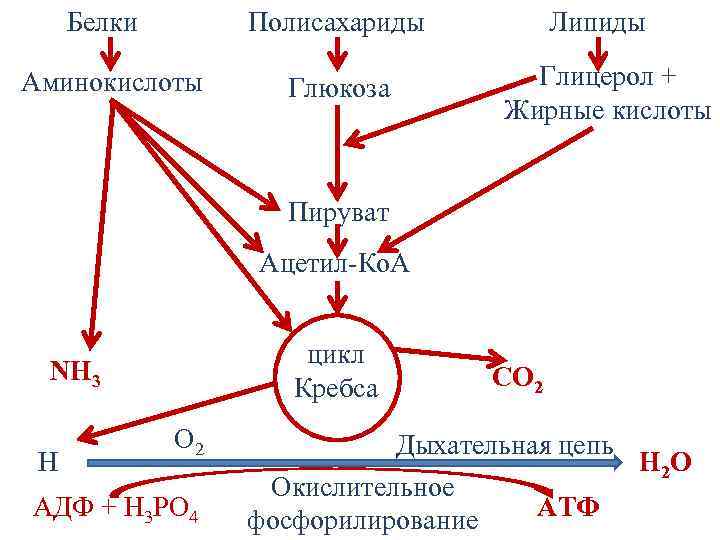
Белки Полисахариды Аминокислоты Глюкоза Липиды Глицерол + Жирные кислоты Пируват Ацетил-Ко. А цикл Кребса NH 3 H O 2 АДФ + Н 3 РО 4 СO 2 Дыхательная цепь H 2 O Окислительное АТФ фосфорилирование

Анаболизм протекает в обратном направлении катаболизму с определенными особенностями: Локализация Энергия Регуляция Катаболизм Анаболизм Митохондрии, Обычно лизосомы цитоплазма Выделение Использование Активаторы катаболизма обычно являются ингибиторами анаболизма и наоборот.

Законы термодинамики • I закон – закон сохранения энергии; общая энергия системы и окружающей среды – величина постоянная. • II закон – все процессы в системе стремятся к необратимому переходу полезной энергии в хаотическую форму.

Термодинамические системы • Биологические системы являются открытыми термодинамическими системами – обмениваются с внешней средой и материей, и энергией.

Свободная энергия • Каждая термодинамическая система обладает определенной внутренней энергией (∆Е), которая состоит из свободной и связанной энергии. • Свободная энергия (∆G) – та часть энергии системы, которая может быть использована для совершения работы при постоянной температуре и давлении.

Свободная энергия Связанная энергия (Т∆S) – та часть энергии системы, которая не может быть использована для совершения работы: • Т – абсолютная температура; • ∆S – энтропия. ∆Е = ∆G + Т∆S Стандартная свободная энергия – ∆G 0´ Стандартные условия: t = 25ºС; р. Н = 7; концентрация – 1 моль/л.

Свободная энергия Значение ∆G определяет направление химической реакции. 1. ∆G ˂ 0. Реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии – экзергонические реакции. 2. ∆G ˃ 0. Реакция нуждается в поступлении свободной энергии извне – эндергонические реакции. 3. ∆G = 0. Реакция находится в состоянии равновесия.
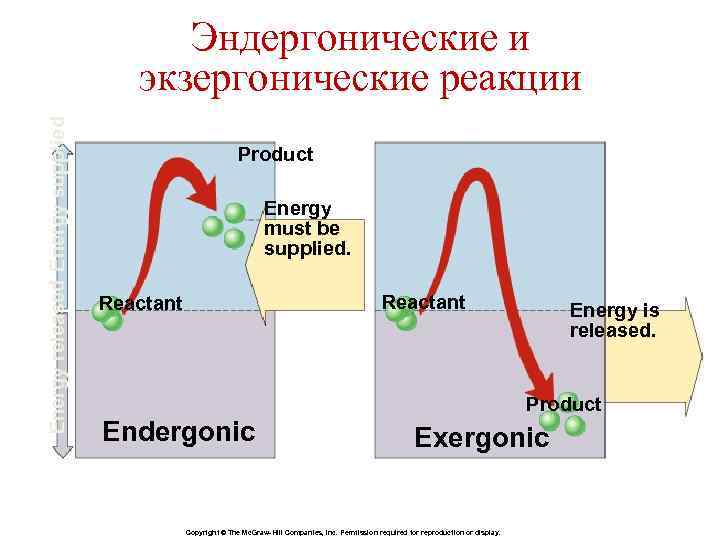
Energy released Energy supplied Эндергонические и экзергонические реакции Product Energy must be supplied. Reactant Energy is released. Product Endergonic Exergonic Copyright © The Mc. Graw-Hill Companies, Inc. Permission required for reproduction or display.

Макроэргические соединения химические соединения, содержащие химические связи, при расщеплении которых выделяется ≥ 5 ккал/моль энергии. Связи называются макроэргическими и обозначаются ~. Макроэргические вещества выполняют функцию энергетических посредников (переносчики энергии от катаболических к анаболическим процессам).
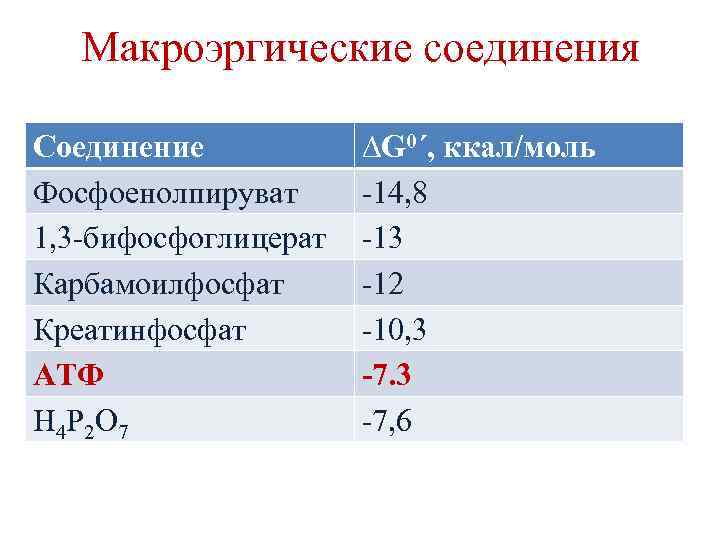
Макроэргические соединения Соединение Фосфоенолпируват 1, 3 -бифосфоглицерат Карбамоилфосфат Креатинфосфат АТФ Н 4 Р 2 О 7 ∆G 0´, ккал/моль -14, 8 -13 -12 -10, 3 -7, 6
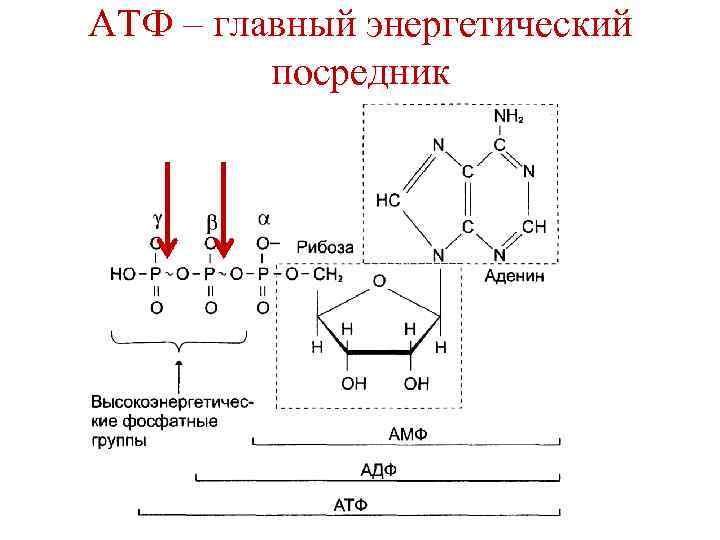
АТФ – главный энергетический посредник

Варианты гидролиза АТФ 1. АТФ + Н 2 О → АДФ + Н 3 РО 4; -7, 3 ккал/моль 2. а) АТФ + Н 2 О → АМФ + Н 4 Р 2 О 7; -7, 3 ккал/моль b) Н 4 Р 2 О 7 + Н 2 О → 2 Н 3 РО 4; -7, 6 ккал/моль -14, 9 ккал/моль

Механизмы синтеза АТФ 1. Окислительное фосфорилирование – синтез АТФ, сопряженный с переносом электронов по дыхательной цепи. АДФ + Н 3 РО 4 → АТФ 2. Субстратное фосфорилирование – синтез АТФ за счет энергии гидролиза супермакроэргических соединений.
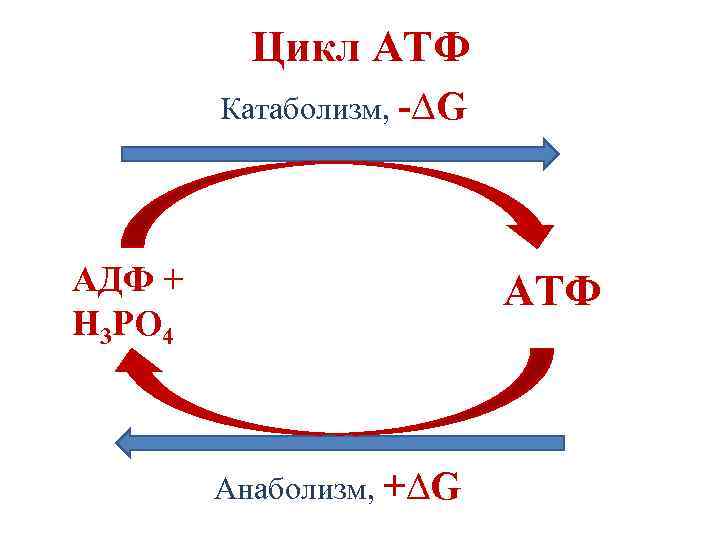
Цикл АТФ Катаболизм, -∆G АДФ + Н 3 РО 4 АТФ Анаболизм, +∆G

Энергетическое состояние клетки характеризует «заполнение» клетки макроэргическими связями (энергией). Показатели энергетического состояния: Энергетический заряд: [ATP]+1/2[ADP] [ATP]+[ADP]+[AMP] N – 0, 8 -0, 95 Потенциал фосфорилирования: [ATP]/[ADP]*[Pa] N - 500

Регуляция внутриклеточного метаболизмя 1. Регуляция энергетическим состоянием клетки. АТФ ингибирует катаболические процессы, но активирует анаболические процессы. АМФ, АДФ ингибируют анаболические процессы, но активируют катаболические процессы.

Регуляция внутриклеточного метаболизма 2. Аллостерическая регуляция 3. Ковалентная регуляция 4. Индукция и репрессия
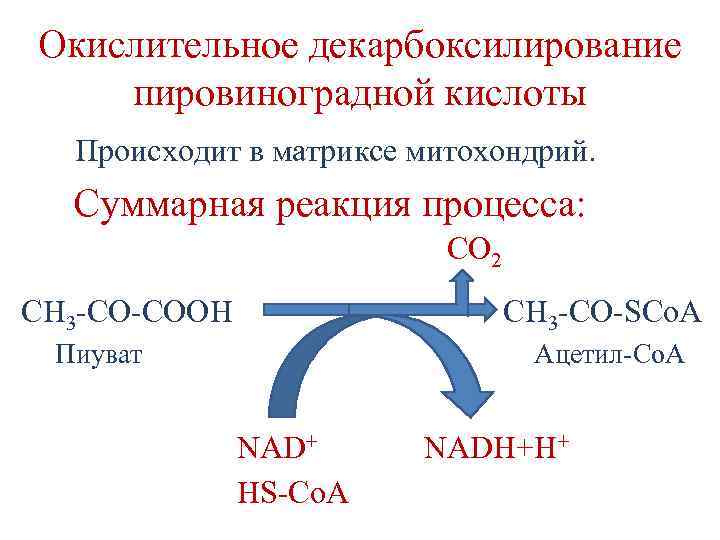
Окислительное декарбоксилирование пировиноградной кислоты Происходит в матриксе митохондрий. Суммарная реакция процесса: CO 2 CH 3 -CO-COOH CH 3 -CO-SCo. A Пиуват Ацетил-Со. А NAD+ HS-Co. A NADH+H+

Окислительное декарбоксилирование пировиноградной кислоты Происходит с участием пируватдегидрогеназного комплекса (ПДК), состоящего из 3 -х ферментов и 5 кофакторов. 1. Е 1 – пируват дегидрогеназа 2. Е 2 – дигтдролипоилацетил трансфераза 3. Е 3 – дигидролипоил дегидрогеназа В состав комплекса входят и 2 регуляторных фермента – киназа и фосфопротеинфосфатаза, участвующие в ковалентной модификации Е 1.

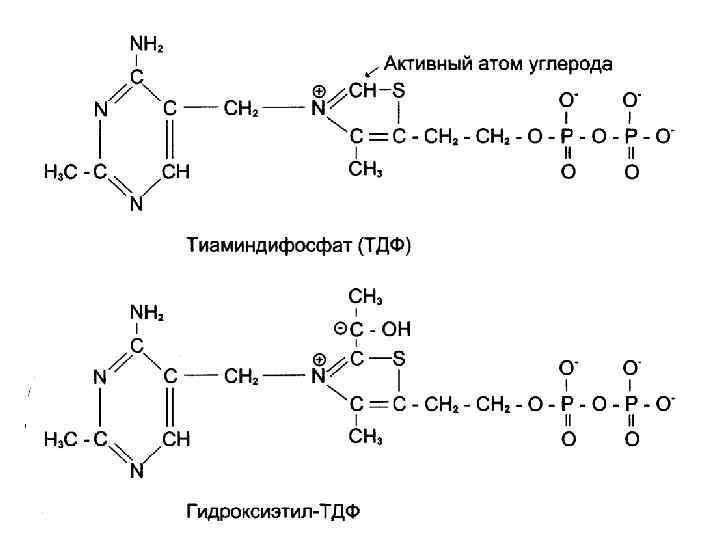
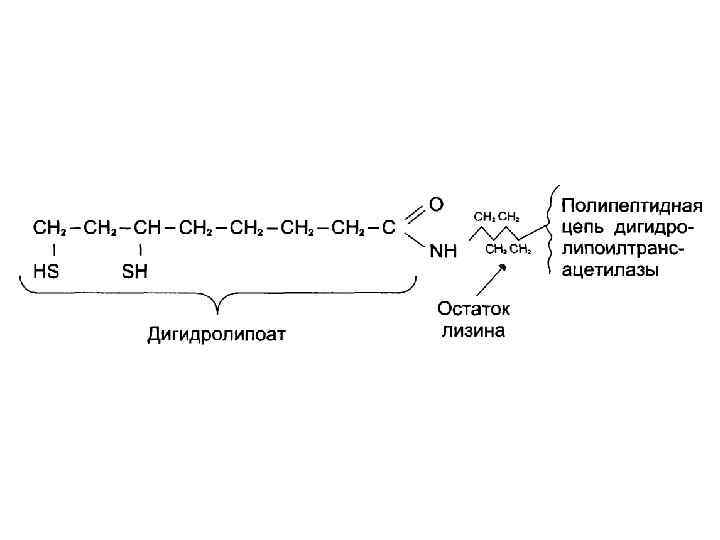
Кофакторы пируватдегидрогеназного комплекса: 1. Е 1 – ТРР (тиамин, витамин В 1) 2. Е 2 – липоевая кислота 3. Е 3 – ФАД (рибофлавин, витамин В 2) 4. NAD+ (никотинамид, витамин РР) 5. HS-Co. A (пантотеновая кислота)
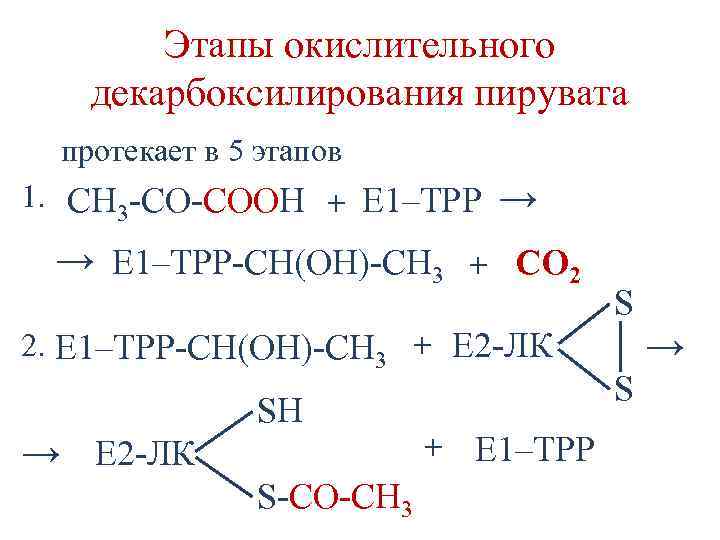
Этапы окислительного декарбоксилирования пирувата протекает в 5 этапов 1. CH 3 -CO-COOH + Е 1–ТРР → Е 1–ТРР-СН(ОН)-СН 3 → + СО 2 2. Е 1–ТРР-СН(ОН)-СН 3 + Е 2 -ЛК SН → Е 2 -ЛК S-СО-СН 3 + Е 1–ТРР S → S
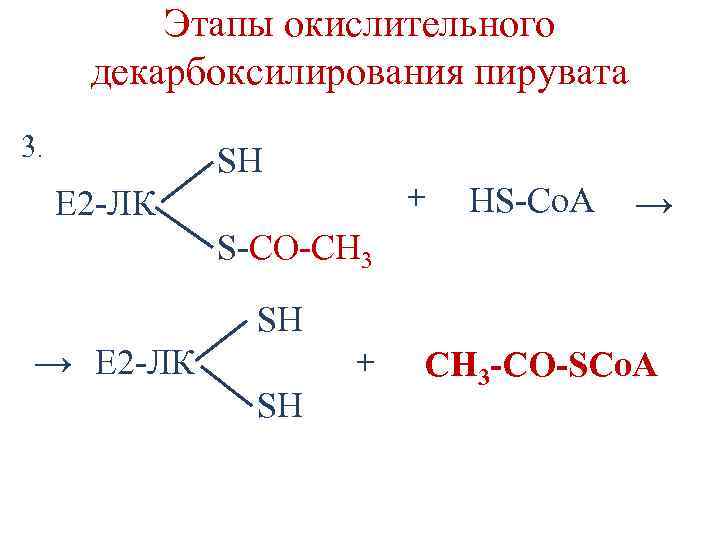
Этапы окислительного декарбоксилирования пирувата 3. SН + Е 2 -ЛК HS-Co. A → S-СО-СН 3 SH → Е 2 -ЛК + SH CH 3 -CO-SCo. A
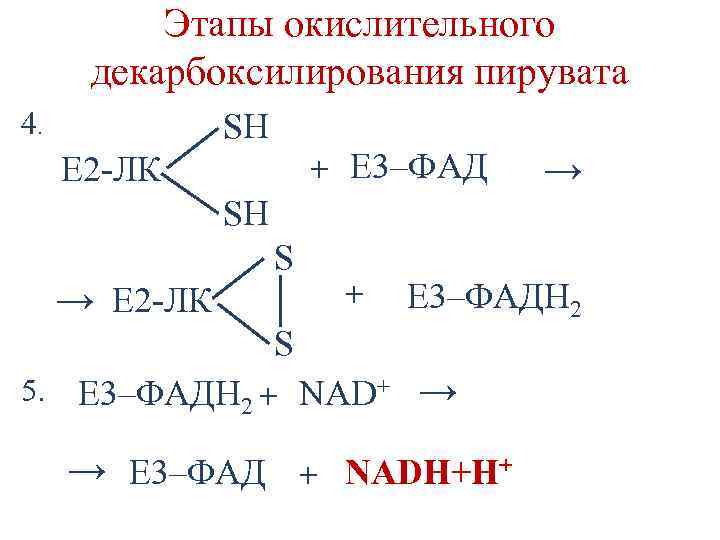
Этапы окислительного декарбоксилирования пирувата 4. SН + Е 3–ФАД Е 2 -ЛК → SH S → Е 2 -ЛК + Е 3–ФАДН 2 S 5. Е 3–ФАДН 2 + NAD+ → → Е 3–ФАД + NADH+H+
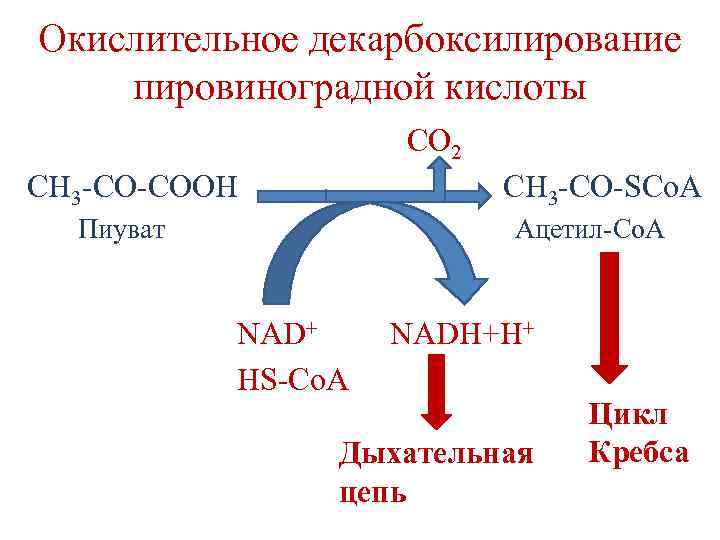
Окислительное декарбоксилирование пировиноградной кислоты CO 2 CH 3 -CO-COOH CH 3 -CO-SCo. A Ацетил-Со. А Пиуват NAD+ HS-Co. A NADH+H+ Дыхательная цепь Цикл Кребса

Регуляция пируватдегидрогеназного комплекса 1. Ковалентная регуляция Е 1 (фермент активируется при дефосфорилировании и ингибиуется при фосфорилиовании). 2. Аллостерическая регуляция Е 2 и Е 3 (конечные продукты – ацетил-Со. А и НАДН ингибируют соответственно Е 2 и Е 3). 3. Регуляция энергетическим состоянием клетки (АТФ – ингибитор, АМФ – активатор).
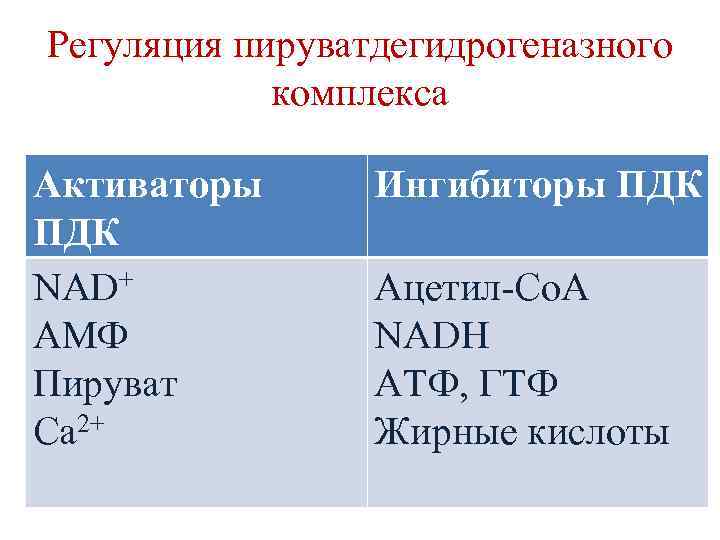
Регуляция пируватдегидрогеназного комплекса Активаторы ПДК NAD+ АМФ Пируват Са 2+ Ингибиторы ПДК Ацетил-Со. А NADH АТФ, ГТФ Жирные кислоты

Цикл Кребса (цикл трикарбоновых кислот - ЦТК, цикл лимонной кислоты, цитратный цикл ) последовательность реакций, в ходе которых происходит полное окисление ацетильного остатка ацетил-Со. А до 2 молекул СО 2. Происходит в матриксе митохондрий
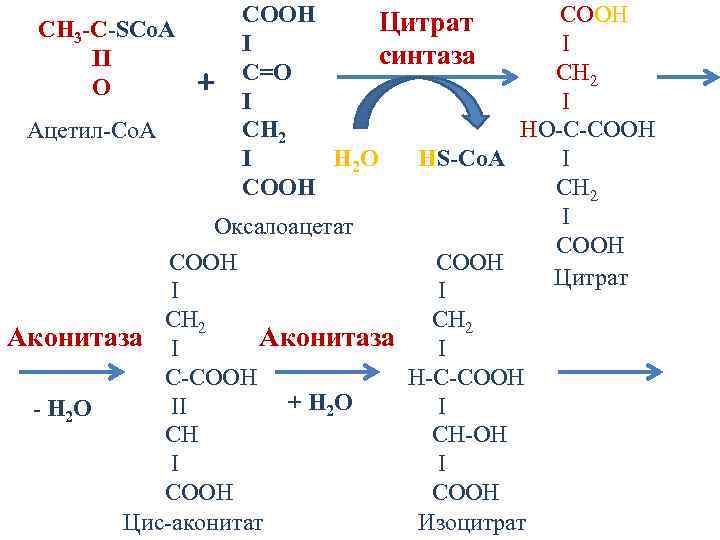
COOH Цитрат CH 3 -C-SCo. A I I синтаза II C=О CH 2 + I O I CН 2 HO-C-COOH Ацетил-Со. А I I H 2 O HS-Co. A COOH CH 2 I Оксалоацетат COOH Цитрат I I CH 2 Аконитаза I C-COOH H-C-COOH + H 2 O II I - H 2 O CH CН-ОН I I COOH Цис-аконитат Изоцитрат
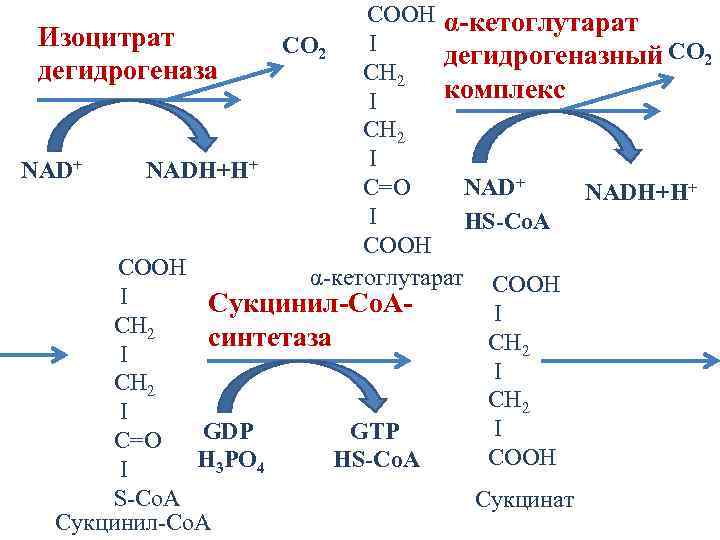
COOH α-кетоглутарат Изоцитрат I CO 2 дегидрогеназный CO 2 дегидрогеназа CH 2 комплекс I CH 2 I NAD+ NADH+H+ NAD+ C=О NADH+H+ I HS-Co. A COOH α-кетоглутарат COOH I Сукцинил-Со. АI CH 2 синтетаза CH 2 I I GDP GTP C=О CООН H 3 PO 4 HS-Co. A I S-Co. A Сукцинил-Со. А Сукцинат
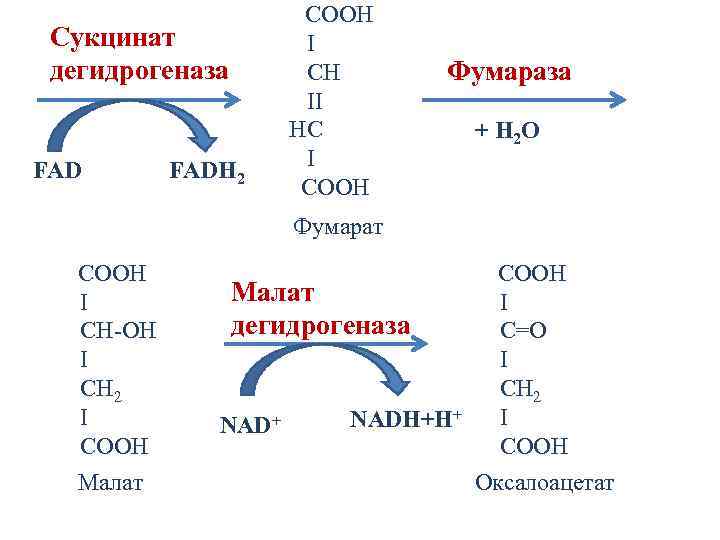
Сукцинат дегидрогеназа FADH 2 COOH I CH II HC I CООН Фумараза + H 2 O Фумарат COOH I CH-OH I CH 2 I CООН Малат COOH Малат I дегидрогеназа C=O I CH 2 I + NADH+H+ NAD CООН Оксалоацетат

Суммарная реакция цикла Кребса + 3 NAD CH 3 -CO-SCo. A + 2 H 2 O + + 1 FAD + GDP + H 3 PO 4 → ++ 2 CO 2 + HS-Co. A + 3 NADH+3 H 1 FADH 2 + GTP
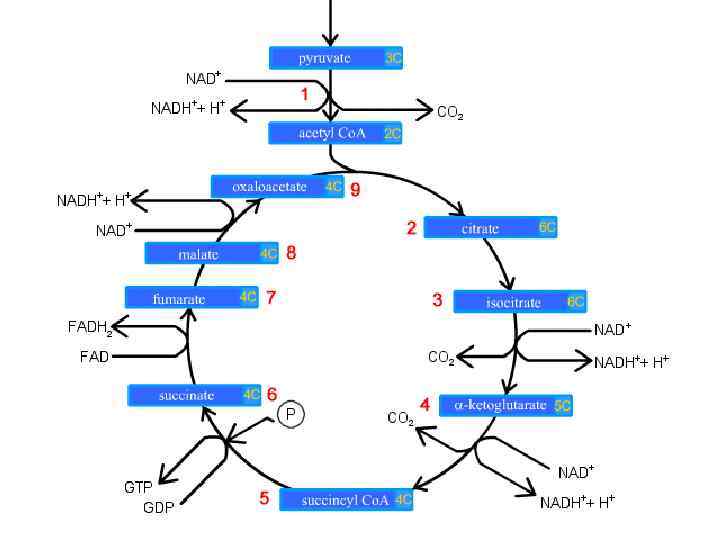

Функции цикла Кребса 1. Интегративная – объединяет пути метаболизма основных классов веществ. 2. Энергетическая – синтез одной молекулы ГТФ в реакции субстратного фосфорилирования. 3. Донор водородов для дыхательной цепи (в составе NADH и FADH 2).

Функции цикла Кребса 4. Амфиболическая: a) Катаболическая – расщепление ацетил. Со. А до 2 молекул СО 2 b) Анаболическая – промежуточные продукты цикла Кребса могут использоваться для синтеза определенных веществ. Примеры: оксалоацетат → Asp, Asn α-кетоглутарат → Glu, Gln
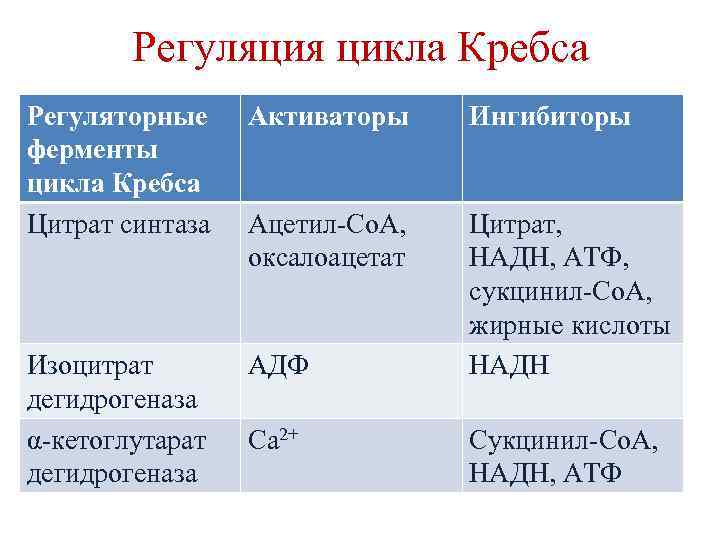
Регуляция цикла Кребса Регуляторные ферменты цикла Кребса Цитрат синтаза Активаторы Ингибиторы Ацетил-Со. А, оксалоацетат Изоцитрат дегидрогеназа α-кетоглутарат дегидрогеназа АДФ Цитрат, НАДН, АТФ, сукцинил-Со. А, жирные кислоты НАДН Са 2+ Сукцинил-Со. А, НАДН, АТФ

Анаплеротические реакции - реакции, пополняющие промежуточные продукты цикла Кребса. • Необходимость анаплеротических реакций вытекает из анаболической функции цикла Кребса.
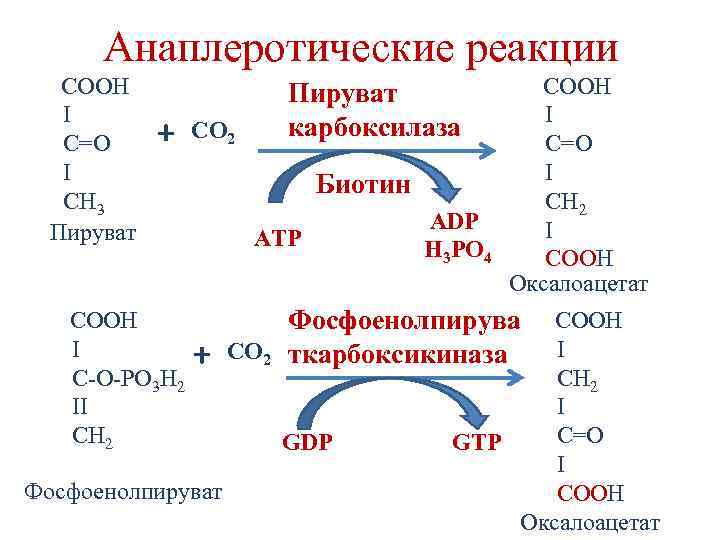
Анаплеротические реакции + COOH I C-O-PO 3 H 2 II CH 2 CO 2 Пируват карбоксилаза Биотин ATP + COOH I C=O I CH 3 Пируват Фосфоенолпируват ADP H 3 PO 4 COOH I C=О I C Н 2 I CООН Оксалоацетат Фосфоенолпирува CO 2 ткарбоксикиназа GDP COOH I C Н 2 I C=О GTP I CООН Оксалоацетат
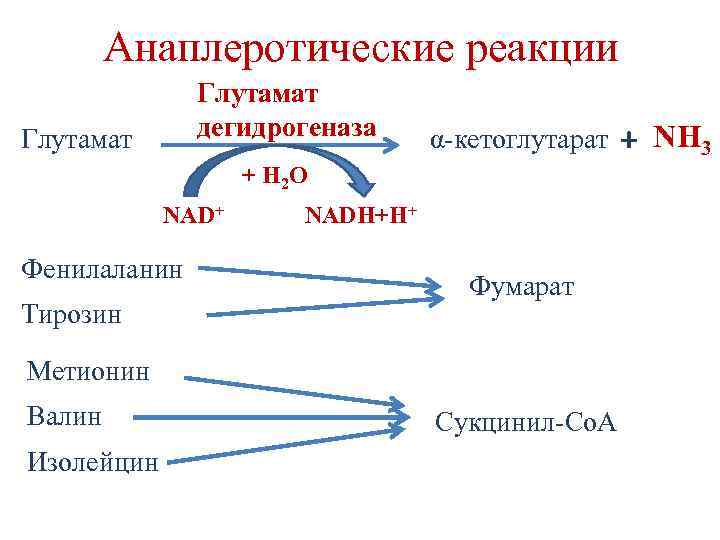
Анаплеротические реакции Глутамат дегидрогеназа Глутамат α-кетоглутарат + H 2 О NAD+ Фенилаланин Тирозин NADH+H+ Фумарат Метионин Валин Изолейцин Сукцинил-Со. А + NH 3

БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ. ДЫХАТЕЛЬНАЯ ЦЕПЬ. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ

Биологическое окисление (тканевое дыхание) – совокупность реакций окисления, протекающих в живых организмах. • Функция – обеспечение организма доступной химической энергией в виде АТФ.

Биологическое окисление (БО) • БО начинается с реакций дегидрирования субстратов. • Реакции дегидрирования катализируются ферментами дегидрогеназами, которые в качестве кофакторов содержат НАД+ и ФАД.
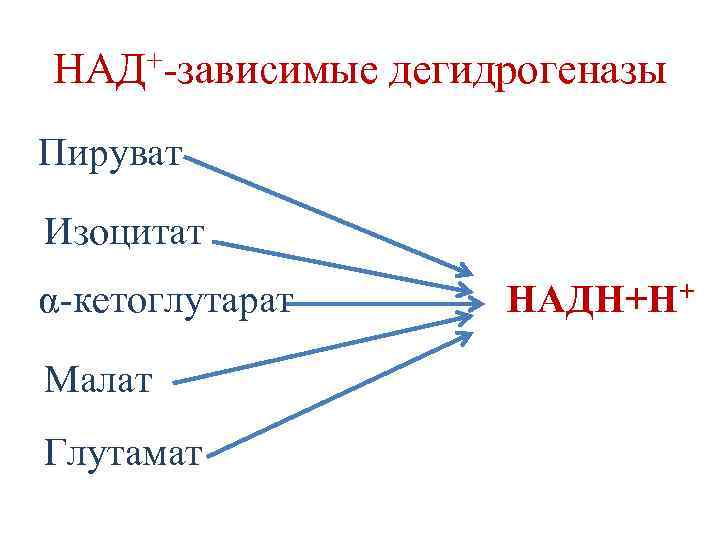
НАД+-зависимые дегидрогеназы Пируват Изоцитат α-кетоглутарат Малат Глутамат НАДН+Н+
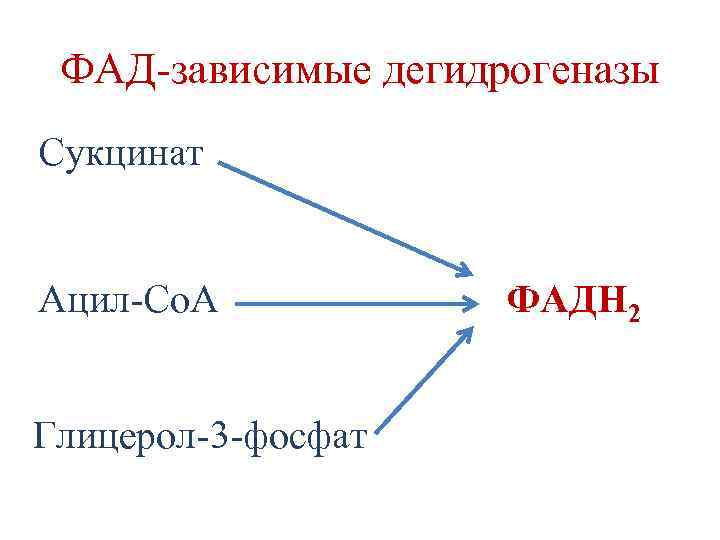
ФАД-зависимые дегидрогеназы Сукцинат Ацил-Со. А Глицерол-3 -фосфат ФАДН 2

• НАДН и ФАДН 2, полученные в реакциях дегидрирования субстратов, переносят электроны и протоны в дыхательную цепь.

Дыхательная цепь (ДЦ) • Комплекс ферментов и окислительновосстановительных систем, участвующих в переносе электронов и протонов с восстановленных кофакторов (НАДН и ФАДН 2) на кислород с образованием воды. • Локализация процесса – внутренняя митохондриальная мембрана.

Функции дыхательной цепи • Энергетическая – перенос электронов по дыхательной цепи сопровождается выделением свободной энергии, которая используется для синтеза АТФ. • Реокисление кофакторов НАДН и ФАДН 2.

Окислительно-восстановительные системы (редокс-системы) • ОВ система состоит из донора и акцептора электронов. • Каждая ОВ система обладает ОВ потенциалом (∆Еº´), который измеряется в вольтах (V) и характеризует сродство ОВ системы к электронам (т. е. способность отдавать или принимать электроны).

Окислительно-восстановительный потенциал • Чем электроотрицательнее величина ОВ потенциала, тем выше способность ОВ пары отдавать электроны. • Чем электроположительнее величина ОВ потенциала, тем выше способность ОВ пары принимать электроны. • В дыхательной цепи ОВ системы расположены в порядке возрастания ОВ потенциала.

Окислительно-восстановительные системы дыхательной цепи NAD+/NADH ― FMN/FMNH 2 ― Co. Q/Co. QH 2 ― цит. b (Fe 3+)/цит. b(Fe 2+ ) ― цит. c 1(Fe 3+)/цит. c 1(Fe 2+ ) ― цит. c(Fe 3+)/цит. c(Fe 2+ ) ― цит. а(Fe 3+)/цит. а(Fe 2+ ) ― цит. а 3(Fe 3+)/цит. а 3(Fe 2+ ) ― ½O 2/H 2 O ― -0, 32 V -0, 05 V +0, 04 V +0, 12 V +0, 25 V +0, 29 V +0, 55 V +0, 82 V
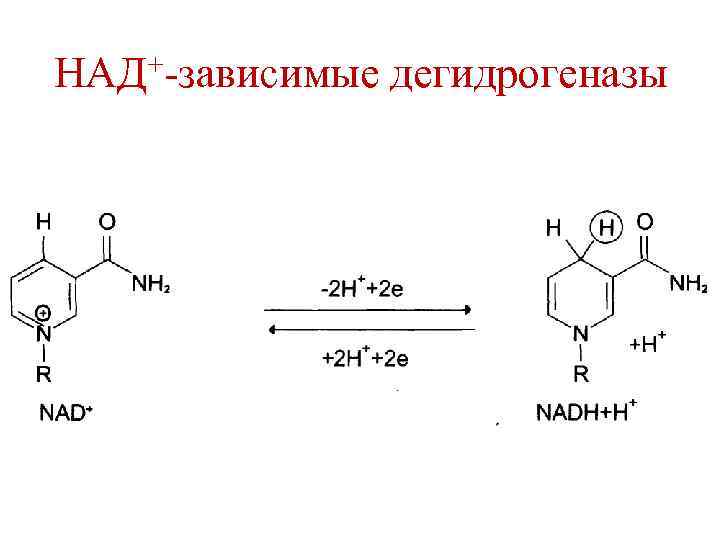
НАД+-зависимые дегидрогеназы
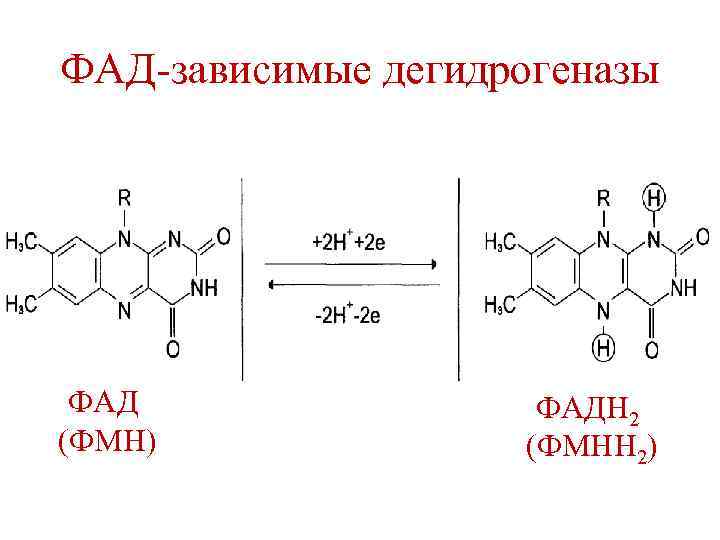
ФАД-зависимые дегидрогеназы ФАД (ФМН) ФАДН 2 (ФМНН 2)

Железо-серные белки • Белки, содержащие атомы железа (негемовое железо), связанные с серой остатков цистеина и/или неорганической серой. • 3 типа железо-серных центров: 1. Fe. S 2. Fe 2 S 2 3. Fe 4 S 4
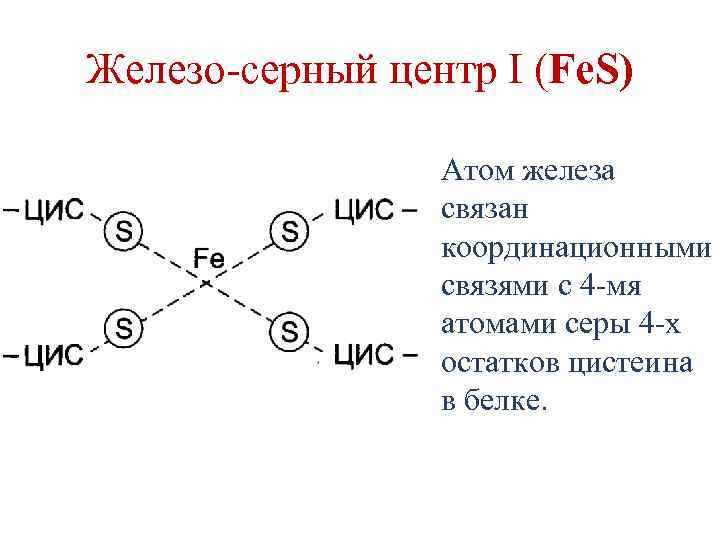
Железо-серный центр I (Fe. S) Атом железа связан координационными связями с 4 -мя атомами серы 4 -х остатков цистеина в белке.
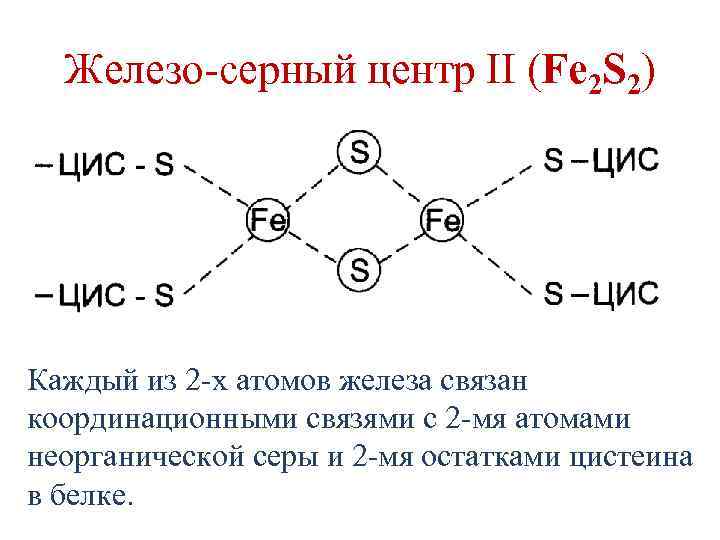
Железо-серный центр II (Fe 2 S 2) Каждый из 2 -х атомов железа связан координационными связями с 2 -мя атомами неорганической серы и 2 -мя остатками цистеина в белке.
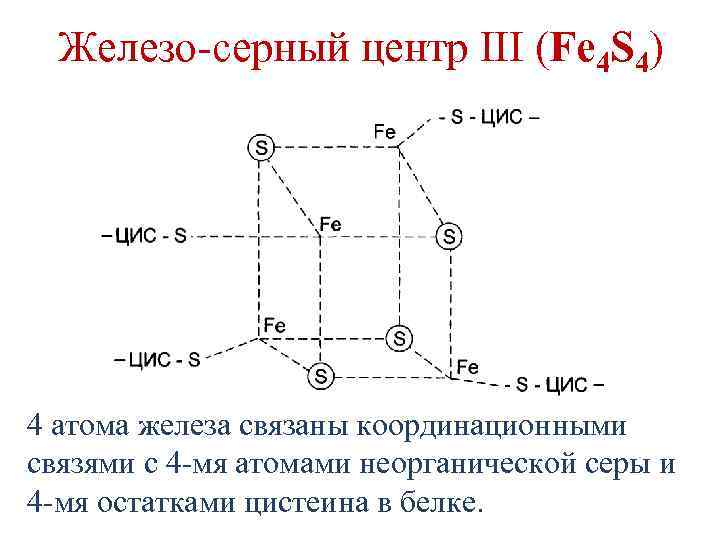
Железо-серный центр III (Fe 4 S 4) 4 атома железа связаны координационными связями с 4 -мя атомами неорганической серы и 4 -мя остатками цистеина в белке.
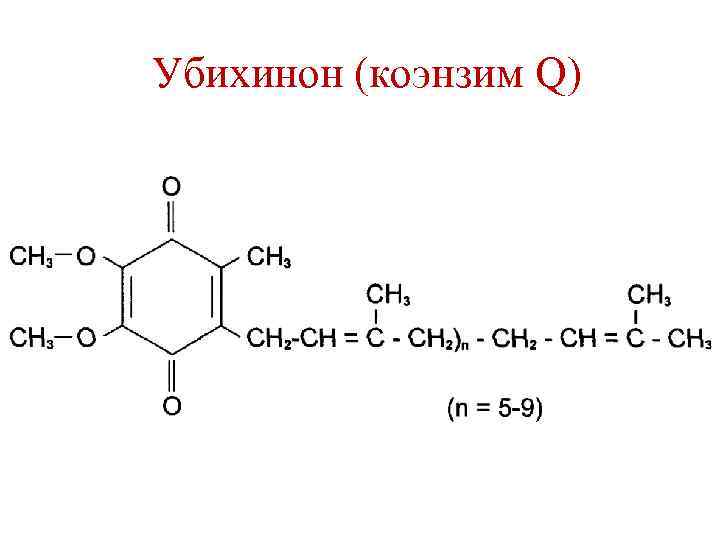
Убихинон (коэнзим Q)
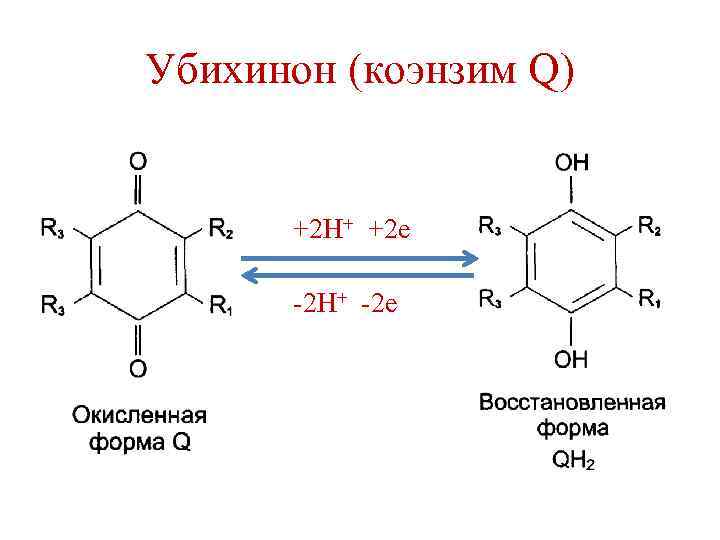
Убихинон (коэнзим Q) +2 Н+ +2 е -2 Н+ -2 е

Цитохромы – гемопротеины • в дыхательной цепи участвуют цитохромы b, c, c 1, а и а 3. • Цитохромы различаются: 1. Структурой боковых цепей гема. 2. Структурой полипептидных цепей. 3. Способом связи полипептидных цепей с гемом. 4. Значением ОВ потенциала.
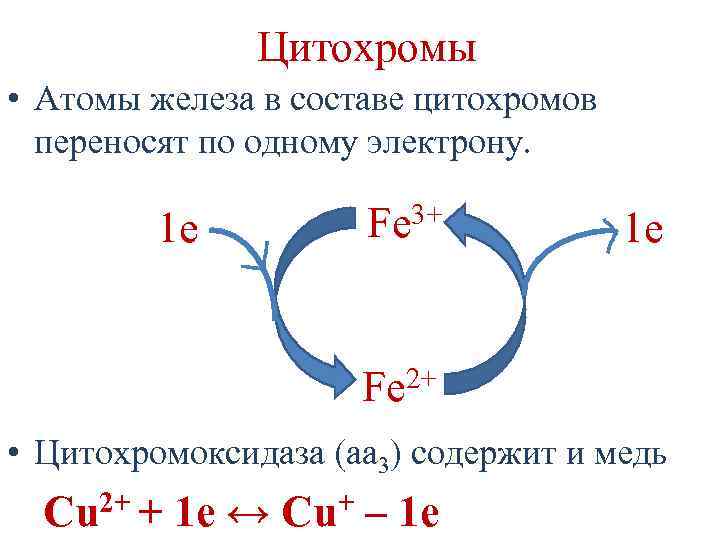
Цитохромы • Атомы железа в составе цитохромов переносят по одному электрону. 1 e 3+ Fe 1 e 2+ Fe • Цитохромоксидаза (аа 3) содержит и медь Cu 2+ + 1 e ↔ Cu+ – 1 e
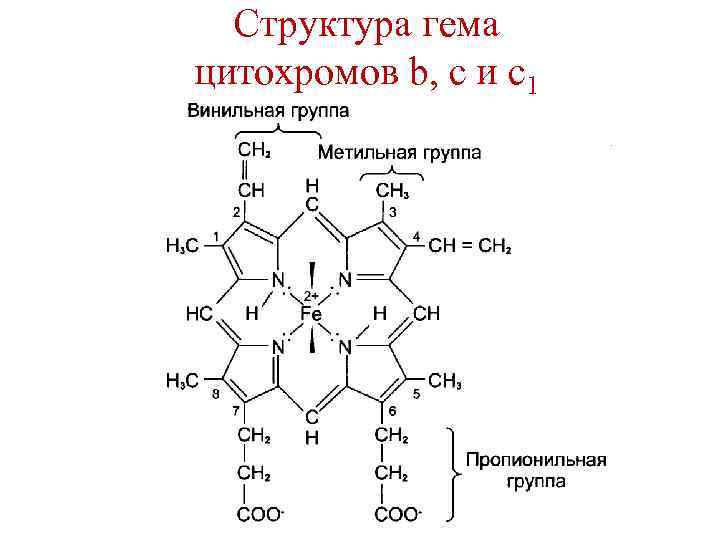
Структура гема цитохромов b, c и c 1
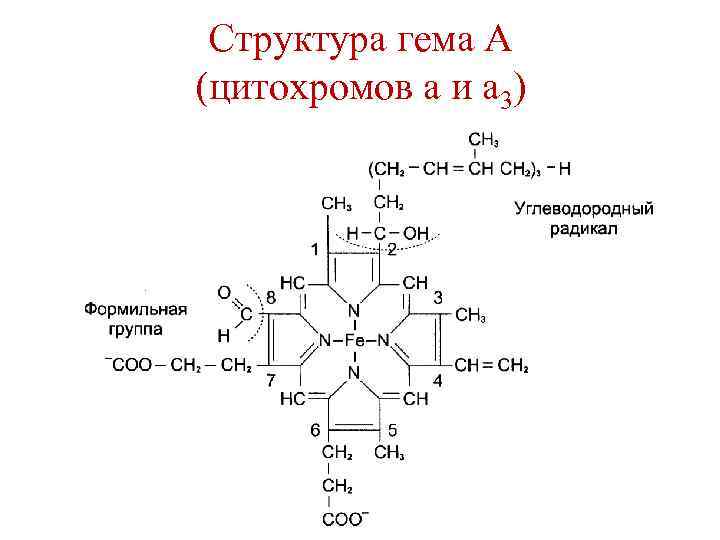
Структура гема А (цитохромов а и а 3)
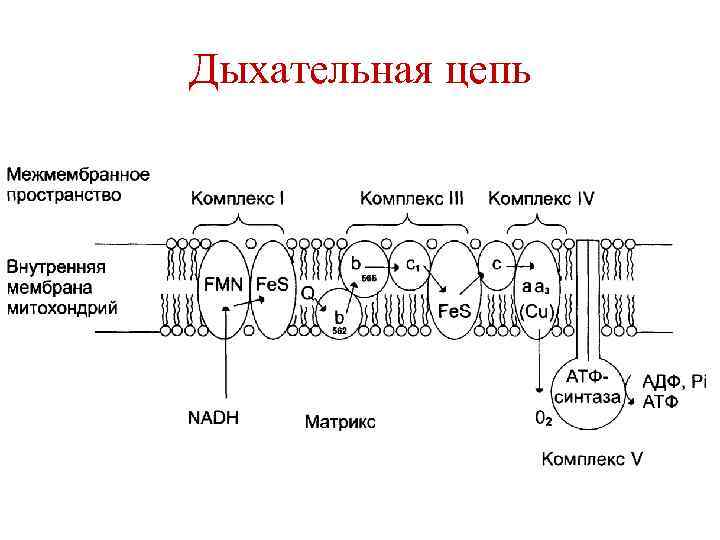
Дыхательная цепь
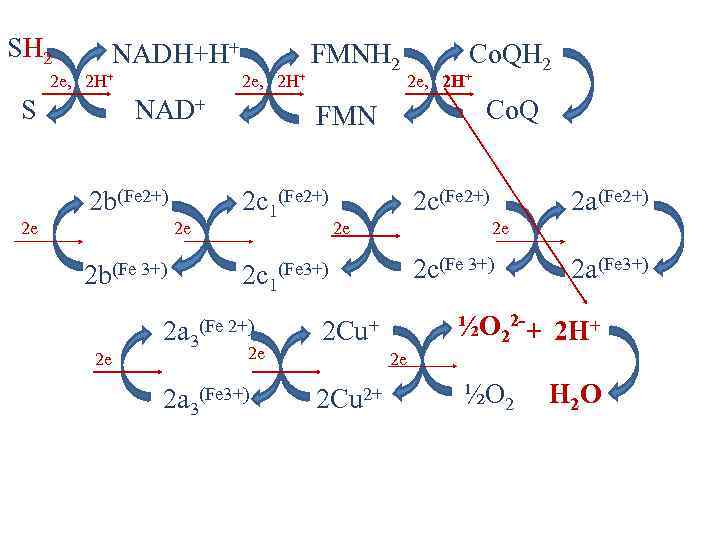
SH 2 NADH+H+ 2 e, 2 H+ S 2 e, 2 H+ NAD+ 2 b(Fe 2+) 2 e 2 e 2 b(Fe 3+) 2 e FMNH 2 2 e, 2 H+ Co. Q FMN 2 c 1(Fe 2+) Co. QH 2 2 c(Fe 2+) 2 e 2 e 2 c(Fe 3+) 2 c 1(Fe 3+) 2 a 3(Fe 2+) 2 e 2 Cu 2+ 2 a(Fe 3+) ½O 22 -+ 2 H+ 2 Cu+ 2 a 3(Fe 3+) 2 a(Fe 2+) 2 e ½O 2 H 2 O
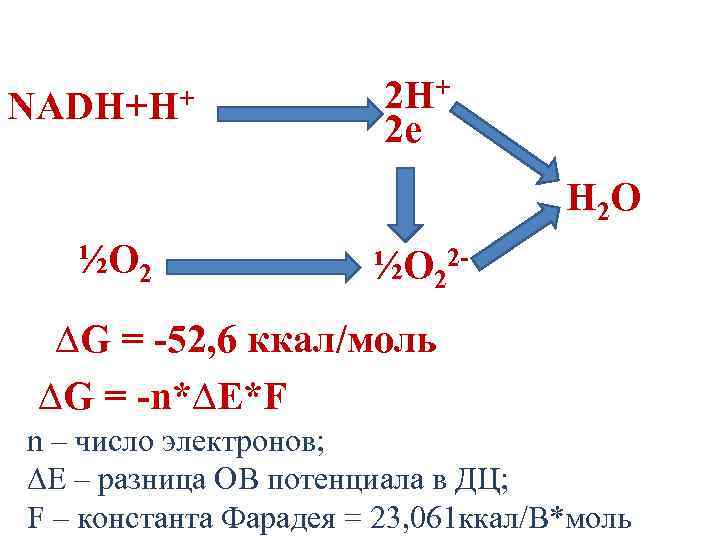
NADH+H+ 2 e H 2 O ½O 22 - ∆G = -52, 6 ккал/моль ∆G = -n*∆E*F n – число электронов; ∆E – разница ОВ потенциала в ДЦ; F – константа Фарадея = 23, 061 ккал/В*моль
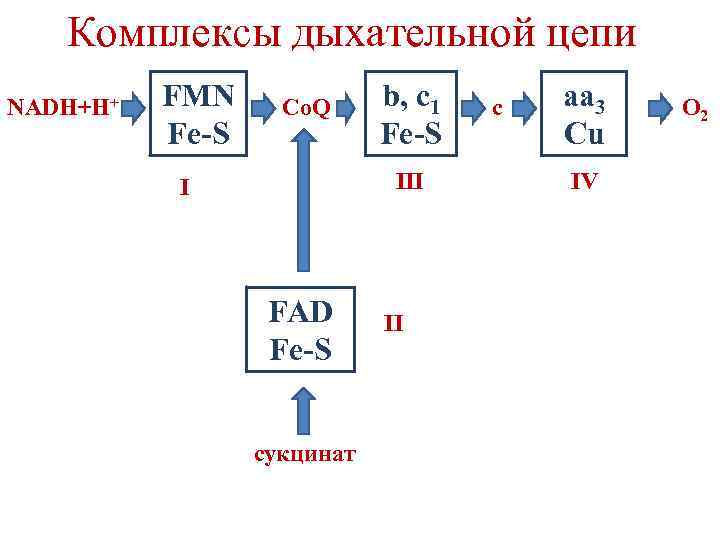
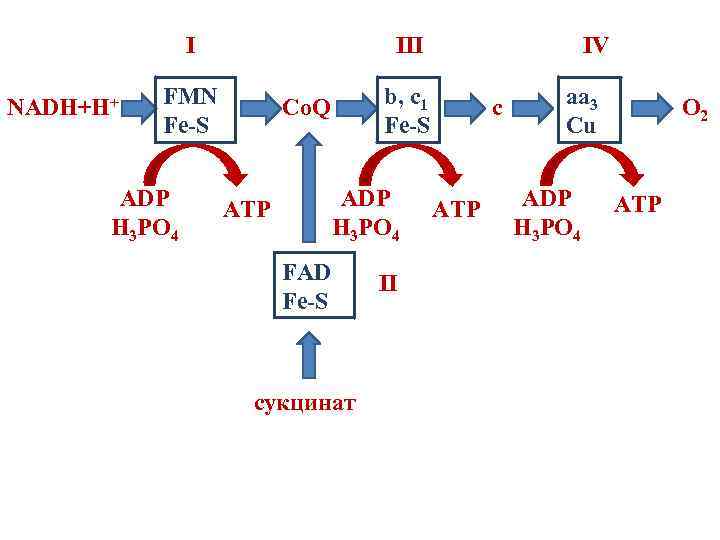
Комплексы дыхательной цепи NADH+H+ FMN Fe-S Co. Q b, c 1 Fe-S III I FAD Fe-S сукцинат II c aa 3 Cu IV O 2

Комплексы дыхательной цепи I – NADH-Co. Q-редуктаза II – сукцинат-Co. Q-редуктаза III – Co. QH 2 -цитохром с-редуктаза IV – цитохромоксидаза

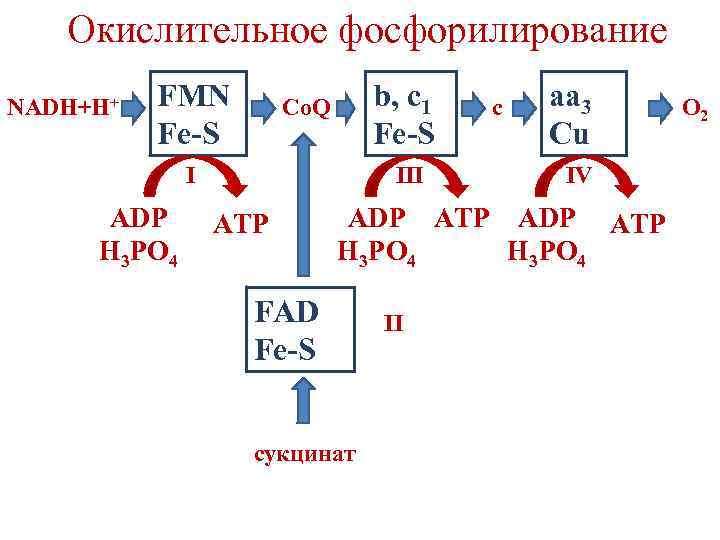
Окислительное фосфорилирование синтез АТФ из АДФ и фосфата, сопряженный с дыхательной цепью (за счет энергии переноса электронов по дыхательной цепи). • Перенос электронов по дыхательной цепи происходит постепенно и сопровождается уменьшением свободной энергии.

Окислительное фосфорилирование • В ДЦ существуют 3 участка, где снижение свободной энергии достаточно для синтеза АТФ из АДФ и фосфата (˃ 7, 3 ккал/моль). • Участки, где происходит синтез АТФ, называются точками фосфорилирования. • Они соответствуют I, III и IV комплексам дыхательной цепи.
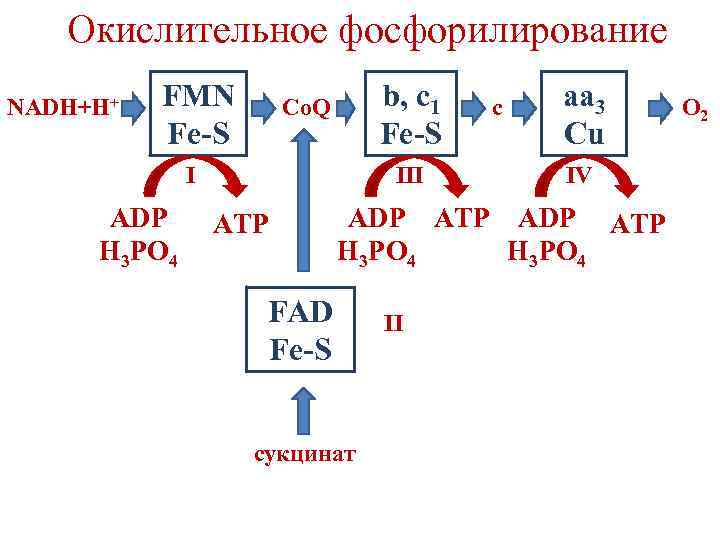
Окислительное фосфорилирование NADH+H+ FMN Fe-S b, c 1 Fe-S Co. Q I ADP H 3 PO 4 III ATP c aa 3 Cu IV ADP ATP H 3 PO 4 FAD Fe-S сукцинат II O 2
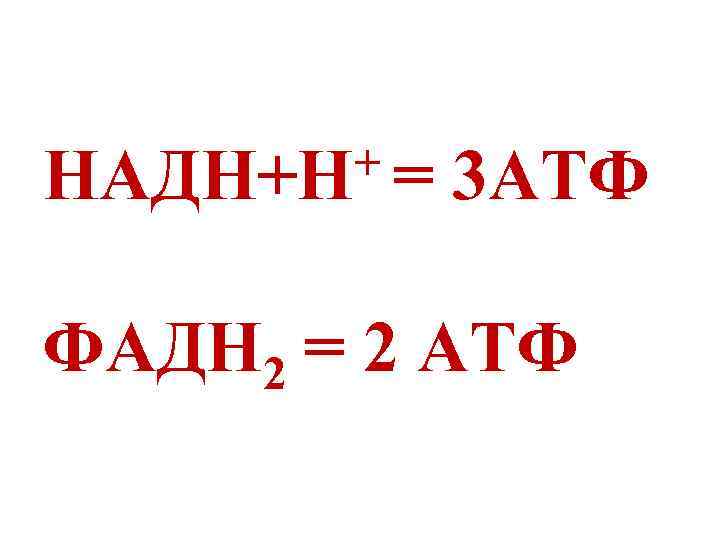
+= НАДН+Н 3 АТФ ФАДН 2 = 2 АТФ

Энергетический баланс цикла Кребса Суммарная реакция цикла Кребса CH 3 -CO-SCo. A + 2 H 2 O + 3 NAD+ + 1 FAD + GDP + H 3 PO 4 → 2 CO 2 + HS-Co. A + 3 NADH+3 H+ + 1 FADH 2 + GTP 3 НАДН = 3*3 АТФ = 9 АТФ 1 ФАДН 2 = 2 АТФ 1 ГТФ = 1 АТФ 12 АТФ
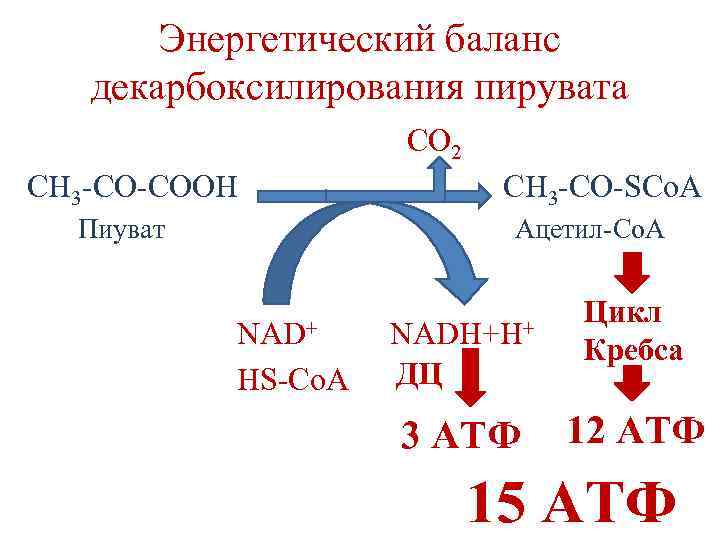
Энергетический баланс декарбоксилирования пирувата CO 2 CH 3 -CO-COOH CH 3 -CO-SCo. A Ацетил-Со. А Пиуват NAD+ NADH+H+ HS-Co. A ДЦ 3 АТФ Цикл Кребса 12 АТФ 15 АТФ

Механизм сопряжения окисления и фосфорилирования Хемиосмотическая теория Митчелла объясняет каким образом энергия переноса электронов по дыхательной цепи используется для синтеза АТФ.

Хемиосмотическая теория Митчелла • Перенос электронов по дыхательной цепи сопровождается выкачиванием протонов из матрикса митохондрий в межмембранное пространство. • Протоны не могут вернуться обратно в матрикс митохондрий, поскольку внутренняя мембрана митохондрий непроницаема для протонов.

Хемиосмотическая теория Митчелла • Создается протонный градиент – концентрация протонов в межмембранном пространстве больше чем в матриксе. • Протоны заряжены положительно, поэтому появляется разность потенциалов по обе стороны внутренней мембраны: положительный – на наружной и отрицательный – на внутренней стороне внутренней мембраны митохондрий.

Хемиосмотическая теория Митчелла • В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал - ∆µН+ • Протоны могут возвращаться в матрикс митохондрий только через ионный канал фермента АТФ-синтазы.

Хемиосмотическая теория Митчелла • Перенос протонов через АТФ-синтазу по градиенту концентрации сопровождается выделением свободной энергии, которая используется для синтеза АТФ. • Протонный градиент является движущей силой синтеза АТФ.
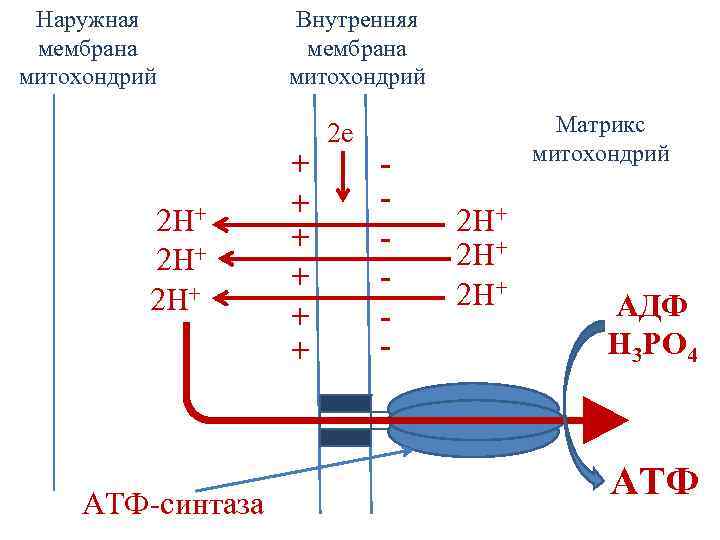
Наружная мембрана митохондрий 2 Н+ 2 Н+ АТФ-синтаза Внутренняя мембрана митохондрий + + + 2 е - Матрикс митохондрий 2 Н+ 2 Н+ АДФ Н 3 РО 4 АТФ

АТФ-синтаза +-АТФ-аза) (Н • Локализация – внутренняя мембрана митохондрий. • Состоит из 2 -х белковых комплексов: • F 0 – погружен в мембрану – является каналом для Н+ • F 1 – выступает в матрикс – является каталитической частью

Коэффициент окислительного фосфорилирования (Р/О) отношение количества фосфорной кислоты (Р), используемой на фосфорилирование АДФ, к атому кислорода (О), используемого в дыхательной цепи. Для НАДН - Р/О = 3 Для ФАДН 2 - Р/О = 2 Дыхательный контроль – зависимость скорости дыхательной цепи от концентрации АДФ.
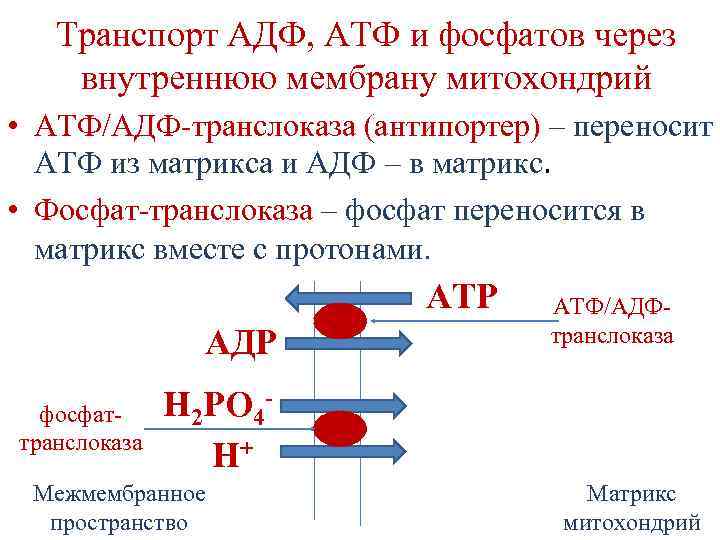
Транспорт АДФ, АТФ и фосфатов через внутреннюю мембрану митохондрий • АТФ/АДФ-транслоказа (антипортер) – переносит АТФ из матрикса и АДФ – в матрикс. • Фосфат-транслоказа – фосфат переносится в матрикс вместе с протонами. ATP AДP фосфаттранслоказа АТФ/АДФтранслоказа Н 2 РО 4 Н+ Межмембранное пространство Матрикс митохондрий

Разобщение дыхания и фосфорилирования • происходит под действием веществ, которые переносят протоны (протонофоры) или другие ионы (ионофоры) из межмембранного пространства в матрикс митохондрий, минуя канал АТФ-синтазы. • Исчезает протонный градиент и уменьшается синтез АТФ. • Энергия переноса электронов выделяется в виде теплоты, коэффициент Р/О уменьшается.

Разобщающие агенты • • • 2, 4 -динитрофенол Дикумарол Тироксин Свободные жирные кислоты Разобщающие агенты являются липофильными веществами, связывают в межмембранном пространстве протоны и переносят их в матрикс.

Терморегуляторная функция дыхательной цепи • 40 -45% энергии переноса электронов по дыхательной цепи используется для синтеза АТФ. • 25% - на транспорт веществ через мембрану • 30 -35% - на теплообразование (термогенез) • Разобщающие агенты увеличивают термогенез.

Физиологическая роль разобщения • Поддержание температуры тела у новорожденных, у зимнеспящих животных, при адаптации к холоду. • Бурая жировая ткань специализированна на термогенезе: • Содержит много митохондрий; • Содержит много ферментов ДЦ; • Содержит белок термогенин (разобщающий белок, UCP – uncoupling protein).

Термогенин • По структуре близок к АТФ/АДФантипортеру, но не переносит нуклеотиды, а переносит анионы жирных кислот. Патологическое разобщение: • Йодтиронины индуцируют синтез термогенина – при гиперфункции щитовидной железы увеличивается температура тела.

Ингибиторы дыхательной цепи • I комплекс – ротенон • III комплекс – антимицин • IV комплекс – цианиды, СО Ингибиторы АТФ-синтазы • Олигомицин
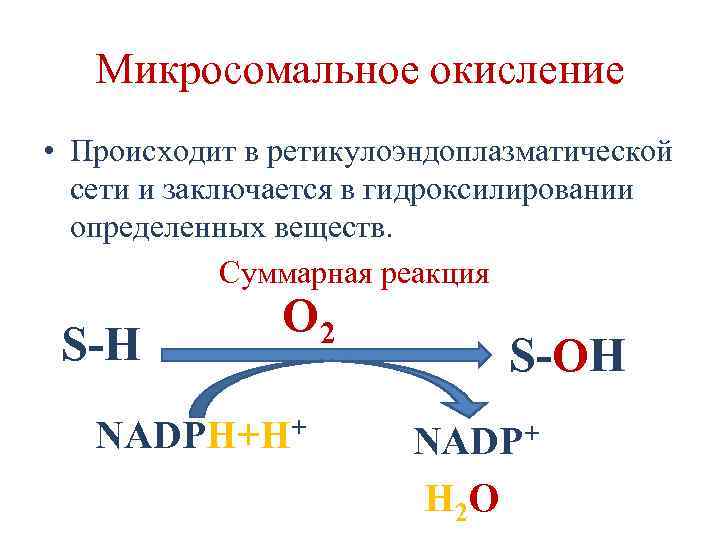
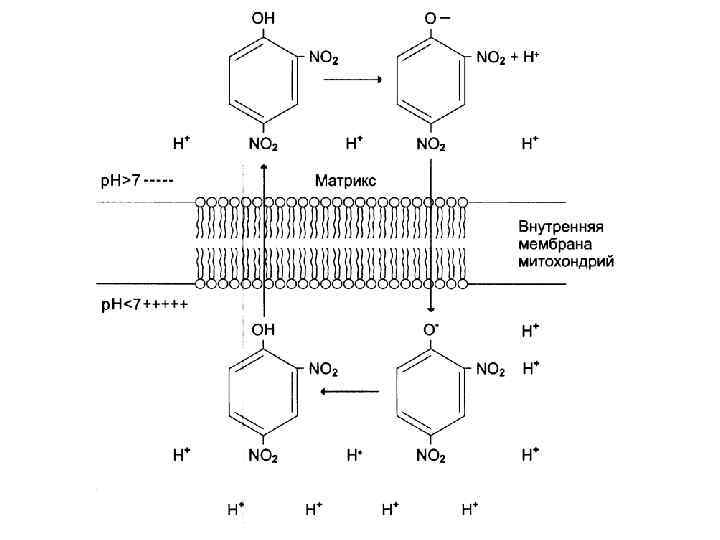
Микросомальное окисление • Происходит в ретикулоэндоплазматической сети и заключается в гидроксилировании определенных веществ. Суммарная реакция S-H O 2 NADPH+H+ S-OH NADP+ H 2 O
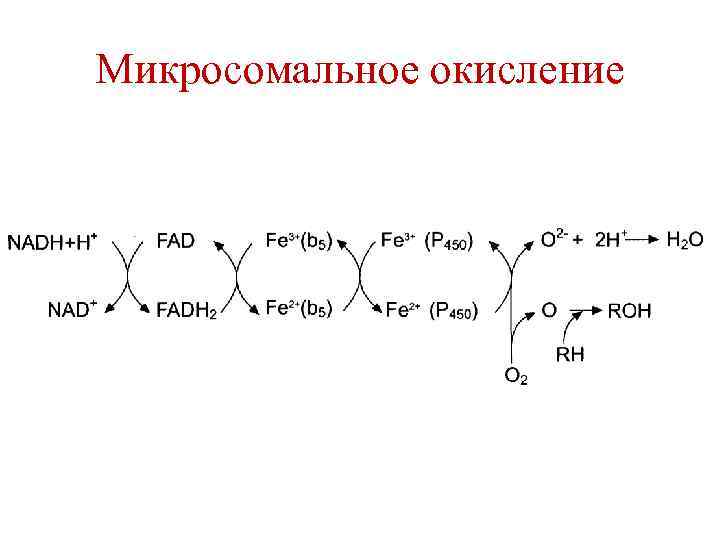
Микросомальное окисление

Микросомальное окисление • Ферменты – гидроксилазы (монооксигеназы). В процессе участвует цитохром Р 450 и ФАДзависимый флавопротеин. Биологическая роль: 1. Обезвреживание экзогенных токсичных веществ и инактивация эндогенных активных веществ. 2. Синтетическая роль (синтез стероидных гормонов, катехоламинов и др. веществ).

Активные формы кислорода • Образуются при неполном восстановлении кислорода. Супероксидный анион О 2 + е- → О 2 Перекись водорода О 2 - + 2 Н+ → Н 2 О 2 + О 2 Гидроксильный радикал О 2 - + Н 2 О 2 → О 2 + НО- + НО∙

Активные формы кислорода • В нормальных количествах обладают физиологическими эффектами (фагоцитоз микроорганизмов, чужеродных частиц). • В высоких концентрациях повреждают нуклеиновые кислоты, белки, ферменты, мембранные липиды.

Антиоксидантные системы 1. Ферменты: Супероксиддисмутаза (СОД) О 2 - + 2 Н+ → Н 2 О 2 + О 2 Каталаза 2 Н 2 О 2 → 2 Н 2 О + О 2 Глутатион пероксидаза Глутатион редуктаза 2. Витамины Е, А, С.
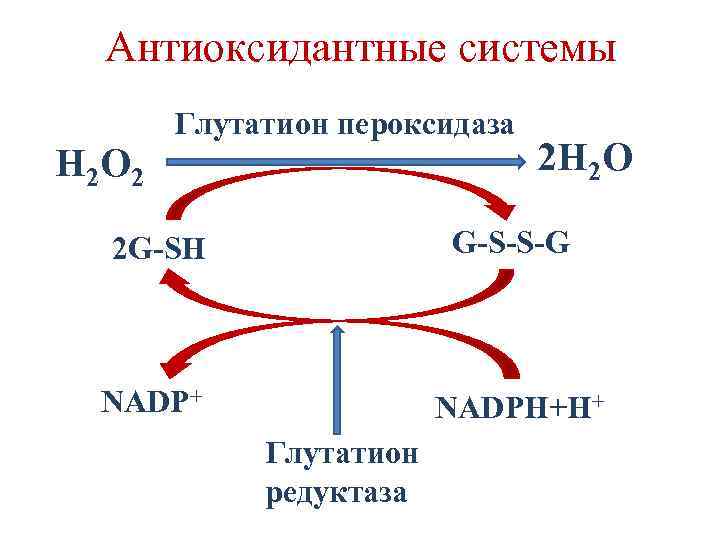
Антиоксидантные системы H 2 O 2 Глутатион пероксидаза 2 H 2 O 2 G-SH G-S-S-G NADP+ NADPH+H+ Глутатион редуктаза
I NADH+H+ III FMN Fe-S ADP H 3 PO 4 b, c 1 Fe-S Co. Q ADP H 3 PO 4 ATP IV FAD Fe-S сукцинат II c ATP aa 3 Cu ADP H 3 PO 4 O 2 ATP
Окислительное фосфорилирование NADH+H+ FMN Fe-S b, c 1 Fe-S Co. Q I ADP H 3 PO 4 III ATP c aa 3 Cu IV ADP ATP H 3 PO 4 FAD Fe-S сукцинат II O 2
4_bioenergetica_ru.ppt