Tema_obmin_aminokyslot_2013.ppt
- Количество слайдов: 36

МЕТАБОЛІЧНІ ПЕРЕТВОРЕННЯ БІЛКІВ І АМІНОКИСЛОТ 1. 2. Катаболізм основних харчових речовин Функції білків. Перетравлення харчових білків 3. Метаболізм амінокислот 4 Розщеплення вуглецевих скелетів амінокислот 5. Спадкові порушення катаболізму амінокислот 6. Аміак – токсична для організму речовина, шляхи його виведення 7. Цикл сечовини
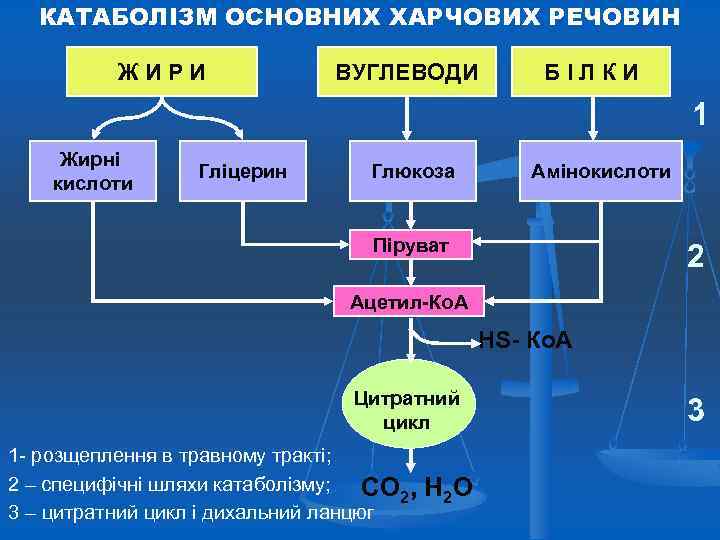
КАТАБОЛІЗМ ОСНОВНИХ ХАРЧОВИХ РЕЧОВИН ЖИРИ ВУГЛЕВОДИ БІЛКИ 1 Жирні кислоти Гліцерин Глюкоза Амінокислоти Піруват 2 Ацетил-Ко. А НS- Ко. А Цитратний цикл 1 - розщеплення в травному тракті; 2 – специфічні шляхи катаболізму; СО 2, 3 – цитратний цикл і дихальний ланцюг Н 2 О 3

ОСНОВНІ ФУНКЦІЇ БІЛКІВ 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Основні структурні компоненти органів і тканин, а також усіх клітинних органел. Енергетична функція (катаболітичні процеси). Поживна, запасаюча функція. Виявляють каталітичну (ферментативну) активність – проте у 1982 р. - відкриття РНКзимів. Беруть участь у регуляції метаболізму -клітинний рівень: білки - репрессори та активатори транскрипції; організменний - білкова природа гормонів. Виконують захисну функцію – антитіла. Беруть участь у процесах скорочення м'язів і руху (актино-міозинові комплекси) Беруть участь у процесах трансформації енергії - білки сітківки ока трансформують світлову енергію в електричну. Транспортна функція: а)гемоглобін здійснює транспорт О 2, СО 2; б)трансферрин - транспорт заліза; в) пермеази - мембранні білки, які переносять полярні сполуки через мембрану як за, так і проти градієнту концентрації. Буферна функція. Клітинна сигналізація - приклад, епідермальний фактор росту, що є промотором клітинного поділу. Беруть участь у процесах міжклітинної взаємодії та розпізнавання клітинних поверхонь молекули адгезії, інтегрини. Рецепторні білки - інсулінові рецептори і інші. Білки, що виконують спеціальні функції - високоваріабельні протеїни , наприклад, антифризові білки, які попереджають від замерзання кров арктичних і антарктичних риб, клейові білки, що сприяють надійному прикріпленню мідій та інших морських організмів до скель.

ОСНОВНІ ФУНКЦІЇ БІЛКІВ
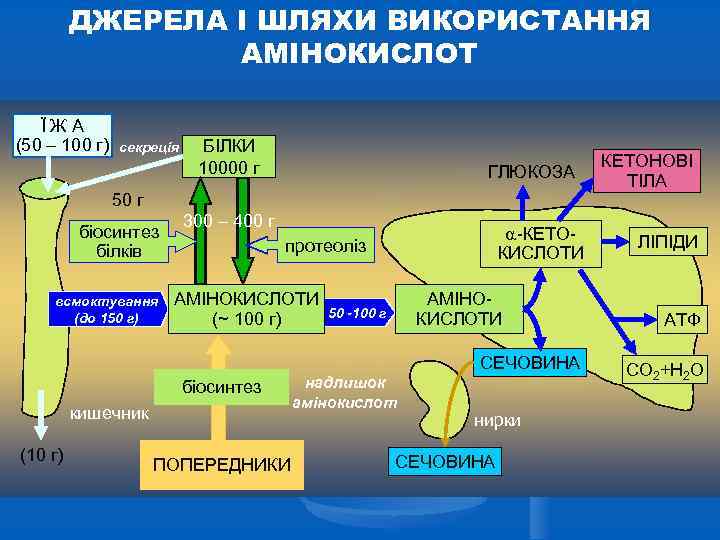
ДЖЕРЕЛА І ШЛЯХИ ВИКОРИСТАННЯ АМІНОКИСЛОТ ЇЖА (50 – 100 г) секреція БІЛКИ 10000 г ГЛЮКОЗА 50 г біосинтез білків всмоктування (до 150 г) 300 – 400 г -КЕТОКИСЛОТИ протеоліз АМІНОКИСЛОТИ (~ 100 г) АМІНОКИСЛОТИ 50 -100 г СЕЧОВИНА біосинтез кишечник (10 г) ПОПЕРЕДНИКИ надлишок амінокислот нирки СЕЧОВИНА КЕТОНОВІ ТІЛА ЛІПІДИ АТФ СО 2+Н 2 О
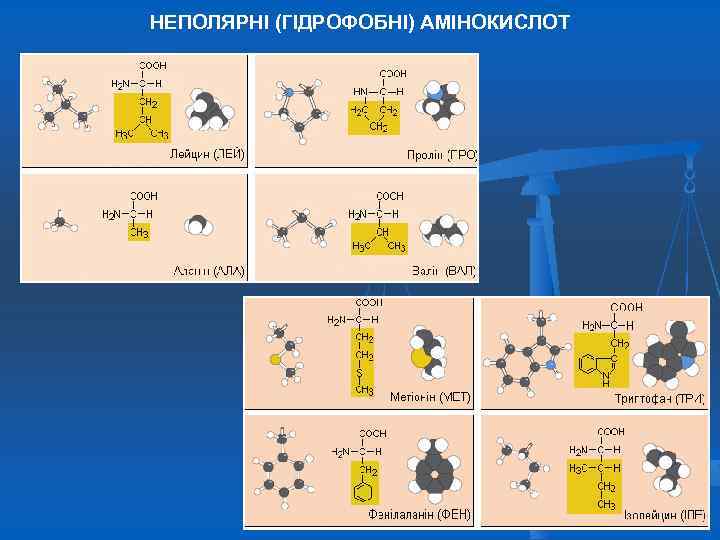
НЕПОЛЯРНІ (ГІДРОФОБНІ) АМІНОКИСЛОТ
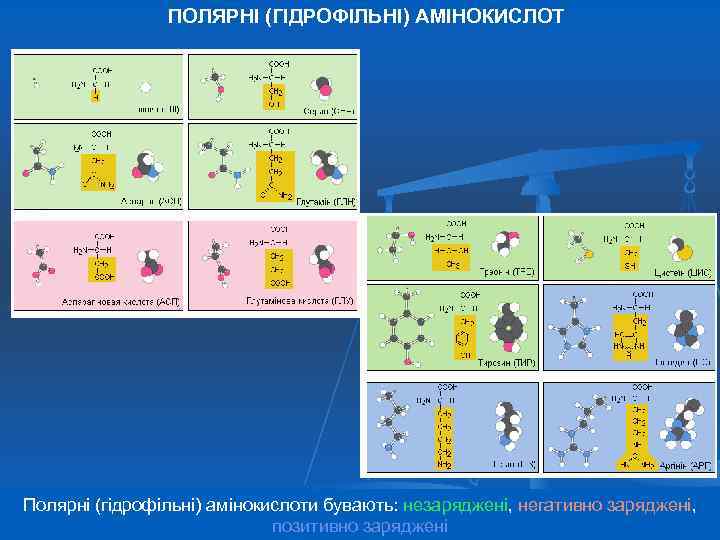
ПОЛЯРНІ (ГІДРОФІЛЬНІ) АМІНОКИСЛОТ Полярні (гідрофільні) амінокислоти бувають: незаряджені, негативно заряджені, позитивно заряджені
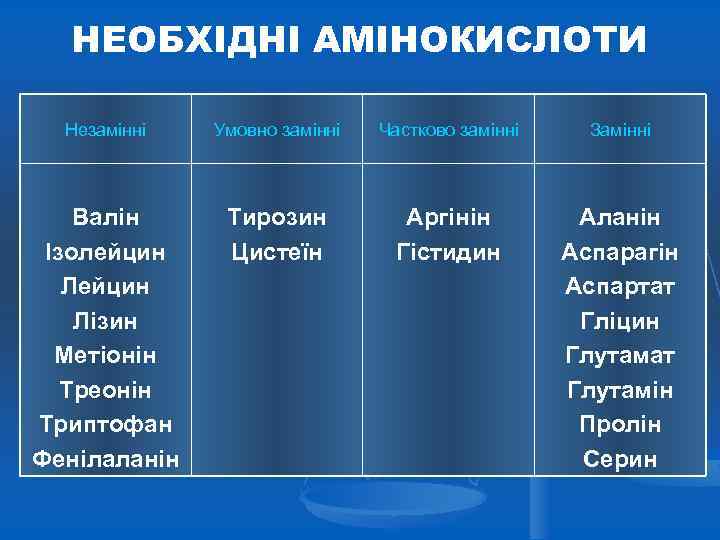
НЕОБХІДНІ АМІНОКИСЛОТИ Незамінні Умовно замінні Частково замінні Замінні Валін Ізолейцин Лізин Метіонін Треонін Триптофан Фенілаланін Тирозин Цистеїн Аргінін Гістидин Аланін Аспарагін Аспартат Гліцин Глутамат Глутамін Пролін Серин
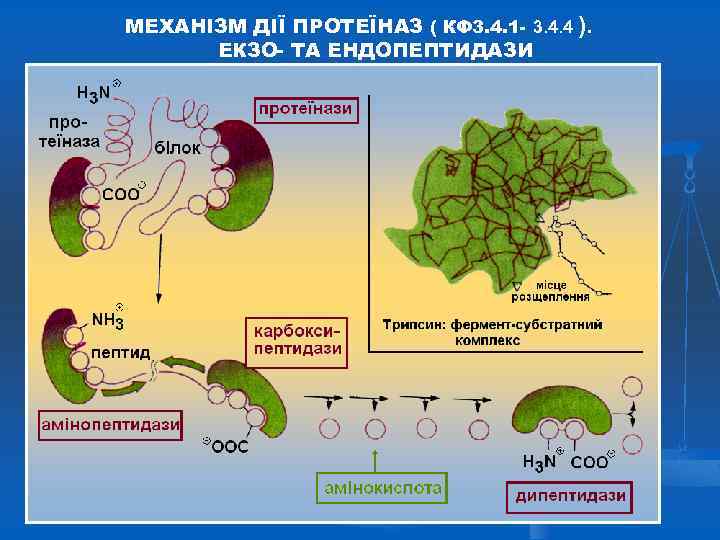
МЕХАНІЗМ ДІЇ ПРОТЕЇНАЗ ( КФ 3. 4. 1 - 3. 4. 4 ). ЕКЗО- ТА ЕНДОПЕПТИДАЗИ
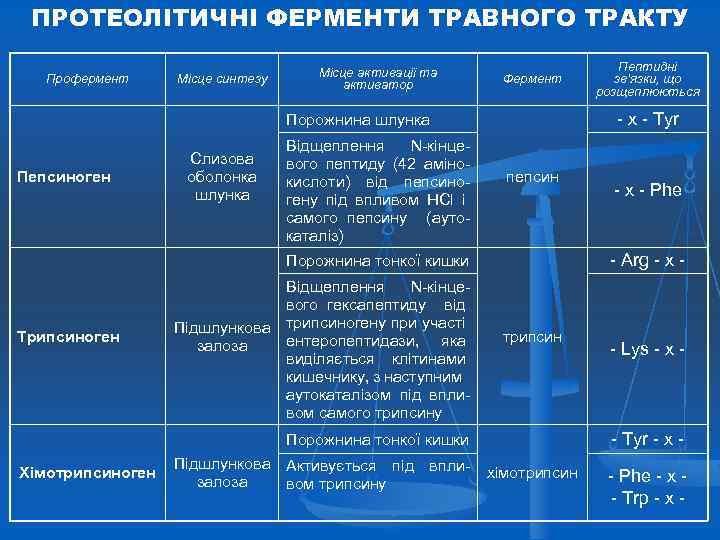
ПРОТЕОЛІТИЧНІ ФЕРМЕНТИ ТРАВНОГО ТРАКТУ Профермент Місце синтезу Місце активації та активатор Фермент - х - Туr Порожнина шлунка Пепсиноген Слизова оболонка шлунка Відщеплення N-кінцевого пептиду (42 амінокислоти) від пепсиногену під впливом НСl і самого пепсину (аутокаталіз) пепсин Трипсиноген трипсин Підшлункова Активується під вплизалоза вом трипсину - Lys - x - - Tyr - x - Порожнина тонкої кишки Хімотрипсиноген - х - Рhе - Arg - x - Порожнина тонкої кишки Відщеплення N-кінцевого гексапептиду від Підшлункова трипсиногену при участі ентеропептидази, яка залоза виділяється клітинами кишечнику, з наступним аутокаталізом під впливом самого трипсину Пептидні зв’язки, що розщеплюються хімотрипсин - Phe - x - Trp - x -
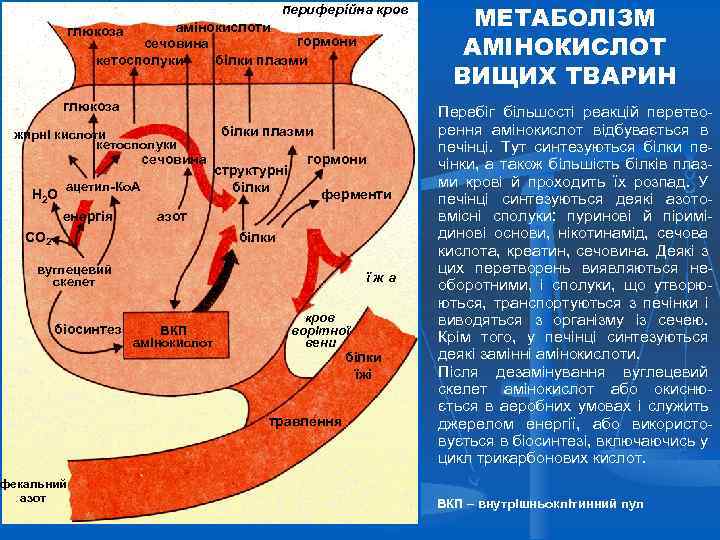
периферійна кров амінокислоти гормони сечовина кетосполуки білки плазми глюкоза жирні кислоти кетосполуки сечовина Н 2 О ацетил-Ко. А енергія білки плазми структурні білки гормони ферменти азот СО 2 білки вуглецевий скелет біосинтез фекальний азот їжа ВКП амінокислот кров ворітної вени білки їжі травлення МЕТАБОЛІЗМ АМІНОКИСЛОТ ВИЩИХ ТВАРИН Перебіг більшості реакцій перетворення амінокислот відбувається в печінці. Тут синтезуються білки печінки, а також більшість білків плазми крові й проходить їх розпад. У печінці синтезуються деякі азотовмісні сполуки: пуринові й піримідинові основи, нікотинамід, сечова кислота, креатин, сечовина. Деякі з цих перетворень виявляються необоротними, і сполуки, що утворюються, транспортуються з печінки і виводяться з організму із сечею. Крім того, у печінці синтезуються деякі замінні амінокислоти. Після дезамінування вуглецевий скелет амінокислот або окиснюється в аеробних умовах і служить джерелом енергії, або використовується в біосинтезі, включаючись у цикл трикарбонових кислот. ВКП – внутрішньоклітинний пул
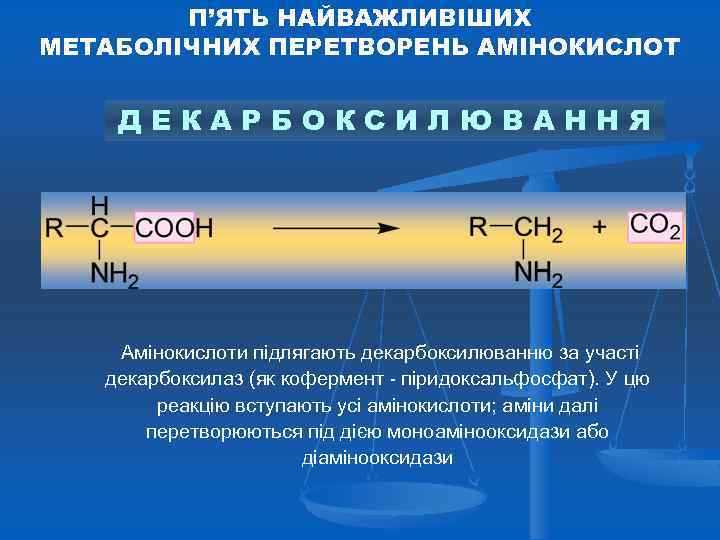
П’ЯТЬ НАЙВАЖЛИВІШИХ МЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ ДЕКАРБОКСИЛЮВАННЯ Амінокислоти підлягають декарбоксилюванню за участі декарбоксилаз (як кофермент - піридоксальфосфат). У цю реакцію вступають усі амінокислоти; аміни далі перетворюються під дією моноамінооксидази або діамінооксидази
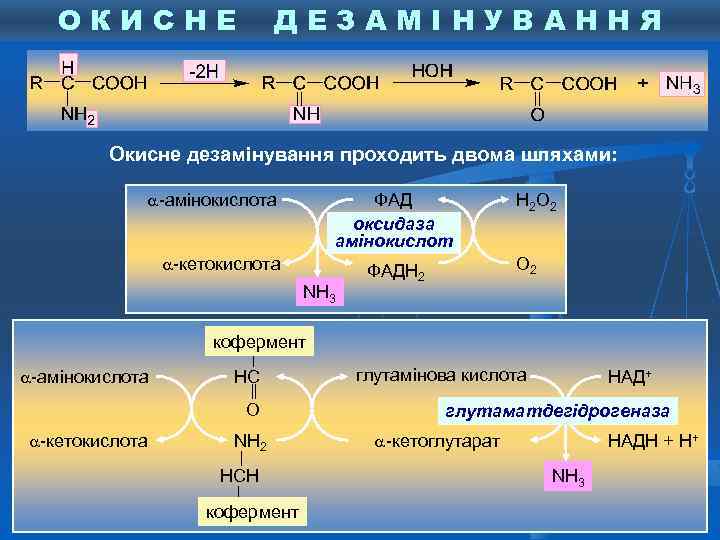
ОКИСНЕ ДЕЗАМІНУВАННЯ Окисне дезамінування проходить двома шляхами: -амінокислота ФАД оксидаза амінокислот -кетокислота NH 3 Н 2 О 2 ФАДН 2 кофермент -амінокислота НС О -кетокислота NН 2 НСН кофермент глутамінова кислота НАД+ глутаматдегідрогеназа -кетоглутарат НАДН + Н+ NH 3

ТРАНСАМІНУВАННЯ ( ПЕРЕАМІНУВАННЯ ) Трансамінування – це основна біосинтетична реакція замінних амінокислот за участі амінотрансфераз (трансаміназ) у присутності коферменту, роль якого виконує піридоксальфосфат. Реакція міжмолекулярного переносу аміногрупи від α амінокислоти на α-кетокислоту. Переаміновуються головним чином глутамінова кислота, аспарагінова кислота і в деяких випадках аспарагін та аланін. Проте цей процес може відбуватися і за участю інших амінокислот.
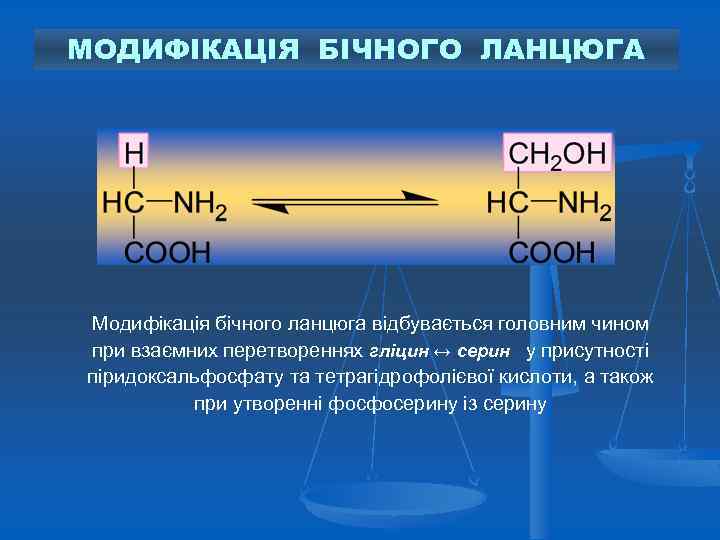
МОДИФІКАЦІЯ БІЧНОГО ЛАНЦЮГА Модифікація бічного ланцюга відбувається головним чином при взаємних перетвореннях гліцин ↔ серин у присутності піридоксальфосфату та тетрагідрофолієвої кислоти, а також при утворенні фосфосерину із серину

ПОЛІМЕРИЗАЦІЯ Пептидні ланцюги (три-, тетра-, пента-, оліго- та поліпептиди) виникають за рахунок полімеризації амінокислот

Біосинтез окремих амінокислот Функціонування біосинтетичних процесів пов'язано з так званими родинами (5). 1. Родина глутамату – синтез власне глутамату, проліну, аргініну, аспартату і аспарагіну. 2. Родина аспартату – синтез власне аспартату , аспарагіну, треоніну, метіоніну, лізину, ізолейцину. 3. Родина пірувату- синтез аланіну, валіну, лейцину, ізолейцину. 4. Родина серину- синтез серину, цистеїну, та гліцину. 5. Родина ароматичних амінокислот та гістидину – синтез триптофану, фенілаланіну , тирозину та гістидину,
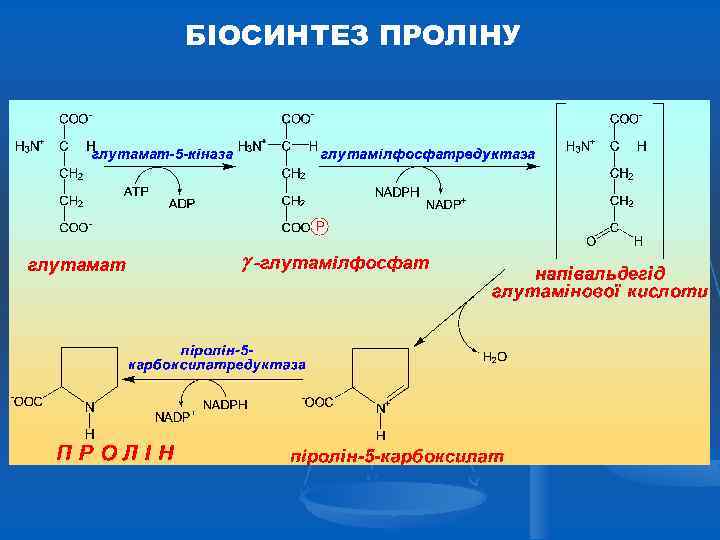
БІОСИНТЕЗ ПРОЛІНУ
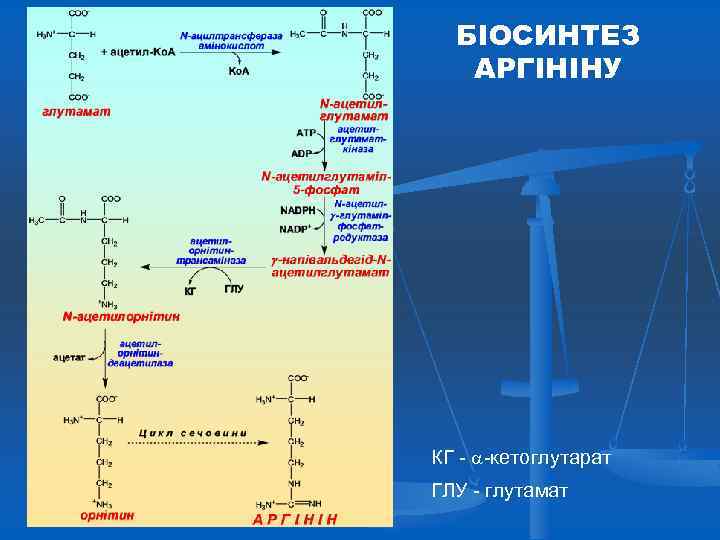
БІОСИНТЕЗ АРГІНІНУ КГ - -кетоглутарат ГЛУ - глутамат
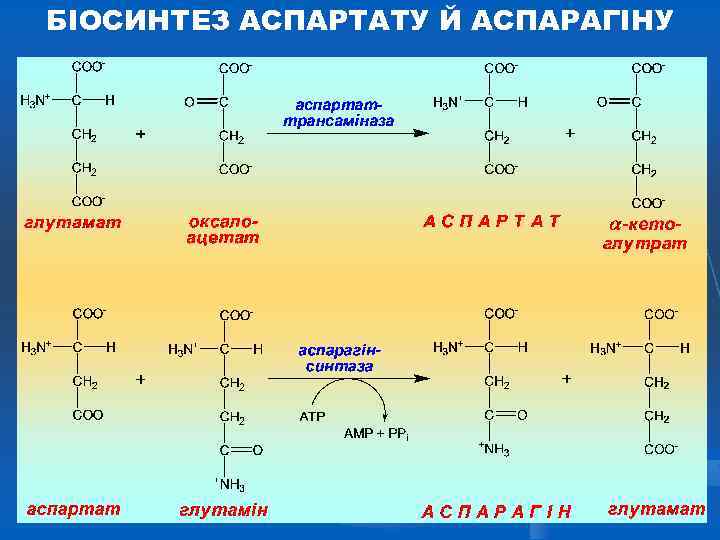
БІОСИНТЕЗ АСПАРТАТУ Й АСПАРАГІНУ
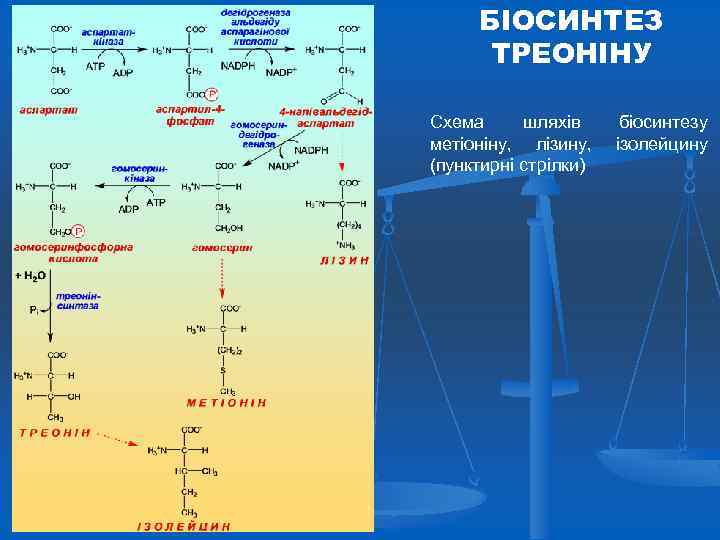
БІОСИНТЕЗ ТРЕОНІНУ Схема шляхів метіоніну, лізину, (пунктирні стрілки) біосинтезу ізолейцину
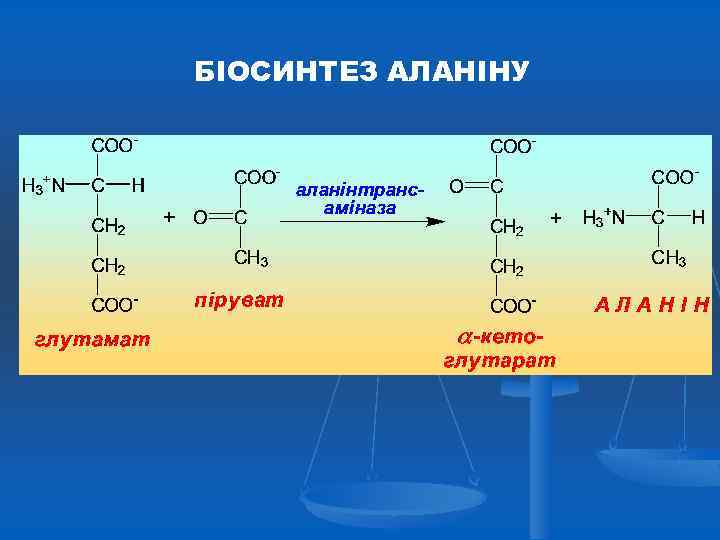
БІОСИНТЕЗ АЛАНІНУ
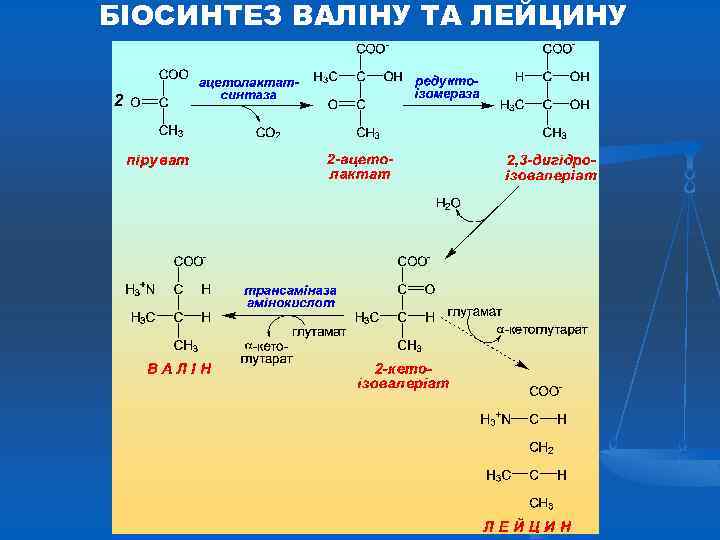
БІОСИНТЕЗ ВАЛІНУ ТА ЛЕЙЦИНУ
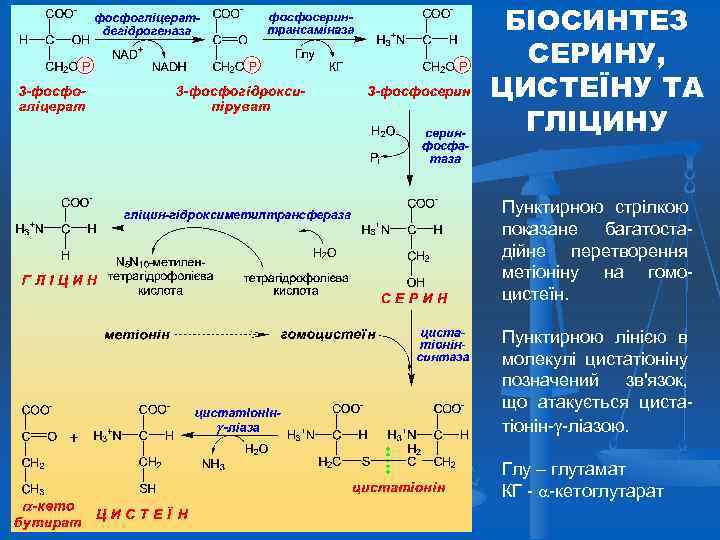
БІОСИНТЕЗ СЕРИНУ, ЦИСТЕЇНУ ТА ГЛІЦИНУ Пунктирною стрілкою показане багатостадійне перетворення метіоніну на гомоцистеїн. Пунктирною лінією в молекулі цистатіоніну позначений зв'язок, що атакується цистатіонін- -ліазою. Глу – глутамат КГ - -кетоглутарат
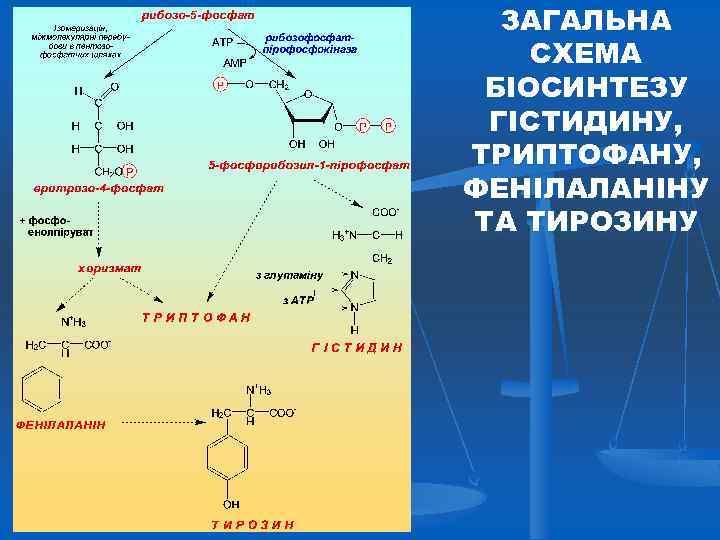
ЗАГАЛЬНА СХЕМА БІОСИНТЕЗУ ГІСТИДИНУ, ТРИПТОФАНУ, ФЕНІЛАЛАНІНУ ТА ТИРОЗИНУ
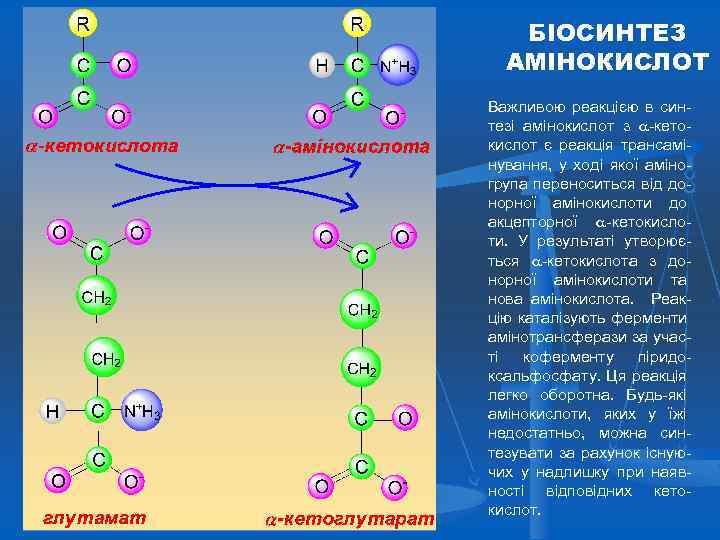
БІОСИНТЕЗ АМІНОКИСЛОТ Важливою реакцією в синтезі амінокислот з -кетокислот є реакція трансамінування, у ході якої аміногрупа переноситься від донорної амінокислоти до акцепторної -кетокислоти. У результаті утворюється -кетокислота з донорної амінокислоти та нова амінокислота. Реакцію каталізують ферменти амінотрансферази за участі коферменту піридоксальфосфату. Ця реакція легко оборотна. Будь-які амінокислоти, яких у їжі недостатньо, можна синтезувати за рахунок існуючих у надлишку при наявності відповідних кетокислот.
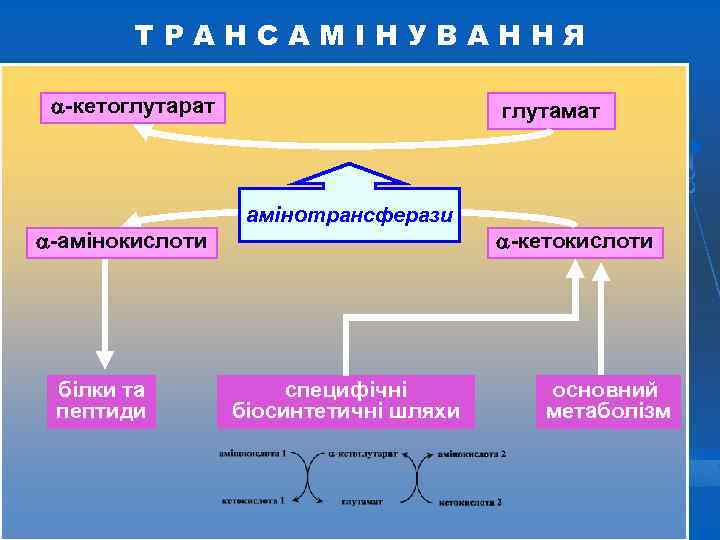
ТРАНСАМІНУВАННЯ -кетоглутарат -амінокислоти білки та пептиди глутамат амінотрансферази специфічні біосинтетичні шляхи -кетокислоти основний метаболізм
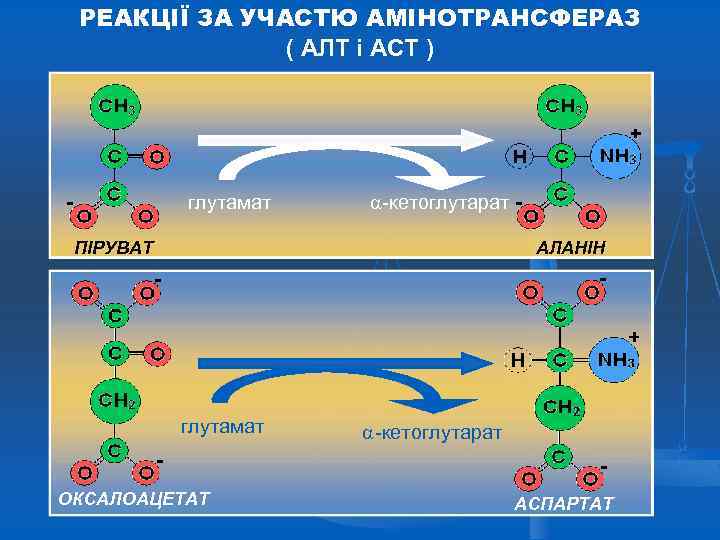
РЕАКЦІЇ ЗА УЧАСТЮ АМІНОТРАНСФЕРАЗ ( АЛТ і АСТ ) глутамат -кетоглутарат ПІРУВАТ АЛАНІН глутамат ОКСАЛОАЦЕТАТ -кетоглутарат АСПАРТАТ
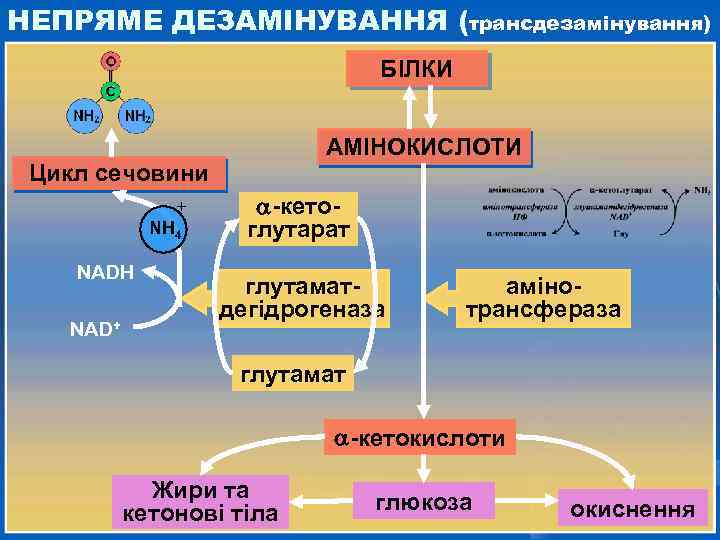
НЕПРЯМЕ ДЕЗАМІНУВАННЯ (трансдезамінування) БІЛКИ АМІНОКИСЛОТИ Цикл сечовини + NH 4 NADH NAD+ -кетоглутарат глутаматдегідрогеназа амінотрансфераза глутамат -кетокислоти Жири та кетонові тіла глюкоза окиснення
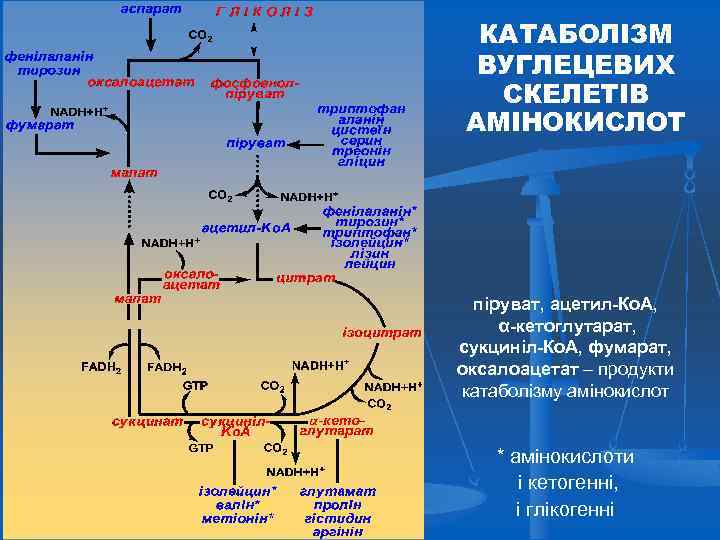
КАТАБОЛІЗМ ВУГЛЕЦЕВИХ СКЕЛЕТІВ АМІНОКИСЛОТ піруват, ацетил-Ко. А, α-кетоглутарат, сукциніл-Ко. А, фумарат, оксалоацетат – продукти катаболізму амінокислот * амінокислоти і кетогенні, і глікогенні
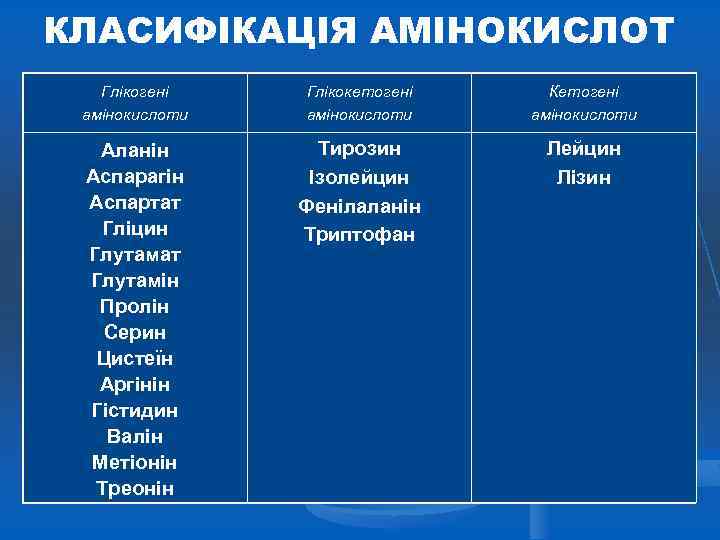
КЛАСИФІКАЦІЯ АМІНОКИСЛОТ Глікогені амінокислоти Глікокетогені амінокислоти Кетогені амінокислоти Аланін Аспарагін Аспартат Гліцин Глутамат Глутамін Пролін Серин Цистеїн Аргінін Гістидин Валін Метіонін Треонін Тирозин Ізолейцин Фенілаланін Триптофан Лейцин Лізин

Спадкові порушення катаболізму амінокислот 1. 2. 3. 4. 5. Фенілкетонурія. Тирозиноз. Алкаптонурія. Альбінізм. Хвороба Паркінсона.
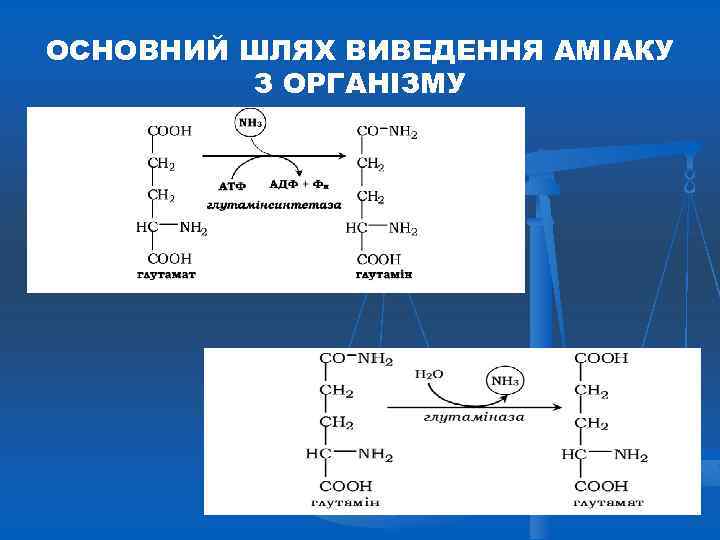
ОСНОВНИЙ ШЛЯХ ВИВЕДЕННЯ АМІАКУ З ОРГАНІЗМУ
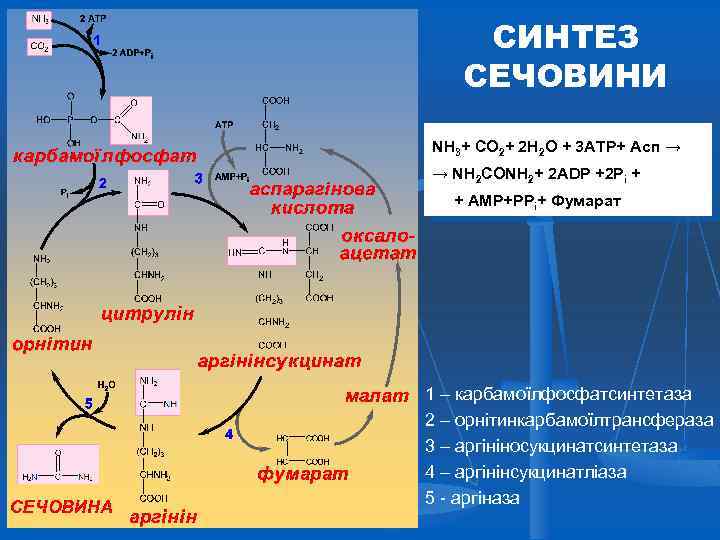
СИНТЕЗ СЕЧОВИНИ NH 3+ CO 2+ 2 H 2 O + 3 ATP+ Асп → → NH 2 CONH 2+ 2 ADP +2 Pi + + АМР+PPi+ Фумарат 1 – карбамоїлфосфатсинтетаза 2 – орнітинкарбамоїлтрансфераза 3 – аргініносукцинатсинтетаза 4 – аргінінсукцинатліаза 5 - аргіназа
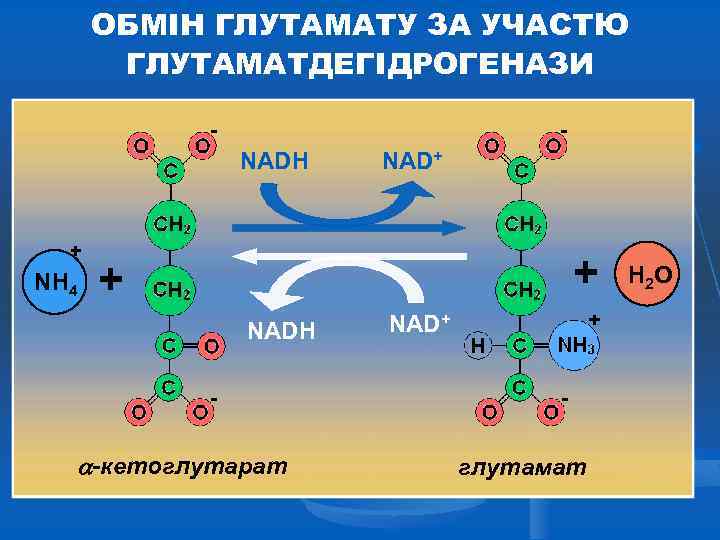
ОБМІН ГЛУТАМАТУ ЗА УЧАСТЮ ГЛУТАМАТДЕГІДРОГЕНАЗИ NADH + NH 4 NAD+ + + NADH -кетоглутарат NAD+ глутамат H 2 O
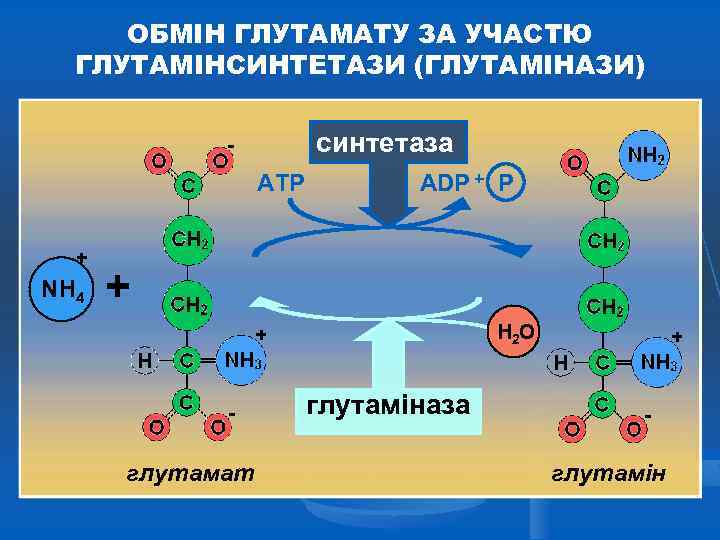
ОБМІН ГЛУТАМАТУ ЗА УЧАСТЮ ГЛУТАМІНСИНТЕТАЗИ (ГЛУТАМІНАЗИ) синтетаза АТР + NH 4 АDР + H 2 O глутаміназа глутамат глутамін
Tema_obmin_aminokyslot_2013.ppt