13 АО Гузь_Ижевск_финал.pptx
- Количество слайдов: 40
 Место таргетной терапии в лечении пациентов с местнораспространенным плоскоклеточным раком головы и шеи Гузь Александр Олегович Врач-онколог, заведующий отделением опухолей головы и шеи ГБУЗ Челябинский областной клинический онкологический диспансер Ижевск 2016
Место таргетной терапии в лечении пациентов с местнораспространенным плоскоклеточным раком головы и шеи Гузь Александр Олегович Врач-онколог, заведующий отделением опухолей головы и шеи ГБУЗ Челябинский областной клинический онкологический диспансер Ижевск 2016
 Раскрытие информации 1. Предоставленная презентация проводится при финансовой поддержке Merck Biopharma 2. Информация, предоставляемая лектором, не обязательно отражает мнение, идеи и взгляды Merck Biopharma
Раскрытие информации 1. Предоставленная презентация проводится при финансовой поддержке Merck Biopharma 2. Информация, предоставляемая лектором, не обязательно отражает мнение, идеи и взгляды Merck Biopharma
 Плоскоклеточный рак головы и шеи (ПРГШ), диагностированный на поздних стадиях, отличается высокой смертностью Заболеваемость ПРГШ* в Европе: 114 000 случаев в год 2 >90% случаев рака головы и шеи* являются плоскоклеточным раком 1 Общемировая заболеваемость ПРГШ*: 633 000 случаев в год 1 Заболеваемость ПРГШ* в России в 2014 г: 19 934 случаев 3 Случаи ПРГШ* составляют 5% от общего количества новых злокачественных новообразований во всем мире 1 Смертность от ПРГШ* в Европе: 57 000 случаев в год Смертность от ПРГШ* в России в 2014 г: 10 903 случаев 3 Общемировая смертность от ПРГШ*: 355 000 случаев в год 1 * Включая рак губы, ротовой полости, гортани, носоглотки и других отделов глотки 1. Ferlay J, et al. Int J Cancer 2010; 127: 2893– 2917 2. GLOBOCAN 2014 v 2. 0, Cancer Incidence and Mortality Worldwide: IARC Cancer. Base No. 10 [Internet]. Lyon, France: International Agency for Research on Cancer; 2014. Available from: http: //globocan. iarc. fr. Accessed on May 24. 3. Состояние онкологической помощи населению России в 201 5 году. под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. ФГБУ «МНИОИ им. П. А. Герцена» Минздрава России, Москва, 201 6 г.
Плоскоклеточный рак головы и шеи (ПРГШ), диагностированный на поздних стадиях, отличается высокой смертностью Заболеваемость ПРГШ* в Европе: 114 000 случаев в год 2 >90% случаев рака головы и шеи* являются плоскоклеточным раком 1 Общемировая заболеваемость ПРГШ*: 633 000 случаев в год 1 Заболеваемость ПРГШ* в России в 2014 г: 19 934 случаев 3 Случаи ПРГШ* составляют 5% от общего количества новых злокачественных новообразований во всем мире 1 Смертность от ПРГШ* в Европе: 57 000 случаев в год Смертность от ПРГШ* в России в 2014 г: 10 903 случаев 3 Общемировая смертность от ПРГШ*: 355 000 случаев в год 1 * Включая рак губы, ротовой полости, гортани, носоглотки и других отделов глотки 1. Ferlay J, et al. Int J Cancer 2010; 127: 2893– 2917 2. GLOBOCAN 2014 v 2. 0, Cancer Incidence and Mortality Worldwide: IARC Cancer. Base No. 10 [Internet]. Lyon, France: International Agency for Research on Cancer; 2014. Available from: http: //globocan. iarc. fr. Accessed on May 24. 3. Состояние онкологической помощи населению России в 201 5 году. под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. ФГБУ «МНИОИ им. П. А. Герцена» Минздрава России, Москва, 201 6 г.
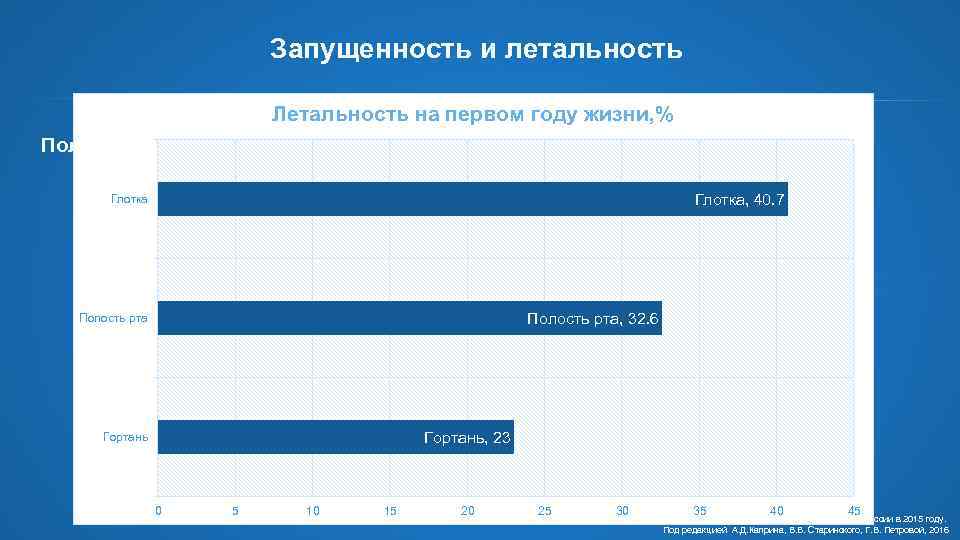 Запущенность и летальность Летальность на первом году жизни, % Полость рта Глотка Рак глотки I 11% IV 31% IV 44% II 27% I 13% II 27% III Гортань, 23 Гортань 42% 5 III 38% Гортань Полость рта, 32. 6 IV 18% 0 II 15% Глотка, 40. 7 III 32% Полость рта I 4% 10 15 20 25 30 35 40 45 Состояние онкологической помощи населению России в 2015 году. Под редакцией А. Д. Каприна, В. В. Старинского, Г. В. Петровой, 2016
Запущенность и летальность Летальность на первом году жизни, % Полость рта Глотка Рак глотки I 11% IV 31% IV 44% II 27% I 13% II 27% III Гортань, 23 Гортань 42% 5 III 38% Гортань Полость рта, 32. 6 IV 18% 0 II 15% Глотка, 40. 7 III 32% Полость рта I 4% 10 15 20 25 30 35 40 45 Состояние онкологической помощи населению России в 2015 году. Под редакцией А. Д. Каприна, В. В. Старинского, Г. В. Петровой, 2016
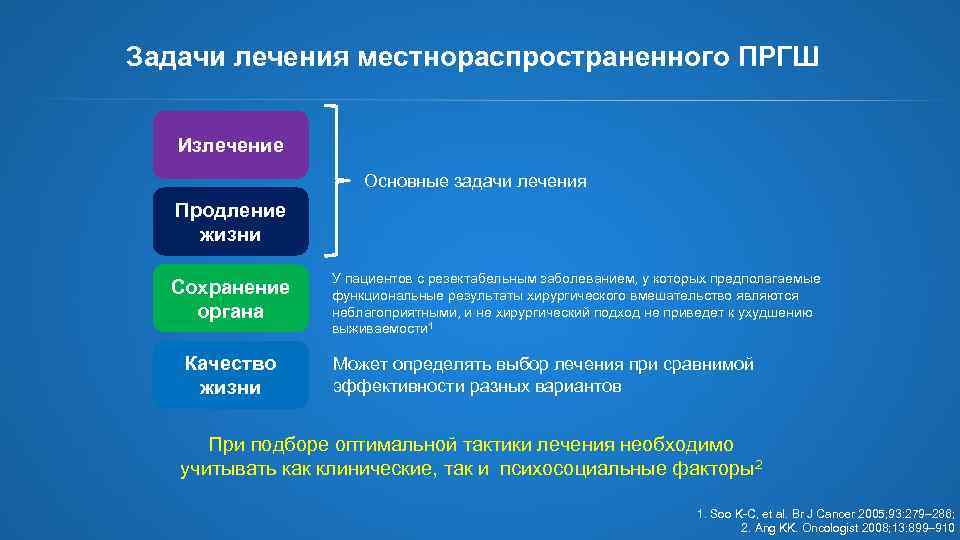 Задачи лечения местнораспространенного ПРГШ Излечение Основные задачи лечения Продление жизни Сохранение органа Качество жизни У пациентов с резектабельным заболеванием, у которых предполагаемые функциональные результаты хирургического вмешательство являются неблагоприятными, и не хирургический подход не приведет к ухудшению выживаемости 1 Может определять выбор лечения при сравнимой эффективности разных вариантов При подборе оптимальной тактики лечения необходимо учитывать как клинические, так и психосоциальные факторы2 1. Soo K-C, et al. Br J Cancer 2005; 93: 279– 286; 2. Ang KK. Oncologist 2008; 13: 899– 910
Задачи лечения местнораспространенного ПРГШ Излечение Основные задачи лечения Продление жизни Сохранение органа Качество жизни У пациентов с резектабельным заболеванием, у которых предполагаемые функциональные результаты хирургического вмешательство являются неблагоприятными, и не хирургический подход не приведет к ухудшению выживаемости 1 Может определять выбор лечения при сравнимой эффективности разных вариантов При подборе оптимальной тактики лечения необходимо учитывать как клинические, так и психосоциальные факторы2 1. Soo K-C, et al. Br J Cancer 2005; 93: 279– 286; 2. Ang KK. Oncologist 2008; 13: 899– 910
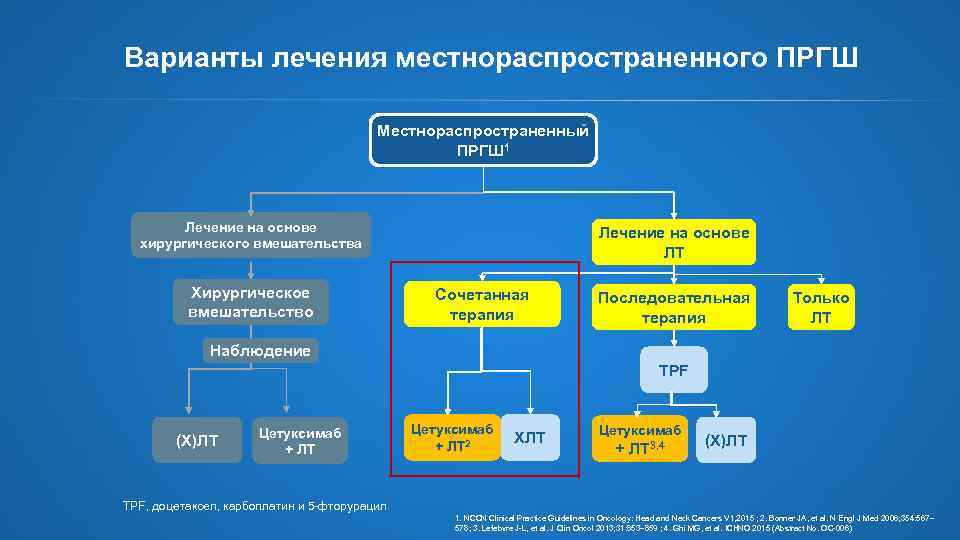 Варианты лечения местнораспространенного ПРГШ Местнораспространенный ПРГШ 1 Лечение на основе хирургического вмешательства Хирургическое вмешательство Лечение на основе ЛТ Сочетанная терапия Последовательная терапия Только ЛТ Наблюдение TPF (Х)ЛТ Цетуксимаб + ЛТ Цетуксимаб ХЛТ + ЛТ 2 Цетуксимаб + ЛТ 3, 4 (Х)ЛТ TPF, доцетаксел, карбоплатин и 5 -фторурацил 1. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1, 2015 ; 2. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 3. Lefebvre J-L, et al. J Clin Oncol 2013; 31: 853– 859 ; 4. Ghi MG, et al. ICHNO 2015 (Abstract No. OC-006)
Варианты лечения местнораспространенного ПРГШ Местнораспространенный ПРГШ 1 Лечение на основе хирургического вмешательства Хирургическое вмешательство Лечение на основе ЛТ Сочетанная терапия Последовательная терапия Только ЛТ Наблюдение TPF (Х)ЛТ Цетуксимаб + ЛТ Цетуксимаб ХЛТ + ЛТ 2 Цетуксимаб + ЛТ 3, 4 (Х)ЛТ TPF, доцетаксел, карбоплатин и 5 -фторурацил 1. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1, 2015 ; 2. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 3. Lefebvre J-L, et al. J Clin Oncol 2013; 31: 853– 859 ; 4. Ghi MG, et al. ICHNO 2015 (Abstract No. OC-006)
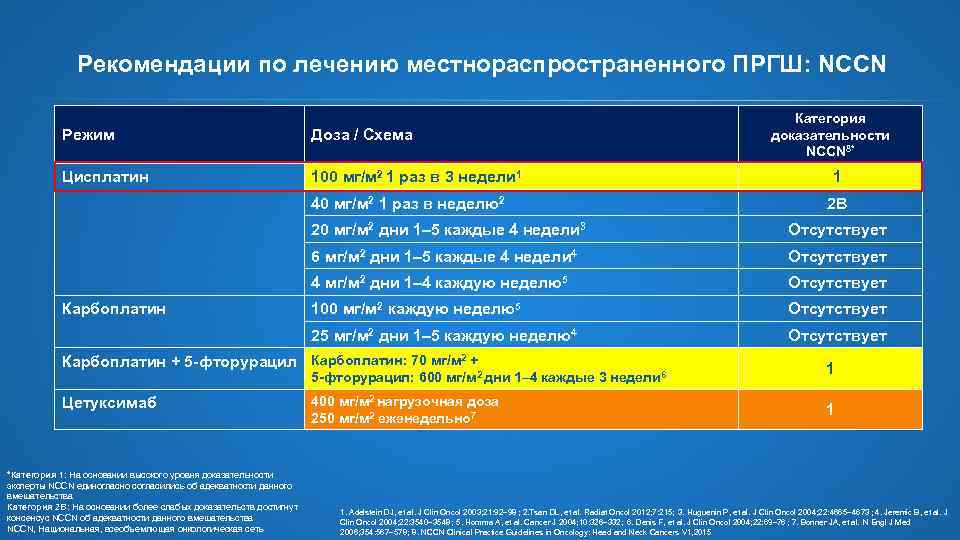 Рекомендации по лечению местнораспространенного ПРГШ: NCCN Режим Доза / Схема Цисплатин 100 мг/м 2 1 раз в 3 недели 1 40 мг/м 2 1 раз в неделю2 Категория доказательности NCCN 8* 1 2 B 20 мг/м 2 дни 1– 5 каждые 4 недели 3 6 мг/м 2 дни 1– 5 каждые 4 недели 4 Отсутствует 4 мг/м 2 дни 1– 4 каждую неделю5 Отсутствует 100 мг/м 2 каждую неделю5 Отсутствует 25 мг/м 2 дни 1– 5 каждую неделю4 Карбоплатин Отсутствует Карбоплатин + 5 -фторурацил Карбоплатин: 70 мг/м 2 + 5 -фторурацил: 600 мг/м 2 дни 1– 4 каждые 3 недели 6 Цетуксимаб *Категория 1: На основании высокого уровня доказательности эксперты NCCN единогласно согласились об адекватности данного вмешательства Категория 2 B: На основании более слабых доказательств достигнут консенсус NCCN об адекватности данного вмешательства NCCN, Национальная, всеобъемлющая онкологическая сеть 400 мг/м 2 нагрузочная доза 250 мг/м 2 еженедельно 7 1 1 1. Adelstein DJ, et al. J Clin Oncol 2003; 21: 92– 98 ; 2. Tsan DL, et al. Radiat Oncol 2012; 7: 215; 3. Huguenin P, et al. J Clin Oncol 2004; 22: 4665– 4673 ; 4. Jeremic B, et al. J Clin Oncol 2004; 22: 3540– 3548; 5. Homma A, et al. Cancer J 2004; 10: 326– 332; 6. Denis F, et al. J Clin Oncol 2004; 22: 69– 76 ; 7. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 8. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1, 2015
Рекомендации по лечению местнораспространенного ПРГШ: NCCN Режим Доза / Схема Цисплатин 100 мг/м 2 1 раз в 3 недели 1 40 мг/м 2 1 раз в неделю2 Категория доказательности NCCN 8* 1 2 B 20 мг/м 2 дни 1– 5 каждые 4 недели 3 6 мг/м 2 дни 1– 5 каждые 4 недели 4 Отсутствует 4 мг/м 2 дни 1– 4 каждую неделю5 Отсутствует 100 мг/м 2 каждую неделю5 Отсутствует 25 мг/м 2 дни 1– 5 каждую неделю4 Карбоплатин Отсутствует Карбоплатин + 5 -фторурацил Карбоплатин: 70 мг/м 2 + 5 -фторурацил: 600 мг/м 2 дни 1– 4 каждые 3 недели 6 Цетуксимаб *Категория 1: На основании высокого уровня доказательности эксперты NCCN единогласно согласились об адекватности данного вмешательства Категория 2 B: На основании более слабых доказательств достигнут консенсус NCCN об адекватности данного вмешательства NCCN, Национальная, всеобъемлющая онкологическая сеть 400 мг/м 2 нагрузочная доза 250 мг/м 2 еженедельно 7 1 1 1. Adelstein DJ, et al. J Clin Oncol 2003; 21: 92– 98 ; 2. Tsan DL, et al. Radiat Oncol 2012; 7: 215; 3. Huguenin P, et al. J Clin Oncol 2004; 22: 4665– 4673 ; 4. Jeremic B, et al. J Clin Oncol 2004; 22: 3540– 3548; 5. Homma A, et al. Cancer J 2004; 10: 326– 332; 6. Denis F, et al. J Clin Oncol 2004; 22: 69– 76 ; 7. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 8. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1, 2015
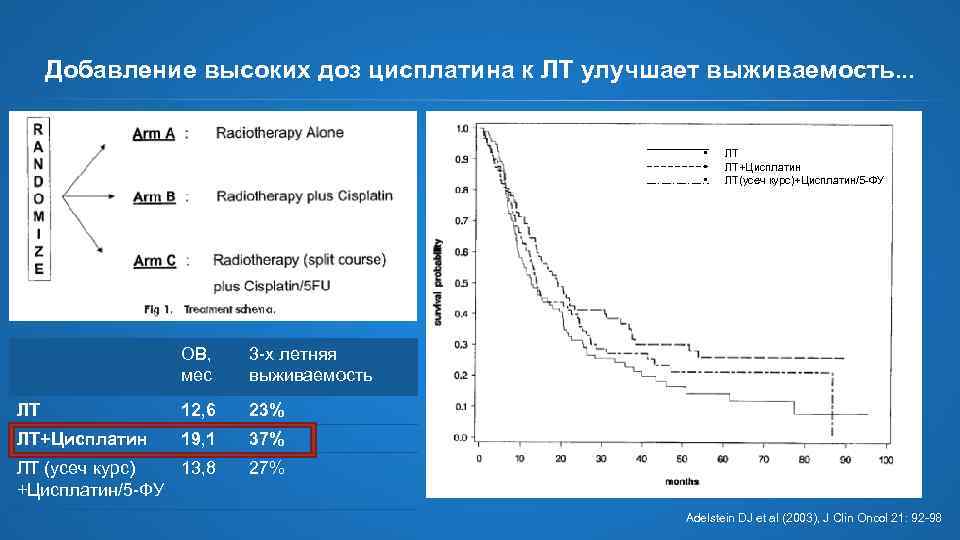 Добавление высоких доз цисплатина к ЛТ улучшает выживаемость. . . • • • ОВ, мес 3 -х летняя выживаемость ЛТ 12, 6 23% ЛТ+Цисплатин 19, 1 37% ЛТ (усеч курс) 13, 8 +Цисплатин/5 -ФУ ЛТ ЛТ+Цисплатин ЛТ(усеч курс)+Цисплатин/5 -ФУ 27% Adelstein DJ et al (2003), J Clin Oncol 21: 92 -98
Добавление высоких доз цисплатина к ЛТ улучшает выживаемость. . . • • • ОВ, мес 3 -х летняя выживаемость ЛТ 12, 6 23% ЛТ+Цисплатин 19, 1 37% ЛТ (усеч курс) 13, 8 +Цисплатин/5 -ФУ ЛТ ЛТ+Цисплатин ЛТ(усеч курс)+Цисплатин/5 -ФУ 27% Adelstein DJ et al (2003), J Clin Oncol 21: 92 -98
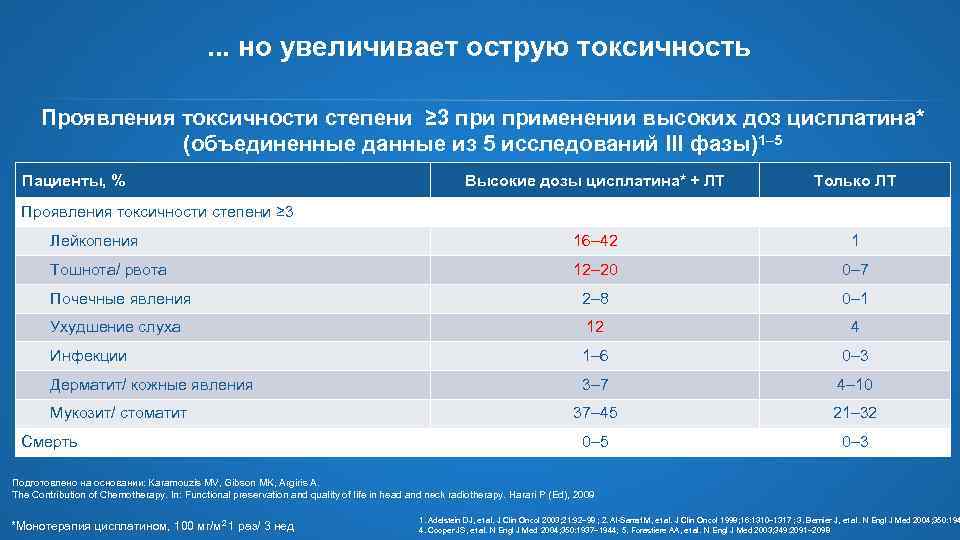 . . . но увеличивает острую токсичность Проявления токсичности степени ≥ 3 применении высоких доз цисплатина* (объединенные данные из 5 исследований III фазы)1– 5 Пациенты, % Высокие дозы цисплатина* + ЛТ Только ЛТ Лейкопения 16– 42 1 Тошнота/ рвота 12– 20 0– 7 Почечные явления 2– 8 0– 1 Ухудшение слуха 12 4 Инфекции 1– 6 0– 3 Дерматит/ кожные явления 3– 7 4– 10 37– 45 21– 32 0– 5 0– 3 Проявления токсичности степени ≥ 3 Мукозит/ стоматит Смерть Подготовлено на основании: Karamouzis MV, Gibson MK, Argiris A. The Contribution of Chemotherapy. In: Functional preservation and quality of life in head and neck radiotherapy. Harari P (Ed), 2009 *Монотерапия цисплатином, 100 мг/м 2 1 раз/ 3 нед 1. Adelstein DJ, et al. J Clin Oncol 2003; 21: 92– 98 ; 2. Al-Sarraf M, et al. J Clin Oncol 1998; 16: 1310– 1317 ; 3. Bernier J, et al. N Engl J Med 2004; 350: 194 4. Cooper JS, et al. N Engl J Med 2004; 350: 1937– 1944; 5. Forastiere AA, et al. N Engl J Med 2003; 349: 2091– 2098
. . . но увеличивает острую токсичность Проявления токсичности степени ≥ 3 применении высоких доз цисплатина* (объединенные данные из 5 исследований III фазы)1– 5 Пациенты, % Высокие дозы цисплатина* + ЛТ Только ЛТ Лейкопения 16– 42 1 Тошнота/ рвота 12– 20 0– 7 Почечные явления 2– 8 0– 1 Ухудшение слуха 12 4 Инфекции 1– 6 0– 3 Дерматит/ кожные явления 3– 7 4– 10 37– 45 21– 32 0– 5 0– 3 Проявления токсичности степени ≥ 3 Мукозит/ стоматит Смерть Подготовлено на основании: Karamouzis MV, Gibson MK, Argiris A. The Contribution of Chemotherapy. In: Functional preservation and quality of life in head and neck radiotherapy. Harari P (Ed), 2009 *Монотерапия цисплатином, 100 мг/м 2 1 раз/ 3 нед 1. Adelstein DJ, et al. J Clin Oncol 2003; 21: 92– 98 ; 2. Al-Sarraf M, et al. J Clin Oncol 1998; 16: 1310– 1317 ; 3. Bernier J, et al. N Engl J Med 2004; 350: 194 4. Cooper JS, et al. N Engl J Med 2004; 350: 1937– 1944; 5. Forastiere AA, et al. N Engl J Med 2003; 349: 2091– 2098
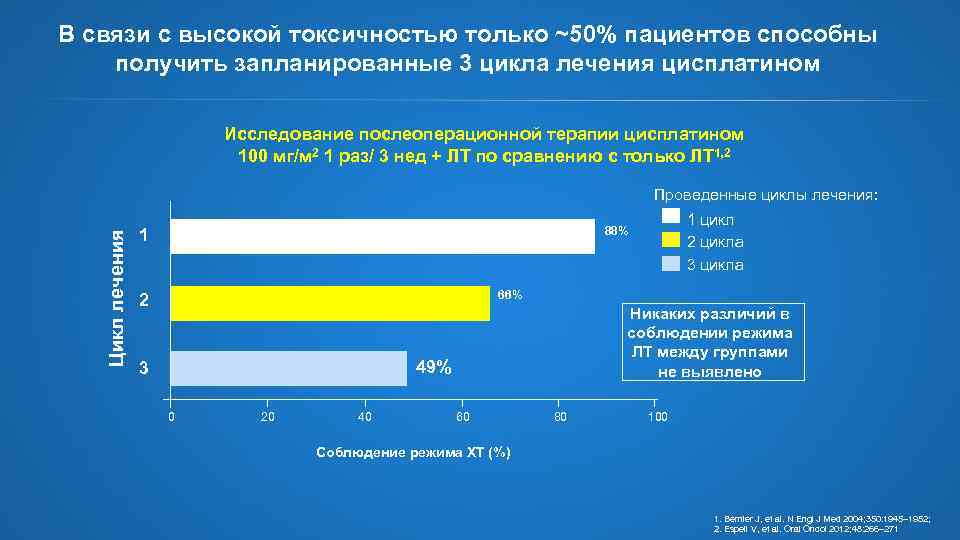 В связи с высокой токсичностью только ~50% пациентов способны получить запланированные 3 цикла лечения цисплатином Исследование послеоперационной терапии цисплатином 100 мг/м 2 1 раз/ 3 нед + ЛТ по сравнению с только ЛТ 1, 2 Цикл лечения Проведенные циклы лечения: 1 цикл 2 цикла 3 цикла 88% 1 66% 2 Никаких различий в соблюдении режима ЛТ между группами не выявлено 49% 3 0 20 40 60 80 100 Соблюдение режима ХТ (%) 1. Bernier J, et al. N Engl J Med 2004; 350: 1945– 1952; 2. Espeli V, et al. Oral Oncol 2012; 48: 266– 271
В связи с высокой токсичностью только ~50% пациентов способны получить запланированные 3 цикла лечения цисплатином Исследование послеоперационной терапии цисплатином 100 мг/м 2 1 раз/ 3 нед + ЛТ по сравнению с только ЛТ 1, 2 Цикл лечения Проведенные циклы лечения: 1 цикл 2 цикла 3 цикла 88% 1 66% 2 Никаких различий в соблюдении режима ЛТ между группами не выявлено 49% 3 0 20 40 60 80 100 Соблюдение режима ХТ (%) 1. Bernier J, et al. N Engl J Med 2004; 350: 1945– 1952; 2. Espeli V, et al. Oral Oncol 2012; 48: 266– 271
 На возможность применения высоких доз цисплатина влияет множество факторов, связанных с состоянием самих пациентов Критерии пациента • Возраст > 70 лет1, 2 • Потеря веса > 20%2 • Курение 3, 4 • В анамнезе употребление нефротоксичных препаратов 2 • ECOG > 12 • Отсутствие социальной и домашней поддержки/ухода 2 Сопутствующая патология • Дисфункция почек: клиренс креатинина менее 60 мл/мин 2, 3 • Снижение слуха 2 • Печеночная/дыхательная недостаточность2 • Неврологические расстройства 2 • Сердечно-сосудистые заболевания 2 • ВИЧ/СПИД (3 стадия, снижение CD клеток менее 350)2 1. Machtay M, et al. J Clin Oncol 2008; 26: 3582– 3589; 2. Ahn MJ, Oral Oncol 2016; 53: 10– 16; 3. Miller RP, et al. Toxins 2010; 2: 2490– 2518; 4. Galloway T, et al. Available at: http: //www. uptodate. com/contents/management-oflate- complications-of-head-and-neck-cancer-and-its-treatment. Last accessed February 2016
На возможность применения высоких доз цисплатина влияет множество факторов, связанных с состоянием самих пациентов Критерии пациента • Возраст > 70 лет1, 2 • Потеря веса > 20%2 • Курение 3, 4 • В анамнезе употребление нефротоксичных препаратов 2 • ECOG > 12 • Отсутствие социальной и домашней поддержки/ухода 2 Сопутствующая патология • Дисфункция почек: клиренс креатинина менее 60 мл/мин 2, 3 • Снижение слуха 2 • Печеночная/дыхательная недостаточность2 • Неврологические расстройства 2 • Сердечно-сосудистые заболевания 2 • ВИЧ/СПИД (3 стадия, снижение CD клеток менее 350)2 1. Machtay M, et al. J Clin Oncol 2008; 26: 3582– 3589; 2. Ahn MJ, Oral Oncol 2016; 53: 10– 16; 3. Miller RP, et al. Toxins 2010; 2: 2490– 2518; 4. Galloway T, et al. Available at: http: //www. uptodate. com/contents/management-oflate- complications-of-head-and-neck-cancer-and-its-treatment. Last accessed February 2016
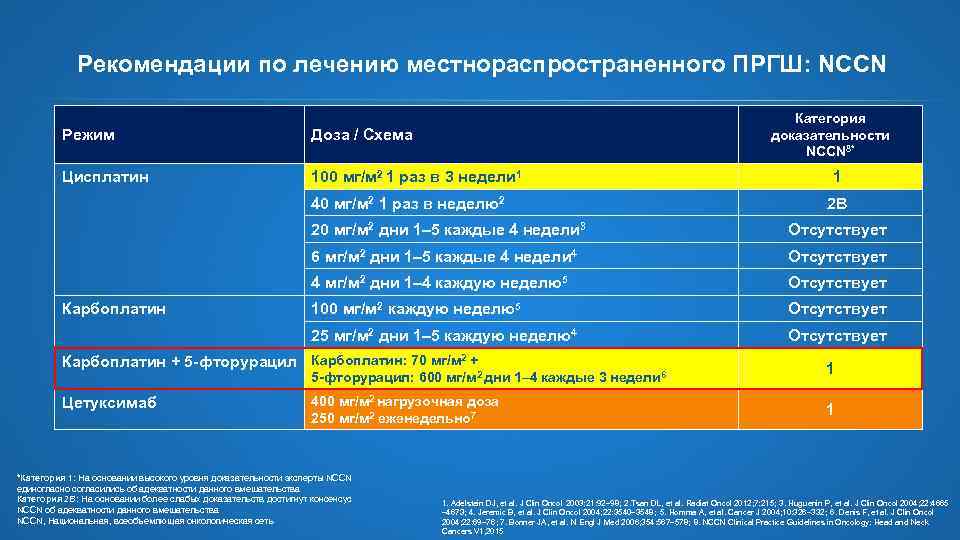 Рекомендации по лечению местнораспространенного ПРГШ: NCCN Категория доказательности NCCN 8* Режим Доза / Схема Цисплатин 100 мг/м 2 1 раз в 3 недели 1 40 мг/м 2 1 раз в неделю2 1 2 B 20 мг/м 2 дни 1– 5 каждые 4 недели 3 6 мг/м 2 дни 1– 5 каждые 4 недели 4 Отсутствует 4 мг/м 2 дни 1– 4 каждую неделю5 Отсутствует 100 мг/м 2 каждую неделю5 Отсутствует 25 мг/м 2 дни 1– 5 каждую неделю4 Карбоплатин Отсутствует Карбоплатин + 5 -фторурацил Карбоплатин: 70 мг/м 2 + 5 -фторурацил: 600 мг/м 2 дни 1– 4 каждые 3 недели 6 Цетуксимаб 400 мг/м 2 нагрузочная доза 250 мг/м 2 еженедельно 7 *Категория 1: На основании высокого уровня доказательности эксперты NCCN единогласно согласились об адекватности данного вмешательства Категория 2 B: На основании более слабых доказательств достигнут консенсус NCCN об адекватности данного вмешательства NCCN, Национальная, всеобъемлющая онкологическая сеть 1 1 1. Adelstein DJ, et al. J Clin Oncol 2003; 21: 92– 98; 2. Tsan DL, et al. Radiat Oncol 2012; 7: 215; 3. Huguenin P, et al. J Clin Oncol 2004; 22: 4665 – 4673; 4. Jeremic B, et al. J Clin Oncol 2004; 22: 3540– 3548; 5. Homma A, et al. Cancer J 2004; 10: 326– 332; 6. Denis F, et al. J Clin Oncol 2004; 22: 69– 76; 7. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 8. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1, 2015
Рекомендации по лечению местнораспространенного ПРГШ: NCCN Категория доказательности NCCN 8* Режим Доза / Схема Цисплатин 100 мг/м 2 1 раз в 3 недели 1 40 мг/м 2 1 раз в неделю2 1 2 B 20 мг/м 2 дни 1– 5 каждые 4 недели 3 6 мг/м 2 дни 1– 5 каждые 4 недели 4 Отсутствует 4 мг/м 2 дни 1– 4 каждую неделю5 Отсутствует 100 мг/м 2 каждую неделю5 Отсутствует 25 мг/м 2 дни 1– 5 каждую неделю4 Карбоплатин Отсутствует Карбоплатин + 5 -фторурацил Карбоплатин: 70 мг/м 2 + 5 -фторурацил: 600 мг/м 2 дни 1– 4 каждые 3 недели 6 Цетуксимаб 400 мг/м 2 нагрузочная доза 250 мг/м 2 еженедельно 7 *Категория 1: На основании высокого уровня доказательности эксперты NCCN единогласно согласились об адекватности данного вмешательства Категория 2 B: На основании более слабых доказательств достигнут консенсус NCCN об адекватности данного вмешательства NCCN, Национальная, всеобъемлющая онкологическая сеть 1 1 1. Adelstein DJ, et al. J Clin Oncol 2003; 21: 92– 98; 2. Tsan DL, et al. Radiat Oncol 2012; 7: 215; 3. Huguenin P, et al. J Clin Oncol 2004; 22: 4665 – 4673; 4. Jeremic B, et al. J Clin Oncol 2004; 22: 3540– 3548; 5. Homma A, et al. Cancer J 2004; 10: 326– 332; 6. Denis F, et al. J Clin Oncol 2004; 22: 69– 76; 7. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 8. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1, 2015
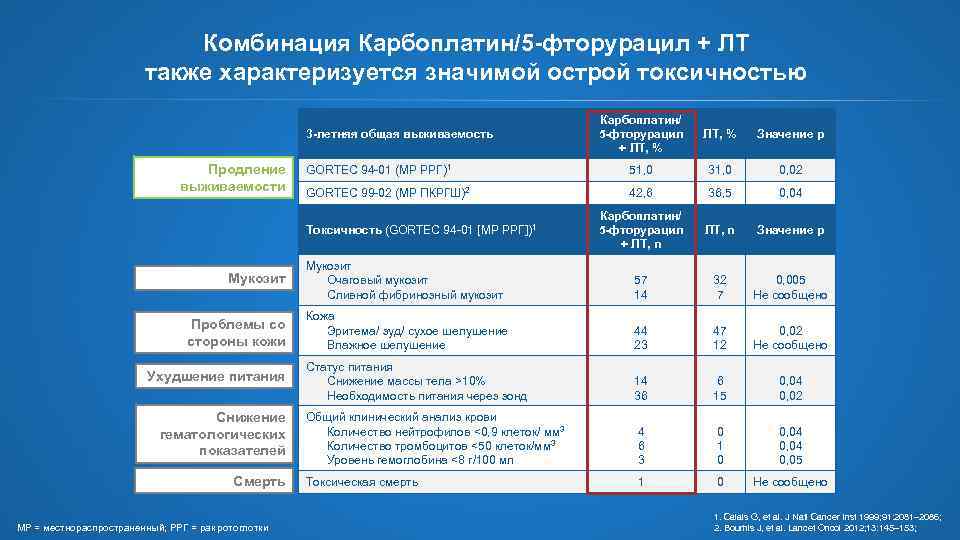 Комбинация Карбоплатин/5 -фторурацил + ЛТ также характеризуется значимой острой токсичностью Карбоплатин/ 5 -фторурацил + ЛТ, % Значение р GORТEC 94 -01 (МР РРГ)1 51, 0 31, 0 0, 02 GORТEC 99 -02 (МР ПКРГШ)2 42, 6 36, 5 0, 04 Карбоплатин/ 5 -фторурацил + ЛТ, n Значение р Мукозит Очаговый мукозит Сливной фибринозный мукозит 57 14 32 7 0, 005 Не сообщено Кожа Эритема/ зуд/ сухое шелушение Влажное шелушение 44 23 47 12 0, 02 Не сообщено Статус питания Снижение массы тела >10% Необходимость питания через зонд 14 36 6 15 0, 04 0, 02 Общий клинический анализ крови Количество нейтрофилов <0, 9 клеток/ мм 3 Количество тромбоцитов <50 клеток/мм 3 Уровень гемоглобина <8 г/100 мл 4 6 3 0 1 0 0, 04 0, 05 Токсическая смерть 1 0 Не сообщено 3 -летняя общая выживаемость Продление выживаемости Токсичность (GORТEC 94 -01 [МР РРГ])1 Мукозит Проблемы со стороны кожи Ухудшение питания Снижение гематологических показателей Смерть МР = местнораспространенный; РРГ = рак ротоглотки 1. Calais G, et al. J Natl Cancer Inst 1999; 91: 2081– 2086; 2. Bourhis J, et al. Lancet Oncol 2012; 13: 145– 153;
Комбинация Карбоплатин/5 -фторурацил + ЛТ также характеризуется значимой острой токсичностью Карбоплатин/ 5 -фторурацил + ЛТ, % Значение р GORТEC 94 -01 (МР РРГ)1 51, 0 31, 0 0, 02 GORТEC 99 -02 (МР ПКРГШ)2 42, 6 36, 5 0, 04 Карбоплатин/ 5 -фторурацил + ЛТ, n Значение р Мукозит Очаговый мукозит Сливной фибринозный мукозит 57 14 32 7 0, 005 Не сообщено Кожа Эритема/ зуд/ сухое шелушение Влажное шелушение 44 23 47 12 0, 02 Не сообщено Статус питания Снижение массы тела >10% Необходимость питания через зонд 14 36 6 15 0, 04 0, 02 Общий клинический анализ крови Количество нейтрофилов <0, 9 клеток/ мм 3 Количество тромбоцитов <50 клеток/мм 3 Уровень гемоглобина <8 г/100 мл 4 6 3 0 1 0 0, 04 0, 05 Токсическая смерть 1 0 Не сообщено 3 -летняя общая выживаемость Продление выживаемости Токсичность (GORТEC 94 -01 [МР РРГ])1 Мукозит Проблемы со стороны кожи Ухудшение питания Снижение гематологических показателей Смерть МР = местнораспространенный; РРГ = рак ротоглотки 1. Calais G, et al. J Natl Cancer Inst 1999; 91: 2081– 2086; 2. Bourhis J, et al. Lancet Oncol 2012; 13: 145– 153;
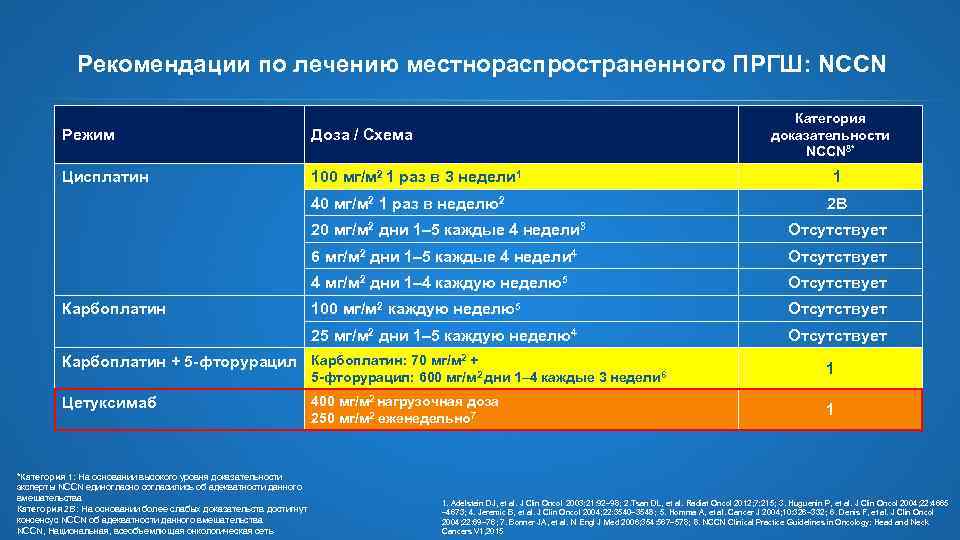 Рекомендации по лечению местнораспространенного ПРГШ: NCCN Категория доказательности NCCN 8* Режим Доза / Схема Цисплатин 100 мг/м 2 1 раз в 3 недели 1 40 мг/м 2 1 раз в неделю2 1 2 B 20 мг/м 2 дни 1– 5 каждые 4 недели 3 6 мг/м 2 дни 1– 5 каждые 4 недели 4 Отсутствует 4 мг/м 2 дни 1– 4 каждую неделю5 Отсутствует 100 мг/м 2 каждую неделю5 Отсутствует 25 мг/м 2 дни 1– 5 каждую неделю4 Карбоплатин Отсутствует Карбоплатин + 5 -фторурацил Карбоплатин: 70 мг/м 2 + 5 -фторурацил: 600 мг/м 2 дни 1– 4 каждые 3 недели 6 Цетуксимаб *Категория 1: На основании высокого уровня доказательности эксперты NCCN единогласно согласились об адекватности данного вмешательства Категория 2 B: На основании более слабых доказательств достигнут консенсус NCCN об адекватности данного вмешательства NCCN, Национальная, всеобъемлющая онкологическая сеть 400 мг/м 2 нагрузочная доза 250 мг/м 2 еженедельно 7 1 1 1. Adelstein DJ, et al. J Clin Oncol 2003; 21: 92– 98; 2. Tsan DL, et al. Radiat Oncol 2012; 7: 215; 3. Huguenin P, et al. J Clin Oncol 2004; 22: 4665 – 4673; 4. Jeremic B, et al. J Clin Oncol 2004; 22: 3540– 3548; 5. Homma A, et al. Cancer J 2004; 10: 326– 332; 6. Denis F, et al. J Clin Oncol 2004; 22: 69– 76; 7. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 8. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1, 2015
Рекомендации по лечению местнораспространенного ПРГШ: NCCN Категория доказательности NCCN 8* Режим Доза / Схема Цисплатин 100 мг/м 2 1 раз в 3 недели 1 40 мг/м 2 1 раз в неделю2 1 2 B 20 мг/м 2 дни 1– 5 каждые 4 недели 3 6 мг/м 2 дни 1– 5 каждые 4 недели 4 Отсутствует 4 мг/м 2 дни 1– 4 каждую неделю5 Отсутствует 100 мг/м 2 каждую неделю5 Отсутствует 25 мг/м 2 дни 1– 5 каждую неделю4 Карбоплатин Отсутствует Карбоплатин + 5 -фторурацил Карбоплатин: 70 мг/м 2 + 5 -фторурацил: 600 мг/м 2 дни 1– 4 каждые 3 недели 6 Цетуксимаб *Категория 1: На основании высокого уровня доказательности эксперты NCCN единогласно согласились об адекватности данного вмешательства Категория 2 B: На основании более слабых доказательств достигнут консенсус NCCN об адекватности данного вмешательства NCCN, Национальная, всеобъемлющая онкологическая сеть 400 мг/м 2 нагрузочная доза 250 мг/м 2 еженедельно 7 1 1 1. Adelstein DJ, et al. J Clin Oncol 2003; 21: 92– 98; 2. Tsan DL, et al. Radiat Oncol 2012; 7: 215; 3. Huguenin P, et al. J Clin Oncol 2004; 22: 4665 – 4673; 4. Jeremic B, et al. J Clin Oncol 2004; 22: 3540– 3548; 5. Homma A, et al. Cancer J 2004; 10: 326– 332; 6. Denis F, et al. J Clin Oncol 2004; 22: 69– 76; 7. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 8. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1, 2015
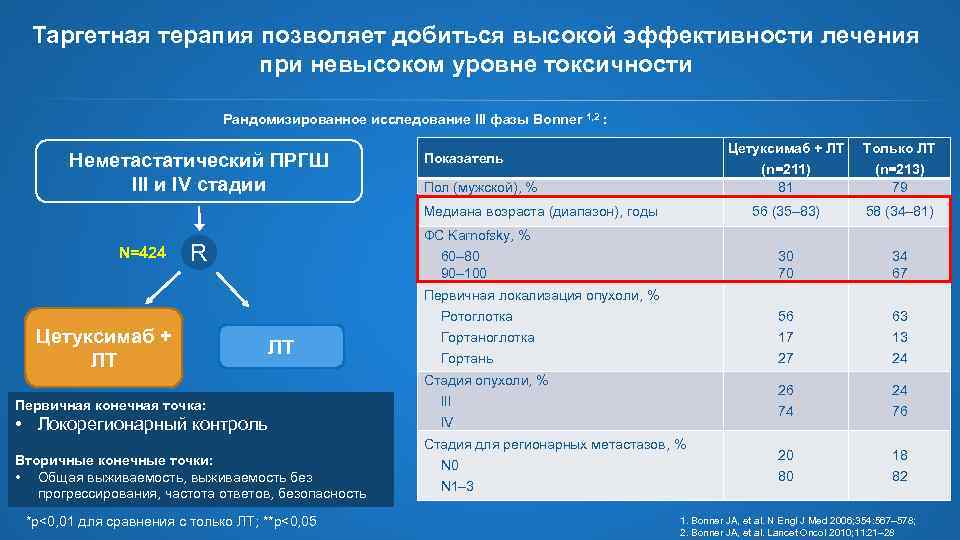 Таргетная терапия позволяет добиться высокой эффективности лечения при невысоком уровне токсичности Рандомизированное исследование III фазы Bonner 1, 2 : Неметастатический ПРГШ III и IV стадии Цетуксимаб + ЛТ N=424 34 67 56 63 17 27 13 24 26 74 24 76 20 80 18 82 ФС Karnofsky, % R 60– 80 90– 100 Первичная локализация опухоли, % Ротоглотка Цетуксимаб + ЛТ 58 (34– 81) 30 70 Медиана возраста (диапазон), годы (n=213) 79 56 (35– 83) Пол (мужской), % Только ЛТ (n=211) 81 Показатель ЛТ Гортаноглотка Гортань Стадия опухоли, % Первичная конечная точка: III • Локорегионарный контроль IV Вторичные конечные точки: • Общая выживаемость, выживаемость без прогрессирования, частота ответов, безопасность *p<0, 01 для сравнения с только ЛТ; **p<0, 05 Стадия для регионарных метастазов, % N 0 N 1– 3 1. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 2. Bonner JA, et al. Lancet Oncol 2010; 11: 21– 28
Таргетная терапия позволяет добиться высокой эффективности лечения при невысоком уровне токсичности Рандомизированное исследование III фазы Bonner 1, 2 : Неметастатический ПРГШ III и IV стадии Цетуксимаб + ЛТ N=424 34 67 56 63 17 27 13 24 26 74 24 76 20 80 18 82 ФС Karnofsky, % R 60– 80 90– 100 Первичная локализация опухоли, % Ротоглотка Цетуксимаб + ЛТ 58 (34– 81) 30 70 Медиана возраста (диапазон), годы (n=213) 79 56 (35– 83) Пол (мужской), % Только ЛТ (n=211) 81 Показатель ЛТ Гортаноглотка Гортань Стадия опухоли, % Первичная конечная точка: III • Локорегионарный контроль IV Вторичные конечные точки: • Общая выживаемость, выживаемость без прогрессирования, частота ответов, безопасность *p<0, 01 для сравнения с только ЛТ; **p<0, 05 Стадия для регионарных метастазов, % N 0 N 1– 3 1. Bonner JA, et al. N Engl J Med 2006; 354: 567– 578; 2. Bonner JA, et al. Lancet Oncol 2010; 11: 21– 28
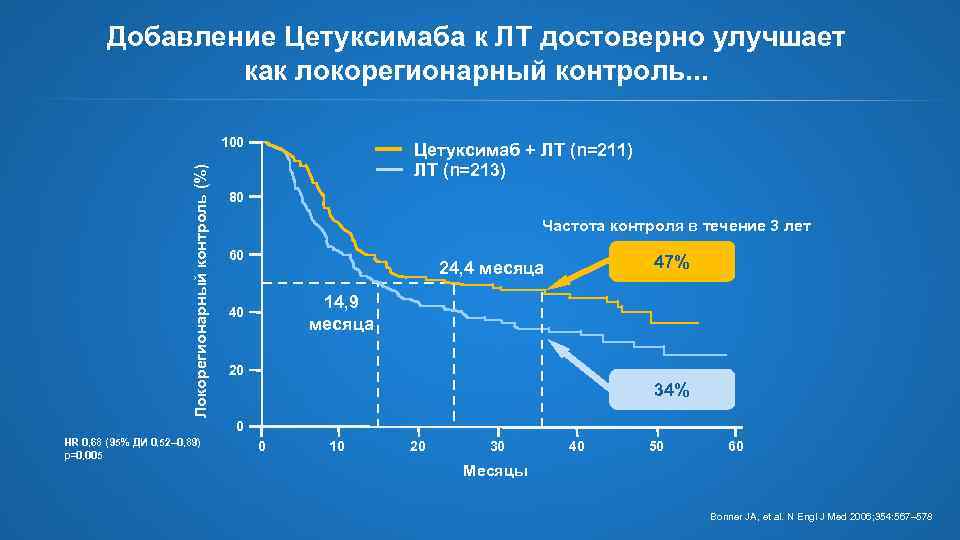 Добавление Цетуксимаба к ЛТ достоверно улучшает как локорегионарный контроль. . . Локорегионарный контроль (%) 100 Цетуксимаб + ЛТ (n=211) ЛТ (n=213) 80 Частота контроля в течение 3 лет 60 47% 24, 4 месяца 14, 9 месяца 40 20 34% 0 HR 0, 68 (95% ДИ 0, 52– 0, 89) p=0, 005 0 10 20 30 40 50 60 Месяцы Bonner JA, et al. N Engl J Med 2006; 354: 567– 578
Добавление Цетуксимаба к ЛТ достоверно улучшает как локорегионарный контроль. . . Локорегионарный контроль (%) 100 Цетуксимаб + ЛТ (n=211) ЛТ (n=213) 80 Частота контроля в течение 3 лет 60 47% 24, 4 месяца 14, 9 месяца 40 20 34% 0 HR 0, 68 (95% ДИ 0, 52– 0, 89) p=0, 005 0 10 20 30 40 50 60 Месяцы Bonner JA, et al. N Engl J Med 2006; 354: 567– 578
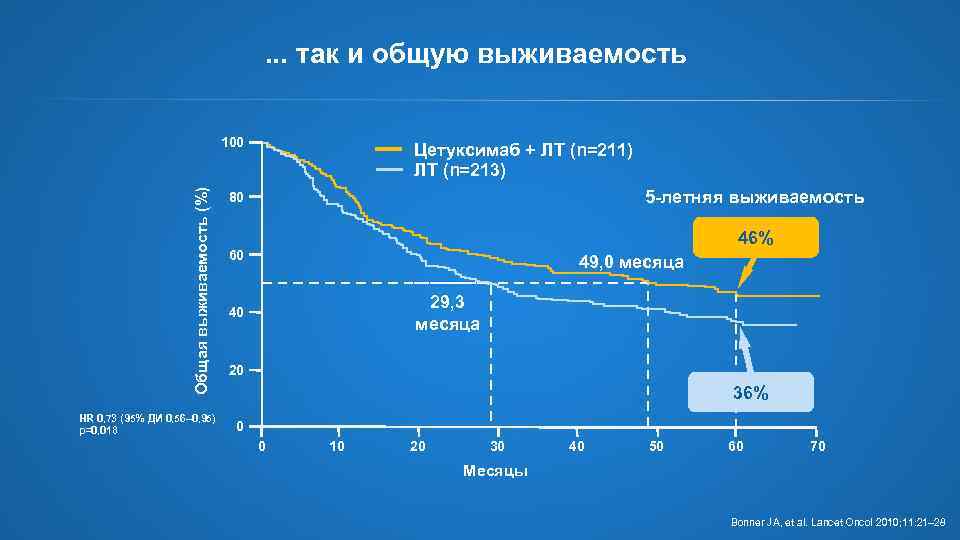 . . . так и общую выживаемость Общая выживаемость (%) 100 HR 0, 73 (95% ДИ 0, 56– 0, 95) p=0, 018 Цетуксимаб + ЛТ (n=211) ЛТ (n=213) 5 -летняя выживаемость 80 46% 60 49, 0 месяца 29, 3 месяца 40 20 36% 0 0 10 20 30 40 50 60 70 Месяцы Bonner JA, et al. Lancet Oncol 2010; 11: 21– 28
. . . так и общую выживаемость Общая выживаемость (%) 100 HR 0, 73 (95% ДИ 0, 56– 0, 95) p=0, 018 Цетуксимаб + ЛТ (n=211) ЛТ (n=213) 5 -летняя выживаемость 80 46% 60 49, 0 месяца 29, 3 месяца 40 20 36% 0 0 10 20 30 40 50 60 70 Месяцы Bonner JA, et al. Lancet Oncol 2010; 11: 21– 28
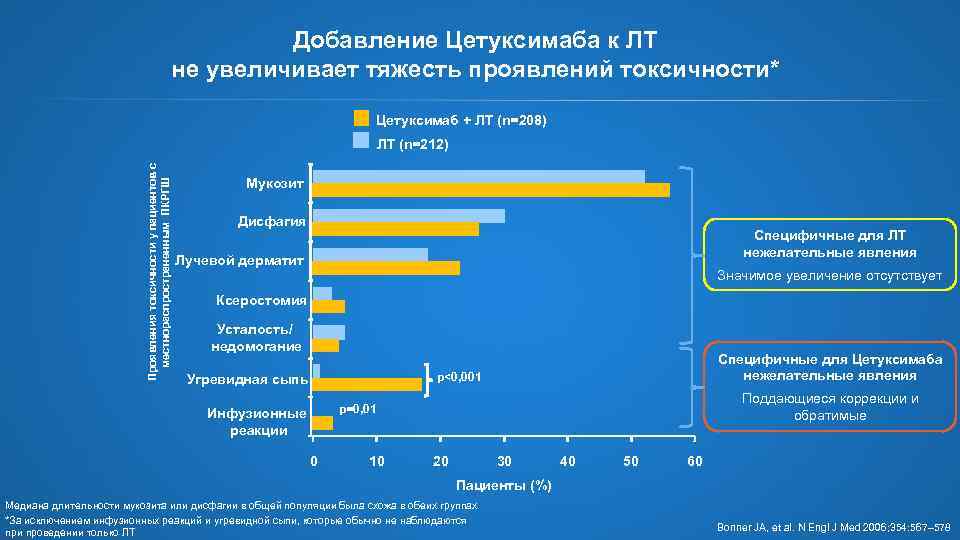 Добавление Цетуксимаба к ЛТ не увеличивает тяжесть проявлений токсичности* Цетуксимаб + ЛТ (n=208) Проявления токсичности у пациентов с местнораспространенным ПКРГШ ЛТ (n=212) Мукозит Дисфагия Специфичные для ЛТ нежелательные явления Лучевой дерматит Значимое увеличение отсутствует Ксеростомия Усталость/ недомогание Специфичные для Цетуксимаба нежелательные явления p<0, 001 Угревидная сыпь Поддающиеся коррекции и обратимые p=0, 01 Инфузионные реакции 0 10 20 30 40 50 60 Пациенты (%) Медиана длительности мукозита или дисфагии в общей популяции была схожа в обеих группах *За исключением инфузионных реакций и угревидной сыпи, которые обычно не наблюдаются при проведении только ЛТ Bonner JA, et al. N Engl J Med 2006; 354: 567– 578
Добавление Цетуксимаба к ЛТ не увеличивает тяжесть проявлений токсичности* Цетуксимаб + ЛТ (n=208) Проявления токсичности у пациентов с местнораспространенным ПКРГШ ЛТ (n=212) Мукозит Дисфагия Специфичные для ЛТ нежелательные явления Лучевой дерматит Значимое увеличение отсутствует Ксеростомия Усталость/ недомогание Специфичные для Цетуксимаба нежелательные явления p<0, 001 Угревидная сыпь Поддающиеся коррекции и обратимые p=0, 01 Инфузионные реакции 0 10 20 30 40 50 60 Пациенты (%) Медиана длительности мукозита или дисфагии в общей популяции была схожа в обеих группах *За исключением инфузионных реакций и угревидной сыпи, которые обычно не наблюдаются при проведении только ЛТ Bonner JA, et al. N Engl J Med 2006; 354: 567– 578
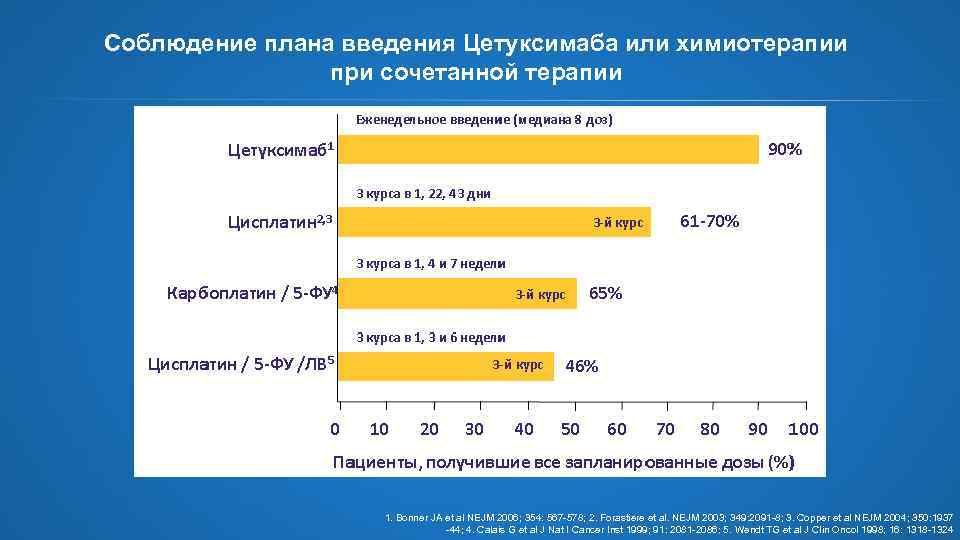 Соблюдение плана введения Цетуксимаба или химиотерапии при сочетанной терапии 1. Bonner JA et al NEJM 2006; 354: 567 -578; 2. Forastiere et al. NEJM 2003; 349: 2091 -8; 3. Copper et al NEJM 2004; 350: 1937 -44; 4. Calais G et al J Nat I Cancer Inst 1999; 91: 2081 -2086; 5. Wendt TG et al J Clin Oncol 1998; 16: 1318 -1324
Соблюдение плана введения Цетуксимаба или химиотерапии при сочетанной терапии 1. Bonner JA et al NEJM 2006; 354: 567 -578; 2. Forastiere et al. NEJM 2003; 349: 2091 -8; 3. Copper et al NEJM 2004; 350: 1937 -44; 4. Calais G et al J Nat I Cancer Inst 1999; 91: 2081 -2086; 5. Wendt TG et al J Clin Oncol 1998; 16: 1318 -1324
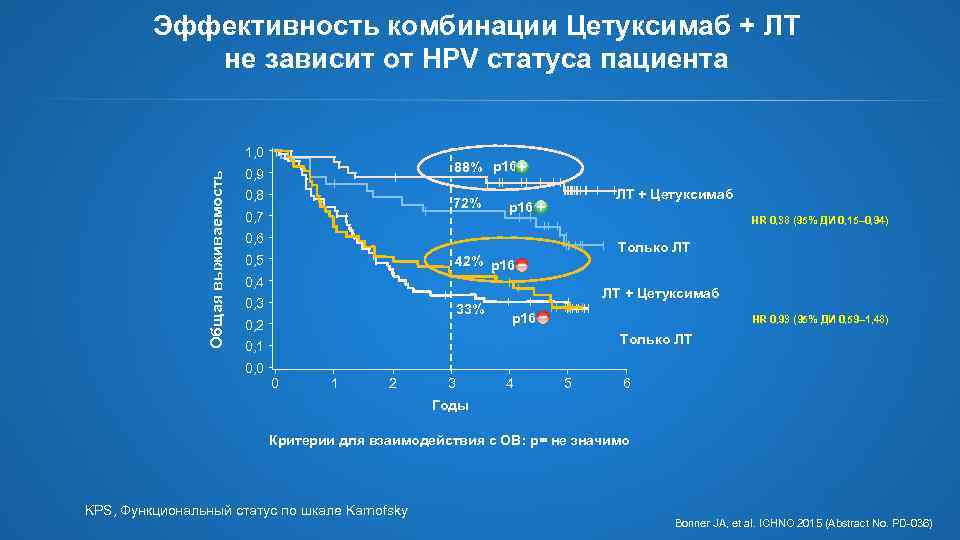 Эффективность комбинации Цетуксимаб + ЛТ не зависит от HPV статуса пациента Общая выживаемость 1, 0 88% p 16 0, 9 0, 8 72% 0, 7 ЛТ + Цетуксимаб p 16 HR 0, 38 (95% ДИ 0, 15– 0, 94) 0, 6 0, 5 Только ЛТ 42% p 16 0, 4 0, 3 33% 0, 2 ЛТ + Цетуксимаб p 16 HR 0, 93 (95% ДИ 0, 59– 1, 48) Только ЛТ 0, 1 0, 0 0 1 2 3 4 5 6 Годы Критерии для взаимодействия с ОВ: p= не значимо KPS, Функциональный статус по шкале Karnofsky Bonner JA, et al. ICHNO 2015 (Abstract No. PD-036)
Эффективность комбинации Цетуксимаб + ЛТ не зависит от HPV статуса пациента Общая выживаемость 1, 0 88% p 16 0, 9 0, 8 72% 0, 7 ЛТ + Цетуксимаб p 16 HR 0, 38 (95% ДИ 0, 15– 0, 94) 0, 6 0, 5 Только ЛТ 42% p 16 0, 4 0, 3 33% 0, 2 ЛТ + Цетуксимаб p 16 HR 0, 93 (95% ДИ 0, 59– 1, 48) Только ЛТ 0, 1 0, 0 0 1 2 3 4 5 6 Годы Критерии для взаимодействия с ОВ: p= не значимо KPS, Функциональный статус по шкале Karnofsky Bonner JA, et al. ICHNO 2015 (Abstract No. PD-036)
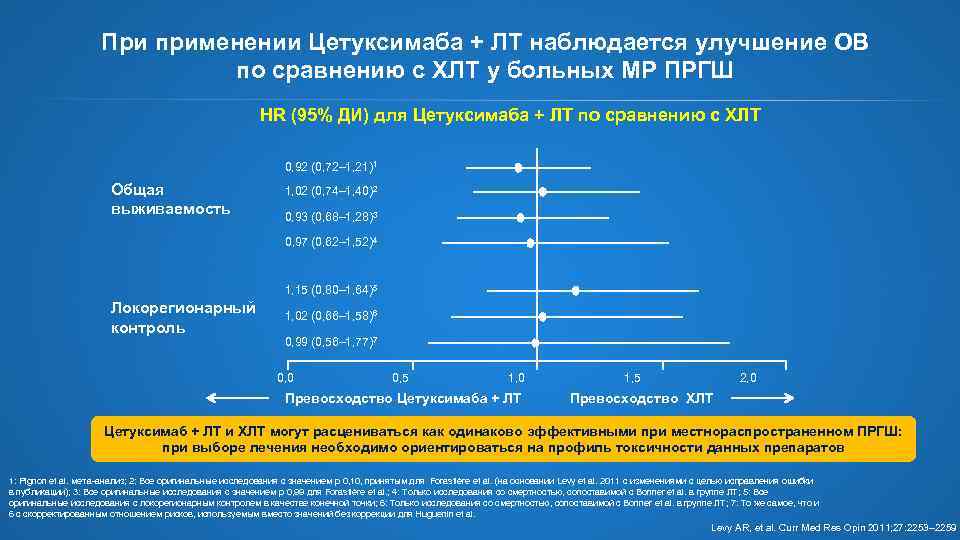 При применении Цетуксимаба + ЛТ наблюдается улучшение ОВ по сравнению с ХЛТ у больных МР ПРГШ HR (95% ДИ) для Цетуксимаба + ЛТ по сравнению с ХЛТ 0, 92 (0, 72– 1, 21)1 Общая выживаемость 1, 02 (0, 74– 1, 40)2 0, 93 (0, 68– 1, 28)3 0, 97 (0, 62– 1, 52)4 1, 15 (0, 80– 1, 64)5 Локорегионарный контроль 1, 02 (0, 66– 1, 58)6 0, 99 (0, 56– 1, 77)7 0, 0 0, 5 1, 0 Превосходство Цетуксимаба + ЛТ 1, 5 2, 0 Превосходство ХЛТ Цетуксимаб + ЛТ и ХЛТ могут расцениваться как одинаково эффективными при местнораспространенном ПРГШ: при выборе лечения необходимо ориентироваться на профиль токсичности данных препаратов 1: Pignon et al. мета-анализ; 2: Все оригинальные исследования с значением р 0, 10, принятым для Forastière et al. (на основании Levy et al. 2011 с изменениями с целью исправления ошибки в публикации); 3: Все оригинальные исследования с значением р 0, 99 для Forastière et al. ; 4: Только исследования со смертностью, сопоставимой с Bonner et al. в группе ЛТ; 5: Все оригинальные исследования с локорегионарным контролем в качестве конечной точки; 6: Только исследования со смертностью, сопоставимой с Bonner et al. в группе ЛТ; 7: То же самое, что и 6 с скорректированным отношением рисков, используемым вместо значений без коррекции для Huguenin et al. Levy AR, et al. Curr Med Res Opin 2011; 27: 2253‒ 2259
При применении Цетуксимаба + ЛТ наблюдается улучшение ОВ по сравнению с ХЛТ у больных МР ПРГШ HR (95% ДИ) для Цетуксимаба + ЛТ по сравнению с ХЛТ 0, 92 (0, 72– 1, 21)1 Общая выживаемость 1, 02 (0, 74– 1, 40)2 0, 93 (0, 68– 1, 28)3 0, 97 (0, 62– 1, 52)4 1, 15 (0, 80– 1, 64)5 Локорегионарный контроль 1, 02 (0, 66– 1, 58)6 0, 99 (0, 56– 1, 77)7 0, 0 0, 5 1, 0 Превосходство Цетуксимаба + ЛТ 1, 5 2, 0 Превосходство ХЛТ Цетуксимаб + ЛТ и ХЛТ могут расцениваться как одинаково эффективными при местнораспространенном ПРГШ: при выборе лечения необходимо ориентироваться на профиль токсичности данных препаратов 1: Pignon et al. мета-анализ; 2: Все оригинальные исследования с значением р 0, 10, принятым для Forastière et al. (на основании Levy et al. 2011 с изменениями с целью исправления ошибки в публикации); 3: Все оригинальные исследования с значением р 0, 99 для Forastière et al. ; 4: Только исследования со смертностью, сопоставимой с Bonner et al. в группе ЛТ; 5: Все оригинальные исследования с локорегионарным контролем в качестве конечной точки; 6: Только исследования со смертностью, сопоставимой с Bonner et al. в группе ЛТ; 7: То же самое, что и 6 с скорректированным отношением рисков, используемым вместо значений без коррекции для Huguenin et al. Levy AR, et al. Curr Med Res Opin 2011; 27: 2253‒ 2259
 Режим дозирования Цетуксимаба при местнораспространенном ПРГШ в комбинации с ЛТ Цетуксимаб (400 мг/м 2 в день 1), за 1 неделю до начала ЛТ; Затем на 2 -8 -й неделях по 250 мг/м 2 1 раз в неделю. ЛТ проводится на 2 -8 -й неделях.
Режим дозирования Цетуксимаба при местнораспространенном ПРГШ в комбинации с ЛТ Цетуксимаб (400 мг/м 2 в день 1), за 1 неделю до начала ЛТ; Затем на 2 -8 -й неделях по 250 мг/м 2 1 раз в неделю. ЛТ проводится на 2 -8 -й неделях.
 В руководствах Цетуксимаб + ЛТ признается стандартным вариантом терапии местно-распространенного ПРГШ Альтернативным вариантом может быть одновременное с лучевой терапией назначение Цетуксимаба (400 мг / м 2 за неделю до лучевой терапии и 250 мг/м 2 еженедельно в процессе ее), что обеспечивает увеличение общей продолжительности жизни и улучшает локорегионарный контроль в сравнении с лучевой терапией, но не увеличивает токсичность. (RUSSCO) Злокачественные В руководствах NCCN рекомендуется применение опухоли головы и шеи Цетуксимаба в качестве первичной системной терапии в сочетании с ЛТ при местнораспространенном ПКРГШ за пределами носоглотки, или в составе последовательной ХТ после индукционной ХТ (Категория 1 доказательности)1 Плоскоклеточный рак головы и шеи: Практические клинические руководства по диагностике, лечению и наблюдению EHNS-ESMO-ESTRO Согласно руководствам ESMO «Цетуксимаб + ЛТ характеризуется более высокой частотой ответов, увеличением выживаемости без прогрессирования [!!!] и общей выживаемости по сравнению с только ЛТ» (Уровень доказательности II, B)2 ESMO, Европейское общество медицинской онкологии 1. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1. 2015; 2. Grégoire V, et al. Ann Oncol 2010; 21(Suppl 5): vi 184–vi 186
В руководствах Цетуксимаб + ЛТ признается стандартным вариантом терапии местно-распространенного ПРГШ Альтернативным вариантом может быть одновременное с лучевой терапией назначение Цетуксимаба (400 мг / м 2 за неделю до лучевой терапии и 250 мг/м 2 еженедельно в процессе ее), что обеспечивает увеличение общей продолжительности жизни и улучшает локорегионарный контроль в сравнении с лучевой терапией, но не увеличивает токсичность. (RUSSCO) Злокачественные В руководствах NCCN рекомендуется применение опухоли головы и шеи Цетуксимаба в качестве первичной системной терапии в сочетании с ЛТ при местнораспространенном ПКРГШ за пределами носоглотки, или в составе последовательной ХТ после индукционной ХТ (Категория 1 доказательности)1 Плоскоклеточный рак головы и шеи: Практические клинические руководства по диагностике, лечению и наблюдению EHNS-ESMO-ESTRO Согласно руководствам ESMO «Цетуксимаб + ЛТ характеризуется более высокой частотой ответов, увеличением выживаемости без прогрессирования [!!!] и общей выживаемости по сравнению с только ЛТ» (Уровень доказательности II, B)2 ESMO, Европейское общество медицинской онкологии 1. NCCN Clinical Practice Guidelines in Oncology: Head and Neck Cancers V 1. 2015; 2. Grégoire V, et al. Ann Oncol 2010; 21(Suppl 5): vi 184–vi 186
 Выводы q Добавление препаратов платины к ЛТ улучшает выживаемость по сравнению с ЛТ, но характеризуется высокой токсичностью и значимой частотой несоблюдения режима терапии q Цетуксимаб + ЛТ улучшает общую выживаемость по сравнению с ЛТ без ухудшения качества жизни q Цетуксимаб+ ЛТ демонстрирует локорегиональный контроль в течение 3 -х лет q Цетуксимаб эффективен вне зависимости от статуса HPV (р16)
Выводы q Добавление препаратов платины к ЛТ улучшает выживаемость по сравнению с ЛТ, но характеризуется высокой токсичностью и значимой частотой несоблюдения режима терапии q Цетуксимаб + ЛТ улучшает общую выживаемость по сравнению с ЛТ без ухудшения качества жизни q Цетуксимаб+ ЛТ демонстрирует локорегиональный контроль в течение 3 -х лет q Цетуксимаб эффективен вне зависимости от статуса HPV (р16)
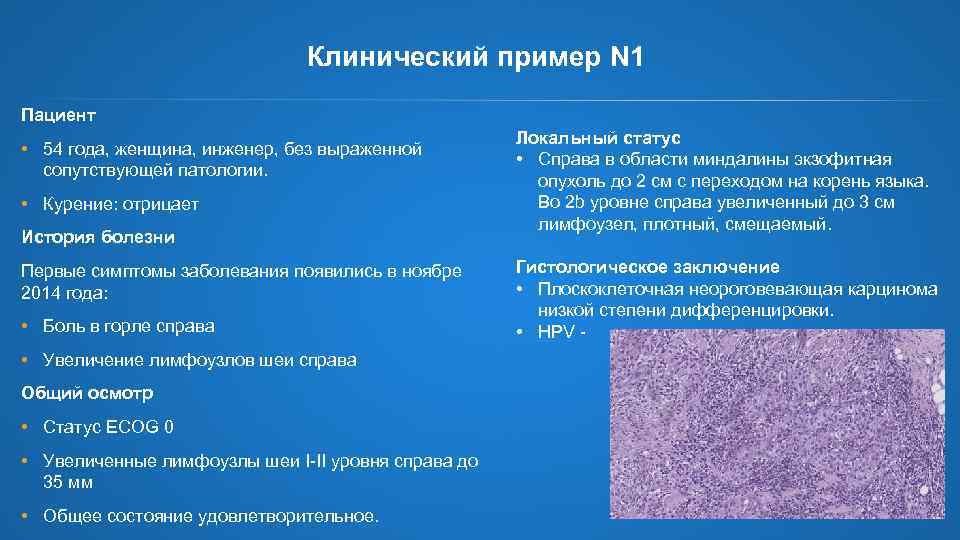 Клинический пример N 1 Пациент • 54 года, женщина, инженер, без выраженной сопутствующей патологии. • Курение: отрицает История болезни Первые симптомы заболевания появились в ноябре 2014 года: • Боль в горле справа • Увеличение лимфоузлов шеи справа Общий осмотр • Статус ECOG 0 • Увеличенные лимфоузлы шеи I-II уровня справа до 35 мм • Общее состояние удовлетворительное. Локальный статус • Справа в области миндалины экзофитная опухоль до 2 см с переходом на корень языка. Во 2 b уровне справа увеличенный до 3 см лимфоузел, плотный, смещаемый. Гистологическое заключение • Плоскоклеточная неороговевающая карцинома низкой степени дифференцировки. • HPV -
Клинический пример N 1 Пациент • 54 года, женщина, инженер, без выраженной сопутствующей патологии. • Курение: отрицает История болезни Первые симптомы заболевания появились в ноябре 2014 года: • Боль в горле справа • Увеличение лимфоузлов шеи справа Общий осмотр • Статус ECOG 0 • Увеличенные лимфоузлы шеи I-II уровня справа до 35 мм • Общее состояние удовлетворительное. Локальный статус • Справа в области миндалины экзофитная опухоль до 2 см с переходом на корень языка. Во 2 b уровне справа увеличенный до 3 см лимфоузел, плотный, смещаемый. Гистологическое заключение • Плоскоклеточная неороговевающая карцинома низкой степени дифференцировки. • HPV -
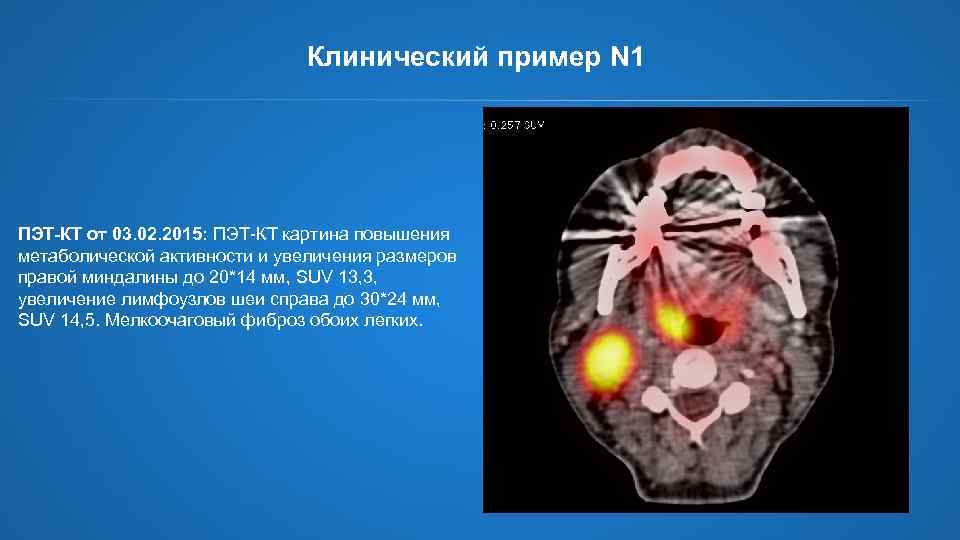 Клинический пример N 1 ПЭТ-КТ от 03. 02. 2015: ПЭТ-КТ картина повышения метаболической активности и увеличения размеров правой миндалины до 20*14 мм, SUV 13, 3, увеличение лимфоузлов шеи справа до 30*24 мм, SUV 14, 5. Мелкоочаговый фиброз обоих легких.
Клинический пример N 1 ПЭТ-КТ от 03. 02. 2015: ПЭТ-КТ картина повышения метаболической активности и увеличения размеров правой миндалины до 20*14 мм, SUV 13, 3, увеличение лимфоузлов шеи справа до 30*24 мм, SUV 14, 5. Мелкоочаговый фиброз обоих легких.
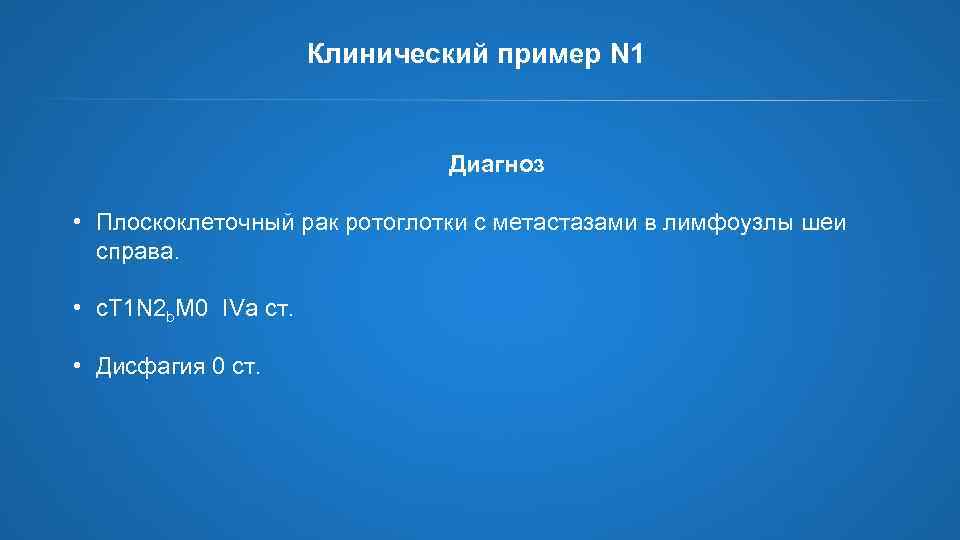 Клинический пример N 1 Диагноз • Плоскоклеточный рак ротоглотки с метастазами в лимфоузлы шеи справа. • c. T 1 N 2 b. M 0 IVa ст. • Дисфагия 0 ст.
Клинический пример N 1 Диагноз • Плоскоклеточный рак ротоглотки с метастазами в лимфоузлы шеи справа. • c. T 1 N 2 b. M 0 IVa ст. • Дисфагия 0 ст.
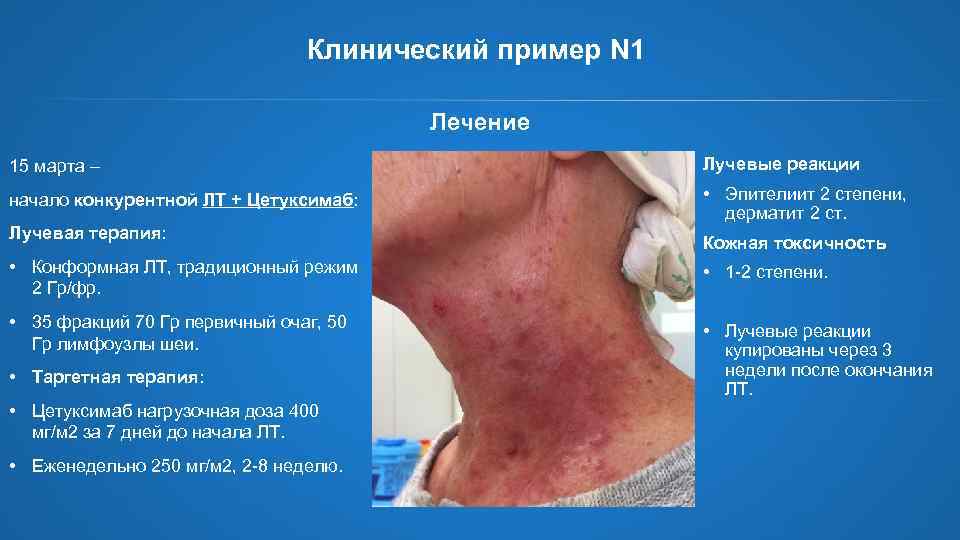 Клинический пример N 1 Лечение 15 марта – Лучевые реакции начало конкурентной ЛТ + Цетуксимаб: • Эпителиит 2 степени, дерматит 2 ст. Лучевая терапия: Кожная токсичность • Конформная ЛТ, традиционный режим 2 Гр/фр. • 1 -2 степени. • 35 фракций 70 Гр первичный очаг, 50 Гр лимфоузлы шеи. • Лучевые реакции купированы через 3 недели после окончания ЛТ. • Таргетная терапия: • Цетуксимаб нагрузочная доза 400 мг/м 2 за 7 дней до начала ЛТ. • Еженедельно 250 мг/м 2, 2 -8 неделю.
Клинический пример N 1 Лечение 15 марта – Лучевые реакции начало конкурентной ЛТ + Цетуксимаб: • Эпителиит 2 степени, дерматит 2 ст. Лучевая терапия: Кожная токсичность • Конформная ЛТ, традиционный режим 2 Гр/фр. • 1 -2 степени. • 35 фракций 70 Гр первичный очаг, 50 Гр лимфоузлы шеи. • Лучевые реакции купированы через 3 недели после окончания ЛТ. • Таргетная терапия: • Цетуксимаб нагрузочная доза 400 мг/м 2 за 7 дней до начала ЛТ. • Еженедельно 250 мг/м 2, 2 -8 неделю.
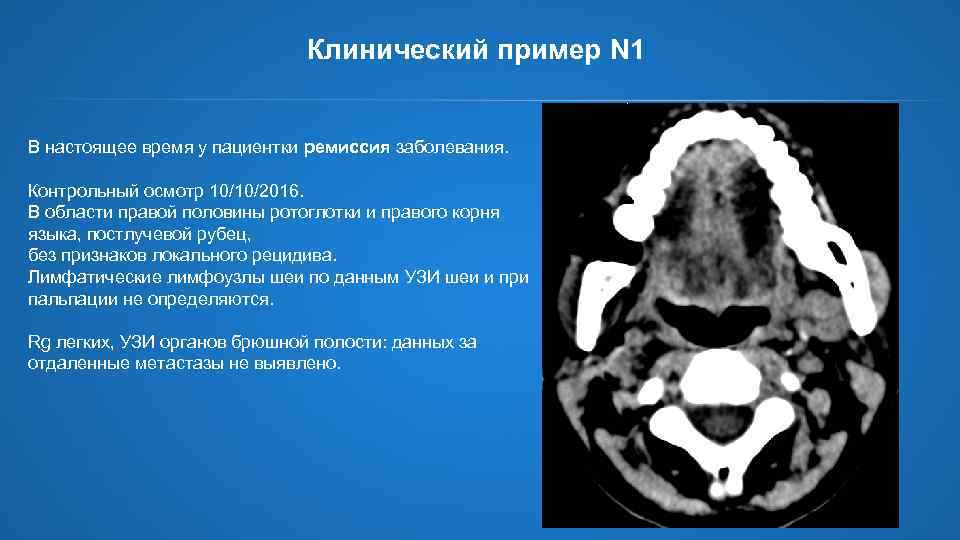 Клинический пример N 1 В настоящее время у пациентки ремиссия заболевания. Контрольный осмотр 10/10/2016. В области правой половины ротоглотки и правого корня языка, постлучевой рубец, без признаков локального рецидива. Лимфатические лимфоузлы шеи по данным УЗИ шеи и при пальпации не определяются. Rg легких, УЗИ органов брюшной полости: данных за отдаленные метастазы не выявлено.
Клинический пример N 1 В настоящее время у пациентки ремиссия заболевания. Контрольный осмотр 10/10/2016. В области правой половины ротоглотки и правого корня языка, постлучевой рубец, без признаков локального рецидива. Лимфатические лимфоузлы шеи по данным УЗИ шеи и при пальпации не определяются. Rg легких, УЗИ органов брюшной полости: данных за отдаленные метастазы не выявлено.
 Режим дозирования Цетуксимаба при рецидивирующем/ метастатическом ПРГШ Цетуксимаб (Начальная доза 400 мг/м 2 - неделя 1 Со 2 -ой недели - 250 мг/м 2 еженедельно) Цисплатин (100 мг/м 2 в/в, день1) [или Карбоплатин (AUC 5 мг/мл/мин, день1)] + 5 -Фторурацил (1000 мг/м 2 /день в/в, дни 1– 4) Цетуксимаб (250 мг/м 2 еженедельно) До прогрессирования До 6 курсов (длительность 1 курса = 3 недели) Vermorken JB, et al. N Engl J Med 2008; 359: 1116– 1127
Режим дозирования Цетуксимаба при рецидивирующем/ метастатическом ПРГШ Цетуксимаб (Начальная доза 400 мг/м 2 - неделя 1 Со 2 -ой недели - 250 мг/м 2 еженедельно) Цисплатин (100 мг/м 2 в/в, день1) [или Карбоплатин (AUC 5 мг/мл/мин, день1)] + 5 -Фторурацил (1000 мг/м 2 /день в/в, дни 1– 4) Цетуксимаб (250 мг/м 2 еженедельно) До прогрессирования До 6 курсов (длительность 1 курса = 3 недели) Vermorken JB, et al. N Engl J Med 2008; 359: 1116– 1127
 Клинический пример N 2 Пациент • 27 лет, мужчина. • Курение: отрицает История болезни Первые симптомы заболевания появились в ноябре 2015 года: Локальный статус Правая половина гортани занята экзофитной опухолью, опухоль локализована в вестибуляном и среднем отделе, переходит на подскладочный отдел. Парез правой половины гортани. Лимфатические узлы шеи не увеличены. • Осиплость. • Чувство инородного тела при глотании. Общий осмотр • Статус ECOG 0 -1 • Регионарные лимфоузлы не увеличены • Общее состояние удовлетворительное. Rg органов грудной клетки • Данных за отделенные метастазы нет. Клиническое обследование • Патологии не выявлено
Клинический пример N 2 Пациент • 27 лет, мужчина. • Курение: отрицает История болезни Первые симптомы заболевания появились в ноябре 2015 года: Локальный статус Правая половина гортани занята экзофитной опухолью, опухоль локализована в вестибуляном и среднем отделе, переходит на подскладочный отдел. Парез правой половины гортани. Лимфатические узлы шеи не увеличены. • Осиплость. • Чувство инородного тела при глотании. Общий осмотр • Статус ECOG 0 -1 • Регионарные лимфоузлы не увеличены • Общее состояние удовлетворительное. Rg органов грудной клетки • Данных за отделенные метастазы нет. Клиническое обследование • Патологии не выявлено
 Клинический пример N 2 Гистологическое заключение • Плоскоклеточная ороговевающая карцинома высокой степени дифференцировки. • HPV - • • Диагноз Плоскоклеточный рак гортани c. T 3 N 0 M 0 III ст. Дисфагия 0 ст. ХБС 0 баллов по ШВО. С учетом стадии заболевания, поражения всех отделов гортани пациенту спланировано хирургическое лечение в объеме: ларингэктомия, селективная лимфаденэктомия с двух сторон II-V уровней, трахеостомия
Клинический пример N 2 Гистологическое заключение • Плоскоклеточная ороговевающая карцинома высокой степени дифференцировки. • HPV - • • Диагноз Плоскоклеточный рак гортани c. T 3 N 0 M 0 III ст. Дисфагия 0 ст. ХБС 0 баллов по ШВО. С учетом стадии заболевания, поражения всех отделов гортани пациенту спланировано хирургическое лечение в объеме: ларингэктомия, селективная лимфаденэктомия с двух сторон II-V уровней, трахеостомия
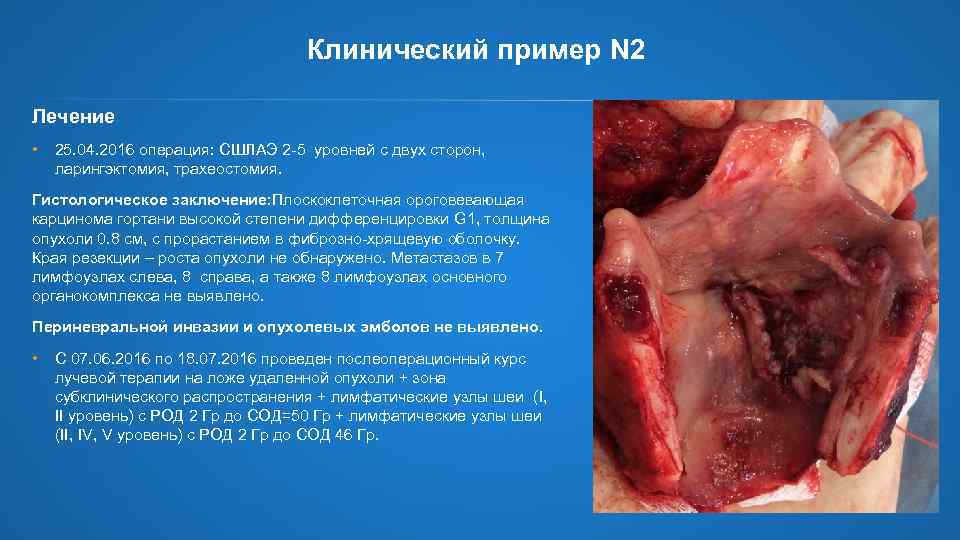 Клинический пример N 2 Лечение • 25. 04. 2016 операция: СШЛАЭ 2 -5 уровней с двух сторон, ларингэктомия, трахеостомия. Гистологическое заключение: Плоскоклеточная ороговевающая карцинома гортани высокой степени дифференцировки G 1, толщина опухоли 0. 8 cм, с прорастанием в фиброзно-хрящевую оболочку. Края резекции – роста опухоли не обнаружено. Метастазов в 7 лимфоузлах слева, 8 справа, а также 8 лимфоузлах основного органокомплекса не выявлено. Периневральной инвазии и опухолевых эмболов не выявлено. • С 07. 06. 2016 по 18. 07. 2016 проведен послеоперационный курс лучевой терапии на ложе удаленной опухоли + зона субклинического распространения + лимфатические узлы шеи (I, II уровень) с РОД 2 Гр до СОД=50 Гр + лимфатические узлы шеи (II, IV, V уровень) с РОД 2 Гр до СОД 46 Гр.
Клинический пример N 2 Лечение • 25. 04. 2016 операция: СШЛАЭ 2 -5 уровней с двух сторон, ларингэктомия, трахеостомия. Гистологическое заключение: Плоскоклеточная ороговевающая карцинома гортани высокой степени дифференцировки G 1, толщина опухоли 0. 8 cм, с прорастанием в фиброзно-хрящевую оболочку. Края резекции – роста опухоли не обнаружено. Метастазов в 7 лимфоузлах слева, 8 справа, а также 8 лимфоузлах основного органокомплекса не выявлено. Периневральной инвазии и опухолевых эмболов не выявлено. • С 07. 06. 2016 по 18. 07. 2016 проведен послеоперационный курс лучевой терапии на ложе удаленной опухоли + зона субклинического распространения + лимфатические узлы шеи (I, II уровень) с РОД 2 Гр до СОД=50 Гр + лимфатические узлы шеи (II, IV, V уровень) с РОД 2 Гр до СОД 46 Гр.
 Клинический пример N 2 Перистомальный рецидив • С начала августа 2016 года появились жалобы на сужение трахеостомы, появление инфильтрата над трахеостомой. • 28. 08. 2016: вскрытие и дренирование абсцесса, расширение трахеостомы. • Гистологическое заключение: рост плоскоклеточного рака. • МСКТ лицевого черепа от 29. 09. 2016 г МСКТ признаки продолженного роста в проекции трахеостомы, аксиальным размером 45*33 мм, протяженностью не менее 55 мм, нельзя исключить инвазию в обе доли щитовидной железы, стенку пищевода. • Rg органов грудной клетки, УЗИ шеи, УЗИ органов брюшной полости: • Данных за регионарные и отдаленные метастазы не выявлено
Клинический пример N 2 Перистомальный рецидив • С начала августа 2016 года появились жалобы на сужение трахеостомы, появление инфильтрата над трахеостомой. • 28. 08. 2016: вскрытие и дренирование абсцесса, расширение трахеостомы. • Гистологическое заключение: рост плоскоклеточного рака. • МСКТ лицевого черепа от 29. 09. 2016 г МСКТ признаки продолженного роста в проекции трахеостомы, аксиальным размером 45*33 мм, протяженностью не менее 55 мм, нельзя исключить инвазию в обе доли щитовидной железы, стенку пищевода. • Rg органов грудной клетки, УЗИ шеи, УЗИ органов брюшной полости: • Данных за регионарные и отдаленные метастазы не выявлено
 Клинический пример N 2 С учетом рецидива в области трахеостомы пациенту назначено лечение: Цетуксимаб 400 мг/м 2 нагрузочная доза в 1 неделю, далее еженедельно 250 мг/м 2 до прогрессирования заболевания или появлением непереносимой токсичности + Цисплатин 100 мг/м 2; ; 5 -Фторурацил 1000 мг/м 2 96 часовая инфузии в 1, 22, 43 день с оценкой динамики от лечения после 3 курсов.
Клинический пример N 2 С учетом рецидива в области трахеостомы пациенту назначено лечение: Цетуксимаб 400 мг/м 2 нагрузочная доза в 1 неделю, далее еженедельно 250 мг/м 2 до прогрессирования заболевания или появлением непереносимой токсичности + Цисплатин 100 мг/м 2; ; 5 -Фторурацил 1000 мг/м 2 96 часовая инфузии в 1, 22, 43 день с оценкой динамики от лечения после 3 курсов.
 Клинический пример N 2 Лечение рецидива 27. 09. 16 1 -ый курс ПХТ по схеме PF + Цетуксимаб : 5 –Фторурацил - 9040 мг, Цисплатин - 220 мг, 1 -е введение Цетуксимаба 400 мг/м 2 - 900 мг. 4. 10. 2016 2 -е введение Цетуксимаба 250 мг/м 2 - 560 мг. 11. 10. 2016 3 -е введение Цетуксимаба 560 мг. 18. 10. 2016 4 -е введение Цетуксимаба 560 мг. Токсические реакции и нежелательные явления • • ECOG 0 -1 Угреподобная сыпь на лице Кожная токсичность - нет Снижение клиренса креатинина - нет.
Клинический пример N 2 Лечение рецидива 27. 09. 16 1 -ый курс ПХТ по схеме PF + Цетуксимаб : 5 –Фторурацил - 9040 мг, Цисплатин - 220 мг, 1 -е введение Цетуксимаба 400 мг/м 2 - 900 мг. 4. 10. 2016 2 -е введение Цетуксимаба 250 мг/м 2 - 560 мг. 11. 10. 2016 3 -е введение Цетуксимаба 560 мг. 18. 10. 2016 4 -е введение Цетуксимаба 560 мг. Токсические реакции и нежелательные явления • • ECOG 0 -1 Угреподобная сыпь на лице Кожная токсичность - нет Снижение клиренса креатинина - нет.
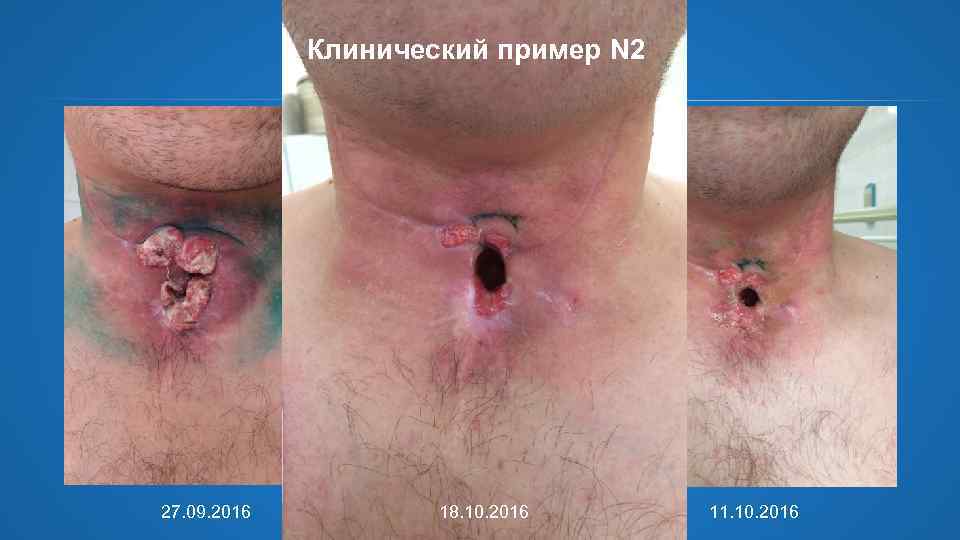 Клинический пример N 2 27. 09. 2016 18. 10. 2016 11. 10. 2016
Клинический пример N 2 27. 09. 2016 18. 10. 2016 11. 10. 2016
 КРАТКАЯ ИНСТРУКЦИЯ по применению лекарственного препарата для медицинского применения ЭРБИТУКС® (ERBITUX®) Регистрационный номер: ЛСР-002745/09 Торговое название препарата: Эрбитукс ® Международное непатентованное название: цетуксимаб (cetuximab) Лекарственная форма: раствор для инфузий Фармакотерапевтическая группа: противоопухолевое средство, антитела моноклональные Код АТХ: L 01 ХС 06 Показания к применению • метастатический колоректальный рак (м. КРР) с экспрессией EGFR и «диким» типом генов RAS в комбинации с химиотерапией на основе иринотекана или продолжительной инфузии фторурацил/кальция фолинат с оксалиплатином; • метастатический колоректальный рак (м. КРР) с экспрессией EGFR и «диким» типом генов RAS в качестве монотерапии в случае неэффективности предшествующей химиотерапии на основе иринотекана и оксалиплатина, а также при непереносимости иринотекана; • местнораспространенный плоскоклеточный рак головы и шеи (ПРГШ) в комбинации с лучевой терапией; • рецидивирующий и/или метастатический плоскоклеточный рак головы и шеи (ПРГШ) в комбинации с химиотерапией на основе препаратов платины; • рецидивирующий и/или метастатический плоскоклеточный рак головы и шеи (ПГРШ) в качестве монотерапии при неэффективности предшествующей химиотерапии на основе препаратов платины. Способ применения и дозы • Терапию препаратом Эрбитукс® необходимо проводить под наблюдением врача, имеющего опыт применения противоопухолевых лекарственных средств. • При всех показаниях Эрбитукс® вводится 1 раз в неделю в начальной дозе 400 мг/ м 2 площади поверхности тела. Первую дозу следует вводить медленно, со скоростью, не привышающей 5 мг/мин. Рекомендуемая продолжтельностьинфузии состовляет 120 минут. Все последующие еженедельные инфузии проводятся в дозе 250 мг/ м 2 площади поверхности тела при рекомендуемой длительности инфузии 60 минут. Скорость инфузии не должна превышать 10 мг/мин Противопоказания • выраженная (3 или 4 степени по шкале токсичности Национального института рака США) гиперчувствительность к цетуксимабу; • беременность; • период кормления грудью; • детский возраст до 18 лет (эффективность и безопасность применения не установлены); • применение препарата Эрбитукс® в комбинации с оксалиплатин-содержащей терапией у пациентов с м. КРР с мутантным типом генов RAS или с неизвестным статусом генов RAS. Перед началом комбинированной терапии необходимо оценить противопоказания к применению сопутствующих химиопрепаратов и лучевой терапии
КРАТКАЯ ИНСТРУКЦИЯ по применению лекарственного препарата для медицинского применения ЭРБИТУКС® (ERBITUX®) Регистрационный номер: ЛСР-002745/09 Торговое название препарата: Эрбитукс ® Международное непатентованное название: цетуксимаб (cetuximab) Лекарственная форма: раствор для инфузий Фармакотерапевтическая группа: противоопухолевое средство, антитела моноклональные Код АТХ: L 01 ХС 06 Показания к применению • метастатический колоректальный рак (м. КРР) с экспрессией EGFR и «диким» типом генов RAS в комбинации с химиотерапией на основе иринотекана или продолжительной инфузии фторурацил/кальция фолинат с оксалиплатином; • метастатический колоректальный рак (м. КРР) с экспрессией EGFR и «диким» типом генов RAS в качестве монотерапии в случае неэффективности предшествующей химиотерапии на основе иринотекана и оксалиплатина, а также при непереносимости иринотекана; • местнораспространенный плоскоклеточный рак головы и шеи (ПРГШ) в комбинации с лучевой терапией; • рецидивирующий и/или метастатический плоскоклеточный рак головы и шеи (ПРГШ) в комбинации с химиотерапией на основе препаратов платины; • рецидивирующий и/или метастатический плоскоклеточный рак головы и шеи (ПГРШ) в качестве монотерапии при неэффективности предшествующей химиотерапии на основе препаратов платины. Способ применения и дозы • Терапию препаратом Эрбитукс® необходимо проводить под наблюдением врача, имеющего опыт применения противоопухолевых лекарственных средств. • При всех показаниях Эрбитукс® вводится 1 раз в неделю в начальной дозе 400 мг/ м 2 площади поверхности тела. Первую дозу следует вводить медленно, со скоростью, не привышающей 5 мг/мин. Рекомендуемая продолжтельностьинфузии состовляет 120 минут. Все последующие еженедельные инфузии проводятся в дозе 250 мг/ м 2 площади поверхности тела при рекомендуемой длительности инфузии 60 минут. Скорость инфузии не должна превышать 10 мг/мин Противопоказания • выраженная (3 или 4 степени по шкале токсичности Национального института рака США) гиперчувствительность к цетуксимабу; • беременность; • период кормления грудью; • детский возраст до 18 лет (эффективность и безопасность применения не установлены); • применение препарата Эрбитукс® в комбинации с оксалиплатин-содержащей терапией у пациентов с м. КРР с мутантным типом генов RAS или с неизвестным статусом генов RAS. Перед началом комбинированной терапии необходимо оценить противопоказания к применению сопутствующих химиопрепаратов и лучевой терапии
 КРАТКАЯ ИНСТРУКЦИЯ по применению лекарственного препарата для медицинского применения ЭРБИТУКС® (ERBITUX®)s С осторожностью При нарушениях функции печени и/или почек, угнетении костномозгового кроветворения, сердечно-легочных заболеваниях в анамнезе, пожилом возрасте. Побочное действие головная боль; конъюнктивит; диарея, тошнота, рвота; кожные реакции; гипомагниемия; дегидротация, в том числе в результате диареи или мукозита, гипокальциемия, анорексия, которая может приводить к снижению массы тела; инфузионно-зависимые реакции легкие и средней степени тяжести; мукозиты, в некоторых случаях тяжелые; инфузионно-зависимые реакции, которые в некоторых случаях могут приводить к летальному исходу, утомляемость; повышение уровня аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ). Особые указания Колоректальный рак с мутантным типом генов RAS Препарат Эрбитукс® не должен применяться при лечении колоректального рака с мутантным типом генов RAS или если статус мутации генов RAS не определен. Результаты клинических исследований свидетельствуют об отрицательном соотношении польза/риск при использовании препарата при опухолях с мутантным типом генов RAS, в частности, применении цетуксимаба в комбинации с химиотерапией на основе оксалиплатина. Особые группы пациентов В клинические исследования до настоящего времени включались только пациенты, имевшие нормальную функцию почек и печени (т. е. концентрация креатинина в сыворотке крови в ≤ 1, 5 раза, активность трансаминаз – в ≤ 5 раз, концентрация билирубина – в ≤ 1, 5 раза выше верхней границы нормы). Цетуксимаб не исследовался у пациентов, имевших одно или несколько из следующих изменений лабораторных показателей: концентрация гемоглобина <9 г/дл; количество лейкоцитов <300 мм 3; абсолютное количество нейтрофилов <1500/мм 3; количество тромбоцитов <100000/мм 3. Опыт применения цетуксимаба в комбинации с лучевой терапией у пациентов с колоректальным раком ограничен. Применение у детей Эффективность цетуксимаба у детей в возрасте младше 18 лет не установлена. Никаких новых данных по безопасности у этих пациентов по сравнению с уже имеющейся информацией, полученной в процессе I фазы клинических исследований, не поступало. Применение у лиц пожилого возраста Коррекция дозы препарата у лиц пожилого возраста не требуется, однако опыт его применения у пациентов в возрасте ≥ 75 лет ограничен. Претензии потребителей и информацию о нежелательных явлениях следует направлять по адресу: «Представительство компании Арес Трейдинг С. А. » , Российская Федерация, 125445 Москва, ул. Смольная 24 Д, офис ООО «Мерк» Тел. : (495) 937 -33 -04, факс: (495) 937 -33 -05, e-mail: safety@merck. ru
КРАТКАЯ ИНСТРУКЦИЯ по применению лекарственного препарата для медицинского применения ЭРБИТУКС® (ERBITUX®)s С осторожностью При нарушениях функции печени и/или почек, угнетении костномозгового кроветворения, сердечно-легочных заболеваниях в анамнезе, пожилом возрасте. Побочное действие головная боль; конъюнктивит; диарея, тошнота, рвота; кожные реакции; гипомагниемия; дегидротация, в том числе в результате диареи или мукозита, гипокальциемия, анорексия, которая может приводить к снижению массы тела; инфузионно-зависимые реакции легкие и средней степени тяжести; мукозиты, в некоторых случаях тяжелые; инфузионно-зависимые реакции, которые в некоторых случаях могут приводить к летальному исходу, утомляемость; повышение уровня аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ). Особые указания Колоректальный рак с мутантным типом генов RAS Препарат Эрбитукс® не должен применяться при лечении колоректального рака с мутантным типом генов RAS или если статус мутации генов RAS не определен. Результаты клинических исследований свидетельствуют об отрицательном соотношении польза/риск при использовании препарата при опухолях с мутантным типом генов RAS, в частности, применении цетуксимаба в комбинации с химиотерапией на основе оксалиплатина. Особые группы пациентов В клинические исследования до настоящего времени включались только пациенты, имевшие нормальную функцию почек и печени (т. е. концентрация креатинина в сыворотке крови в ≤ 1, 5 раза, активность трансаминаз – в ≤ 5 раз, концентрация билирубина – в ≤ 1, 5 раза выше верхней границы нормы). Цетуксимаб не исследовался у пациентов, имевших одно или несколько из следующих изменений лабораторных показателей: концентрация гемоглобина <9 г/дл; количество лейкоцитов <300 мм 3; абсолютное количество нейтрофилов <1500/мм 3; количество тромбоцитов <100000/мм 3. Опыт применения цетуксимаба в комбинации с лучевой терапией у пациентов с колоректальным раком ограничен. Применение у детей Эффективность цетуксимаба у детей в возрасте младше 18 лет не установлена. Никаких новых данных по безопасности у этих пациентов по сравнению с уже имеющейся информацией, полученной в процессе I фазы клинических исследований, не поступало. Применение у лиц пожилого возраста Коррекция дозы препарата у лиц пожилого возраста не требуется, однако опыт его применения у пациентов в возрасте ≥ 75 лет ограничен. Претензии потребителей и информацию о нежелательных явлениях следует направлять по адресу: «Представительство компании Арес Трейдинг С. А. » , Российская Федерация, 125445 Москва, ул. Смольная 24 Д, офис ООО «Мерк» Тел. : (495) 937 -33 -04, факс: (495) 937 -33 -05, e-mail: safety@merck. ru
 Спасибо за внимание
Спасибо за внимание


