MedChem12_1.ppt
- Количество слайдов: 53
 Медицинская химия
Медицинская химия
 Ефимов Павел Викторович
Ефимов Павел Викторович
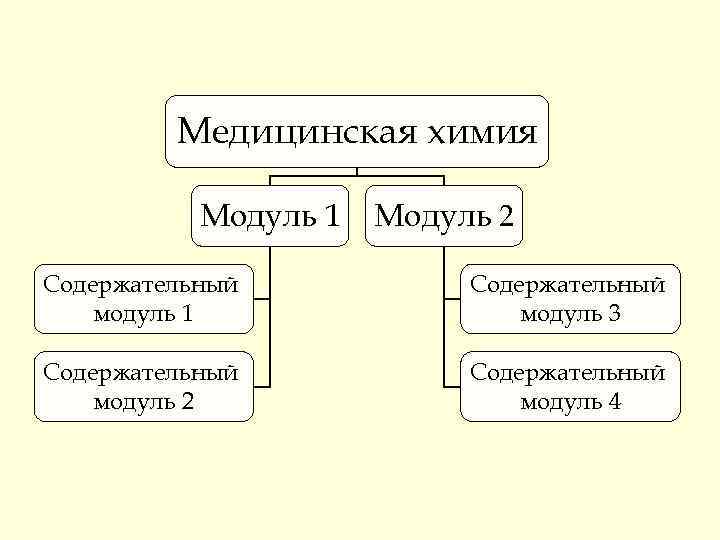 Медицинская химия Модуль 1 Модуль 2 Содержательный модуль 1 модуль 3 Содержательный модуль 2 модуль 4
Медицинская химия Модуль 1 Модуль 2 Содержательный модуль 1 модуль 3 Содержательный модуль 2 модуль 4
 Модуль 1 «Основные типы равновесий в растворах электролитов и в биологических системах. Соединения биоэлементов в организме человека, их биологическое значение и использование в медицине» 5 пар лекций ауд. 5 -84 10 пар практических занятий и 2 контрольные работы ауд. 7 -85, 7 -88 (Центральный корпус)
Модуль 1 «Основные типы равновесий в растворах электролитов и в биологических системах. Соединения биоэлементов в организме человека, их биологическое значение и использование в медицине» 5 пар лекций ауд. 5 -84 10 пар практических занятий и 2 контрольные работы ауд. 7 -85, 7 -88 (Центральный корпус)
 Модуль 1 Оценивание Практические занятия. Максимум 120 баллов. Тестовый контроль. Максимум 2× 40=80 баллов. Итого: Максимум 200 баллов. Баллы ECTS Оценка 180 -200 A Відмінно 166 -179 B Добре 150 -165 C Добре 136 -149 D Задовільно 120 -135 E Задовільно <120 F Незадовільно
Модуль 1 Оценивание Практические занятия. Максимум 120 баллов. Тестовый контроль. Максимум 2× 40=80 баллов. Итого: Максимум 200 баллов. Баллы ECTS Оценка 180 -200 A Відмінно 166 -179 B Добре 150 -165 C Добре 136 -149 D Задовільно 120 -135 E Задовільно <120 F Незадовільно
 Модуль 1 • Классы неорганических • Комплексные соединения, соединений. Общие равновесия комплексообразования в закономерности протекания растворах и биологических химических реакций. системах. • Общая характеристика • Окислительно- растворов и растворов восстановительные процессы в растворах и биологических электролитов. системах • Кислотно-основные • Равновесия в растворах равновесия в растворах и малорастворимых биологических системах. электролитов • Соединения биоэлементов в биологических системах, их биологическое значение и использование в медицине
Модуль 1 • Классы неорганических • Комплексные соединения, соединений. Общие равновесия комплексообразования в закономерности протекания растворах и биологических химических реакций. системах. • Общая характеристика • Окислительно- растворов и растворов восстановительные процессы в растворах и биологических электролитов. системах • Кислотно-основные • Равновесия в растворах равновесия в растворах и малорастворимых биологических системах. электролитов • Соединения биоэлементов в биологических системах, их биологическое значение и использование в медицине
 Самостоятельная подготовка • Классы неорганических соединений. Общие закономерности протекания химических реакций.
Самостоятельная подготовка • Классы неорганических соединений. Общие закономерности протекания химических реакций.
 Общая характеристика растворов и растворов электролитов.
Общая характеристика растворов и растворов электролитов.
 • Раствор - система переменного состава, состоящая из двух или более компонентов • Гомогенная система – система, состоящая из одной фазы. Гетерогенная система – система, состоящая из двух или большего числа фаз.
• Раствор - система переменного состава, состоящая из двух или более компонентов • Гомогенная система – система, состоящая из одной фазы. Гетерогенная система – система, состоящая из двух или большего числа фаз.
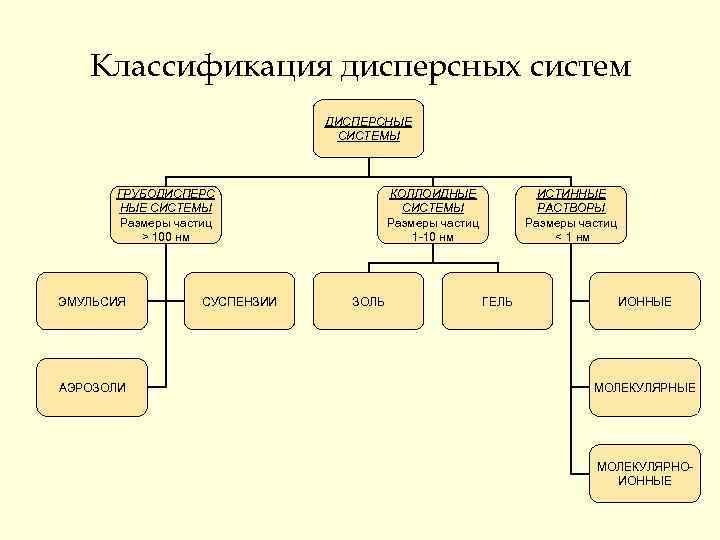 Классификация дисперсных систем ДИСПЕРСНЫЕ СИСТЕМЫ ГРУБОДИСПЕРС КОЛЛОИДНЫЕ ИСТИННЫЕ СИСТЕМЫ СИСТЕМЫ РАСТВОРЫ Размеры частиц > 100 нм 1 -10 нм < 1 нм ЭМУЛЬСИЯ СУСПЕНЗИИ ЗОЛЬ ГЕЛЬ ИОННЫЕ АЭРОЗОЛИ МОЛЕКУЛЯРНЫЕ МОЛЕКУЛЯРНО- ИОННЫЕ
Классификация дисперсных систем ДИСПЕРСНЫЕ СИСТЕМЫ ГРУБОДИСПЕРС КОЛЛОИДНЫЕ ИСТИННЫЕ СИСТЕМЫ СИСТЕМЫ РАСТВОРЫ Размеры частиц > 100 нм 1 -10 нм < 1 нм ЭМУЛЬСИЯ СУСПЕНЗИИ ЗОЛЬ ГЕЛЬ ИОННЫЕ АЭРОЗОЛИ МОЛЕКУЛЯРНЫЕ МОЛЕКУЛЯРНО- ИОННЫЕ
 Истинные растворы ь Молекулярные – это водные растворы неэлектролитов – органических веществ (спирта, глюкозы, сахарозы и т. д. ); ь Ионные – это растворы сильных электролитов (щелочей, солей, кислот – Na. OH, K 2 SO 4. HNO 3, HCl. O 4); ь Молекулярно – ионные – это растворы слабых электролитов (азотистой, сероводородной кислот и др. ).
Истинные растворы ь Молекулярные – это водные растворы неэлектролитов – органических веществ (спирта, глюкозы, сахарозы и т. д. ); ь Ионные – это растворы сильных электролитов (щелочей, солей, кислот – Na. OH, K 2 SO 4. HNO 3, HCl. O 4); ь Молекулярно – ионные – это растворы слабых электролитов (азотистой, сероводородной кислот и др. ).
 Способы выражения состава растворов • Массовая доля ω • Мольная доля Х • Молярность С • Моляльность Сm
Способы выражения состава растворов • Массовая доля ω • Мольная доля Х • Молярность С • Моляльность Сm
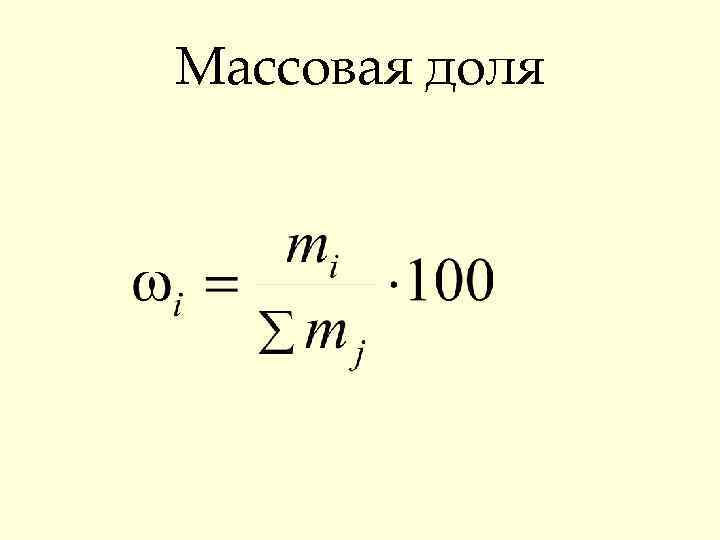 Массовая доля
Массовая доля
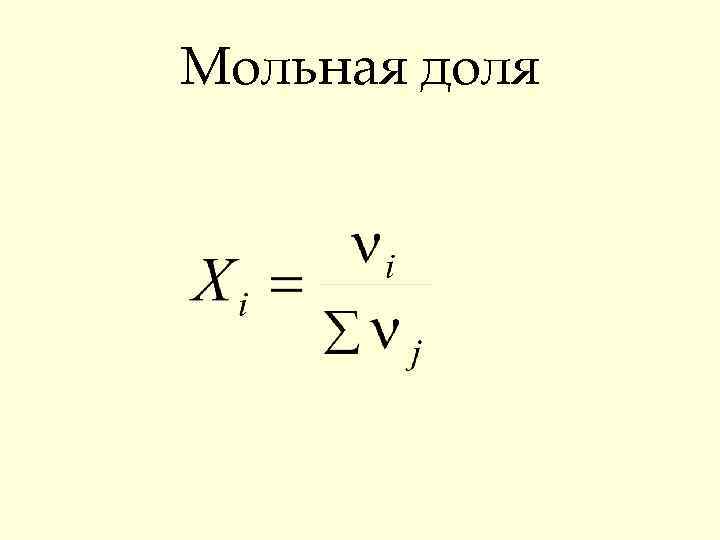 Мольная доля
Мольная доля
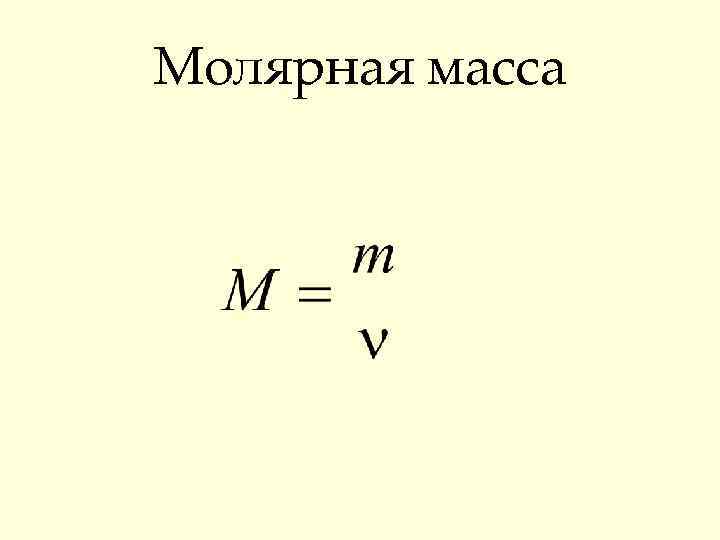 Молярная масса
Молярная масса
 Молярная концентрация
Молярная концентрация
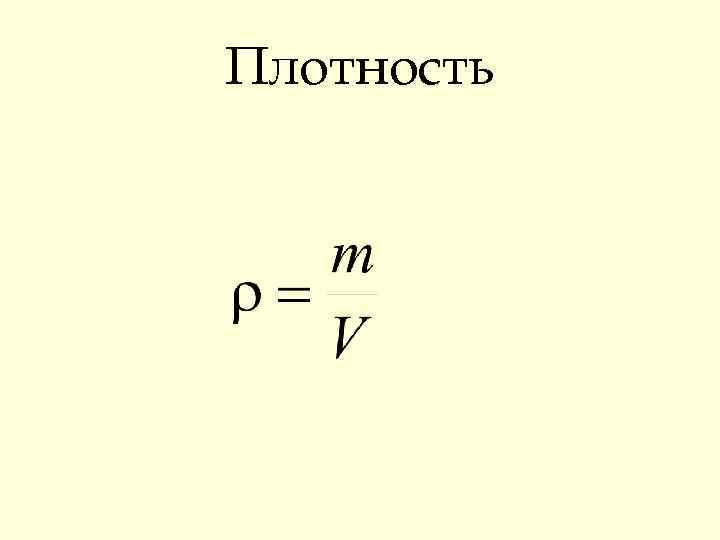 Плотность
Плотность
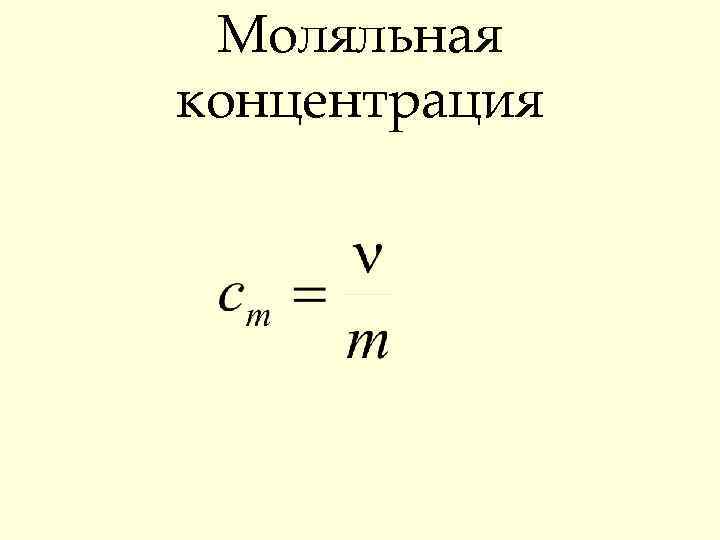 Моляльная концентрация
Моляльная концентрация
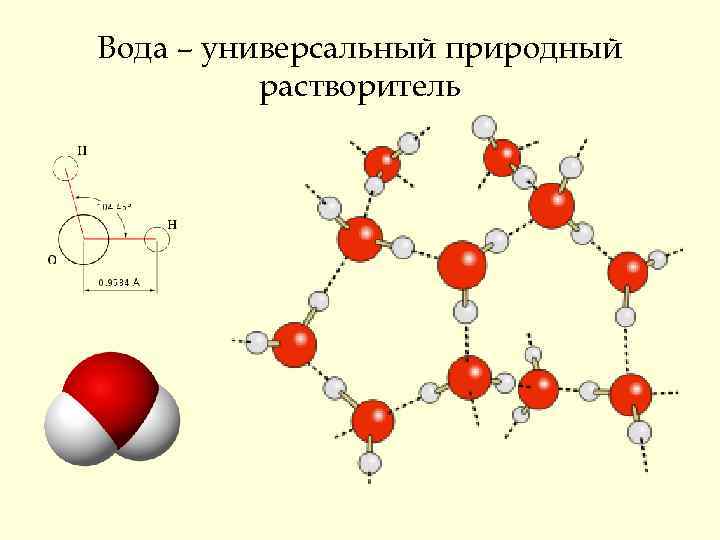 Вода – универсальный природный растворитель
Вода – универсальный природный растворитель
 В биохимических процессах вода выступает как : 1. Растворитель 2. Реагент 3. Продукт реакции
В биохимических процессах вода выступает как : 1. Растворитель 2. Реагент 3. Продукт реакции
 Существование межмолекулярных водородных связей определяет аномальные физические свойства воды: 1. Высокая теплоемкость 2. Высокая температура кипения 3. Большая теплота испарения 4. Высокое поверхностное натяжение 5. Высокая вязкость 6. Более высокая плотность в жидком состоянии, чем в твердом Высокая диэлектрическая проницаемость (ε = 80) …
Существование межмолекулярных водородных связей определяет аномальные физические свойства воды: 1. Высокая теплоемкость 2. Высокая температура кипения 3. Большая теплота испарения 4. Высокое поверхностное натяжение 5. Высокая вязкость 6. Более высокая плотность в жидком состоянии, чем в твердом Высокая диэлектрическая проницаемость (ε = 80) …
 Термодинамика процесса растворения Растворение – процесс самопроизвольный, поэтому ∆Gрастворения < 0. ∆ Gрастворения = ∆Н растворения –Т ∆Sрастворения
Термодинамика процесса растворения Растворение – процесс самопроизвольный, поэтому ∆Gрастворения < 0. ∆ Gрастворения = ∆Н растворения –Т ∆Sрастворения
 Энергетическая характеристика растворения 1. Рассмотрим растворение твердого вещества с ионной связью в воде. ∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации > 0 < 0 Образование хим. связи Разрушение к. р. – –экзотермический эндотермический процесс процесс
Энергетическая характеристика растворения 1. Рассмотрим растворение твердого вещества с ионной связью в воде. ∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации > 0 < 0 Образование хим. связи Разрушение к. р. – –экзотермический эндотермический процесс процесс
 1. Если |∆Н ф. п. |> |∆Н гидр. |, то ∆Н растворения > 0, эндо-процесс, раствор охлаждается (КNO 3, NH 4 NO 3) 2. Если |∆Н ф. п. |<|∆Н гидр. |, то ∆Н растворения < 0, экзо-процесс, раствор нагревается (Na. OH ) Т. о. при растворении тв. /ж. 0 < ∆ Н растворения < 0
1. Если |∆Н ф. п. |> |∆Н гидр. |, то ∆Н растворения > 0, эндо-процесс, раствор охлаждается (КNO 3, NH 4 NO 3) 2. Если |∆Н ф. п. |<|∆Н гидр. |, то ∆Н растворения < 0, экзо-процесс, раствор нагревается (Na. OH ) Т. о. при растворении тв. /ж. 0 < ∆ Н растворения < 0
 Энтропийная характеристика растворения ∆Sрастворения = ∆S фаз. перехода + ∆S гидратации >> 0 < 0, т. к. уменьшается число частиц в единице объёма Т. о. , |∆S ф. п. |> |∆S гидр. |, поэтому ∆Sрастворения тв. вещ-в > 0
Энтропийная характеристика растворения ∆Sрастворения = ∆S фаз. перехода + ∆S гидратации >> 0 < 0, т. к. уменьшается число частиц в единице объёма Т. о. , |∆S ф. п. |> |∆S гидр. |, поэтому ∆Sрастворения тв. вещ-в > 0
 2. Рассмотрим растворение газообразного вещества в воде. Обычно ∆Sрастворения газов < 0, ∆Gрастворения = ∆Н растворения – Т ∆Sрастворения ∆Нрастворения=∆G растворения + Т ∆Sрастворения ∆Gраств. < 0 и ∆Sраств. < 0 ; ∆Н растворения газов < 0
2. Рассмотрим растворение газообразного вещества в воде. Обычно ∆Sрастворения газов < 0, ∆Gрастворения = ∆Н растворения – Т ∆Sрастворения ∆Нрастворения=∆G растворения + Т ∆Sрастворения ∆Gраств. < 0 и ∆Sраств. < 0 ; ∆Н растворения газов < 0
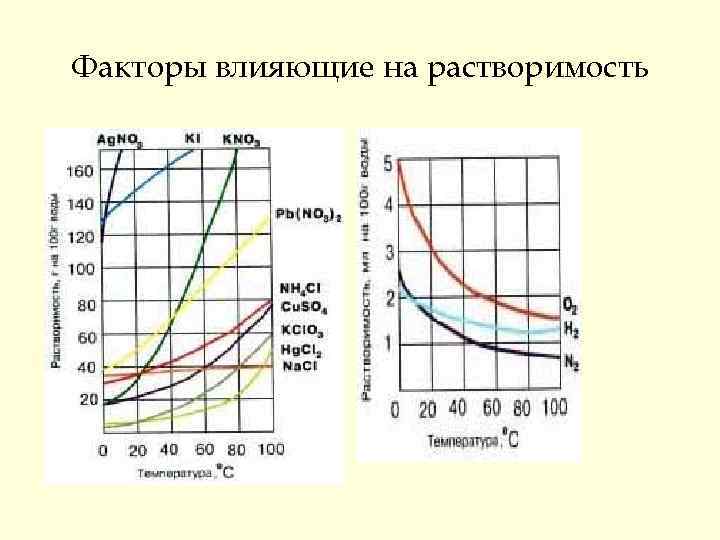 Факторы влияющие на растворимость
Факторы влияющие на растворимость
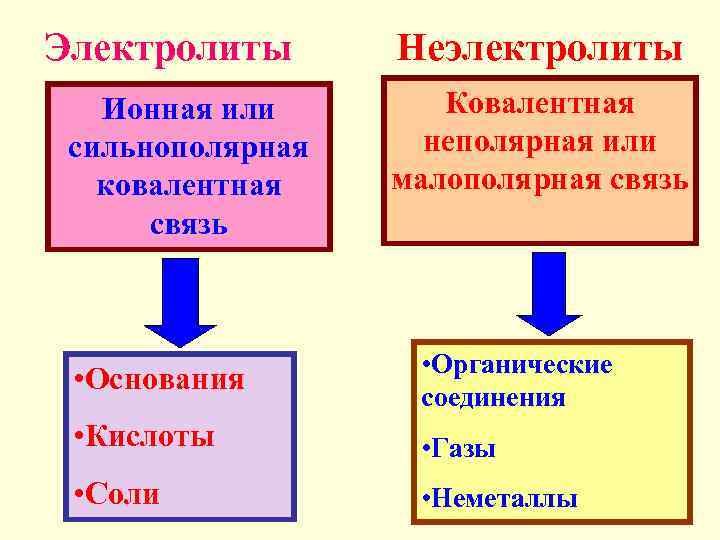 Электролиты Неэлектролиты Ионная или Ковалентная сильнополярная неполярная или ковалентная малополярная связь • Органические • Основания соединения • Кислоты • Газы • Соли • Неметаллы
Электролиты Неэлектролиты Ионная или Ковалентная сильнополярная неполярная или ковалентная малополярная связь • Органические • Основания соединения • Кислоты • Газы • Соли • Неметаллы
 В раствор переходят гидратированные ионы
В раствор переходят гидратированные ионы
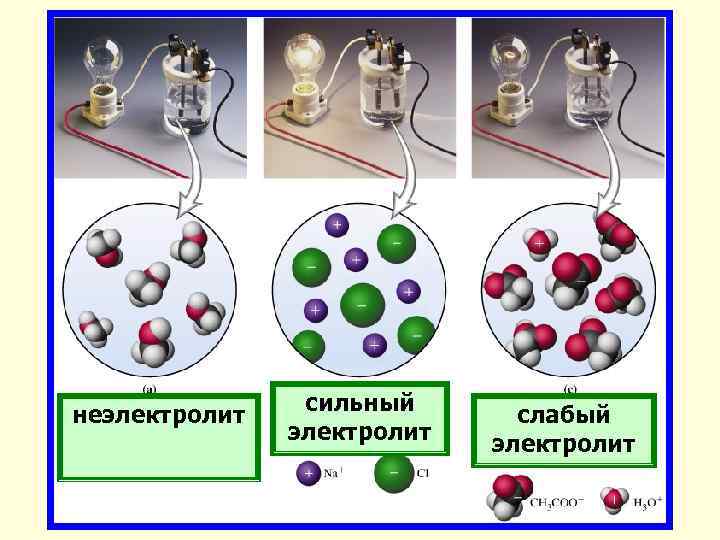 сильный неэлектролит слабый электролит
сильный неэлектролит слабый электролит
 Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
 С- исходная молярная концентрация кислоты, моль/л; - степень диссоциации; С - число продиссоциировавших молекул; (С- С ) – число не продиссоциировавших (оставшихся) молекул; [H+] = [CH 3 COO -] = С
С- исходная молярная концентрация кислоты, моль/л; - степень диссоциации; С - число продиссоциировавших молекул; (С- С ) – число не продиссоциировавших (оставшихся) молекул; [H+] = [CH 3 COO -] = С
 для слабых электролитов 0 и (1 - ) 1, тогда закон разведения Оствальда (1888 г. )
для слабых электролитов 0 и (1 - ) 1, тогда закон разведения Оствальда (1888 г. )
 Теория электролитической диссоциации (ТЭД) электролитов Аррениуса -это теория растворов слабых электролитов. Факторы, влияющие на : 1. природа вещества а) растворителя (дипольный момент , диэлектрическая проницаемость) б) характер хим. связи в молекуле растворенного вещества. 2. концентрация вещества ( с С, ↓) 3. температура (с Т, )
Теория электролитической диссоциации (ТЭД) электролитов Аррениуса -это теория растворов слабых электролитов. Факторы, влияющие на : 1. природа вещества а) растворителя (дипольный момент , диэлектрическая проницаемость) б) характер хим. связи в молекуле растворенного вещества. 2. концентрация вещества ( с С, ↓) 3. температура (с Т, )
 4. наличие одноименных ионов – принцип Ле- Шателье: а) НCl, H+, х. р. , б) СН 3 СООNa, х. р. , в) Na. OH, OH-, х. р. , Т. о. , = f (C, Т)
4. наличие одноименных ионов – принцип Ле- Шателье: а) НCl, H+, х. р. , б) СН 3 СООNa, х. р. , в) Na. OH, OH-, х. р. , Т. о. , = f (C, Т)
 К дис. зависит: 1. от природы электролита 2. от температуры: Т , Кдис Т. к. Кдис. f (C) , то ее сравнивают для разных электролитов. Чем больше Кдис. , тем сильнее электролит.
К дис. зависит: 1. от природы электролита 2. от температуры: Т , Кдис Т. к. Кдис. f (C) , то ее сравнивают для разных электролитов. Чем больше Кдис. , тем сильнее электролит.
 Диссоциация воды. Нонное произведение воды. Н+ Н 2 О Н+ + ОН-
Диссоциация воды. Нонное произведение воды. Н+ Н 2 О Н+ + ОН-
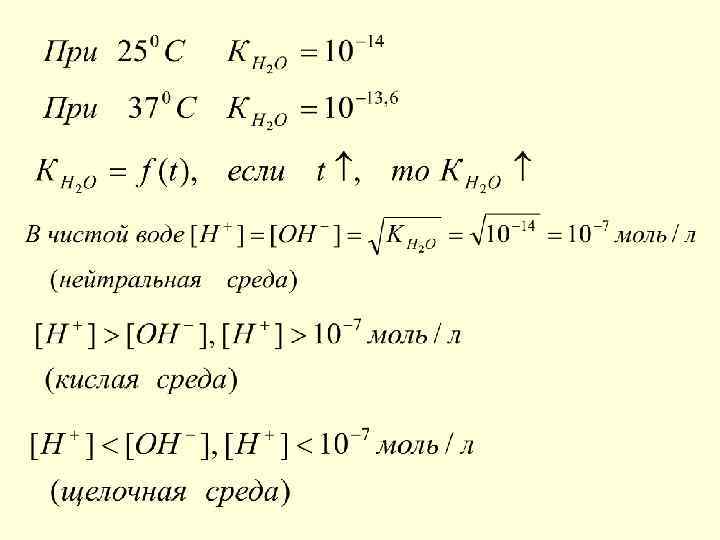
 Водородный показатель (р. Н) 1909 г. Серенсен
Водородный показатель (р. Н) 1909 г. Серенсен
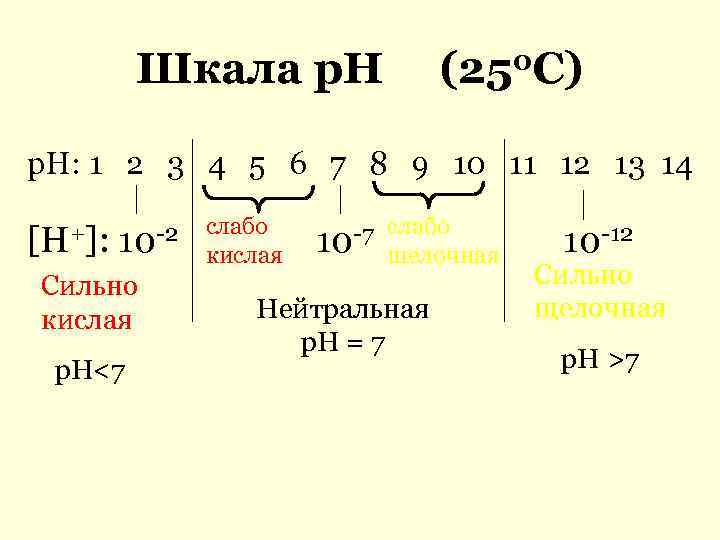 Шкала р. Н (250 С) р. Н: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 слабо -7 слабо [H+]: 10 -2 кислая 10 щелочная 10 -12 Сильно Сильно кислая Нейтральная щелочная р. Н = 7 р. Н<7 р. Н >7
Шкала р. Н (250 С) р. Н: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 слабо -7 слабо [H+]: 10 -2 кислая 10 щелочная 10 -12 Сильно Сильно кислая Нейтральная щелочная р. Н = 7 р. Н<7 р. Н >7
 Расчет р. Н растворов I. Сильных кислот и оснований fa 1
Расчет р. Н растворов I. Сильных кислот и оснований fa 1
 II. Слабых кислот и оснований
II. Слабых кислот и оснований
![Если неизвестно: [СН 3 СОО-]=[Н+] В справочнике Если неизвестно: [СН 3 СОО-]=[Н+] В справочнике](https://present5.com/presentation/3/-43076683_132558908.pdf-img/-43076683_132558908.pdf-43.jpg) Если неизвестно: [СН 3 СОО-]=[Н+] В справочнике
Если неизвестно: [СН 3 СОО-]=[Н+] В справочнике
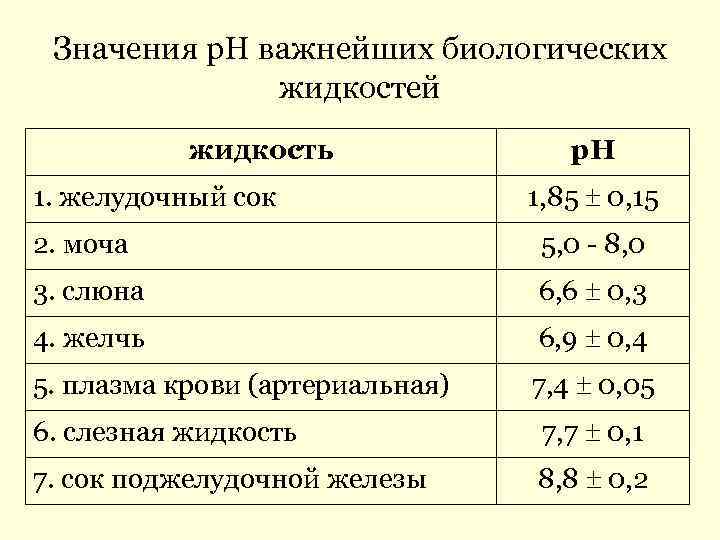 Значения р. Н важнейших биологических жидкостей жидкость р. Н 1. желудочный сок 1, 85 0, 15 2. моча 5, 0 - 8, 0 3. слюна 6, 6 0, 3 4. желчь 6, 9 0, 4 5. плазма крови (артериальная) 7, 4 0, 05 6. слезная жидкость 7, 7 0, 1 7. сок поджелудочной железы 8, 8 0, 2
Значения р. Н важнейших биологических жидкостей жидкость р. Н 1. желудочный сок 1, 85 0, 15 2. моча 5, 0 - 8, 0 3. слюна 6, 6 0, 3 4. желчь 6, 9 0, 4 5. плазма крови (артериальная) 7, 4 0, 05 6. слезная жидкость 7, 7 0, 1 7. сок поджелудочной железы 8, 8 0, 2
 Теория растворов сильных электролитов (1923 г, Дебай, Хюккель) 1. Сильные электролиты в водных растворах диссоциируют полностью, т. е. для них = 1 или 100 % , молекул электролита нет. Поэтому, ни , ни Кд к сильным электролитам неприменимы. 2. В растворах за счет сильного ион-дипольного взаимодействия с молекулами Н 2 О образуются гидратные оболочки иона. 3. Сильное ион-ионное взаимодействие создает ионные атмосферы (каждый гидратированный ион окружен гидратированными ионами противоположного заряда).
Теория растворов сильных электролитов (1923 г, Дебай, Хюккель) 1. Сильные электролиты в водных растворах диссоциируют полностью, т. е. для них = 1 или 100 % , молекул электролита нет. Поэтому, ни , ни Кд к сильным электролитам неприменимы. 2. В растворах за счет сильного ион-дипольного взаимодействия с молекулами Н 2 О образуются гидратные оболочки иона. 3. Сильное ион-ионное взаимодействие создает ионные атмосферы (каждый гидратированный ион окружен гидратированными ионами противоположного заряда).
 Активность (а) Аналитическая концентрация Коэффициент активности- … Для реальных растворов fa < 1. В сильно разбавленных растворах fa 1.
Активность (а) Аналитическая концентрация Коэффициент активности- … Для реальных растворов fa < 1. В сильно разбавленных растворах fa 1.
 fa зависит от : 1. концентрации раствора а) С , fa б) С 0, fa 1. 2. природы иона (заряд и радиус): Z , fa ; r , fa , если Z = cоnst; 3. температуры: Т , fa 4. природа растворителя ( , ) 5. ионной силы раствора (I ): I , fa
fa зависит от : 1. концентрации раствора а) С , fa б) С 0, fa 1. 2. природы иона (заряд и радиус): Z , fa ; r , fa , если Z = cоnst; 3. температуры: Т , fa 4. природа растворителя ( , ) 5. ионной силы раствора (I ): I , fa
 Ионная сила раствора (I) для разбавленных растворов Сm ~ Cм I биологических жидкостей, например плазмы крови ~0, 15 моль/кг. Изотонический раствор 0, 85% (0, 15 М) р-р Na. Cl , I= 0, 15 моль/кг. Сm (Na. Cl) = 0, 15 моль/ кг
Ионная сила раствора (I) для разбавленных растворов Сm ~ Cм I биологических жидкостей, например плазмы крови ~0, 15 моль/кг. Изотонический раствор 0, 85% (0, 15 М) р-р Na. Cl , I= 0, 15 моль/кг. Сm (Na. Cl) = 0, 15 моль/ кг
 Для разбавленных растворов, в которых I ≤ 0, 01: Предельный з-н Дебая-Хюккеля Для растворов электролитов одинаковозарядных (Mg. SO 4):
Для разбавленных растворов, в которых I ≤ 0, 01: Предельный з-н Дебая-Хюккеля Для растворов электролитов одинаковозарядных (Mg. SO 4):
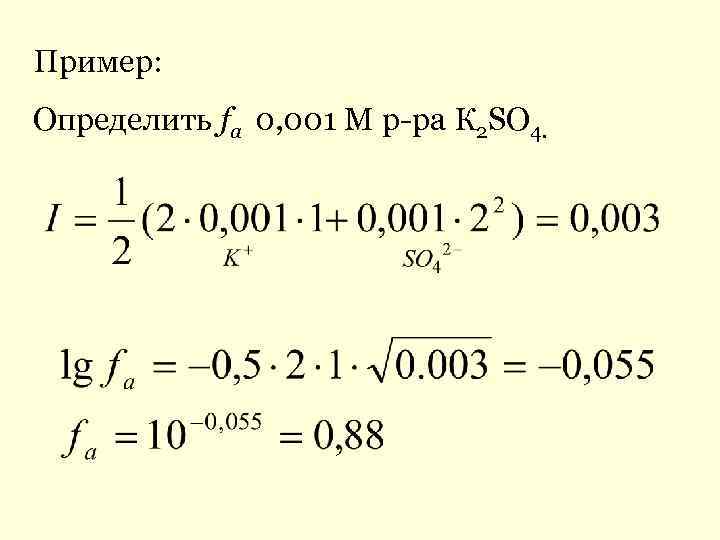 Пример: Определить fa 0, 001 М р-ра К 2 SO 4.
Пример: Определить fa 0, 001 М р-ра К 2 SO 4.
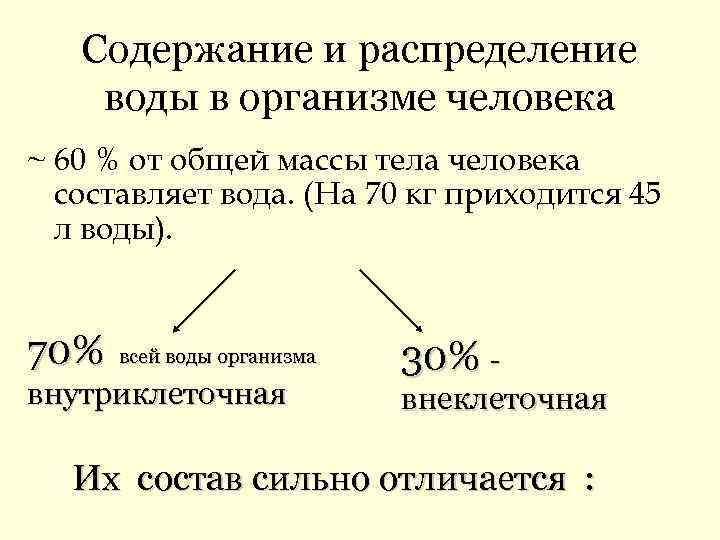 Содержание и распределение воды в организме человека ~ 60 % от общей массы тела человека составляет вода. (На 70 кг приходится 45 л воды). 70% всей воды организма 30% - внутриклеточная внеклеточная Их состав сильно отличается :
Содержание и распределение воды в организме человека ~ 60 % от общей массы тела человека составляет вода. (На 70 кг приходится 45 л воды). 70% всей воды организма 30% - внутриклеточная внеклеточная Их состав сильно отличается :
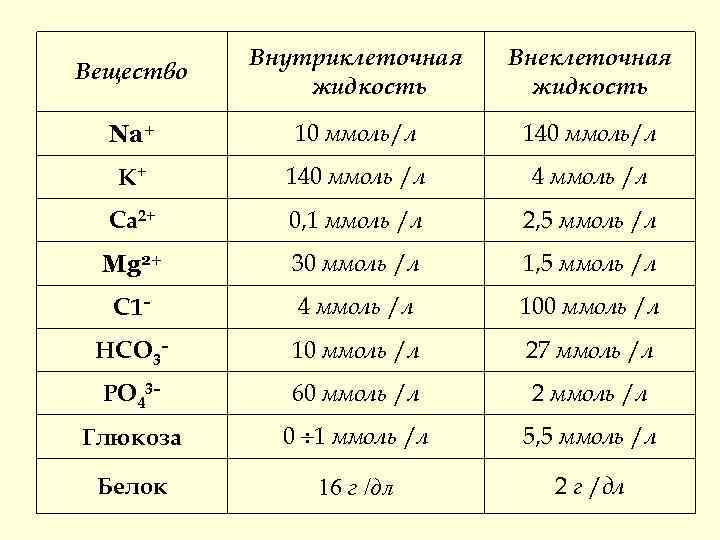 Внутриклеточная Внеклеточная Вещество жидкость Na+ 10 ммоль/л 140 ммоль/л К+ 140 ммоль /л 4 ммоль /л Са 2+ 0, 1 ммоль /л 2, 5 ммоль /л Mg 2+ 30 ммоль /л 1, 5 ммоль /л С 1– 4 ммоль /л 100 ммоль /л НСО 3– 10 ммоль /л 27 ммоль /л РO 43– 60 ммоль /л 2 ммоль /л Глюкоза 0 ¸ 1 ммоль /л 5, 5 ммоль /л Белок 16 г /дл 2 г /дл
Внутриклеточная Внеклеточная Вещество жидкость Na+ 10 ммоль/л 140 ммоль/л К+ 140 ммоль /л 4 ммоль /л Са 2+ 0, 1 ммоль /л 2, 5 ммоль /л Mg 2+ 30 ммоль /л 1, 5 ммоль /л С 1– 4 ммоль /л 100 ммоль /л НСО 3– 10 ммоль /л 27 ммоль /л РO 43– 60 ммоль /л 2 ммоль /л Глюкоза 0 ¸ 1 ммоль /л 5, 5 ммоль /л Белок 16 г /дл 2 г /дл
 Внеклеточная жидкость (30%) Межклеточная Внутрисосудистая (7%) тканевая (23 %) Их состав почти одинаков, разница лишь в содержании белков. ( больше белка во внутрисосудистой жидкости)
Внеклеточная жидкость (30%) Межклеточная Внутрисосудистая (7%) тканевая (23 %) Их состав почти одинаков, разница лишь в содержании белков. ( больше белка во внутрисосудистой жидкости)


