2012 ММ ПатогенностьЗадМетодыКлинМикроб.ppt
- Количество слайдов: 78

Медицинская микробиология Лекция 1 О патогенности микроорганизмов ¡ Задачи и методы клинической микробиологии ¡ СПб. ГУ ¡ 2012 ¡

Проф. В. Я. Александров ¡ "Уровень познания природы человеком можно оценивать не только по сумме узнанного и понятого, но также и по сумме осознанного незнания".

О патогенности микроорганизмов

Вопросы по разделу Патогенность ¡ ¡ ¡ ¡ ¡ 1. Определение патогенности 2. Атрибуты патогенности 3. Патогенные МО 4. Условия развития патогенного процесса 5. Контроль за проявлением патогенных свойств МО 6. Вирулентность 7. Факторы патогенности 8. Классификация МО по патогенности 9. Формирование патогенных штаммов МО 10. Функции "островов патогенности"

Главные термины Патогенность ¡ Вирулентность ¡ Патогенные микроорганизмы ¡ Факторы патогенности ¡

Патогенность микроорганизмов – это способность вызывать инфекционный процесс ¡ ¡ ¡ Патогенность от греч. pathos –страдание, болезнь genos -рождение

Проф. В. Г. Петровская (сер. XX в. ) ¡ Классические атрибуты патогенности бактерий: ¡ 1. инфективность ¡ 2. инвазивность (только внутриклеточное проникновение) ¡ 3. токсигенность

Современные атрибуты патогенности (проф. Бондаренко В. М. ) ¡ 1. адгезивность ¡ 2. инвазивность (общая) ¡ 3. токсигенность

Патогенные микроорганизмы ¡ Это микроорганизмы, способные преодолевать защитные силы макроорганизма и вызывать инфекционный процесс в организме человека, животных и растений

Условия развития инфекционного процесса Развитие инфекционного процесса – результат взаимодействия двух систем: ¡ СООБЩЕСТВА МИКРООРГАНИЗМОВ ¡ И МАКРООРГАНИЗМА ¡ Развитие инфекционного процесса зависит от: лабильности перестройки метаболизма патогенных микроорганизмов и физиологических особенностей и иммунореактивности макроорганизма ¡

Контроль за проявлением патогенных свойств бактерий Осуществляется на генетическом уровне ¡ Является результатом сложного взаимодействия бактериальной хромосомы и генов специфических плазмид ¡

Патогенность - признак непостоянный! ¡ ¡ Для оценки степени патогенности существует количественная мера: первое определение вирулентность - это количественная мера патогенности определенной бактериальной культуры в отношении определенного макроорганизма при определенных условиях заражения

Вирулентность (второе определение) ¡ это степень патогенности, при которой возбудитель способен инфицировать макроорганизм и вызвать заболевание

Вирулентность определенного возбудителя заболевания зависит от 1. количества инфицирующих бактерий ¡ 2. пути их поступления в организм ¡ 3. набора факторов патогенности у данных микроорганизмов ¡ 4. специфических и неспецифических защитных механизмов организма-хозяина ¡

Вирулентность определяют ¡ ¡ ¡ вычисляя количество бактерий, необходимое для гибели животного в определенный период времени при определенном способе поражения: единицы измерения вирулентности: DL - летальная доза – наименьшее количество МО, способное вызвать гибель лабораторных животных LD 50 – летальная доза для 50% лаб. животных DCL – dosis certe letalis – 100% гибель ID- минимальная доза МО, способная вызвать заболевание

Факторы патогенности ¡ Это компоненты бактериальных клеток или вырабатываемые ими вещества, благодаря которым они способны вызывать глубокие изменения в клетках и органах макроорганизма, приводящие к развитию инфекционного процесса ¡ Ими могут быть капсула, жгутики, пили, адгезины наружной мембраны, ферменты, токсины

4 группы факторов патогенности (по функциям) 1. адгезия (прикрепление) ¡ 2. инвазия (проникновение) ¡ 3. токсинообразование (вызывают патоморфологические изменения различных органов и тканей) ¡ 4. индуция цитокинов и медиаторов воспаления (приводит к иммунопатологии) ¡

Классификация бактерий по патогенности ¡ ¡ В зависимости от наличия факторов патогенности бактерии условно разделены на три группы: 1. патогенные (вызывают инфекционный процесс) 2. условно-патогенные (вызывают оппортунистические инфекции) 3. непатогенные (не способны вызывать инфекционный процесс)

Степень паразитизма МО ¡ ¡ ¡ 1. Облигатные паразиты (все этапы жизненного цикла связаны с организмом хозяина) 2. Факультативные паразиты(часть жизненного цикла связана с организмом хозяина) 3. Случайные паразиты (паразитирование в организме – случайная фаза жизненного цикла)

Формирование патогенных штаммов ¡ ¡ ¡ Эволюция бактерий определяется следующими факторами: 1. частотой точечных мутаций 2. высоким уровнем рекомбинаций 3. горизонтальным переносом генов (перенос генетического материалы между бактериями различных видов и родов) Горизонтальный перенос генов – основной механизм эволюции бактерий, ведущий к качественным изменениям состава микробных геномов в течение короткого периода времени

Передача генетической информации ¡ ¡ ¡ ¡ ¡ Механизм распространения бактериальных генов путем: 1. конъюгации 2. трансдукции 3. трансформации Мобильный пул генов бактерий состоит из носителей: 1. бактериофаги 2. плазмиды 3. транспозоны 4. геномные «острова патогенности»

Геномные «острова» патогенности ¡ "Острова патогенности" – это сегменты бактериальной ДНК, несущие один или несколько генов вирулентности, приобретенные через мобильные генетические элементы: транспозоны, плазмиды или бактериофаги.
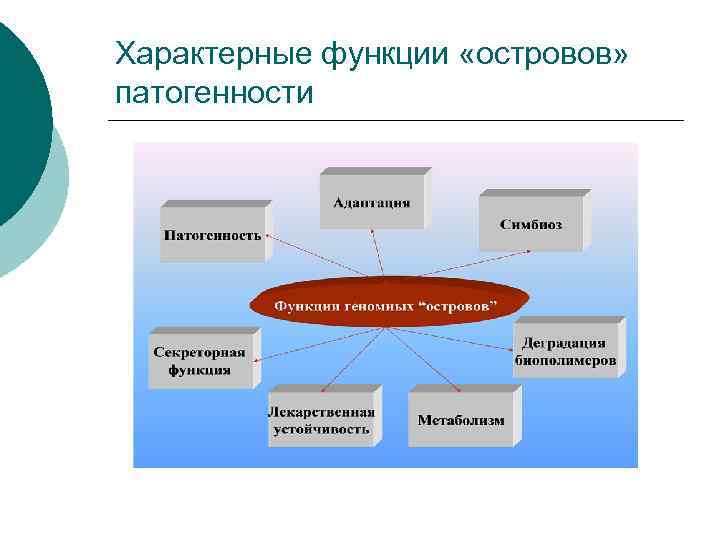
Характерные функции «островов» патогенности

Вопросы по разделу Задачи и методы клинической микробиологии ¡ ¡ ¡ ¡ ¡ 1. Определение "клиническая микробиология" 2. 6 групп задач клинической микробиологии 3. Микроскопические методы 4. Культуральные методы 5. Иммунологические методы 6. Иммунологические реакции 7. Диагностические критерии 8. Нарастание титра АТ 9. Молекулярно-биологические методы 10. Неспецифические тесты

Клиническая микробиология – это научная дисциплина, изучающая характер взаимоотношений между макро - и микроорганизмами в норме и, главным образом, в динамике патологического процесса с учетом проводимой антимикробной терапии

Клиническая микробиология самостоятельный статус в 50 -60 -е гг. XX в. обнаружено и описано много новых возбудителей заболеваний открыто явление возрастания устойчивости возбудителей к АМП началась активная разработка методов лабораторной диагностики инфекционных заболеваний

Клиническая микробиология базируется на клиникодиагностических лабораторных исследованиях инфекционных заболеваний ¡ позволяет лучше понять стратегию и тактику врача при встрече с патологией, вызванной возбудителями инфекционных заболеваний ¡

Задачи клинической микробиологии 1 -я Задача Оценить природу возбудителя и как можно быстрее идентифицировать его. уметь отличить возбудителя заболевания от представителя нормальной микрофлоры.

2 -я задача клинической микробиологии Правильно выбрать орган и место, откуда необходимо брать материал у больного на исследование. ¡ Напр. , Salmonella typhi, сначала находится в тонком кишечнике, с 10 -го дня начала инфекционного процесса персистирует в крови, а на 5 -й неделе снова попадает в тонкий кишечник. ¡

3 -я задача клинической микробиологии 1. ¡ ¡ ¡ Соблюдать правила взятия и транспортировки клинического материала от больного. Например, при подозрении на менингит и коклюш материал берут из верхних дыхательных путей тампоном на проволочке, который загнут под углом 45°. менингит – вверх коклюш – вниз

4 -я задача клинической микробиологии Правильный выбор условий выращивания возбудителя заболевания. Главная цель получение чистой культуры. Нужно подобрать состав питательной среды и условия выращивания (температуру и аэрацию).

5 -я задача клинической микробиологии Выбор соответствующей антимикробной терапии. Желательно еще до получения окончательных результатов лабораторных исследований. ¡ На основании: предварительных микроскопических исследований узнать тип строения клеточной стенки (Гр+ или Гр-), при выявлении чувствительности микроорганизмов к АМП в процессе выращивания ¡

6 -я задача клинической микробиологии Правильная интерпретация результатов лабораторных исследований. с учетом и во взаимосвязи со всем комплексом клинической информации о больном

Основные методы, используемые для решения поставленных выше задач ¡ ¡ 1. Микробиологические 2. Иммунологические 3. Молекулярно-биологические 4. Неспецифические лабораторные тесты

Микробиологические методы выявление причины инфекционного процесса 1. Микроскопические 2. Культуральные

Микроскопические методы Визуализация возбудителя инфекционного процесса Прямое исследование патологического материала от больного: ¡ 1. световая микроскопия ¡ 2. люминесцентная микроскопия ¡ 3. электронная микроскопия

Световая микроскопия ¡ ¡ ¡ Цель –морфологическая характеристика возбудителя по форме, размерам, подвижности, наличию спор. Достоинства–в большинстве случаев очень полезны, т. к. достаточно быстры. Недостатки -для диагностики имеют лишь ориентировачное значение, а результат расценивается как предварительный. Световая микроскопия включает: микроскопию нативного материала – влажные препараты микроскопия фиксированных, окрашенных препаратов
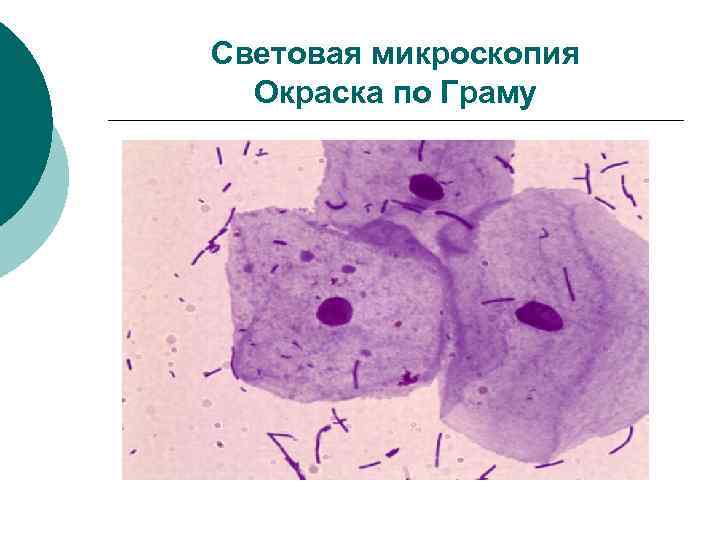
Световая микроскопия Окраска по Граму

Люминесцентная микроскопия ¡ ¡ ¡ Мазок обрабатывают не красителем, а сывороткой, содержащей АТ, конъюгированные с флюорохромом. В том случае, если АТ гомогенны АГ микроорганизмов, в люминесцентном микроскопе можно увидеть свечение. Метод характеризуется высокой специфичностью
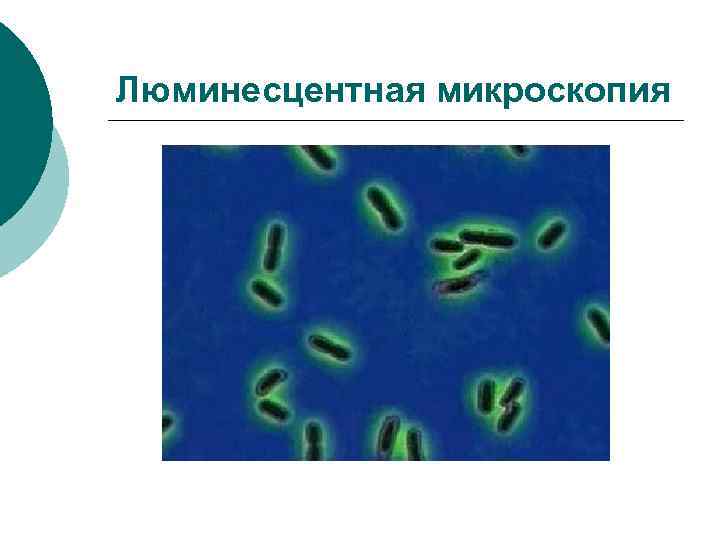
Люминесцентная микроскопия

Электронная микроскопия (ЭМ) ¡ ТЭМ – трансмиссионная (просвечивающая) ЭМ ¡ СЭМ –сканирующая (растровая) ЭМ ¡ ИЭМ – иммунная ЭМ
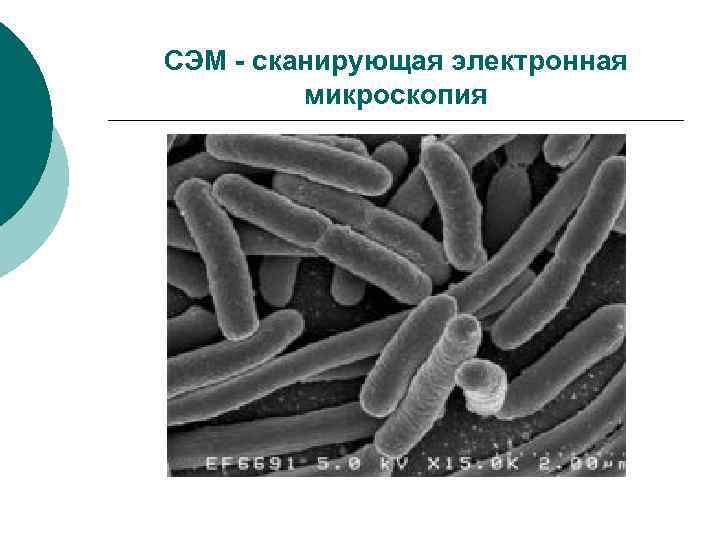
СЭМ - сканирующая электронная микроскопия

Культуральные методы • Выделение чистой культуры • Идентификация выделенной чистой культуры • Определение чувствительности бактерий к антимикробным препаратам

Выделение чистой культуры Путем посева на питательные среды является основным этапом микробиологического исследования. ¡ Успех выделения чистой культуры зависит от правильного выбора питательной среды и условий выращивания. ¡
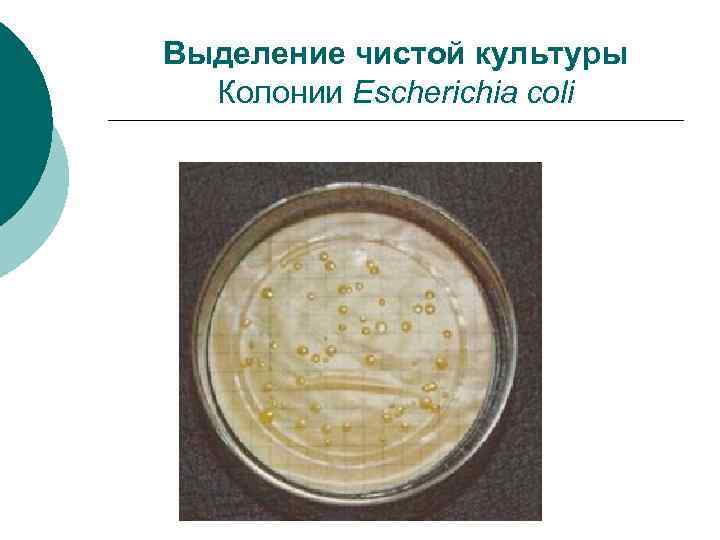
Выделение чистой культуры Колонии Escherichia coli

Идентификация выделенной чистой культуры ¡ После получения чистой культуры проводят идентификацию микроорганизмов по совокупности морфологических, тинкториальных, культуральных, биохимических и антигенных свойств.
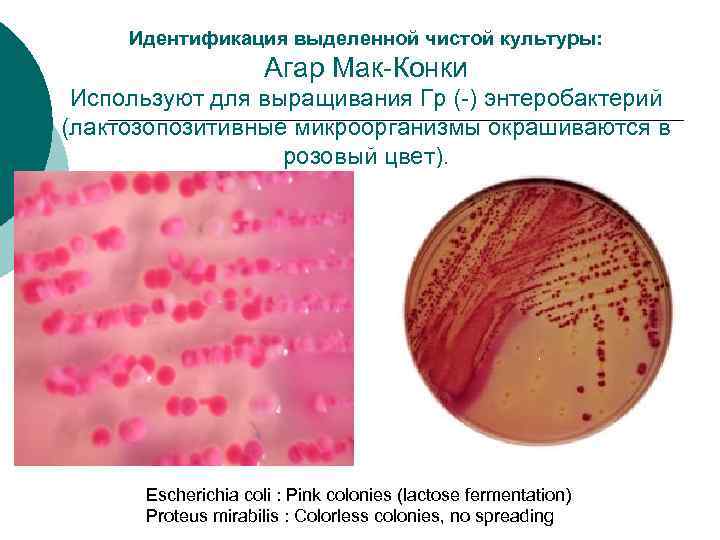
Идентификация выделенной чистой культуры: Агар Мак-Конки Используют для выращивания Гр (-) энтеробактерий (лактозопозитивные микроорганизмы окрашиваются в розовый цвет). Escherichia coli : Pink colonies (lactose fermentation) Proteus mirabilis : Colorless colonies, no spreading

Определение чувствительности к антимикробным препаратам ¡ ¡ ¡ Выбор тактики лечения основан на определении чувствительности микроорганизмов к АМП Выявленная чувствительность in vitro не всегда гарантирует высокую клиническую эффективность in vivo. Это зависит от ряда причин: Приобретение устойчивости к АМП в процессе лечения Особенности всасывания АМП клетками слизистой оболочки кишечника АМП не могут проникать в очаг воспаления где образуется бактериальная биопленка и т. д.

Определение чувствительности к антимикробным препаратам

Иммунологические методы ¡ 1. Методы поиска антигенов возбудителей инфекционных заболеваний с помощью имеющихся антител. ¡ 2. Методы поиска антител – выявление активного иммунного ответа – по нарастанию титра АТ (используют диагностикумы). Это методы серодиагностики и аллергодиагностики

Достоинства серодиагностических методов ¡ ¡ ¡ Высоко чувствительные Быстрые Достаточно дешевые

Недостатки серодиагностических методов ¡ ¡ ¡ В большинстве случаев ретроспективный характер нельзя получить информацию о чувствительности возбудителя к АМП Применение серодиагностики для оценки эффективности лечения возможно только при хронических формах заболевания.

Для серодиагностики применяют иммунологические реакции ¡ ¡ ¡ РН – реакция нейтрализации РСК – реакция связывания комплемента ИФА – иммуноферментный анализ РИФ – реакция иммунофлюоресценции РНГА – реакция непрямой гемагглютинации ИЭМ – иммунная электронная микроскопия

Диагностические критерии ¡ ¡ Только в некоторых случаях (гепатит или сифилис) сам факт обнаружения АТ имеет диагностическое значение Чаще диагноз ставят на основании нескольких диагностических критериев: 1. Диагностический титр АТ (Д-титр); 2. Нарастание титра АТ

Диагностический титр АТ – Д-титр ¡ ¡ условная величина, обозначающая количество АТ в сыворотке крови к конкретному возбудителю. Превышение определенного уровня АТ может быть расценено как признак заболевания. Величина Д-титра устанавливается эмпирическим путем для каждого заболевания и для каждой серологической реакции. Д-титры могут не совпадать при обследовании различными серологическими методами.

Нарастание титра АТ ¡ Современные методы серодиагностики позволяют получать информацию о наличии Ig разной специфичности
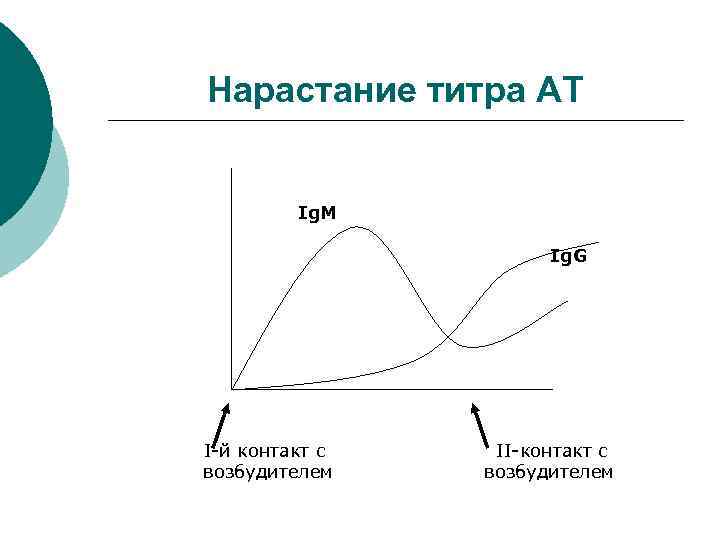
Нарастание титра АТ Ig. M Ig. G I-й контакт с возбудителем II-контакт с возбудителем

Молекулярно-биологические методы

Молекулярнобиологические методы ¡ ¡ Методы выявления ДНК или РНК возбудителя (ПЦР) PCR Методы определения структуры 16 S р. РНК малой субъединицы бактериальной рибосомы – метод риботипирования

ПЦР (PCR) ¡ Полимеразная цепная реакция метод выявления ДНК или РНК возбудителя

ПЦР ¡ ¡ Разработал амер. исс. - Кэрри Муллис, Ноб. лауреат 1993 г. 1985 г. in vitro - репликация участков ДНК. Цель - обнаружение незначительных количеств ДНК (вирусной, бактериальной, простейших) в клиническом материале от больного. Не является абсолютно точным (случаются ошибки), но он очень специфичен, т. к. основан на уникальном свойстве ДНК – комплементарности, при этом должно произойти взаимодействие участков ДНК возбудителя из клинического материала от больного и имеющихся в диагностическом наборе фрагментов ДНК-возбудителя – праймеров.

Метод PCR включают несколько этапов ¡ 1. выделение ДНК ¡ 2. амплификация ¡ 3. детекция

1 -й этап - выделение ДНК возбудителя из клинического материала ¡ ¡ Материал: кровь, любая ткань, моча, кость, соскобы со слизистых специальными щеточками. Идентификация останков тоже осуществляется этим способом, т. к. в костях ДНК сохраняется много десятков лет. Этот этап очень ответственный, необходимо использовать специальные приемы для взятия материала, правильной транспортировки. Лучше всего брать материал и сразу же проводить исследование.

Амплификация ¡ ¡ Умножение ДНК возбудителя из клинического материала. 25 -35 циклов умножения. Теоретически можно иметь всего 1 копию ДНК возбудителя в клиническом материале и ее размножить.

Детекция ¡ Определение интересующих фрагментов ДНК – нуклеотидов.

Комплект для PCR ¡ ¡ ДНК-возбудителя из кл. материала – фрагмент нуклеотидов, который нужно определить. Смесь нуклеотидов – супермикст, из которых будет строиться новые, вновь синтезируемые фрагменты ДНК. Затравки-праймеры – искусственно синтезированные фрагменты ДНК (олигомеры), Соответствующие фрагментам ДНК определенных возбудителей. Они нужны для того, чтобы начался синтез новой цепочки ДНК только в том случае, если ДНК-возбудителя из клинического материала комплементарно совпадет с ДНК-затравкой, соответствующей ДНК предполагаемого возбудителя. ДНК-полимераза (термостабильная) – фрагмент, сшивающий нуклеотиды (из термофильной бактерии Thermus aquaticus).

Условия проведения ПЦР Объемы реактивов, используемые в работе: ¡ Объем супермикса – 20 мкл ¡ Объем ДНК-полимеразы – 20 мкл ¡ Обязательное условие – соблюдение идеальной чистоты!!! ¡

Этапы амплификации 1. Денатурация (ДНК возбудителя из клин. материала) Т° = 94°С → 2 цепочки расходятся, рвутся водородные связи между азотистыми основаниями → 1 -цепочечные молекулы ДНК. С этого момента 1 -цеп. молекулы ДНК возбудителя называются – амплификатор 1 и 2. ¡ При 94°С

ПЦР(1 -й этап денатурация)

2 этап - связывание (отжиг) праймеров к амплификатору ¡ ¡ ¡ амплификатор 1 связывается с праймером 1 амплификатор 2 с праймером 2 Связывание происходит в случае комплементарного совпадения участка праймера с амплификатором. Праймеры должны соответствовать предполагаемым возбудителям. При 62°С.
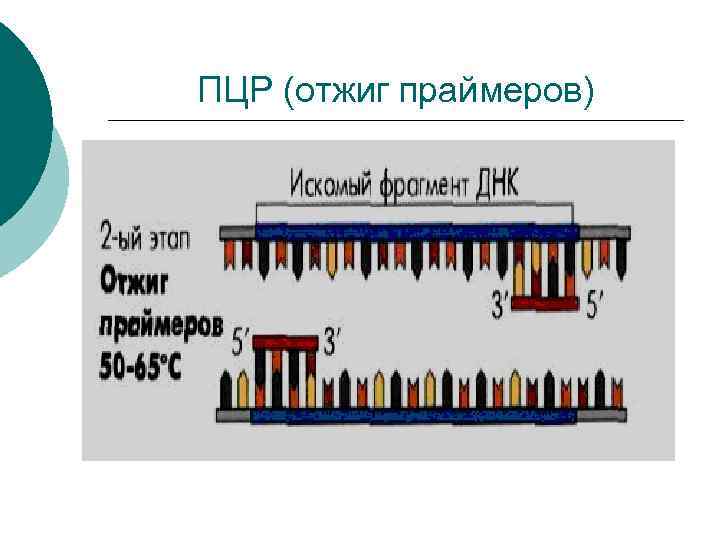
ПЦР (отжиг праймеров)

3 -й этап – синтез новой цепи ДНК ¡ ¡ ¡ ДНК достраивается из нуклеотидов супермикста. Строится ампликон. Именно эту реакцию осуществил Кэрри Муллис в 1985 г. Скорость синтеза – 1 нуклеотид/ 1 мин. Все повторяется примерно 30 раз. Занимает 2, 5 часа. При 72°С (оптимальная температура для работы термостабильной ДНКполимеразы.
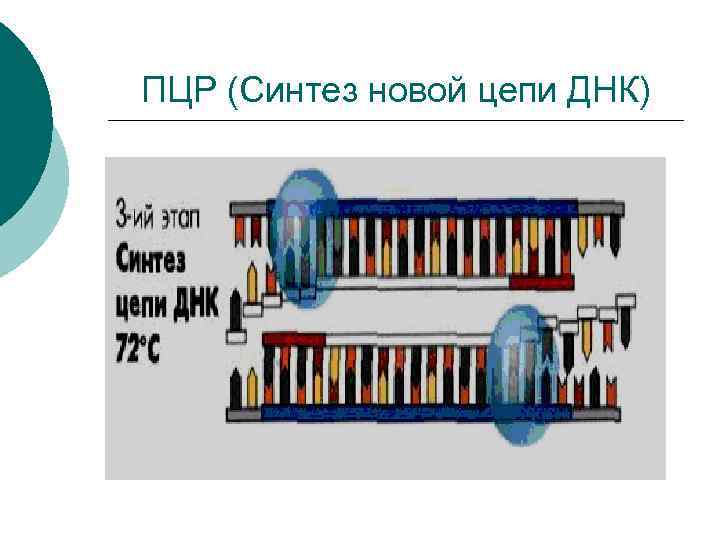
ПЦР (Синтез новой цепи ДНК)

Детекция Существует несколько способов: ¡ Электрофорез в агарозном геле ¡ ДНК – гибридизация ¡ ИФА на микрочастицах ¡

PCR характеризуется 2 важными параметрами ¡ ¡ Высокая чувствительность Высокая специфичность

Чувствительность зависит ¡ ¡ ¡ ¡ Интенсивности инфекционного процесса Правильного отбора проб Сроков и условий транспортировки материала Правильного выделения ДНК из материала Качества реактивов Точности этапа амплификации Эффективности системы детекции результатов

Неспецифические лабораторные тесты

¡ Обнаружение в исследуемом материале продуктов метаболизма бактерий (обнаружение токсинов при ботулизме) ¡ Неспецифические тесты, по характеру отклонения которых можно судить о наличии патологических изменений, специфических для инфекционного процесса определенной этиологии (нарастание активности трансаминазы)
2012 ММ ПатогенностьЗадМетодыКлинМикроб.ppt