 МЕДЬ ЕЕ СТРОЕНИЕ, СВОЙСТВА, ПРИМЕНЕНИЕ
МЕДЬ ЕЕ СТРОЕНИЕ, СВОЙСТВА, ПРИМЕНЕНИЕ
 • Медь — элемент одиннадцатой группычетвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440 -50 -8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
• Медь — элемент одиннадцатой группычетвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440 -50 -8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
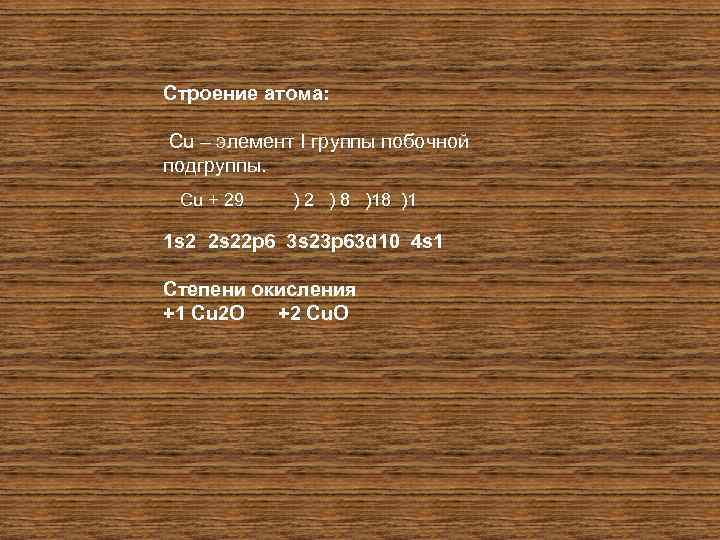 Строение атома: Cu – элемент I группы побочной подгруппы. Сu + 29 ) 2 ) 8 )18 )1 1 s 2 2 s 22 p 6 3 s 23 p 63 d 10 4 s 1 Степени окисления +1 Cu 2 O +2 Cu. O
Строение атома: Cu – элемент I группы побочной подгруппы. Сu + 29 ) 2 ) 8 )18 )1 1 s 2 2 s 22 p 6 3 s 23 p 63 d 10 4 s 1 Степени окисления +1 Cu 2 O +2 Cu. O
 Физические свойства: Медь – блестящий, светло-розовый металл; легко прокатывается; температура плавления 1083; плотность 8, 9 г/см 3; Отличный проводник электрического тока (уступает серебру);
Физические свойства: Медь – блестящий, светло-розовый металл; легко прокатывается; температура плавления 1083; плотность 8, 9 г/см 3; Отличный проводник электрического тока (уступает серебру);
 Химические свойства: 1. Взаимодействует с неметаллами Cu + Cl 2 = Cu. Cl 2 2. При нагревании с кислородом и серой 2 Cu + O 2 = 2 Cu. О Cu + S = Cu. S 3. Взаимодействует с кислотами Cu + 2 H 2 SO 4 (к ) = Cu. SO 4 + SO 2 + H 2 O Cu + 4 HNO 3 (к ) = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O
Химические свойства: 1. Взаимодействует с неметаллами Cu + Cl 2 = Cu. Cl 2 2. При нагревании с кислородом и серой 2 Cu + O 2 = 2 Cu. О Cu + S = Cu. S 3. Взаимодействует с кислотами Cu + 2 H 2 SO 4 (к ) = Cu. SO 4 + SO 2 + H 2 O Cu + 4 HNO 3 (к ) = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O
 Получение Медь добывается: а) пирометаллургическим путём 2 Cu 2 S + 3 O 2 = 2 Cu 2 O + 2 SO 2 2 Cu 2 O + Cu 2 S = 6 Cu + SO 2 б) гидрометаллургическим путём Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. SO 4 + Fe = Cu + Fe. SO 4
Получение Медь добывается: а) пирометаллургическим путём 2 Cu 2 S + 3 O 2 = 2 Cu 2 O + 2 SO 2 2 Cu 2 O + Cu 2 S = 6 Cu + SO 2 б) гидрометаллургическим путём Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. SO 4 + Fe = Cu + Fe. SO 4
 Нахождение в природе. Аузурит 2 Cu. CO 3 Cu(OH)2 – (55, 5 % меди)
Нахождение в природе. Аузурит 2 Cu. CO 3 Cu(OH)2 – (55, 5 % меди)
 Халькозин (медный блеск) Cu 2 S – (79, 8% меди)
Халькозин (медный блеск) Cu 2 S – (79, 8% меди)
 Халькопирит Cu. Fe. S 2 – (30 % меди)
Халькопирит Cu. Fe. S 2 – (30 % меди)
 Малахит Cu. CO 3 Cu(OH)2 – (57, 4 % меди)
Малахит Cu. CO 3 Cu(OH)2 – (57, 4 % меди)
 Ковеллин Cu. S – (64, 4 % меди)
Ковеллин Cu. S – (64, 4 % меди)
 Соединения меди Cu(OH)2 – студенистый осадок голубого цвета; получают при действии щелочей на соли Меди: Cu. SO 4 + 2 Na. OH = Cu(OH)2 + Na 2 SO 4 Гидроксид меди При нагревании разлагается: Cu(OH)2 = Cu. O + H 2 O чёрный Легко растворяется в кислотах: Cu(OH)2 + H 2 SO 4 = Cu. SO 4 + 2 H 2 O
Соединения меди Cu(OH)2 – студенистый осадок голубого цвета; получают при действии щелочей на соли Меди: Cu. SO 4 + 2 Na. OH = Cu(OH)2 + Na 2 SO 4 Гидроксид меди При нагревании разлагается: Cu(OH)2 = Cu. O + H 2 O чёрный Легко растворяется в кислотах: Cu(OH)2 + H 2 SO 4 = Cu. SO 4 + 2 H 2 O
 Cu. SO 4 – сульфат меди, белого цвета; с водой образует кристаллогидрат голубого цвета Cu. SO 4 * 5 H 2 O; Используется в с/х в качестве антисептика и для борьбы с вредителями.
Cu. SO 4 – сульфат меди, белого цвета; с водой образует кристаллогидрат голубого цвета Cu. SO 4 * 5 H 2 O; Используется в с/х в качестве антисептика и для борьбы с вредителями.
 Биологическая роль меди. Не смотря на то, что ионы меди ядовиты, медь необходима нашему организму, она участвует в процессах кроветворения, входит в состав многих ферментов, ускоряющих процессы окисления, стимулирует углеводный обмен, синтез гемоглобина и жиров, образование витаминов. Cu в организме концентрируется в печени.
Биологическая роль меди. Не смотря на то, что ионы меди ядовиты, медь необходима нашему организму, она участвует в процессах кроветворения, входит в состав многих ферментов, ускоряющих процессы окисления, стимулирует углеводный обмен, синтез гемоглобина и жиров, образование витаминов. Cu в организме концентрируется в печени.
 Сплав меди. Бронза – сплав меди и олова, превосходит медь в твёрдости, устойчива к окислению. Бронзовый век начало III тыс – I тыс до н. э Бронза широко использовалась для изготовления орудий труда, кухонная утварь: чаши, котлы. Изделия из бронзы отливались у египтян, индусов. Ассирийцев.
Сплав меди. Бронза – сплав меди и олова, превосходит медь в твёрдости, устойчива к окислению. Бронзовый век начало III тыс – I тыс до н. э Бронза широко использовалась для изготовления орудий труда, кухонная утварь: чаши, котлы. Изделия из бронзы отливались у египтян, индусов. Ассирийцев.