Матричные биосинтезы.ppt
- Количество слайдов: 91

Матричные биосинтезы

Матричные биосинтезы • При биосинтезе белков и нуклеиновых кислот матрицей служат нуклеиновые кислоты. • Матрица в ходе матричного синтеза не расходуется и может использоваться многократно.

Существует три основных типа матричных биосинтезов. • Биосинтез ДНК (репликация ДНК) с использованием в качестве матрицы уже существующих молекул ДНК. • Биосинтез РНК на матрице ДНК (транскрипция). • Биосинтез белков с использованием в качестве матрицы и-РНК (трансляция).
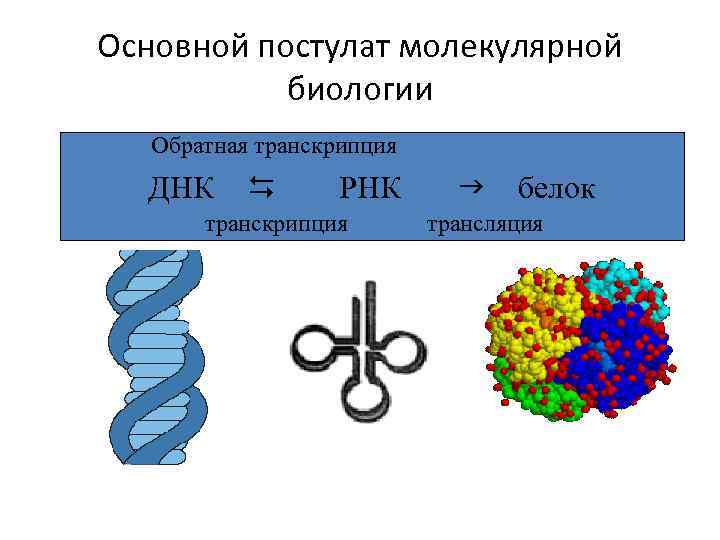
Основной постулат молекулярной биологии Обратная транскрипция ДНК D РНК транскрипция g белок трансляция

Генетическая организация генома млекопитающих • Гаплоидный геном каждой клетки представлен 3, 5*10 парами оснований и состоит из 23 пар хромосом. • Это достаточно для кодирования 1, 5 мм пар генов. • В организме около 100 000 белков. • Это означает, что большая часть геномной ДНК не кодируется.

ДНК генома делят на: • Уникальные (неповторяющиеся) последовательности ДНК. Они кодируют белки. • Повторяющиеся последовательности ДНК. Составляют 20 -30% генома. Высоко повторяющиеся последовательности транскрипционно неактивны.

Строение ДНК Молекула ДНК среднего размера • имеет длину 4 см. • содержит 150 000 нуклеотидных пар. • Общая длина ДНК в 23 парах хромосом человека 1, 5 м. • Первичная структура ДНК характеризуется видовой специфичностью
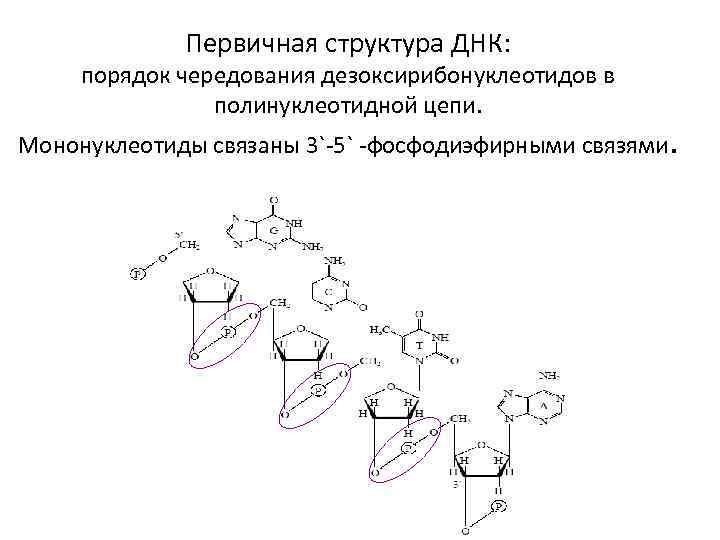
Первичная структура ДНК: порядок чередования дезоксирибонуклеотидов в полинуклеотидной цепи. Мононуклеотиды связаны 3`-5` -фосфодиэфирными связями.

Вторичная структура ДНК: Двойная спираль, которая удерживается за счёт водородных связей между комплементарными азотистыми основаниями.

Хроматин – комплекс белка с ядерной ДНК. • 2/3 хроматина –белки. • 1/3 хроматина – ДНК. • в хроматине содержится до 10% РНК. Белки, связывающиеся с ДНК делятся на 2 группы: • гистоны, • негистоновые белки.
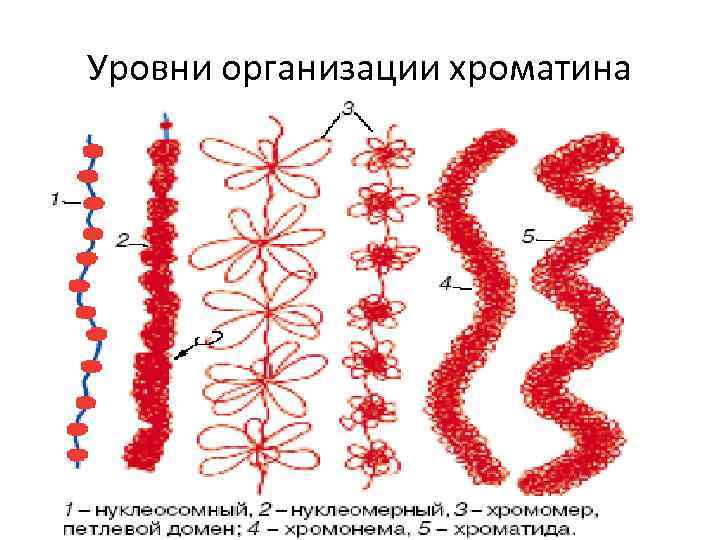
Уровни организации хроматина
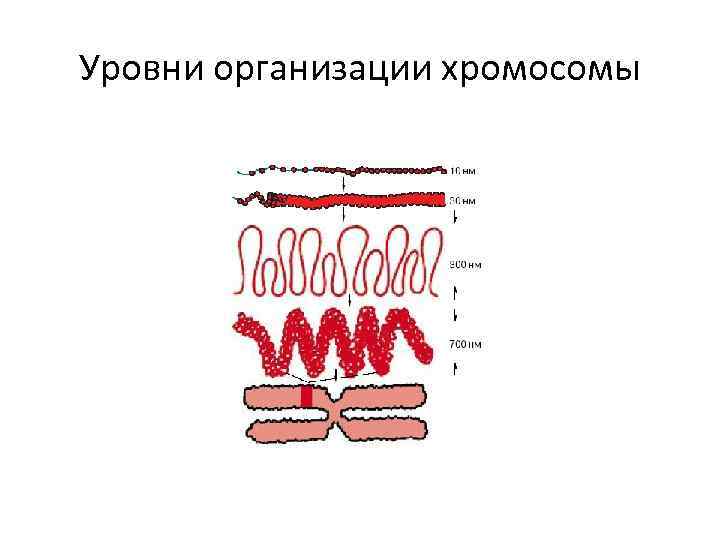
Уровни организации хромосомы

Гистоны • Молекулярная масса 20 000. • Хроматин содержит 5 типов гистонов: Н 2 А, Н 2 В, Нз, Н 4 (нуклеосомные гистоны), Н 1. • Нуклеосома - фрагмент ДНК, взаимодействующий с комплексом гистонов.

Гистоны Н 1 связываются с ДНК в межнуклеосомных участках (линкерных последовательностях) и защищают эти участки от действия нуклеаз.

Негистоновые белки • регуляторные белки, • белки, участвующие в матричном биосинтезе.

Строение РНК Первичная структура РНК: порядок чередования рибонуклеозидмонофосфатов в полинуклеотидной цепи. Вторичная структура РНК: За счёт водородных связей между комплементарными азотистыми основаниями образуются спирализованные петли – «шпильки» .

Гибридизация • Данный метод применяют для изучения видовой специфичности нуклеиновых кислот. • Метод основан на способности ДНК к денатурации при нагревании (80 -90) и ренатурации при последующем охлаждении.

Репликация • воспроизведение (удвоение) молекул ДНК в процессе деления клетки. • процесс синтеза дочерней ДНК на матрице ДНК. Структура дочерней ДНК аналогична родительской ДНК.

Функции ДНК • сохранение генетической информации, • воспроизведение генетической информации, • реализация генетической информации,

Механизм репликации ДНК– полуконсервативный. В каждой дочерней молекуле одна нить является старой, а другая – вновь синтезированной.

Постулаты Корнберга (1955 г) • Для синтеза ДНК нужны нуклеозидтрифосфаты. • Реакция идёт только в присутствии уже готовой ДНК, выполняющей роль матрицы. • Поскольку в молекуле ДНК нуклеотидные остатки образуют пары А-Т и Г-Ц, в реакции расходуются одинаковые количества d. АТФ и ТТФ (стехиометричекий коэффициент m), d. ГТФ и d. ЦТФ(стехиометричекий коэффициент n) • Требуется набор ферментов (реплисома).

Синтез нуклеиновых кислот происходит в ядре и митохондриях

Этапы репликации. Инициация репликации происходит в нескольких точках хромосомы. Точки инициации репликации- ориджины репликации.
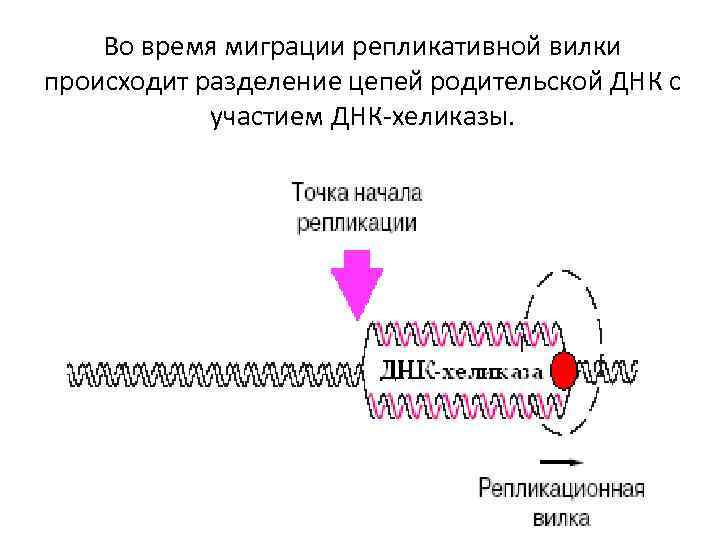
Во время миграции репликативной вилки происходит разделение цепей родительской ДНК с участием ДНК-хеликазы.
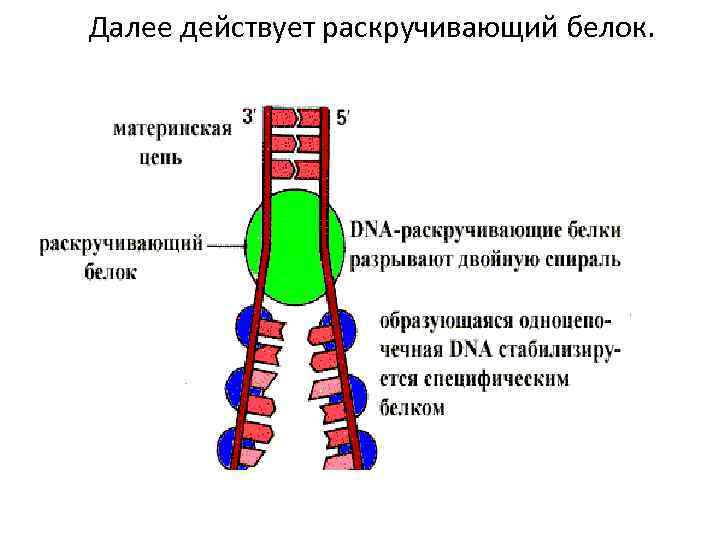
Далее действует раскручивающий белок.
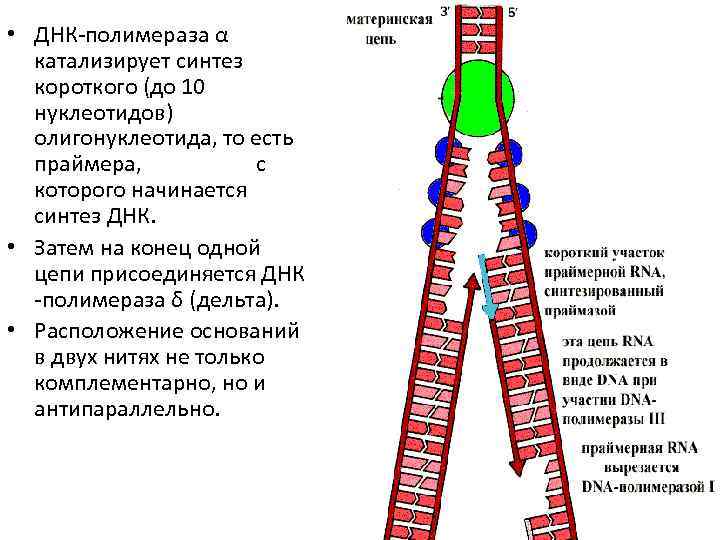
• ДНК-полимераза α катализирует синтез короткого (до 10 нуклеотидов) олигонуклеотида, то есть праймера, с которого начинается синтез ДНК. • Затем на конец одной цепи присоединяется ДНК -полимераза δ (дельта). • Расположение оснований в двух нитях не только комплементарно, но и антипараллельно.

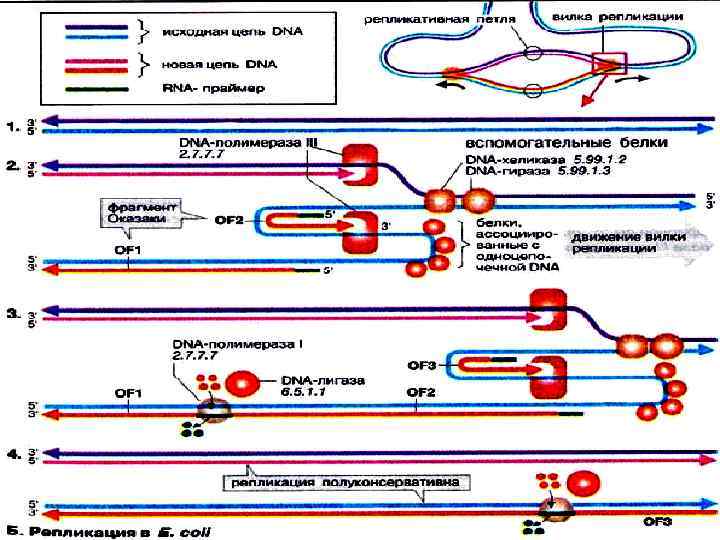
Элонгация репликации – репликация обеих материнских цепей ДНК и связывание друг с другом фрагментов новообразованных цепей ДНК. • • Обе дочерние молекулы сохраняют связь с родительской. Хромосома имеет форму вилки. Обе цепи реплицируются одновременно, хотя имеют разное направление. Рост дочерних цепей должен происходить в противоположных направлениях. Синтез новых цепей идёт в направлении от 5`- к 3`- концу. На одной репликативной вилке синтезируются непрерывная нуклеотидная цепь, на другой – фрагменты Оказаки, которые потом соединяются ДНК-лигазой. Элонгация завершается отделением праймеров, формированием дочерней цепи ДНК.
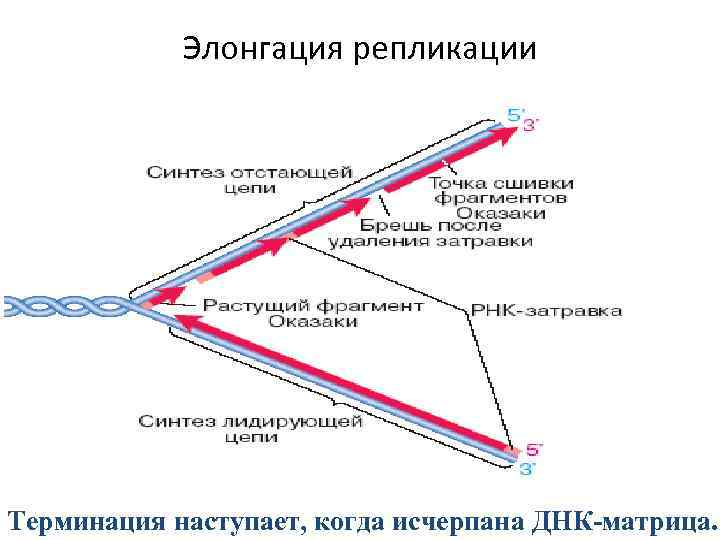
Элонгация репликации Терминация наступает, когда исчерпана ДНК-матрица.

• После завершения репликации происходит метилирование нуклеотидных остатков вновь образованных цепей ДНК. • На каждом конце хромосомы присутствует специфическая нуклеотидная последовательность (GGG ТТА-теломерная ДНК). Это нужно для сохранения генетической информации. • С каждым клеточным циклом ДНК хромосом будет последовательно укорачиваться.
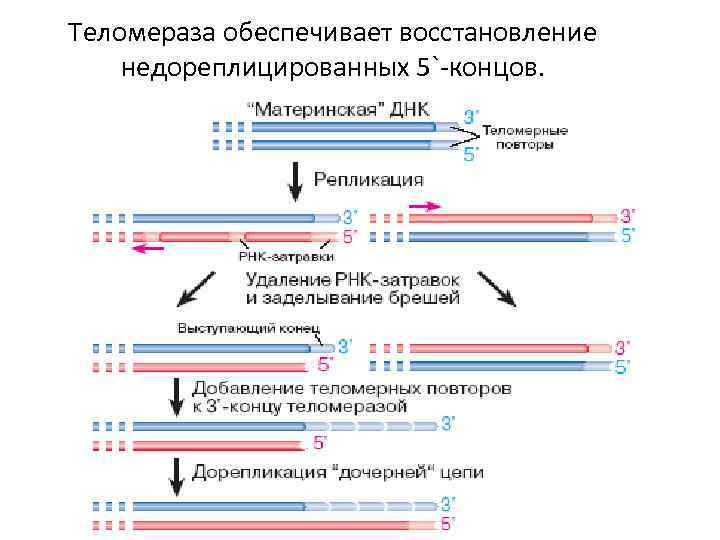
Теломераза обеспечивает восстановление недореплицированных 5`-концов.

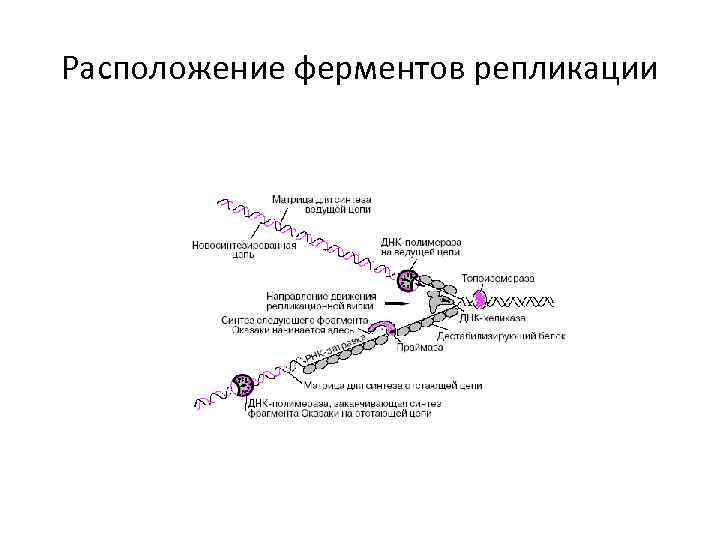
Ферменты репликации • ДНК-топоизомераза (нуклеаза) разрывает цепь ДНК ( -5`-фосфодиэфирную связь), а в конце репликации зашивает надрезы. • ДНК-хеликаза расплетает двойную спираль ДНК. • Белки, дестабилизирующие спираль, связываются с одноцепочечной ДНК и предотвращают комплементарное скручивание матричных цепей.

ДНК-полимеразы • имеют цинк в активном центре, • для реакции необходим магний. • ДНК-полимераза α синтезирует РНК (праймер, затравка) длиной до 10 нуклеотидов. • ДНК-полимераза δ продолжает синтез новой непрерывной цепи в направлении от 5`- к 3`- концу (лидирующая цепь). • ДНК-полимераза α и ε ведут синтез фрагментов Оказаки на отстающей цепи. Каждый фрагмент Оказаки состоит из 100 нуклеотидов, содержит праймер, который удаляет ДНКполимераза β. • ДНК-лигаза соединяет разрывы отстающей цепи ДНК.
Расположение ферментов репликации

Репарация ошибок и повреждений ДНК • Молекула ДНК подвергается спонтанным (ошибки репликации) и индуцированным повреждениям (УФО, радиация, химические вещества). • Снижение активности ферментов репарации приводит к накоплению повреждений (мутаций) в ДНК.

Деградация и репарация ДНК • Дефектная область одной цепи ДНК может быть исправлена по неповреждённой комплементарной цепи. • Одноцепочечные разрывы ДНК, вызванные ионизирующей радиацией, может быть репарированы прямым лигированием или рекомбинацией.

Ферменты репарации • ДНК-N-гликозидазы обнаруживают и удаляют повреждённые основания ДНК. • ДНК-инсертаза присоединяет основания к дезоксирибозе. • Эндонуклеаза определяет повреждения и гидролизует 3`-5`-фосфодиэфирную связь. • Экзонуклеаза находит место разрыва цепи и удаляет повреждённый участок. • ДНК-полимераза β достраивает повреждённую нуклеотидную цепь. • ДНК-лигаза соединяет неповреждённый и вновь синтезированный участки цепи ДНК.

Синтез ДНК на матрице РНК (обратная транскрипция) • Фермент обратная транскриптаза (ревертаза, РНК-зависимая ДНК-полимераза) был обнаружен в 1970 году Балтимором и Теминым.
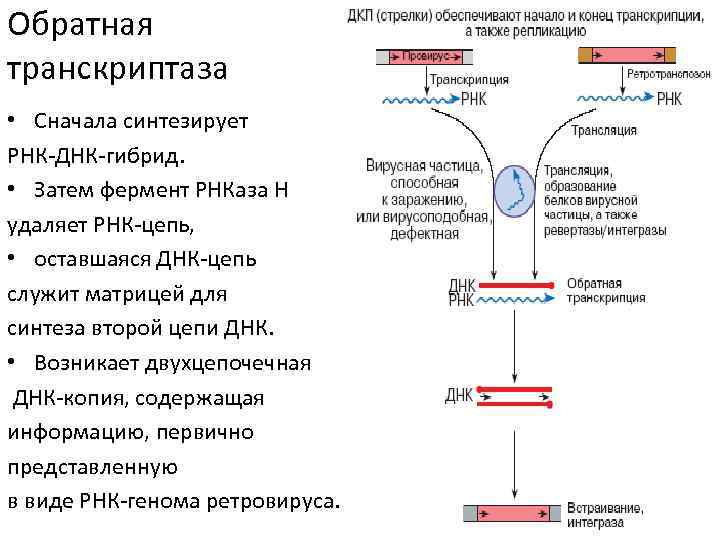
Обратная транскриптаза • Сначала синтезирует РНК-ДНК-гибрид. • Затем фермент РНКаза Н удаляет РНК-цепь, • оставшаяся ДНК-цепь служит матрицей для синтеза второй цепи ДНК. • Возникает двухцепочечная ДНК-копия, содержащая информацию, первично представленную в виде РНК-генома ретровируса.
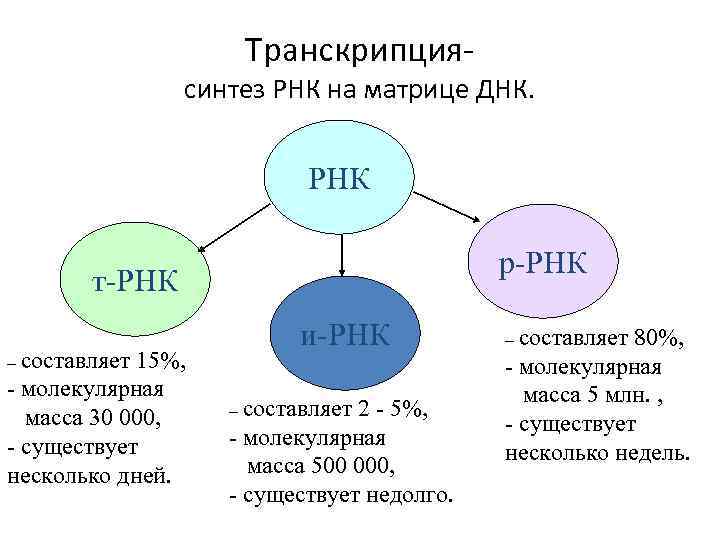
Транскрипция- синтез РНК на матрице ДНК. РНК р-РНК т-РНК – составляет 15%, - молекулярная масса 30 000, - существует несколько дней. и-РНК – составляет 2 - 5%, - молекулярная масса 500 000, - существует недолго. – составляет 80%, - молекулярная масса 5 млн. , - существует несколько недель.

т-РНК • ЦЦА конец соответствует месту присоединения АМК, • Псевдоуридиновая петля обеспечивает связывание аминоацил-т. РНК с поверхностью рибосомы. • Дигидроуридиновая петля – место для узнавания специфического кодона. • Антикодон – специфичен и комплементарен кодону м. РНК. • Минорные основания в антикодоне играют роль в гибкости считывания согласно гипотезе неоднозначност соответствия.

• Синтез идёт из нуклеозидтрифосфатов. • В синтезе участвует ДНК-зависимая-РНК-полимераза. • Синтез РНК идёт в направлении от 5`к 3`-концу. • Фермент присоединяется к участку ДНК (промотору). На матрице ДНК комплементарно строится полирибонуклеотид, являющийся копией первичной структуры ДНК.

Промотор • РНК-полимераза связывается с одной цепью нативной молекулы ДНК в определённой точке (промоторе), вызывая расплетение двойной спирали, где и происходит синтез. • РНК-полимераза I участвует в синтезе пре-р. РНК. • РНК-полимераза II - в синтезе пре-м. РНК. • РНК-полимераза III - в синтезе пре-т. РНК.

Транскрипция- биосинтез матричных РНК. Экспрессия генов (поток генетической информации) включает транскрипцию и трансляцию. Отличия транскрипции от репликации: не требует синтеза праймера, использует не всю молекулу ДНК, а отдельные её сегменты, требует наличия одной из цепей ДНК в качестве матрицы, которая полностью сохраняется, при транскрипции транскрибируются отдельные гены или группы генов, а при репликации кодируется вся родительская ДНК.

м-РНК • переносит информацию от ДНК в ядре до цитоплазмы, где она соединяется с рибосомами и служит матрицей, на которой происходит синтез белка, • короткоживущая, • локализована в ядре и цитоплазме, • одноцепочечная, • комплементарна одной из цепей ДНК

В транскрипции различают три фазы • инициация, • элонгация, • терминация. Элонгация идёт в направлении от 5`- к 3`- концу антипараллельно матричной цепи ДНК. Активация промотора происходит с помощью белкового фактора – ТАТА. Транскриптон - участок ДНК, ограниченный промотором и сайтом терминации. У эукариотов в состав транскриптона входит один ген.

Посттранскрипционный процессинг- ферментативные превращения транскриптов, после чего они стают активными. Процессинг включает: • кэпирование, • сплайсинг, • полиаденилирование, • метилирование.
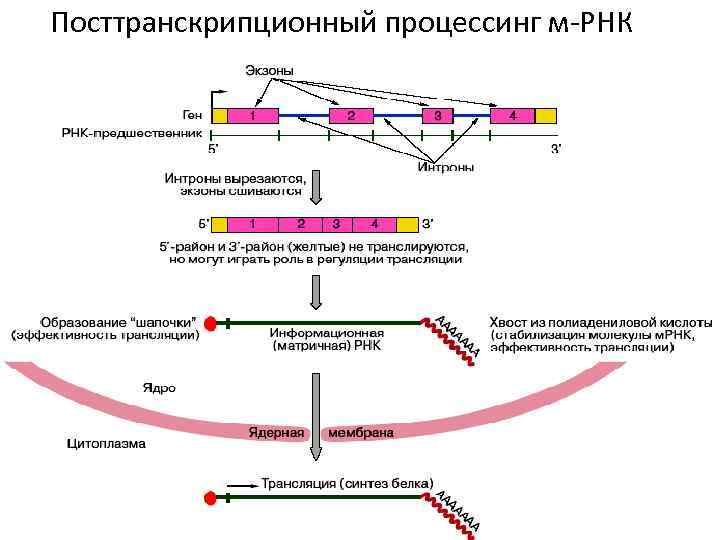
Посттранскрипционный процессинг м-РНК

Кэпирование • присоединение остатка 7 -метилгуанозина к 5`- концу молекулы и-РНК, что защищает РНК от ферментативного распада.

Полиаденилирование • присоединение фрагментов АА УАА к 3`- концу и-РНК в ядре или цитоплазме. • Это облегчает выход и-РНК из ядра и замедляет гидролиз в цитоплазме.
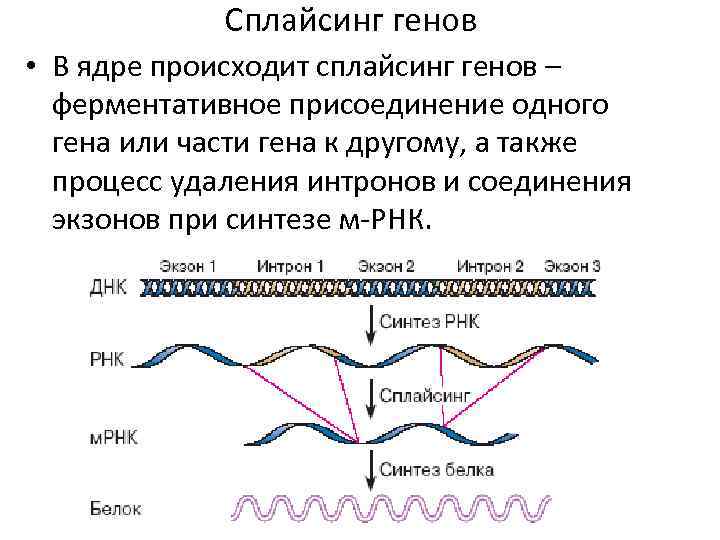
Сплайсинг генов • В ядре происходит сплайсинг генов – ферментативное присоединение одного гена или части гена к другому, а также процесс удаления интронов и соединения экзонов при синтезе м-РНК.

• Эукариотические гены имеют фрагментарное строение: они состоят из нескольких значащих участков (экзонов), разделённых нетранслируемыми вставками (интронами). • Экзон – участок гена, транскрипт которого оказывается в зрелой м-РНК. Он кодирует участок цепи белка. • Интрон – вставочная последовательность в гене, которая транскрибируется, но вырезается до трансляции.

• Сплайсосома координирует сплайсинг. Сплайсосома- комплекс малых ядерных РНК и белков (малых ядерных нуклеопротеинов). Регуляторные сигналы при транскрипции • Энхансеры повышают уровень транскрипции. • Силансеры ослабляют уровень транскрипции. Энхансеры и силансеры – участки в нетранскрибируемых последовательностях генома. • Рибозимы катализируют сам сплайсинг.

Посттранскрипционная модификация т-РНК • у т-РНК на 3`-конце формируется акцепторный участок, а в средней части молекулы – антикодон.

Посттранскрипционная модификация пре-р. РНК • В ходе посттранскрипционной модификации пре-р. РНК и связывания со специфическими белками образуется рибосома.

Рибосомы – нуклеопротеиды. • Рибосомы характеризуют по скорости их седиментации в центрифужном поле, которая количественно выражается константой седиментации S , выражаемой в единицах Сведберга. • 80 S – рибосомы эукариот. Они содержат равное количество белка и РНК. • 70 S - рибосомы прокариот. Соотношение РНК : белок = 2: 1.

Рибосома состоит из двух субчастиц (30 S + 50 S). • В меньшей субъединице содержится 20 белков. • В большей содержится 30 белков. На большой субъединице находятся 2 центра: А и Р.

Свойства генетического кода. • Триплетность. Одна АМК кодируется тремя нуклеотидами. • Вырожденность. Несколько кодонов кодируют одну и ту же АМК. • Однозначность и специфичность. Каждому кодону соответствует одна АМК. • Неперекрываемость. Отсутствие знаков препинания. Считывание триплетов идёт без пропусков. • Универсальность. • Среди 64 кодонов – 3 кодона нонсенс (УАГ, УАА, УГА) бессмысленные. • Неоднозначность соответствия в считывании кодонов. Строгая комплементарность в двух первых буквах кодона, в случае же третьей буквы это необязательно.

Аминоацил-т. РНК-синтетазы имеют три центра связывания: • для АМК, • для т-РНК, • для АТФ.

Активация аминокислоты Требуется: • аминокислота, • т-РНК, • АТФ, • ионы магния, • кодазы.

Трансляция – белка на матрице РНК. • ДНК – код АТГ, • и-РНК – кодон УАУ, • т –РНК – антикодон АУГ. синтез

Этапы трансляции • инициация, • элонгация, • терминация.

Инициация Инициирующий кодон – АУГ. • Рост цепей идёт с N-конца. • Синтез начинается с Nформилметионина. Необходимые компоненты: • рибосомы, • инициирующий кодон, • инициаторная аминоацил-т. РНК, • факторы инициации (IF 1, IF 2, IF 3), • ГТФ, • ионы магния.

• Процесс формилирования предотвращает участие аминогруппы АМК в образовании пептидной связи и обеспечивает синтез белка в направлении от аминогруппы к карбоксильной. • IF 3 первым связывается с малой субъединицей рибосомы. • IF 3 обеспечивает узнавание участка на м-РНК, куда присоединяется формилметионин-т. РНК. • IF 1 способствует связыванию формилметионинт. РНК с малой субъединицей рибосомы и присоединению к ней м-РНК. • IF 2 способствует объединению большой и малой субчастиц.

Образование инициаторного комплекса • Осуществляется путём присоединения белковых факторов, формилметионин-т. РНК, ГТФ к малой субчастице рибосомы, к которой комплементарно антикодону присоединяется м-РНК, при участии кодона АУГ. • После присоединения 50 S субчастицы рибосома становится функционально активной.

Расположение функциональных центров на малой и большой субчастицах рибосомы

Элонгация трансляции Необходимо: • т-РНК, • АМК, • ГТФ, • ионы магния, • рибосомы, • факторы элонгации, • м-РНК

• Формилметионин-т. РНК поступает сначала на А-центр, а потом на Р-центр. • Участок А получает другую АМК. Для этого необходим ГТФ. • Рибосома делает «шаг» по м-РНК на один кодон. • Формилметионин переходит на А-участок с Р-участка. На А-участке происходит синтез пептидной связи под влиянием пептидилтрансферазы. • Рибосома перемещается на один кодон. Дипептид вновь переносится на Р-участок под влиянием пептидилтранслоказы. • На А-участок поступает третья АМК. • При перебросе в участок А дипептида образуется трипептид.

• Главное событие транслокации – перемещение пептидил-т. РНК из А в Р-участок рибосомы. • Антикодон тянет за собой кодон матрицы, приводя к перемещению матрицы на один триплет относительно рибосомы.

Для синтеза одной пептидной связи нужно 4 АТФ: 2 АТФ - на активацию АМК и 2 ГТФ - на включение АМК т-РНК в А-центр и транслокацию.

Терминация Необходимы: • рибосомы, • факторы терминации (3), • м-РНК, • терминирующие кодоны УАГ, УАА, УГА. От рибосомы отделяется белок, т-РНК, м-РНК распадается до рибонуклеотидов.

Синтез митохондриальных белков • 2% клеточной ДНК находится в митохондриях. • Белки, синтезируемые в митохондриях, нерастворимы и участвуют в организации структуры митохондрий.

Посттрансляционная модификация • формирование третичной и четвертичной структур – фолдинг (участвуют шапероны), • ограниченный протеолиз. • присоединение коферментов, простетической группы, • гликозилирование, метилирование, гидроксилирование, фосфорилирование, образование дисульфидных связей.

Ингибиторы белкового синтеза • 50% антибиотиков являются ингибиторами белкового синтеза, • 20% - антибиотиков ингибиторы синтеза нуклеиновых кислот. • Репликацию нарушают антибиотики, химические яды, вирусы.

Ингибиторы репликации • Антибиотики (новобиоцин, митомицин) • Аналоги азотистых оснований и нуклеозидов (5 -бромурацил, 5 фтордезоксиурацил) • Алкилирующие агенты (иприт) • Мутагены (уретан, гидроксиламин, азотистая кислота и др. )

Ингибиторы синтеза нуклеотидов применяются при лечении • лейкозов, • опухолей, • вирусных заболеваний. Они прекращают репликацию ДНК и деление клеток.

Аналоги нуклеозидов (ИДУ) применяют при лечении вирусных гепатитов. • ИДУ отличаются от тимидина лишь тем, что у 5 углеродного атома метильная группа заменена на атом йода. • Блокируется синтез ДНК.

Аметоптерин • структурный аналог фолиевой кислоты, • ингибирует дегидрофолатредуктазу, • конкурирует с фолиевой кислотой за фермент, так как структурно похож на неё, но коферментом быть не может. • Он ингибирует перенос одноуглеродных остатков, необходимых для синтеза нуклеиновых кислот, содержащихся в клетках белой крови и тем самым снижает их число, резко повышенное при ряде форм острого лейкоза.

Ингибиторы транскрипции • Антибиотики • Аналоги нуклеозидов (кордицепин, цитозинарабинозид) • Алкалоиды (винкристин, винбластин – противоопухолевые препараты) • Яды и токсины

Ингибиторы трансляции • Антибиотики. Тетрациклин тормозит связывание аминоацилт. РНК с А-центром в рибосоме. Эритромицин тормозит активность пептидилтранслоказы в процессе трансляции, Хлоранфеникол ингибирует пептидилтрансферазу. • Яды и токсины (дифтерийный токсин, токсины грибов).

Влияние облучения на синтез белков • Наиболее чувствительны ткани в состоянии митоза (костный мозг, эпителий кишечника). • Наиболее устойчивы - клетки ЦНС. • Если повреждаются соматические клетки, то они гибнут или укорачивается срок их жизни. • В половых клетках изменения передаются по наследству.

При облучении активируется СРО • гибель клетки, • мутации, • торможение деления.

Действие на репликацию • мутации типа делеции, • нарушается связь ДНК с гистоновыми и негистоновыми белками, • хромосомные аберрации, • тормозится репарация ДНК.

Влияние облучения на транскрипцию. • подавление активности ферментов транскрипции • нарушение процессинга РНК. Влияние облучения на трансляцию. • тормозится сборка инициаторного комплекса, • происходит сборка белка с изменённой первичной структурой, • появляются функционально неполноценные белки.

Мутации – разнообразные изменения генома. • Мутагены – вещества, вызывающие изменения в генах. Обычно зародыш с изменёнными генами организм матери отторгает (выкидыши составляют 15% исходов беременностей). • Каждый человек несёт в геноме рецессивные мутации. • Наследственные заболевания среди новорожденных составляют 4 -6%.

Действие мутагенов

Точечные мутации – в ДНК изменён один нуклеотид. • Транзиция – изменение последовательности нуклеотидных пар. АТ ГЦ. • Трансверсия (перевёрты). АТ ТА. • Вставка нуклеотидов. • Делеция – выпадение нуклеотидов.

Антимутагены • в-каротин, • витамины А, С, Е, • селен (чеснок, макароны, молоко, морские продукты).

Генная инженерия – прикладное направление молекулярной генетики, исследующее возможности и способы создания лабораторным путём генетических структур и наследственно изменённых организмов. • Генная инженерия подготавливает переход медицины на новый, более высокий уровень её развития и расширяет возможности профилактики и лечения многих заболеваний человека.

Цели генной инженерии • Генетическая модификация микроорганизмов для увеличения количества и улучшения качества изначально вырабатываемого данным организмом продукта. • Перенос генов млекопитающих и человека в микроорганизмы (бактерии, дрожжи) для синтеза с их помощью специфических белков (гормонов, вакцин, интерферона, ферментов). • Генетическая модификация высших растений для увеличения их продуктивности. • Генетическая модификация соматических клеток человека с наследственными заболеваниями.

Достижения генетической инженерии • С помощью бактерий синтезирован соматотропин, инсулин. • Воспроизведён синтез E. Coli человеческого а-интерферона. • Получена безопасная вакцина против ящура.
Матричные биосинтезы.ppt