МАТЕРИАЛОВЕД-243-Лекция -1-2011.ppt
- Количество слайдов: 53

МАТЕРИАЛОВЕДЕНИЕ – ОБЛАСТЬ ЗНАНИЙ О МАТЕРИАЛАХ, ИХ СТРОЕНИИ И СВОЙСТВАХ. Центральное место занимают металлы. Из них сплавы железа и углерода: стали и чугуны. Далее следует алюминий и его сплавы. Тем не менее свойства неметаллических веществ (полимеров) и их сочетаний (композитов, например, резин) также широко применяются, оставаясь незаменимыми в том числе и в полиграфическом производстве. Материаловедение – совокупность знаний естественно-научных дисциплин (физика, химия, биология) и точных наук (математика).
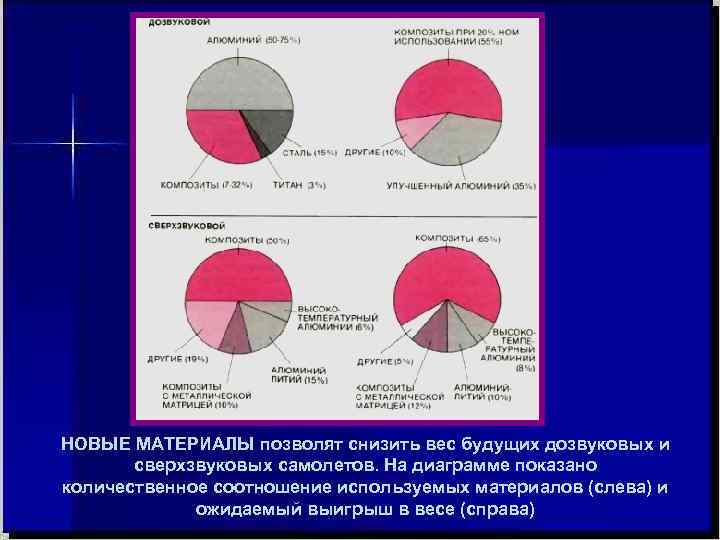
НОВЫЕ МАТЕРИАЛЫ позволят снизить вес будущих дозвуковых и сверхзвуковых самолетов. На диаграмме показано количественное соотношение используемых материалов (слева) и ожидаемый выигрыш в весе (справа)
![Материал [material] — материал обладает некоторыми общими физическими и КЛЮЧЕВЫЕ ПОНЯТИЯ: химическими свойствами, по Материал [material] — материал обладает некоторыми общими физическими и КЛЮЧЕВЫЕ ПОНЯТИЯ: химическими свойствами, по](https://present5.com/presentation/18444935_148204020/image-3.jpg)
Материал [material] — материал обладает некоторыми общими физическими и КЛЮЧЕВЫЕ ПОНЯТИЯ: химическими свойствами, по которым его можно распознать. Другие его свойства могут варьировать, что позволяет различать сорта одного материала. Примерами материалов являются дерево, кожа, резина и латунь. Различные сорта дерева имеют несколько различающихся свойств: окраску, плотность, твердость. Изменение свойств, отличающих один сорт данного материала от другого сорта, невелико. Химический состав материала тоже может быть непостоянным, но его изменения обычно незначительны. Металл [metal]. — элемент (↑), который в химических реакциях образует положительные ноны. Металлы обладают несколькими общими физическими свойствами: а)хорошо проводят электрический ток и тепло; б) имеют характерный блеск, тягучесть и ковкость. Общие химические свойства металлов таковы: а) они образуют основные оксиды; б) они образуют с неметаллами соединения, которые представляют собой соли. Металлы проявляют эти свойства в неодинаковой степени. Все металлы, за исключением ртути, при нормальных условиях находятся в твердом состоянии, металлический [metаllic]. Неметалл [non-metаl] — элемент, не имеющий никаких или имеющий лишь некоторые признаки металла (↑). Неметаллы при нормальных условиях находятся в твердом или газообразном состояниях, за исключением брома который находится в жидком состоянии, физические свойства неметаллов зависят от их структуры (структура – относительное расположение между собой частей целого с указанием взаимосвязи между ними). Твердые неметаллы не обладают ни тягучестью, ни ковкостью, обычно они хрупкие. Они плохо проводят тепло и электрический ток, исключением является только графит. В химических реакциях неметаллы обычно образуют отрицательные ноны, исключением является только водород, образующий положительные ионы. Оксиды неметаллов относятся к кислотным оксидам. [А. Годмен. Иллюстрированный химический словарь. М. : Мир, 1988. 270 с. ]

ИСТОКИ МАТЕРИАЛОВЕДЕНИЯ Ещё в восьмом тысячелетии до н. э. люди заметили, что, если ГОРШОК ИЗ СЫРОЙ ГЛИНЫ обжечь на огне, он становится прочнее: в нем МОЖНО, например, хранить ЖИДКОСТИ, и он не деформируется, даже если его поставить на горящие угли. Таким образом, мягкая, легко поддающаяся обработке глина превращается в прочный и твердый как камень материал. Это верное намеренное превращение неорганического вещества природного происхождения в новый материал с другими свойствами ознаменовало зарождение технологии материалов. Семь тысячелетий спустя философы древней Греции пришли к выводу, что всякое вещество состоит Из мельчайших невидимых частиц одного и того же основного вещества. Эту попытку понять природу предметов окружающего нас мира можно считать началом науки о материалах. Появление новых мощных теоретических концепций и совершенных приборов способствовало тому, что наука стала основной движущей силой в развитии техники.
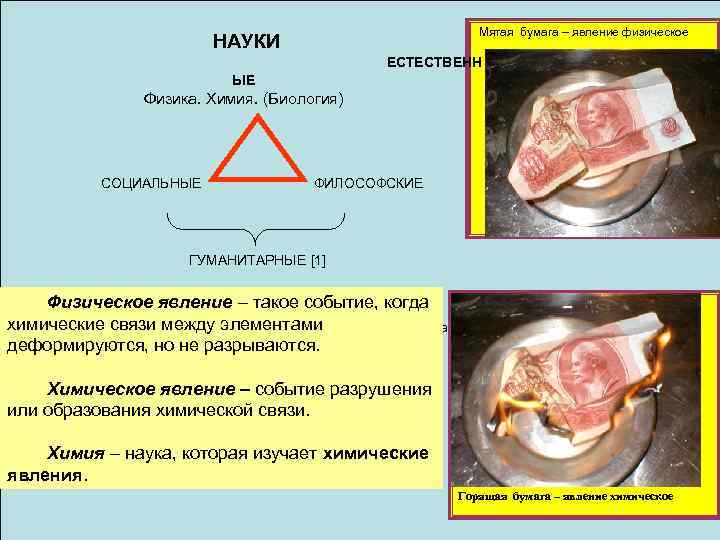
НАУКИ Мятая бумага – явление физическое ЕСТЕСТВЕНН ЫЕ Физика. Химия. (Биология) СОЦИАЛЬНЫЕ ФИЛОСОФСКИЕ ГУМАНИТАРНЫЕ [1] Физическое явление – такое событие, когда химические связи между элементами Иерархия наук в исторической последовательности такова: БИОЛОГИЯ (5); деформируются, но не разрываются. ХИМИЯ (4); ФИЗИКА (3); Химическое явление – событие разрушения МАТЕМАТИКА (2); или образования химической связи. ФИЛОСОФИЯ (1). Химия – наука, которая изучает химические явления. Горящая бумага – явление химическое
![Khemia Kham* , khem ЕГИПЕТ Khemia – египетское искусство [1]. * В английском переводе Khemia Kham* , khem ЕГИПЕТ Khemia – египетское искусство [1]. * В английском переводе](https://present5.com/presentation/18444935_148204020/image-6.jpg)
Khemia Kham* , khem ЕГИПЕТ Khemia – египетское искусство [1]. * В английском переводе библии оно превратилось в Ham Искусство – это вид духовного освоения действительности человеком, отображение окружающего мира в художественных образах, т. е. это субъективное отношение к реальности. В современном представлении химия - это наука. Наука – это область человеческой деятельности, функциями которой являются выработка и теоретическая систематизация объективных знаний о действительности [3].

ЭТАПЫ РАЗВИТИЯ ХИМИИ 1. Предалхимический – от 5000 до н. э. до IV в. н. э. В это время происходило накопление знаний, передаваемых кастами жрецов, монахов, т. е. химия была разделом религии. 2. Алхимический (al-Khemeia) – от IV в. н. э. до XVI в. н. э. В это время происходит поиск «философского камня» , эликсира долголетия (xerion – al-iksir), универсального растворителя Появляется арабская алхимия – результат завоевания в VII в. Египта. 3. Период объединения химии – XVI в. н. э. – XVIII в. н. э. Состоит из 4 подпериодов: ятрохимии (Филипп Ауреол Теофраст Бомбаст фон Гогенгейм или Теофраст Парацельс): соединение химии с медициной [6]; пневмохимии (Р. Бойль): исследование газов и открытие газообразных простых и сложных веществ. В 1661 г. Р. Бойль выпускает научный труд «Химик – скептик» (The Sceptical Chymist), где утверждается материализм в химии. Этот год 1661 – год рождения химии как науки. теплорода (теории флогистона Шталя) кислородная (антифлогистонной системы) (А. Л. Лавуазье): четкость в понятии химического элемента, утверждение ЗАКОНА СОХРАНЕНИЯ ВЕЩЕСТВА. (О Лавуазье(1743 – 1794): ученый был налоговым инспектором, «королевским откупщиком» . Анализируя балансовые ведомости, пришёл к формулировке закона сохранения вещества, т. е. материального баланса взаимодействия веществ: химической реакции. В 1773 г. создал кислородную теорию горения. В 1794 г. председатель Революционного трибунала Французской Республики Коффиналь отверг прошение о помиловании Лавуазье словами: «… Республика не нуждается в химиках и учёных. Не нарушайте судебного процесса» , и … Лавуазье был гильотинирован за антинародную деятельность. ) За 17 (1756 г. ) лет до кислородной теории горения А. Лавуазье в России проблемами химии занимался М. В. Ломоносов(1711 – 1765) Закон сохранения вещества (массы) Ломоносов не открывал – в своих знаменитых опытах он занимался проблемой массы огня [7]. 4. Период количественных законов в химии – 1800 – 1860 гг. Основные этапы следующие: атомная теория Д. Дальтона атомно – молекулярная теория А. Авогадро

Элемент – определённый вид атома Атом – понятие общее, элемент – частное. Понятие элемент – начало формироваться примерно в интервале с 1800 по 1860 годы. Основополагающей теорией материалистического взгляда на мир (вещество) стала атомно-молекулярная гипотеза (теория) Дж. Дальтона (1766 - 1844), представленная научным кругам Англии в 1803 – 1805 годах. Основная идея концепции Дальтона – дискретность материи. Д. Дальтон (1766 – 1844)

АТОМ ЭЛЕМЕНТ АТОМ
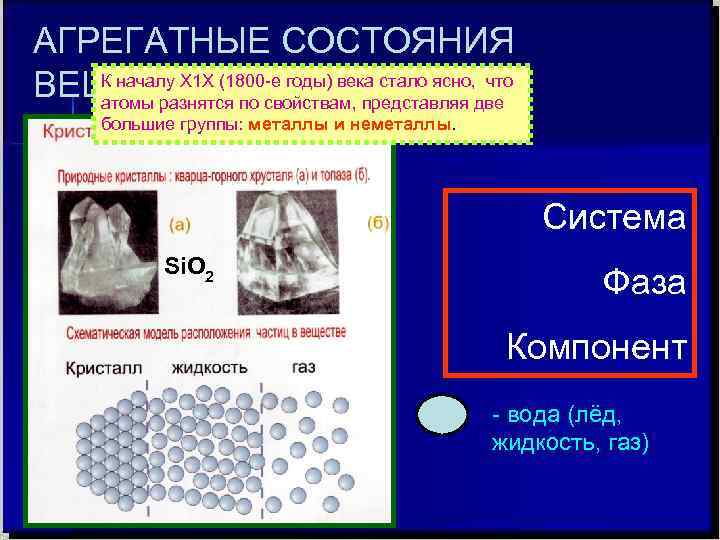
АГРЕГАТНЫЕ СОСТОЯНИЯ К началу Х 1 Х (1800 -е годы) века стало ясно, что ВЕЩЕСТВА атомы разнятся по свойствам, представляя две большие группы: металлы и неметаллы. Система Si. O 2 Фаза Компонент - вода (лёд, жидкость, газ)


Л у ч и Левкипп (ок. 500 – 440 до н. э. ), Демокрит (ок. 470 – 360 до н. э. ) – АТОМ-άτομος Фалес (660 – 546 до н. э. ) - ЭЛЕМЕНТ Бойль (1627 – 1691) – ЭЛЕМЕНТ, Ньютон (1642 - 1727) - АТОМ Лавуазье (1743 – 1794) - ЭЛЕМЕНТ, 1803 – 1805 г. Д. Дальтон - АТОМ Решающим в штурме тайны строения атома был 1869 г. , который известен не только как год рождения периодического закона, но и как год «крушения» представлений о недлимости атома. В этом году немецкий учёный Иоганн Гитторф (1824 – 1914) обнаружил новый вид лучей, которые впоследствии назвали «катодными лучами» , но не ему первому пришла идея попускать ток через воздушное пространство. Кто же автор идеи? Фарадей (1791 - 1867)

Л у ч и Наблюдая, как молния пробивает толщу воздушной массы, М. Фарадей задался целью пропустить ток через слой воздуха или пустоты, т. е. смоделировать молнию. Тогда не было ни мощных источников тока, ни глубокого вакуума, поэтому из этой затеи у Фарадея ничего не получилось, но идея пустоты осталась. В 1855 г. (ещё при жизни Фарадея) немецкий стеклодув Генрих Гейслер (1814 – 1879) изготовил хорошо вакуумированные им же трубки. Далее его друг, физик и математик Юлиус Плюккер (1801 – 1868), использовал их для изучения электрических разрядов в вакууме и газах. По мере разряжения газ начинает светиться. При увеличении разряжения появляется темное пространство – катодное пятно. Далее при разряжении это пространство начинают пронизывать какие-то лучи: Схема трубки Гейслера В 1876 г. немецкий физик Эуген Гольдшнейн (1850 – 1930) назвал поток, образующийся в темном пространстве, «катодными лучами» . Ранее упомянутый Гитторф обнаружил, что они отклоняются в магнитном поле, а в 1879 г. Кромвель Вэрли (1828 – 1883) определил, что они заряжены отрицательно (это будущие электроны, но пока их так не называют). ЭЛЕКТРОНЫ В 1891 г. наименьшее количество отрицательного электричества получило название «электрон» . Это произошло с лёгкой руки ирландца Джорджа Джонсона Стони (1826 – 1911)
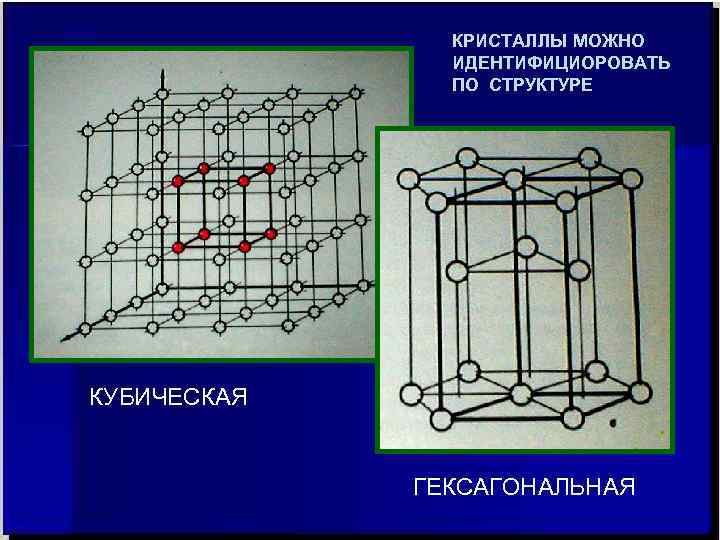
КРИСТАЛЛЫ МОЖНО ИДЕНТИФИЦИОРОВАТЬ ПО СТРУКТУРЕ КУБИЧЕСКАЯ ГЕКСАГОНАЛЬНАЯ
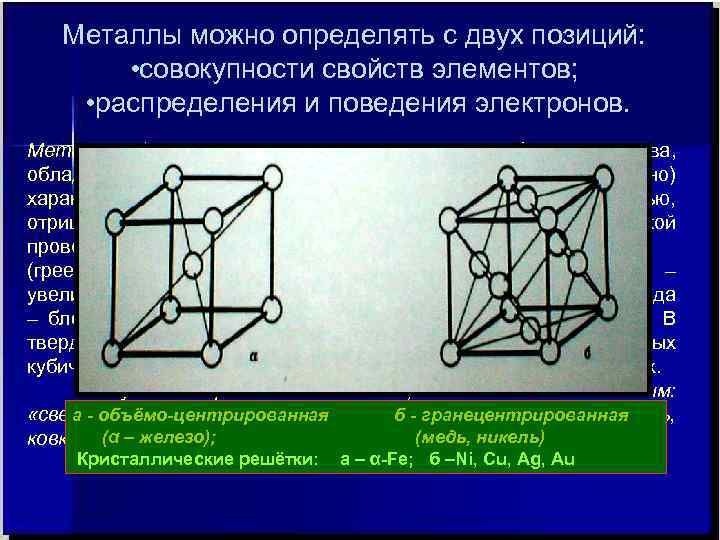
Металлы можно определять с двух позиций: • совокупности свойств элементов; • распределения и поведения электронов. Металлы (metallon – гр. руды, шахты, копи) – вещества, обладающие в обычных условиях (20 0 С, 1 атм - условно) характерными свойствами: высокой электро- и теплопроводностью, отрицательным температурным коэффициентом электрической проводимости (греем металл – проводимость уменьшается, охлаждаем – увеличивается), способны хорошо отражать световые волны (отсюда – блеск, к которому мы так все стремимся …. ) , пластичны. В твердом состоянии обычно кристаллические в плотно- упакованных кубической и гексагональной решетках , хотя могут быть и в других. Актуально определение металла, данное М. В. Ломоносовым: «светлое тело, которое ковать можно» (блеск, пластичность, a - объёмо-центрированная б - гранецентрированная (α железо); (медь, никель) ковкость -–три в одном !). Кристаллические решётки: а – α-Fe; б –Ni, Cu, Ag, Au
В металлах «металлическая связь» . Они делятся на s, p , d, f – элементы. Свойства любого химического соединения определяются типом химической связи между атомами его образующими. Основных типов связи три: ионная, ковалентная, металлическая. У металлов и сплавов тип химической связи между атомами – «металлическая» Для того, чтобы уяснить, что это такое и почему химическую связь в металлах и сплавах выделили ОСОБО, т. е. в чём проблема металлической связи, необходимо вспомнить другие типы химсвязи, базирующиеся на электронной природе взаимодействия частиц. Какая же химическая связь в неметаллах? НЕМЕТАЛЛИЧЕСКАЯ ?

ЭЛЕКТРОННЫЕ ТЕОРИИ ХИМИЧЕСКОЙ СВЯЗИ Генри Кавендиш (1731 – 1810) (Англия) – 1800 год Сванте Аррениус (1859 -1927) (Швеция) – 1877 год Электропроводность обеспечивается увеличением числа заряженных частиц, способных переносить электрические заряды, т. е. диссоциацией: H 2 O ↔ H+ + OH – Na. Cl ↔ Na+ + Cl –

ИОННАЯ СВЯЗЬ Основная идея теории ионной связи, предложенной Вальтером Косселем (1888 – 1956) в 1916 г. (Германия), которая базировалась на электростатическом взаимодействии зарядов, на удержании атомов (ионов) друг возле друга силами электростатического взаимодействия. Cl. Na+ Na + Cl – Структура кристалла Na. Cl
КОВАЛЕНТНАЯ СВЯЗЬ Статистическая теория строения атомов и молекул (теория ковалентной связи Дж. Н. Льюиса), основана на образовании общей электронной пары между атомами.
КОВАЛЕНТНАЯ СВЯЗЬ N N

ПРИРОДА МЕТАЛЛИЧЕСКОЙ ХИМСВЯЗИ Химическую связь в металлах можно считать разновидностью ионной связи, т. к. в узлах кристаллической решётки металлов находятся положительно заряженные ионы (катионы). Но метллы имеют пластичность, не характерную для кристаллических солеподобных соединений типа Na. Cl. Значить химсвязь в металлах не ионная. Можно предположить, что металлическая химсвязь есть разновидность ковалентной, т. к. заряды ионов металлов имеют очень маленькие значения (много меньше валентности, т. е. количества связевых валентных электронов), кроме того металлы электропроводны, теплопроводны, что несвойственно неметаллам (азот, кислород, составляющие воздух). Значит химсвязь в металлах и не ковалентная. Какова же природа химической связи в металлах и сплавах ?
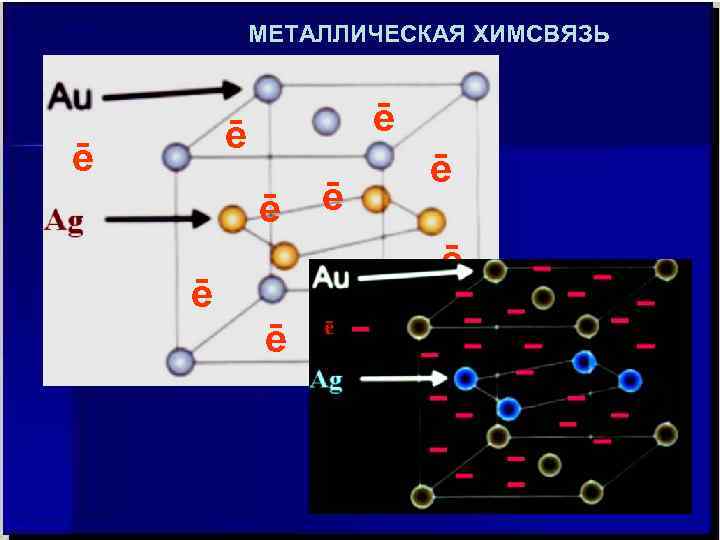
МЕТАЛЛИЧЕСКАЯ ХИМСВЯЗЬ ē ē ē

МЕТАЛЛЫ И НЕМЕТАЛЛЫ В современной науке уже нет деления элементов на металлы и неметаллы. Элементы по распределению электронов в атоме делятся на s, p , d, f – элементы. По геохимической классификации металлы бывают: • черные (Fe); • тяжелые цветные (Cu, Pb, Zn, Ni, Sn примыкают: Со, Sb, Bi, Hg, Cd – ρ ≥ 5 г/см 3); • лёгкие ( Al, Ca, Mg и т. д. – ρ ≤ 5 г/см 3); • драгоценные (Au, Ag) и платиновые (Ru, Rh, Pd, Os, Ir, Pt) – вместе – благородные металлы; • легирующие (ферро- сплавные) (Mn, Cr, W, W, Mo, V); • редкие (La, Y, Sc), их несколько групп; • радиоактивные (U, Th, Pu и др. ) Неметаллы: S - сера (красноломкость), P - фосфор (хладноломкость), C – углерод, N - азот углерод

СВОЙСТВА МЕТАЛЛОВ И СПЛАВОВ Металлы – вещества с сильно делокализованными* электронами. Делокализация обуславливается тем, что количество низших по энергиям орбиталей у металлов значительно больше, чем имеющихся валентных электронов. Высокие электропроводность и теплопроводность металлов и их блеск объясняются высокой подвижностью электронов на делокализованных орбиталях, а большая пластичность – наличием в их структуре плоскостей скольжения и минимальной направленностью металлических связей. Между собой металлы могут образовывать сплавы разной природы. *) - с нефиксированным местоположением в пространстве. Необходимо отметить, что золото и серебро имеют один тип кристаллической решётки – гранецентрированную, имеют одинаковый атомный радиус (1, 44 Å), близкие ионные радиусы для одновалентного состояния (1, 16 и 1, 37 Å) , атомный объем (10, 27 и 10, 23 см 3 /г-атом), твердость (по Бринеллю (10, 5 и 10, 3 кг/мм 2) и Моосу (2, 5 и 2, 5), λ коэффициент теплопроводности (1, 0 и 0, 75 кал • см – 1 • сек – 1 • град – 1 при 0 0 С)
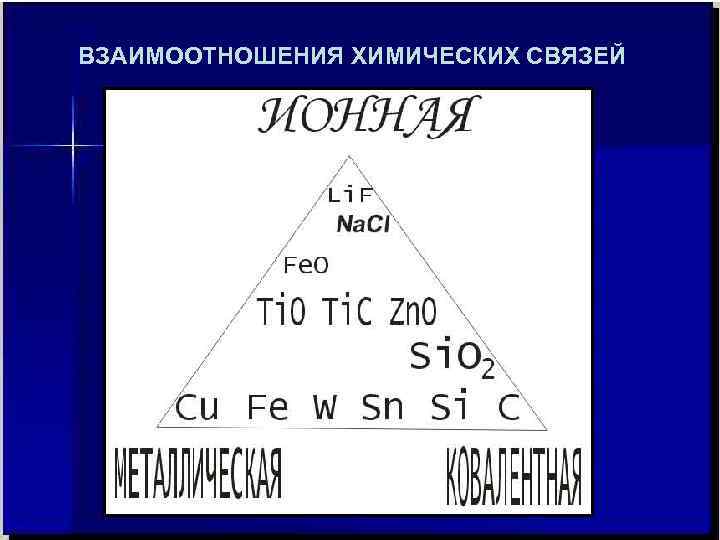
ВЗАИМООТНОШЕНИЯ ХИМИЧЕСКИХ СВЯЗЕЙ

МЕТАЛЛЫ И СПЛАВЫ Между собой металлы могут образовывать сплавы разной природы. Сплавы – формируются в результате замещения некоторых атомов в кристаллической решётке другими атомами – аналогами, за счет внедрения в решётку дополнительных атомов или за счет образования соединений с новой кристаллической структурой. Сплавы, как правило, отличаются меньшим блеском, так как электроны в сплавах более локализованы и плоскостей скольжения в их кристаллических решетках меньше (теряется пластичность).
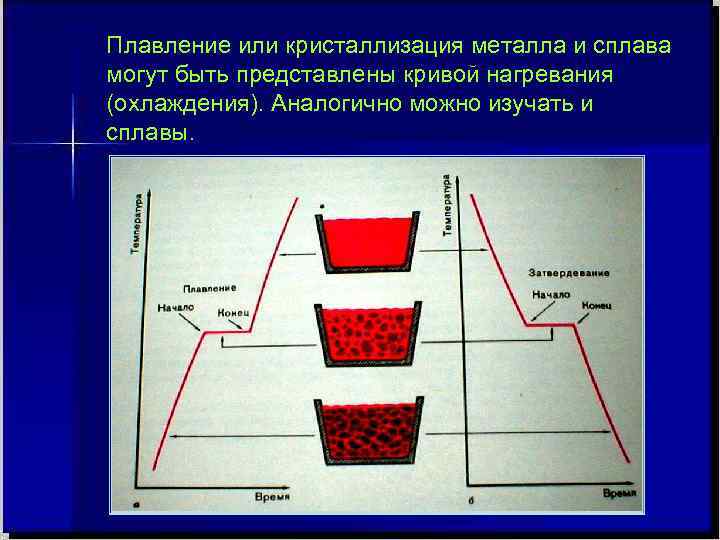
Плавление или кристаллизация металла и сплава могут быть представлены кривой нагревания (охлаждения). Аналогично можно изучать и сплавы.
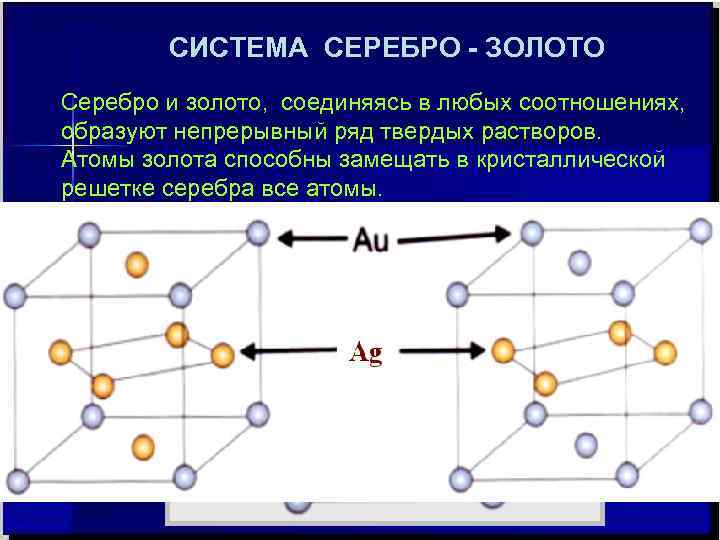
СИСТЕМА СЕРЕБРО - ЗОЛОТО Серебро и золото, соединяясь в любых соотношениях, образуют непрерывный ряд твердых растворов. Атомы золота способны замещать в кристаллической решетке серебра все атомы.
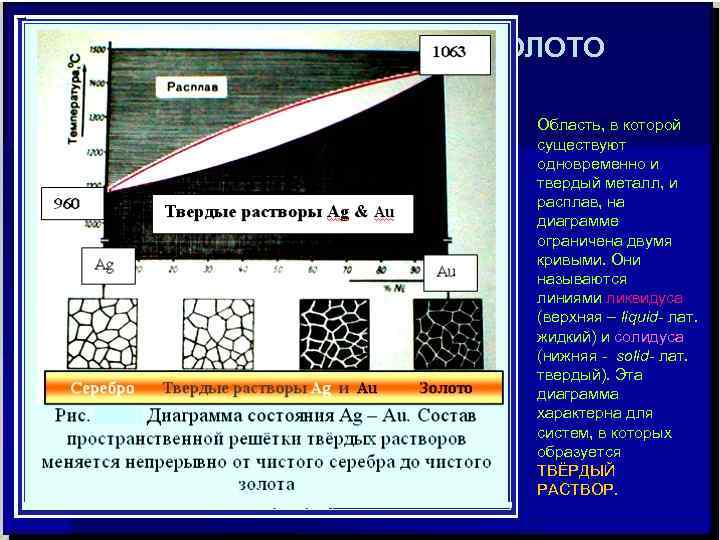
СИСТЕМА СЕРЕБРО - ЗОЛОТО Область, в которой существуют одновременно и твердый металл, и расплав, на диаграмме ограничена двумя кривыми. Они называются линиями ликвидуса (верхняя – liquid- лат. жидкий) и солидуса (нижняя - solid- лат. твердый). Эта диаграмма характерна для систем, в которых образуется ТВЁРДЫЙ РАСТВОР.
СИСТЕМА СЕРЕБРО - ЗОЛОТО

СИСТЕМА ВИСМУТ - КАДМИЙ В случае, когда при кристаллизации каждый компонент формируется отдельно (т. е. в твердом состоянии кристаллы металлов располагаются рядом, появляется граница раздела фаз), область существования расплава ограничена ломаной линией, соединяющей точки плавления компонентов через некоторую точку «Е» (или «Э» ). В системе Bi – Cd она соответствует 60 % (мас. ) висмута и 40 % (мас. ) кадмия. Это единственный сплав, имеющий точки плавления ликвидуса и солидуса одинаковые + 146 0 С (температура плавления висмута +276 0 С, а кадмия +324 0 С). Этот сплавится как чистый металл, т. е. при определенной температуре. Он называется эвтектическим (от гр. ευτεκτοσ – легкоплавкий) и плавится при самой низкой температуре относительно других составов.

СИСТЕМА ВИСМУТ - КАДМИЙ Это происходит потому, что в эвтектических сплавах самые мелкие кристаллы, образуют достаточно однородную фазу, имитирующую поведение чистого металла, только при более низкой температуре*.

СИСТЕМА ВИСМУТ - КАДМИЙ Равномерность распределения мелких частиц предполагает минимальные затраты энергии, поэтому понижается температура. Тогда как, в других случаях присутствие крупных частиц высокоплавкого компонента (в данном случае кадмия предполагает большие затраты энергии (что поднимает температуру плавления): они тем больше. Чем больше высокоплавкого компонента в смеси. Максимальная температура достигается, когда остается один высокоплавкий компонент. Его структура становится совершенной, искажения в ней за счёт присутствия второго компонента – нет, поэтому прочность химической связи между атомами кадмия максимальная. Это является причиной температуры плавления (в данной случае наиболее высокой), соответствующей плавлению чистого компонента (кадмия).
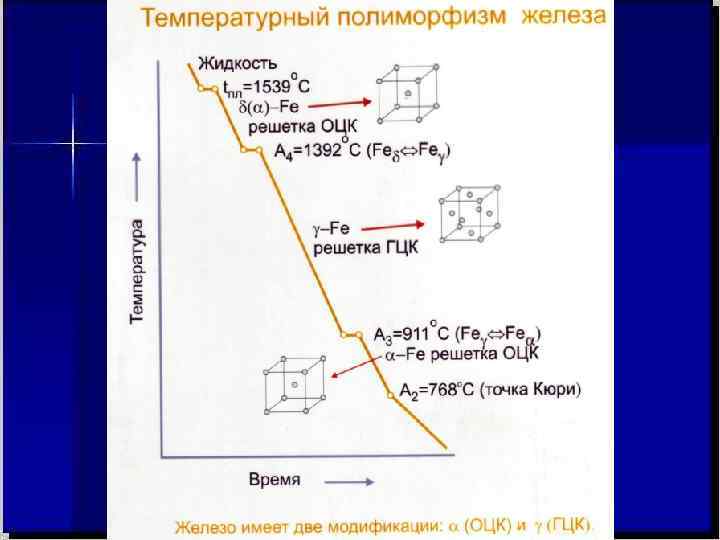
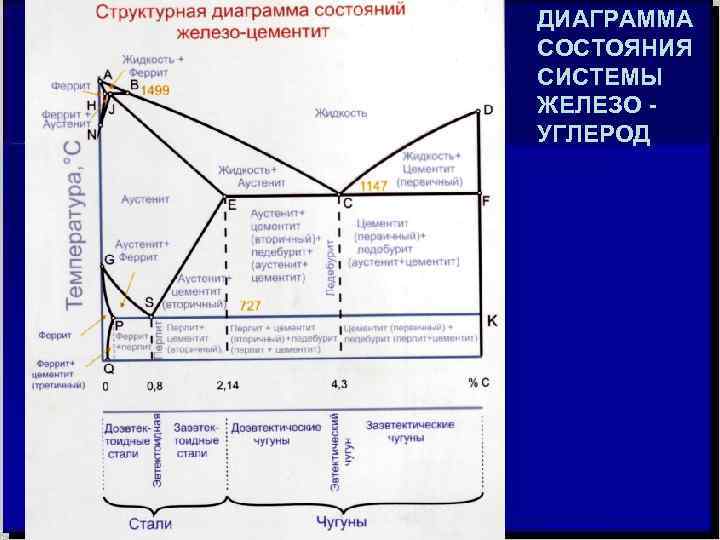
ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ ЖЕЛЕЗО УГЛЕРОД

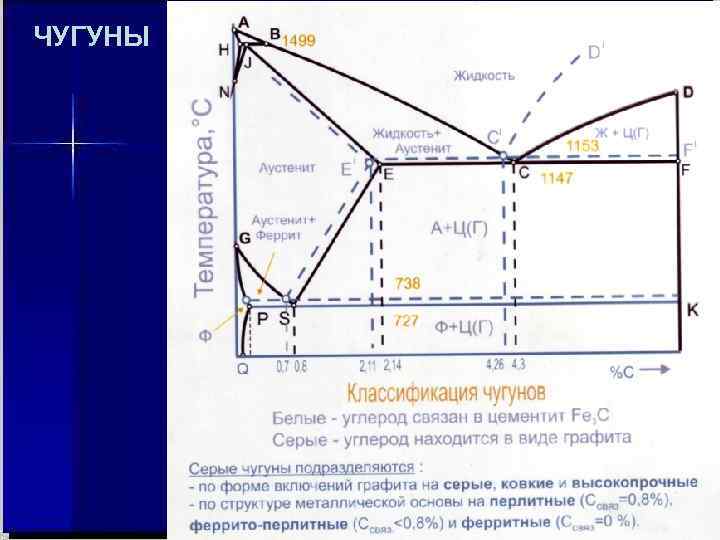
ЧУГУНЫ


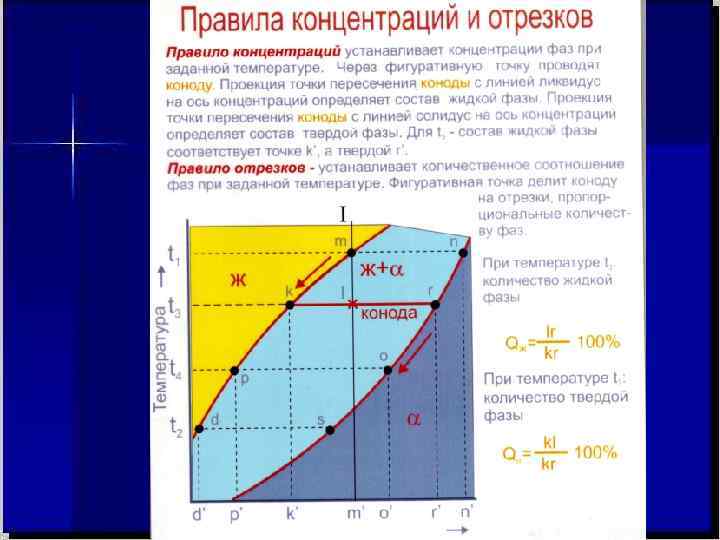
Приведенные диаграммы состояния системы «СОСТАВ – СВОЙСТВО» представляют собой элементы большого раздела общей химии «Физико – химического анализа» , основоположником которого является выдающийся российский учёный Николой Семёнович Курнаков

МАКРО- И МИКРОАНАЛИЗ МЕТАЛЛОВ И СПЛАВОВ Структура – пространственное расположение частиц в веществе. Макроструктура – строение вещества (в том числе и кристаллическое ), изучаемое без или под небольшим увеличением (2 х – 3 х кратное – лупа). Микроструктура – мелкие кристаллы (зерна), составляющие вещество. Тонкая структура – расположение частиц в кристалле и электронов в атоме. Наноструктура – расположение частиц, размером, не превышающим 100 нм (10– 7 м). При этом зерна сферической формы должны иметь толщину слоя 1 нм, что соответствует 2 – 3–х атомным слоям у большинства металлов.

Физические методы исследования металлов и сплавов Электронная микроскопия: используется явление прохождения потока электронов через объект или их отражения от поверхности объекта. В то время как видимый свет позволяет различать объекты с длиной, равной длине волны (500 нм), поток электронов (электронный свет) позволяет видеть объекты размером до 0, 5 нм. Для сравнения диаметр иона алюминия (Al+3) ≈ 0, 1 нм.

Hydroxyapatite crystal growth http: //www. eyeofscience. com/eos 2/english/gallery/kristalle/frame. html

Физические методы исследования металлов и сплавов Рентгенофазовый и рентгеноструктурный анализ: используется явление интерференции рентгеновских лучей ( λ = 10 нм ÷ 10– 3 нм), проходящих через исследуемый объект.
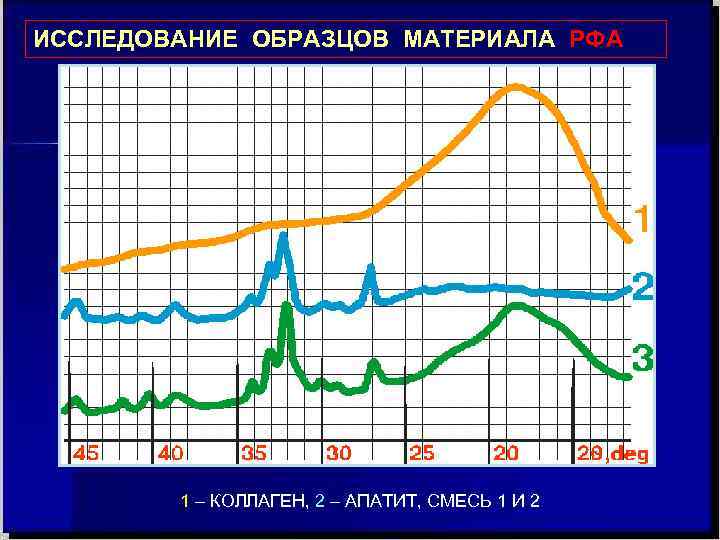
ИССЛЕДОВАНИЕ ОБРАЗЦОВ МАТЕРИАЛА РФА 1 – КОЛЛАГЕН, 2 – АПАТИТ, СМЕСЬ 1 И 2
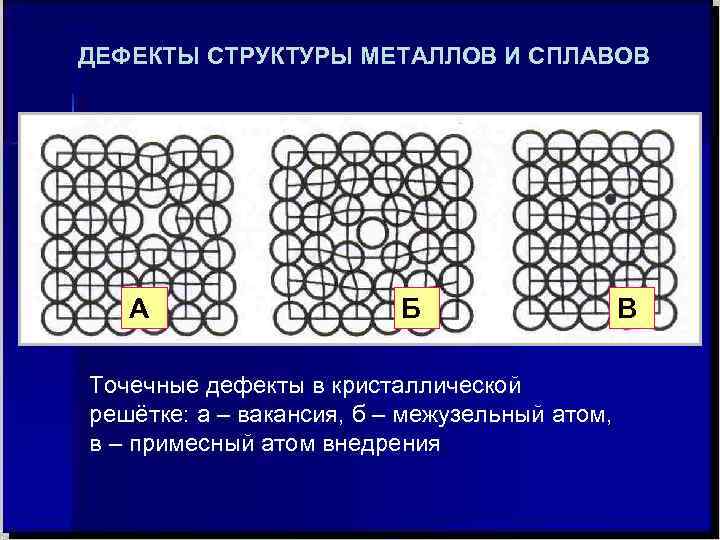
ДЕФЕКТЫ СТРУКТУРЫ МЕТАЛЛОВ И СПЛАВОВ Дефект – отклонение структуры кристалла от идеальной. У точечных – размеры близки к межатомному расстоянию. Они делятся на вакансии, межузельные атомы основного вещества, А Б В чужеродные атомы внедрения. Точечные дефекты в кристаллической решётке: а – вакансия, б – межузельный атом, в – примесный атом внедрения

УЛЬТРА ДИСПЕРСНЫЕ ПОРОШКИ Один из способов получения УДП, основанный на процессах испарения и последующей конденсации, – плазмохимический. Он осуществляется на дуговых плазмотронах – устройствах, где дуга, нагревающая поток обдуваемого ею газа до нескольких тысяч градусов, горит между анодом и катодом. Причем газ может быть самого разного состава – как инертного, так и любого, наперед Разработка наноструктурированных твердых заданного. сплавов с твердостью свыше 2100 кг/мм 2 Суть метода заключается в том, что если в этот, нагретый до очень высокой температуры, газ поместить нужный нам материал, высокоэнергетическими методами синтеза и вплоть до самых тугоплавких (вольфрам, тантал и т. д. ), то с ним компактирования начинают происходить разные, сначала химические, а затем физические превращения, в частности конденсация. Все это происходит за чрезвычайно короткое время – сотые и даже тысячные доли секунды. При этом возникает резкий перепад температур, до 105 – 107 градусов в секунду. В результате материал очень быстро охлаждается и кристаллизуется. Причем можно создать такие условия, что эта кристаллизация будет происходить в виде наночастиц. В результате экспериментов выяснилось, что таким способом можно получить широчайший спектр материалов с размером частиц от 10 до 100 нм.

СВЕРХТВЕРДЫЕ НАНОСПЛАВЫ КАРБИД ВОЛЬФРАМА , РАЗМЕР ЧАСТИЦ 30 НМ

КАРБИД ВОЛЬФРАМА С КОБАЛЬТОМ Структура твердого сплава. Размер зерна карбида –меньше 1 мкм.

КАРБИД ТАНТАЛА, РАЗМЕР ЧАСТИЦ 10 НМ

ПЛАЗМОХИМИЧЕСКАЯ УСТАНОВКА

БУМАГА ПРОЧНЕЕ … СТАЛИ ? Испытания образца «стальной» бумаги длиной 40 миллиметров, шириной 5 миллиметров и толщиной 50 микрометров показали, что его прочность на разрыв составляет 214 мегапаскалей, что выше, чем у чугуна (130 мегапаскалей) и немногим хуже, чем у конструкционной стали (250 мегапаскалей). Обычная бумага имеет прочность на разрыв менее 1 мегапаскаля. Секрет этой бумаги основан на следующих деталях: перенос естественных волокон целлюлозы в лист почти без привнесения дефектов; далее — толщина волокон составляет порядка 20 нанометров, что в тысячу раз меньше, чем волокна, из которых состоит обычная бумага (а по отношению к своему диаметру тонкие нити держат намного большее разрывное усилие, нежели толстые); наконец, сама сеть даёт волокнам немного сдвигаться друг относительно друга, что "рассеивает" напряжения.
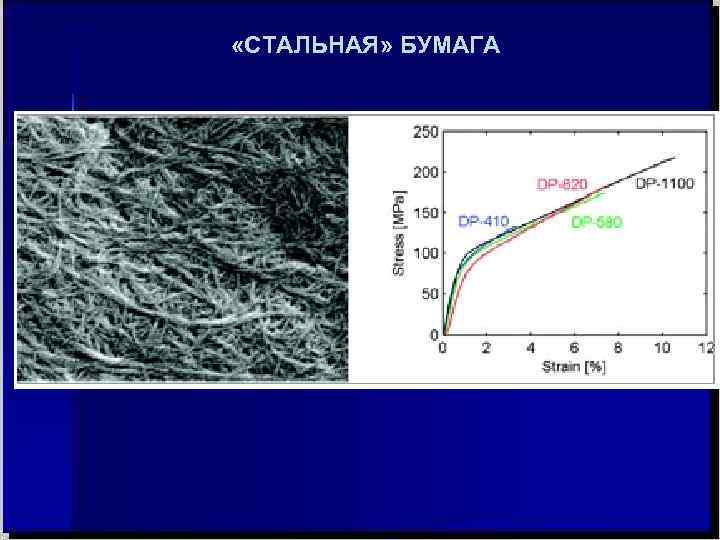
«СТАЛЬНАЯ» БУМАГА

МАТЕРИАЛОВЕД-243-Лекция -1-2011.ppt