1_Материаловедение-Fe-C.ppt
- Количество слайдов: 18
 Материаловедение Диаграмма состояния Fe – C
Материаловедение Диаграмма состояния Fe – C
 Железо Fe (атомный номер 26; атомный вес 55, 85) – ферромагнитный металл серебристо-белого цвета. Плотность – 7, 86 г/см 3. Тпл. = 1539 °С. Переходный металл. При нормальных условиях Fe существует в двух аллотропических модификациях. Кристаллическое строение. Впервые критические температуры превращений железа были определены в 1868 г. Д. К. Черновым. В 1888 г. французский ученый Осмонд предложил каждую критическую точку обозначить индексом А (от французской “arret” – что означает остановку на термической кривой). Для различия критических точек при нагревании и охлаждении к обозначению критической точки А добавляется индекс “с” (от французского слова choftage – нагревание) или индекс “r” (от французского refroidissement – охлаждение). Критические точки температур превращений. Механические свойства железа.
Железо Fe (атомный номер 26; атомный вес 55, 85) – ферромагнитный металл серебристо-белого цвета. Плотность – 7, 86 г/см 3. Тпл. = 1539 °С. Переходный металл. При нормальных условиях Fe существует в двух аллотропических модификациях. Кристаллическое строение. Впервые критические температуры превращений железа были определены в 1868 г. Д. К. Черновым. В 1888 г. французский ученый Осмонд предложил каждую критическую точку обозначить индексом А (от французской “arret” – что означает остановку на термической кривой). Для различия критических точек при нагревании и охлаждении к обозначению критической точки А добавляется индекс “с” (от французского слова choftage – нагревание) или индекс “r” (от французского refroidissement – охлаждение). Критические точки температур превращений. Механические свойства железа.
 Углерод – нeметаллический элемент IV группы II периода, порядковый номер 6, атомная масса 12, 01; плотность 2, 5 г/см 3, температура плавления ~3500°С. Он растворяется в довольно значительных количествах не только в жидком железе, но и в -Fe и -Fe. Предельная растворимость в -Fe при 20°С - 0, 006%, при 725°С - 0, 025%. В -Fe - 0, 8% при 727°С и 2, 14% при 1147°С. Углерод, как и железо, обладает полиморфизмом. Модификация углерода в виде алмаза в обычных условиях метастабильна. Высокое давление (>1000 МПа) стабилизирует модификацию углерода в виде алмаза. При давлениях свыше 60000 МПа стабилен графит II, имеющий о. ц. к. решетку. Переход алмаза в графит возможен при температурах ~1200°С.
Углерод – нeметаллический элемент IV группы II периода, порядковый номер 6, атомная масса 12, 01; плотность 2, 5 г/см 3, температура плавления ~3500°С. Он растворяется в довольно значительных количествах не только в жидком железе, но и в -Fe и -Fe. Предельная растворимость в -Fe при 20°С - 0, 006%, при 725°С - 0, 025%. В -Fe - 0, 8% при 727°С и 2, 14% при 1147°С. Углерод, как и железо, обладает полиморфизмом. Модификация углерода в виде алмаза в обычных условиях метастабильна. Высокое давление (>1000 МПа) стабилизирует модификацию углерода в виде алмаза. При давлениях свыше 60000 МПа стабилен графит II, имеющий о. ц. к. решетку. Переход алмаза в графит возможен при температурах ~1200°С.
 Основными фазами в сплавах системы «железо – углерод» являются: жидкая фаза (Ж), феррит (Ф), аустенит (А), цементит (Ц) и графит (Гр). Жидкий раствор углерода в железе характеризуется: - ближним порядком в расположении атомов, - с преобладанием металлической связи. Строение жидкого раствора (или расплава) зависит от концентрации углерода. При содержании С до 0, 2% первая координационная сфера соответствует размытой решетке ОЦК; в интервале 0, 2… 0, 6%С наблюдается переход к размытой ГЦК решетке. При содержании углерода до 2% жидкие растворы микроскопически однородны. При содержании углерода > 2% в жидком растворе появляются микрогруппировки атомов углерода величиной 10 -8… 10 -9 м, что связано с более сильным взаимодействием одноименных атомов (С – С и Fe – Fe), чем разноименных (Fe – С). По мере увеличения концентрации углерода снижаются вязкость и поверхностное натяжение.
Основными фазами в сплавах системы «железо – углерод» являются: жидкая фаза (Ж), феррит (Ф), аустенит (А), цементит (Ц) и графит (Гр). Жидкий раствор углерода в железе характеризуется: - ближним порядком в расположении атомов, - с преобладанием металлической связи. Строение жидкого раствора (или расплава) зависит от концентрации углерода. При содержании С до 0, 2% первая координационная сфера соответствует размытой решетке ОЦК; в интервале 0, 2… 0, 6%С наблюдается переход к размытой ГЦК решетке. При содержании углерода до 2% жидкие растворы микроскопически однородны. При содержании углерода > 2% в жидком растворе появляются микрогруппировки атомов углерода величиной 10 -8… 10 -9 м, что связано с более сильным взаимодействием одноименных атомов (С – С и Fe – Fe), чем разноименных (Fe – С). По мере увеличения концентрации углерода снижаются вязкость и поверхностное натяжение.
 Твердые растворы углерода в полиморфных - и -модификациях железа являются растворами внедрения. По мере повышения температуры растворимость углерода как в решетке -Fe, так и в -Fe возрастает. Твердый раствор углерода в -Fe (решетка ОЦК) называют ферритом. Механические свойства феррита при 20°С: в = 250 МПа; т = 120 МПа; до 50%; до 80%; НВ = 800… 1000 МПа. Физические свойства феррита сильно зависят от содержания углерода и других примесей. Микроструктура феррита – гранулированные зерна.
Твердые растворы углерода в полиморфных - и -модификациях железа являются растворами внедрения. По мере повышения температуры растворимость углерода как в решетке -Fe, так и в -Fe возрастает. Твердый раствор углерода в -Fe (решетка ОЦК) называют ферритом. Механические свойства феррита при 20°С: в = 250 МПа; т = 120 МПа; до 50%; до 80%; НВ = 800… 1000 МПа. Физические свойства феррита сильно зависят от содержания углерода и других примесей. Микроструктура феррита – гранулированные зерна.
 Твердый раствор углерода в -Fe (решетка ГЦК) называют аустенитом. Максимальная растворимость углерода в -Fe намного больше, чем в -Fe, и составляет 2, 14%. Это объясняется присутствием в решетке -Fe меньшего числа, но более крупных межузельных октаэдрических пор, в которых атомы углерода размещаются более свободно. Микроструктура аустенита – полиэдрическая; в полиэдрах бывают видны двойники деформации и рекристаллизации. Механические свойства аустенита железоуглеродистых сплавов при нормальной температуре определить нельзя, так как он в этих условиях не может существовать. Обычно указывают свойства аустенита высоколегированных сплавов, поскольку в них аустенит может наблюдаться и при нормальных температурах. Для такого аустенита характерна высокая пластичность, низкие значения твердости и предела текучести. Аустенит может упрочняться за счет деформационного наклепа. В общем случае в сплавах на основе железа феррит и аустенит являются твердыми растворами не только углерода, но и других элементов, входящих в состав сплава и образующих с железом твердые растворы замещения и (или) внедрения.
Твердый раствор углерода в -Fe (решетка ГЦК) называют аустенитом. Максимальная растворимость углерода в -Fe намного больше, чем в -Fe, и составляет 2, 14%. Это объясняется присутствием в решетке -Fe меньшего числа, но более крупных межузельных октаэдрических пор, в которых атомы углерода размещаются более свободно. Микроструктура аустенита – полиэдрическая; в полиэдрах бывают видны двойники деформации и рекристаллизации. Механические свойства аустенита железоуглеродистых сплавов при нормальной температуре определить нельзя, так как он в этих условиях не может существовать. Обычно указывают свойства аустенита высоколегированных сплавов, поскольку в них аустенит может наблюдаться и при нормальных температурах. Для такого аустенита характерна высокая пластичность, низкие значения твердости и предела текучести. Аустенит может упрочняться за счет деформационного наклепа. В общем случае в сплавах на основе железа феррит и аустенит являются твердыми растворами не только углерода, но и других элементов, входящих в состав сплава и образующих с железом твердые растворы замещения и (или) внедрения.
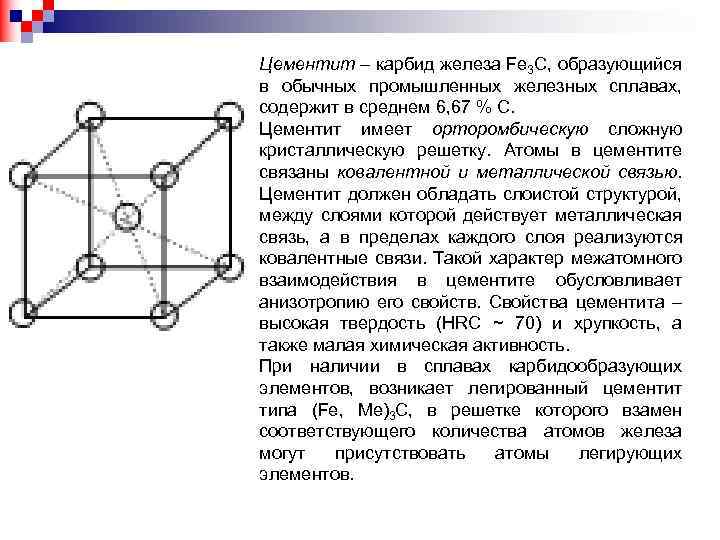 Цементит – карбид железа Fe 3 C, образующийся в обычных промышленных железных сплавах, содержит в среднем 6, 67 % С. Цементит имеет орторомбическую сложную кристаллическую решетку. Атомы в цементите связаны ковалентной и металлической связью. Цементит должен обладать слоистой структурой, между слоями которой действует металлическая связь, а в пределах каждого слоя реализуются ковалентные связи. Такой характер межатомного взаимодействия в цементите обусловливает анизотропию его свойств. Свойства цементита – высокая твердость (HRC ~ 70) и хрупкость, а также малая химическая активность. При наличии в сплавах карбидообразующих элементов, возникает легированный цементит типа (Fe, Ме)3 С, в решетке которого взамен соответствующего количества атомов железа могут присутствовать атомы легирующих элементов.
Цементит – карбид железа Fe 3 C, образующийся в обычных промышленных железных сплавах, содержит в среднем 6, 67 % С. Цементит имеет орторомбическую сложную кристаллическую решетку. Атомы в цементите связаны ковалентной и металлической связью. Цементит должен обладать слоистой структурой, между слоями которой действует металлическая связь, а в пределах каждого слоя реализуются ковалентные связи. Такой характер межатомного взаимодействия в цементите обусловливает анизотропию его свойств. Свойства цементита – высокая твердость (HRC ~ 70) и хрупкость, а также малая химическая активность. При наличии в сплавах карбидообразующих элементов, возникает легированный цементит типа (Fe, Ме)3 С, в решетке которого взамен соответствующего количества атомов железа могут присутствовать атомы легирующих элементов.
 Графит, образующийся в железоуглеродистых сплавах, мало отличается от природного графита и представляет собой почти чистый углерод. Растворимость железа в графите очень мала. Графит – наименее прочная фаза в железоуглеродистых сплавах. В строении графита и цементита имеется сходство; в обеих фазах между атомами в пределах каждого слоя действуют ковалентные связи, а между слоями – ненаправленные связи. Это отражается в сходстве строения первичных кристаллов этих фаз, растущих в железоуглеродистых расплавах в виде плоских дендритов. Цементит и графит обладают также и ненаправленной (металлической) связью, действующей между слоями, которая обеспечивается коллективизированными электронами. Цементит является метастабильной фазой и может в определенных условиях распадаться на железо и графит.
Графит, образующийся в железоуглеродистых сплавах, мало отличается от природного графита и представляет собой почти чистый углерод. Растворимость железа в графите очень мала. Графит – наименее прочная фаза в железоуглеродистых сплавах. В строении графита и цементита имеется сходство; в обеих фазах между атомами в пределах каждого слоя действуют ковалентные связи, а между слоями – ненаправленные связи. Это отражается в сходстве строения первичных кристаллов этих фаз, растущих в железоуглеродистых расплавах в виде плоских дендритов. Цементит и графит обладают также и ненаправленной (металлической) связью, действующей между слоями, которая обеспечивается коллективизированными электронами. Цементит является метастабильной фазой и может в определенных условиях распадаться на железо и графит.
 На диаграмме равновесия Fe – С имеются следующие линии: В области затвердевания или плавления АВ – линия ликвидус (граница области Ж + ); ВС – линия ликвидус (граница области Ж + ); CD – линия ликвидус (граница области Ж + Fe 3 C); C'D' – линия ликвидус (граница области Ж + Гр); АН – линия солидус (граница области Ж + ); НВ – линия перитектического равновесия (при охлаждении соединение жидкости состава В с -фазой состава Н и образование -фазы состава J); для сплавов участка HJ – линия солидус; EF – линия эвтектического равновесия (аустенит состава Е, цементит, жидкость С) – линия солидус; E'F' – линия эвтектического равновесия (аустенит состава Е', графит, жидкость состава С') – линия солидус.
На диаграмме равновесия Fe – С имеются следующие линии: В области затвердевания или плавления АВ – линия ликвидус (граница области Ж + ); ВС – линия ликвидус (граница области Ж + ); CD – линия ликвидус (граница области Ж + Fe 3 C); C'D' – линия ликвидус (граница области Ж + Гр); АН – линия солидус (граница области Ж + ); НВ – линия перитектического равновесия (при охлаждении соединение жидкости состава В с -фазой состава Н и образование -фазы состава J); для сплавов участка HJ – линия солидус; EF – линия эвтектического равновесия (аустенит состава Е, цементит, жидкость С) – линия солидус; E'F' – линия эвтектического равновесия (аустенит состава Е', графит, жидкость состава С') – линия солидус.
 В области затвердевших сплавов NH – верхняя граница области равновесия + (при охлаждении начало превращения ); NJ – нижняя граница области равновесия + (при охлаждении конец превращения ); GO – верхняя граница области равновесия + (при охлаждении начало выпадения из аустенита неферромагнитного феррита – -фазы); OS – верхняя граница области равновесия + (при охлаждении начало выпадения из аустенита ферромагнитного феррита – -фазы); SE – линия ограниченной растворимости Fe 3 C в аустените ( -фазе); S'E' – линия ограниченной растворимости графита в аустените ( -фазе); GP – граница области равновесия ( ) + (при охлаждении конец превращения аустенита в феррит); МО – температура Кюри (при охлаждении переход неферромагнитного феррита в ферромагнитный; превращение ); РК – линия эвтектоидного равновесия (при охлаждении распад аустенита состава S на феррит состава Р и цементит) ; Р'К' – линия эвтектоидного равновесия (при охлаждении распад аустенита состава S' на феррит состава Р' и графит); PQ – линия ограниченной растворимости цементита в феррите.
В области затвердевших сплавов NH – верхняя граница области равновесия + (при охлаждении начало превращения ); NJ – нижняя граница области равновесия + (при охлаждении конец превращения ); GO – верхняя граница области равновесия + (при охлаждении начало выпадения из аустенита неферромагнитного феррита – -фазы); OS – верхняя граница области равновесия + (при охлаждении начало выпадения из аустенита ферромагнитного феррита – -фазы); SE – линия ограниченной растворимости Fe 3 C в аустените ( -фазе); S'E' – линия ограниченной растворимости графита в аустените ( -фазе); GP – граница области равновесия ( ) + (при охлаждении конец превращения аустенита в феррит); МО – температура Кюри (при охлаждении переход неферромагнитного феррита в ферромагнитный; превращение ); РК – линия эвтектоидного равновесия (при охлаждении распад аустенита состава S на феррит состава Р и цементит) ; Р'К' – линия эвтектоидного равновесия (при охлаждении распад аустенита состава S' на феррит состава Р' и графит); PQ – линия ограниченной растворимости цементита в феррите.
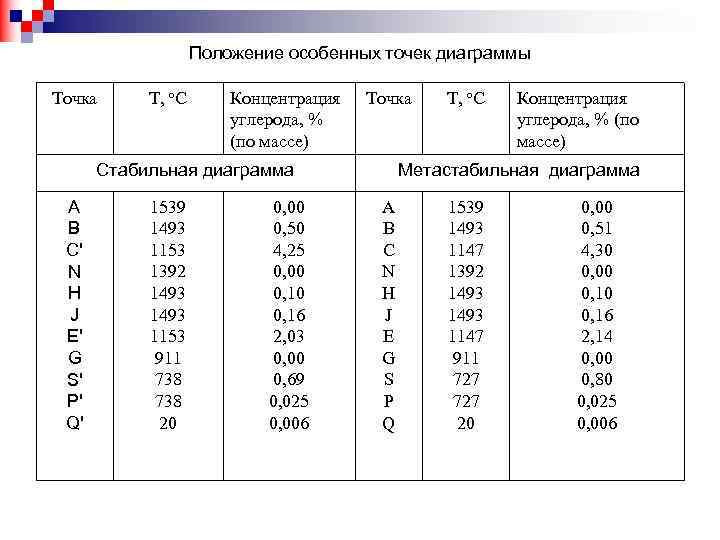 Положение особенных точек диаграммы Точка T, о. С Концентрация углерода, % (по массе) Точка Стабильная диаграмма А В С' N Н J Е' G S' Р' Q' 1539 1493 1153 1392 1493 1153 911 738 20 0, 00 0, 50 4, 25 0, 00 0, 16 2, 03 0, 00 0, 69 0, 025 0, 006 T, о. С Концентрация углерода, % (по массе) Метастабильная диаграмма A B С N Н J Е G S P Q 1539 1493 1147 1392 1493 1147 911 727 20 0, 00 0, 51 4, 30 0, 00 0, 16 2, 14 0, 00 0, 80 0, 025 0, 006
Положение особенных точек диаграммы Точка T, о. С Концентрация углерода, % (по массе) Точка Стабильная диаграмма А В С' N Н J Е' G S' Р' Q' 1539 1493 1153 1392 1493 1153 911 738 20 0, 00 0, 50 4, 25 0, 00 0, 16 2, 03 0, 00 0, 69 0, 025 0, 006 T, о. С Концентрация углерода, % (по массе) Метастабильная диаграмма A B С N Н J Е G S P Q 1539 1493 1147 1392 1493 1147 911 727 20 0, 00 0, 51 4, 30 0, 00 0, 16 2, 14 0, 00 0, 80 0, 025 0, 006
 Переход к следующей теме
Переход к следующей теме
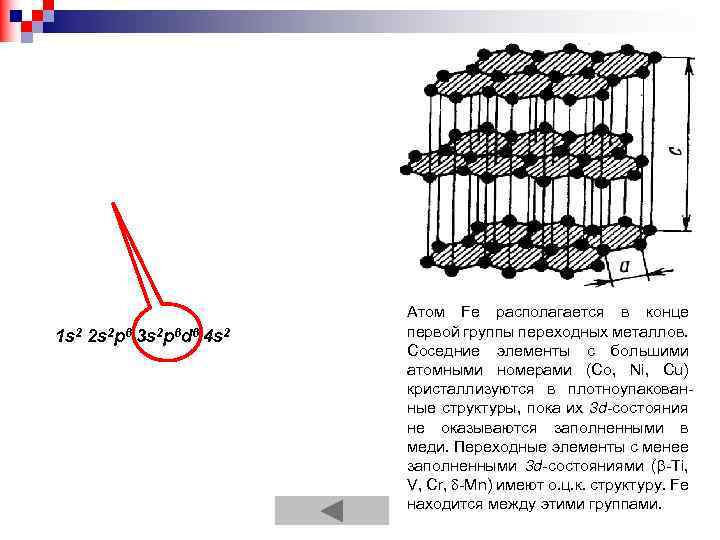 1 s 2 2 s 2 p 6 3 s 2 p 6 d 6 4 s 2 Атом Fe располагается в конце первой группы переходных металлов. Соседние элементы с большими атомными номерами (Со, Ni, Сu) кристаллизуются в плотноупакованные структуры, пока их 3 d-состояния не оказываются заполненными в меди. Переходные элементы с менее заполненными 3 d-состояниями ( -Ti, V, Cr, -Мn) имеют о. ц. к. структуру. Fe находится между этими группами.
1 s 2 2 s 2 p 6 3 s 2 p 6 d 6 4 s 2 Атом Fe располагается в конце первой группы переходных металлов. Соседние элементы с большими атомными номерами (Со, Ni, Сu) кристаллизуются в плотноупакованные структуры, пока их 3 d-состояния не оказываются заполненными в меди. Переходные элементы с менее заполненными 3 d-состояниями ( -Ti, V, Cr, -Мn) имеют о. ц. к. структуру. Fe находится между этими группами.
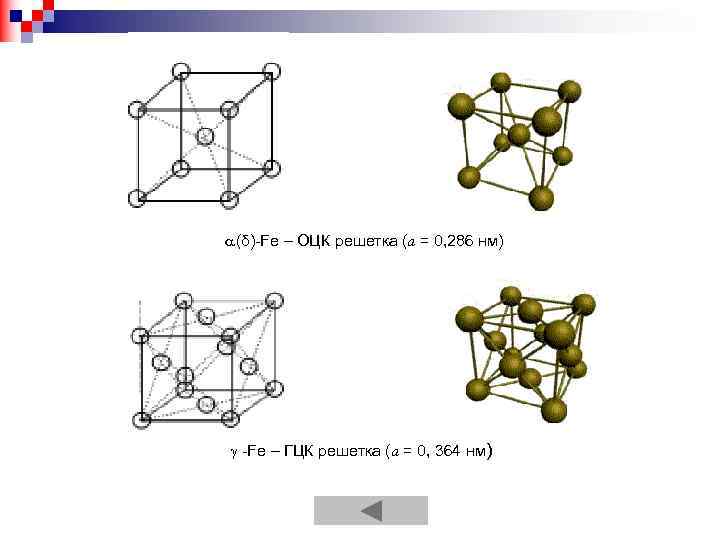 (δ)-Fe – ОЦК решетка (а = 0, 286 нм) -Fe – ГЦК решетка (а = 0, 364 нм)
(δ)-Fe – ОЦК решетка (а = 0, 286 нм) -Fe – ГЦК решетка (а = 0, 364 нм)
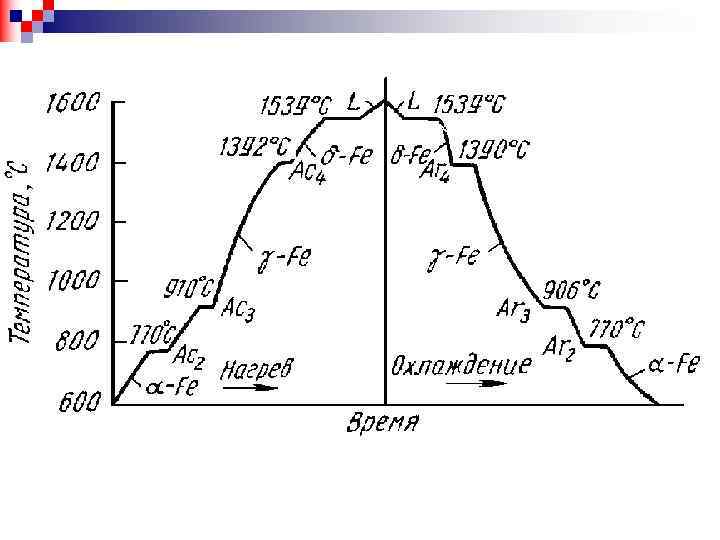
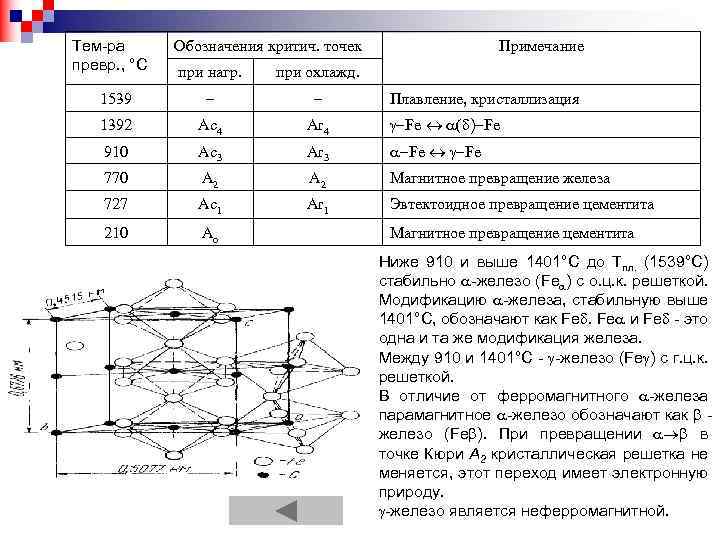 Тем-ра превр. , °С Обозначения критич. точек Примечание при нагр. при охлажд. 1539 – – 1392 Ас4 Аr 4 -Fe « ( )-Fe 910 Ас3 Аr 3 -Fe « -Fe 770 A 2 Магнитное превращение железа 727 Ас1 Ar 1 Эвтектоидное превращение цементита 210 Ао Плавление, кристаллизация Магнитное превращение цементита Ниже 910 и выше 1401°С до Тпл. (1539°С) стабильно -железо (Fe ) с о. ц. к. решеткой. Модификацию -железа, стабильную выше 1401°С, обозначают как Fe. Fе и Fе - это одна и та же модификация железа. Между 910 и 1401°С - -железо (Fe ) c г. ц. к. решеткой. В отличие от ферромагнитного -железа парамагнитное -железо обозначают как железо (Fe ). При превращении в точке Кюри A 2 кристаллическая решетка не меняется, этот переход имеет электронную природу. -железо является неферромагнитной.
Тем-ра превр. , °С Обозначения критич. точек Примечание при нагр. при охлажд. 1539 – – 1392 Ас4 Аr 4 -Fe « ( )-Fe 910 Ас3 Аr 3 -Fe « -Fe 770 A 2 Магнитное превращение железа 727 Ас1 Ar 1 Эвтектоидное превращение цементита 210 Ао Плавление, кристаллизация Магнитное превращение цементита Ниже 910 и выше 1401°С до Тпл. (1539°С) стабильно -железо (Fe ) с о. ц. к. решеткой. Модификацию -железа, стабильную выше 1401°С, обозначают как Fe. Fе и Fе - это одна и та же модификация железа. Между 910 и 1401°С - -железо (Fe ) c г. ц. к. решеткой. В отличие от ферромагнитного -железа парамагнитное -железо обозначают как железо (Fe ). При превращении в точке Кюри A 2 кристаллическая решетка не меняется, этот переход имеет электронную природу. -железо является неферромагнитной.
 Механические свойства. Технически чистое железо содержит небольшие количества примесей, попадающих в него из руды или из топлива и воздуха при выплавке: С, Mn, Si, Al, S, Р, О, N, Н, Сu, Cr, Ni. Твердость технически чистого железа, содержащего 99, 9%Fe, значительно выше чем у химически чистого; HB ~ 900 МПа (У химического чистого железа – HB ~ 490 МПа). Механические свойства: в = 300… 350 МПа, = 35… 40%, = 65… 70%.
Механические свойства. Технически чистое железо содержит небольшие количества примесей, попадающих в него из руды или из топлива и воздуха при выплавке: С, Mn, Si, Al, S, Р, О, N, Н, Сu, Cr, Ni. Твердость технически чистого железа, содержащего 99, 9%Fe, значительно выше чем у химически чистого; HB ~ 900 МПа (У химического чистого железа – HB ~ 490 МПа). Механические свойства: в = 300… 350 МПа, = 35… 40%, = 65… 70%.
 В обычных условиях С находится в виде графита с гексагональной слоистой решеткой. Между атомами углерода каждого слоя действуют сильные ковалентные связи (энергия связи ~680 Дж/кмоль), так как межатомные расстояния здесь очень малы (0, 1415 нм). Ковалентные связи осуществляются спариванием трехвалентных электронов каждого атома с электронами трех окружающих его соседей. Четвертые валентные электроны переходят в коллективные, и это сообщает графиту металлические свойства, в первую очередь, повышенную электрическую проводимость, Слои находятся на сравнительно больших расстояниях друг от друга (0, 3354 нм) и связаны поляризационными силами. Алмаз характеризуется тетраэдрической решеткой, в которой каждый атом углерода ковалентно связан с четырьмя соседями, находящимися на расстоянии 0, 1545 нм. Алмаз при обычных T и P в сплавах Fe–C не встречается.
В обычных условиях С находится в виде графита с гексагональной слоистой решеткой. Между атомами углерода каждого слоя действуют сильные ковалентные связи (энергия связи ~680 Дж/кмоль), так как межатомные расстояния здесь очень малы (0, 1415 нм). Ковалентные связи осуществляются спариванием трехвалентных электронов каждого атома с электронами трех окружающих его соседей. Четвертые валентные электроны переходят в коллективные, и это сообщает графиту металлические свойства, в первую очередь, повышенную электрическую проводимость, Слои находятся на сравнительно больших расстояниях друг от друга (0, 3354 нм) и связаны поляризационными силами. Алмаз характеризуется тетраэдрической решеткой, в которой каждый атом углерода ковалентно связан с четырьмя соседями, находящимися на расстоянии 0, 1545 нм. Алмаз при обычных T и P в сплавах Fe–C не встречается.


