2011_OKhT_Min_LK_3_balansy_opt_parametry.ppt
- Количество слайдов: 48
Материальный баланс химико-технологического процесса Энергетические ресурсы. Энергетический баланс химикотехнологического процесса Основные закономерности химической технологии. Химические процессы и их роль в структуре химического производства Основные закономерности химической технологии. Термодинамические расчёты химико-технологического процесса Основные закономерности химической технологии. Химическое равновесие. Основные закономерности химической технологии. Кинетика химических превращений
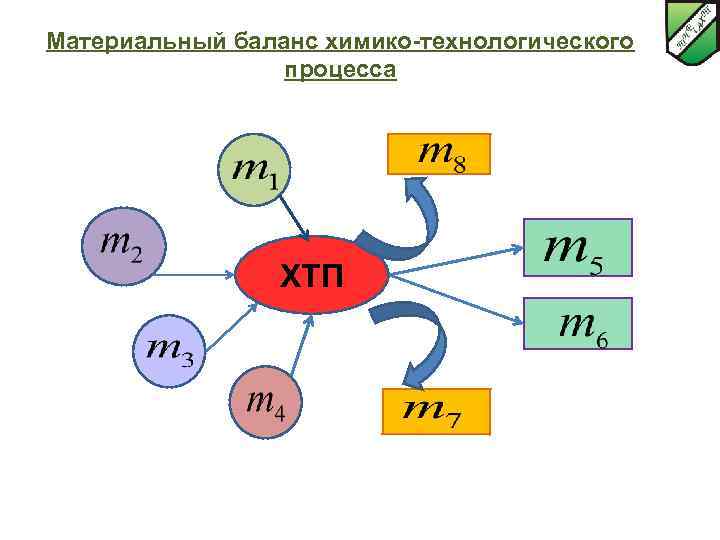
Материальный баланс химико-технологического процесса ХТП

Материальный баланс химико-технологического процесса Материальный баланс – это вещественное выражение закона сохранения массы вещества: во всякой замкнутой системе масса веществ, вступивших во взаимодействие равна массе веществ, оставшихся в результате взаимодействия. Для ХТС это значит, что масса веществ, поступивших на технологическую операцию (приход), равна массе веществ, покидающих технологическую операцию (расход) Материальный баланс может быть представлен уравнением, левую часть которого составляет масса всех видов сырья и материалов, поступающих на переработку (Σmприх), а правую – масса получаемых продуктов плюс производственные потери (Σm расх): Σmприх = Σm расх. Уравнение материального баланса представлено в следующем виде: m 1 + m 2 + m 3 + m 4 = m 5 + m 6+ m 7 + m 8 где m 1 m 2 m 3 m 4 массы поступившего газообразного, жидкого и твердого сырья и вспомогательного материала; m 5, m 6 соответственно полученные целевой и побочный продукты; m 7 непрореагировавшее сырье; m 8 – производственные потери.
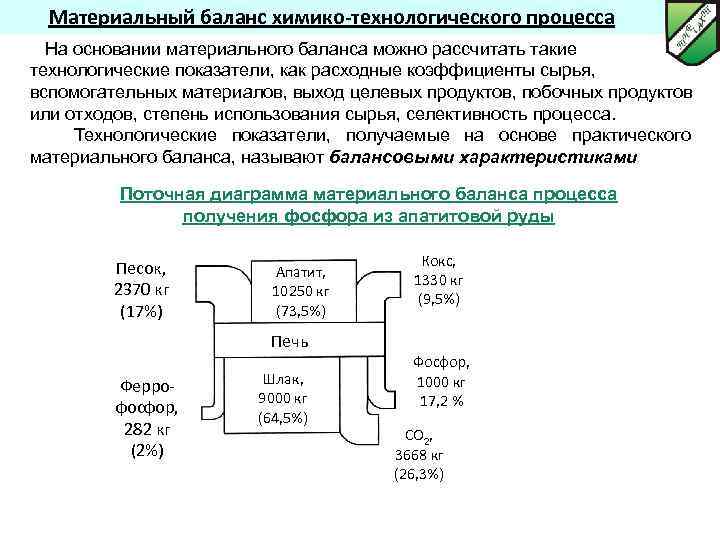
Материальный баланс химико-технологического процесса На основании материального баланса можно рассчитать такие технологические показатели, как расходные коэффициенты сырья, вспомогательных материалов, выход целевых продуктов, побочных продуктов или отходов, степень использования сырья, селективность процесса. Технологические показатели, получаемые на основе практического материального баланса, называют балансовыми характеристиками Поточная диаграмма материального баланса процесса получения фосфора из апатитовой руды Песок, 2370 кг (17%) Апатит, 10250 кг (73, 5%) Кокс, 1330 кг (9, 5%) Печь Феррофосфор, 282 кг (2%) Шлак, 9000 кг (64, 5%) Фосфор, 1000 кг 17, 2 % СО 2, 3668 кг (26, 3%)
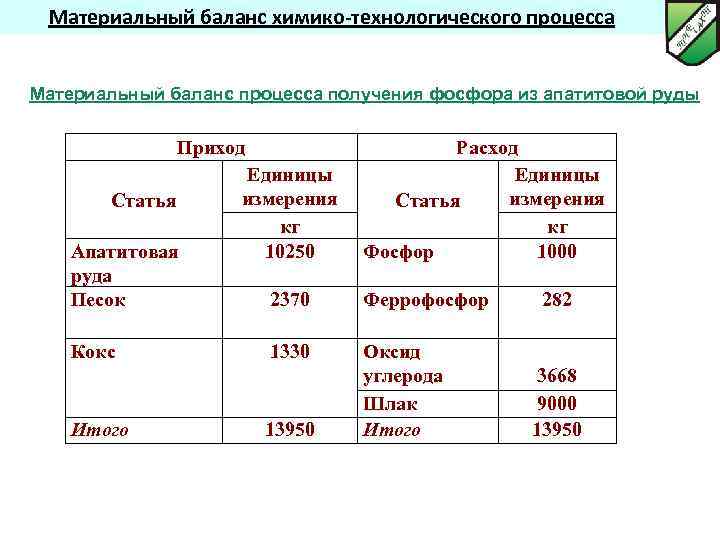
Материальный баланс химико-технологического процесса Материальный баланс процесса получения фосфора из апатитовой руды Приход Статья Апатитовая руда Песок Кокс Итого Единицы измерения кг 10250 Расход Единицы измерения Статья кг Фосфор 1000 2370 Феррофосфор 1330 Оксид углерода Шлак Итого 13950 282 3668 9000 13950
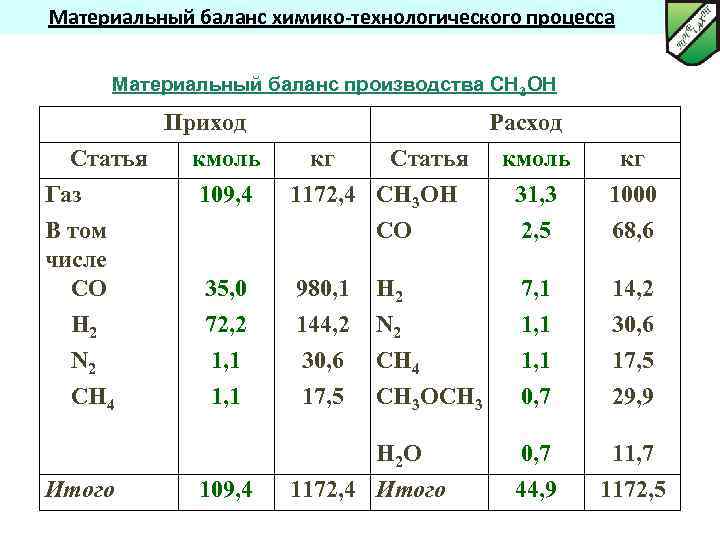
Материальный баланс химико-технологического процесса Материальный баланс производства СН 3 ОН Приход Статья Газ В том числе СО Н 2 N 2 СН 4 Итого кмоль 109, 4 Расход кг Статья 1172, 4 СН 3 ОН СО 35, 0 72, 2 1, 1 980, 1 144, 2 30, 6 17, 5 Н 2 N 2 СН 4 СН 3 ОСН 3 109, 4 Н 2 О 1172, 4 Итого кмоль 31, 3 2, 5 кг 1000 68, 6 7, 1 1, 1 0, 7 14, 2 30, 6 17, 5 29, 9 0, 7 44, 9 11, 7 1172, 5

Энергетические ресурсы Современная химическая промышленность является одним из крупнейших потребителей топлива и электроэнергии. Структура потребления энергии характеризуется следующими данными, %: тепловая (пар и горячая вода) – 50; электрическая – 40; топливо прямого использования – 10% Тепловые процессы подразделяют на высокотемпературные (более 500 С), среднетемпературные (150– 500 С), низкотемпературные (50– 150 С) и криогенные (менее – 153 С). Энергетические ресурсы разделяют на топливные и нетопливные, возобновляемые и невозобновляемые, первичные и вторичные.

Энергетический баланс химико-технологического процесса Энергетический баланс основан на законе превращения и сохранения энергии, в соответствии с которым сумма всех энергий в замкнутой системе постоянна. Многообразие форм существования и передачи характерно для энергии. Энергия делится на три вида: внутренняя энергия, работа, внешняя энергия. С учетом этого выразим закон сохранения и превращения энергии: Где U – внутренняя энергия, А – работа, Е – внешний поток энергии
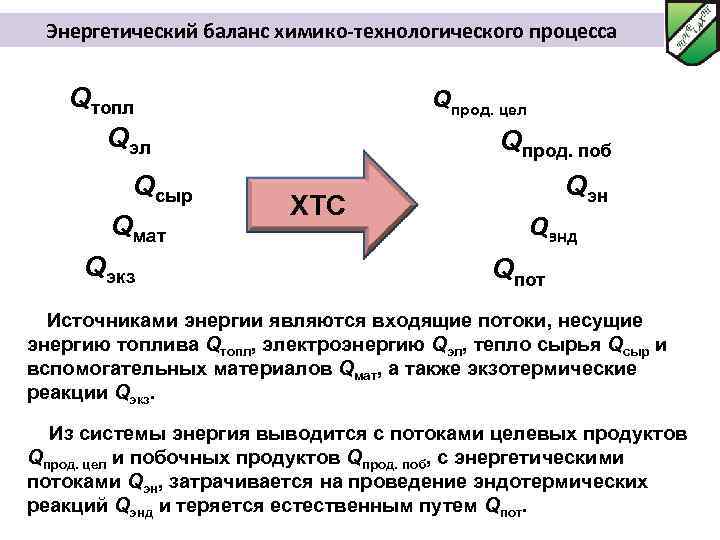
Энергетический баланс химико-технологического процесса Qтопл Qэл Qсыр Qмат Qэкз Qпрод. цел Qпрод. поб ХТС Qэнд Qпот Источниками энергии являются входящие потоки, несущие энергию топлива Qтопл, электроэнергию Qэл, тепло сырья Qсыр и вспомогательных материалов Qмат, а также экзотермические реакции Qэкз. Из системы энергия выводится с потоками целевых продуктов Qпрод. цел и побочных продуктов Qпрод. поб, с энергетическими потоками Qэн, затрачивается на проведение эндотермических реакций Qэнд и теряется естественным путем Qпот.

Энергетический баланс химико-технологического процесса Энергетическую эффективность ХТС характеризуют тепловым коэффициентом полезного действия – тепловым КПД В химической промышленности часто пользуются названием тепловой баланс. Этот термин не эквивалентен энергетическому балансу, т. к. тепловой энергией не учитывается работа, что учитывает энергетический баланс. Количество выделившейся (или поглощенной) теплоты при протекании химической реакции зависит от степени превращения исходного реагента (х. А) и значения теплового эффекта (изменения энтальпии): Qх. р = Q х. Аn. А, где n. А – химическое количество исходного реагента, моль (кмоль); Q – тепловой эффект реакции

Энергетический баланс химико-технологического процесса уравнение теплового баланса будет иметь следующие составляющие: Q = n С (Т – Т ), исх А р(м) А А 0 Qх. р = QТ x. Аn. А, Или Qх. р = QТx. Аn. А, Qпрод = n. RСр(м)R(ТR – Т 0), где n. А, n. R – химическое количество входящих реагентов и выходящих продуктов, моль или кмоль; ТА, ТR – температуры реагентов и продуктов соответственно, К; Т 0 – температура начала отcчета энтальпии, 298 К; Q , QТ – тепловой эффект реакции при стандартной температуре и температуре в зоне реакции соответственно, к. Дж

Энергетический баланс химико-технологического процесса при составлении тепловых балансов могут вноситься следующие упрощения: ü изменение Т мало отражается на величине Q. Это обусловлено возрастанием энтальпии всех реагентов с нагреванием. ü Допущение Q const означает также малое влияние температуры на разность теплоемкостей исходной и прореагировавшей реакционных смесей; ü средние значения Q и Ср (удельной теплоемкости) в рабочем температурном интервале остаются практически неизменными. уравнение теплового баланса с учетом принятых допущений, можно записать в следующем виде: mисх Ср исх(Т 1 – Т 0) + Qх. р = mпрод Ср прод(Т 2 – Т 0), mисх Ср исх. Т 1 – mисх Ср исх. Т 0 + Qх. р = mпрод Ср прод. Т 2 – mпрод Ср прод Т 0

Энергетический баланс химико-технологического процесса Для фазовых превращений (испарение, конденсация, плавление, сублимация, растворение) количество выделяющегося (поглощенного) тепла рассчитывается следующим образом: Qф. пр = где ni – химическое количество i - го компонента, изменившего свое фазовое состояние; qф. пр – удельная теплота фазового превращения. Тепловые потери вычисляются по известным формулам, в которые входит коэффициент теплопередачи, поверхность теплообмена и разность температур в реакционной и окружающей средах. Подвод теплоты в аппарат Qп можно учитывать, исходя из потери количества теплоты теплоносителем, например греющей водой (mв. Св): или по формуле теплопередачи через греющую стенку Q = k F(Tг – Tx) , п т где kт – коэффициент теплопередачи; F – поверхность теплообмена; Tг, Tx – средняя температура греющего агента (воды, пара и т. п. ) и нагреваемого (холодного) вещества в аппарате соответственно; – время.

Энергетический баланс химико-технологического процесса Для паров значения энтальпии при различных температурах и давлениях приводятся в справочниках. Значение энтальпии перегретого пара при заданном давлении складывается из нескольких составляющих I = сж tкип + qисп + сп (t – tкип) где сж – массовая теплоемкость жидкости, к. Дж/(кг ∙ К); tкип – температура кипения жидкости при данном давлении, ºС; qисп – теплота испарения жидкости при температуре tкип, к. Дж/кг; сп – теплоемкость перегретого пара, к. Дж/(кг ∙ К); t – температура пара, ºС. Поэтому, если в тепловом балансе используется значение энтальпии пара, при расчете тепла смеси газов пар не учитывается. Тепловой баланс в общем случае рассчитывают по данным материального баланса с учетом тепловых эффектов (экзотермических и эндотермических) химических реакций и физических превращений (испарение, конденсация и др. ), происходящих в аппарате, с учетом подвода теплоты извне и отвода ее с продуктами реакции, а также через стенки аппарата.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химические процессы (ХП) и их роль в структуре химического производства. Химический процесс – система взаимосвязанных явлений, поэтому в основе классификации лежат различные признаки. В химическом процессе происходят химическая реакция (одна или несколько) и явления переноса между фазами, обеспечивающие перемещение реагентов к месту их взаимодействия. В основе классификации лежит природа протекающих явлений: физикохимических, характеризующих протекающую реакцию, и физических, характеризующих фазовый состав среды с реагентами. Классификация химических процессов А. Физико-химические признаки Тип химической реакции: • прямое химическое взаимодействие • с химическим воздействием (каталитическая реакция) • с физическим воздействием (Эл. ток, излучение различной природы, механическое воздействие пример: электро, фото-, радиационно-, механохимические реакции

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химические процессы (ХП) и их роль в структуре химического производства. Термодинамические характеристики: • тепловой эффект: экзотермический процесс эндотермический процесс • обратимость: необратимая реакция Кинетические характеристики: • схема превращения простая реакция сложная реакция: параллельная схема последовательная схема включающая обе схемы • кинетическая модель: виды кинетической модели

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химические процессы (ХП) и их роль в структуре химического производства. Б. Физические признаки Фазовый состав реагентов: • число участвующих фаз с реагентами: однофазный (гомогенный) процесс многофазный (гетерогенный) процесс • состояние фаз: газ жидкость твердое

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Термодинамические расчеты химико-технологических процессов Термодинамическими называются характеристики процессов, связанные с передачей энергии в форме теплоты и работы при осуществлении последних и учетом состояний равновесности в ХТП. Их подразделяют на энергетические и статические характеристики ХТП соответственно. Статические характеристики, необходимы для анализа направленности, т. е. обратимости и необратимости процессов. Термодинамической мерой направленности протекания процесса является энергия Гиббса. Свободная энергия Гиббса (энергия Гиббса, потенциал Гиббса, или термодинамический потенциал в узком смысле) — это термодинамический потенциал следующего вида: G=U+PV-TS

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Термодинамические расчеты химико-технологических процессов В химических процессах одновременно действуют два противоположных фактора — энтропийный (TΔS) и энтальпийный (ΔH). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (G): G = H -T S Из этого выражения следует, что H= G+T S то есть некоторое количество теплоты расходуется на увеличение энтропии (TΔS), эта часть энергии потеряна для совершения полезной работы, её часто называют связанной энергией. Другая часть теплоты (ΔG) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Термодинамические расчеты химико-технологических процессов Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При ΔG < 0 процесс может протекать, при ΔG > 0 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же ΔG = 0, то система находится в состоянии термодинамического равновесия.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Термодинамические расчеты химико-технологических процессов Температура потоков в элементах ХТС изменяется за счет внутренних источников, одним из которых являются химические превращения. Количество теплоты, которое выделяется или поглощается в результате реакции, вычисляется из термохимического уравнения представляющего собой стехиометрическое уравнение с указанием его теплового эффекта: а. А + b. B + … = r. R + s. S + … + Q( Н) где Q – тепловой эффект реакции; Н энтальпия реакции. Тепловой эффект Q и энтальпия Н реакции равны, но противоположны по знаку (Q = Н). Значение Qр зависит от записи химического уравнения, поэтому в справочниках тепловой эффект приводится прямо в уравнениях или указывается изменение энтальпии в расчете на 1 моль превратившегося вещества.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Термодинамические расчеты химико-технологических процессов По энергетическим характеристикам процессы делятся на экзотермические и эндотермические. Экзотермические процессы – процессы, идущие с выделением энергии, эндотермические процессы – процессы, идущие с поглощением энергии. Экзотермические процессы сопровождаются повышением температуры, а эндотермические – с понижением температуры. Энергетической характеристикой химического процесса является энтальпия: ΔH 0298<0 – экзотермический процесс ΔH 0298>0 – эндотермический процесс Тепловые эффекты процесса влияют на энергозатраты производства

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Термодинамические расчеты химико-технологических процессов Зависимость энергии Гиббса от состава реакционной смеси отражает уравнение Вант-Гоффа: ΔGP, T = Соотношение, связывающее изменение свободной энергии Гиббса в ходе химической реакции с её константой равновесия : G= -RT ln. K Любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как где — константа скорости прямой реакции, — константа скорости обратной реакции.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Термодинамические расчеты химико-технологических процессов Зависимость энергии Гиббса от состава реакционной смеси отражает уравнение Вант-Гоффа: ΔGP, T= Данное уравнение позволяет определить возможность использования процесса для получения продукта, что необходимо при разработке нового процесса или способа производства. Другое применение данного уравнения – определение условий, предотвращающих протекание побочных реакций.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причем скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. В состоянии равновесия скорости прямой и обратной реакции становятся равными. А + В ⇄ С + D Соотношение, связывающее изменение свободной энергии Гиббса в ходе химической реакции с её константой равновесия : G= -RT ln. K

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Устойчивое термодинамическое равновесие характеризуется общими условиями: 1. Неизменность равновесия – состояние системы во времени при постоянных внешних условиях; 2. Подвижность равновесия, т. е. самопроизвольное восстановление состояния равновесия после снятия внешнего воздействия, вызвавшего отклонение системы от положения равновесия; 3. Динамический характер равновесия, который вытекает из равенства скоростей прямого и обратного процессов; 4. Возможноcть подхода к состоянию равновесия с двух противоположных сторон; 5. Минимальное значение энергии Гиббса ΔG в изобарных, изотермических процессах и энергии Гельмгольца ΔF в изохорных изотермических процессах.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Одним из способов доказательства равновесия является достижимость одинакового состава системы (концентраций компонентов) при движении с двух сторон. Пример: С KCl + H 2 O, t=250 C, растворение КСl в воде. С* τ Если взять достаточное количество соли, например, 50 г и 100 г воды, и вести процесс растворения в термостате при 250 С, то с течением времени концентрация соли будет возрастать и достигает предельного значения С* (кривая 1) 26, 45%. Если же нагреем указанную смесь, первоначально до 800 С, то вся соль раствориться, и если ее теперь поместим в термостат при 250 С, то будет происходить кристаллизация соли и ее концентрация будет уменьшаться (кривая 2), но лишь до величины 26, 45%.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Конста нта равнове сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению: ai — активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов); νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным); Ka — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Пример: для стандартной реакции константа химического равновесия определяется по формуле Константа равновесия определяет глубину протекания процесса в момент достижения состояния равновесия. Чем больше эта константа, значит, тем полнее произошло взаимодействие веществ. Константа химического равновесия зависит от природы реагентов и от температуры и не зависит от давления (при не очень высоких давлениях) и от концентраций реагентов и продуктов реакции (в разбавленных растворах), а также от наличия или отсутствия примесей в небольших количествах. Константа равновесия связана с энергией Гиббса реакции термодинамическим соотношением ΔG°T = –RTln. K.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные компонентов pi по формуле: парциальные давления где νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным). Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры Например, для реакции окисления монооксида углерода: 2 CO + O 2 = 2 CO 2 константа равновесия может быть рассчитана по уравнению:

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие В некоторых случаях (в зависимости от способа выражения) константа равновесия может являться функцией не только температуры, но и давления. Так, для реакции в смеси идеальных газов парциальное давление компонента может быть выражено по закону Дальтона через суммарное давление и мольную долю компонента тогда легко показать, что: где Δn — изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ (Δn = 0), то Kp = Kx.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Константа равновесия реакций в гетерогенных системах Для гетерогенной химической реакции, например, между компонентами реального газа и реального раствора, константа равновесия в общем случае может быть выражена уравнением: где fi — фугитивность компонентов газовой фазы, а ak — активность компонентов конденсированной фазы. Если конденсированные фазы (твёрдые или жидкие) представляют собой практически чистые вещества, их активности постоянны и могут быть включены в константу равновесия (то есть в левую часть выражения выше). Условно можно принять их равными единице и, таким образом, исключить из выражения. Например, для реакции твёрдофазного восстановления оксида железа: Fe. Oт + COг = Feт + CO 2 г константа равновесия (при условии, что газовая фаза идеальна) имеет вид:

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Если реакционная смесь идеальна (небольшие температура и давление, разбавленные растворы), то пользуясь справочными значениями , ΔH°, Δ S° можно рассчитать по уравнению Δ GT° = Δ H° - T Δ S° = -RT ln K. Если неидеальна, то используется более сложная расчетная зависимость - предэкспненциальный множитель, = 0, 101 МПа или 1 атм - нормальное давление.
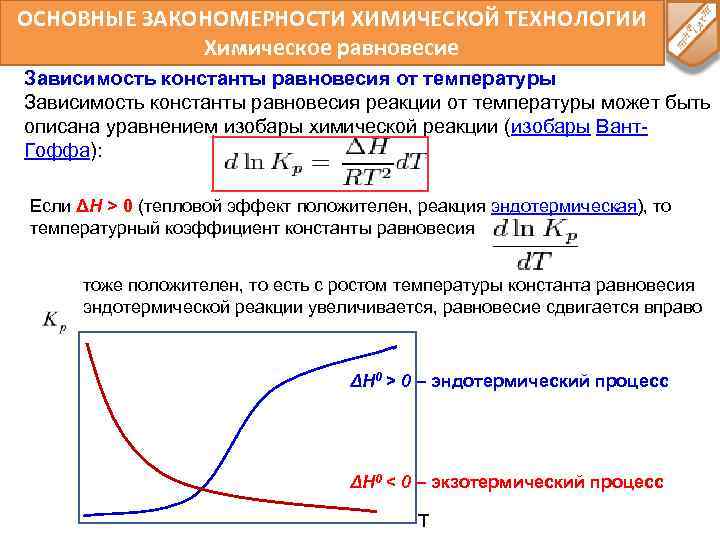
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Зависимость константы равновесия от температуры Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант. Гоффа): Если ΔH > 0 (тепловой эффект положителен, реакция эндотермическая), то температурный коэффициент константы равновесия тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо ΔH 0 > 0 – эндотермический процесс ΔH 0 < 0 – экзотермический процесс T

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Расчет равновесного состава реакционной смеси Концентрации всех реагентов в смеси связаны между собой стехиометрическим уравнением, и их можно определить через исходный состав и степень превращения ключевого компонента x. В состоянии равновесия системы достигается равновесная степень превращения xр, следовательно Кр = f(xр) Определив из данной зависимости xр, далее могут быть расститаны равновесные концентрации всех компонентов системы. Пример: Простая обратимая реакция: A = R. Исходная концентрация компонента А = СА 0, для компонента R = СА 0 = 0. В равновесной смеси СА равн = СА 0(1 – xр) и СR равн = СА 0 * xр. и
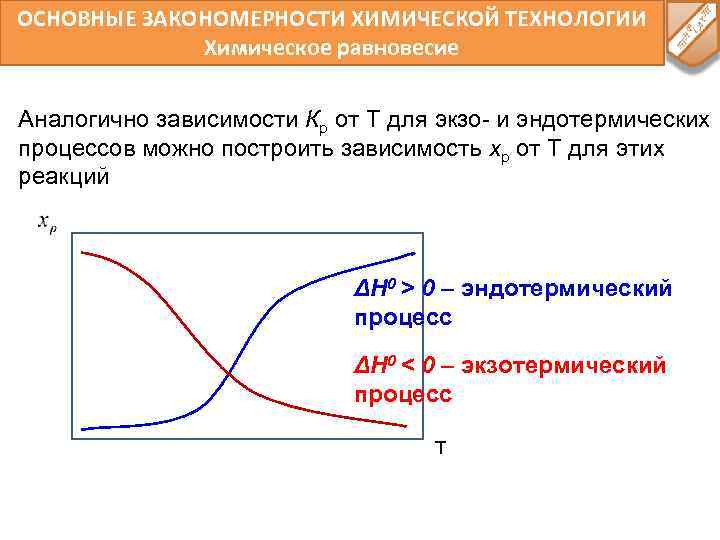
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Аналогично зависимости Кр от Т для экзо- и эндотермических процессов можно построить зависимость xр от Т для этих реакций ΔH 0 > 0 – эндотермический процесс ΔH 0 < 0 – экзотермический процесс T

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Принцип Ле Шателье. Влияние изменения внешних условий на положение равновесия определяется правилом, которое получило название принципа Ле Шателье (1884 г. ), или принципа подвижного равновесия: если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении. Система перейдет из одного состояния равновесия в другое, отвечающее новым условиям. Это связано с тем, что внешнее воздействие в разной степени изменяет скорость двух взаимно противоположных процессов. Принцип Ле Шателье справедлив и для равновесных систем, не связанных с химическими превращениями (кипение, кристаллизация, растворение и т. д. ).

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Факторы влияющие на химическое равновесие: ü Температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. Повышение температуры вызывает возрастание константы равновесия эндотермического процесса. Понижение температуры приводит к противоположному результату: равновесие смещается в направлении того процесса, протекание которого сопровождается выделением теплоты, иначе говоря, охлаждение благоприятствует экзотермическому процессу и вызывает увеличение константы его равновесия. Из термодинамики известно:

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Если реакция характеризуется эндотермическим эффектом, то ΔН 0 Т>0, следовательно, а это означает, что с увеличением температуры возрастает константа равновесия К 0 р, Т и как следствие повышение температуры при осуществлении эндотермической реакции приводит к возрастанию концентрации продуктов реакции. Экзотермический процесс характеризуется условием ΔН 0 Т<0, следовательно, и тогда с увеличением температуры К 0 р, Т уменьшается и вследствие этого уменьшаются концентрации продуктов реакции.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Примером реакции, равновесие которой при нагревании смещается вправо, является разложение карбоната кальция: Са. СО 3 =Са. О + СO 2; ΔH° 298 = 178 к. Дж Наоборот, равновесие 2 NO = N 2 + O 2; Δ H° 298 = -181 к. Дж при повышении температуры смещается влево.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие ü давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т. е. если в реакции участвуют твердые вещества, то они в расчет не берутся. Давление на Кр не влияет, но влияет на КN. где ν∑ - суммарный стехиометрический коэффициент реакции, вычисленной по газообразным участникам реакции и равен изменению числа моль и, соответственно, объема реакционной смеси протекании реакции; Робщ – общее относительное давление в зоне реакции. Если ν∑= Δn >0 (реакция идет с увеличением числа газовых молей, т. е. объем возрастает) и, следовательно, КN уменьшается. Это означает, что повышение давления смещает равновесие данной реакции влево, в сторону реагентов. Если Δn<0, объем уменьшается и увеличивается КN.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Для определения степени смещения равновесия необходимо знать абсолютную величину ΔV. Так, если на реакции: N 2 + 3 Н 2 =2 NH 3; СО + 2 Н 2 =СН 3 ОН повышение давления влияет почти одинаково (Δ V = – 2 моль), то для реакции 2 SO 2 + O 2 =2 SO 3 его действие менее эффективно (Δ V = – 1 моль).

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие ü концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции в сторону исходных веществ. Во многих случаях смещение химического равновесия вправо можно осуществить, удаляя продукты процесса из реакционной зоны путем связывания их в малодиссоциирующие, малорастворимые или нелетучие вещества. Так, введение в равновесную систему СН 3 ОН + СН 3 СООН = СН 3 СООСН 3 + Н 2 O водоотнимающих веществ, например H 2 SO 4, позволяет сместить реакцию вправо. При введении в равновесную систему (при р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Если течение процесса связано с уменьшением объема, то равновесие сместится влево (например, при синтезе аммиака). Наоборот, для реакций, которые сопровождаются возрастанием объема реакционной смеси, разбавление инертным газом вызывает увеличение степени протекания прямой реакции. Если же Δ V = 0, то система нечувствительна к присутствию инертного газа. Катализаторы не влияют на смещение химического равновесия!

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений В общем случае нельзя считать, что чем дальше реагенты находятся от состояния равновесия, т. е. чем отрицательнее энергия Гиббса реакции Δ G, тем быстрее будет достигнуто равновесие, т. е. между скоростью достижения равновесия и его положением нет однозначной зависимости. Так, для реакций 2 NO (г) + O 2 (г) = 2 NO 2 (г); ΔG° 298 = -70 к. Дж 2 Н 2 (г)+O 2 (г) = 2 Н 2 O (г); ΔG° 298 = -447 к. Дж энергия Гиббса меньше у второго процесса, однако первая реакция в отличие от второй протекает очень быстро при обычной температуре. Если термодинамические данные свидетельствуют о невозможности протекания реакции, т. е. если Δ G > 0, то, разумеется, бессмысленно пытаться реализовать ее при данных условиях. Но и в том случае, когда согласно расчету процесс принципиально осуществим (Δ G < 0), он может протекать не при всех условиях.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Исследованием течения реакций во времени занимается химическая кинетика. Под кинетикой в широком смысле понимают учение о скоростях различных процессов (химических реакций, растворения, кристаллизации, парообразования и т. д. ) и их механизмах, определяющих скорость процесса. Ход любой реакции можно представить схемой: Исходные реагенты → Промежуточные вещества → Продукты реакции (переходное состояние) Выявление и учет параметров переходного состояния, не требующихся для вычисления значений ΔH, Δ S, и Δ G процессов, но определяющих скорость, является чрезвычайно сложной проблемой, так как в отличие от исходных реагентов и продуктов реакции промежуточные продукты выделить и изучить зачастую затруднительно.

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Для выражения скорости реакции можно использовать и пропорциональные числу актов величины, например, скорость изменения во времени концентрации реагирующих веществ (концентрацию обычно выражают в моль/л, а время – в секундах). Так как в общем случае концентрации реагирующих веществ непрерывно изменяются, то следует рассматривать мгновенную скорость реакции v, т. е. скорость в данный момент времени t. Она выражает изменение количества n реагирующих веществ в единицу времени в единице объема V реакционного пространства: Для гомогенных реакций скорость можно выразить как изменение во времени концентрации: где с = n / V – концентрация любого реагента (так как все они связаны стехиометрическими коэффициентами).

ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Поскольку концентрация исходных веществ убывает (dc<0), а продуктов реакции возрастает (dc > 0), то при расчете скорости по изменению концентрации исходных веществ эту производную надо брать с минусом (dc<0, dt>0), а по изменению концентрации продуктов реакции – с плюсом (dc>0, dt>0). Основными параметрами, которые приходится учитывать при изучении кинетики процессов, являются концентрации (давления) реагентов, температура и действие катализатора. Влияние концентрации на скорость реакций Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит: скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Для элементарной химической реакции: закон действующих масс может быть записан в виде кинетического уравнения вида: где - скорость химической реакции, k — константа скорости реакции

2011_OKhT_Min_LK_3_balansy_opt_parametry.ppt