Масс-спектрометрия АХ.ppt
- Количество слайдов: 63

Масс-спектрометрия в аналитической химии

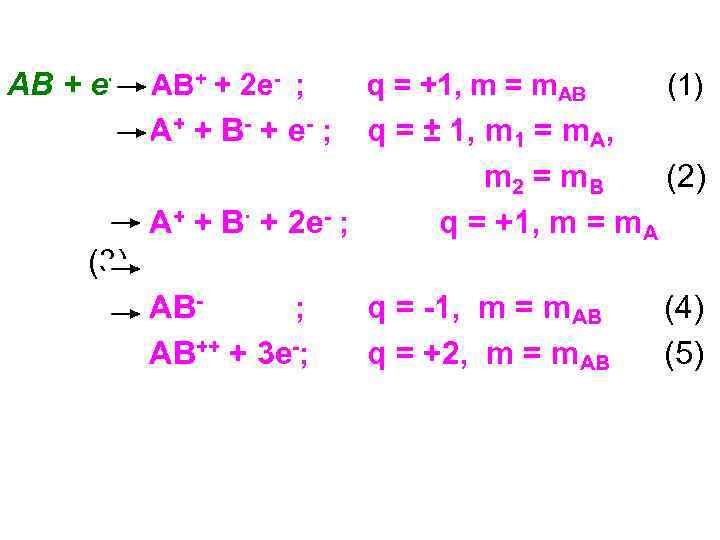
AB + e- AB+ + 2 e- ; q = +1, m = m. AB (1) A+ + B - + e - ; (3) q = ± 1, m 1 = m. A, m 2 = m. B (2) A+ + B· + 2 e- ; q = +1, m = m. A AB; AB++ + 3 e-; q = -1, m = m. AB q = +2, m = m. AB (4) (5)

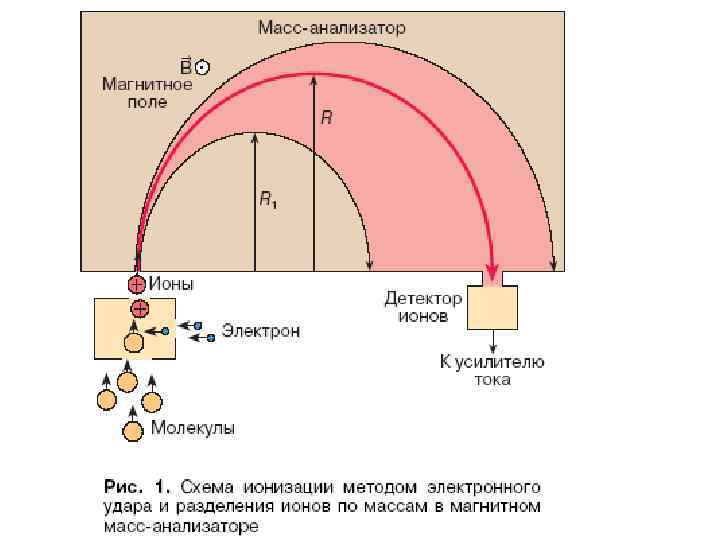
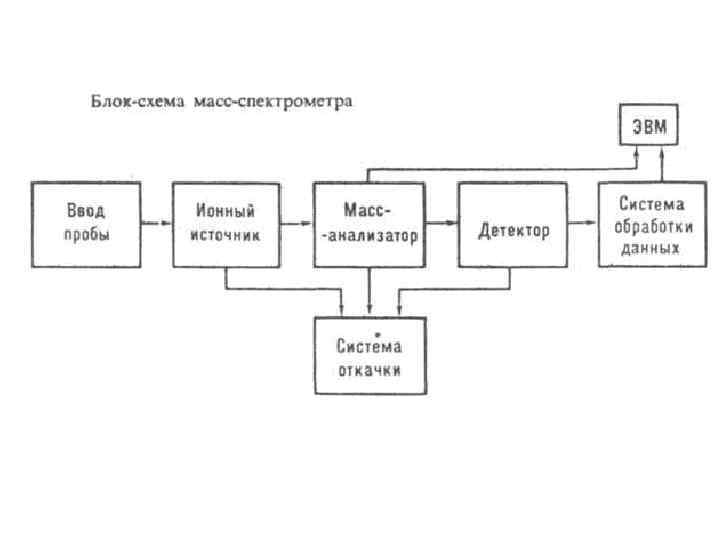
Первое, что надо сделать для того, чтобы получить масс-спектр - превратить нейтральные молекулы и атомы, составляющие любое органическое или неорганическое вещество, в заряженные частицы — ионы. Этот процесс называется ионизацией и по-разному осуществляется для органических и неорганических веществ. Вторым необходимым условием является перевод ионов в газовую фазу в вакуумной части масс спектрометра. Глубокий вакуум обеспечивает беспрепятственное движение ионов внутри массспектрометра, а при его отсутствии ионы рассеются и рекомбинируют (превратятся обратно в незаряженные частицы).

• • Условно способы ионизации органических веществ можно классифицировать по фазам, в которых находятся вещества перед ионизацией. Газовая фаза электронная ионизация (EI) химическая ионизация (CI) электронный захват (EC) ионизация в электрическом поле (FI) Жидкая фаза термоспрей ионизация при атмосферном давлении (AP) – электроспрей (APESI) – химическая ионизация при атмосферном давлении (APCI) – фотоионизация при атмосферном давлении (APPI) • Твёрдая фаза • прямая лазерная десорбция - масс-спектрометрия (LDMS) • матрично-активированная лазерная десорбция/ионизация (MALDI) • масс-спектрометрия вторичных ионов (SIMS) • бомбардировка быстрыми атомами (FAB) • десорбция в электрическом поле (FD) • плазменная десорбция (PD)

В неорганической химии для анализа элементного состава применяются жёсткие методы ионизации, так как энергии связи атомов в твёрдом теле гораздо больше и значительно более жёсткие методы необходимо использовать для того, чтобы разорвать эти связи и получить ионы: • ионизация в индуктивно-связанной плазме (ICP) • термоионизация или поверхностная ионизация • ионизация в тлеющем разряде и искровая ионизация в процессе лазерной абляции

Исторически первые методы ионизации были разработаны для газовой фазы. К сожалению, очень многие органические вещества невозможно испарить, то есть перевести в газовую фазу, без разложения. А это значит, что их нельзя ионизовать электронным ударом. Но среди таких веществ почти всё, что составляет живую ткань (белки, ДНК и т. д. ), физиологически активные вещества, полимеры, то есть всё то, что сегодня представляет особый интерес.
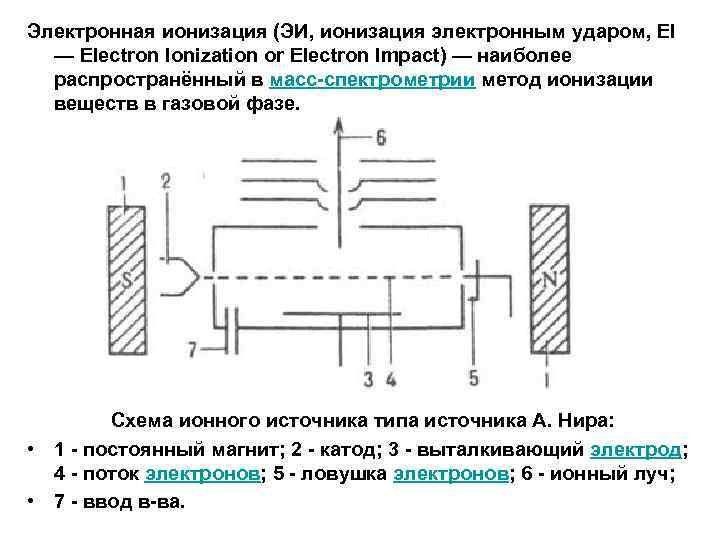
Электронная ионизация (ЭИ, ионизация электронным ударом, EI — Electron Ionization or Electron Impact) — наиболее распространённый в масс-спектрометрии метод ионизации веществ в газовой фазе. Схема ионного источника типа источника А. Нира: • 1 - постоянный магнит; 2 - катод; 3 - выталкивающий электрод; 4 - поток электронов; 5 - ловушка электронов; 6 - ионный луч; • 7 - ввод в-ва.

При электронной ионизации молекулы анализируемого вещества попадают в поток электронов движущихся от эмитирующего их катода к аноду. Энергия движущихся электронов обычно 70 э. В, что согласно формуле де Бройля соответствует длине волны около 0, 14 нм, что сравнимо со стандартной длиной химической связи в органических молекулах. Электроны вызывают ионизацию анализируемых молекул с образованием катион-радикалов: M + e- = M. + + 2 e-

Для ионизации молекул обычно используют электроны с энергиями 70 -100 э. В, к-рые движутся со скоростью ~108 см/с и проходят путь, равный диаметру молекулы орг. соед. , за 10 -16 с. Этого времени достаточно для удаления электрона из молекулы в-ва и образования молекулярного иона - положительно заряженного ион-радикала М+', имеющего энергию 2÷ 8 э. В. Ионы с минимальным запасом энергии достаточно устойчивы и достигают приемника. Ионы с большим запасом внутренней энергии распадаются на пути движения на ионы с меньшей мол. массой (т. наз. осколочные ионы), характерные для в-ва определенного строения.

Для ионизации молекул энергия электронного пучка должна превышать некрую критическую для в-ва величину, наз. потенциалом ионизации. Потенциалы ионизации лежат в пределах 3, 98 э. В (Fr) - 24, 58 э. В (Не), для большинства орг. соед. 7 -11 э. В. Используя моноэнергетич. пучки электронов и снижая их энергию до пороговых значений, можно определять потенциалы ионизации в-в и потенциалы появления ионов - критич. энергию электронов, при к-рой в спектре появляются линии соответствующих осколочных ионов.

При ионизации электронным ударом происходит перераспределение энергии возбуждения по колебат. степеням свободы мол. иона, прежде чем этот ион распадается. При взаимод. электронов c низкой энергией (менее 10 э. В) с в-вом могут осуществляться процессы резонансного захвата электронов молекулами с образованием отрицательно заряженных ионов М-.

М. С. электронного удара - высокочувствит. метод анализа, позволяет анализировать пикомольные колва в-ва, ее предпочитают для исследования структуры соединений. Существуют "библиотеки" масс-спектров, содержащие спектры более 600000 орг. соед. , по к-рым можно проводить их идентификацию с применением ЭВМ. Недостатки метода: мол. ионы образуются лишь у 20% орг. соед. ; метод применим только для определения легколетучих термически стабильных соед. ; в полном ионном токе на ионы с большими значениями m/z, дающие информацию о мол. массе и наличии функц. групп, приходится меньшая часть; отрицательно заряженные ионы, имеющие большое значение в структурном анализе, образуются в очень небольшом кол-ве и ограниченным числом орг. соединений. Некоторые вещества подвергаются очень интенсивной фрагментации, порождая только низкомолекулярные фрагменты, затрудняющие идентификацию. Для анализа таких веществ существует альтернативные методы ионизации.

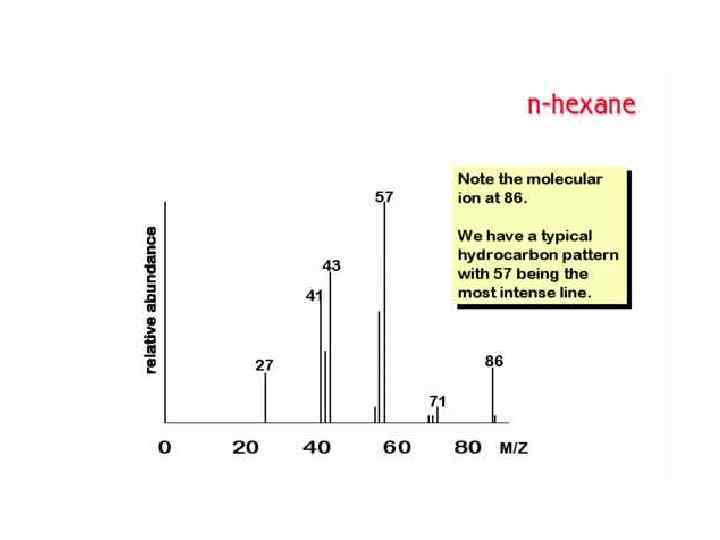
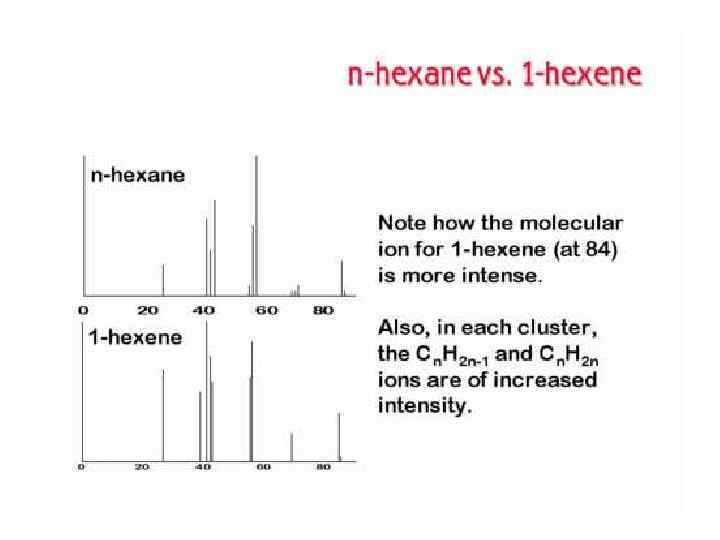
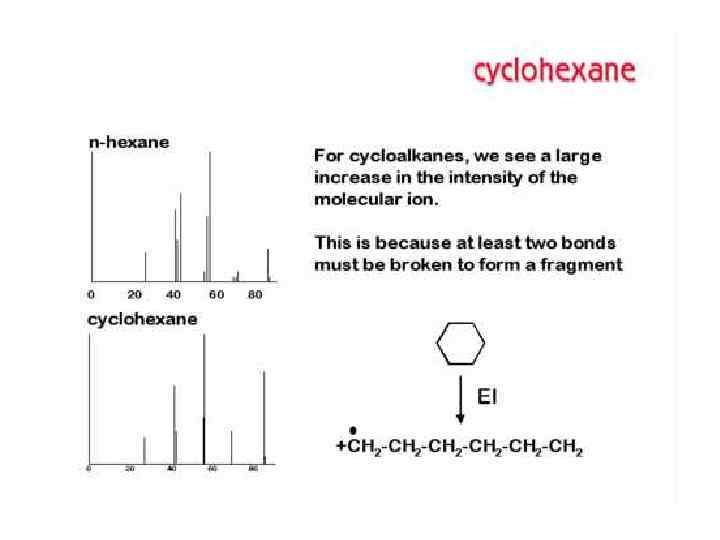
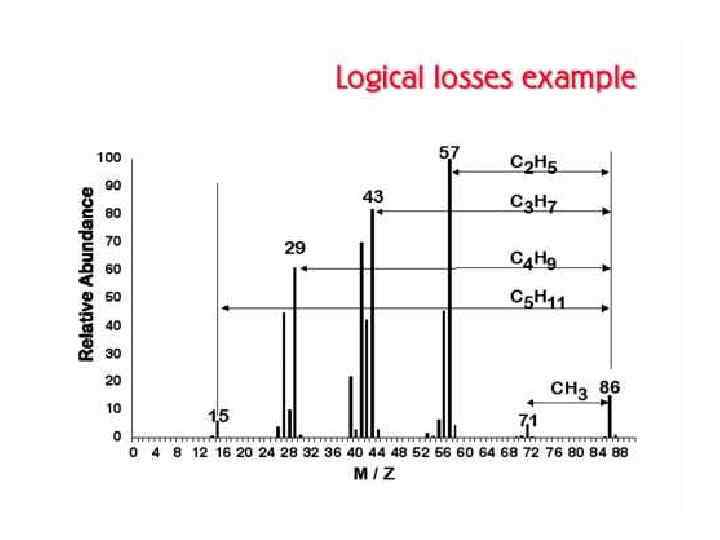
ТИПЫ ИОНОВ В МАСС-СПЕКТРАХ Молекулярные ионы М+ Ионы М+ которые имеют время жизни не менее 10 -5 с, регистрируются в масс-спектре. Массовое число М+ равно молекулярной массе соединения. Интенсивность пиков ионов зависит от стабильности М+ и варьирует в широких пределах. Наибольшей стабильностью обладают М+ соединений, имеющих сопряженные π-электронные системы. Если пик М+ отсутствует в спектре, снятом при 70 э. В, его обычно не удается зафиксировать и в спектре, снятом при более низких значениях ионизирующего напряжения. В этом случае определить молекулярную массу иногда можно и в результате частичной интерпретации массспектра в области высоких массовых чисел.

Массовое число пика М+ в масс-спектрах низкого и среднего разрешения имеет целочисленное значение, поэтому оно дает возможность определить лишь молекулярную массу соединения в расчете на наиболее распространенные изотопы входящих в молекулу элементов. Применяя масс-спектрометрию высокого разрешения, массовое число М+, равно как и осколочных ионов, можно определять с точностью до 0, 001 а. е. м. и выше, что позволяет устанавливать элементный состав этих ионов.
![В масс-спектрах органических соединений наблюдаются также пики ионов [М+1]+ и [М+2]+, хотя и значительно В масс-спектрах органических соединений наблюдаются также пики ионов [М+1]+ и [М+2]+, хотя и значительно](https://present5.com/presentation/42092798_44540483/image-18.jpg)
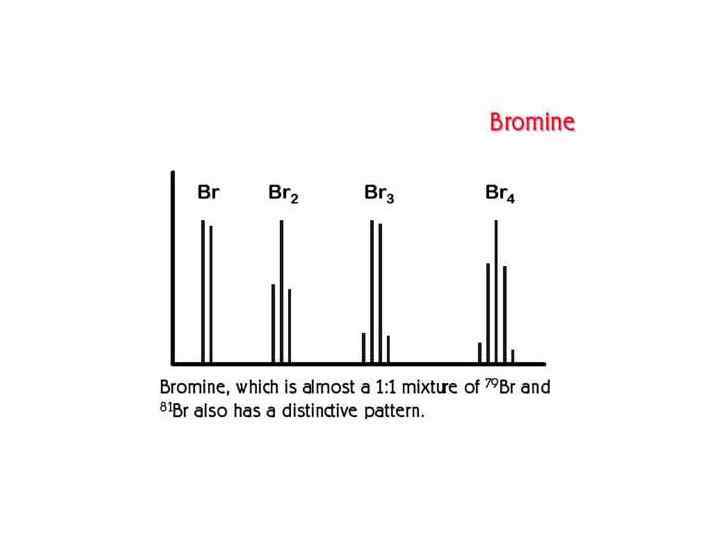
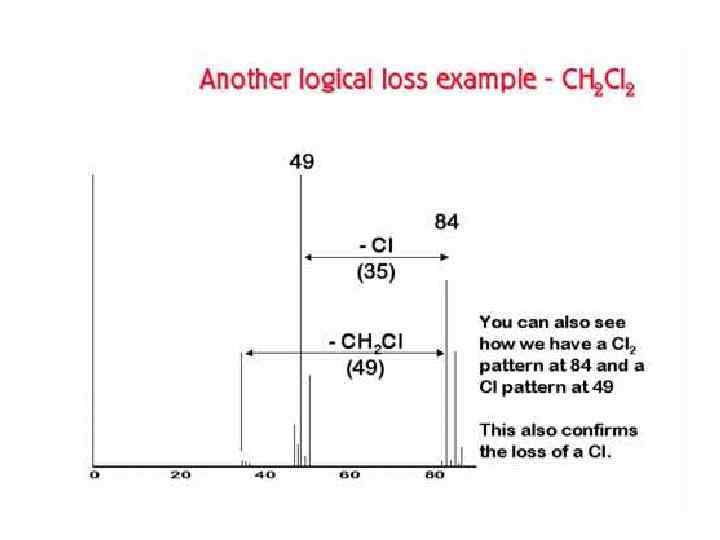
В масс-спектрах органических соединений наблюдаются также пики ионов [М+1]+ и [М+2]+, хотя и значительно менее интенсивные. Однако и их интенсивность в сравнении с интенсивностью пиков М+ отражает элементный состав вещества. В спектрах серо- и кремнийсодержащих соединений интенсивность пиков [М+2]+ приближается к интенсивности пиков [М+1]+, так как S и Si имеют заметную распространенность более тяжелых изотопов 34 S и 30 Si (табл. )
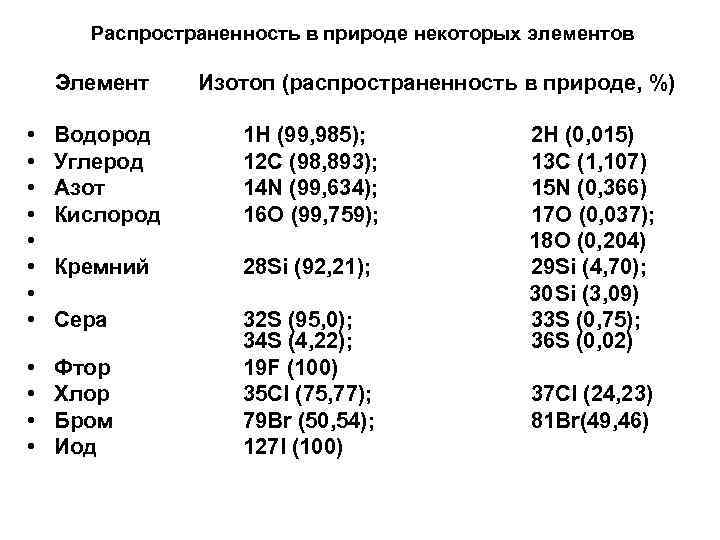
Распространенность в природе некоторых элементов Элемент Изотоп (распространенность в природе, %) • • Водород Углерод Азот Кислород 1 Н (99, 985); 12 С (98, 893); 14 N (99, 634); 16 О (99, 759); Кремний 28 Si (92, 21); Сера • • Фтор Хлор Бром Иод 32 S (95, 0); 34 S (4, 22); 19 F (100) 35 Cl (75, 77); 79 Br (50, 54); 127 I (100) 2 Н (0, 015) 13 С (1, 107) 15 N (0, 366) 17 О (0, 037); 18 О (0, 204) 29 Si (4, 70); 30 Si (3, 09) 33 S (0, 75); 36 S (0, 02) 37 Cl (24, 23) 81 Br(49, 46)
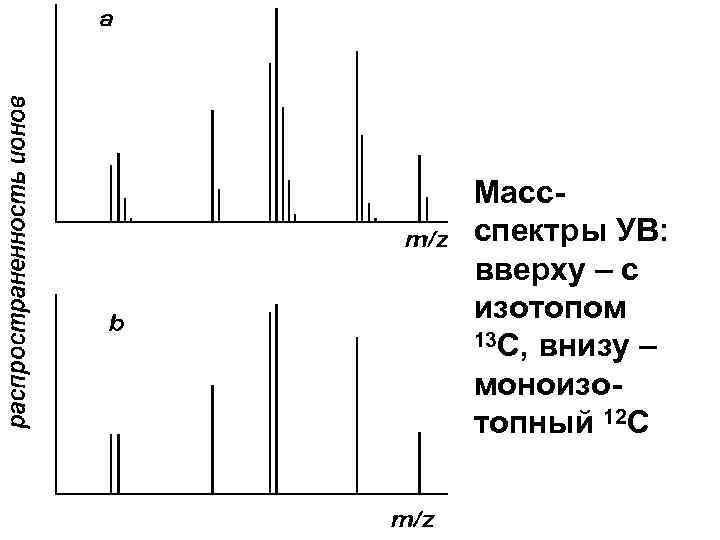
• Массспектры УВ: вверху – с изотопом 13 С, внизу – моноизотопный 12 С

Точная молекулярная формула включает в себя сумму общего числа колец и двойных (кратных) связей. В соединении C w H x. N y. O z R – число колец и двойных связей равно R = (2 w-x+y+2)/2 Примеры: бензол – R= 4, и каждое бензольное кольцо в молекуле увеличивает его на 4: трифенил – R = 12.

Гомологи – разница в количестве атомов углерода в алкильных цепях не изменяет R. Антрацен и метаноантрацен (R = 10 и 11 соответственно). Присутствие кислорода не изменяет значения R. Если R является целым, структура иона позволяет рассматривать его как потенциально молекулярный.

Азотное правило: Соединения, содержащие нечетное число атомов азота в молекуле, имеют нечетную молекулярную массу.

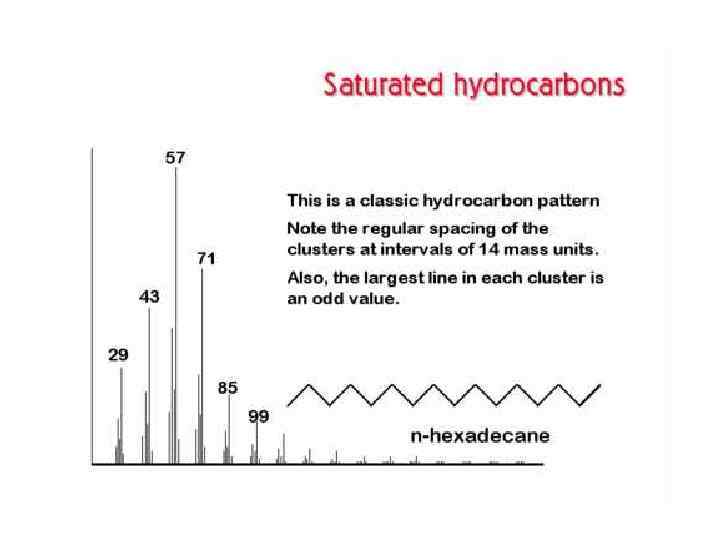
Изотопные пики в масс-спектрах В соединении Cw. Hx. Ny. Oz в отсутствие тяжелых изотопов молекулярная масса равна M = 12 w+x+14 y+16 z Молекулы с массами М+1, М+2, … будут содержать один или более тяжелых изотопов. Пики, соответствующие таким ионам, называют первым, вторым и т. д. изотопными пиками.


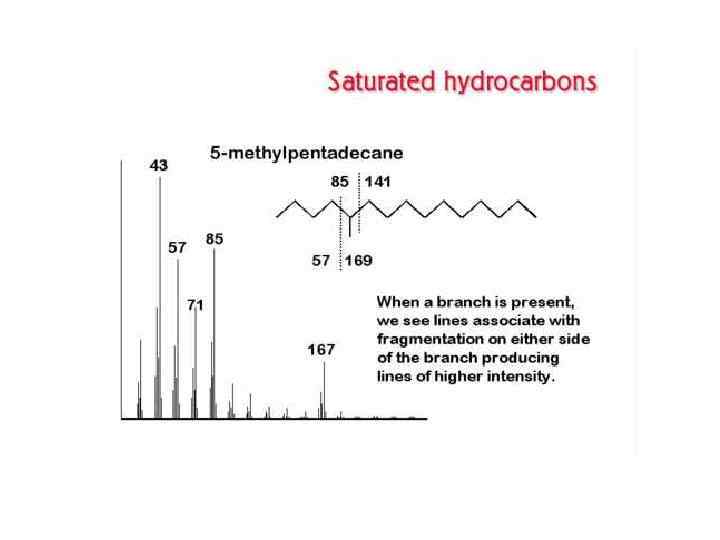

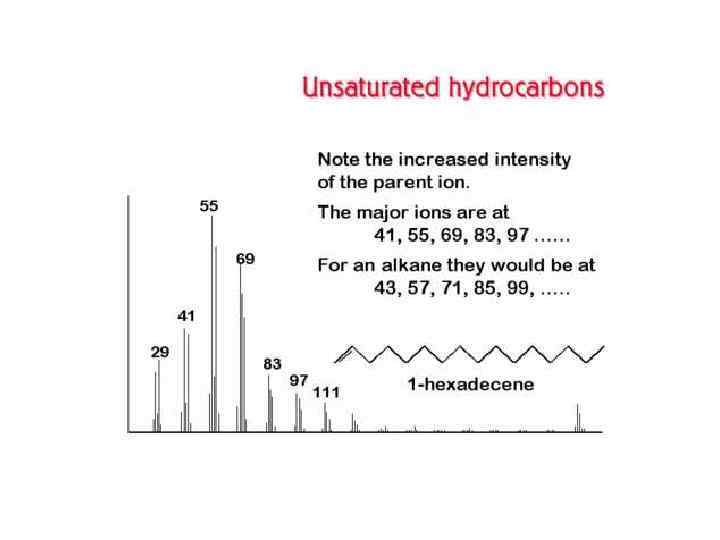
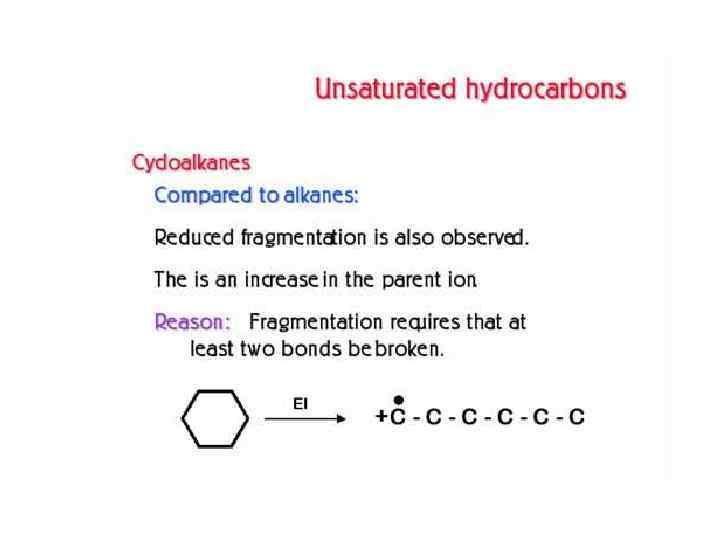
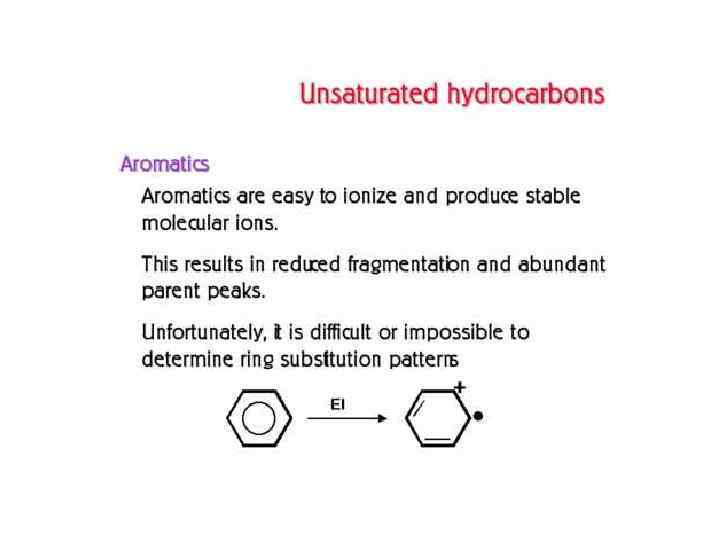



СОЕДИНЕНИЕ ГАЗОВОГО ХРОМАТОГРАФА С МАСС-СПЕКТРОМЕТРОМ Соединение хроматографа с масс-спектрометром представляет сложную проблему вследствие несовместимости их рабочих условий: хроматограф работает при давлении атмосферном или выше атмосферного, а масс-спектрометр — в высоком вакууме. Поэтому вначале объединение этих методов выглядело так: каждый компонент на выходе хроматографической колонки улавливали, переносили в систему напуска масс-спектрометра и получали его масс-спектр.

Однако такой метод имел большие неудобства. Не говоря уже о трудоемкости и длительности улавливания и переноса, скажем, 100 или 200 компонентов, практически невозможно выделить их все в чистом виде и предохранить от возможных загрязнений и изменений вследствие гидролиза, окисления или какого-либо другого вида разложения до получения масс-спектра. Поэтому хромато-масс-спектрометрия в современном варианте заключается в непосредственном соединении двух приборов – масс-спектрометра и хроматографа.

Соединение газового или жидкостного хроматографа и масс-спектрометра накладывает определенные ограничения на условия работы этих приборов. Масс-спектрометр должен работать в условиях вакуума: анализатор — 10 -5— 10 -7 Па, источник ионов при ЭУ ионизации — 10 -3— 10 -4 Па, при ХИ — 0, 1— 100 Па. Поступление в ионный источник большой массы газа из хроматографической колонки требует дифференциальной откачки источника и анализатора. Динамический диапазон масс-спектрометра должен быть достаточно велик, чтобы можно было регистрировать сигналы разной интенсивности, он должен охватывать около 6 порядков величины сигнала. Это означает, что максимальный ионный ток, который может быть зарегистрирован детектором до насыщения, в 106 раз больше, чем минимальный ионный ток, который может быть измерен выше уровня шумов.

Неподвижная фаза должна обладать достаточной термической стабильностью, т. е. испарение и разложение, при которых могут выделяться летучие продукты, должны быть сведены к минимуму. Это необходимо для получения стабильной базовой линии и малоинтенсивного фонового масс-спектра. Последнее особенно важно при анализе следовых компонентов. Кроме того, испарение или разложение неподвижной фазы приводит к загрязнению ионного источника и масс-анализатора, к потере чyвcтвитeльнocти и разрешающей способности масс-спектрометра.
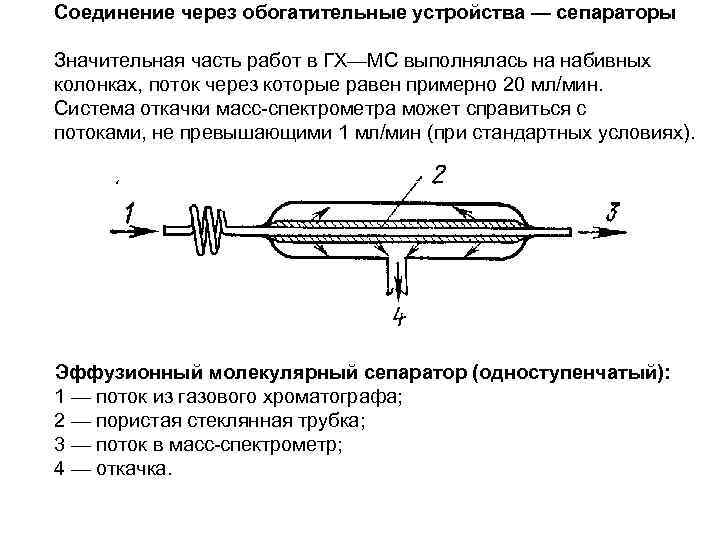
Соединение через обогатительные устройства — сепараторы Значительная часть работ в ГХ—МС выполнялась на набивных колонках, поток через которые равен примерно 20 мл/мин. Система откачки масс-спектрометра может справиться с потоками, не превышающими 1 мл/мин (при стандартных условиях). Эффузионный молекулярный сепаратор (одноступенчатый): 1 — поток из газового хроматографа; 2 — пористая стеклянная трубка; 3 — поток в масс-спектрометр; 4 — откачка.

ИОННАЯ МАСС-ХРОМАТОГРАФИЯ Ионная масс-хроматография (ИМХ) представляет собой метод, в котором масс-спектрометр используют для непрерывного селективного детектирования одного или нескольких ионов с заданными массами. Если известен один или несколько характеристических ионов, специфичных для данного соединения или группы родственных соединений, то селективное ионное детектирование позволяет выделить хроматограмму этих соединений из общей хроматограммы, определить время удерживания каждого компонента, идентифицировать его и провести количественный анализ. Этот метод особенно эффективен для сложных смесей и может дать хорошие результаты даже тогда, когда компоненты не разделяются полностью на хроматографической колонке.

Ионная масс-хроматография осуществляется двумя способами. Первый способ состоит в том, что из всех ионов, образующихся в ионном источнике, на детектор поступают только ионы с одной или несколькими заданными массами. Этот метод получил название селективного ионного детектирования (СИД), а в случае одновременной регистрации нескольких ионов — многоионного детектирования (МИД). В литературе встречаются и другие термины для обозначения этого метода: «масс-фрагментография» , «мониторирование выбранных ионов» , «получение ионных профилей» и др.

Второй способ ИМХ реализуется с помощью ЭВМ и представляет собой специфическую машинную обработку ГХ—МС информации. Он основан на непрерывном циклическом сканировании полного масс-спектра в процессе всего опыта и построении графика интенсивности любого пика масс-спектра в зависимости от номера спектра (т. е. времени его получения). Это так называемая компьютерная ионная массхроматография. Селективное ионное детектирование обеспечивает значительно большую чувствительность по сравнению с регистрацией полных масс-спектров.

Селективное детектирование ионов при отрицательной ионизации путем захвата электронов обеспечивает получение ионных токов в 100— 1000 раз больших, чем в случае положительных ионов, и высокую чувствительность определения многих органических веществ. По теоретическим оценкам эта чувствительность в 10— 100 раз превышает чувствительность электронозахватного детектора, используемого в ГХ; на практике же она повышается только в 10 раз. Предел обнаружения таких веществ, как амфетамин, допамин и т. п. , достигает 10 -18 г

При обычном масс-спектральном анализе условно считают, что качественный анализ заключается в установлении состава двухили многокомпонентных смесей и приближенной оценке их состава. Под идентификацией можно понимать отнесение данного вещества к весьма узкому типу известных веществ. Если идентифицируемое вещество ранее не было исследовано, то возникает необходимость установления его структуры с той или иной степенью приближения.

Идентификация соединений и качественный анализ смесей являются важнейшей целью ХМС анализа. Этот метод позволяет охарактеризовать вещество, не выделяя его из смеси, часто весьма сложной. Он дает информацию о физико-химических характеристиках вещества, таких как температура кипения, полярность и т. п. (по хроматографическим данным), а также о молекулярной массе и химической структуре (по массспектральным данным). Если учесть, что этот уникальный по эффективности метод позволяет анализировать ничтожно малые количества вещества, то неудивительно, что он находит широкое применение для решения самых сложных задач качественного анализа в биохимии, химии природных соединений, охране окружающей среды и других областях.

Для качественного анализа и установления структуры смесей ХМС дает различные возможности. Во-первых, это полные масс-спектры компонентов, являющиеся как бы «отпечатками пальцев» молекулярной структуры и характеризующие молекулярную массу и массы основных структурных фрагментов, по которым можно установить их состав и наличие определенных функциональных групп. Масс-спектры высокого разрешения позволяют с большой точностью установить элементный состав молекулярного и осколочных ионов, а значит, и структуру исходной молекулы.

Во-вторых, масс-хроматограммы дают возможность определить времена удерживания (или индексы удерживания) для всех разделенных компонентов, причем благодаря селективному ионному детектированию и специальным методам обработки данных степень разделения масс-хроматограмм, как правило, значительно выше, чем обычных хроматограмм, регистрируемых другими хроматографическими детекторами. Селективный характер детектирования с помощью масс-спектрометра позволяет выделить определенные классы веществ из сложной и даже неразделенной хроматограммы.

В-третьих, разные методы ионизации обладают селективностью по отношению к некоторым структурным или функциональным особенностям анализируемых молекул. Выбирая соответствующий способ ионизации, можно осуществить селективный анализ определенных типов структур или удостовериться в наличии определенных функциональных групп.
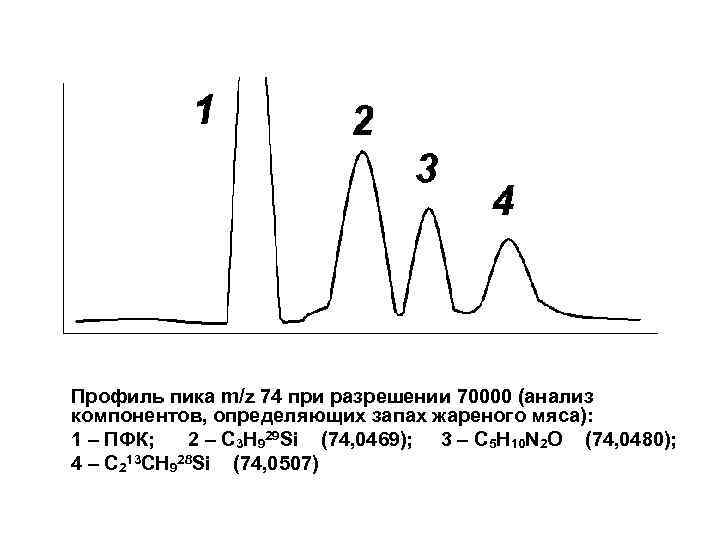
Профиль пика m/z 74 при разрешении 70000 (анализ компонентов, определяющих запах жареного мяса): 1 – ПФК; 2 – C 3 H 929 Si (74, 0469); 3 – C 5 H 10 N 2 O (74, 0480); 4 – C 213 CH 928 Si (74, 0507)
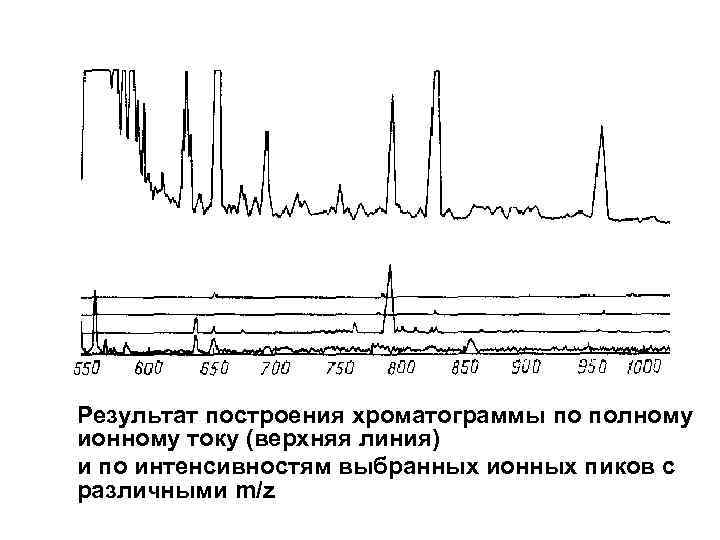
Результат построения хроматограммы по полному ионному току (верхняя линия) и по интенсивностям выбранных ионных пиков с различными m/z

Масс-спектрометрический анализ смесей При использовании МС для анализа многокомпонентных смесей его можно рассматривать в качестве многоканального детектора, который в результате снятия одного спектра на выходе регистрирует набор N характеристик образца (интенсивности ионных пиков каждой из N линий масс-спектра m/zi), который можно рассматривать как Nмерный вектор а = {аi}, i = 1, 2, …, N

Для образца, состоящего из k = 1, 2, …, L компонентов набор наблюдаемых аналитических характеристик (масс-спектр) аi связан с характеристиками индивидуальных компонент hik и их содержаниями ck соотношением аi = hik * ck, k

Рассмотрим несколько M спектров разных образцов (различающихся составом). Этот набор спектров можно представить в виде матрицы наблюдений А = { а j } = {аij}, j = 1, 2, …, M. В случае анализа образца из L компонент элементы матрицы наблюдений А = {аij} будут связаны с их содержаниями С = {ckj}, спектрами индивидуальных компонент Н = {hik}, k = 1, 2, …, L и экспериментальными ошибками (погрешностями) Е = {еij} соотношением А=Н*С + Е

Установление состава образца, т. е. расчет содержаний компонент по масс-спектру смеси в случае N = L осуществляется в соответствии с ck = {hi k} -1 * аi или С = Н -1 А Для N > L : ck = (НT Н ) -1 Н Т аi Последняя операция называется псевдообращением матрицы Н.

История масс-спектрометрии 1912 год — Томсон создает первый масс-спектрограф и получает масс-спектры молекул кислорода, азота, угарного газа, углекислого газа и фосгена. 1913 год — С помощью своего масс-спектрографа Томсон открывает изотопы неона: неон-20 и неон-22. 1923 год — Астон измеряет с помощью массспектрометра дефект массы. 1934 год — Конрад применяет масс-спектрометрию для анализа органических молекул. 1940 год — Нир с помощью препаративной массспектрометрии выделяет уран-235 1940 год — Нир создает первый надежный источник электронного удара, применив ионизационную камеру

1948 год — Камероном и Эггером создан первый массспектрометр с времяпролётным масс-анализатором. 1952 год — Тальрозе и Любимова впервые наблюдают сигнал метония CH 5+ в ионном источнике электронного удара при повышенном давлении метана в ионизационной камере (в 1966 Мансон и Филд применят это открытие для аналитических целей и создадут ионный источник с химической ионизацией). 1953 год — Пауль патентует квадрупольный массанализатор и ионную ловушку. 1956 год — Мак-Лафферти и Голке создают первый газовый хромато-масс-спектрометр 1966 год — Мансон и Филд создают ионный источник с химической ионизацией

1972 год — Каратаев и Мамырин изобретают времяпролётный масс-анализатор с фокусировкой, значительно улучшающий разрешение анализатора. 1974 год — Первый жидкостный хромато-массспектрометр создан Арпино, Болдуином и Мак. Лафферти 1981 год — Барбер, Бордоли, Седжвик и Тайлор создают ионизатор с бомбардировкой быстрыми атомами (FAB) 1982 год — Первый масс-спектр целого белка (инсулин) с помощью бомбардировки быстрыми атомами (FAB) 1983 год — Бланки и Бестал изобретают термоспрей. 1984 год — Л. Н. Галль, а затем Фенн публикуют работы по методу электроспрей. 1987 год — Карас, Бахман, Бар и Хилленкамп изобретают ионизацию лазерной десорбцией при содействии матрицы (MALDI). 1999 год — Александр Макаров изобретает электростатическую ионную ловушку.
Масс-спектрометрия АХ.ppt