Массы Лыт. (2).ppt
- Количество слайдов: 59

Масс спектрометрия

• Чтобы измерить массу тела его взвешивают. Специальными весами можно измерить массы до нанограммов (10 -9 грамма). Веса отдельных молекул на много порядков величины меньше - 10 -23 - 10 -18 г. Для взвешивания молекул используется массспектромерия. • Масс-спектрометрия как аналитический метод применяется в: биохимии, общей и органической химии, медицине и токсикологии, фармацевтике, контроле окружающей среды, криминалистике, допинговом контроле, контроле наркотических средств, геохимии, геологии, археологии, ядерной промышленности и т. д.

Состав масс-спектра Масс-спектр может состоять из нескольких типов ионов: 1. Молекулярный ион 2. Перегруппировочные ионы 3. Фрагментные ионы 4. Многозарядные ионы 5. Метастабильные ионы

История масс-спектрометрии 1912 год — Томсон (1906 физика) создает первый масс-спектрограф и получает массспектры молекул кислорода, азота, угарного газа, углекислого газа и фосгена. 1913 год — С помощью своего массспектрографа Томсон открывает изотопы неона: неон-20 и неон-22. 1923 год — Астон (1922 химия) измеряет с помощью масс-спектрометра дефект массы.

• 1934 год — Конрад применяет массспектрометрию для анализа органических молекул. • 1940 год — Нир с помощью препаративной масс-спектрометрии выделяет уран-235. • 1940 год — Нир создает первый надежный источник электронного удара, применив ионизационную камеру. • 1948 год — Камероном и Эггером создан первый масс-спектрометр с времяпролётным масс-анализатором.

1952 год — Тальрозе и Любимова впервые наблюдают сигнал метония CH 5+ в ионном источнике электронного удара при повышенном давлении метана в ионизационной камере. 1953 год — Пауль(1989 физика) патентует квадрупольный массанализатор и ионную ловушку. 1956 год — Мак. Лаферти и Голке создают первый газовый хромато-масс-спектрометр. 1966 год — Мансон и Филд создают ионный источник с химической ионизацией.

1972 год — Каратаев и Мамырин изобретают время-пролётный массанализатор с фокусировкой, значительно улучшающий разрешение анализатора. 1974 год — Первый жидкостный хромато-масс -спектрометр создан Арпино, Болдуином и Мак. Лаферти 1981 год — Барбер, Бордоли, Седжвик и Тайлор создают ионизатор с бомбардировкой быстрыми атомами (FAB). 1982 год — Первый масс-спектр целого белка (инсулин) с помощью бомбардировки быстрыми атомами (FAB).

1983 год — Бланки и Бестал изобретают термоспрей. 1984 год — Л. Н. Галль, а затем Фенн (2002 химия) публикуют работы по методу электроспрей. 1987 год — Карас, Бахман, Бар и Хилленкамп изобретают ионизацию лазерной десорбцией при содействии матрицы (MALDI). 1999 год — Александр Макаров изобретает электростатическую ионную ловушку.

• Масс-спектрометрия в современном понимании этого слова - это физический метод измерения отношения массы заряженных частиц материи (ионов) к их заряду и определения количества ионов с определенным отношением массы к заряду. Для этого используются законы движения заряженных частиц материи в магнитном или электрическом поле. Масс-спектр - это просто рассортировка заряженных частиц по их массам (точнее отношениям массы к заряду).

• Существенное отличие массспектрометрии от других аналитических физико-химических методов состоит в том, что оптические, рентгеновские и некоторые другие методы детектируют излучение или поглощение энергии молекулами или атомами, а массспектрометрия имеет дело с самими частицами вещества. •

• Macс-спектральные приборы. • Для разделения ионов исследуемого вещества по величинам m/z, измерения этих величин и токов разделенных ионов используют масс-спектральные приборы или масс-спектрометрические детекторы. • Приборы, в которых регистрация осуществляется электрическими методами, называются масс-спектрометрами. • Приборы с регистрацией ионов на фотопластинках – масс-спектрографами.

• Начало развитию масс-спектрометрии. положено опытами Дж. Томсона (1910), исследовавшего пучки заряженных частиц, разделение которых по массам производилось с помощью электрических и магнитных полей, а спектр регистрировался на фотопластинки. • Первый масс-спектрометр построен А. Демпстером в 1918. • Первый масс-спектрограф создал Ф. Астон в 1919; он же исследовал изотопический состав большого числа элементов.

• Первый серийный масс-спектрометр создан А. Ниром в 1940; его работы положили начало изотопной масс-спектрометрии. • Прямое соединение масс-спектрометра с газо-жидкостным хроматографом (1959) дало возможность анализировать сложные смеси летучих соединений. , а соединение с жидкостным хроматографом с помощью термораспылительного устройства (1983) смеси труднолетучих соединений. • ( Метод хроматомасс-спектрометрия)

Хромато-масс-спектрометрия • Масс-спектрометры используются для анализа органических и неорганических соединений. • Органические вещества в большинстве случаев представляют собой многокомпонентные смеси индивидуальных компонентов. Например, показано, что запах жареной курицы составляют 400 компонентов (то есть, 400 индивидуальных органических соединений

• Задача аналитики состоит в том, чтобы определить сколько компонентов составляют органическое вещество, узнать какие это компоненты (идентифицировать их) и узнать сколько каждого соединения содержится в смеси. Для этого идеальным является сочетание хроматографии с массспектрометрией

• Газовая хроматография как нельзя лучше подходит для сочетания с ионным источником масс-спектрометра с ионизацией электронным ударом или химической ионизацией, поскольку в колонке хроматографа соединения уже находятся в газовой фазе. Приборы, в которых масс-спектрометрический детектор скомбинирован с газовым хроматографом, называются хроматомасс-спектрометрами ( «Хромасс» ).
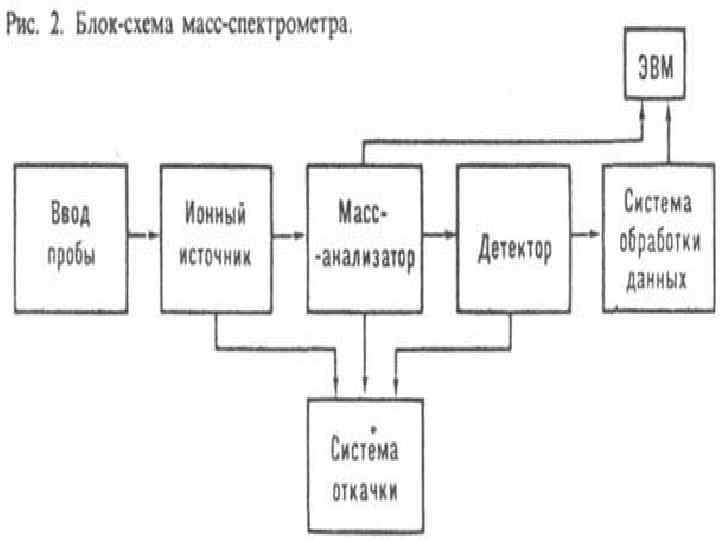

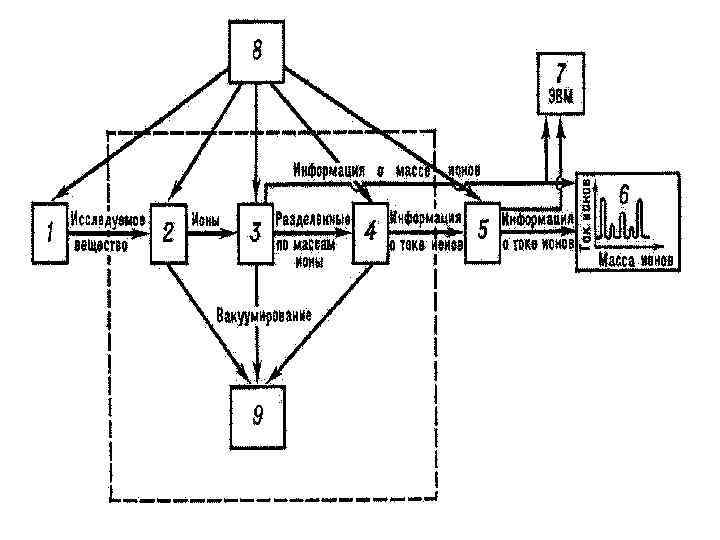
Скелетная схема массспектрометра 1 – система подготовки и введения исследуемого вещества; 2 – ионный источник; 3 – массанализатор; 4 – приемник ионов; 5 – усилитель; 6 – регистрирующее устройство; 7 – ЭВМ; 8 – система электрического питания; 9 – откачные устройства. Пунктиром обведена вакуумируемая часть прибора

Образовавшиеся при ионизации положительно заряженные ионы проходят через ускоряющие пластины, разность потенциалов между которыми несколько тысяч вольт и приобретают энергию e. V, а их скорость возрастает до V. Энергия e. V=F будет равна кинетической энергии ионов mv 2/2, покидающих ионный источник со скоростью V, тогда e. V=F= mv 2/2, …(1) После ускорения в электрическом поле ионы под прямым углом пересекают магнитное поле напряженностью H, подвергаясь действию силы F= Hev , направленной перпендикулярно движению иона. Поэтому траекторией движения ионов будет окружность радиуса r. Приравнивая F получаем Hev = mv 2/ r. Тогда V= r He/m Подставляя это выражение в (1) получаем e. V=mr 2 H 2 e 2/2 m 2 радиус окружности r= 1/H √ 2 Vm/e …(2) или m/e = r 2 Н 2/2 V
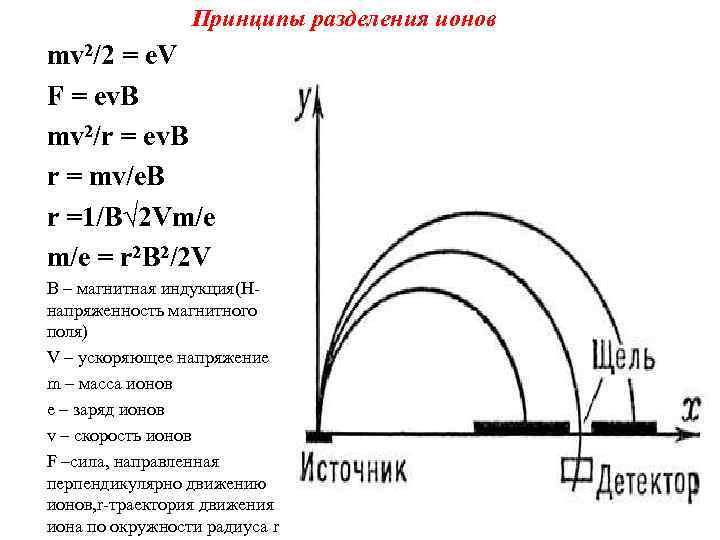
Принципы разделения ионов mv 2/2 = e. V F = ev. B mv 2/r = ev. B r = mv/e. B r =1/B√ 2 Vm/e = r 2 B 2/2 V B – магнитная индукция(Н напряженность магнитного поля) V – ускоряющее напряжение m – масса ионов е – заряд ионов v – скорость ионов F –сила, направленная перпендикулярно движению ионов, r траектория движения иона по окружности радиуса r

Масс-спектр тириевого свинца (δm 50% – ширина пика на полувысоте; δm 10% – ширина пика на уровне 1/10 от максимальной интенсивности) разрешающая способность массспектрометра

Характеристики масс-спектрометра Важнейшими техническими характеристиками масс-спектрометров являются чувствительность, динамический диапазон, разрешение, скорость сканирования. 1. Фокусировка пучка ионов по направлению – формирование изображения источника и уменьшение расходимости потока ионов в магнитном поле. 2. Разрешающая сила R – возможность разделить два соседних пика – для ионов с наибольшей массой m и массой m+Δm. R<2000 – низкое разрешение, R>10000 – высокое разрешение. 3. Чувствительность – минимальное определяемое давление паров изучаемого вещества (10 14 Па) или минимальная масса этого вещества (до 10 7%). Например, чтобы различить два иона C 2 H 4+ и CH 2 N+, которые имеют одинаковую номинальную массу (m =28), но разные точные массы (28. 0313 и 28. 0187, соответственно), прибор должен иметь разрешение не меньше, чем R = 28 / (28. 0313 – 28. 0187) ≈ 2200. Более дешевые спектрометры с низким разрешением (R ≈ 300 -1000) могут различать простые ионы с относительно низкими молекулярными массами.

• Первое, что надо сделать для того, чтобы получить масс-спектр, превратить нейтральные молекулы и атомы, составляющие любое органическое или неорганическое вещество, в заряженные частицы - ионы. • Этот процесс называется ионизацией и по разному осуществляется для органических и неорганических веществ.

Методы ионизации Ионизация молекул должна проводиться в условиях, при которых образовавшийся ион вне зависимости от метода ионизации не претерпевал бы никаких столкновений с другими молекулами или ионами. Это необходимо для установления взаимосвязи между свойствами иона и молекулы. Ионизация электронным ударом (Е 50 100 э. В) Фотоионизация (Е 7 15 э. В, λ~80 120 нм) Ионизация электрическим полем Химическая ионизация (газы реагенты: СН 4, СН 3 СН 2 СН 3, (СН 3)3 СН; реактивные ионы: СН 5+ и С 2 Н 5+, С 2 Н 5+ и С 3 Н 7+, С 3 Н 7+ и С 4 Н 9+) Поверхностная ионизация Комбинированные методы ионизации Вторичная ионизация (ионизация потоком первичных ионов, например, Ar+)

• Ионизация газообразной пробы может быть вызвана фотонами, ионами, электрическим полем, электронным ударом и другими способами. Энергия электронов невелика (10 -100 э. В). При бомбардировке молекул или атомов электронами происходит ряд процессов. В условиях массспектрального анализа образуются преимущественно положительные однозарядные ионы, реже – двухзарядные и практически не встречаются ионы с более высоким зарядом. • Если энергия бомбардирующих электронов достаточно велика, чтобы вызвать разрыв химических связей, то происходит фрагментация молекул и в потоке появляются так называемые ионы-осколки

• Процесс ионизации и типы ионов • Ионизация атомов • А + е = А+ + 2 е или А + е = А+* + 2 е • Ионизация молекул • М + е → М+* + 2 е • М + е → М 2+ + 3 е • М + е → М * • М+* катион радикал • Процессы фрагментации молекулярных ионов • АВС+* → А+ + ВС* • АВС+* → АВ+ + С* • └→ А+ + В • АВС+* → АВ+* + С • Реакции прямого распада: в осколочных ионах атомы связаны в той же последовательности, как и в исходной молекуле

• Продолжение фрагментации • АВС+* → АС+ + В* • Реакция перегруппировки: в процессе распада образуется новые соединения • Метастабильные ионы. Основные ионы, которые представлены в масс спектрах соединений, возникают непосред ственно ионизационной камере, откуда они за в время 10 6 с поступают в бесполевое пространство между ионным источником и магнитным анализатором. Если ион распадается не в ионной камере, а в этом пространстве, то возникают так называемые метастабильные ионы, которые отличаются по скорости от осколочных и молекулярных ионов и в масс спектрах проявляются в виде диффузных пиков. Массовые числа таких диффузных пиков, измеренные в максимуме их интенсивности, обычно имеют дробные значения.

• Масс-анализаторы Итак, мы получили ионы. Поскольку это заряженные частицы, мы можем с помощью электрического поля вытянуть их из той области, где они образовались. Теперь, начинается второй этап масс- спектрометрического анализа - сортировка ионов по массам (точнее по отношению массы к заряду, или m/z), собственно то, что дало имя этому методу. Это происходит в той части масс-спектрометра, которая называется "масс-анализатором".

• Все масс-анализаторы используют зависимость динамики движения заряженных частиц в магнитных и переменных электромагнитных полях от отношения массы частицы к ее заряду. В первых масс-анализаторах использовалось магнитное поле. Согласно физическим законам траектория заряженных частиц в магнитном поле искривляется, а радиус кривизны зависит от массы частиц. Именно это явление используется для анализа ионов по массам
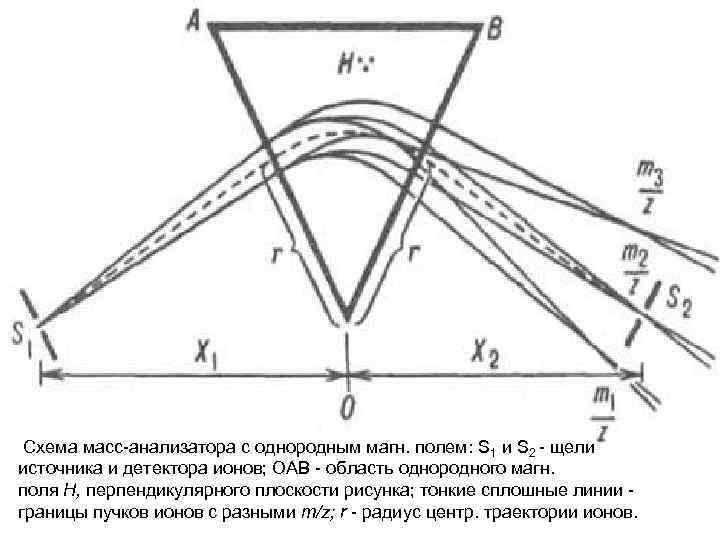
Схема масс-анализатора с однородным магн. полем: S 1 и S 2 - щели источника и детектора ионов; ОAВ - область однородного магн. поля Н, перпендикулярного плоскости рисунка; тонкие сплошные линии - границы пучков ионов с разными т/z; r - радиус центр. траектории ионов.

• Именно это используется для анализа ионов по массам. Для того, чтобы увеличить разрешение, на пути ионов устанавливается еще и электростатический анализатор. Магнитные масс-спектрометры имеют высокое разрешение и могут использоваться со всеми видами ионизации.
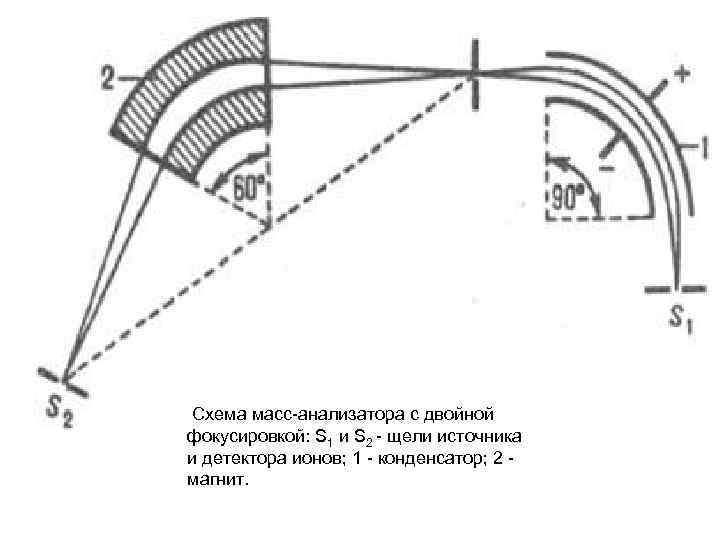
Схема масс-анализатора с двойной фокусировкой: S 1 и S 2 - щели источника и детектора ионов; 1 - конденсатор; 2 - магнит.

• Квадруполь Ученые в течение долгого времени искали альтернативу магниту в качестве массанализатора. Первым успеха добился профессор Стэнфордского университета Robert Finnigan, построивший в 1967 году первый коммерческий хромато-массспектрометр с квадрупольным анализатором. Квадруполь представляет собой четыре стержня, к которым попарно в противоположной полярности подается определенная комбинация постоянного и радиочастотного переменного напряжений.
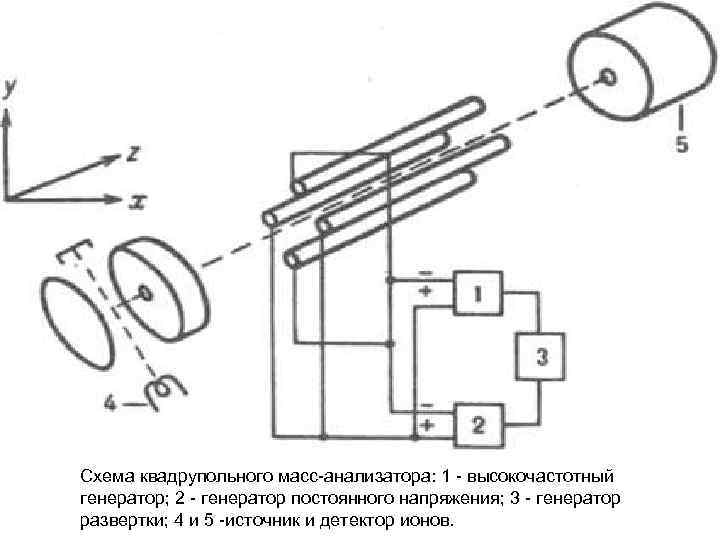
Схема квадрупольного масс-анализатора: 1 - высокочастотный генератор; 2 - генератор постоянного напряжения; 3 - генератор развертки; 4 и 5 -источник и детектор ионов.
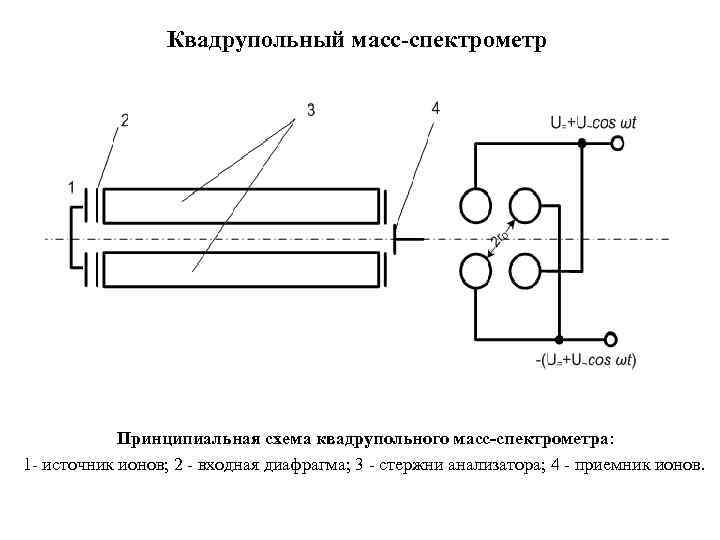
Квадрупольный масс-спектрометр Принципиальная схема квадрупольного масс-спектрометра: 1 источник ионов; 2 входная диафрагма; 3 стержни анализатора; 4 приемник ионов.

• Ионы, влетающие параллельно оси этих стержней, попадают в гиперболическое поле и оно, в зависимости от соотношения их массы (как всегда, m/z) и частоты, пропускаются этим полем или не пропускаются дальше. Магнитные массспектрометры требуют использования высоких напряжений (тысячи вольт), а квадрупольные нет, и это упрощает его конструкцию, меньшие размеры вакуумной части упрощают систему создания вакуума. Масс-спектрометры уменьшились в размерах, стали проще в эксплуатации и, что самое главное, намного дешевле. .

Ионно-циклотронный резонанс В этом анализаторе ионы влетают в сильное магнитное поле и вращаются там по циклическим орбитам (как в циклотроне, ускорителе элементарных частиц). Такой масс-анализатор обладает определенными преимуществами: имеет очень высокое разрешение, диапазон измеряемых масс весьма широк, может анализировать ионы, получаемые всеми способами. Однако, для своей работы он требует сильного магнитного поля, а значит, использования сильного магнита со сверхпроводящим соленойдом, поддерживаемым при очень низкой температуре (жидкого гелия, приблизительно - 270 о. С).
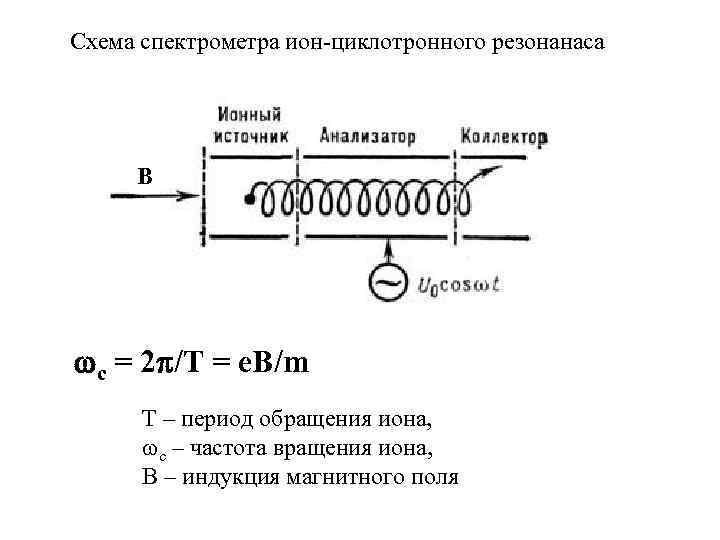
Схема спектрометра ион циклотронного резонанаса B с = 2 /Т = е. В/m T – период обращения иона, с – частота вращения иона, B – индукция магнитного поля

Циклотронно-резонансный масс-анализатор -ячейка в виде прямоугольного параллелепипеда или куба, помещенная в однородное магн. поле. Ионы, попадая в ячейку, движутся в ней по спиральной траектории (циклотронное движение) с частотой wц = 1/2 pz. H/m, где H - напряженность магн. поля, т. е. ионы с одинаковыми значениями m/z имеют определенную циклотронную частоту. Действие прибора основано на резонансном поглощении энергии ионами при совпадении частоты поля и циклотронной частоты ионов. На применении циклотронно-резонансного масс-анализатора основан метод ион-циклотронного резонанса, который используют для определения массы ионов, в частности молекулярных ионов, образующихся при ионно-молекулярных реакциях в газовой фазе; анализа структуры высокомолекулярных ионов; определения кислотно -основных св-в в-в. Для легких ионов R = 108. Первый массспектрометр ионциклотронного резонанса построен Г. Соммером, Г. Томасом и Дж. Хиплом (США, 1950).

Дальнейшее развитие квадрупольных анализаторов привело к созданию "ионной ловушки". Одна пара стержней была закручена в кольцо, а вторая пара превратилась в шарообразные чашки. Комбинация радиочастотных и постоянных напряжений, прикладываемых к электродам ионной ловушки, стала позволять удерживать ионы внутри нее или выбрасывать из нее. Внешний по отношению к массанализатору, ионный источник гарантирует отсутствие химической самоионизации, приводящей к искажению масс-спектров электронного удара и делает прибор гораздо более универсальным - можно анализировать отрицательные ионы, образующиеся при диссоциативном захвате электронов, можно использовать классический прямой ввод и т. д.

В последнее время все большую популярность приобрели "времяпролетные" (Time Of Flight, TOF) масс-анализаторы. В них ионы разгоняются электрическим полем, приобретают одинаковую не зависящую от массы кинетическую энергию и вылетают в бесполевое пространство. При движении в этом пространство ионы имеют зависящую от массы скорость, определяемую известной формулой E=mv 2/2, где Е- кинетическая энергия ионов, м- масса иона, а v - его скорость. Они разделятся пространстве и в разное время достигнут детектора, расположенного в конце бесполевого пространства. Измерив время прихода на детектор, при известной длине бесполевого пространства можно определить их массу. С помощью этого анализатора можно измерять массы очень больших молекул (с массами в десятки и сотни тысяч атомных единиц). В квадрупольных анализаторах большие молекулы не удается удерживать доступными электрическими полями. Магнитные анализаторы для ионов больших масс (больше 10 кило Дальтон) очень громоздки и требуют мощных источников тока и напряжения. Наиболее подходящим методом ионизации для времяпролетных масс-спектрометров оказался описанный выше MALDI (ионизация лазерной десорбцией из матрицы).
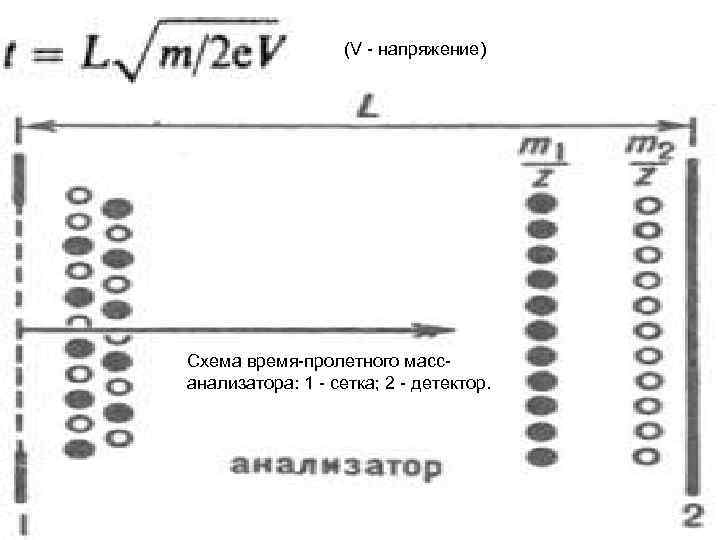
(V - напряжение) Схема время-пролетного массанализатора: 1 - сетка; 2 - детектор.
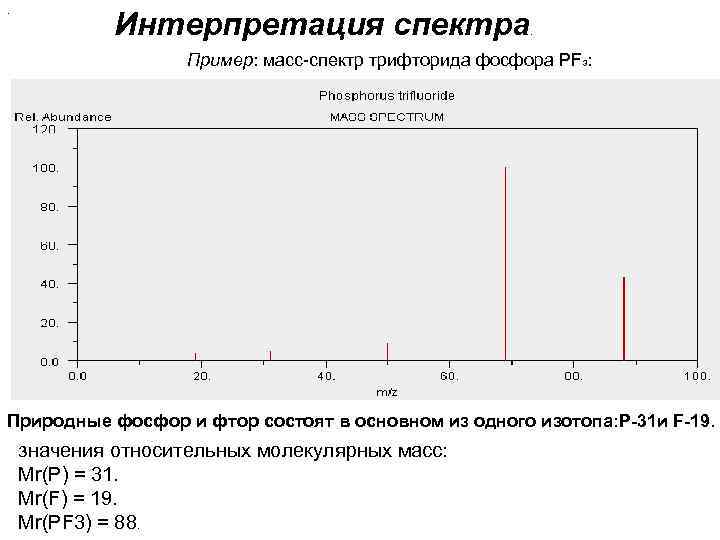
. Интерпретация спектра . Пример: масс-спектр трифторида фосфора PF 3: Природные фосфор и фтор состоят в основном из одного изотопа: Р-31 и F-19. значения относительных молекулярных масс: Мr(P) = 31. Мr(F) = 19. Мr(PF 3) = 88.

Если все частицы, зарегистрированные детектором, однозарядны (z=1), то пики спектра можно соотнести следующим образом: Сигнал при m/z=88 обусловлен молекулярными ионами PF 3+. Сигнал при m/z=69 обусловлен ионами PF 2+. Сигнал при m/z=50 обусловлен ионами PF+. Сигнал при m/z=31 обусловлен ионами P+. Сигнал при m/z=19 обусловлен ионами F+. Как видим, в данном примере сигнал при самом большом значении m/z принадлежит молекулярному иону. Такая ситуация встречается часто, но не всегда (если молекулярный ион нестабилен и легко распадается, то сигнал с самым большим значением m/z будет принадлежать одному из осколков; если вещество содержит примесь, то сигнал с самым большим значением m/z может принадлежать постороннему соединению). Тем не менее в огромном числе случаев максимальная в спектре величина m/z численно равна молярной массе исследуемого вещества. Этот факт полезен в качественном анализе.
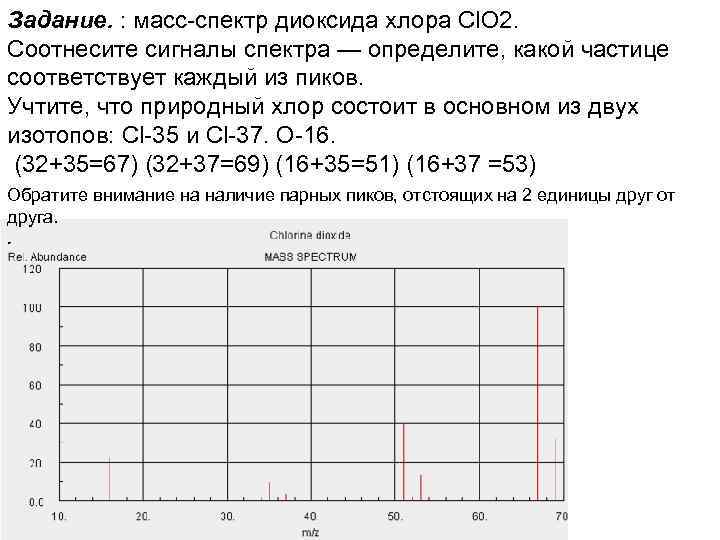
Задание. : масс-спектр диоксида хлора Cl. O 2. Соотнесите сигналы спектра — определите, какой частице соответствует каждый из пиков. Учтите, что природный хлор состоит в основном из двух изотопов: Cl-35 и Cl-37. О-16. (32+35=67) (32+37=69) (16+35=51) (16+37 =53) Обратите внимание на наличие парных пиков, отстоящих на 2 единицы друг от друга. .

Распространенность изотопов некоторых элементов Элемент Изотоп (распространенность в природе, %) Водород 1 Н (99, 985); 2 H (0, 015) Углерод (98, 893); (1, 107) Азот 14 N (99, 634); 15 N (0, 366) Кислород 16 O (99, 759); 17 O (0, 037); 18 O (0, 204) Фтор (100) Кремний 28 Si (92, 21); 29 Si (4, 70); 30 Si (3, 09) Фосфор 31 P (100) Сера 32 S (95, 0); 33 S (0, 75); 34 S(4, 22); 36 S (0, 02) Хлор 35 Cl (75, 77); 37 Cl (24, 23) Мышьяк 75 As (100) Селен Бром Теллур Иод 74 Se (0, 87); 76 Se (9, 02); 77 Se (7, 58); 78 Se (23, 52); 80 Se (49, 82); 82 Se (9, 19) 79 Br (50, 537); 81 Br (49, 463) 120 Te (0, 089); 122 Te (2, 46); 123 Te (0, 89); 124 Te (4, 74); 125 Te (7, 03); 126 Te (18, 72); 128 Te (31, 759); 130 Te(34, 27) 127 I (100)

Некоторые масс-спектрометрические правила Определение элементного состава по масс • • • спектру низкого разрешения 1. "Азотное правило". Большинство встречающихся в органических соединениях элементов имеют либо четную массу основных изотопов и четные валентности (C, O, S, Si, Ge, Pb и др. ), либо нечетную массу и нечетные валентности (H, F, Cl, Br, I, As, Sb и др. ). Поэтому М+. соединений, составленных из любых комбинаций этих элементов, имеют четную массу. Азот имеет четную массу и нечетную валентность. 2. "Четно-электронное" правило. Ион радикалы (нечетное число электронов) могут элиминировать или радикалы, или четно электронные нейтральные молекулы, тогда как ионы (четное число электронов) могут терять лишь нейтральные четно электронные частицы. Следует отметить, что это правило имеет довольно много исключений. 3. Правило Стивенсона-Одье. При распаде молекул под действием электронного удара положительный заряд локализуется на фрагменте, который обладает наименьшей энергией ионизации. 4. Затрудненный разрыв связей, принадлежащих к ненасыщенным системам. Разрыв связей, прилежащих к винильной, этинильной или арильной группе, обычно затруднен вследствие очень низкой стабильности образующихся ненасыщенных ионов или радикалов (часто за подобные ионы принимают фрагменты продуктов перегруппировки молекулярных ионов).

Одна из важнейших задач - нахождение зависимости между характером масс-спектра и строением исследуемой орг. молекулы. При ионизации орг. молекулы образуется молекулярный ион, в котором далее происходят процессы гетеро- и гомолитического. разрыва связей или разрыва связей с перегруппировкой молекулы и образование осколочных ионов, которые в свою очередь могут подвергаться дальнейшему распаду. Последовательные распады ионов, устанавливаемые из масс-спектра, называются направлениями или путями распада. Направления распада - важная характеристика каждого класса соединений. Совокупность всех направлений распада составляет характерную для каждого органического соединения схему фрагментации. Если масс-спектр прост, схема фрагментации сводится к одному пути распада, например, при распаде молекулярного иона СН 3 ОН+ последовательно образуются ионы СН 2=ОН+ и Н—С=О+. В случае сложных масс-спектров схема фрагментации отвечает
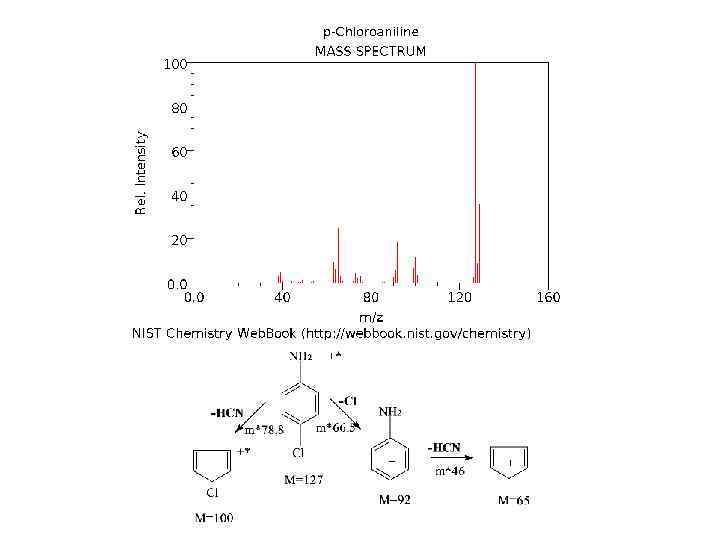

Примером установленных закономерностей фрагментации являются следующие схемы разрыва связей: • 1. В разветвленных углеводородах наиболее вероятен разрыв связей у места ветвления • 2. Вероятность разрыва связи С Н уменьшается с увеличением длины цепи углеводорода • 3. В ароматических производных наиболее вероятен разрыв β связей с образованием перегруппировочного тропилиевого иона С 7 Н 7+

• 4. В масс спектрах спиртов характерными осколочными ионами являются ионы с массами 31(СН 2=ОН+) и М 1 (RCH=OH+), которые соответствуют следующей схеме разрыва связей: • 5. Для аминов H 2 N CH 2 R характерен разрыв α связи • с образованием иона NH 2=CH 2 (30). Значительным также является пик H 2 N=CHR (M 1).

• 6. Масс спектр кетонов содержит ионы R 1 C=O+ и R 2 C=O+. Если алкильная цепь содержит три и более атомов углерода, то происходит отрыв β связи и далее перегруппировка с участием атома водорода: • 7. Алифатические фториды, хлориды и бромиды дают малую интенсивность молекулярного ионного тока, но иодиды имеют значительный пик молекулярного иона. • 8. Металлорганические соединения обладают крайне низкой энергией связи металл углерод, что приводит к резкому уменьшению интенсивности молекулярного иона в масс спектре.

Определение парциального давления паров веществ число молекул в единице объема напускной системы, средняя скорость молекул, δS – площадь молекулярного потока газа, интенсивность ионного тока nj число ионизируемых молекул, рj парциальное давление, k постоянная Больцмана, Т температура К константа чувствительности прибора, σ площадь сечения ионизации молекулы j с образованием ионов i.

Определение константы равновесия химической реакции и теплоты реакции i – продукты реакции, j – исходные вещества, Кр – безразмерная функция После преобразования: В – постоянная величина

Измерение теплот сублимации и испарения Уравнение Клапейрона-Клаузиуса Использование масс-спектрометрии позволяет определить теплоты сублимации (испарения) летучих веществ. Для этого измеряли интенсивность пика молекулярного иона при различных температурах, результаты вносили в интегрированную форму уравнения Клапейрона-Клаузиуса, где: I – интенсивность сигнала молекулярного иона (в произвольных единицах измерения); T – температура, K; R – универсальная газовая постоянная; H – теплота сублимации (испарения). Линеаризация этого уравнения в координатах ln(I T) от 1/Т дает возможность по углу наклона прямой определить теплоту сублимации (испарения) вещества.

Кинетические исследования: 1. Определение механизмов химических процессов (в том числе по изотопным меткам). 2. Определение констант скоростей химических процессов. 3. Определение порядка и молекулярности реакции. Термодинамические исследования: 1. Определение потенциалов ионизации молекул и появления ионов. 2. Определение парциального давления паров вещества. 3. Определение теплоты сублимации. 4. Определение константы равновесия химической реакции и теплоты химической реакции. 5. Ион-молекулярные равновесия.

Масс спектромерия в химической кинетике • Метод изотопной метки • 1) изучение механизма реакции • 2) исследование механизма фрагментации и установление структуры иона • СD 3 OH + e ↔ [CD 2 OH]+ + D* + 2 e
Массы Лыт. (2).ppt