D--Users-CHELOMINA-Desktop-МАГИСТРЫ-2016-МАЛЫЕ интерферирующие РНК-1.ppt
- Количество слайдов: 146
 МАЛЫЕ ИНТЕРФЕРРИРУЮЩИЕ РНК лекция 1
МАЛЫЕ ИНТЕРФЕРРИРУЮЩИЕ РНК лекция 1
 • микро. РНК – недавно открытый класс малых некодирующих РНК, которые регулируют экспрессию белков через узнавание специфических м. РНК. Открытие таких молекул является одним из главных научных достижений последних лет. Со времени первого описания более 28 тыс. микро. РНК (для более 200 видов) зарегистрировано в базе данных mi. RBase (http: //www. mirbase. org/). • Малые интерферирующие РНК вовлечены в такие ключевые биологические процессы, как - развитие, - дифференциация, - апоптоз и - пролиферация. • Они играют важную роль в - контроле генной экспрессии, - эпигенетической модификации и - регуляции активности гетерохроматина эукариот. • Хотя микро. РНК и связанные с ними белки оказались одним из наиболее обильных рибонуклеопротеидных комплексов клетки, экспрессия некоторых из них ограничена немногочисленными клеточными типами или специфическими условиями окружающей среды. Поэтому для идентификации таких микро. РНК были разработаны специальные 2 вычислительные подходы in silico.
• микро. РНК – недавно открытый класс малых некодирующих РНК, которые регулируют экспрессию белков через узнавание специфических м. РНК. Открытие таких молекул является одним из главных научных достижений последних лет. Со времени первого описания более 28 тыс. микро. РНК (для более 200 видов) зарегистрировано в базе данных mi. RBase (http: //www. mirbase. org/). • Малые интерферирующие РНК вовлечены в такие ключевые биологические процессы, как - развитие, - дифференциация, - апоптоз и - пролиферация. • Они играют важную роль в - контроле генной экспрессии, - эпигенетической модификации и - регуляции активности гетерохроматина эукариот. • Хотя микро. РНК и связанные с ними белки оказались одним из наиболее обильных рибонуклеопротеидных комплексов клетки, экспрессия некоторых из них ограничена немногочисленными клеточными типами или специфическими условиями окружающей среды. Поэтому для идентификации таких микро. РНК были разработаны специальные 2 вычислительные подходы in silico.
 • Чтобы дополнить экспериментальные методы идентификации генов микро. РНК, были разработаны вычислительные подходы in silico. Они основываются на разных принципах: - поиске гомологии с известными генами микро. РНК, - исследовании окружения известных генов микро. РНК, и - идентификации консервативных генных сегментов, которые выпадают из предсказанных белок-кодирующих регионов и потенциально могут формировать структуры типа стебель-петля. • Потенциальные м. РНК мишени могут быть идентифицированы с помощью методов биоинформатики (таких как Mi. Randa и Pic. Tar) и экспериментальной биологии, включающих иммунопреципитацию м. РНК в комплексах сайленсинга, а также секвенирование. 3
• Чтобы дополнить экспериментальные методы идентификации генов микро. РНК, были разработаны вычислительные подходы in silico. Они основываются на разных принципах: - поиске гомологии с известными генами микро. РНК, - исследовании окружения известных генов микро. РНК, и - идентификации консервативных генных сегментов, которые выпадают из предсказанных белок-кодирующих регионов и потенциально могут формировать структуры типа стебель-петля. • Потенциальные м. РНК мишени могут быть идентифицированы с помощью методов биоинформатики (таких как Mi. Randa и Pic. Tar) и экспериментальной биологии, включающих иммунопреципитацию м. РНК в комплексах сайленсинга, а также секвенирование. 3
 • Со времени первого описания более 10 тыс. микро. РНК (для более 100 видов) зарегистрировано в базе данных mi. RBase (ftp: //mirbase. org/pub/mirbase/). • Показано, что микро. РНК регулируют по крайней мере 10% генов C. elegans. В геноме человека обнаружено >2000 генов микро. РНК, контролирующих работу более 60% белок-кодирующих генов (большинство из которых являются факторами развития и транскрпции). • Аномальная экспрессия генов микро. РНК может быть причиной болезней человека, сильных фенотипических изменений и летального исхода. • Открыты стресс-индуцированные микро. РНК, появляющиеся в ответ на специфические условия. 4
• Со времени первого описания более 10 тыс. микро. РНК (для более 100 видов) зарегистрировано в базе данных mi. RBase (ftp: //mirbase. org/pub/mirbase/). • Показано, что микро. РНК регулируют по крайней мере 10% генов C. elegans. В геноме человека обнаружено >2000 генов микро. РНК, контролирующих работу более 60% белок-кодирующих генов (большинство из которых являются факторами развития и транскрпции). • Аномальная экспрессия генов микро. РНК может быть причиной болезней человека, сильных фенотипических изменений и летального исхода. • Открыты стресс-индуцированные микро. РНК, появляющиеся в ответ на специфические условия. 4
 • Сведения по микро. РНК паразитических червей получены для 17 видов нематод, 11 видов трематод и 8 видов цестод. В частности, данные по геномике, транскриптомике и биоинформатике шистосом - Shistosoma mansoni, S. japonicum и кровяной шистосомы S. haematobium - предполагают наличие системы сайленсинга через микро. РНК по крайней мере у двух первых видов. При этом характер экспрессии генов, участвующих в интерференции РНК, существенно отличается на разных стадиях развития паразитов. • У нематоды сосновой древесины Bursaphelenchus xylophilus микро. РНК вероятно может принимать участие в экологической адаптации и регуляции поведения нематоды. • Самая ранняя экспрессия микро. РНК - сразу после оплодотворения, до слияния пронуклеусов, и до первого дробления зиготы, т. е. на стадии развития, долгое время считавшейся стадией транскрипционного покоя, обнаружена у свиной аскариды Ascaris suum. 5
• Сведения по микро. РНК паразитических червей получены для 17 видов нематод, 11 видов трематод и 8 видов цестод. В частности, данные по геномике, транскриптомике и биоинформатике шистосом - Shistosoma mansoni, S. japonicum и кровяной шистосомы S. haematobium - предполагают наличие системы сайленсинга через микро. РНК по крайней мере у двух первых видов. При этом характер экспрессии генов, участвующих в интерференции РНК, существенно отличается на разных стадиях развития паразитов. • У нематоды сосновой древесины Bursaphelenchus xylophilus микро. РНК вероятно может принимать участие в экологической адаптации и регуляции поведения нематоды. • Самая ранняя экспрессия микро. РНК - сразу после оплодотворения, до слияния пронуклеусов, и до первого дробления зиготы, т. е. на стадии развития, долгое время считавшейся стадией транскрипционного покоя, обнаружена у свиной аскариды Ascaris suum. 5
 • История изучения интерференции РНК началась в 1998 г. , когда Крейг Меллоу и Эндрю Файер опубликовали статью в журнале Nature с данными о том, что молекулы двуцепочечных РНК способны подавлять экспрессию генов у почвенной нематоды Caenorhabditis elegans. За это открытие в 2006 г. им была присуждена Нобелевская премия в области физиологии и медицины. Первое описание аналогичного явления у растений дано группой Д. Болкомба в статье журнала Science (Hamilton, Baulcombe, 1999). • Механизм подавления экспрессии генов (сайленсинг) с помощью таких РНК у животных был назван РНК-интерференцией, у грибов это явление получило название "подавление" транскрипции, а у растений – "посттрансляционный сайленсинг генов". По определению Л. И. Корочкина (2006), РНК-интерференция – это механизм формирования и наследственной передачи специфического функционального состояния генома. • РНК-интерференция обеспечивает возможность появления множественных фенотипов, поскольку связана с изменением экспрессии ядерной ДНК. Полагают, что первоначально этот механизм мог сформироваться как защита клеток хозяина против внедрения чужеродных генетических последовательностей вирусной природы и транспозонов. К настоящему времени данный способ регуляции экспрессии генов обнаружен во всех крупных таксонах, включая вирусы, грибы, растения, позвоночных и беспозвоночных, и даже однин одноклеточный организм – зеленую водоросль 6 Chlamydomonas reinhardtii.
• История изучения интерференции РНК началась в 1998 г. , когда Крейг Меллоу и Эндрю Файер опубликовали статью в журнале Nature с данными о том, что молекулы двуцепочечных РНК способны подавлять экспрессию генов у почвенной нематоды Caenorhabditis elegans. За это открытие в 2006 г. им была присуждена Нобелевская премия в области физиологии и медицины. Первое описание аналогичного явления у растений дано группой Д. Болкомба в статье журнала Science (Hamilton, Baulcombe, 1999). • Механизм подавления экспрессии генов (сайленсинг) с помощью таких РНК у животных был назван РНК-интерференцией, у грибов это явление получило название "подавление" транскрипции, а у растений – "посттрансляционный сайленсинг генов". По определению Л. И. Корочкина (2006), РНК-интерференция – это механизм формирования и наследственной передачи специфического функционального состояния генома. • РНК-интерференция обеспечивает возможность появления множественных фенотипов, поскольку связана с изменением экспрессии ядерной ДНК. Полагают, что первоначально этот механизм мог сформироваться как защита клеток хозяина против внедрения чужеродных генетических последовательностей вирусной природы и транспозонов. К настоящему времени данный способ регуляции экспрессии генов обнаружен во всех крупных таксонах, включая вирусы, грибы, растения, позвоночных и беспозвоночных, и даже однин одноклеточный организм – зеленую водоросль 6 Chlamydomonas reinhardtii.
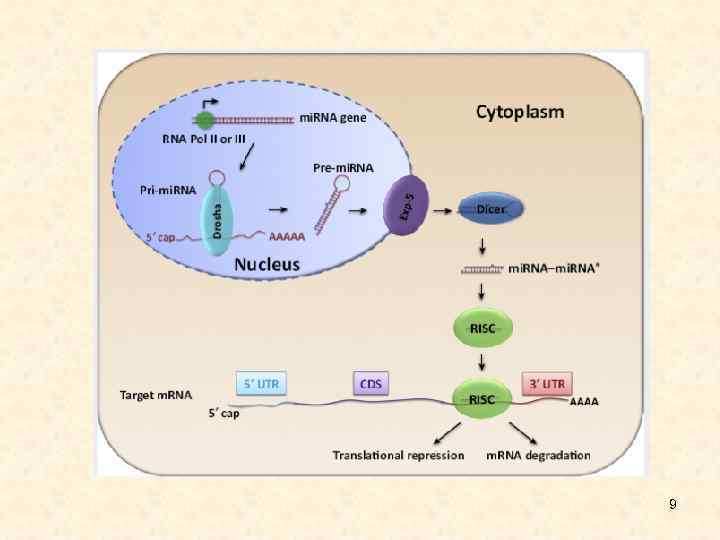
 Биогенез • Хотя зрелые микро. РНК состоят всего из 22 нуклеотидов, их биогенез является достаточно сложным. Первичные транскрипты представляют собой относительно крупные молекулы, содержащие характерные структуры типа стебель-петля, которые процессируются в ядре ферментом Drosha и белком Pasha, специфически связывающимся с двуцепочечной РНК. Продукт Drosha представляет собой примерно 65 нуклеотидную спираль, называемую пре-микро. РНК Пре-микро. РНК экспортируются в цитоплазму с помощью особого белкового комплекса Exportin, где разрезаются ферментом Dicer. В результате образуются зрелые микро. РНК, которые являются РНК-дуплексами длиной около 22 нуклеотидов. Показано, что они могут служить праймерами для синтеза новых, вторичных молекул, что приводит к амплификации сигнала. Одна нить дуплекса микро. РНК, называемая направляющей mi. R нитью, селективно наносится на белок аргонавт (AGO). В итоге формируется РНК индуцированный комплекс сайленсинга (RISC), который может связаться и репрессировать м. РНК мишени, содержащие сайты, комплементарные микро. РНК. Другая нить, получившая название спутника/пассажира, деградирует во время активизации RISC. У животных микро. РНК обычно имеют неполное спаривание с м. РНК-мишенью, поэтому они могут ингибировать транскрипцию 7 многих генов, в м. РНК которых имеются гомологичные последовательности.
Биогенез • Хотя зрелые микро. РНК состоят всего из 22 нуклеотидов, их биогенез является достаточно сложным. Первичные транскрипты представляют собой относительно крупные молекулы, содержащие характерные структуры типа стебель-петля, которые процессируются в ядре ферментом Drosha и белком Pasha, специфически связывающимся с двуцепочечной РНК. Продукт Drosha представляет собой примерно 65 нуклеотидную спираль, называемую пре-микро. РНК Пре-микро. РНК экспортируются в цитоплазму с помощью особого белкового комплекса Exportin, где разрезаются ферментом Dicer. В результате образуются зрелые микро. РНК, которые являются РНК-дуплексами длиной около 22 нуклеотидов. Показано, что они могут служить праймерами для синтеза новых, вторичных молекул, что приводит к амплификации сигнала. Одна нить дуплекса микро. РНК, называемая направляющей mi. R нитью, селективно наносится на белок аргонавт (AGO). В итоге формируется РНК индуцированный комплекс сайленсинга (RISC), который может связаться и репрессировать м. РНК мишени, содержащие сайты, комплементарные микро. РНК. Другая нить, получившая название спутника/пассажира, деградирует во время активизации RISC. У животных микро. РНК обычно имеют неполное спаривание с м. РНК-мишенью, поэтому они могут ингибировать транскрипцию 7 многих генов, в м. РНК которых имеются гомологичные последовательности.
 Филогения. • Широкое распространение компонентов РНК-интерференции среди эукариотических организмов различной степени филогенетического родства предполагает наличие функциональной системы РНКинтерференции у общего предка всех эукариот, т. е. эта система, вероятно, сформировалась сотни миллионов лет назад. Широкомасштабное сравнительное исследование, включающее филогенетический анализ всех известных семейств микро. РНК животных, позволило надежно идентифицировать кластеры микро. РНК, которые произошли от общего транскрипта. Идентифицировали три эпизода инноваций микро. РНК, которые соответствуют основным инновациям развития животных организмов. Первую волну инноваций представляет класс примерно из 20 микро. РНК, который является общим для протостом и деутеростом и может быть связан с появлением билатеральности. Вторая волна инноваций связана с позвоночными, а третья – с плацентарными млекопитающими. Кроме того, обнаружена ожидаемая экспансия микро. РНК, обусловленная геномными дупликациями у ранних позвоночных и анцестральных телеостов. Нелокальные дупликации у предка позвоночных предшествовали локальным (тандемным), ведущим к образованию множества предковых кластеров микро. РНК. Инновации микро. РНК, тандемные и нелокальные дупликации генов микро. РНК распределены в филогении Metazoa неравномерно. 8
Филогения. • Широкое распространение компонентов РНК-интерференции среди эукариотических организмов различной степени филогенетического родства предполагает наличие функциональной системы РНКинтерференции у общего предка всех эукариот, т. е. эта система, вероятно, сформировалась сотни миллионов лет назад. Широкомасштабное сравнительное исследование, включающее филогенетический анализ всех известных семейств микро. РНК животных, позволило надежно идентифицировать кластеры микро. РНК, которые произошли от общего транскрипта. Идентифицировали три эпизода инноваций микро. РНК, которые соответствуют основным инновациям развития животных организмов. Первую волну инноваций представляет класс примерно из 20 микро. РНК, который является общим для протостом и деутеростом и может быть связан с появлением билатеральности. Вторая волна инноваций связана с позвоночными, а третья – с плацентарными млекопитающими. Кроме того, обнаружена ожидаемая экспансия микро. РНК, обусловленная геномными дупликациями у ранних позвоночных и анцестральных телеостов. Нелокальные дупликации у предка позвоночных предшествовали локальным (тандемным), ведущим к образованию множества предковых кластеров микро. РНК. Инновации микро. РНК, тандемные и нелокальные дупликации генов микро. РНК распределены в филогении Metazoa неравномерно. 8
 9
9
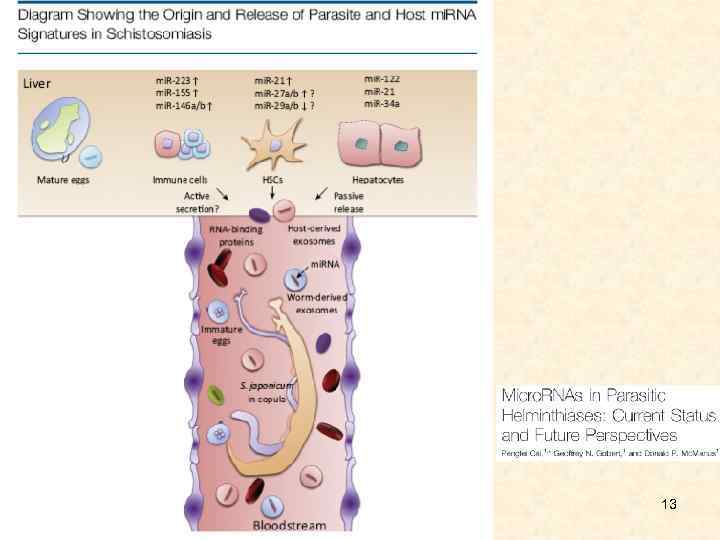
 • В системе паразит-хозяин и хозяин-патоген, РНК-интерференция имеет особый интерес для исследования коэволюционных взаимодействий. Паразиты активно выпускают экзосомы и другие внеклеточные структуры, содержащие специфические белки, РНК, а иногда – геномную ДНК. Слияние внеклеточных структур паразита и хозяина действует, как канал паразитохозяинного взаимодействия. Внеклеточные везикулы принимают участие в распространении патогена и регуляции иммунного ответа хозяина; у O. viverrini, например, они индуцируют провоспалительные и онкогенные фенотипы холангиоцитов человека. 10
• В системе паразит-хозяин и хозяин-патоген, РНК-интерференция имеет особый интерес для исследования коэволюционных взаимодействий. Паразиты активно выпускают экзосомы и другие внеклеточные структуры, содержащие специфические белки, РНК, а иногда – геномную ДНК. Слияние внеклеточных структур паразита и хозяина действует, как канал паразитохозяинного взаимодействия. Внеклеточные везикулы принимают участие в распространении патогена и регуляции иммунного ответа хозяина; у O. viverrini, например, они индуцируют провоспалительные и онкогенные фенотипы холангиоцитов человека. 10
 • Сложный жизненный цикл паразитических видов требует наличия надежных механизмов, обеспечивающих нормальное развитие при постоянном изменении окружающей среды. Функцию посредника между поступающими сигналами и адекватным ответом организма могут выполнять молекулы малых интерферирующих РНК. микро. РНК обладают большим потенциалом в качестве терапевтических и диагностических мишеней для контроля паразитарных заболеваний человека и животных. Например, показано, что изменения профиля микро. РНК строго связаны с субтипами внутрипеченочной холангиокарциномы 11
• Сложный жизненный цикл паразитических видов требует наличия надежных механизмов, обеспечивающих нормальное развитие при постоянном изменении окружающей среды. Функцию посредника между поступающими сигналами и адекватным ответом организма могут выполнять молекулы малых интерферирующих РНК. микро. РНК обладают большим потенциалом в качестве терапевтических и диагностических мишеней для контроля паразитарных заболеваний человека и животных. Например, показано, что изменения профиля микро. РНК строго связаны с субтипами внутрипеченочной холангиокарциномы 11
 • Большое внимание привлекают недавно обнаруженные микро. РНК, циркулирующие вне клеток, которые при болезнях печени могут пассивно высвобождаться в процессе некроза клетки, или активно секретироваться в везикулярные структуры (например, экзосомы). Эти микро. РНК стабильны в биологических жидкостях, таких как моча, сыворотка и плазма крови. Получены свидетельства того, что уровни mi. R-192 и mi. R 21 в сыворотке больных могут быть биомаркерами холангиокарциномы, индуцированной O. viverrini. 12
• Большое внимание привлекают недавно обнаруженные микро. РНК, циркулирующие вне клеток, которые при болезнях печени могут пассивно высвобождаться в процессе некроза клетки, или активно секретироваться в везикулярные структуры (например, экзосомы). Эти микро. РНК стабильны в биологических жидкостях, таких как моча, сыворотка и плазма крови. Получены свидетельства того, что уровни mi. R-192 и mi. R 21 в сыворотке больных могут быть биомаркерами холангиокарциномы, индуцированной O. viverrini. 12
 13
13
 • микро. РНК обладают большим потенциалом в качестве терапевтических и диагностических мишеней для контроля паразитарных заболеваний человека и животных. Например, показано, что изменения профиля микро. РНК строго связаны с субтипами внутрипеченочной холангиокарциномы. Большое внимание привлекают недавно обнаруженные микро. РНК, циркулирующие вне клеток, которые при болезнях печени могут пассивно высвобождаться в процессе некроза клетки, или активно секретироваться в везикулярные структуры (например, экзосомы). Эти микро. РНК стабильны в биологических жидкостях, таких как моча, сыворотка и плазма крови. Показано, что уровни mi. R-192 и mi. R-21 в сыворотке больных могут быть биомаркерами холангиокарциномы, индуцированной O. viverrini. 14
• микро. РНК обладают большим потенциалом в качестве терапевтических и диагностических мишеней для контроля паразитарных заболеваний человека и животных. Например, показано, что изменения профиля микро. РНК строго связаны с субтипами внутрипеченочной холангиокарциномы. Большое внимание привлекают недавно обнаруженные микро. РНК, циркулирующие вне клеток, которые при болезнях печени могут пассивно высвобождаться в процессе некроза клетки, или активно секретироваться в везикулярные структуры (например, экзосомы). Эти микро. РНК стабильны в биологических жидкостях, таких как моча, сыворотка и плазма крови. Показано, что уровни mi. R-192 и mi. R-21 в сыворотке больных могут быть биомаркерами холангиокарциномы, индуцированной O. viverrini. 14
 Лечение • Известно несколько микро. РНК, которые имеют либо повышенную (mi. R-18, mi. R-224), либо пониженную (mi. R-199, mi. R-195, mi. R-200 и mi. R-125) экспрессию при раке печени человека. Одним из наиболее изученных и интересных в плане диагностики и лечения видом микро. РНК являются mi. R-122 является консервативной специфической микро. РНК, составляющей около 70% от клонированных микро. РНК печени взрослых мышей. • Антисенс-опосредованное ингибирование mi. R-122 у мышей приводит к индукции генов, которые, как правило, репрессированы в печени взрослых особей, предполагая, что эта микро. РНК имеет важное значение для поддержания терминально дифференцированной программы экспрессии генов гепатоцитов. Удаление генов mi. R-122 у мышей приводит к гепатостеатозу, гепатиту и развитию опухолей, напоминающих холангиокарциному, а поставки mi. R-122 в холангиокарциному мышей, напротив, существенно ингибируют образование опухолей, предполагая для mi. R-122 важные функции в поддержании гомеостаза печени. 15
Лечение • Известно несколько микро. РНК, которые имеют либо повышенную (mi. R-18, mi. R-224), либо пониженную (mi. R-199, mi. R-195, mi. R-200 и mi. R-125) экспрессию при раке печени человека. Одним из наиболее изученных и интересных в плане диагностики и лечения видом микро. РНК являются mi. R-122 является консервативной специфической микро. РНК, составляющей около 70% от клонированных микро. РНК печени взрослых мышей. • Антисенс-опосредованное ингибирование mi. R-122 у мышей приводит к индукции генов, которые, как правило, репрессированы в печени взрослых особей, предполагая, что эта микро. РНК имеет важное значение для поддержания терминально дифференцированной программы экспрессии генов гепатоцитов. Удаление генов mi. R-122 у мышей приводит к гепатостеатозу, гепатиту и развитию опухолей, напоминающих холангиокарциному, а поставки mi. R-122 в холангиокарциному мышей, напротив, существенно ингибируют образование опухолей, предполагая для mi. R-122 важные функции в поддержании гомеостаза печени. 15
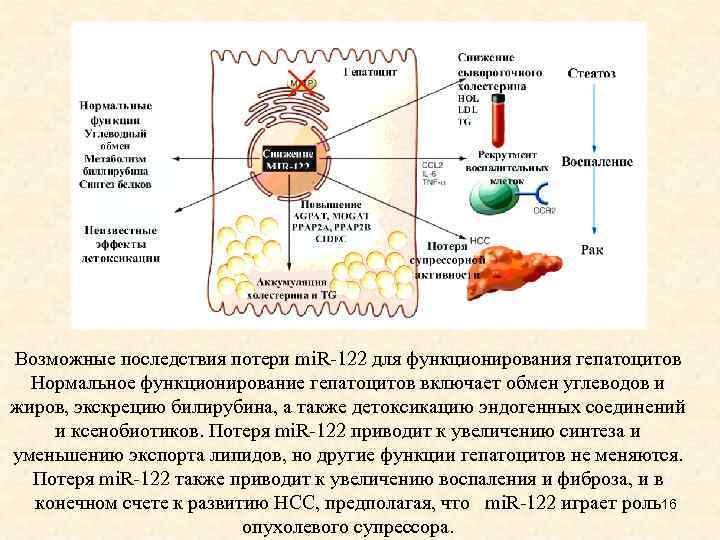 Возможные последствия потери mi. R-122 для функционирования гепатоцитов Нормальное функционирование гепатоцитов включает обмен углеводов и жиров, экскрецию билирубина, а также детоксикацию эндогенных соединений и ксенобиотиков. Потеря mi. R-122 приводит к увеличению синтеза и уменьшению экспорта липидов, но другие функции гепатоцитов не меняются. Потеря mi. R-122 также приводит к увеличению воспаления и фиброза, и в конечном счете к развитию НСС, предполагая, что mi. R-122 играет роль16 опухолевого супрессора.
Возможные последствия потери mi. R-122 для функционирования гепатоцитов Нормальное функционирование гепатоцитов включает обмен углеводов и жиров, экскрецию билирубина, а также детоксикацию эндогенных соединений и ксенобиотиков. Потеря mi. R-122 приводит к увеличению синтеза и уменьшению экспорта липидов, но другие функции гепатоцитов не меняются. Потеря mi. R-122 также приводит к увеличению воспаления и фиброза, и в конечном счете к развитию НСС, предполагая, что mi. R-122 играет роль16 опухолевого супрессора.
 • Примечательно, что mi. R-122 играет неканоническую роль в жизненном цикле вируса гепатита С; через взаимодействие с двумя участками, расположенными на 5'-конце геномной РНК вируса, mi. R-122 выполняет функции, необходимые для его репликации. Внутривенное введение специальных антисенс-mi. R 122 олигонуклеотидов (олигонуклеотидов, комплементарных 5'концу mi. R-122) снижает вирусную нагрузку у HCVинфицированных шимпанзе. Этот терапевтический подход в настоящее время находится на стадии клинических исследований для HCV в организме человека. 17
• Примечательно, что mi. R-122 играет неканоническую роль в жизненном цикле вируса гепатита С; через взаимодействие с двумя участками, расположенными на 5'-конце геномной РНК вируса, mi. R-122 выполняет функции, необходимые для его репликации. Внутривенное введение специальных антисенс-mi. R 122 олигонуклеотидов (олигонуклеотидов, комплементарных 5'концу mi. R-122) снижает вирусную нагрузку у HCVинфицированных шимпанзе. Этот терапевтический подход в настоящее время находится на стадии клинических исследований для HCV в организме человека. 17
 • микро. РНК могут обеспечить новые лекарства, направленные на лечение паразитарных заболеваний. Для этого необходимо разрешить две основных проблемы. • Одна из них заключается в том, что эффект РНК-интерференции, запускаемой эндогенными или экзогенными малыми интерферирующими РНК, является кратковременным и дозозависимым. Различными работами показано, что пик деградации РНК мишени приходится на 36 -48 часов после интродукции малых интерферирующих РНК. Эффект можно продлить повторной доставкой. Количество доставляемых молекул может быть ключевым, так как использование слишком малых или слишком больших доз минимизирует эффект интерференции. Кроме того, синтетические РНК для использования в терапии определенным образом модифицируются, чтобы придать стабильность, эффективность и специфичность, а также, чтобы уменьшить иммуностимулирующие эффекты. • Другая проблема терапии с помощью интерферирующей РНК заключается в необходимости развития эффективных систем прямой доставки малых интерферирующих РНК в ткани-мишени. Следовательно, клиническое использование такой терапии будет зависеть, по крайней мере, частично от наличия безопасных и эффективных систем доставки, которые представляют первостепенную важность для успеха будущей терапии болезней человека, в том числе тех, которые вызваны паразитарными инвазиями. Эффективная доставка включает широкий диапазон стратегий, от инъекций "naked" молекул малых интерферирующих РНК до недавно разработанных систем доставки этих молекул в наночастицах, комплексированных с поликатионами. Так как все эти технологии новые, их продолжают совершенствовать и развивать. 18
• микро. РНК могут обеспечить новые лекарства, направленные на лечение паразитарных заболеваний. Для этого необходимо разрешить две основных проблемы. • Одна из них заключается в том, что эффект РНК-интерференции, запускаемой эндогенными или экзогенными малыми интерферирующими РНК, является кратковременным и дозозависимым. Различными работами показано, что пик деградации РНК мишени приходится на 36 -48 часов после интродукции малых интерферирующих РНК. Эффект можно продлить повторной доставкой. Количество доставляемых молекул может быть ключевым, так как использование слишком малых или слишком больших доз минимизирует эффект интерференции. Кроме того, синтетические РНК для использования в терапии определенным образом модифицируются, чтобы придать стабильность, эффективность и специфичность, а также, чтобы уменьшить иммуностимулирующие эффекты. • Другая проблема терапии с помощью интерферирующей РНК заключается в необходимости развития эффективных систем прямой доставки малых интерферирующих РНК в ткани-мишени. Следовательно, клиническое использование такой терапии будет зависеть, по крайней мере, частично от наличия безопасных и эффективных систем доставки, которые представляют первостепенную важность для успеха будущей терапии болезней человека, в том числе тех, которые вызваны паразитарными инвазиями. Эффективная доставка включает широкий диапазон стратегий, от инъекций "naked" молекул малых интерферирующих РНК до недавно разработанных систем доставки этих молекул в наночастицах, комплексированных с поликатионами. Так как все эти технологии новые, их продолжают совершенствовать и развивать. 18
 • Недавно, чтобы доказать биологическую важность енолазы, был проведен первый эксперимент по сайленсингу гена этого белка у С. sinensis посредством РНК-интерференции. Полагают, что такой подход в будущем найдет применение для идентификации функциональных генов С. sinensis. • Интересно, что нокдаун экспрессии катапсина L и B, опосредованный РНК-интерференцией предохраняет от вновь эксцистированных личинок F. hepatica, а вакцина с катепсином L 1 дает частичную защиту против инфекции этой трематоды и последующего развития патологии. • Выяснение генной регуляции, основанной на микро. РНК, станет весомым вкладом для анализа биологических основ антигенной изменчивости и иммунного уклонения для паразитов, а также разработки антипаразитарных препаратов нового поколения. 19
• Недавно, чтобы доказать биологическую важность енолазы, был проведен первый эксперимент по сайленсингу гена этого белка у С. sinensis посредством РНК-интерференции. Полагают, что такой подход в будущем найдет применение для идентификации функциональных генов С. sinensis. • Интересно, что нокдаун экспрессии катапсина L и B, опосредованный РНК-интерференцией предохраняет от вновь эксцистированных личинок F. hepatica, а вакцина с катепсином L 1 дает частичную защиту против инфекции этой трематоды и последующего развития патологии. • Выяснение генной регуляции, основанной на микро. РНК, станет весомым вкладом для анализа биологических основ антигенной изменчивости и иммунного уклонения для паразитов, а также разработки антипаразитарных препаратов нового поколения. 19
 Механизм РНК-интерференции: терапевтический эффект 20
Механизм РНК-интерференции: терапевтический эффект 20
 Феномен малых РНК Задавшись целью получить сорт петуний, который обладал бы более яркими бордовыми лепестками, генетики ввели в ее клетки ген, отвечающий за синтез красного пигмента. К удивлению ученых, многие цветы, вместо того, чтобы усилить окраску, вовсе теряли пигмент и получались белыми. С этого и других похожих наблюдений, сделанных в начале 90 -х годов, и началась история малых РНК. 21
Феномен малых РНК Задавшись целью получить сорт петуний, который обладал бы более яркими бордовыми лепестками, генетики ввели в ее клетки ген, отвечающий за синтез красного пигмента. К удивлению ученых, многие цветы, вместо того, чтобы усилить окраску, вовсе теряли пигмент и получались белыми. С этого и других похожих наблюдений, сделанных в начале 90 -х годов, и началась история малых РНК. 21
 В другом эксперименте биологи, изучавшие генетическую регуляцию у одного из самых популярных в последнее время модельных организмов – круглого червя Caenorhabditis elegans, пытались усилить работу определенных генов путем введения в клетки червя дополнительных копий таких генов (в виде ДНК). И снова, вместо усиления выраженности (экспрессии) данного гена, ученые наблюдали противоположный эффект: его полное "замолкание". 22
В другом эксперименте биологи, изучавшие генетическую регуляцию у одного из самых популярных в последнее время модельных организмов – круглого червя Caenorhabditis elegans, пытались усилить работу определенных генов путем введения в клетки червя дополнительных копий таких генов (в виде ДНК). И снова, вместо усиления выраженности (экспрессии) данного гена, ученые наблюдали противоположный эффект: его полное "замолкание". 22
 • Длительное время никто не мог объяснить происходившие феномены, рассматривая их как артефакты. И лишь спустя годы удалось установить, что во всех подобных случаях в клетках подопытных организмов появлялись большие количества так называемых "малых" РНК. К еще большему удивлению привело исследование структуры таких молекул. Оказалось, что эти РНК являются копией отдельных участков тех самых генов (ДНК), которые вводились в клетку, и активность которых подавлялась. • Решение парадокса малых РНК началось с детального изучения их структуры, биологических характеристик и путей их превращения (метаболизма) в клетках различных организмов. 23
• Длительное время никто не мог объяснить происходившие феномены, рассматривая их как артефакты. И лишь спустя годы удалось установить, что во всех подобных случаях в клетках подопытных организмов появлялись большие количества так называемых "малых" РНК. К еще большему удивлению привело исследование структуры таких молекул. Оказалось, что эти РНК являются копией отдельных участков тех самых генов (ДНК), которые вводились в клетку, и активность которых подавлялась. • Решение парадокса малых РНК началось с детального изучения их структуры, биологических характеристик и путей их превращения (метаболизма) в клетках различных организмов. 23
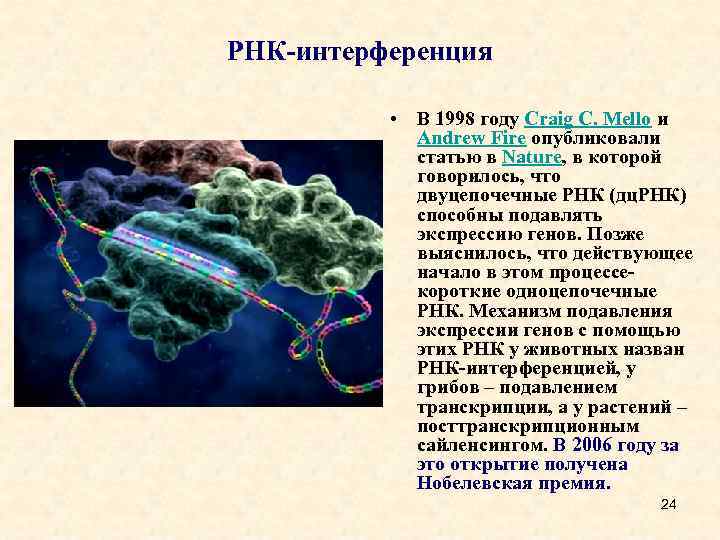 РНК-интерференция • В 1998 году Craig C. Mello и Andrew Fire опубликовали статью в Nature, в которой говорилось, что двуцепочечные РНК (дц. РНК) способны подавлять экспрессию генов. Позже выяснилось, что действующее начало в этом процессе- короткие одноцепочечные РНК. Механизм подавления экспрессии генов с помощью этих РНК у животных назван РНК-интерференцией, у грибов – подавлением транскрипции, а у растений – посттранскрипционным сайленсингом. В 2006 году за это открытие получена Нобелевская премия. 24
РНК-интерференция • В 1998 году Craig C. Mello и Andrew Fire опубликовали статью в Nature, в которой говорилось, что двуцепочечные РНК (дц. РНК) способны подавлять экспрессию генов. Позже выяснилось, что действующее начало в этом процессе- короткие одноцепочечные РНК. Механизм подавления экспрессии генов с помощью этих РНК у животных назван РНК-интерференцией, у грибов – подавлением транскрипции, а у растений – посттранскрипционным сайленсингом. В 2006 году за это открытие получена Нобелевская премия. 24
 • РНК-интерференция - это механизм формирования и наследственной передачи специфического функционального состояния генома. РНК-интерференция обеспечивает возможность появления множественных фенотипов, поскольку связана с изменением обычной экспрессии ядерной ДНК. • Полагают, что первоначально этот механизм мог сформироваться как защита клеток хозяина против внедрения чужеродных генетических последовательностей вирусной природы и транспозонов. • К настоящему времени данный способ регуляции экспрессии генов обнаружен во всех крупных таксонах эукариот, включая вирусы, грибы, растения, позвоночных и беспозвоночных, и даже одного одноклеточного организма - зеленой водоросли Chlamydomonas reinhardtii. 25
• РНК-интерференция - это механизм формирования и наследственной передачи специфического функционального состояния генома. РНК-интерференция обеспечивает возможность появления множественных фенотипов, поскольку связана с изменением обычной экспрессии ядерной ДНК. • Полагают, что первоначально этот механизм мог сформироваться как защита клеток хозяина против внедрения чужеродных генетических последовательностей вирусной природы и транспозонов. • К настоящему времени данный способ регуляции экспрессии генов обнаружен во всех крупных таксонах эукариот, включая вирусы, грибы, растения, позвоночных и беспозвоночных, и даже одного одноклеточного организма - зеленой водоросли Chlamydomonas reinhardtii. 25
 • Малые интерферирующие РНК являются некодирующими одноцепочечными короткими молекулами (21 -26 нуклеотидов длиной). Выделяют два типа этих молекул, отличающихся по происхождению и функциям. • Малые интерферирующие РНК, si. RNA, происходят из протяженной двуцепочечной РНК; обычно запускают интерференцию для деградации матричной РНК (м. РНК), а также модификации хроматина. • Микро. РНК, mi. RNA, образуются в результате двухступенчатого созревания из первичных транскриптов, содержат инвертированные повторы и шпилечные структуры; вызывают трансляционную репрессию, иногда - деградацию м. РНК. 26
• Малые интерферирующие РНК являются некодирующими одноцепочечными короткими молекулами (21 -26 нуклеотидов длиной). Выделяют два типа этих молекул, отличающихся по происхождению и функциям. • Малые интерферирующие РНК, si. RNA, происходят из протяженной двуцепочечной РНК; обычно запускают интерференцию для деградации матричной РНК (м. РНК), а также модификации хроматина. • Микро. РНК, mi. RNA, образуются в результате двухступенчатого созревания из первичных транскриптов, содержат инвертированные повторы и шпилечные структуры; вызывают трансляционную репрессию, иногда - деградацию м. РНК. 26
 • Полагают, что РНК-интерференция являются ключевым механизмом генной регуляции на уровне посттранскрипционного контроля. Это определяет огромные потенциальные перспективы таких молекул, для использования в разных областях медицины и биотехнологии. • В частности, рассматриваются различные стратегии применения РНК-интерференции в борьбе против вируса иммунодефицита человека, для лечения онкологических заболеваний и заболеваний генетической этиологии. В геноме человека обнаружено около 1000 генов микро. РНК, контролирующих работу не менее трети генов и определяющих профиль клеточной дифференцировки или злокачественной трансформации. Изучение роли малых РНК в абиотическом стрессе позволило предположить, что у растений новые виды малых РНК могут быть эволюционным путем адаптации к экстремальным условиям окружающей среды. 27
• Полагают, что РНК-интерференция являются ключевым механизмом генной регуляции на уровне посттранскрипционного контроля. Это определяет огромные потенциальные перспективы таких молекул, для использования в разных областях медицины и биотехнологии. • В частности, рассматриваются различные стратегии применения РНК-интерференции в борьбе против вируса иммунодефицита человека, для лечения онкологических заболеваний и заболеваний генетической этиологии. В геноме человека обнаружено около 1000 генов микро. РНК, контролирующих работу не менее трети генов и определяющих профиль клеточной дифференцировки или злокачественной трансформации. Изучение роли малых РНК в абиотическом стрессе позволило предположить, что у растений новые виды малых РНК могут быть эволюционным путем адаптации к экстремальным условиям окружающей среды. 27
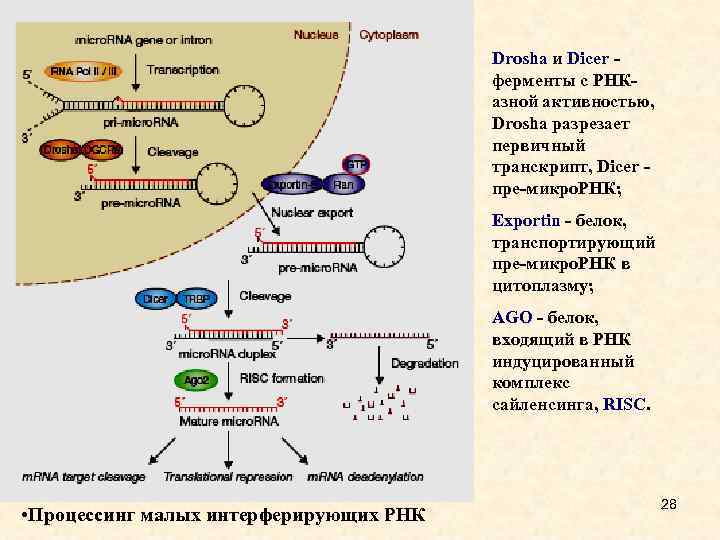 Drosha и Dicer - ферменты с РНКазной активностью, Drosha разрезает первичный транскрипт, Dicer - пре-микро. РНК; Exportin - белок, транспортирующий пре-микро. РНК в цитоплазму; AGO - белок, входящий в РНК индуцированный комплекс сайленсинга, RISC. • Процессинг малых интерферирующих РНК 28
Drosha и Dicer - ферменты с РНКазной активностью, Drosha разрезает первичный транскрипт, Dicer - пре-микро. РНК; Exportin - белок, транспортирующий пре-микро. РНК в цитоплазму; AGO - белок, входящий в РНК индуцированный комплекс сайленсинга, RISC. • Процессинг малых интерферирующих РНК 28
 • Значение открытия интерферирующих РНК • 1. Защита от вирусов • 2. Обеспечивание геномной стабильности через поддержание сайленсинга мобильных элементов • 3. Репрессия белкового синтеза и регуляция развития организма • 4. Конденсация хроматина и супрессия транскрипции • 5. Открытие новых экспериментальных подходов для специфичной репрессии генов • 6. Будущее использование в генной терапии 29
• Значение открытия интерферирующих РНК • 1. Защита от вирусов • 2. Обеспечивание геномной стабильности через поддержание сайленсинга мобильных элементов • 3. Репрессия белкового синтеза и регуляция развития организма • 4. Конденсация хроматина и супрессия транскрипции • 5. Открытие новых экспериментальных подходов для специфичной репрессии генов • 6. Будущее использование в генной терапии 29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
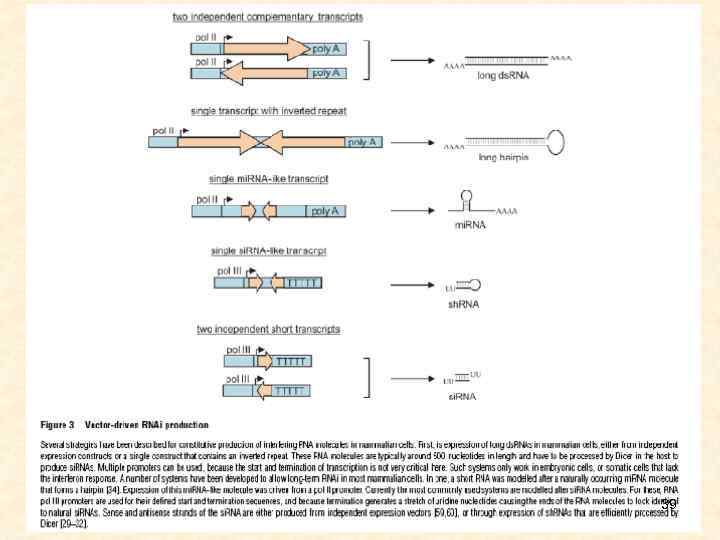 39
39
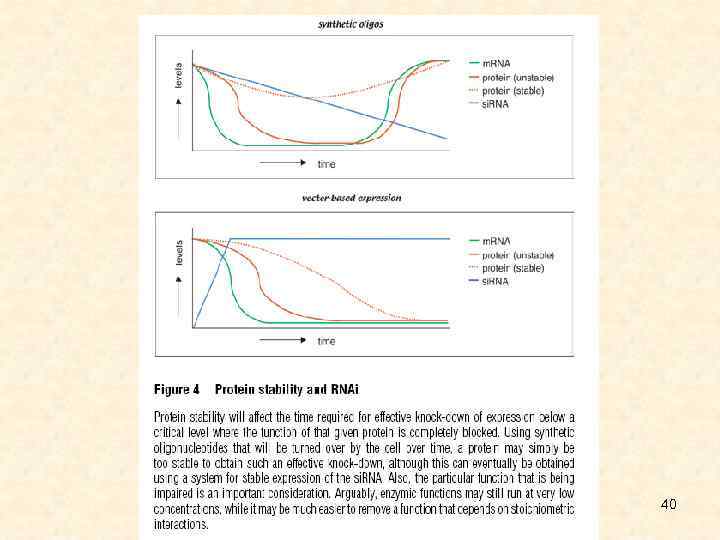 40
40
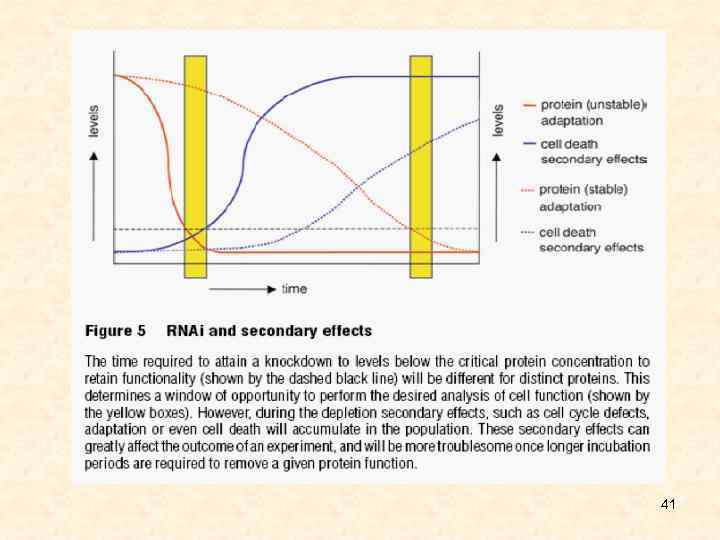 41
41
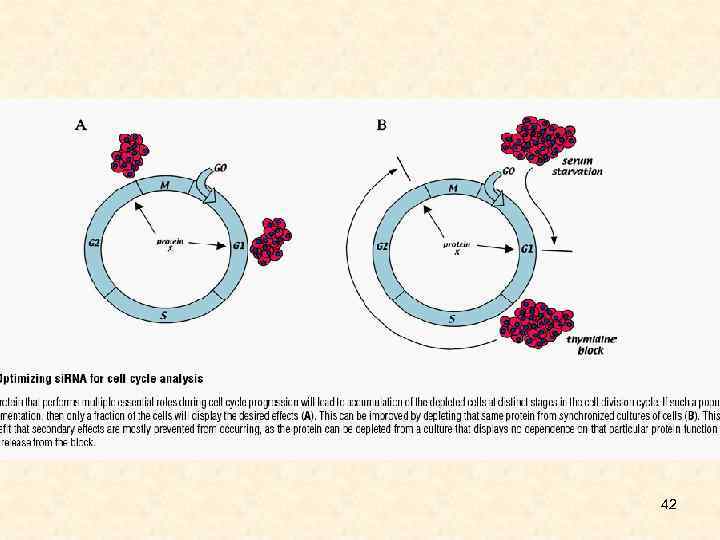 42
42
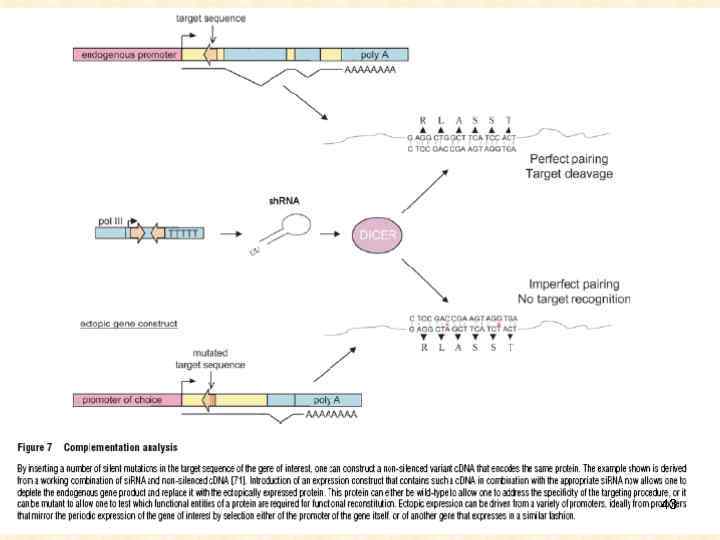 43
43
 44
44
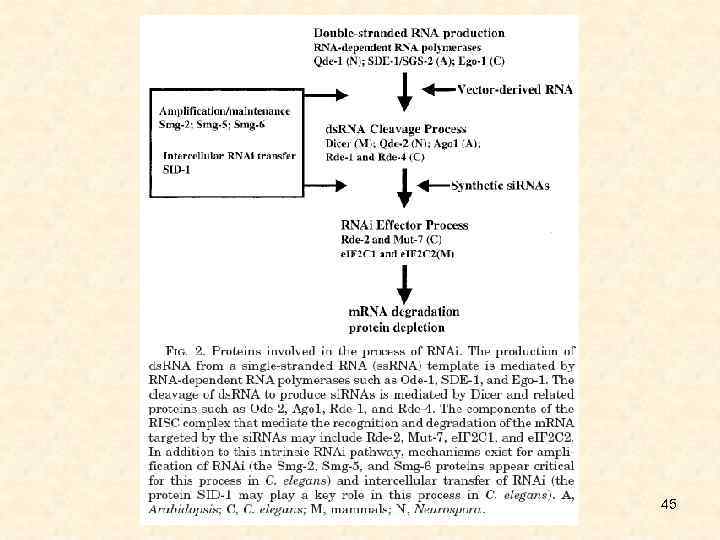 45
45
 46
46
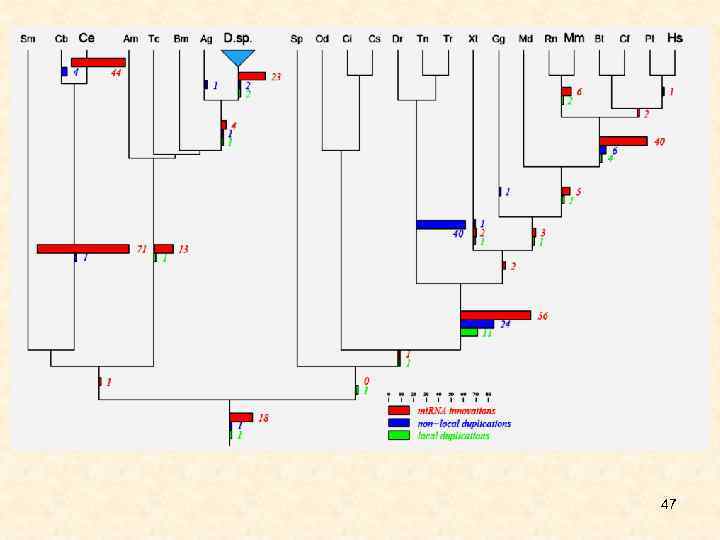 47
47
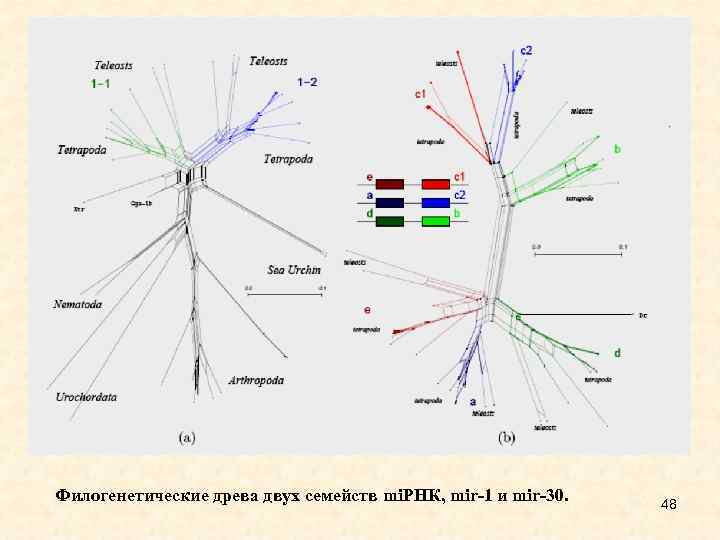 Филогенетические древа двух семейств mi. РНК, mir-1 и mir-30. 48
Филогенетические древа двух семейств mi. РНК, mir-1 и mir-30. 48
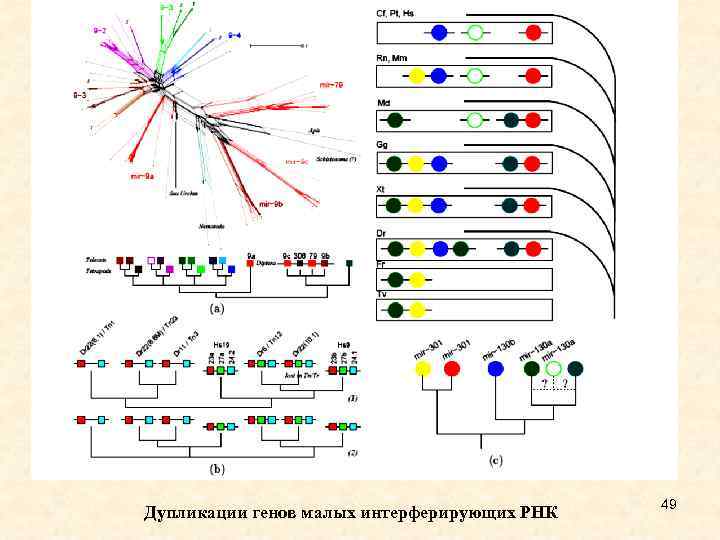 Дупликации генов малых интерферирующих РНК 49
Дупликации генов малых интерферирующих РНК 49
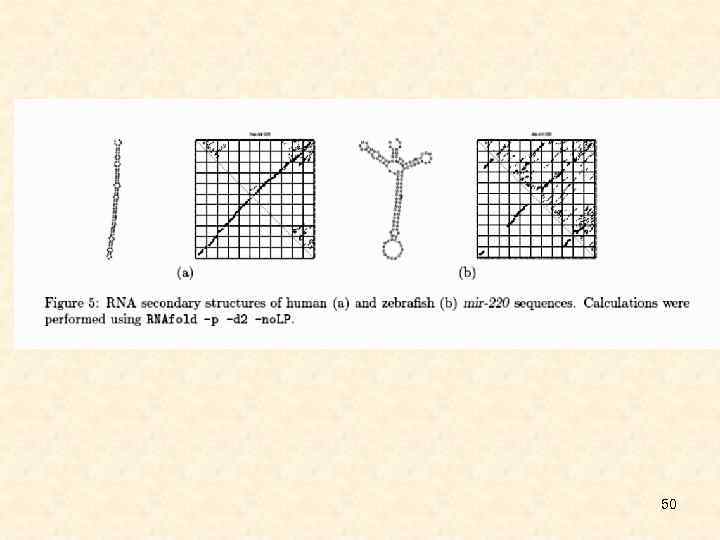 50
50
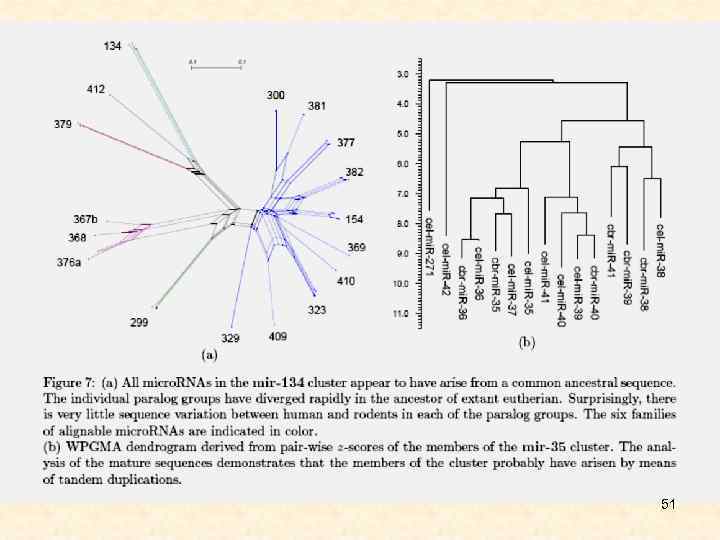 51
51
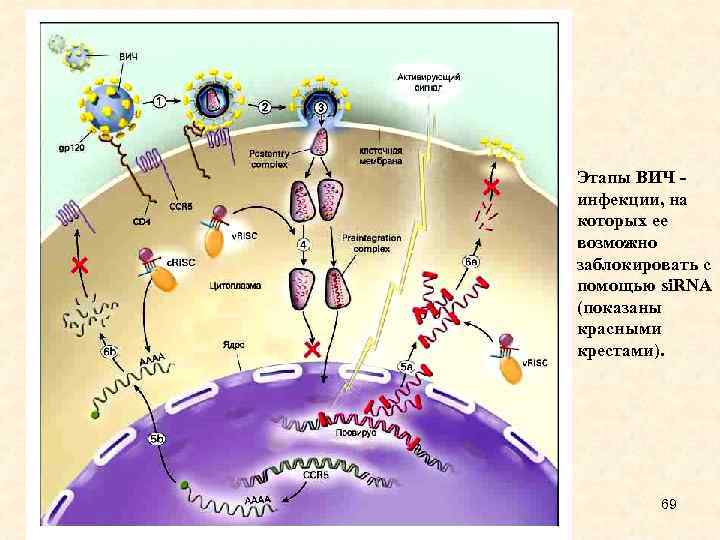
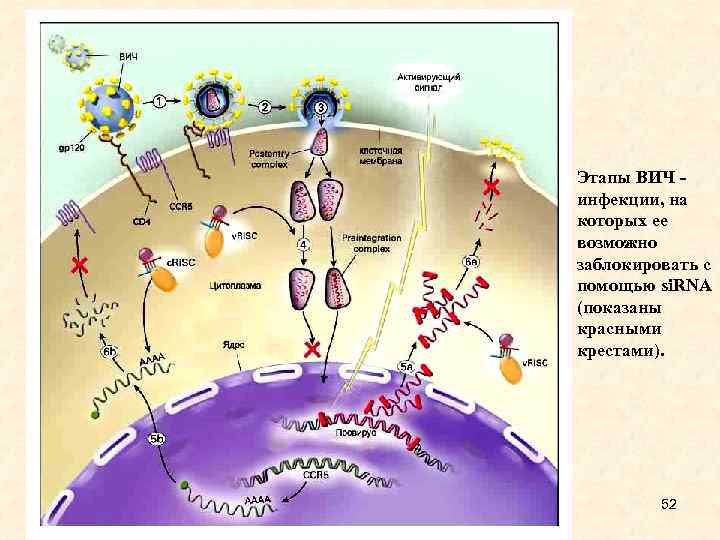 Этапы ВИЧ - инфекции, на которых ее возможно заблокировать с помощью si. RNA (показаны красными крестами). 52
Этапы ВИЧ - инфекции, на которых ее возможно заблокировать с помощью si. RNA (показаны красными крестами). 52
 Старение и канцерогенез • Как и любой эпигенетический фактор, si. RNA влияют на экспрессию генов, которые заставляет "молчать". Сейчас появляются работы, в которых описаны эксперименты по выключению генов, ассоциированных с опухолями. Гены выключают (knock-down) именно с помощью si. RNA. Например, китайские ученые с помощью si. RNA выключили ген транскрипционного фактора 4 (TCF 4), активность которого служит причиной синдрома Pitt-Hopkins (очень редкое генетическое заболевание, характеризующееся умственной отсталостью и эпизодами гипервентиляции и апноэ) и других умственных заболеваний. В данной работе проводилось изучение роли TCF 4 в клетках рака желудка. Эктопическая экспрессия TCF 4 снижает рост клеток в линиях клеток рака желудка, выключение гена TCF 4 с помощью si. RNA повышает миграцию клеток. Таким образом, можно сделать вывод, что эпигенетическое выключение (сайленсинг) гена TCF 4 играет важную роль в образовании и развитии опухоли. 53
Старение и канцерогенез • Как и любой эпигенетический фактор, si. RNA влияют на экспрессию генов, которые заставляет "молчать". Сейчас появляются работы, в которых описаны эксперименты по выключению генов, ассоциированных с опухолями. Гены выключают (knock-down) именно с помощью si. RNA. Например, китайские ученые с помощью si. RNA выключили ген транскрипционного фактора 4 (TCF 4), активность которого служит причиной синдрома Pitt-Hopkins (очень редкое генетическое заболевание, характеризующееся умственной отсталостью и эпизодами гипервентиляции и апноэ) и других умственных заболеваний. В данной работе проводилось изучение роли TCF 4 в клетках рака желудка. Эктопическая экспрессия TCF 4 снижает рост клеток в линиях клеток рака желудка, выключение гена TCF 4 с помощью si. RNA повышает миграцию клеток. Таким образом, можно сделать вывод, что эпигенетическое выключение (сайленсинг) гена TCF 4 играет важную роль в образовании и развитии опухоли. 53
 • Согласно исследованиям si. RNA участвует в выключении гена HDAC 4, что вызывает ингибирование роста раковой опухоли толстой кишки, апоптоз и повышение транскрипции р21. HDAC 4 - это гистоновая деацетилаза, которая является тканеспецифичной, подавляет дифференцировку клеток и ее экспрессия подавлена в процессе дифференцировки клеток. В работе показано, что HDAC 4 является важным регулятором пролиферации клеток толстой кишки (что имеет значение при раковом процессе), а ее в свою очередь регулируют si. RNA. 54
• Согласно исследованиям si. RNA участвует в выключении гена HDAC 4, что вызывает ингибирование роста раковой опухоли толстой кишки, апоптоз и повышение транскрипции р21. HDAC 4 - это гистоновая деацетилаза, которая является тканеспецифичной, подавляет дифференцировку клеток и ее экспрессия подавлена в процессе дифференцировки клеток. В работе показано, что HDAC 4 является важным регулятором пролиферации клеток толстой кишки (что имеет значение при раковом процессе), а ее в свою очередь регулируют si. RNA. 54
 • Существенный недостаток предполагаемой si. RNA - терапии у человека - ее кратковременность. Ведь si. RNA действуют не на сами гены (ДНК), а только лишь на их продукты - м. РНК, и у человека нет той системы усиления сигнала, о которая присуща растениям. Кроме того, двухцепочечные молекулы si. RNA чрезвычайно неустойчивы и недолговечны, поэтому эффект терапии закончится, как только они разрушатся и будут выведены из клетки. Для того, чтобы продлить терапию, придется вводить все новые si. RNA. • Но самым главным препятствием на пути разработки лекарств из si. RNA являются сложности с их доставкой в нужные клетки внутри целого организма (их называют клетками-мишенями). • И все же разработка лекарств, несмотря на всю свою значимость, - не самая главное из предполагаемых "занятий" si. RNA. Самым важным направлением в использовании их свойств считают бурно развивающуюся в последнее время функциональную геномику. После описания геномов многих животных и человека перед наукой встала очередная глобальная задача: выяснить роль каждого гена. Одним из основных инструментов, применяемых генетиками для решения этого вопроса, является "выключение" гена. Действительно, чтобы хотя бы в первом приближении оценить функцию гена, нужно посмотреть, как поведет себя клетка без него, какие биохимические процессы при этом нарушатся. Вот здесь - то si. RNA явились для генетиков неоценимым подарком. Если раньше на поиски удачного способа блокировки гена и приведение его в действие требовалось от нескольких месяцев до года, то с помощью метода si. RNA практически с любым геном любого организма, последовательность нуклеотидов которого известна, эту процедуру можно проделать в 1 -2 недели, при этом значительно повысив специфичность блокирования. 55 •
• Существенный недостаток предполагаемой si. RNA - терапии у человека - ее кратковременность. Ведь si. RNA действуют не на сами гены (ДНК), а только лишь на их продукты - м. РНК, и у человека нет той системы усиления сигнала, о которая присуща растениям. Кроме того, двухцепочечные молекулы si. RNA чрезвычайно неустойчивы и недолговечны, поэтому эффект терапии закончится, как только они разрушатся и будут выведены из клетки. Для того, чтобы продлить терапию, придется вводить все новые si. RNA. • Но самым главным препятствием на пути разработки лекарств из si. RNA являются сложности с их доставкой в нужные клетки внутри целого организма (их называют клетками-мишенями). • И все же разработка лекарств, несмотря на всю свою значимость, - не самая главное из предполагаемых "занятий" si. RNA. Самым важным направлением в использовании их свойств считают бурно развивающуюся в последнее время функциональную геномику. После описания геномов многих животных и человека перед наукой встала очередная глобальная задача: выяснить роль каждого гена. Одним из основных инструментов, применяемых генетиками для решения этого вопроса, является "выключение" гена. Действительно, чтобы хотя бы в первом приближении оценить функцию гена, нужно посмотреть, как поведет себя клетка без него, какие биохимические процессы при этом нарушатся. Вот здесь - то si. RNA явились для генетиков неоценимым подарком. Если раньше на поиски удачного способа блокировки гена и приведение его в действие требовалось от нескольких месяцев до года, то с помощью метода si. RNA практически с любым геном любого организма, последовательность нуклеотидов которого известна, эту процедуру можно проделать в 1 -2 недели, при этом значительно повысив специфичность блокирования. 55 •
 • Сложный жизненный цикл паразитических видов требует наличия надежных механизмов обеспечивающих нормальное развитие при постоянном изменении окружающей среды. Функцию посредника между поступающими сигналами и адекватным ответом организма могут выполнять молекулы малых интерферирующих РНК. • За последние двадцать лет сотни таких молекул идентифицированы у Caenorhabditis elegans и других паразитических видов, их функции изучаются, рассматриваются возможности применения этих молекул для лечения паразитарных заболеваний. 56
• Сложный жизненный цикл паразитических видов требует наличия надежных механизмов обеспечивающих нормальное развитие при постоянном изменении окружающей среды. Функцию посредника между поступающими сигналами и адекватным ответом организма могут выполнять молекулы малых интерферирующих РНК. • За последние двадцать лет сотни таких молекул идентифицированы у Caenorhabditis elegans и других паразитических видов, их функции изучаются, рассматриваются возможности применения этих молекул для лечения паразитарных заболеваний. 56
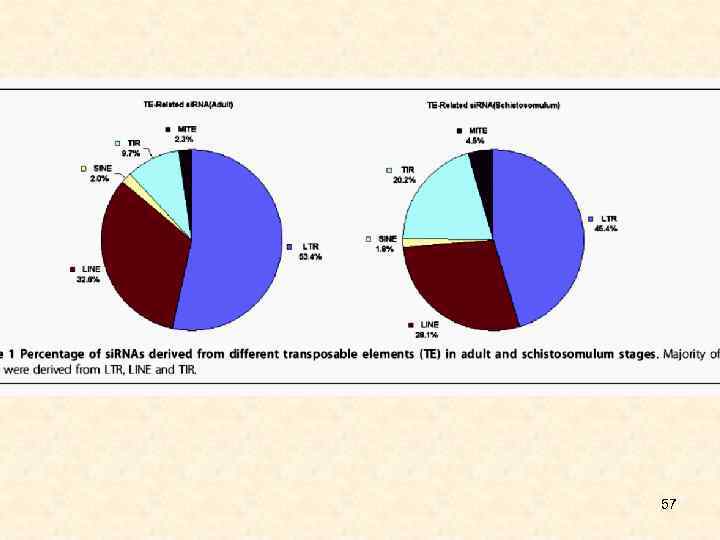 57
57
 • Нерешенные вопросы: • Как осуществляются функции si. RNA, каковы их молекулярные детали? Откуда, например, может появляться та необходимая для запуска реакции РНК - интерференции молекула двухцепочечной РНК? Если она создается в клетке намеренно, то какие ферменты отвечают за ее создание? • Какие свойства сигнализируют о том, что молекула одноцепочечной РНК "не своя" или ошибочная и подлежит уничтожению? • Каковы особенности функционирования системы si. RNA у разных организмов, и почему они возникли именно в таком виде? • Как появляются si. RNA в клетке млекопитающих, у которых пока не выявлены ферменты, ответственные за достраивание второй цепочки si. RNA? 58
• Нерешенные вопросы: • Как осуществляются функции si. RNA, каковы их молекулярные детали? Откуда, например, может появляться та необходимая для запуска реакции РНК - интерференции молекула двухцепочечной РНК? Если она создается в клетке намеренно, то какие ферменты отвечают за ее создание? • Какие свойства сигнализируют о том, что молекула одноцепочечной РНК "не своя" или ошибочная и подлежит уничтожению? • Каковы особенности функционирования системы si. RNA у разных организмов, и почему они возникли именно в таком виде? • Как появляются si. RNA в клетке млекопитающих, у которых пока не выявлены ферменты, ответственные за достраивание второй цепочки si. RNA? 58
 59
59
 60
60
 • Длина si. RNA 21 -25 п. н. , они образуются из дц. РНК. Источником таких РНК могут быть вирусные инфекции, введенные в геном генетические конструкции, длинные шпильки в составе транскриптов и двунаправленная транскрипция мобильных элементов. • дц. РНК нарезаются РНКазой Dicer на фрагменты длиной 21 -25 п. н. с выступающими на 2 нуклеотида 3'-концами, после чего • одна из цепей входит в состав RISC и направляет разрезание гомологичных РНК. В составе RISC присутствуют si. RNA, соответствующие как плюс-, так и минус- цепям дц. РНК. • si. RNA не имеют собственных генов и представляют собой фрагменты более длинных РНК. si. RNA направляют разрезание РНК -мишени, поскольку полностью ей комплементарны. • У растений, грибов и нематод в процесс подавления экспрессии генов вовлечены РНК-зависимые РНК-полимеразы, для которой si. RNA служат еще и праймерами (затравками для синтеза новой РНК). Образовавшаяся дц. РНК нарезается Dicer, образуются новые si. RNA, которые являются вторичными. Таким образом происходит амплификация сигнала. 61
• Длина si. RNA 21 -25 п. н. , они образуются из дц. РНК. Источником таких РНК могут быть вирусные инфекции, введенные в геном генетические конструкции, длинные шпильки в составе транскриптов и двунаправленная транскрипция мобильных элементов. • дц. РНК нарезаются РНКазой Dicer на фрагменты длиной 21 -25 п. н. с выступающими на 2 нуклеотида 3'-концами, после чего • одна из цепей входит в состав RISC и направляет разрезание гомологичных РНК. В составе RISC присутствуют si. RNA, соответствующие как плюс-, так и минус- цепям дц. РНК. • si. RNA не имеют собственных генов и представляют собой фрагменты более длинных РНК. si. RNA направляют разрезание РНК -мишени, поскольку полностью ей комплементарны. • У растений, грибов и нематод в процесс подавления экспрессии генов вовлечены РНК-зависимые РНК-полимеразы, для которой si. RNA служат еще и праймерами (затравками для синтеза новой РНК). Образовавшаяся дц. РНК нарезается Dicer, образуются новые si. RNA, которые являются вторичными. Таким образом происходит амплификация сигнала. 61
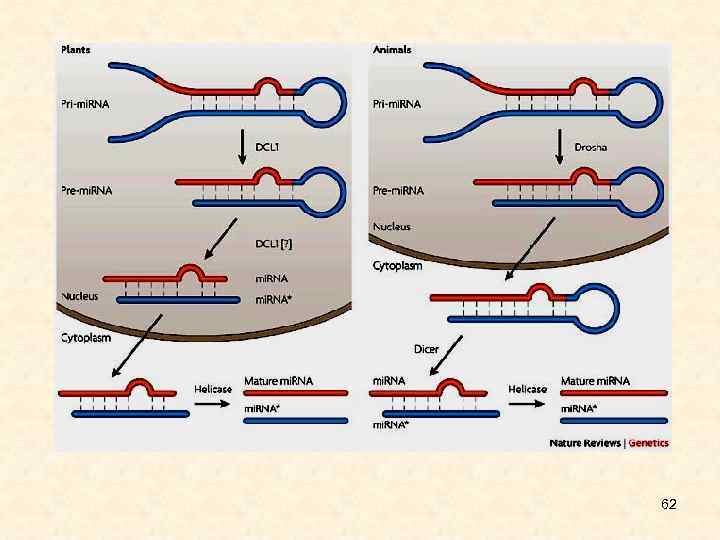 62
62
 • Геном некоторых из вирусов состоит из ДНК, у некоторых же - из РНК, причем, РНК у вирусов может быть как одно-, так и двуцепочечной. Сам процесс разрезания чужеродной (вирусной) м. РНК в этом случае происходит так же, как было описано выше, то есть путем активации комплекса ферментов RISC. Однако для большей эффективности растения и насекомые изобрели своеобразный путь усиления защитного действия si. RNA. Присоединяясь к цепи м. РНК, участок si. RNA может с помощью комплекса ферментов DICER сначала достроить вторую цепочку м. РНК, а затем разрезать ее в разных местах, создавая таким образом разнообразные "вторичные" si. RNA. Они, в свою очередь, формируют RISC и проводят м. РНК через все стадии, о которых шла речь выше, вплоть до ее полного уничтожения. Такие "вторичные" молекулы смогут специфично связываться не только с тем участком вирусной м. РНК, к которому была направлена "первичная" молекула, но также и с другими участками, что резко усиливает эффективность клеточной защиты. Таким образом, у растений и низших животных организмов si. RNA являются важным звеном своеобразного "внутриклеточного иммунитета ", позволяющего распознавать и быстро уничтожать чужую РНК. В том случае, если в клетку проник РНК - содержащий вирус, такая система защиты не даст ему размножиться. Если же вирус содержит ДНК, система si. RNA будет мешать ему производить вирусные белки (так как необходимая для этого м. РНК будет распознаваться и разрезаться), и с помощью этой стратегии замедлит его распространение по организму. 63
• Геном некоторых из вирусов состоит из ДНК, у некоторых же - из РНК, причем, РНК у вирусов может быть как одно-, так и двуцепочечной. Сам процесс разрезания чужеродной (вирусной) м. РНК в этом случае происходит так же, как было описано выше, то есть путем активации комплекса ферментов RISC. Однако для большей эффективности растения и насекомые изобрели своеобразный путь усиления защитного действия si. RNA. Присоединяясь к цепи м. РНК, участок si. RNA может с помощью комплекса ферментов DICER сначала достроить вторую цепочку м. РНК, а затем разрезать ее в разных местах, создавая таким образом разнообразные "вторичные" si. RNA. Они, в свою очередь, формируют RISC и проводят м. РНК через все стадии, о которых шла речь выше, вплоть до ее полного уничтожения. Такие "вторичные" молекулы смогут специфично связываться не только с тем участком вирусной м. РНК, к которому была направлена "первичная" молекула, но также и с другими участками, что резко усиливает эффективность клеточной защиты. Таким образом, у растений и низших животных организмов si. RNA являются важным звеном своеобразного "внутриклеточного иммунитета ", позволяющего распознавать и быстро уничтожать чужую РНК. В том случае, если в клетку проник РНК - содержащий вирус, такая система защиты не даст ему размножиться. Если же вирус содержит ДНК, система si. RNA будет мешать ему производить вирусные белки (так как необходимая для этого м. РНК будет распознаваться и разрезаться), и с помощью этой стратегии замедлит его распространение по организму. 63
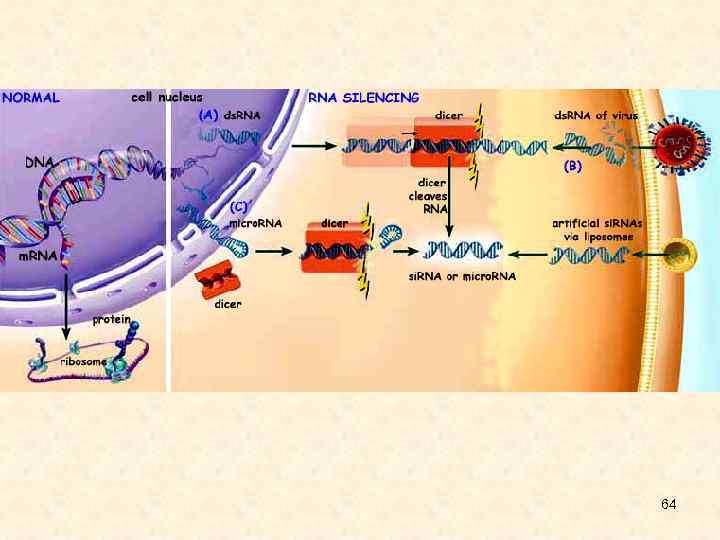 64
64
 • У млекопитающих же, в отличие от насекомых и растений, работает и другая система защиты. При попадании в "зрелую" (дифференцированную) клетку млекопитающего чужой РНК, длина которой больше 30 п. н. , клетка начинает синтез интерферона. Интерферон, связываясь со специфическими рецепторами на клеточной поверхности, способен стимулировать в клетке целую группу генов. В результате в клетке синтезируется несколько видов ферментов, которые тормозят синтез белков и расщепляют вирусные РНК. Кроме того, интерферон может действовать и на соседние, еще не зараженные клетки, блокируя тем самым возможное распространение вируса. Как можно заметить, обе системы во многом схожи: у них общая цель и "методы" работы. Даже сами названия "interferon" и "(RNA) interference" происходят от общего корня. Но есть у них и одно очень существенное различие: если интерферон при первых признаках вторжения просто "замораживает" работу клетки, не позволяя (на всякий случай) производство многих, в том числе и "невиновных" белков в клетке, то система si. RNA отличается чрезвычайной разборчивостью: каждая si. RNA будет распознавать и уничтожать только свою, специфическую м. РНК. Замена всего лишь одного нуклеотида внутри si. RNA ведет к резкому снижению эффекта интерференции. Ни один из блокаторов генов, известных до сих пор, не обладает такой исключительной специфичностью по отношению к своему гену-мишени. 65
• У млекопитающих же, в отличие от насекомых и растений, работает и другая система защиты. При попадании в "зрелую" (дифференцированную) клетку млекопитающего чужой РНК, длина которой больше 30 п. н. , клетка начинает синтез интерферона. Интерферон, связываясь со специфическими рецепторами на клеточной поверхности, способен стимулировать в клетке целую группу генов. В результате в клетке синтезируется несколько видов ферментов, которые тормозят синтез белков и расщепляют вирусные РНК. Кроме того, интерферон может действовать и на соседние, еще не зараженные клетки, блокируя тем самым возможное распространение вируса. Как можно заметить, обе системы во многом схожи: у них общая цель и "методы" работы. Даже сами названия "interferon" и "(RNA) interference" происходят от общего корня. Но есть у них и одно очень существенное различие: если интерферон при первых признаках вторжения просто "замораживает" работу клетки, не позволяя (на всякий случай) производство многих, в том числе и "невиновных" белков в клетке, то система si. RNA отличается чрезвычайной разборчивостью: каждая si. RNA будет распознавать и уничтожать только свою, специфическую м. РНК. Замена всего лишь одного нуклеотида внутри si. RNA ведет к резкому снижению эффекта интерференции. Ни один из блокаторов генов, известных до сих пор, не обладает такой исключительной специфичностью по отношению к своему гену-мишени. 65
 • Открытие РНК-интерференции дало новую надежду в борьбе со СПИДом и онкологическими заболеваниями. Возможно, применяя терапию si. RNA вместе с традиционной антивирусной терапией, можно достичь эффекта потенцирования, когда два воздействия приводят к более выраженному лечебному эффекту, чем простая сумма каждого из них, применяемого по отдельности. Для того, чтобы использовать механизм si. RNA - интерференции в клетках млекопитающих, внутрь клеток нужно ввести уже готовые двухцепочечные молекулы si. RNA. Оптимальный размер таких синтетических si. RNA при этом составляет те же 21 -28 нуклеотидов. Если увеличить ее длину - клетки ответят выработкой интерферона и снижением синтеза белка. Синтетические si. RNA могут попасть как в зараженные, так и в здоровые клетки, и снижение выработки белков в незараженных клетках будет крайне нежелательным. С другой стороны, если попытаться применять si. RNA меньшие, чем 21 нуклеотид, резко снижается специфичность ее связывания с нужной м. РНК и способность к формированию комплекса RISC. 66
• Открытие РНК-интерференции дало новую надежду в борьбе со СПИДом и онкологическими заболеваниями. Возможно, применяя терапию si. RNA вместе с традиционной антивирусной терапией, можно достичь эффекта потенцирования, когда два воздействия приводят к более выраженному лечебному эффекту, чем простая сумма каждого из них, применяемого по отдельности. Для того, чтобы использовать механизм si. RNA - интерференции в клетках млекопитающих, внутрь клеток нужно ввести уже готовые двухцепочечные молекулы si. RNA. Оптимальный размер таких синтетических si. RNA при этом составляет те же 21 -28 нуклеотидов. Если увеличить ее длину - клетки ответят выработкой интерферона и снижением синтеза белка. Синтетические si. RNA могут попасть как в зараженные, так и в здоровые клетки, и снижение выработки белков в незараженных клетках будет крайне нежелательным. С другой стороны, если попытаться применять si. RNA меньшие, чем 21 нуклеотид, резко снижается специфичность ее связывания с нужной м. РНК и способность к формированию комплекса RISC. 66
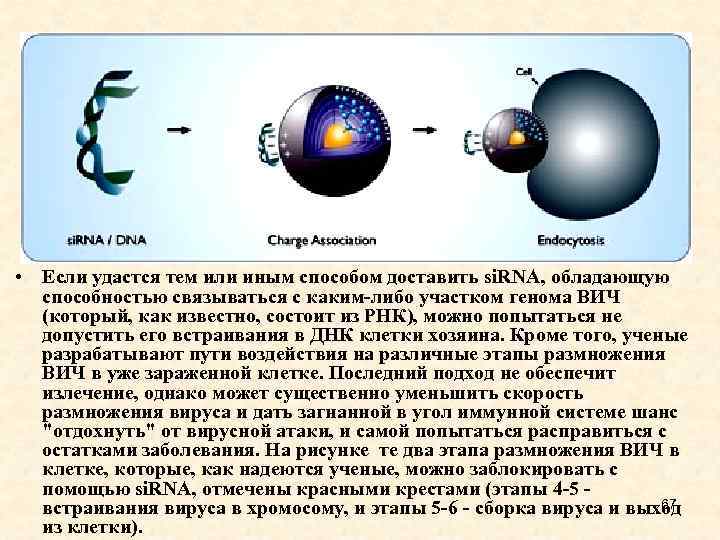 • Если удастся тем или иным способом доставить si. RNA, обладающую способностью связываться с каким-либо участком генома ВИЧ (который, как известно, состоит из РНК), можно попытаться не допустить его встраивания в ДНК клетки хозяина. Кроме того, ученые разрабатывают пути воздействия на различные этапы размножения ВИЧ в уже зараженной клетке. Последний подход не обеспечит излечение, однако может существенно уменьшить скорость размножения вируса и дать загнанной в угол иммунной системе шанс "отдохнуть" от вирусной атаки, и самой попытаться расправиться с остатками заболевания. На рисунке те два этапа размножения ВИЧ в клетке, которые, как надеются ученые, можно заблокировать с помощью si. RNA, отмечены красными крестами (этапы 4 -5 - 67 встраивания вируса в хромосому, и этапы 5 -6 - сборка вируса и выход из клетки).
• Если удастся тем или иным способом доставить si. RNA, обладающую способностью связываться с каким-либо участком генома ВИЧ (который, как известно, состоит из РНК), можно попытаться не допустить его встраивания в ДНК клетки хозяина. Кроме того, ученые разрабатывают пути воздействия на различные этапы размножения ВИЧ в уже зараженной клетке. Последний подход не обеспечит излечение, однако может существенно уменьшить скорость размножения вируса и дать загнанной в угол иммунной системе шанс "отдохнуть" от вирусной атаки, и самой попытаться расправиться с остатками заболевания. На рисунке те два этапа размножения ВИЧ в клетке, которые, как надеются ученые, можно заблокировать с помощью si. RNA, отмечены красными крестами (этапы 4 -5 - 67 встраивания вируса в хромосому, и этапы 5 -6 - сборка вируса и выход из клетки).
 • На сегодняшний день, правда, все вышесказанное относится лишь к области теории. На практике терапия si. RNA встречается с затруднениями, обойти которые ученым пока не удается. Например, в случае антивирусной терапии именно высокая специфичность si. RNA может сыграть злую шутку: как известно, вирусы обладают способностью быстро мутировать, т. е. изменять состав своих нуклеотидов. Особенно преуспел в этом ВИЧ, частота изменений которого такова, что у человека, заразившегося одним подтипом вируса, через несколько лет может быть выделен абсолютно непохожий на него подтип. В этом случае измененный штамм ВИЧ автоматически станет нечувствительным к si. RNA, подобранной в начале терапии. 68
• На сегодняшний день, правда, все вышесказанное относится лишь к области теории. На практике терапия si. RNA встречается с затруднениями, обойти которые ученым пока не удается. Например, в случае антивирусной терапии именно высокая специфичность si. RNA может сыграть злую шутку: как известно, вирусы обладают способностью быстро мутировать, т. е. изменять состав своих нуклеотидов. Особенно преуспел в этом ВИЧ, частота изменений которого такова, что у человека, заразившегося одним подтипом вируса, через несколько лет может быть выделен абсолютно непохожий на него подтип. В этом случае измененный штамм ВИЧ автоматически станет нечувствительным к si. RNA, подобранной в начале терапии. 68
 Этапы ВИЧ - инфекции, на которых ее возможно заблокировать с помощью si. RNA (показаны красными крестами). 69
Этапы ВИЧ - инфекции, на которых ее возможно заблокировать с помощью si. RNA (показаны красными крестами). 69
 Старение и канцерогенез • Как и любой эпигенетический фактор, si. RNA влияют на экспрессию генов, которые заставляет "молчать". Сейчас появляются работы, в которых описаны эксперименты по выключению генов, ассоциированных с опухолями. Гены выключают (knock-down) именно с помощью si. RNA. Например, китайские ученые с помощью si. RNA выключили ген транскрипционного фактора 4 (TCF 4), активность которого служит причиной синдрома Pitt-Hopkins (очень редкое генетическое заболевание, характеризующееся умственной отсталостью и эпизодами гипервентиляции и апноэ) и других умственных заболеваний. В данной работе проводилось изучение роли TCF 4 в клетках рака желудка. Эктопическая экспрессия TCF 4 снижает рост клеток в линиях клеток рака желудка, выключение гена TCF 4 с помощью si. RNA повышает миграцию клеток. Таким образом, можно сделать вывод, что эпигенетическое выключение (сайленсинг) гена TCF 4 играет важную роль в образовании и развитии опухоли. 70
Старение и канцерогенез • Как и любой эпигенетический фактор, si. RNA влияют на экспрессию генов, которые заставляет "молчать". Сейчас появляются работы, в которых описаны эксперименты по выключению генов, ассоциированных с опухолями. Гены выключают (knock-down) именно с помощью si. RNA. Например, китайские ученые с помощью si. RNA выключили ген транскрипционного фактора 4 (TCF 4), активность которого служит причиной синдрома Pitt-Hopkins (очень редкое генетическое заболевание, характеризующееся умственной отсталостью и эпизодами гипервентиляции и апноэ) и других умственных заболеваний. В данной работе проводилось изучение роли TCF 4 в клетках рака желудка. Эктопическая экспрессия TCF 4 снижает рост клеток в линиях клеток рака желудка, выключение гена TCF 4 с помощью si. RNA повышает миграцию клеток. Таким образом, можно сделать вывод, что эпигенетическое выключение (сайленсинг) гена TCF 4 играет важную роль в образовании и развитии опухоли. 70
 • Согласно исследованиям si. RNA участвует в выключении гена HDAC 4, что вызывает ингибирование роста раковой опухоли толстой кишки, апоптоз и повышение транскрипции р21. HDAC 4 - это гистоновая деацетилаза, которая является тканеспецифичной, подавляет дифференцировку клеток и ее экспрессия подавлена в течение процесса дифференцировки клеток. В работе показано, что HDAC 4 является важным регулятором пролиферации клеток толстой кишки (что имеет значение при раковом процессе), а ее в свою очередь регулируют si. RNA. 71
• Согласно исследованиям si. RNA участвует в выключении гена HDAC 4, что вызывает ингибирование роста раковой опухоли толстой кишки, апоптоз и повышение транскрипции р21. HDAC 4 - это гистоновая деацетилаза, которая является тканеспецифичной, подавляет дифференцировку клеток и ее экспрессия подавлена в течение процесса дифференцировки клеток. В работе показано, что HDAC 4 является важным регулятором пролиферации клеток толстой кишки (что имеет значение при раковом процессе), а ее в свою очередь регулируют si. RNA. 71
 • В Японии проводились исследования рака простаты. Репликативное старение клеток- это барьер против неконтролируемого деления и канцерогенеза. Короткоживущие делящиеся клетки (TAC) являются частью популяции клеток простаты, из которой и образуется опухоль. Японские ученые изучали причины, по которым эти клетки преодолевают старение. В клетки простаты в культуре были трасфецированы jun. B si. RNA. В этих клетках наблюдается повышенный уровень экспрессии p 53, p 21, p 16 и p. Rb, выявляемый при старении. Клетки в культуре, которые показали пониженный уровень p 16, использовались для следующего этапа. Повторная трансфекция si. RNA в TAC позволила клеткам избежать старения при инактивации p 16/p. Rb. Кроме того сайленсинг прото-онкогена jun. B с помощью jun. B si. RNA вызывает инвазию клеток. На основании этого был сделан вывод, что jun. B является энхансерным элементом для p 16 и способствует клеточному старению, препятствующему малигнизации (озлокачествлению)TAC. Таким образом, jun. B является регулятором канцерогенеза в простате и может быть целью для терапевтического воздействия. А регулировать его активность можно с помощью si. RNA. 72
• В Японии проводились исследования рака простаты. Репликативное старение клеток- это барьер против неконтролируемого деления и канцерогенеза. Короткоживущие делящиеся клетки (TAC) являются частью популяции клеток простаты, из которой и образуется опухоль. Японские ученые изучали причины, по которым эти клетки преодолевают старение. В клетки простаты в культуре были трасфецированы jun. B si. RNA. В этих клетках наблюдается повышенный уровень экспрессии p 53, p 21, p 16 и p. Rb, выявляемый при старении. Клетки в культуре, которые показали пониженный уровень p 16, использовались для следующего этапа. Повторная трансфекция si. RNA в TAC позволила клеткам избежать старения при инактивации p 16/p. Rb. Кроме того сайленсинг прото-онкогена jun. B с помощью jun. B si. RNA вызывает инвазию клеток. На основании этого был сделан вывод, что jun. B является энхансерным элементом для p 16 и способствует клеточному старению, препятствующему малигнизации (озлокачествлению)TAC. Таким образом, jun. B является регулятором канцерогенеза в простате и может быть целью для терапевтического воздействия. А регулировать его активность можно с помощью si. RNA. 72
 • Подобных исследований проводится огромное множество. В настоящее время si. RNA- это не только объект, но и инструмент в руках исследователя- врача, биолога, онколога, геронтолога. Исследование связи si. RNA с онкологическими заболеваниями, с экспрессией возраст-ассоциированных генов- это важнейшая задача для науки. Прошло совсем немного времени с момента открытия si. RNA, а сколько появилось интересных исследований и публикаций, связанных с ними. Можно не сомневаться, что их изучение станет одним из шагов человечества к победе над раком и старением. . . 73
• Подобных исследований проводится огромное множество. В настоящее время si. RNA- это не только объект, но и инструмент в руках исследователя- врача, биолога, онколога, геронтолога. Исследование связи si. RNA с онкологическими заболеваниями, с экспрессией возраст-ассоциированных генов- это важнейшая задача для науки. Прошло совсем немного времени с момента открытия si. RNA, а сколько появилось интересных исследований и публикаций, связанных с ними. Можно не сомневаться, что их изучение станет одним из шагов человечества к победе над раком и старением. . . 73
 • Science назвал малые РНК самым главным научным достижением 2002 года. В статье С. Григоровича подробно описано современное представление о механизме функционирования малых РНК в клетках, рассматриваются перспективы их применения как новой, весьма эффективной лабораторной методики и как потенциального способа терапии. 74
• Science назвал малые РНК самым главным научным достижением 2002 года. В статье С. Григоровича подробно описано современное представление о механизме функционирования малых РНК в клетках, рассматриваются перспективы их применения как новой, весьма эффективной лабораторной методики и как потенциального способа терапии. 74
 "Иммунная система" внутри клетки • Один из ответов на вопрос о необходимости РНК - интерференции в клетке напрашивается сам собой: с помощью si. RNA клетка может защищать себя от проникновения вирусов. • Присоединяясь к цепи м. РНК, участок si. RNA может с помощью комплекса ферментов, называемого DICER, сначала достроить вторую цепочку м. РНК, а затем разрезать ее в разных местах, создавая таким образом разнообразные "вторичные" si. RNA. Они, в свою очередь, формируют RISC и проводят м. РНК через все стадии, о которых шла речь выше, вплоть до ее полного уничтожения. Такие "вторичные" молекулы смогут специфично связываться не только с тем участком вирусной м. РНК, к которому была направлена "первичная" молекула, но также и с другими участками, что резко усиливает эффективность клеточной защиты. • Таким образом, у растений и низших животных организмов si. RNA являются важным звеном своеобразного "внутриклеточного иммунитета", позволяющего распознавать и быстро уничтожать чужую РНК. В том случае, если в клетку проник РНК - содержащий вирус, такая система защиты не даст ему размножиться. Если же вирус содержит ДНК, система si. RNA будет мешать ему производить вирусные белки (так как необходимая для этого м. РНК будет распознаваться и разрезаться), и с помощью этой стратегии замедлит его распространение по организму. 75
"Иммунная система" внутри клетки • Один из ответов на вопрос о необходимости РНК - интерференции в клетке напрашивается сам собой: с помощью si. RNA клетка может защищать себя от проникновения вирусов. • Присоединяясь к цепи м. РНК, участок si. RNA может с помощью комплекса ферментов, называемого DICER, сначала достроить вторую цепочку м. РНК, а затем разрезать ее в разных местах, создавая таким образом разнообразные "вторичные" si. RNA. Они, в свою очередь, формируют RISC и проводят м. РНК через все стадии, о которых шла речь выше, вплоть до ее полного уничтожения. Такие "вторичные" молекулы смогут специфично связываться не только с тем участком вирусной м. РНК, к которому была направлена "первичная" молекула, но также и с другими участками, что резко усиливает эффективность клеточной защиты. • Таким образом, у растений и низших животных организмов si. RNA являются важным звеном своеобразного "внутриклеточного иммунитета", позволяющего распознавать и быстро уничтожать чужую РНК. В том случае, если в клетку проник РНК - содержащий вирус, такая система защиты не даст ему размножиться. Если же вирус содержит ДНК, система si. RNA будет мешать ему производить вирусные белки (так как необходимая для этого м. РНК будет распознаваться и разрезаться), и с помощью этой стратегии замедлит его распространение по организму. 75
 • У млекопитающих же, в отличие от насекомых и растений, работает и другая система защиты. При попадании в "зрелую" (дифференцированную) клетку млекопитающего чужой РНК, длина которой больше 30 нуклеотидов, клетка начинает синтез интерферона. Интерферон, связываясь со специфическими рецепторами на клеточной поверхности, способен стимулировать в клетке целую группу генов. В результате в клетке синтезируется несколько видов ферментов, которые тормозят синтез белков и расщепляют вирусные РНК. Кроме того, интерферон может действовать и на соседние, еще не зараженные клетки, блокируя тем самым возможное распространение вируса. • Как можно заметить, обе системы во многом схожи: у них общая цель и "методы" работы. Даже сами названия "interferon" и "(RNA) interference" происходят от общего корня. Но есть у них и одно очень существенное различие: если интерферон при первых признаках вторжения просто "замораживает" работу клетки, не позволяя (на всякий случай) производство многих, в том числе и "невиновных" белков в клетке, то система si. RNA отличается чрезвычайной разборчивостью: каждая si. RNA будет распознавать и уничтожать только свою, специфическую м. РНК. Замена всего лишь одного нуклеотида внутри si. RNA ведет к резкому снижению эффекта интерференции. ни один из блокаторов генов, известных до сих пор, не обладает такой исключительной специфичностью по отношению к своему гену-мишени. • • о si. RNA. Их открытие интересно тем, что дает новую надежду в борьбе с вирусами, в том числе СПИДа, а также с теми, кого подозревают в соучастии при развитии рака. Высокая специфичность и эффективность вкупе с низкой токсичностью будут здесь как нельзя кстати. Как ожидается, применяя терапию si. RNA вместе с традиционной антивирусной терапией, можно достичь эффекта потенцирования, когда два воздействия приводят к более выраженному лечебному эффекту, чем простая сумма каждого из них, применяемого по отдельности. 76
• У млекопитающих же, в отличие от насекомых и растений, работает и другая система защиты. При попадании в "зрелую" (дифференцированную) клетку млекопитающего чужой РНК, длина которой больше 30 нуклеотидов, клетка начинает синтез интерферона. Интерферон, связываясь со специфическими рецепторами на клеточной поверхности, способен стимулировать в клетке целую группу генов. В результате в клетке синтезируется несколько видов ферментов, которые тормозят синтез белков и расщепляют вирусные РНК. Кроме того, интерферон может действовать и на соседние, еще не зараженные клетки, блокируя тем самым возможное распространение вируса. • Как можно заметить, обе системы во многом схожи: у них общая цель и "методы" работы. Даже сами названия "interferon" и "(RNA) interference" происходят от общего корня. Но есть у них и одно очень существенное различие: если интерферон при первых признаках вторжения просто "замораживает" работу клетки, не позволяя (на всякий случай) производство многих, в том числе и "невиновных" белков в клетке, то система si. RNA отличается чрезвычайной разборчивостью: каждая si. RNA будет распознавать и уничтожать только свою, специфическую м. РНК. Замена всего лишь одного нуклеотида внутри si. RNA ведет к резкому снижению эффекта интерференции. ни один из блокаторов генов, известных до сих пор, не обладает такой исключительной специфичностью по отношению к своему гену-мишени. • • о si. RNA. Их открытие интересно тем, что дает новую надежду в борьбе с вирусами, в том числе СПИДа, а также с теми, кого подозревают в соучастии при развитии рака. Высокая специфичность и эффективность вкупе с низкой токсичностью будут здесь как нельзя кстати. Как ожидается, применяя терапию si. RNA вместе с традиционной антивирусной терапией, можно достичь эффекта потенцирования, когда два воздействия приводят к более выраженному лечебному эффекту, чем простая сумма каждого из них, применяемого по отдельности. 76
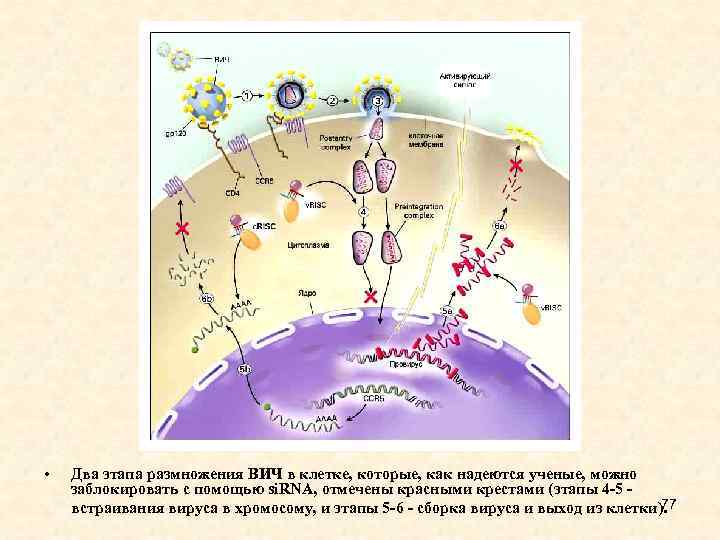 • Два этапа размножения ВИЧ в клетке, которые, как надеются ученые, можно заблокировать с помощью si. RNA, отмечены красными крестами (этапы 4 -5 - 77 встраивания вируса в хромосому, и этапы 5 -6 - сборка вируса и выход из клетки).
• Два этапа размножения ВИЧ в клетке, которые, как надеются ученые, можно заблокировать с помощью si. RNA, отмечены красными крестами (этапы 4 -5 - 77 встраивания вируса в хромосому, и этапы 5 -6 - сборка вируса и выход из клетки).
 • • Они, оказывается, были созданы, чтобы защитить нас. . . от нас самих. Дело в том, что геном любого многоклеточного организма включает в себя множество элементов, которые когда-то были привнесены в него в процессе эволюции извне, например как результат встраивания вируса. Из всего материала, содержащегося в наших хромосомах, 34% приходится на долю элементов, называемых LINEs и SINEs (соответственно, Long и Short Interspersed Nuclear Elements ), о функциях которых известно только то, что они могут по временам копировать себя и перемещаться с одного места хромосомы на другое; те участки ДНК, которые достались нам от ретровирусов (8% генома) и транспозоны (3%) также способны менять свое место в геноме. На их фоне всего лишь 2 (два(!)) процента собственно генов, кодирующих наши клеточные белки, кажутся такой же маловажной деталью, как и si. RNA среди огромного разнообразия своих больших "сестер". • LINEs, SINEs, остатки вирусной ДНК и транспозоны, за свою способность к перемещениям именуемые подвижными, или мобильными элементами генома, представляют значительную опасность для наших хромосом. "Чужие среди своих", они при определенных обстоятельствах могут поднять бунт и привести к внутриклеточному хаосу. Некоторые из них - остатки вирусов, или протоонкогены - способны при "включении" вызывать рак; мобильные элементы, размножаясь и перемещаясь, меняют структуру хромосом, что может привести к мутациям. Например, у плодовой мушки дрозофилы более 80% спонтанных мутаций возникают именно из-за "хулиганского" поведения ее собственных мобильных элементов. Их перемещения внутри генома так индивидуальны и непредсказуемы, что положение некоторых из них может служить "молекулярным паспортом", точно определяющим личность хозяина, что уже используется на практике. • Понятно, что каждому организму необходимо было разработать систему жесткого контроля за поведением мобильных элементов. Как раз эту "надзирательскую" функцию, как полагают ученые, и выполняет система внутриклеточных si. RNA. На модели все того же C. elegans, например, было показано, что отключение генов, кодирующих некоторые из малых РНК, ведет к активизации перемещений мобильных элементов в его хромосомах и, соответственно, к повышению уровня мутаций. 78
• • Они, оказывается, были созданы, чтобы защитить нас. . . от нас самих. Дело в том, что геном любого многоклеточного организма включает в себя множество элементов, которые когда-то были привнесены в него в процессе эволюции извне, например как результат встраивания вируса. Из всего материала, содержащегося в наших хромосомах, 34% приходится на долю элементов, называемых LINEs и SINEs (соответственно, Long и Short Interspersed Nuclear Elements ), о функциях которых известно только то, что они могут по временам копировать себя и перемещаться с одного места хромосомы на другое; те участки ДНК, которые достались нам от ретровирусов (8% генома) и транспозоны (3%) также способны менять свое место в геноме. На их фоне всего лишь 2 (два(!)) процента собственно генов, кодирующих наши клеточные белки, кажутся такой же маловажной деталью, как и si. RNA среди огромного разнообразия своих больших "сестер". • LINEs, SINEs, остатки вирусной ДНК и транспозоны, за свою способность к перемещениям именуемые подвижными, или мобильными элементами генома, представляют значительную опасность для наших хромосом. "Чужие среди своих", они при определенных обстоятельствах могут поднять бунт и привести к внутриклеточному хаосу. Некоторые из них - остатки вирусов, или протоонкогены - способны при "включении" вызывать рак; мобильные элементы, размножаясь и перемещаясь, меняют структуру хромосом, что может привести к мутациям. Например, у плодовой мушки дрозофилы более 80% спонтанных мутаций возникают именно из-за "хулиганского" поведения ее собственных мобильных элементов. Их перемещения внутри генома так индивидуальны и непредсказуемы, что положение некоторых из них может служить "молекулярным паспортом", точно определяющим личность хозяина, что уже используется на практике. • Понятно, что каждому организму необходимо было разработать систему жесткого контроля за поведением мобильных элементов. Как раз эту "надзирательскую" функцию, как полагают ученые, и выполняет система внутриклеточных si. RNA. На модели все того же C. elegans, например, было показано, что отключение генов, кодирующих некоторые из малых РНК, ведет к активизации перемещений мобильных элементов в его хромосомах и, соответственно, к повышению уровня мутаций. 78
 • Кроме того, ошибки в развитии органов и тканей при отключении генов, кодирующих систему si. RNA у подопытных животных, а также ее активность в "незрелых" клетках указывают на то, что механизм РНК - интерференции активно участвует в регуляции программы "созревания" клеток и, как следствие, может играть одну из ключевых ролей в формировании целостного организма. • Еще одна из предполагаемых нормальных функций si. RNA - отслеживание неправильно обработанных копий других типов РНК в клетке. • Наконец, в 2002 году исследователи неожиданно выяснили, что действие si. RNA может не ограничиваться только лишь временным выключением генов не уровне РНК. Имеются показания, что в некоторых случаях si. RNA, видимо, воздействует прямо на ДНК, изменяя структуру хроматина и способствуя длительному "замолканию" одних, и, возможно, активизации других генов. • Как осуществляются все эти функции si. RNA, каковы их молекулярные детали? Откуда, например, может появляться та необходимая для запуска реакции РНК - интерференции молекула двухцепочечной РНК? Если она создается в клетке намеренно, то какие ферменты отвечают за ее создание? Какие свойства сигнализируют о том, что молекула одноцепочечной РНК "не своя" или ошибочная и подлежит уничтожению? Каковы особенности функционирования системы si. RNA у разных организмов, и почему они возникли именно в таком виде? Как появляются si. RNA в клетке млекопитающих, у которых пока не выявлены ферменты, ответственные за достраивание второй цепочки si. RNA? На эти и многие другие вопросы ответов пока нет. • 79
• Кроме того, ошибки в развитии органов и тканей при отключении генов, кодирующих систему si. RNA у подопытных животных, а также ее активность в "незрелых" клетках указывают на то, что механизм РНК - интерференции активно участвует в регуляции программы "созревания" клеток и, как следствие, может играть одну из ключевых ролей в формировании целостного организма. • Еще одна из предполагаемых нормальных функций si. RNA - отслеживание неправильно обработанных копий других типов РНК в клетке. • Наконец, в 2002 году исследователи неожиданно выяснили, что действие si. RNA может не ограничиваться только лишь временным выключением генов не уровне РНК. Имеются показания, что в некоторых случаях si. RNA, видимо, воздействует прямо на ДНК, изменяя структуру хроматина и способствуя длительному "замолканию" одних, и, возможно, активизации других генов. • Как осуществляются все эти функции si. RNA, каковы их молекулярные детали? Откуда, например, может появляться та необходимая для запуска реакции РНК - интерференции молекула двухцепочечной РНК? Если она создается в клетке намеренно, то какие ферменты отвечают за ее создание? Какие свойства сигнализируют о том, что молекула одноцепочечной РНК "не своя" или ошибочная и подлежит уничтожению? Каковы особенности функционирования системы si. RNA у разных организмов, и почему они возникли именно в таком виде? Как появляются si. RNA в клетке млекопитающих, у которых пока не выявлены ферменты, ответственные за достраивание второй цепочки si. RNA? На эти и многие другие вопросы ответов пока нет. • 79
 Вопросы без ответов • Существенный недостаток предполагаемой si. RNA - терапии у человека - ее кратковременность. Ведь si. RNA действуют не на сами гены (ДНК), а только лишь на их продукты - м. РНК, и у человека нет той системы усиления сигнала, о которая присуща растениям. Кроме того, двухцепочечные молекулы si. RNA чрезвычайно неустойчивы и недолговечны, поэтому эффект терапии закончится, как только они разрушатся и будут выведены из клетки. Для того, чтобы продлить терапию, придется вводить все новые si. RNA. • Но самым главным препятствием на пути разработки лекарств из si. RNA являются сложности с их доставкой в нужные клетки внутри целого организма (их называют клетками-мишенями). • И все же разработка лекарств, несмотря на всю свою значимость, - не самая главное из предполагаемых "занятий" si. RNA. Самым важным направлением в использовании их свойств считают бурно развивающуюся в последнее время функциональную геномику. После описания геномов многих животных и человека перед наукой встала очередная глобальная задача: выяснить роль каждого гена. Одним из основных инструментов, применяемых генетиками для решения этого вопроса, является "выключение" гена. Действительно, чтобы хотя бы в первом приближении оценить функцию гена, нужно посмотреть, как поведет себя клетка без него, какие биохимические процессы при этом нарушатся. Вот здесь - то si. RNA явились для генетиков неоценимым подарком. Если раньше на поиски удачного способа блокировки гена и приведение его в действие требовалось от нескольких месяцев до года, то с помощью метода si. RNA практически с любым геном любого организма, последовательность нуклеотидов которого известна, эту процедуру можно проделать в 1 -2 недели, при этом значительно повысив специфичность 80 блокирования. •
Вопросы без ответов • Существенный недостаток предполагаемой si. RNA - терапии у человека - ее кратковременность. Ведь si. RNA действуют не на сами гены (ДНК), а только лишь на их продукты - м. РНК, и у человека нет той системы усиления сигнала, о которая присуща растениям. Кроме того, двухцепочечные молекулы si. RNA чрезвычайно неустойчивы и недолговечны, поэтому эффект терапии закончится, как только они разрушатся и будут выведены из клетки. Для того, чтобы продлить терапию, придется вводить все новые si. RNA. • Но самым главным препятствием на пути разработки лекарств из si. RNA являются сложности с их доставкой в нужные клетки внутри целого организма (их называют клетками-мишенями). • И все же разработка лекарств, несмотря на всю свою значимость, - не самая главное из предполагаемых "занятий" si. RNA. Самым важным направлением в использовании их свойств считают бурно развивающуюся в последнее время функциональную геномику. После описания геномов многих животных и человека перед наукой встала очередная глобальная задача: выяснить роль каждого гена. Одним из основных инструментов, применяемых генетиками для решения этого вопроса, является "выключение" гена. Действительно, чтобы хотя бы в первом приближении оценить функцию гена, нужно посмотреть, как поведет себя клетка без него, какие биохимические процессы при этом нарушатся. Вот здесь - то si. RNA явились для генетиков неоценимым подарком. Если раньше на поиски удачного способа блокировки гена и приведение его в действие требовалось от нескольких месяцев до года, то с помощью метода si. RNA практически с любым геном любого организма, последовательность нуклеотидов которого известна, эту процедуру можно проделать в 1 -2 недели, при этом значительно повысив специфичность 80 блокирования. •
 • Mature micro. RNAs (mi. RNAs) are short (22 -nucleotide), non-coding ss. RNAs that repress m. RNAs post-transcriptionally by binding to partially complementary sites, called mi. RNA binding sites, in their target m. RNAs. In animals, mi. RNA-mediated repression is often relatively weak, whereas transcription-factor-mediated repression can be much stronger. • Mature mi. RNAs are cleaved from 70 -nucleotide hairpin structures, called precursor mi. RNAs (pre-m. RNAs), by the enzyme dicer. Pre-mi. RNAs are in turn excised from a primary mi. RNA (pri-m. RNA) transcript by the enzyme drosha. Pri-mi. RNAs are typically transcribed by RNA polymerase II 104 and seem to possess promoter and enhancer elements that are similar to those of protein-coding genes (for example, Refs 105, 106). They can be thousands of nucleotides long and contain multiple pre-mi. RNAs. In some cases, however, pre-mi. RNAs are contained in introns of protein-coding genes and are excised by the splicing machinery. In metazoans, pre-m. RNAs are exported into the cytoplasm where they are processed into mature mi. RNAs, whereas in plants, mi. RNA maturation occurs within the nucleus. mi. RNAs are grouped into families on the basis of their target recognition motifs (Box 3). • The predominant regulatory effect of mi. RNAs is to repress their target m. RNAs; mechanisms for this include translational repression, m. RNA cleavage, m. RNA deadenylation or alteration of m. RNA stability (reviewed in Ref. 107, 126). mi. RNA-mediated cleavage of m. RNAs seems to be the exception in animals. By contrast, it is believed to be the dominant regulatory mode in plants. DCL 1, dicer-like 1; mi. RNA*, the rapidly decaying strand that is complementary to the mature mi. RNA. 81
• Mature micro. RNAs (mi. RNAs) are short (22 -nucleotide), non-coding ss. RNAs that repress m. RNAs post-transcriptionally by binding to partially complementary sites, called mi. RNA binding sites, in their target m. RNAs. In animals, mi. RNA-mediated repression is often relatively weak, whereas transcription-factor-mediated repression can be much stronger. • Mature mi. RNAs are cleaved from 70 -nucleotide hairpin structures, called precursor mi. RNAs (pre-m. RNAs), by the enzyme dicer. Pre-mi. RNAs are in turn excised from a primary mi. RNA (pri-m. RNA) transcript by the enzyme drosha. Pri-mi. RNAs are typically transcribed by RNA polymerase II 104 and seem to possess promoter and enhancer elements that are similar to those of protein-coding genes (for example, Refs 105, 106). They can be thousands of nucleotides long and contain multiple pre-mi. RNAs. In some cases, however, pre-mi. RNAs are contained in introns of protein-coding genes and are excised by the splicing machinery. In metazoans, pre-m. RNAs are exported into the cytoplasm where they are processed into mature mi. RNAs, whereas in plants, mi. RNA maturation occurs within the nucleus. mi. RNAs are grouped into families on the basis of their target recognition motifs (Box 3). • The predominant regulatory effect of mi. RNAs is to repress their target m. RNAs; mechanisms for this include translational repression, m. RNA cleavage, m. RNA deadenylation or alteration of m. RNA stability (reviewed in Ref. 107, 126). mi. RNA-mediated cleavage of m. RNAs seems to be the exception in animals. By contrast, it is believed to be the dominant regulatory mode in plants. DCL 1, dicer-like 1; mi. RNA*, the rapidly decaying strand that is complementary to the mature mi. RNA. 81
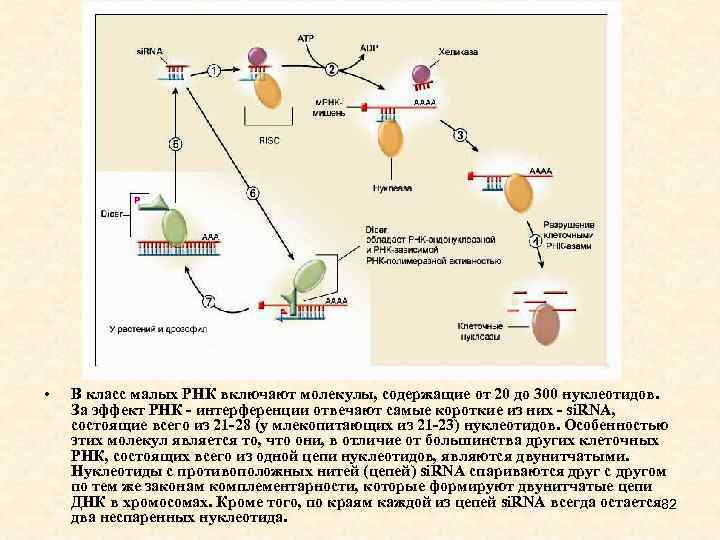 • В класс малых РНК включают молекулы, содержащие от 20 до 300 нуклеотидов. За эффект РНК - интерференции отвечают самые короткие из них - si. RNA, состоящие всего из 21 -28 (у млекопитающих из 21 -23) нуклеотидов. Особенностью этих молекул является то, что они, в отличие от большинства других клеточных РНК, состоящих всего из одной цепи нуклеотидов, являются двунитчатыми. Нуклеотиды с противоположных нитей (цепей) si. RNA спариваются друг с другом по тем же законам комплементарности, которые формируют двунитчатые цепи ДНК в хромосомах. Кроме того, по краям каждой из цепей si. RNA всегда остается 82 два неспаренных нуклеотида.
• В класс малых РНК включают молекулы, содержащие от 20 до 300 нуклеотидов. За эффект РНК - интерференции отвечают самые короткие из них - si. RNA, состоящие всего из 21 -28 (у млекопитающих из 21 -23) нуклеотидов. Особенностью этих молекул является то, что они, в отличие от большинства других клеточных РНК, состоящих всего из одной цепи нуклеотидов, являются двунитчатыми. Нуклеотиды с противоположных нитей (цепей) si. RNA спариваются друг с другом по тем же законам комплементарности, которые формируют двунитчатые цепи ДНК в хромосомах. Кроме того, по краям каждой из цепей si. RNA всегда остается 82 два неспаренных нуклеотида.
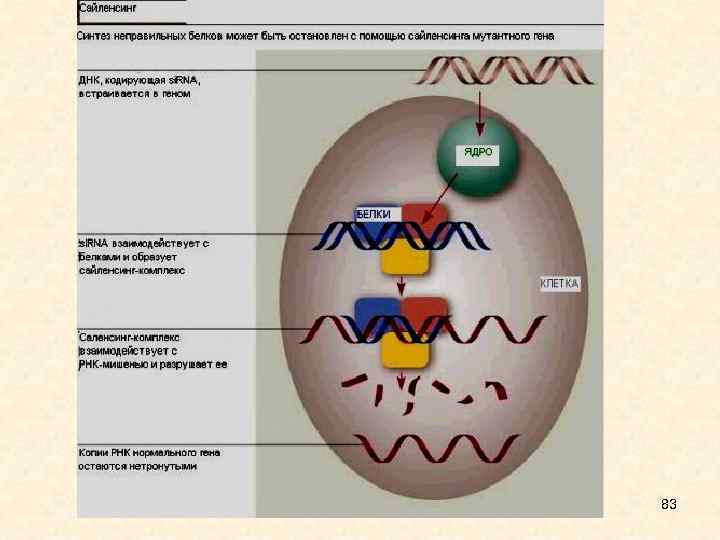 83
83
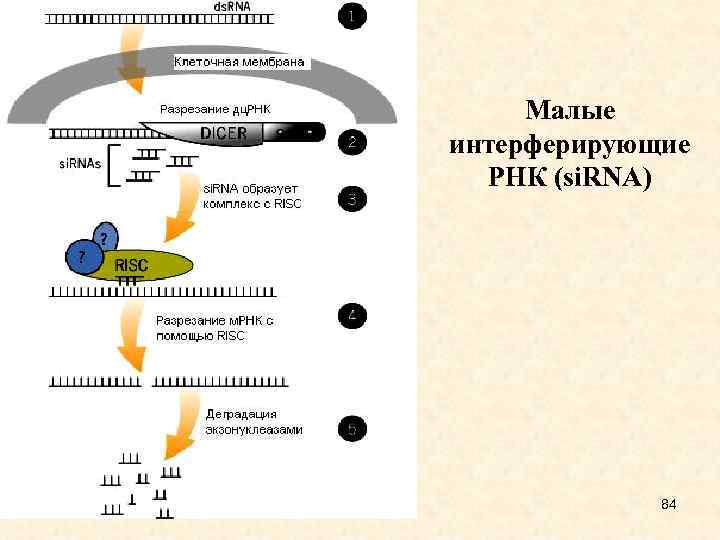 Малые интерферирующие РНК (si. RNA) 84
Малые интерферирующие РНК (si. RNA) 84
 Подавление экспрессии может происходить на уровне транскрипции или посттранскрипционно. Оказалось, что во всех случаях необходим сходный набор белков и короткие (21 -32 п. н. ) РНК. si. RNA регулируют активность генов двумя способами. Они направляют разрезание РНК-мишеней. Это явление получило название "подавление" (quelling) у грибов, "посттрансляционный сайленсинг генов" у растений и "РНК-интерференция" у животных. В этих процессах участвуют si. RNA длиной 21 -23 п. н. Другой тип воздействия- si. RNA способны подавлять транскрипцию генов, содержащих гомологичные si. RNA-последовательности. Это явление было названо транскрипционным сайленсингом генов(TGS) и обнаружено у дрожжей, растений и животных. si. RNA направляют модификации гистонов и метилирование ДНК, что приводит к образованию гетерохроматина и репрессии транскрипции. Лучше всего TGS изучен у дрожжей S. pombe, обнаружено, что у них si. RNA встраиваются в похожий на RISC белковый комплекс, названный RITS. В его случае, как и в случае RISC, si. RNA взаимодействует с белком семейства AGO. Вероятно, si. RNA способна направлять этот комплекс к гену, который содержит гомологичный si. RNA фрагмент. После этого белки RITS рекрутируют метилтрансферазы , в результате чего в локусе, кодирующем ген-мишень si. RNA, формируется гетерохроматин, и активная экспрессия гена прекращается. 85
Подавление экспрессии может происходить на уровне транскрипции или посттранскрипционно. Оказалось, что во всех случаях необходим сходный набор белков и короткие (21 -32 п. н. ) РНК. si. RNA регулируют активность генов двумя способами. Они направляют разрезание РНК-мишеней. Это явление получило название "подавление" (quelling) у грибов, "посттрансляционный сайленсинг генов" у растений и "РНК-интерференция" у животных. В этих процессах участвуют si. RNA длиной 21 -23 п. н. Другой тип воздействия- si. RNA способны подавлять транскрипцию генов, содержащих гомологичные si. RNA-последовательности. Это явление было названо транскрипционным сайленсингом генов(TGS) и обнаружено у дрожжей, растений и животных. si. RNA направляют модификации гистонов и метилирование ДНК, что приводит к образованию гетерохроматина и репрессии транскрипции. Лучше всего TGS изучен у дрожжей S. pombe, обнаружено, что у них si. RNA встраиваются в похожий на RISC белковый комплекс, названный RITS. В его случае, как и в случае RISC, si. RNA взаимодействует с белком семейства AGO. Вероятно, si. RNA способна направлять этот комплекс к гену, который содержит гомологичный si. RNA фрагмент. После этого белки RITS рекрутируют метилтрансферазы , в результате чего в локусе, кодирующем ген-мишень si. RNA, формируется гетерохроматин, и активная экспрессия гена прекращается. 85
 • Понятно, что с первого взгляда малые РНК, состоящие всего из нескольких десятков нуклеотидов, могли показаться просто мусором, остатками от своих "больших братьев". И даже несмотря на то, что роль отдельных малых молекул РНК в процессах превращения информационных РНК (сплайсинге), а также при упаковке нитей нуклеиновых кислот, была доказана ранее, истинным "хитом" в биологии малые РНК стали только лишь с открытием своей способности подавлять экспрессию генов у животных. • Эффект "гашения" экспрессии определенных генов малыми РНК получил название РНК-интерференции, а молекулы, вызывающие его, назвали si. RNA (small interfering Ribo. Nucleic Acids - малые интерферирующие рибонуклеиновые кислоты • С открытием si. RNA - интерференции стало ясно, что этот феномен может иметь огромное практическое значение 86
• Понятно, что с первого взгляда малые РНК, состоящие всего из нескольких десятков нуклеотидов, могли показаться просто мусором, остатками от своих "больших братьев". И даже несмотря на то, что роль отдельных малых молекул РНК в процессах превращения информационных РНК (сплайсинге), а также при упаковке нитей нуклеиновых кислот, была доказана ранее, истинным "хитом" в биологии малые РНК стали только лишь с открытием своей способности подавлять экспрессию генов у животных. • Эффект "гашения" экспрессии определенных генов малыми РНК получил название РНК-интерференции, а молекулы, вызывающие его, назвали si. RNA (small interfering Ribo. Nucleic Acids - малые интерферирующие рибонуклеиновые кислоты • С открытием si. RNA - интерференции стало ясно, что этот феномен может иметь огромное практическое значение 86
 Роль в клеточных процессах • si. RNA вовлечены в защиту клетки от • вирусов, • репрессию трансгенов, • регуляцию некоторых генов и • формирование центромерного гетерохроматина. В 1998 году Craig C. Mello и Andrew Fire опубликовали статью в Nature в которой говорилось, что двуцепочечные РНК (дц. РНК) способны подавлять экспрессию генов. • Важная функция si. RNA-подавление экспрессии мобильных генетических элементов. • Описаны эксперименты по выключению генов, ассоциированных с опухолями. • Такое подавление может происходить как на уровне транскрипции, так и посттранскрипционно. • Эффект "гашения" экспрессии определенных генов малыми РНК получил название РНК-интерференции, а молекулы, вызывающие его, назвали si. RNA (small interfering Ribo. Nucleic Acids - малые интерферирующие рибонуклеиновые кислоты 87
Роль в клеточных процессах • si. RNA вовлечены в защиту клетки от • вирусов, • репрессию трансгенов, • регуляцию некоторых генов и • формирование центромерного гетерохроматина. В 1998 году Craig C. Mello и Andrew Fire опубликовали статью в Nature в которой говорилось, что двуцепочечные РНК (дц. РНК) способны подавлять экспрессию генов. • Важная функция si. RNA-подавление экспрессии мобильных генетических элементов. • Описаны эксперименты по выключению генов, ассоциированных с опухолями. • Такое подавление может происходить как на уровне транскрипции, так и посттранскрипционно. • Эффект "гашения" экспрессии определенных генов малыми РНК получил название РНК-интерференции, а молекулы, вызывающие его, назвали si. RNA (small interfering Ribo. Nucleic Acids - малые интерферирующие рибонуклеиновые кислоты 87
 Роль в клеточных процессах • si. RNA вовлечены в защиту клетки от • вирусов, • репрессию трансгенов, • регуляцию некоторых генов и • формирование центромерного гетерохроматина. • Важная функция si. RNA-подавление экспрессии мобильных генетических элементов. • Описаны эксперименты по выключению генов, ассоциированных с опухолями. • Такое подавление может происходить как на уровне транскрипции, так и посттранскрипционно. 88
Роль в клеточных процессах • si. RNA вовлечены в защиту клетки от • вирусов, • репрессию трансгенов, • регуляцию некоторых генов и • формирование центромерного гетерохроматина. • Важная функция si. RNA-подавление экспрессии мобильных генетических элементов. • Описаны эксперименты по выключению генов, ассоциированных с опухолями. • Такое подавление может происходить как на уровне транскрипции, так и посттранскрипционно. 88
 89
89
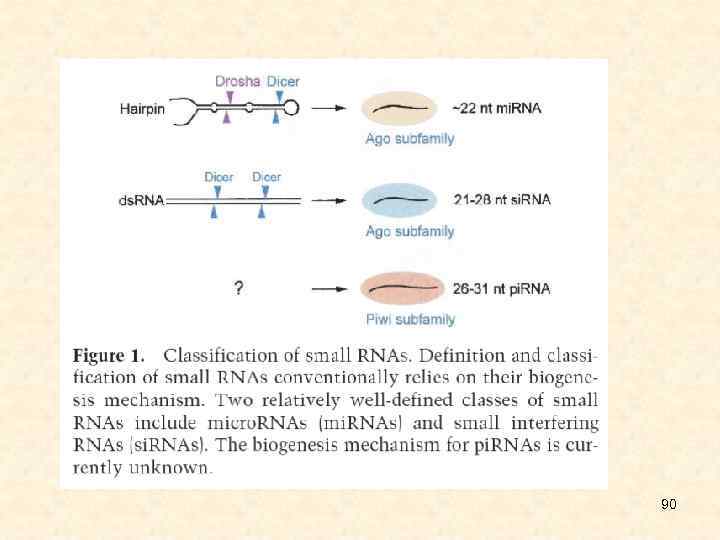 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
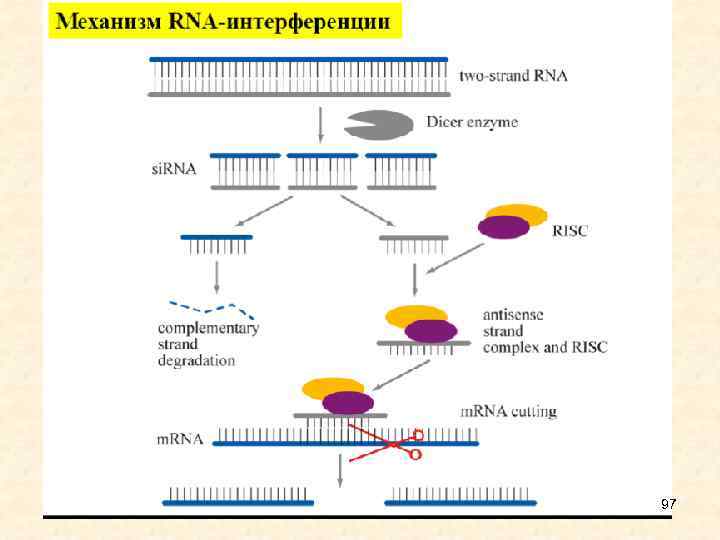 97
97
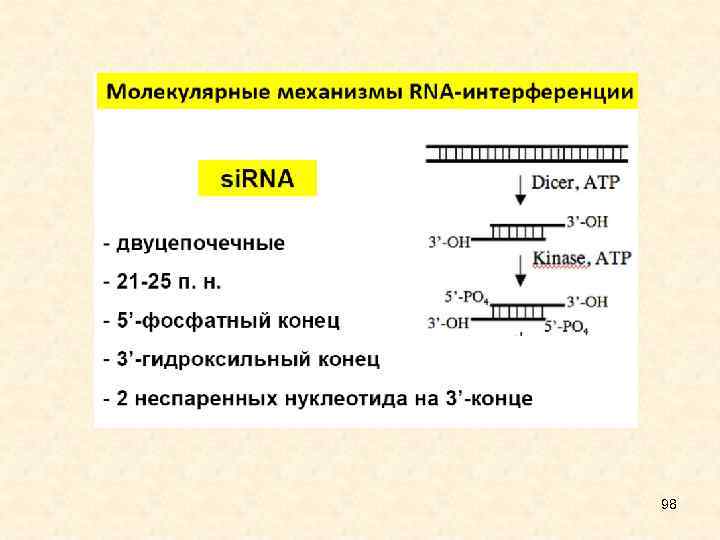 98
98
 99
99
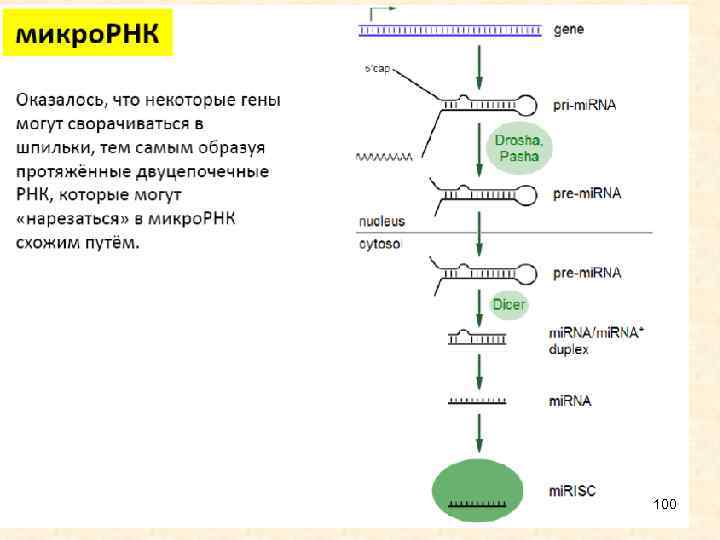 100
100
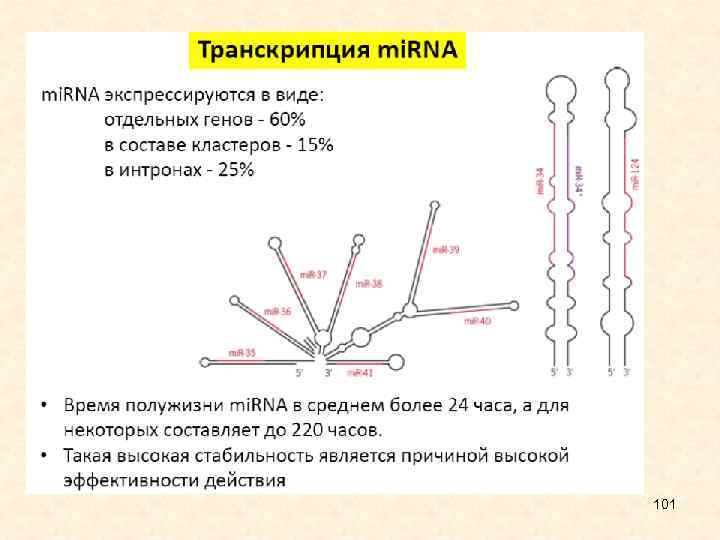 101
101
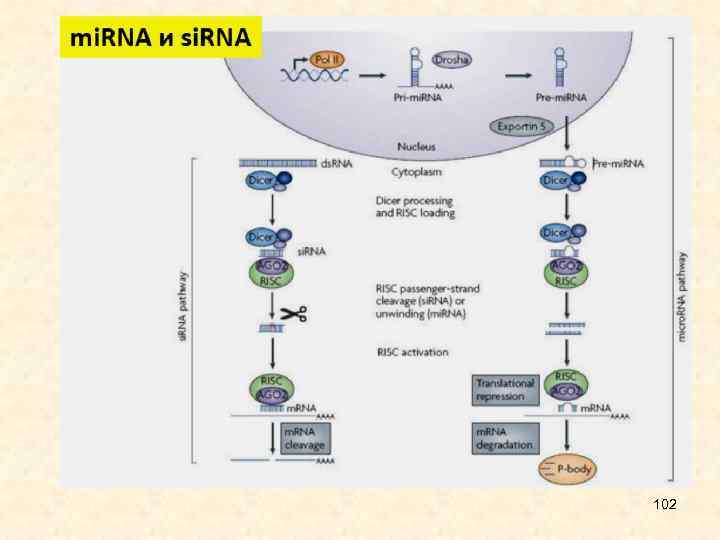 102
102
 103
103
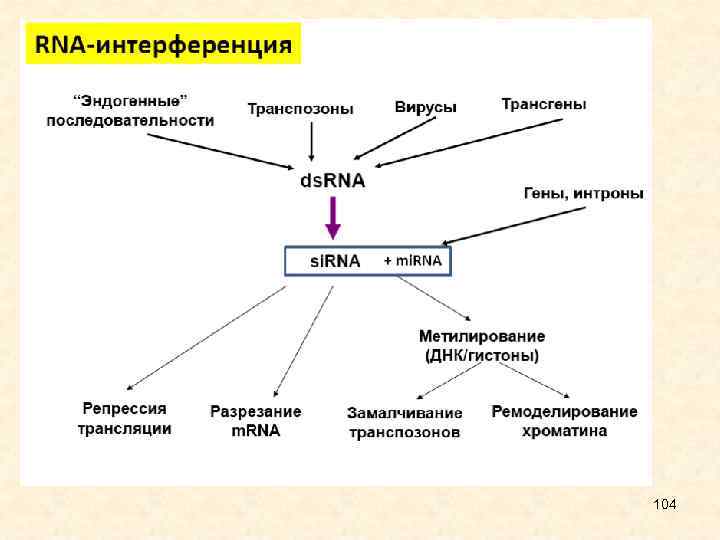 104
104
 105
105
 106
106
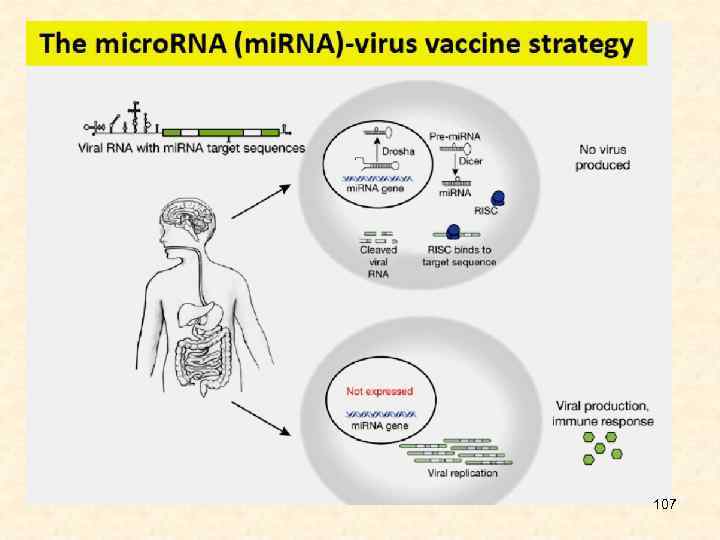 107
107
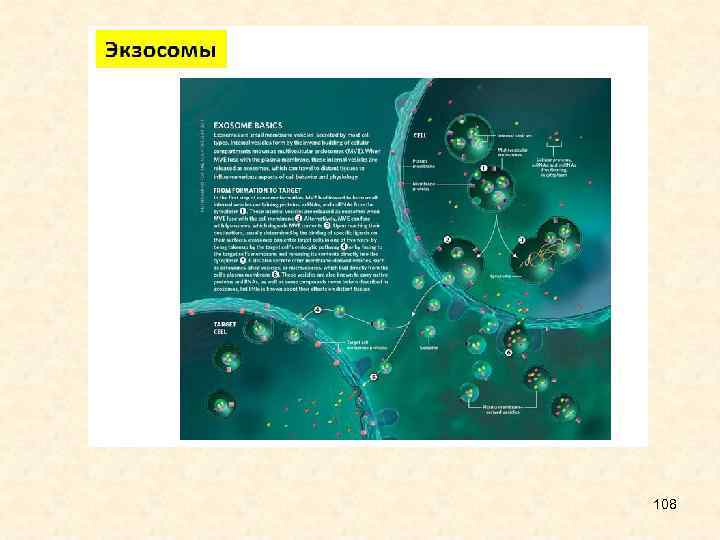 108
108
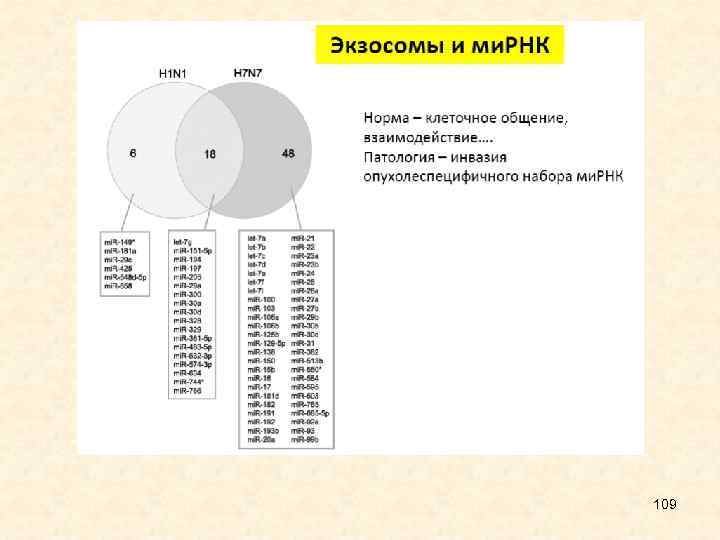 109
109
 110
110
 111
111
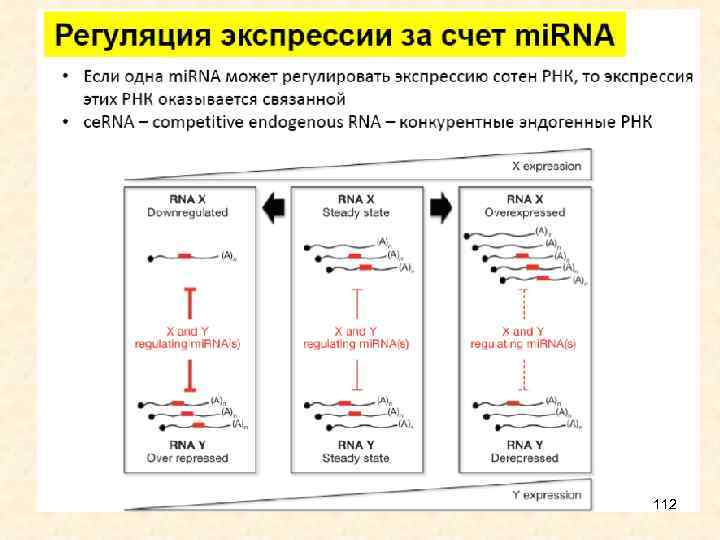 112
112
 113
113
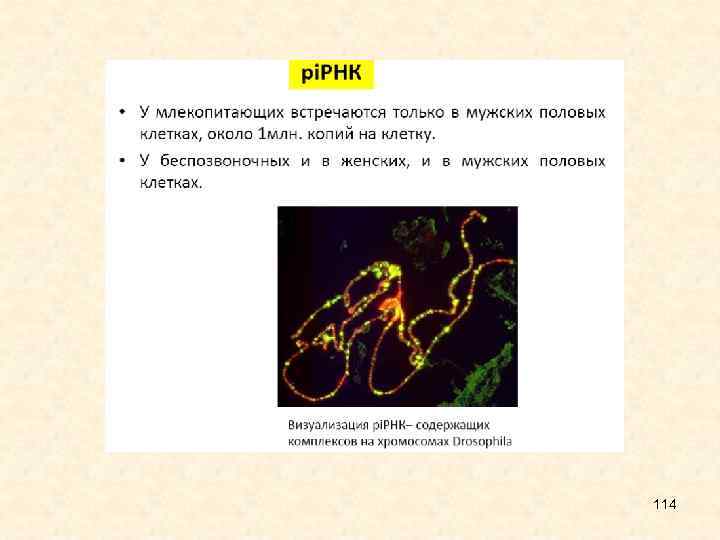 114
114
 115
115
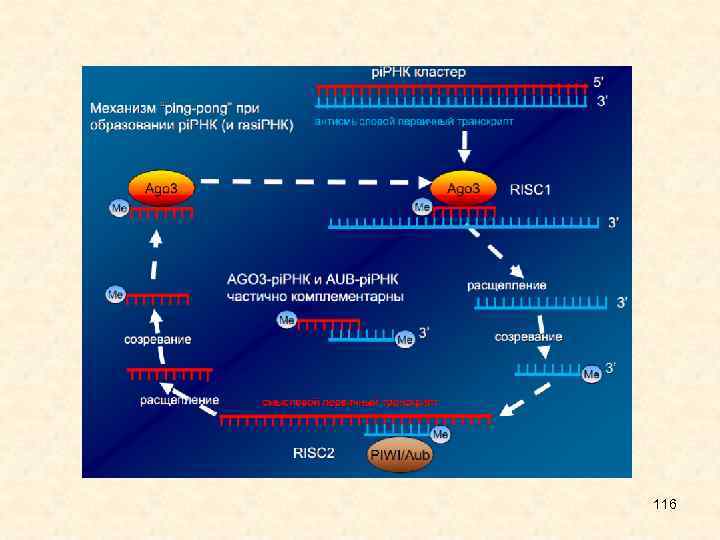 116
116
 117
117
 118
118
 119
119
 Нобелевская премия по физиологии и медицине 2006 год "RNA interference – gene silencing by double-stranded RNA" Andrew Z. Fire Craig C. Mello 120
Нобелевская премия по физиологии и медицине 2006 год "RNA interference – gene silencing by double-stranded RNA" Andrew Z. Fire Craig C. Mello 120
 Предположение Fire & Mello: Двуцепочечные РНК (ds. RNA) – запускающий механизм (триггер) системы интерференции РНК. 121
Предположение Fire & Mello: Двуцепочечные РНК (ds. RNA) – запускающий механизм (триггер) системы интерференции РНК. 121
 Интерференция РНК – это замолкание (сайленсинг) генов, обеспечиваемое двуцепочечными молекулами РНК (ds. РНК). Явление интерференции РНК открыто в 1998 г. у Nematoda (Fire et al. , 1998) 122
Интерференция РНК – это замолкание (сайленсинг) генов, обеспечиваемое двуцепочечными молекулами РНК (ds. РНК). Явление интерференции РНК открыто в 1998 г. у Nematoda (Fire et al. , 1998) 122
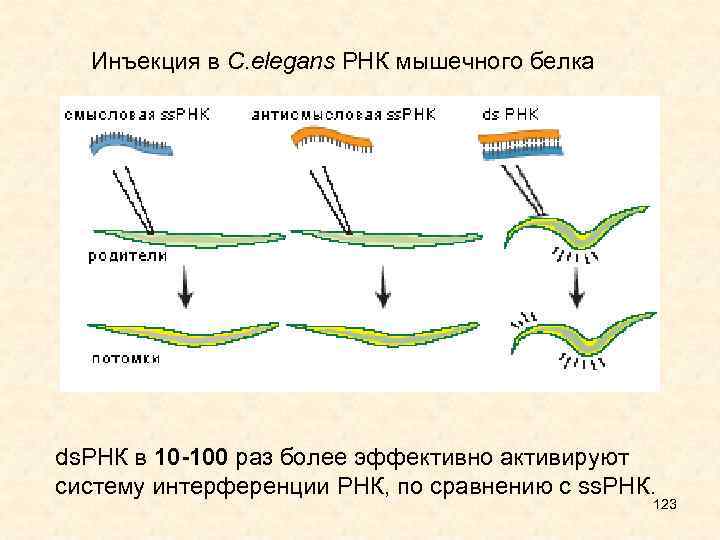 Инъекция в C. elegans РНК мышечного белка ds. РНК в 10 -100 раз более эффективно активируют систему интерференции РНК, по сравнению с ss. РНК. 123
Инъекция в C. elegans РНК мышечного белка ds. РНК в 10 -100 раз более эффективно активируют систему интерференции РНК, по сравнению с ss. РНК. 123
 Fire A. , Xu S. Q. , Montgomery M. K. , Kostas S. A. , Driver S. E. , Mello C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391, 806– 811 (1998). Эффект генетического сайленсинга посредством интерференции РНК: распространяется в тканях организма (!) наследуется (!!!) 124
Fire A. , Xu S. Q. , Montgomery M. K. , Kostas S. A. , Driver S. E. , Mello C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391, 806– 811 (1998). Эффект генетического сайленсинга посредством интерференции РНК: распространяется в тканях организма (!) наследуется (!!!) 124
 Механизм интерференции РНК • при исследовании интерференции РНК у растений обнаружены короткие молекулы РНК, маркирующие ген, подверженный сайленсингу; • в условиях in vitro воспроизведены биохимические реакции интерференции РНК. Малые интерферирующие РНК (si. RNAs – short interfering RNAs) – класс 21 -22 нуклеотидных двуцепочечных РНК, образующихся из более длинных двуцепочечных РНК. 125
Механизм интерференции РНК • при исследовании интерференции РНК у растений обнаружены короткие молекулы РНК, маркирующие ген, подверженный сайленсингу; • в условиях in vitro воспроизведены биохимические реакции интерференции РНК. Малые интерферирующие РНК (si. RNAs – short interfering RNAs) – класс 21 -22 нуклеотидных двуцепочечных РНК, образующихся из более длинных двуцепочечных РНК. 125
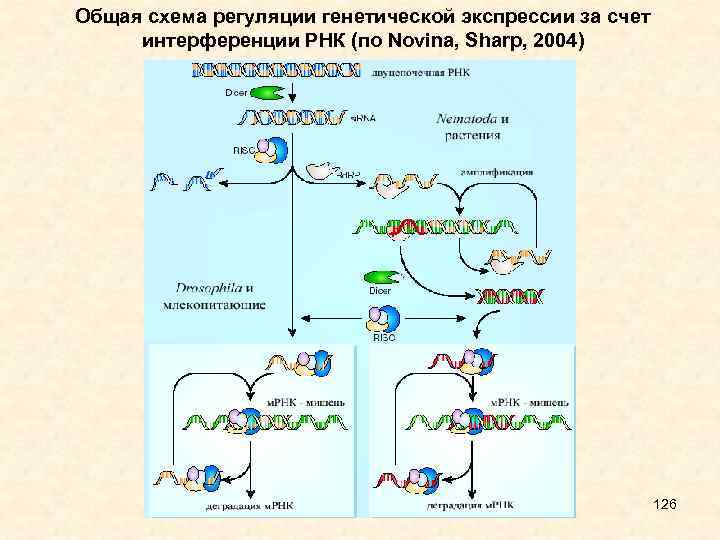 Общая схема регуляции генетической экспрессии за счет интерференции РНК (по Novina, Sharp, 2004) 126
Общая схема регуляции генетической экспрессии за счет интерференции РНК (по Novina, Sharp, 2004) 126
 Функции si. РНК 1. Сайленсинг мобильных генетических элементов; 2. Сайленсинг гетерохроматиновых повторов; 3. Сайленсинг генетического материала вирусного происхождения; 4. Ограничение степени экспрессии гена в определенных тканях. 127
Функции si. РНК 1. Сайленсинг мобильных генетических элементов; 2. Сайленсинг гетерохроматиновых повторов; 3. Сайленсинг генетического материала вирусного происхождения; 4. Ограничение степени экспрессии гена в определенных тканях. 127
 При выделение фракций коротких РНК (19 -25 нуклеотидов) из различных организмов обнаружен еще один класс малых РНК – микро. РНК. Микро. РНК (mi. RNAs - micro RNAs) – класс 19 -25 нуклеотидных одноцепочечных РНК, закодированных в уникальных генах геномов многоклеточных организмов. 128
При выделение фракций коротких РНК (19 -25 нуклеотидов) из различных организмов обнаружен еще один класс малых РНК – микро. РНК. Микро. РНК (mi. RNAs - micro RNAs) – класс 19 -25 нуклеотидных одноцепочечных РНК, закодированных в уникальных генах геномов многоклеточных организмов. 128
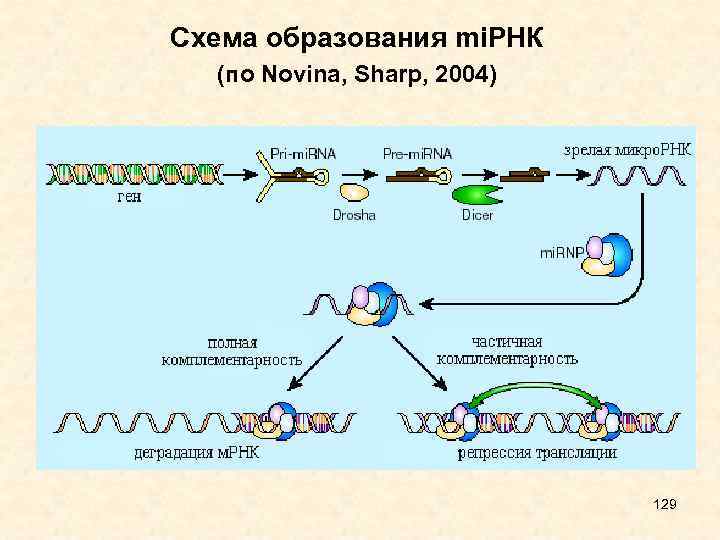 Схема образования mi. РНК (по Novina, Sharp, 2004) 129
Схема образования mi. РНК (по Novina, Sharp, 2004) 129
 Функция mi. РНК Обеспечивают сайленсинг различных генов, обычно, за счет частично комплементарного связывания с м. РНК, в результате которого блокируется ее трансляция. • один тип mi. РНК может регулировать трансляцию м. РНК более 100 различных генов; • степень ингибирования зависит от количества связывающихся mi. РНК (в 3’UTR м. РНК содержится несколько сайтов связывания). 130
Функция mi. РНК Обеспечивают сайленсинг различных генов, обычно, за счет частично комплементарного связывания с м. РНК, в результате которого блокируется ее трансляция. • один тип mi. РНК может регулировать трансляцию м. РНК более 100 различных генов; • степень ингибирования зависит от количества связывающихся mi. РНК (в 3’UTR м. РНК содержится несколько сайтов связывания). 130
 Отличия mi. РНК и si. РНК mi. РНК si. РНК • Продукт ds. РНК, закодированных в уникальных генах геномов многоклеточных организмов (>1% от всех генов у человека); • Продукт ds. РНК, образующихся в результате транскрипции транспозонов, гетерохроматиновых повторов или генетического материала вирусного происхождения ; • м. РНК может не разрушаться; • Один тип mi. РНК регулирует разные гены. • м. РНК разрушается; • Один тип si. РНК обычно регулирует только один тип м. РНК. 131
Отличия mi. РНК и si. РНК mi. РНК si. РНК • Продукт ds. РНК, закодированных в уникальных генах геномов многоклеточных организмов (>1% от всех генов у человека); • Продукт ds. РНК, образующихся в результате транскрипции транспозонов, гетерохроматиновых повторов или генетического материала вирусного происхождения ; • м. РНК может не разрушаться; • Один тип mi. РНК регулирует разные гены. • м. РНК разрушается; • Один тип si. РНК обычно регулирует только один тип м. РНК. 131
 • созданы библиотеки коротких РНК и ДНК-векторов, кодирующих короткие РНК, мишенями которых является около 8000 генов генома человека; • внедряется в практику терапевтическое применение синтетических коротких РНК для целенаправленного подавления генетической экспрессии при некоторых заболеваниях. 132
• созданы библиотеки коротких РНК и ДНК-векторов, кодирующих короткие РНК, мишенями которых является около 8000 генов генома человека; • внедряется в практику терапевтическое применение синтетических коротких РНК для целенаправленного подавления генетической экспрессии при некоторых заболеваниях. 132
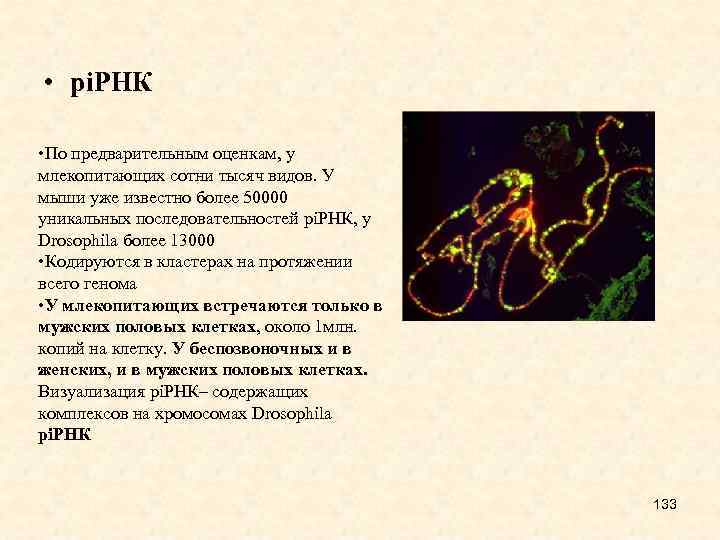 • pi. РНК • По предварительным оценкам, у млекопитающих сотни тысяч видов. У мыши уже известно более 50000 уникальных последовательностей pi. РНК, у Drosophila более 13000 • Кодируются в кластерах на протяжении всего генома • У млекопитающих встречаются только в мужских половых клетках, около 1 млн. копий на клетку. У беспозвоночных и в женских, и в мужских половых клетках. Визуализация pi. РНК– содержащих комплексов на хромосомах Drosophila pi. РНК 133
• pi. РНК • По предварительным оценкам, у млекопитающих сотни тысяч видов. У мыши уже известно более 50000 уникальных последовательностей pi. РНК, у Drosophila более 13000 • Кодируются в кластерах на протяжении всего генома • У млекопитающих встречаются только в мужских половых клетках, около 1 млн. копий на клетку. У беспозвоночных и в женских, и в мужских половых клетках. Визуализация pi. РНК– содержащих комплексов на хромосомах Drosophila pi. РНК 133
 • Главная функция pi. РНК — подавление активности мигрирующих генетических элементов. • • pi. РНК активны только во время эмбриогенеза, когда непредсказуемые перетасовки генома особенно опасны и могут привести к гибели зародыша • • Один из предполагаемых механизмов биогенеза –”Ping Pong” (не у всех объектов): • • Первичные pi. РНК узнают комплементарные им мишени (транскрипты с транспозонов и других повторов) и их комплекс привлекает белки Piwi. • • Piwi расщепляет мишень в позиции 10 н. от 5’ конца первичной pi. РНК, образуется вторичная pi. РНК, которая включается в Piwi. 134
• Главная функция pi. РНК — подавление активности мигрирующих генетических элементов. • • pi. РНК активны только во время эмбриогенеза, когда непредсказуемые перетасовки генома особенно опасны и могут привести к гибели зародыша • • Один из предполагаемых механизмов биогенеза –”Ping Pong” (не у всех объектов): • • Первичные pi. РНК узнают комплементарные им мишени (транскрипты с транспозонов и других повторов) и их комплекс привлекает белки Piwi. • • Piwi расщепляет мишень в позиции 10 н. от 5’ конца первичной pi. РНК, образуется вторичная pi. РНК, которая включается в Piwi. 134
 • Один из предполагаемых механизмов биогенеза –”Ping Pong” (не у всех объектов): • • Первичные pi. РНК узнают комплементарные им мишени (транскрипты с транспозонов и других повторов) и их комплекс привлекает белки Piwi. • • Piwi расщепляет мишень в позиции 10 н. от 5’ конца первичной pi. РНК, образуется вторичная pi. РНК, которая включается в Piwi. 135
• Один из предполагаемых механизмов биогенеза –”Ping Pong” (не у всех объектов): • • Первичные pi. РНК узнают комплементарные им мишени (транскрипты с транспозонов и других повторов) и их комплекс привлекает белки Piwi. • • Piwi расщепляет мишень в позиции 10 н. от 5’ конца первичной pi. РНК, образуется вторичная pi. РНК, которая включается в Piwi. 135
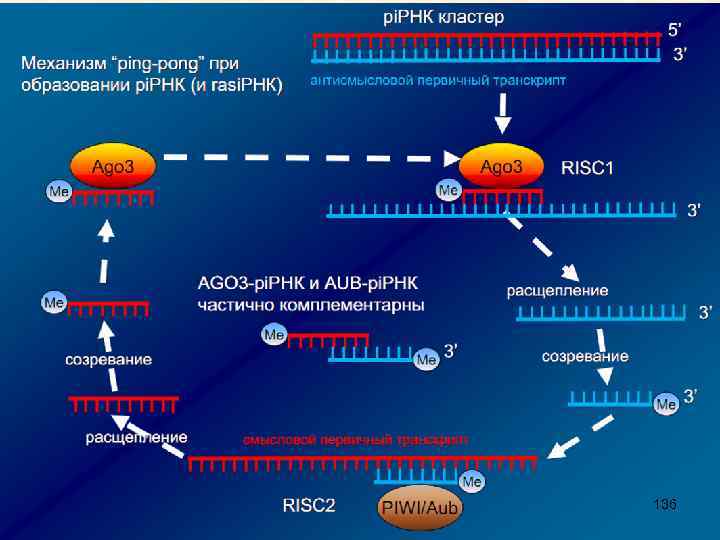 136
136
 rasi. РНК Repeat associated small interfering RNA • Одноцепочечные короткие РНК - 24 - 29 нук. • Выявлены у Drosophila и некоторых одноклеточных эукариот. У млекопитающих до сих пор не обнаружены. • Предполагается участие в формировании клеток зародышевого пути. • Предполагаемый предшественник – дц. РНК, образующаяся в результате транскрипции с обеих цепей повторенных элементов генома. Биогенез не требует участия Dicer, но требуется белок Ago 3 (Argonaute, Piwi и Piwi- подобный белок Aub (от Aubergine –мутация у Drosophila), у растений нет Piwi белков, но есть rasi. РНК, образующиеся с участием Dcl-белков. • Мутации белков Piwi, ассоциированных с rasi. РНК у Drosophila, приводят к стерильности и отсутствию формирования клеток зародышевого пути у особей обоего пола. • Возможно, являются разновидностью pi. РНК rasi. РНК Repeat associated small interfering RNA 137
rasi. РНК Repeat associated small interfering RNA • Одноцепочечные короткие РНК - 24 - 29 нук. • Выявлены у Drosophila и некоторых одноклеточных эукариот. У млекопитающих до сих пор не обнаружены. • Предполагается участие в формировании клеток зародышевого пути. • Предполагаемый предшественник – дц. РНК, образующаяся в результате транскрипции с обеих цепей повторенных элементов генома. Биогенез не требует участия Dicer, но требуется белок Ago 3 (Argonaute, Piwi и Piwi- подобный белок Aub (от Aubergine –мутация у Drosophila), у растений нет Piwi белков, но есть rasi. РНК, образующиеся с участием Dcl-белков. • Мутации белков Piwi, ассоциированных с rasi. РНК у Drosophila, приводят к стерильности и отсутствию формирования клеток зародышевого пути у особей обоего пола. • Возможно, являются разновидностью pi. РНК rasi. РНК Repeat associated small interfering RNA 137
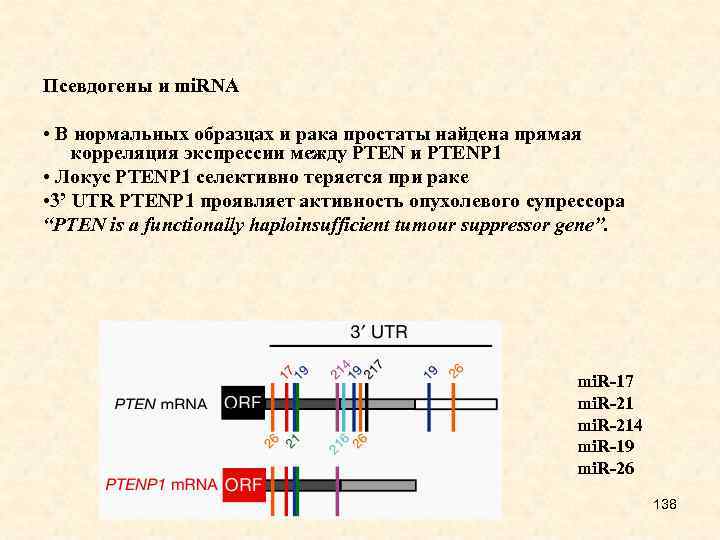 Псевдогены и mi. RNA • В нормальных образцах и рака простаты найдена прямая корреляция экспрессии между PTEN и PTENP 1 • Локус PTENP 1 селективно теряется при раке • 3’ UTR PTENP 1 проявляет активность опухолевого супрессора “PTEN is a functionally haploinsufficient tumour suppressor gene”. mi. R-17 mi. R-214 mi. R-19 mi. R-26 138
Псевдогены и mi. RNA • В нормальных образцах и рака простаты найдена прямая корреляция экспрессии между PTEN и PTENP 1 • Локус PTENP 1 селективно теряется при раке • 3’ UTR PTENP 1 проявляет активность опухолевого супрессора “PTEN is a functionally haploinsufficient tumour suppressor gene”. mi. R-17 mi. R-214 mi. R-19 mi. R-26 138
 Псевдогены и mi. RNA Консервативность подтвержденных сайтов связывания mi. RNA в генах связанных с раком 139
Псевдогены и mi. RNA Консервативность подтвержденных сайтов связывания mi. RNA в генах связанных с раком 139
 Функция вторичной структуры РНК: • Структурная Рибосомальная РНК • Ферментативная Рибозимы • Транспортная т. РНК • Регуляторная Разные РНК 140
Функция вторичной структуры РНК: • Структурная Рибосомальная РНК • Ферментативная Рибозимы • Транспортная т. РНК • Регуляторная Разные РНК 140
 Антисмысловая регуляция вовлечена в различные клеточные процессы : • • Транскрипция Процессинг РНК и транспорт Стабильность РНК и трансляция Геномный импринтинг и инактивация Х хромосомы Модификации ДНК и хроматина Метилирование генома Альтернативные: инициация транскрипции, сплайсинг, полиаденилирование, терминация. • РНК редактирование • РНК интерференция 141
Антисмысловая регуляция вовлечена в различные клеточные процессы : • • Транскрипция Процессинг РНК и транспорт Стабильность РНК и трансляция Геномный импринтинг и инактивация Х хромосомы Модификации ДНК и хроматина Метилирование генома Альтернативные: инициация транскрипции, сплайсинг, полиаденилирование, терминация. • РНК редактирование • РНК интерференция 141
 • Парой смысловой-антисмысловой транскрипты называется пара чьи последовательности м. РНК комплементарны. • Цис-антисмысловой транскрипт экспрессируется в одном геномном локусе со смысловым транскриптом. • Транс-антисмысловой транскрипт экспрессируется с другого геномного локуса чем смысловой транскрипт. 142
• Парой смысловой-антисмысловой транскрипты называется пара чьи последовательности м. РНК комплементарны. • Цис-антисмысловой транскрипт экспрессируется в одном геномном локусе со смысловым транскриптом. • Транс-антисмысловой транскрипт экспрессируется с другого геномного локуса чем смысловой транскрипт. 142
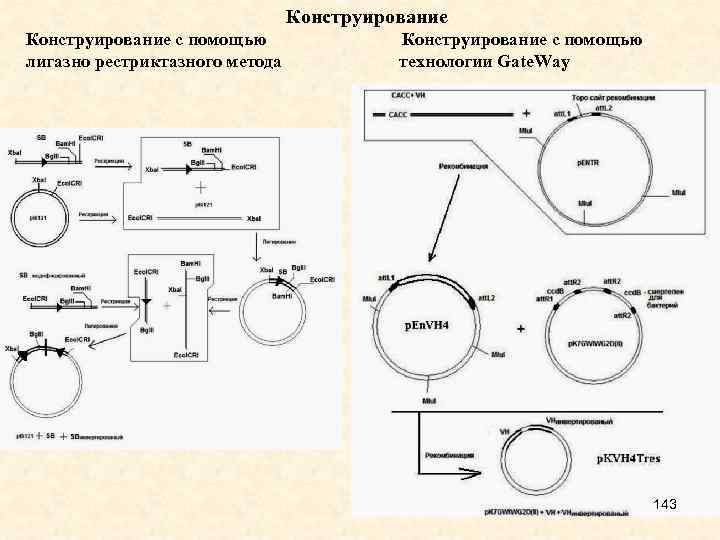 Конструирование с помощью Конструирование с помощью лигазно рестриктазного метода технологии Gate. Way 143
Конструирование с помощью Конструирование с помощью лигазно рестриктазного метода технологии Gate. Way 143
 Выводы • 1) Разработаны схемы генетических конструкций кодирующих противовирусный и противовироидный ds. RNA супрессоры. • 2) Получены генетические конструкции: • 3) Получены растения N. tabacum, несущие конструкцию p. Bi. SBJ 1 III. Показано, что в клетках растений-трансформантов присутствуют si. RNA, комплементарные генетической конструкции. p. Bi. SBJ 1 III – конструкция, содержащая фрагмент кодирующий ds. RNA супрессор вирусов картофеля X, Y, S, M, вируса погремковости табака и вируса скрученности листьев картофеля; pk. VHtres - конструкция содержащая фрагмент кодирующий ds. RNA комплементарную участкам РНК вироида веретеновидности клубней картофеля; 144
Выводы • 1) Разработаны схемы генетических конструкций кодирующих противовирусный и противовироидный ds. RNA супрессоры. • 2) Получены генетические конструкции: • 3) Получены растения N. tabacum, несущие конструкцию p. Bi. SBJ 1 III. Показано, что в клетках растений-трансформантов присутствуют si. RNA, комплементарные генетической конструкции. p. Bi. SBJ 1 III – конструкция, содержащая фрагмент кодирующий ds. RNA супрессор вирусов картофеля X, Y, S, M, вируса погремковости табака и вируса скрученности листьев картофеля; pk. VHtres - конструкция содержащая фрагмент кодирующий ds. RNA комплементарную участкам РНК вироида веретеновидности клубней картофеля; 144
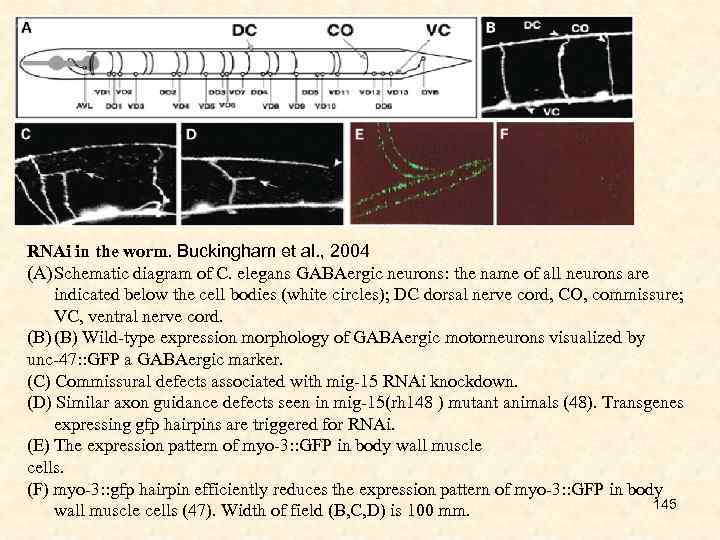 RNAi in the worm. Buckingham et al. , 2004 (A) Schematic diagram of C. elegans GABAergic neurons: the name of all neurons are indicated below the cell bodies (white circles); DC dorsal nerve cord, CO, commissure; VC, ventral nerve cord. (B) Wild-type expression morphology of GABAergic motorneurons visualized by unc-47: : GFP a GABAergic marker. (C) Commissural defects associated with mig-15 RNAi knockdown. (D) Similar axon guidance defects seen in mig-15(rh 148 ) mutant animals (48). Transgenes expressing gfp hairpins are triggered for RNAi. (E) The expression pattern of myo-3: : GFP in body wall muscle cells. (F) myo-3: : gfp hairpin efficiently reduces the expression pattern of myo-3: : GFP in body 145 wall muscle cells (47). Width of field (B, C, D) is 100 mm.
RNAi in the worm. Buckingham et al. , 2004 (A) Schematic diagram of C. elegans GABAergic neurons: the name of all neurons are indicated below the cell bodies (white circles); DC dorsal nerve cord, CO, commissure; VC, ventral nerve cord. (B) Wild-type expression morphology of GABAergic motorneurons visualized by unc-47: : GFP a GABAergic marker. (C) Commissural defects associated with mig-15 RNAi knockdown. (D) Similar axon guidance defects seen in mig-15(rh 148 ) mutant animals (48). Transgenes expressing gfp hairpins are triggered for RNAi. (E) The expression pattern of myo-3: : GFP in body wall muscle cells. (F) myo-3: : gfp hairpin efficiently reduces the expression pattern of myo-3: : GFP in body 145 wall muscle cells (47). Width of field (B, C, D) is 100 mm.
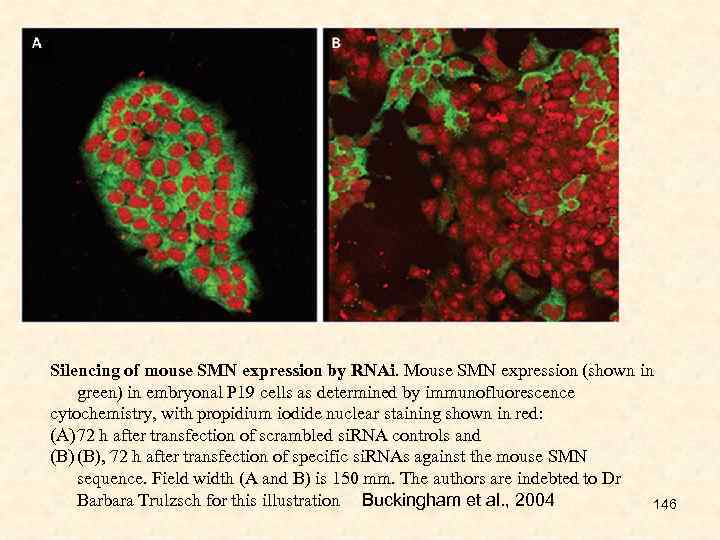 Silencing of mouse SMN expression by RNAi. Mouse SMN expression (shown in green) in embryonal P 19 cells as determined by immunofluorescence cytochemistry, with propidium iodide nuclear staining shown in red: (A) 72 h after transfection of scrambled si. RNA controls and (B), 72 h after transfection of specific si. RNAs against the mouse SMN sequence. Field width (A and B) is 150 mm. The authors are indebted to Dr Barbara Trulzsch for this illustration Buckingham et al. , 2004 146
Silencing of mouse SMN expression by RNAi. Mouse SMN expression (shown in green) in embryonal P 19 cells as determined by immunofluorescence cytochemistry, with propidium iodide nuclear staining shown in red: (A) 72 h after transfection of scrambled si. RNA controls and (B), 72 h after transfection of specific si. RNAs against the mouse SMN sequence. Field width (A and B) is 150 mm. The authors are indebted to Dr Barbara Trulzsch for this illustration Buckingham et al. , 2004 146


