 Лёвкин А. Н. Реакции азотной кислоты с металлами и неметаллами
Лёвкин А. Н. Реакции азотной кислоты с металлами и неметаллами
 +1 +5 Zn + HNO 3 = Zn(NO 3)2 + H 2↑
+1 +5 Zn + HNO 3 = Zn(NO 3)2 + H 2↑
 Азотная кислота + Металл 0 +5 HNO 3 + Me = +5 = Me(NO 3)n + продукт + H 2 O восстановления азота
Азотная кислота + Металл 0 +5 HNO 3 + Me = +5 = Me(NO 3)n + продукт + H 2 O восстановления азота
 Продукты восстановления азота(V) -3 0 +1 +2 +3 +4 +5 HNO 2 HNO 3 NH 3 N 2 O NO NH 4 NO 3 NH 3 + HNO 3 = NH 4 NO 3 NO 2
Продукты восстановления азота(V) -3 0 +1 +2 +3 +4 +5 HNO 2 HNO 3 NH 3 N 2 O NO NH 4 NO 3 NH 3 + HNO 3 = NH 4 NO 3 NO 2
 От чего зависит глубина восстановления азота(V)? Природа восстановителя n Концентрация кислоты n Температура n Чистота кислоты n
От чего зависит глубина восстановления азота(V)? Природа восстановителя n Концентрация кислоты n Температура n Чистота кислоты n
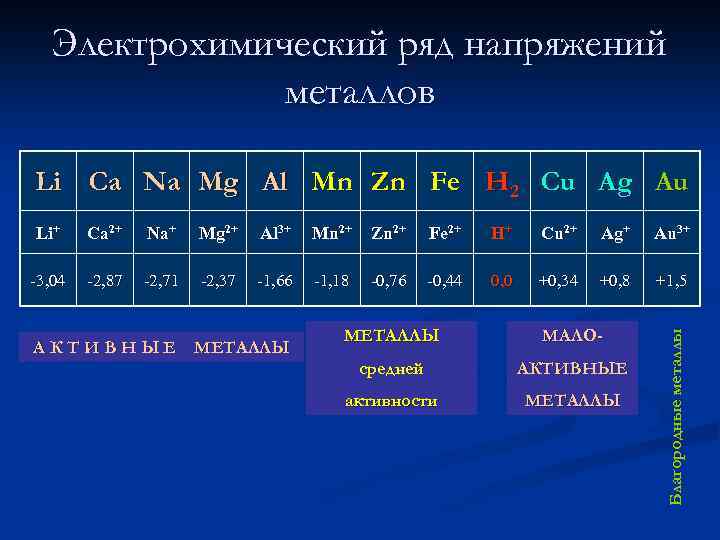 Электрохимический ряд напряжений металлов Li Ca Na Mg Al Mn Zn Fe H 2 Cu Ag Au Ca 2+ Na+ Mg 2+ Al 3+ Mn 2+ Zn 2+ Fe 2+ H+ Cu 2+ Ag+ Au 3+ -3, 04 -2, 87 -2, 71 -2, 37 -1, 66 -1, 18 -0, 76 -0, 44 0, 0 +0, 34 +0, 8 +1, 5 А К Т И В Н Ы Е МЕТАЛЛЫ МАЛО- средней АКТИВНЫЕ активности МЕТАЛЛЫ Благородные металлы Li+
Электрохимический ряд напряжений металлов Li Ca Na Mg Al Mn Zn Fe H 2 Cu Ag Au Ca 2+ Na+ Mg 2+ Al 3+ Mn 2+ Zn 2+ Fe 2+ H+ Cu 2+ Ag+ Au 3+ -3, 04 -2, 87 -2, 71 -2, 37 -1, 66 -1, 18 -0, 76 -0, 44 0, 0 +0, 34 +0, 8 +1, 5 А К Т И В Н Ы Е МЕТАЛЛЫ МАЛО- средней АКТИВНЫЕ активности МЕТАЛЛЫ Благородные металлы Li+
 Зависимость от природы металла 0 +5 +5 +4 Cu + 4 HNO 3 = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O конц. -3 0 +1 +2 +3 +4 +5 NO 2 HNO 3 Малоактивные металлы в концентрированной азотной кислоте восстанавливают преимущественно до NO 2
Зависимость от природы металла 0 +5 +5 +4 Cu + 4 HNO 3 = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O конц. -3 0 +1 +2 +3 +4 +5 NO 2 HNO 3 Малоактивные металлы в концентрированной азотной кислоте восстанавливают преимущественно до NO 2
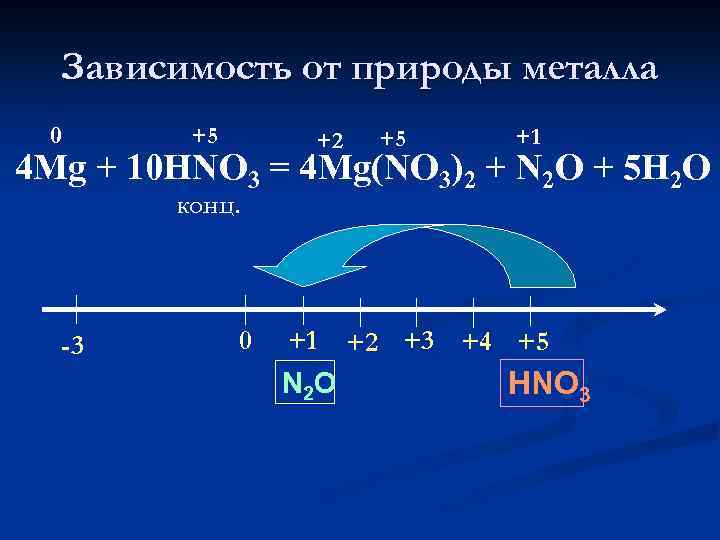 Зависимость от природы металла 0 +5 +2 +5 +1 4 Mg + 10 HNO 3 = 4 Mg(NO 3)2 + N 2 O + 5 H 2 O конц. -3 0 +1 N 2 O +2 +3 +4 +5 HNO 3
Зависимость от природы металла 0 +5 +2 +5 +1 4 Mg + 10 HNO 3 = 4 Mg(NO 3)2 + N 2 O + 5 H 2 O конц. -3 0 +1 N 2 O +2 +3 +4 +5 HNO 3
 Зависимость от концентрации Чем ниже концентрация кислоты, тем глубже восстанавливается азот(V) 0 +5 +2 +5 Опыт: взаимодействие HNO 3 и меди +4 Cu + 4 HNO 3 = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O конц. 0 +5 +2 +2 3 Cu + 8 HNO 3 = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O разб. -3 Опыт: получение NO 0 +1 +2 +3 +4 +5 NO NO 2 HNO 3
Зависимость от концентрации Чем ниже концентрация кислоты, тем глубже восстанавливается азот(V) 0 +5 +2 +5 Опыт: взаимодействие HNO 3 и меди +4 Cu + 4 HNO 3 = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O конц. 0 +5 +2 +2 3 Cu + 8 HNO 3 = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O разб. -3 Опыт: получение NO 0 +1 +2 +3 +4 +5 NO NO 2 HNO 3
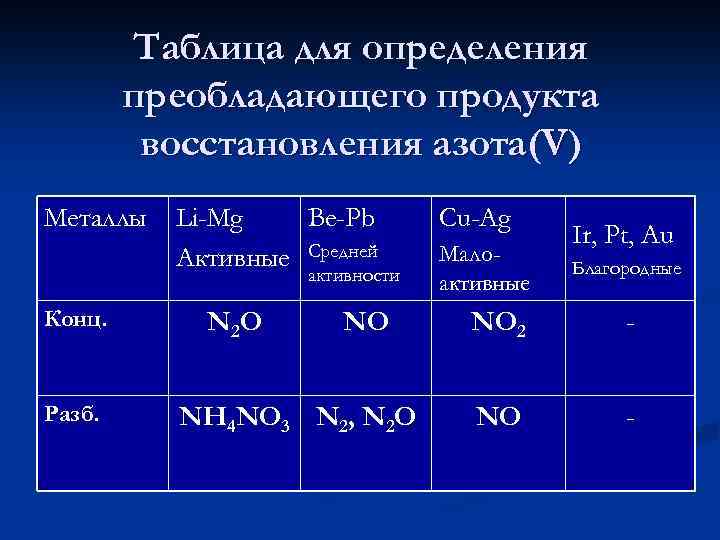 Таблица для определения преобладающего продукта восстановления азота(V) Металлы Li-Mg Be-Pb Активные Средней активности Конц. Разб. N 2 O NO NH 4 NO 3 N 2, N 2 O Cu-Ag Малоактивные Ir, Pt, Au Благородные NO 2 - NO -
Таблица для определения преобладающего продукта восстановления азота(V) Металлы Li-Mg Be-Pb Активные Средней активности Конц. Разб. N 2 O NO NH 4 NO 3 N 2, N 2 O Cu-Ag Малоактивные Ir, Pt, Au Благородные NO 2 - NO -
 Азотная кислота не реагирует со следующими металлами: 1) Au, Pt 2) Al, Cr, Fe концентрированная азотная кислота не реагирует вследствие пассивации Опыт: пассивация железа
Азотная кислота не реагирует со следующими металлами: 1) Au, Pt 2) Al, Cr, Fe концентрированная азотная кислота не реагирует вследствие пассивации Опыт: пассивация железа
 Примеры реакций с разбавленной HNO 3 Примесь NO 5 Sn + 12 HNO 3 = 5 Sn(NO 3)2 + N 2 + 6 H 2 O разб. Примесь H 2 8 Al + 30 HNO 3 = 8 Al(NO 3)3 + 3 NH 4 NO 3 + 9 H 2 O разб. 5 Fe + 12 HNO 3 = 5 Fe(NO 3)2 + N 2 + 6 H 2 O оч. разб. Fe + 4 HNO 3 = Fe(NO 3)3 + NO + 2 H 2 O разб.
Примеры реакций с разбавленной HNO 3 Примесь NO 5 Sn + 12 HNO 3 = 5 Sn(NO 3)2 + N 2 + 6 H 2 O разб. Примесь H 2 8 Al + 30 HNO 3 = 8 Al(NO 3)3 + 3 NH 4 NO 3 + 9 H 2 O разб. 5 Fe + 12 HNO 3 = 5 Fe(NO 3)2 + N 2 + 6 H 2 O оч. разб. Fe + 4 HNO 3 = Fe(NO 3)3 + NO + 2 H 2 O разб.
 Д. И. Менделеев: «Ни одно уравнение не выражает всего, что в действительности при действии металлов на азотную кислоту, так как образуется всегда несколько окислов азота вместе или последовательно – один за другим, по мере нагревания и изменения крепости кислоты…»
Д. И. Менделеев: «Ни одно уравнение не выражает всего, что в действительности при действии металлов на азотную кислоту, так как образуется всегда несколько окислов азота вместе или последовательно – один за другим, по мере нагревания и изменения крепости кислоты…»
 Влияние концентрации на глубину окисления металла +2 +4 Hg + 4 HNO 3 = Hg(NO 3)2 + 2 NO 2 + 2 H 2 O конц. , горяч. +1 +2 Hg + 6 HNO 3 = 3 Hg 2(NO 3)2 + 2 NO + 4 H 2 O разб. , хол. Посмотрите опыт
Влияние концентрации на глубину окисления металла +2 +4 Hg + 4 HNO 3 = Hg(NO 3)2 + 2 NO 2 + 2 H 2 O конц. , горяч. +1 +2 Hg + 6 HNO 3 = 3 Hg 2(NO 3)2 + 2 NO + 4 H 2 O разб. , хол. Посмотрите опыт
 Реакции азотной кислоты с неметаллами С + 4 HNO 3 = СO 2 + 4 NO 2 + 2 H 2 O конц. S + 6 HNO 3 = H 2 SO 4 + 6 NO 2 + 2 H 2 O конц. P + 5 HNO 3 = H 3 PO 4 + 5 NO 2 + H 2 O красн. конц. I 2 +10 HNO 3 = 2 HIO 3 + 10 NO 2 + 4 H 2 O конц. , горяч.
Реакции азотной кислоты с неметаллами С + 4 HNO 3 = СO 2 + 4 NO 2 + 2 H 2 O конц. S + 6 HNO 3 = H 2 SO 4 + 6 NO 2 + 2 H 2 O конц. P + 5 HNO 3 = H 3 PO 4 + 5 NO 2 + H 2 O красн. конц. I 2 +10 HNO 3 = 2 HIO 3 + 10 NO 2 + 4 H 2 O конц. , горяч.
 Спасибо за внимание!
Спасибо за внимание!