 . ЛЫ АЛ Т Е НЫ Д ХО РЕ М 1 ПЕ О И Я 3 ХРЕ К Ц Л Е М
. ЛЫ АЛ Т Е НЫ Д ХО РЕ М 1 ПЕ О И Я 3 ХРЕ К Ц Л Е М
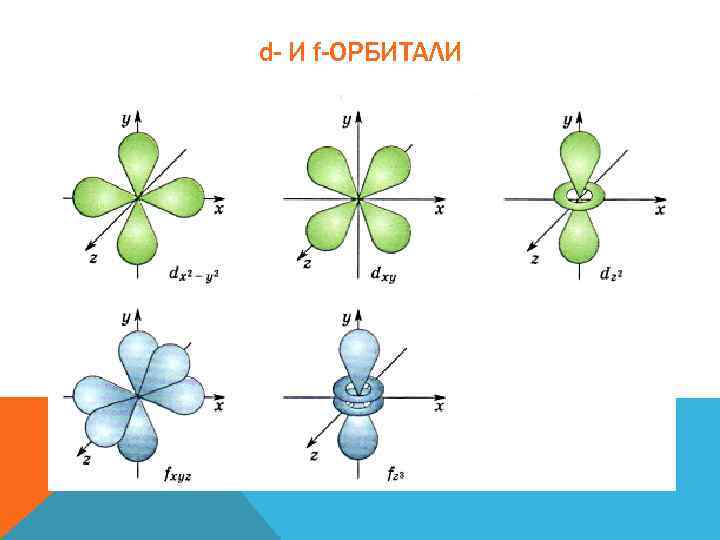 d- И f-ОРБИТАЛИ
d- И f-ОРБИТАЛИ
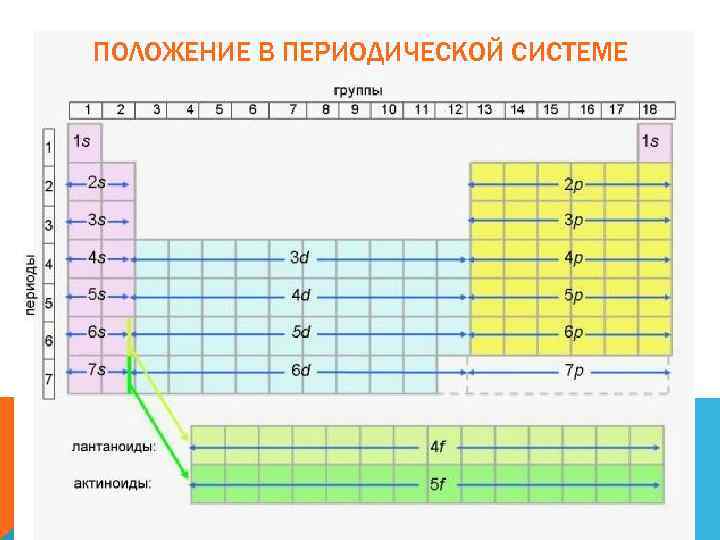 ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
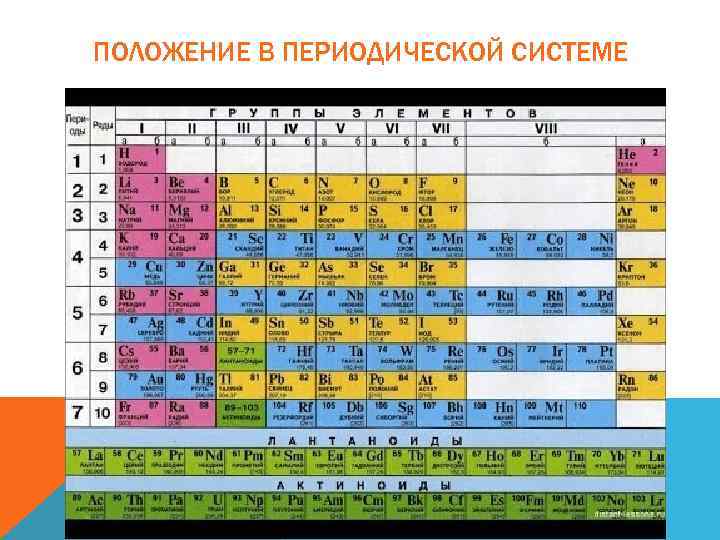 ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ

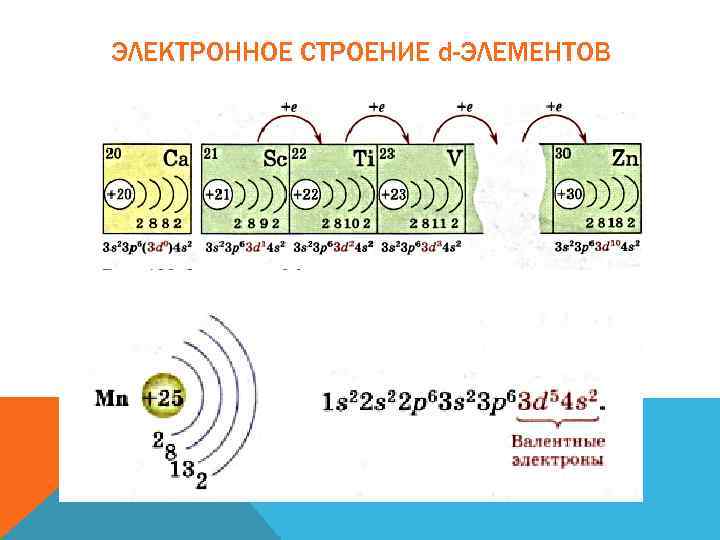 ЭЛЕКТРОННОЕ СТРОЕНИЕ d-ЭЛЕМЕНТОВ
ЭЛЕКТРОННОЕ СТРОЕНИЕ d-ЭЛЕМЕНТОВ
 f-ЭЛЕМЕНТЫ Лантаноиды и актиноиды располагаются в третьей побочной группе Периодической системы. Эти элементы следуют в таблице сразу после лантана и актиния и поэтому их называют соответственно лантаноиды и актиноиды. В короткой форме Периодической системы Д. И. Менделеева они вынесены в два последних ряда. Они относятся к f-элементам. В атомах лантаноидов и актиноидов происходит заполнение соответственно 4 f- и 5 fподуровней.
f-ЭЛЕМЕНТЫ Лантаноиды и актиноиды располагаются в третьей побочной группе Периодической системы. Эти элементы следуют в таблице сразу после лантана и актиния и поэтому их называют соответственно лантаноиды и актиноиды. В короткой форме Периодической системы Д. И. Менделеева они вынесены в два последних ряда. Они относятся к f-элементам. В атомах лантаноидов и актиноидов происходит заполнение соответственно 4 f- и 5 fподуровней.
 ЛАНТАНОИДЫ Лантаноиды очень сходны по хими ческимсвойствам. Близость свойств соединений лантаноидов обусловлена тем, что застройка внутренней 4 f-оболочки атомов мало сказывается на со стоянии валентных электронов. В образовании химической связи 4 fэлектроны лантаноидов обычно не принимают участия. Электроны заполняют 4 f-, а не 5 d-подуровень потому, что в этом случае они обладают меньшей энергией. Однако разница в энер гиях4 f- и 5 d-состояний очень мала. Благодаря этому один из 4 f -электронов (а в некоторых случаях, например, у церия, два 4 f--электрона) легко возбуждается, переходя на 5 d-подуровень, и становится, таким образом, валентным электроном. Поэтому в большинстве своих соединений лантаноиды имеют степень окисления +3, а не +2. Это обстоятельство объясняет близость свойств лантаноидов к свойствам элементов подгруппы скандия.
ЛАНТАНОИДЫ Лантаноиды очень сходны по хими ческимсвойствам. Близость свойств соединений лантаноидов обусловлена тем, что застройка внутренней 4 f-оболочки атомов мало сказывается на со стоянии валентных электронов. В образовании химической связи 4 fэлектроны лантаноидов обычно не принимают участия. Электроны заполняют 4 f-, а не 5 d-подуровень потому, что в этом случае они обладают меньшей энергией. Однако разница в энер гиях4 f- и 5 d-состояний очень мала. Благодаря этому один из 4 f -электронов (а в некоторых случаях, например, у церия, два 4 f--электрона) легко возбуждается, переходя на 5 d-подуровень, и становится, таким образом, валентным электроном. Поэтому в большинстве своих соединений лантаноиды имеют степень окисления +3, а не +2. Это обстоятельство объясняет близость свойств лантаноидов к свойствам элементов подгруппы скандия.

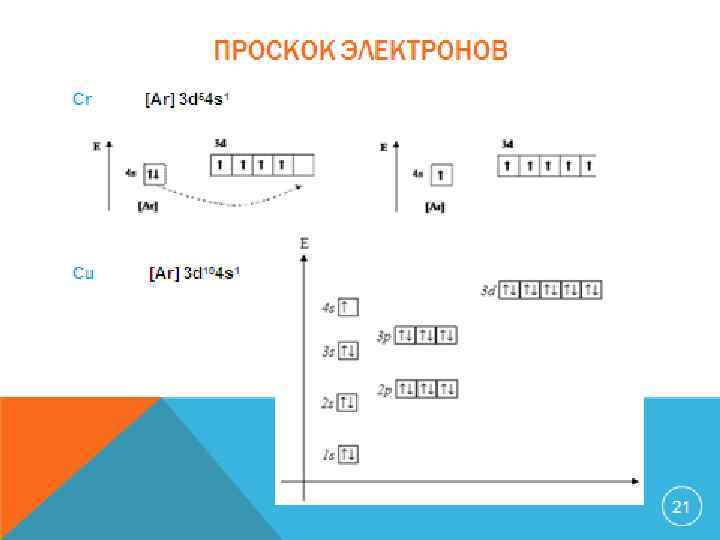 ПРОСКОК ЭЛЕКТРОНОВ
ПРОСКОК ЭЛЕКТРОНОВ
 ПЕРЕХОДНЫЕ МЕТАЛЛЫ
ПЕРЕХОДНЫЕ МЕТАЛЛЫ
 ОСОБЕННОСТИ ПЕРЕХОДНЫХ МЕТАЛЛОВ o Различные степени окисления (особенно в середине ряда) o Яркая окраска солей o Более прочная металлическая связь o Высокая твердость o Тугоплавкость o Низкая химическая активность
ОСОБЕННОСТИ ПЕРЕХОДНЫХ МЕТАЛЛОВ o Различные степени окисления (особенно в середине ряда) o Яркая окраска солей o Более прочная металлическая связь o Высокая твердость o Тугоплавкость o Низкая химическая активность
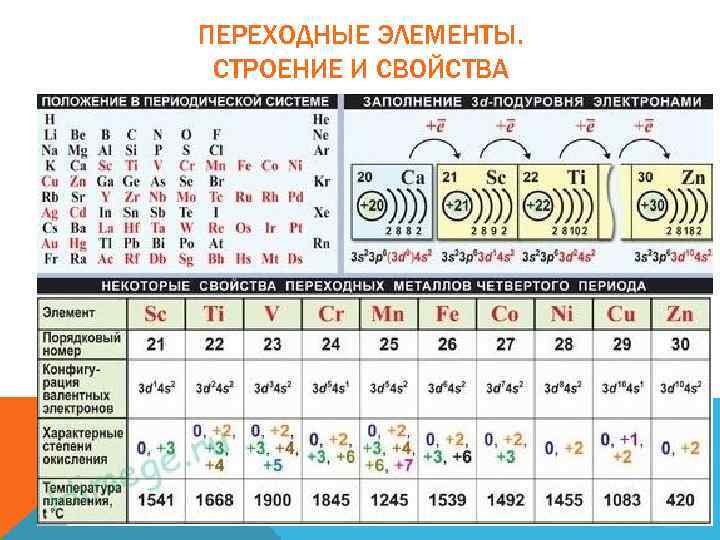 ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ. СТРОЕНИЕ И СВОЙСТВА
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ. СТРОЕНИЕ И СВОЙСТВА
 СТЕПЕНИ ОКИСЛЕНИЯ И ОКРАСКА СОЛЕЙ
СТЕПЕНИ ОКИСЛЕНИЯ И ОКРАСКА СОЛЕЙ


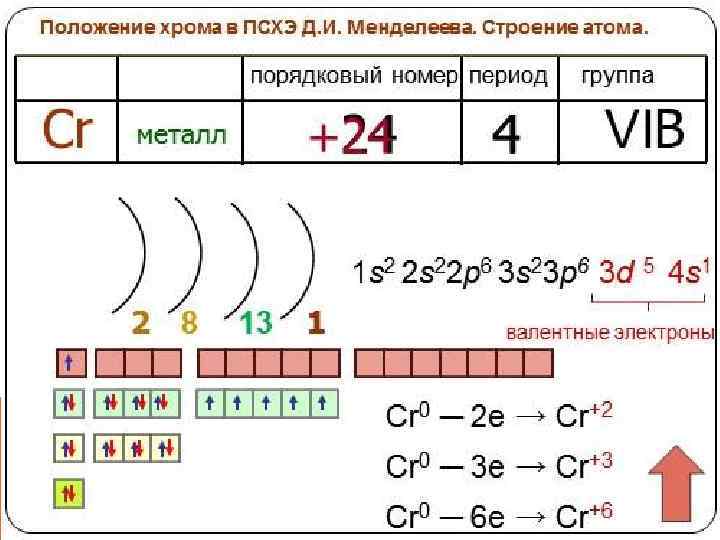 ХРОМ. СТРОЕНИЕ АТОМА
ХРОМ. СТРОЕНИЕ АТОМА





















 ХИМИЧЕСКИЙ ВУЛКАН
ХИМИЧЕСКИЙ ВУЛКАН









 СОЕДИНЕНИЯ ХРОМА (III)
СОЕДИНЕНИЯ ХРОМА (III)


 ИЗОМЕРИЯ АКВАКОМПЛЕКСОВ ХРОМА
ИЗОМЕРИЯ АКВАКОМПЛЕКСОВ ХРОМА













 ВОССТАНОВЛЕНИЕ ХРОМОВОЙ СМЕСИ K 2 Cr 2 O 7 + H 2 SO 4 Cr 2(SO 4)3
ВОССТАНОВЛЕНИЕ ХРОМОВОЙ СМЕСИ K 2 Cr 2 O 7 + H 2 SO 4 Cr 2(SO 4)3
 ТВЕРДОФАЗНОЕ ОКИСЛЕНИЕ
ТВЕРДОФАЗНОЕ ОКИСЛЕНИЕ



 ФЕРРОХРОМ
ФЕРРОХРОМ






 ТРИВИАЛЬНЫЕ НАЗВАНИЯ Хромовая смесь – смесь равных объемов насыщенного раствора K 2 Cr 2 O 7 и концентрированной H 2 SO 4 Cr 2(SO 4)3 ▪ K 2 SO 4 ▪ 24 H 2 O – хромовые квасцы Хромпик – K 2 Cr 2 O 7 и Na 2 Cr 2 O 7 Fe. Cr 2 O 4 – хромистый железняк Феррохром – сплав железа и хрома
ТРИВИАЛЬНЫЕ НАЗВАНИЯ Хромовая смесь – смесь равных объемов насыщенного раствора K 2 Cr 2 O 7 и концентрированной H 2 SO 4 Cr 2(SO 4)3 ▪ K 2 SO 4 ▪ 24 H 2 O – хромовые квасцы Хромпик – K 2 Cr 2 O 7 и Na 2 Cr 2 O 7 Fe. Cr 2 O 4 – хромистый железняк Феррохром – сплав железа и хрома
 А! К ТИ К А ЕП Т РЬ Е РА П
А! К ТИ К А ЕП Т РЬ Е РА П


