Лук’яненко Анастасія, Дужак Анастасія , Вовк Микола, Савченко





















594tgp_family_light_ani.ppt
- Размер: 7.1 Mегабайта
- Количество слайдов: 24
Описание презентации Лук’яненко Анастасія, Дужак Анастасія , Вовк Микола, Савченко по слайдам

 Лук’яненко Анастасія, Дужак Анастасія , Вовк Микола, Савченко Ігор, Сонора Євгеній.
Лук’яненко Анастасія, Дужак Анастасія , Вовк Микола, Савченко Ігор, Сонора Євгеній.
 ● Магній — сріблясто-білий, дуже легкий метал. На повітрі майже не змінюється, оскільки покривається тонким шаром окислу, що захищає його від подальшого окислення.
● Магній — сріблясто-білий, дуже легкий метал. На повітрі майже не змінюється, оскільки покривається тонким шаром окислу, що захищає його від подальшого окислення.
 В 1695 з мінеральної води Епсомского джерела в Англії виділили сіль, що володіла гірким смаком. Аптекарі називали її гіркою сіллю, а також англійською, або епсомской сіллю. Мінерал епсоміт має склад Mg. SO 4 7 H 2 O. Латинська назва елемента походить від назви стародавнього міста Магнезія в Малій Азії, в околицях якого є поклади мінералу магнезиту. Вперше був виділений в чистому вигляді сером Гемфрі Деві в 1808.
В 1695 з мінеральної води Епсомского джерела в Англії виділили сіль, що володіла гірким смаком. Аптекарі називали її гіркою сіллю, а також англійською, або епсомской сіллю. Мінерал епсоміт має склад Mg. SO 4 7 H 2 O. Латинська назва елемента походить від назви стародавнього міста Магнезія в Малій Азії, в околицях якого є поклади мінералу магнезиту. Вперше був виділений в чистому вигляді сером Гемфрі Деві в 1808.

 Кларк магнію 19 кг / т. Це поширений елемент земної кори. Великі кількості магнію знаходяться в морській воді. Головними видами знаходження магнезіального сировини є: морська вода — ( Mg 0, 12 — 0, 13% ), карналіт — Mg. Cl 2 KCl 6 H 2 O (Mg 8, 7%), бішофіт – Mg. Cl 2 6 H 2 O (Mg 11, 9%), кізерит — Mg. SO 4 H 2 O (Mg 17, 6%), епсоміт — Mg. SO 4 7 H 2 O (Mg 16, 3%), каїніт — KCl. Mg. SO 4 3 H 2 O (Mg 9, 8%), магнезит – Mg. CO 3 (Mg 28, 7% ), доломіт — Ca. CO 3 Mg. CO 3 (Mg 13, 1%), брусит — Mg (OH) 2 (Mg 41, 6%).
Кларк магнію 19 кг / т. Це поширений елемент земної кори. Великі кількості магнію знаходяться в морській воді. Головними видами знаходження магнезіального сировини є: морська вода — ( Mg 0, 12 — 0, 13% ), карналіт — Mg. Cl 2 KCl 6 H 2 O (Mg 8, 7%), бішофіт – Mg. Cl 2 6 H 2 O (Mg 11, 9%), кізерит — Mg. SO 4 H 2 O (Mg 17, 6%), епсоміт — Mg. SO 4 7 H 2 O (Mg 16, 3%), каїніт — KCl. Mg. SO 4 3 H 2 O (Mg 9, 8%), магнезит – Mg. CO 3 (Mg 28, 7% ), доломіт — Ca. CO 3 Mg. CO 3 (Mg 13, 1%), брусит — Mg (OH) 2 (Mg 41, 6%).
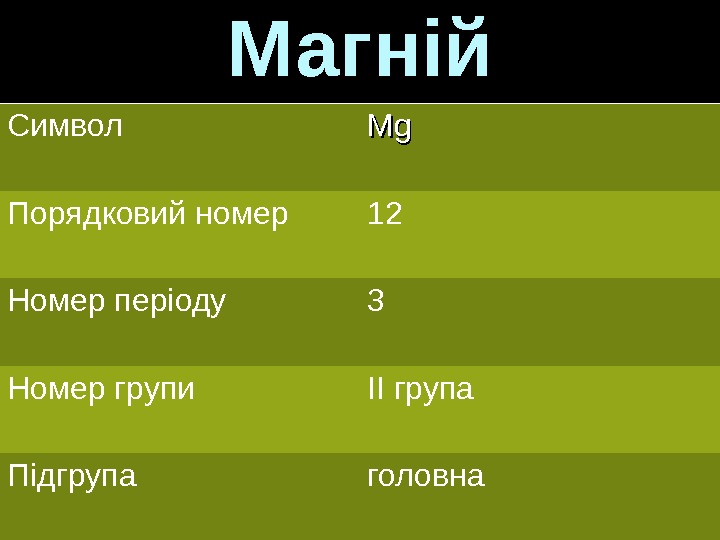
 Магній Символ Mg. Mg Порядковий номер 12 Номер періоду 3 Номер групи ІІ група Підгрупа головна
Магній Символ Mg. Mg Порядковий номер 12 Номер періоду 3 Номер групи ІІ група Підгрупа головна
 Будова атома Заряд ядра +12 Кількість р, n, e р-12, n -12, e -12 Електронна формула 1 s² 2 p 3 s² Кількість електронів на зовнішньому рівні
Будова атома Заряд ядра +12 Кількість р, n, e р-12, n -12, e -12 Електронна формула 1 s² 2 p 3 s² Кількість електронів на зовнішньому рівні
 Магн іі й — метал Формула вищого оксиду Mg. O , основний Формула гідрооксиду Mg(OH) 2 , основа Формула леткої сполуки не ма є
Магн іі й — метал Формула вищого оксиду Mg. O , основний Формула гідрооксиду Mg(OH) 2 , основа Формула леткої сполуки не ма є
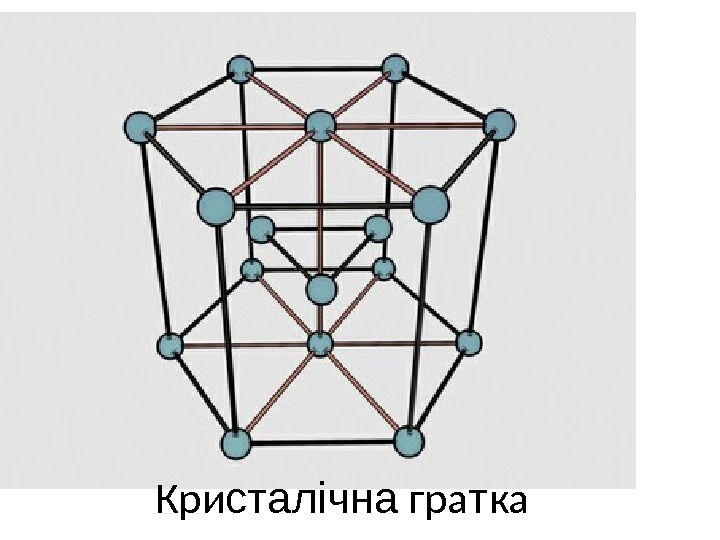
 Ф ізичні властивості Магній — сріблисто-білий блискучий метал, порівняно м’який іпластичний, гарний провідник тепла й електрики. На повітрі віноксидної покривається тонкою плівкою, що надає йому матовий колір. Кристалічна решітка магнію відноситься до гексагональної системі. Атомний радіус, (| 1, 6 | Радіус іона Mg²+, (| 0, 74 | Щільність (20 ˚ C), г/см 3 | 1, 739 | Температура плавлення. , OC | 651 | Температура кипіння, o˚C | 1107 | Теплота плавлення, кал/г-атом | 2100 | Теплота випаровування, кал/г-атом | 31000 | Теплота сублімації (при 25 o. C), кал/г-атом | 35000 | Питома теплоємність (20 o. C), кал/г-град | 0, 248 | Теплопровідність (20 o. C), кал/см (сек град | 0, 37 | Питомий електричний опір, Ом (см | 4, 5 (10 -6 | Поперечний перетин захоплення теплових електронів, барні | 0, 059 | Електропровідність ( Hg = 1) | 22 | У природі магній зустрічається у виді трьох стабільних ізотопів: 24 Mg (78, 60%), 25 Mg (10, 11%) і 26 Mg (11, 29%). Штучно були отримані ізотопиз масами 23, 27 і 28.
Ф ізичні властивості Магній — сріблисто-білий блискучий метал, порівняно м’який іпластичний, гарний провідник тепла й електрики. На повітрі віноксидної покривається тонкою плівкою, що надає йому матовий колір. Кристалічна решітка магнію відноситься до гексагональної системі. Атомний радіус, (| 1, 6 | Радіус іона Mg²+, (| 0, 74 | Щільність (20 ˚ C), г/см 3 | 1, 739 | Температура плавлення. , OC | 651 | Температура кипіння, o˚C | 1107 | Теплота плавлення, кал/г-атом | 2100 | Теплота випаровування, кал/г-атом | 31000 | Теплота сублімації (при 25 o. C), кал/г-атом | 35000 | Питома теплоємність (20 o. C), кал/г-град | 0, 248 | Теплопровідність (20 o. C), кал/см (сек град | 0, 37 | Питомий електричний опір, Ом (см | 4, 5 (10 -6 | Поперечний перетин захоплення теплових електронів, барні | 0, 059 | Електропровідність ( Hg = 1) | 22 | У природі магній зустрічається у виді трьох стабільних ізотопів: 24 Mg (78, 60%), 25 Mg (10, 11%) і 26 Mg (11, 29%). Штучно були отримані ізотопиз масами 23, 27 і 28.
 Кри сталічна гра т ка
Кри сталічна гра т ка
 • Майже в 5 разів легше міді, в 4, 5 рази легше заліза; навіть алюміній в 1, 5 рази важчий в ід магнію. Плавиться магній при темпратуре 651˚С, але у звичайних умовах розплавити його досить важко: нагріте на повітрі до 550˚С він спалахує і миттєво згоряє сліпучо яскравим полум’ям. Смужку магнієвої фольги легко підпалити звичайної сірником, а в атмосфері хлору магній самозаймається навіть при кімнатній температурі. При горінні магнію виділяється велика кількість ультрафіолетових променів і тепла — щоб нагріти склянку крижаної води до кипіння, потрібно спалити всього 4 г магнію.
• Майже в 5 разів легше міді, в 4, 5 рази легше заліза; навіть алюміній в 1, 5 рази важчий в ід магнію. Плавиться магній при темпратуре 651˚С, але у звичайних умовах розплавити його досить важко: нагріте на повітрі до 550˚С він спалахує і миттєво згоряє сліпучо яскравим полум’ям. Смужку магнієвої фольги легко підпалити звичайної сірником, а в атмосфері хлору магній самозаймається навіть при кімнатній температурі. При горінні магнію виділяється велика кількість ультрафіолетових променів і тепла — щоб нагріти склянку крижаної води до кипіння, потрібно спалити всього 4 г магнію.
 Хімічні властивості Звичайний промисловий метод отримання металевого магнію — це електроліз розплаву суміші безводних хлоридів магнію Mg. Cl 2 , натрію Na. Cl і калію KCl. В розплаві електрохімічного відновлення піддається хлорид магнію: Mg. Cl 2 ( електроліз) = Mg + Cl 2. Розплавлений метал періодично відбирають із електролізної ванни, а в неї додають нові порції магнійсодержащіе сировини. Так як отриманий таким способом магній містить порівняно багато (близько 0, 1%) домішок, при необхідності «сирий» магній піддають додатковому очищенню. З цією метою використовують електролітичне рафінування, переплавлення в вакуумі з використанням спеціальних добавок — флюсів, які «забирають» домішки від магнію або перегонку ( сублімацію) металу у вакуумі. Чистота рафінованої магнію досягає 99, 999% і вище. Розроблено й інший спосіб отримання магнію — термічний. У цьому випадку для відновлення оксиду магнію при високій температурі використовують кремній або кокс : Mg. O + C = Mg + CO Застосування кремнію дозволяє отримувати магній з такої сировини, як доломіт Ca. CO 3 Mg. CO 3 , не проводячи попереднього розділення магнію і кальцію. За участю доломіту протікають реакції: Ca. CO 3 Mg. CO 3 =Ca. O+Mg. O+2 CO 2 , 2 Mg. O+Ca. O+Si = Ca. Si. O 3 +2 Mg.
Хімічні властивості Звичайний промисловий метод отримання металевого магнію — це електроліз розплаву суміші безводних хлоридів магнію Mg. Cl 2 , натрію Na. Cl і калію KCl. В розплаві електрохімічного відновлення піддається хлорид магнію: Mg. Cl 2 ( електроліз) = Mg + Cl 2. Розплавлений метал періодично відбирають із електролізної ванни, а в неї додають нові порції магнійсодержащіе сировини. Так як отриманий таким способом магній містить порівняно багато (близько 0, 1%) домішок, при необхідності «сирий» магній піддають додатковому очищенню. З цією метою використовують електролітичне рафінування, переплавлення в вакуумі з використанням спеціальних добавок — флюсів, які «забирають» домішки від магнію або перегонку ( сублімацію) металу у вакуумі. Чистота рафінованої магнію досягає 99, 999% і вище. Розроблено й інший спосіб отримання магнію — термічний. У цьому випадку для відновлення оксиду магнію при високій температурі використовують кремній або кокс : Mg. O + C = Mg + CO Застосування кремнію дозволяє отримувати магній з такої сировини, як доломіт Ca. CO 3 Mg. CO 3 , не проводячи попереднього розділення магнію і кальцію. За участю доломіту протікають реакції: Ca. CO 3 Mg. CO 3 =Ca. O+Mg. O+2 CO 2 , 2 Mg. O+Ca. O+Si = Ca. Si. O 3 +2 Mg.
 Рівняння реакцій Горить яскравим полум’ям: 2 Mg+O 2 =2 Mg. O З галогеном : Mg+ Cl 2 = Mg. Cl 2 З воднем : Mg+H 2 = Mg. H 2 З розчинами кислот : Mg+2 HCl=Mg. Cl 2 +H 2 З водою : Mg+H 2 O= Mg. O+H 2 магній
Рівняння реакцій Горить яскравим полум’ям: 2 Mg+O 2 =2 Mg. O З галогеном : Mg+ Cl 2 = Mg. Cl 2 З воднем : Mg+H 2 = Mg. H 2 З розчинами кислот : Mg+2 HCl=Mg. Cl 2 +H 2 З водою : Mg+H 2 O= Mg. O+H 2 магній
 Хімічні властивості магнію досить своєрідні. Він легко забирає кисень і хлор у більшості елементів, не боїться їдких лугів, соди, гасу, бензину і мінеральних масел. З холодною водою магній майже не взаємодіє, але при нагріванні розкладає її з виділенням водню. ● У цьому відношенні він займає проміжне положення між берилієм, який взагалі з водою не реагує і кальцієм, легко з нею взаємодіє. Особливо інтенсивно йде реакція з водяною парою, нагрітим вище 380˚С: -2 e ● Mg 0 ( тв) + H 2 + + O ( газ) Mg 2 O ( тв) + H 20( газ).
Хімічні властивості магнію досить своєрідні. Він легко забирає кисень і хлор у більшості елементів, не боїться їдких лугів, соди, гасу, бензину і мінеральних масел. З холодною водою магній майже не взаємодіє, але при нагріванні розкладає її з виділенням водню. ● У цьому відношенні він займає проміжне положення між берилієм, який взагалі з водою не реагує і кальцієм, легко з нею взаємодіє. Особливо інтенсивно йде реакція з водяною парою, нагрітим вище 380˚С: -2 e ● Mg 0 ( тв) + H 2 + + O ( газ) Mg 2 O ( тв) + H 20( газ).
 ● Оскільки продуктом цієї реакції є водень ясно, що гасіння палаючого магнію водою неприпустимо: може відбутися освіта гримучої суміші водню з киснем і вибух. Не можна загасити палаючий магній і вуглекислим газом: магній відновлює його до вільного вуглецю 2 Mg+CO 2 = 2 Mg. O+
● Оскільки продуктом цієї реакції є водень ясно, що гасіння палаючого магнію водою неприпустимо: може відбутися освіта гримучої суміші водню з киснем і вибух. Не можна загасити палаючий магній і вуглекислим газом: магній відновлює його до вільного вуглецю 2 Mg+CO 2 = 2 Mg. O+
 ● Припинити до палаючого магнію доступ кисню можна засипавши його піском, хоча і з оксидом кремнію ( IV) магній взаємодіє, але зі значно меншим виділенням теплоти: 2 Mg + Si. O 2 = 2 Mg о + Si цим і визначається неможливість використання піску для гасіння кремнію. Небезпека спалаху магнію при інтенсивному нагріванні одна з причин, за якими його використання як технічного матеріалу обмежена.
● Припинити до палаючого магнію доступ кисню можна засипавши його піском, хоча і з оксидом кремнію ( IV) магній взаємодіє, але зі значно меншим виділенням теплоти: 2 Mg + Si. O 2 = 2 Mg о + Si цим і визначається неможливість використання піску для гасіння кремнію. Небезпека спалаху магнію при інтенсивному нагріванні одна з причин, за якими його використання як технічного матеріалу обмежена.
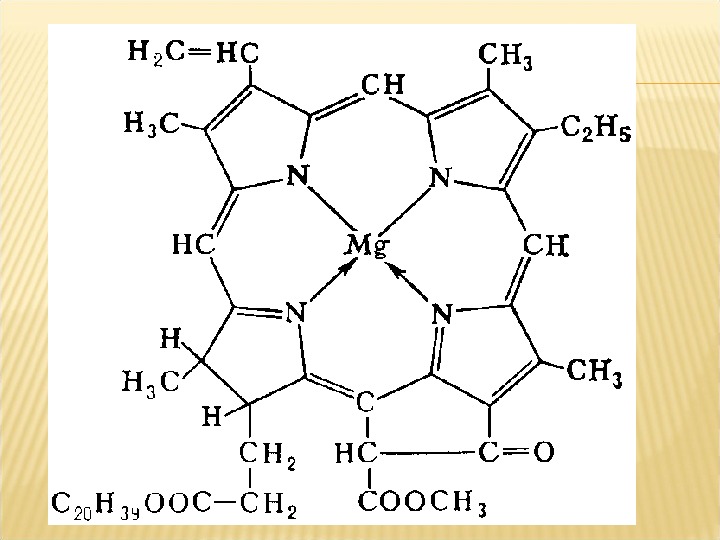
 Елемент магній входить до складу хлорофілу і бере участь в процесі фотосинтезу рослин. Недолік магнію в першу чергу наступає на кислих грунтах. При недоліку магнію листя бліднуть, можливий хлороз, на листовій пластинці починається пожовтіння між жилками, дрібні цятки, збільшуються в розмірах самі жилки залишаються зеленими. Потім лист рослини набуває жовтий, оранжевий, червоний або фіолетовий відтінок, буріє і відмирає. Недолік магнію затримує цвітіння, сповільнюється зростання всієї рослини. Недолік магнію виявляється в першу чергу на старих нижніх листках рослин. Магній одержують з органічних добрив або додають сірчанокислий магній.
Елемент магній входить до складу хлорофілу і бере участь в процесі фотосинтезу рослин. Недолік магнію в першу чергу наступає на кислих грунтах. При недоліку магнію листя бліднуть, можливий хлороз, на листовій пластинці починається пожовтіння між жилками, дрібні цятки, збільшуються в розмірах самі жилки залишаються зеленими. Потім лист рослини набуває жовтий, оранжевий, червоний або фіолетовий відтінок, буріє і відмирає. Недолік магнію затримує цвітіння, сповільнюється зростання всієї рослини. Недолік магнію виявляється в першу чергу на старих нижніх листках рослин. Магній одержують з органічних добрив або додають сірчанокислий магній.


 Добова потреба і основні джерела надходження: становить 0. 05% від маси тіла. Загальна вміст магнію в організмі людини становить приблизно 21 р. Щодня потреба в магнії — 0, 250 -0, 500 р. Особливо багата магнієм рослинна їжа — Необроблені зернові, фіги, мигдаль, горіхи, темно-зелені овочі, банани. Значна кількість магнію міститься в горіхах і зернових культурах (пшеничні висівки, борошно грубого помелу), урюк, куразі, сливах (чорнослив), фініках, какао (порошок). Багаті їм риба (особливо лососеві), соя, горіхи, хліб з висівками, шоколад, свіжі фрукти (особливо банани), кавуни. Магній містять крупи (вівсяна, пшоняна, гречана), бобові (квасоля, горох), морська капуста, кальмари, м’ясо, яйця, хліб зелень (шпинат, петрушка, салат, кріп), лимони, грейпфрути, мигдаль, горіхи, халва (соняшникова і тахіна), яблука.
Добова потреба і основні джерела надходження: становить 0. 05% від маси тіла. Загальна вміст магнію в організмі людини становить приблизно 21 р. Щодня потреба в магнії — 0, 250 -0, 500 р. Особливо багата магнієм рослинна їжа — Необроблені зернові, фіги, мигдаль, горіхи, темно-зелені овочі, банани. Значна кількість магнію міститься в горіхах і зернових культурах (пшеничні висівки, борошно грубого помелу), урюк, куразі, сливах (чорнослив), фініках, какао (порошок). Багаті їм риба (особливо лососеві), соя, горіхи, хліб з висівками, шоколад, свіжі фрукти (особливо банани), кавуни. Магній містять крупи (вівсяна, пшоняна, гречана), бобові (квасоля, горох), морська капуста, кальмари, м’ясо, яйця, хліб зелень (шпинат, петрушка, салат, кріп), лимони, грейпфрути, мигдаль, горіхи, халва (соняшникова і тахіна), яблука.
 1) входить до складу майже 300 ферментів; 2) комплекси магнію з фосфоліпідами знижують плинність клітинних мембран; 3) бере участь у підтримці нормальної температури тіла; 4) бере участь у роботі нервово-м’язового апарату.
1) входить до складу майже 300 ферментів; 2) комплекси магнію з фосфоліпідами знижують плинність клітинних мембран; 3) бере участь у підтримці нормальної температури тіла; 4) бере участь у роботі нервово-м’язового апарату.
 Магній є необхідною складовою частиною всіх клітин і тканин, беручи участь у місці з іонами інших елементів у збереженні іонного рівноваги рідких середовищ організму; входить до складу ферментів, пов’язаних з обміном фосфору і вуглеводів; активує фосфатазу плазми і кісток і бере участь у процесі нервово-м’язової збудливості. Значення магнію, як макроелементи, в життєдіяльності виявляється в тому, що він є універсальним регулятором біохімічних і фізіологічних процесів в організмі. Магній, вступаючи у зворотні зв’язки з багатьма органічними речовинами, забезпечує можливість метаболізму близько 300 ферментів, Магній необхідний для підтримання структури рибосом, нуклеїнових кислот і деяких білків. Він бере участь у реакціях окисного фосфорилювання, синтезі білка, обміні нуклеїнових кислот і ліпідів. Магній контролює нормальне функціонування міокардіоцитів. Він має велике значення в регуляції скорочувальної функції міокарда.
Магній є необхідною складовою частиною всіх клітин і тканин, беручи участь у місці з іонами інших елементів у збереженні іонного рівноваги рідких середовищ організму; входить до складу ферментів, пов’язаних з обміном фосфору і вуглеводів; активує фосфатазу плазми і кісток і бере участь у процесі нервово-м’язової збудливості. Значення магнію, як макроелементи, в життєдіяльності виявляється в тому, що він є універсальним регулятором біохімічних і фізіологічних процесів в організмі. Магній, вступаючи у зворотні зв’язки з багатьма органічними речовинами, забезпечує можливість метаболізму близько 300 ферментів, Магній необхідний для підтримання структури рибосом, нуклеїнових кислот і деяких білків. Він бере участь у реакціях окисного фосфорилювання, синтезі білка, обміні нуклеїнових кислот і ліпідів. Магній контролює нормальне функціонування міокардіоцитів. Він має велике значення в регуляції скорочувальної функції міокарда.
 Особливе значення має магній у функціонуванні нервової тканини та провідної системи серця. Гарна забезпеченість організму магнієм сприяє кращій переносимості стресовій ситуації, придушення депресії. Важливий для метаболізму кальцію, фосфору, натрію, калію, а також вітаміну С. Магній добре взаємодіє з вітаміном А. Таким чином, магній забезпечує нормальне функціонування як окремих клітин, так і відділів серця в цілому — передсердь, шлуночків. Знижений рівень магнію в крові (виявлений у дітей із зайвою вагою) асоціюється з резистентністю до інсуліну, тобто, є першим кроком до розвитку цукрового діабету. У раціоні здорових дітей відзначений явний дефіцит продуктів, багатих на магній — риби, соєвих, овочів, горіхів. Магній відіграє важливу роль у метаболізмі вуглеводів, його дефіцит є вже доведеним чинником ризику діабету у дорослих, а тепер — виходячи з даних цього дослідження — і у дітей.
Особливе значення має магній у функціонуванні нервової тканини та провідної системи серця. Гарна забезпеченість організму магнієм сприяє кращій переносимості стресовій ситуації, придушення депресії. Важливий для метаболізму кальцію, фосфору, натрію, калію, а також вітаміну С. Магній добре взаємодіє з вітаміном А. Таким чином, магній забезпечує нормальне функціонування як окремих клітин, так і відділів серця в цілому — передсердь, шлуночків. Знижений рівень магнію в крові (виявлений у дітей із зайвою вагою) асоціюється з резистентністю до інсуліну, тобто, є першим кроком до розвитку цукрового діабету. У раціоні здорових дітей відзначений явний дефіцит продуктів, багатих на магній — риби, соєвих, овочів, горіхів. Магній відіграє важливу роль у метаболізмі вуглеводів, його дефіцит є вже доведеним чинником ризику діабету у дорослих, а тепер — виходячи з даних цього дослідження — і у дітей.

