Low-molecular biologic compounds 2-11.pptx
- Количество слайдов: 58

Low-molecular biologic compounds Lecture #2 1
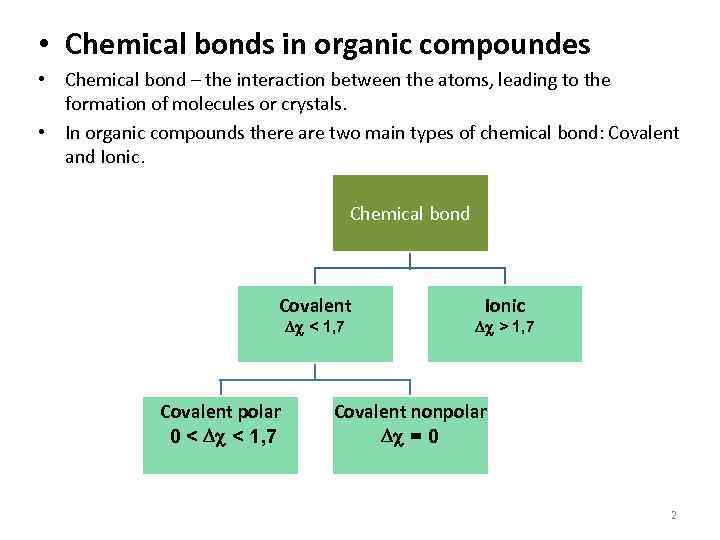
• Chemical bonds in organic compoundes • Chemical bond – the interaction between the atoms, leading to the formation of molecules or crystals. • In organic compounds there are two main types of chemical bond: Covalent and Ionic. Chemical bond Covalent Dc < 1, 7 Covalent polar 0 < Dc < 1, 7 Ionic Dc > 1, 7 Covalent nonpolar Dc = 0 2
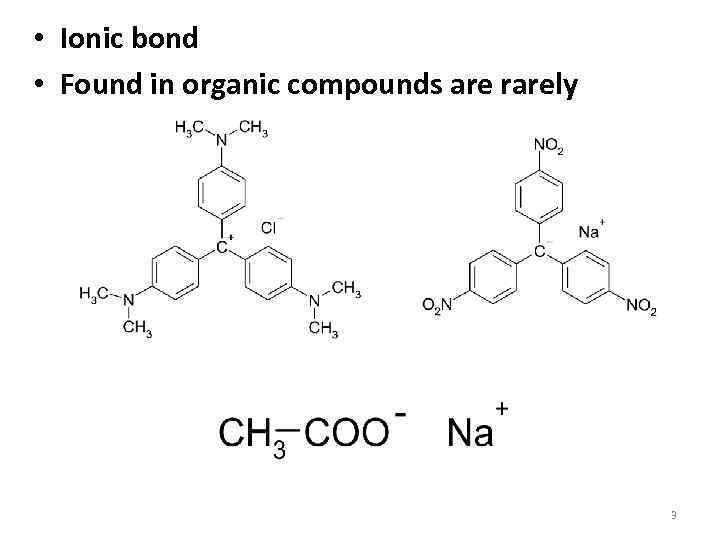
• Ionic bond • Found in organic compounds are rarely 3
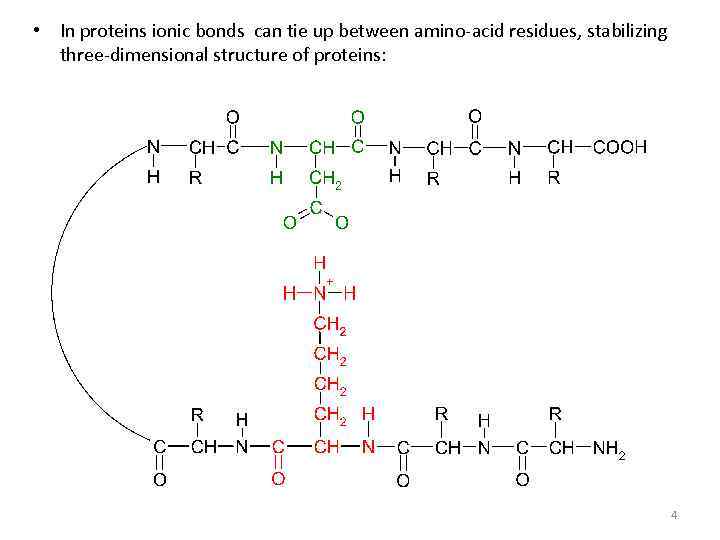
• In proteins ionic bonds can tie up between amino-acid residues, stabilizing three-dimensional structure of proteins: 4
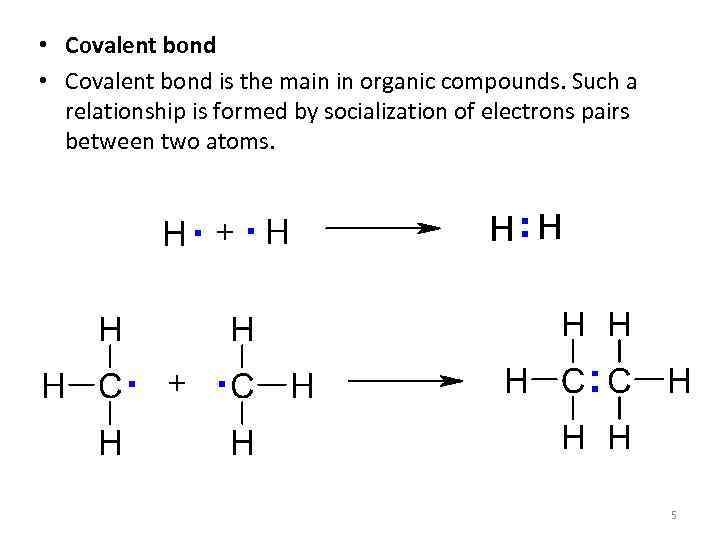
• Covalent bond is the main in organic compounds. Such a relationship is formed by socialization of electrons pairs between two atoms. 5
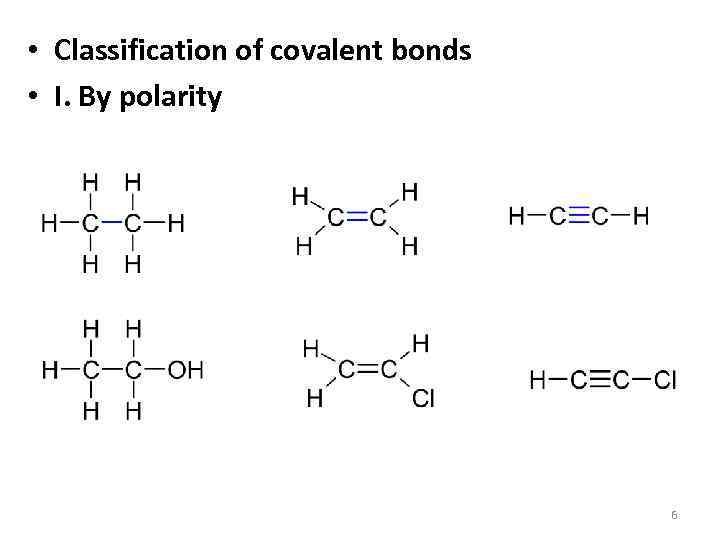
• Classification of covalent bonds • I. By polarity 6
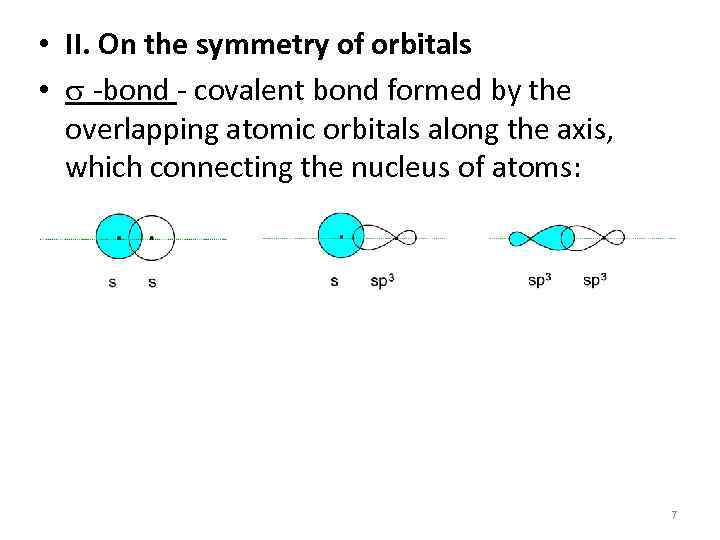
• II. On the symmetry of orbitals • s -bond - covalent bond formed by the overlapping atomic orbitals along the axis, which connecting the nucleus of atoms: 7
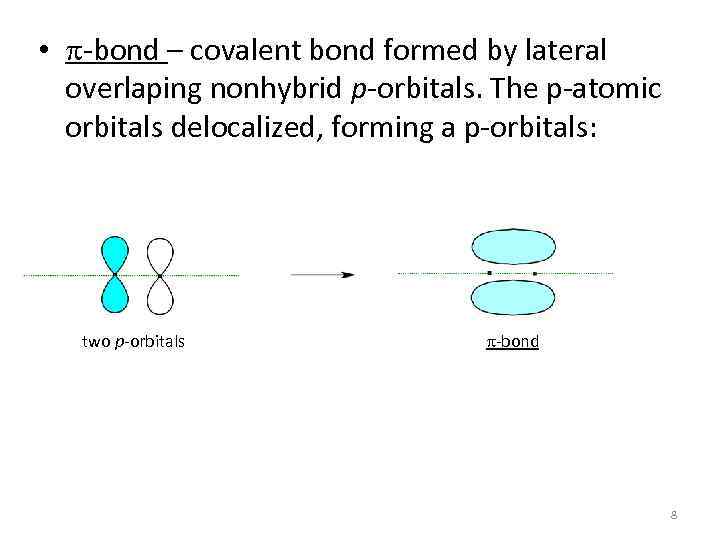
• p-bond – covalent bond formed by lateral overlaping nonhybrid p-orbitals. The p-atomic orbitals delocalized, forming a p-orbitals: two p-orbitals p-bond 8
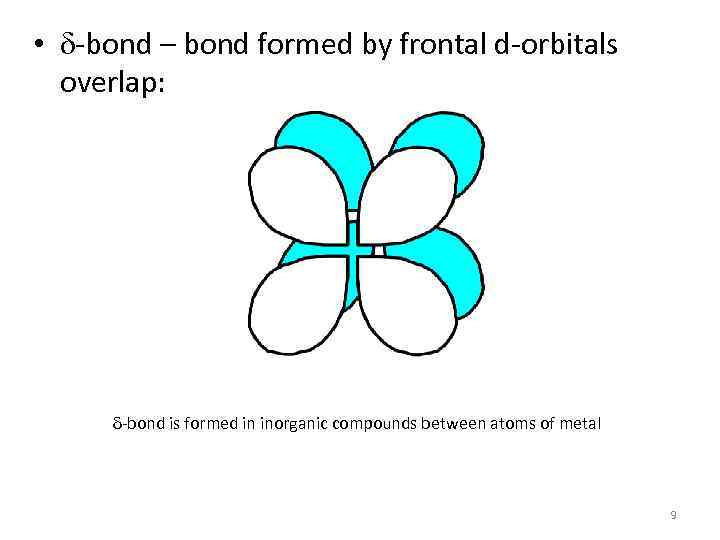
• d-bond – bond formed by frontal d-orbitals overlap: d-bond is formed in inorganic compounds between atoms of metal 9
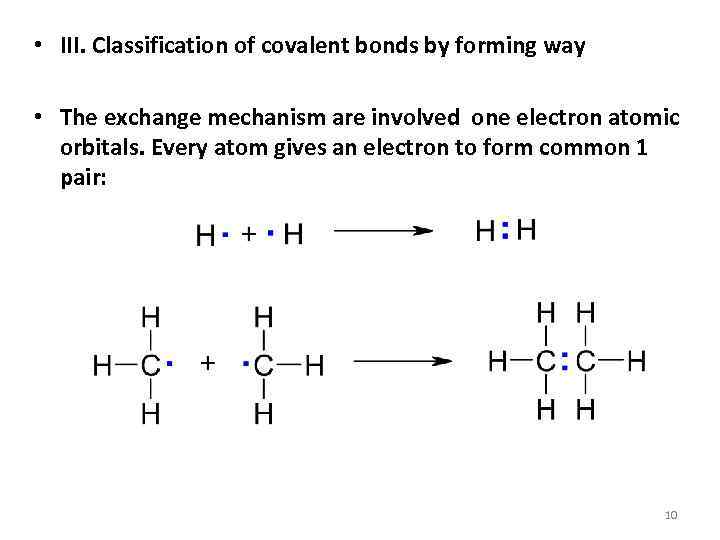
• III. Classification of covalent bonds by forming way • The exchange mechanism are involved one electron atomic orbitals. Every atom gives an electron to form common 1 pair: 10
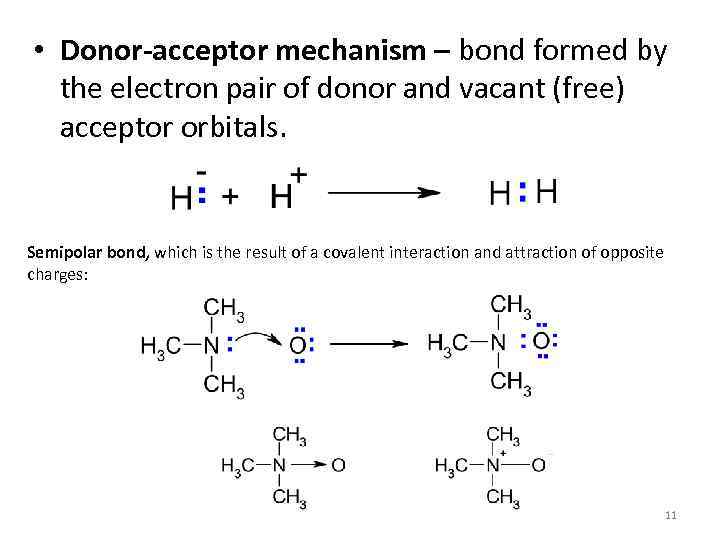
• Donor-acceptor mechanism – bond formed by the electron pair of donor and vacant (free) acceptor orbitals. Semipolar bond, which is the result of a covalent interaction and attraction of opposite charges: 11
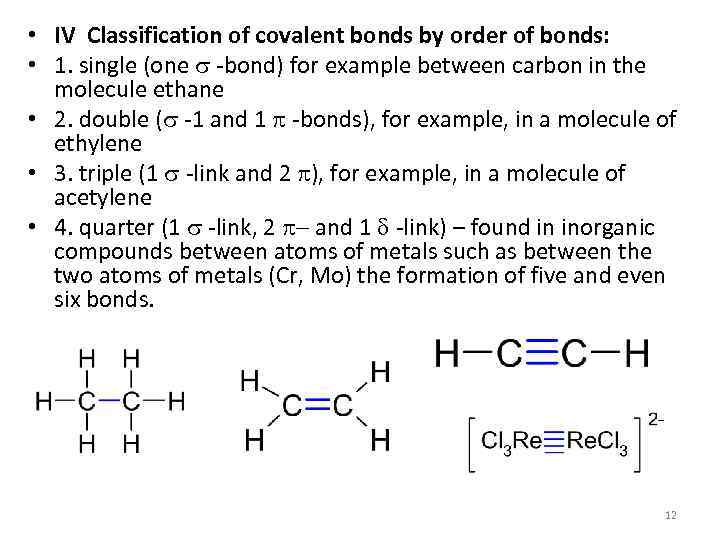
• IV Classification of covalent bonds by order of bonds: • 1. single (one s -bond) for example between carbon in the molecule ethane • 2. double (s -1 and 1 p -bonds), for example, in a molecule of ethylene • 3. triple (1 s -link and 2 p), for example, in a molecule of acetylene • 4. quarter (1 s -link, 2 p- and 1 d -link) – found in inorganic compounds between atoms of metals such as between the two atoms of metals (Cr, Mo) the formation of five and even six bonds. 12
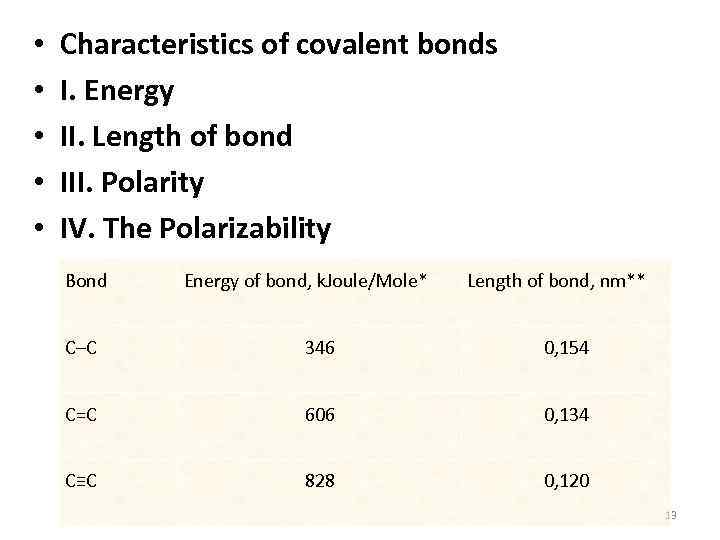
• • • Characteristics of covalent bonds Ι. Energy II. Length of bond III. Polarity IV. The Polarizability Bond Energy of bond, k. Joule/Mole* Length of bond, nm** С–С 346 0, 154 С=С 606 0, 134 С≡С 828 0, 120 13
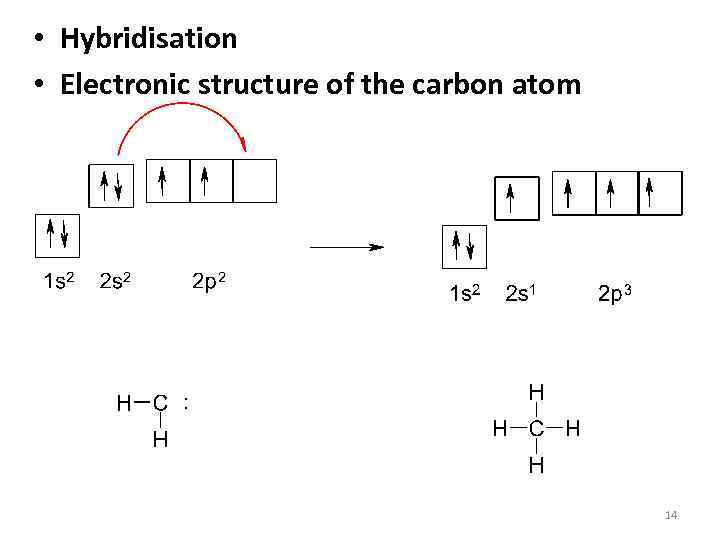
• Hybridisation • Electronic structure of the carbon atom 14
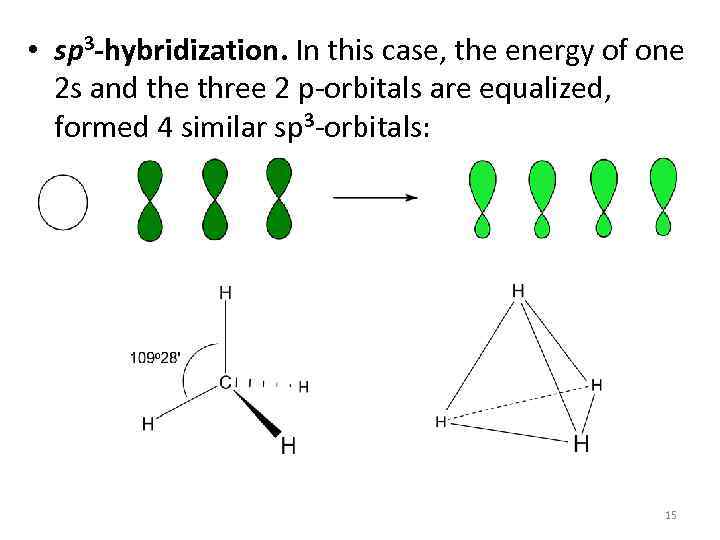
• sp 3 -hybridization. In this case, the energy of one 2 s and the three 2 p-orbitals are equalized, formed 4 similar sp 3 -orbitals: 15

• sp 2 - hybridization. • Energy one 2 s and two 2 p-orbitals are equalized, formed the same 3 sp 2 orbitals and one p-nonhybrid orbitals: 16
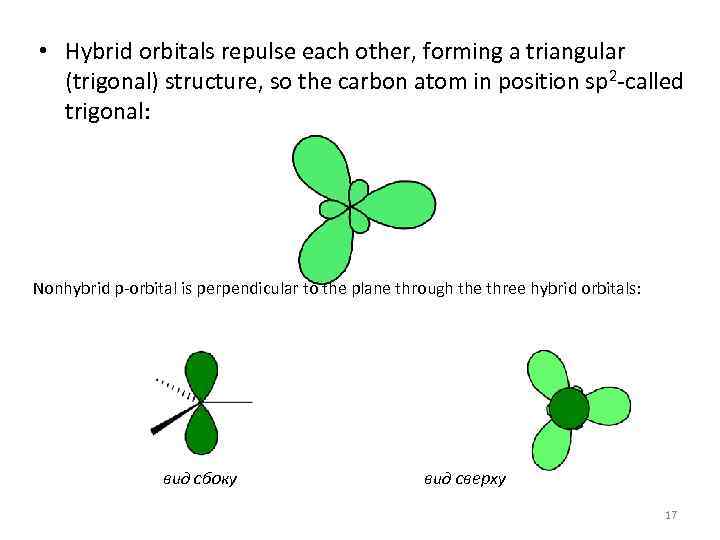
• Hybrid orbitals repulse each other, forming a triangular (trigonal) structure, so the carbon atom in position sp 2 -called trigonal: Nonhybrid p-orbital is perpendicular to the plane through the three hybrid orbitals: вид сбоку вид сверху 17
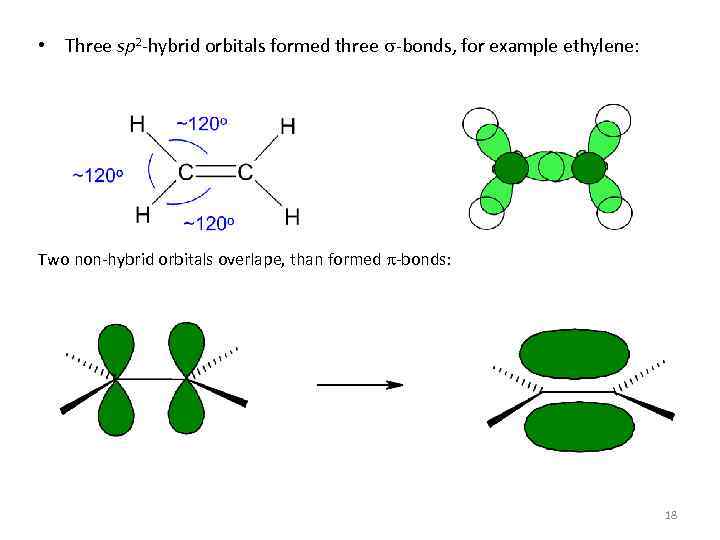
• Three sp 2 -hybrid orbitals formed three s-bonds, for example ethylene: Two non-hybrid orbitals overlape, than formed p-bonds: 18
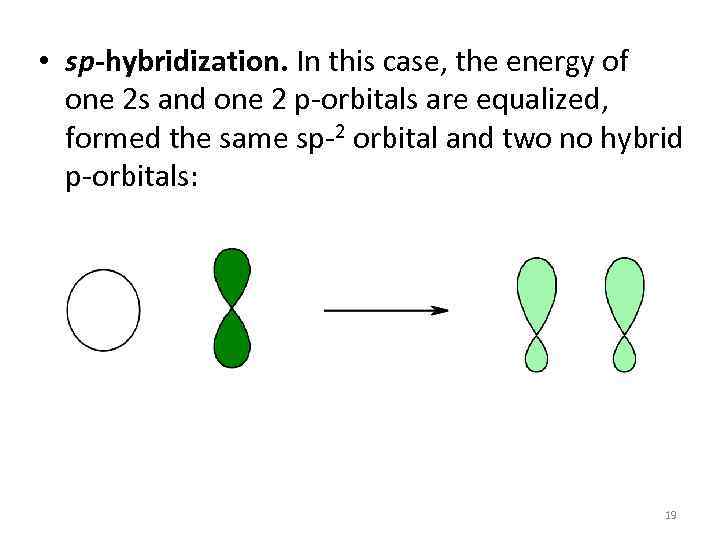
• sp-hybridization. In this case, the energy of one 2 s and one 2 p-orbitals are equalized, formed the same sp-2 orbital and two no hybrid p-orbitals: 19
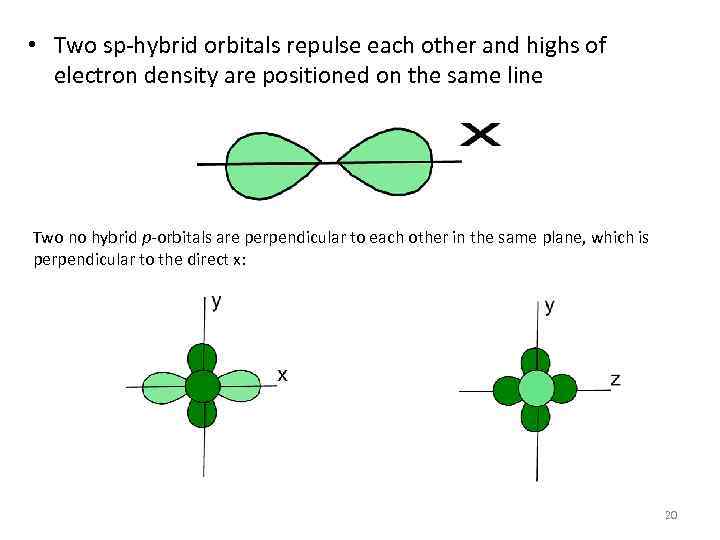
• Two sp-hybrid orbitals repulse each other and highs of electron density are positioned on the same line Two no hybrid p-orbitals are perpendicular to each other in the same plane, which is perpendicular to the direct x: 20
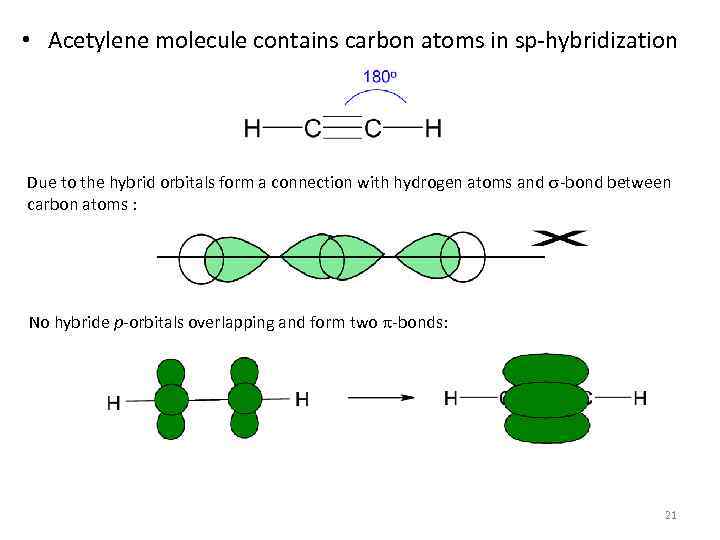
• Acetylene molecule contains carbon atoms in sp-hybridization Due to the hybrid orbitals form a connection with hydrogen atoms and s-bond between carbon atoms : No hybride p-orbitals overlapping and form two p-bonds: 21

• Other types of interaction Hydrogen bond – the attraction of protonized hydrogen atoms, attached to the electonegative atom or any other atom whith a negative charge. 22
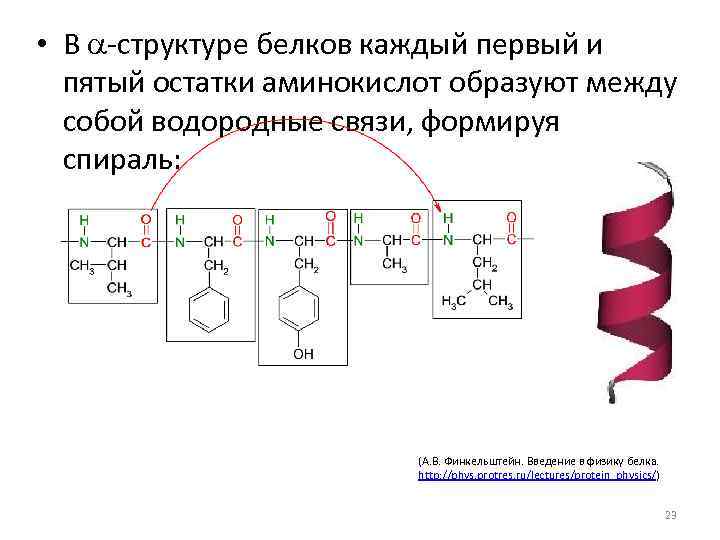
• В a-структуре белков каждый первый и пятый остатки аминокислот образуют между собой водородные связи, формируя спираль: (А. В. Финкельштейн. Введение в физику белка. http: //phys. protres. ru/lectures/protein_physics/) 23
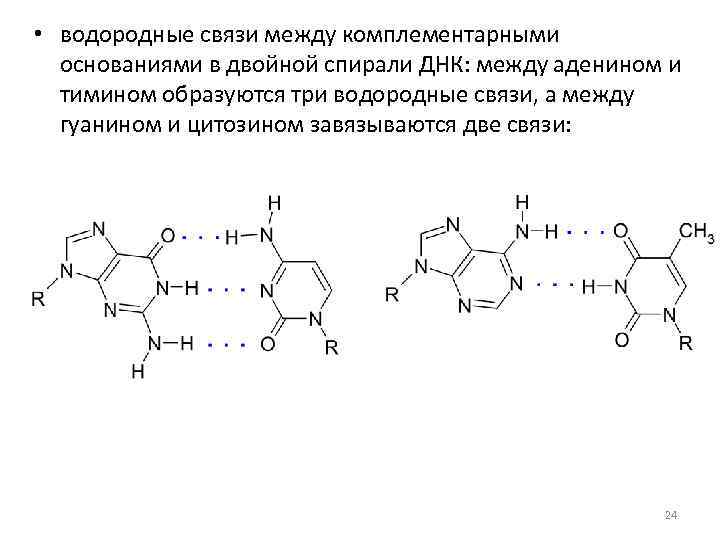
• водородные связи между комплементарными основаниями в двойной спирали ДНК: между аденином и тимином образуются три водородные связи, а между гуанином и цитозином завязываются две связи: 24
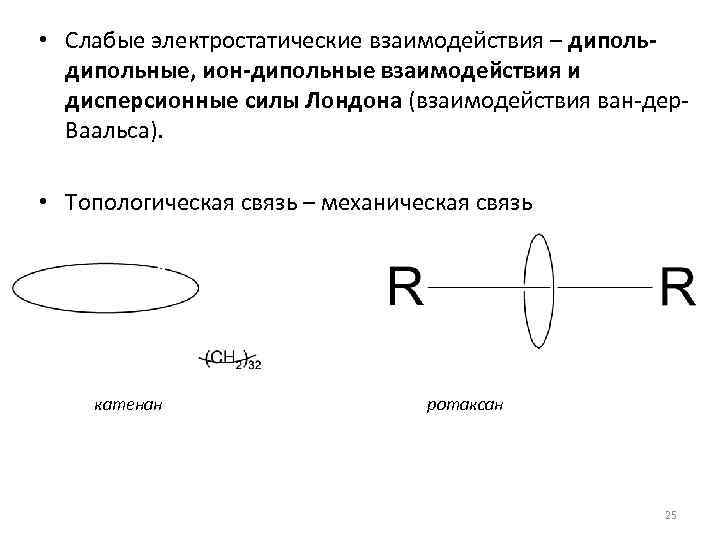
• Слабые электростатические взаимодействия – дипольные, ион-дипольные взаимодействия и дисперсионные силы Лондона (взаимодействия ван-дер. Ваальса). • Топологическая связь – механическая связь катенан ротаксан 25

Поляризация связей Атомы в молекуле влияют друг на друга, поляризуя связи. При этом на атомах появляется частичный заряд: d- или d+ (дельта минус или дельта плюс). Взаимное влияние может осуществляться по системе s-связей (индуктивный эффект), по системе p-связей (мезомерный эффект) и через пространство (эффект поля). 26

• 1. 1. Индуктивный эффект (I-эффект) – смещение электронной плотности по цепи s-связей, которое обусловлено различиями в электроотрицательностях атомов: 27

• –I эффект проявляют заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl, -Br, -OH, -NH 2, -NO 2, >C=O, -COOH и др. • +I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: Металлы (-Mg-, -Li); насыщенные углеводородные радикалы (-CH 3, -C 2 H 5) и т. п. 28

– 1. 2. Мезомерный эффект - смещение электронной плотности по цепи сопряженных p-связей. Возникает только при наличии сопряжения связей. Сопряжение связей – взаимодействие между орбиталями отдельных фрагментов молекулы. • p, p -сопряжение • другие виды 29

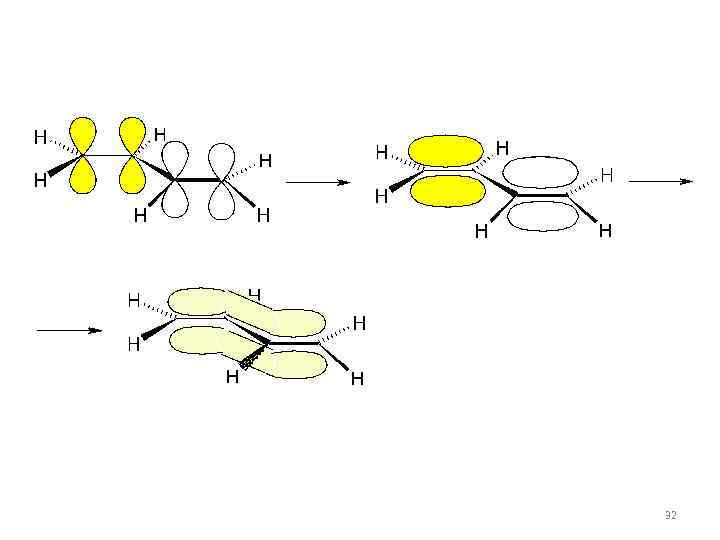
• p, p -сопряжение возникает тогда, когда в молекуле есть чередование простых и кратных (двойных или тройных) связей. 30
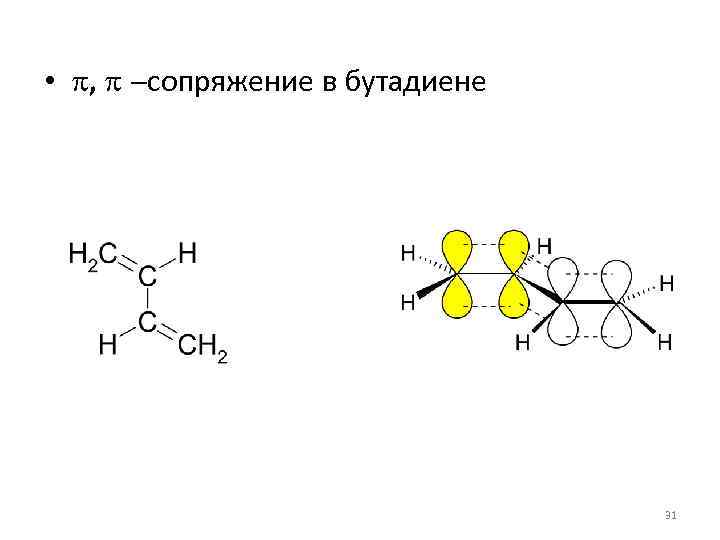
• p, p -сопряжение в бутадиене 31
32
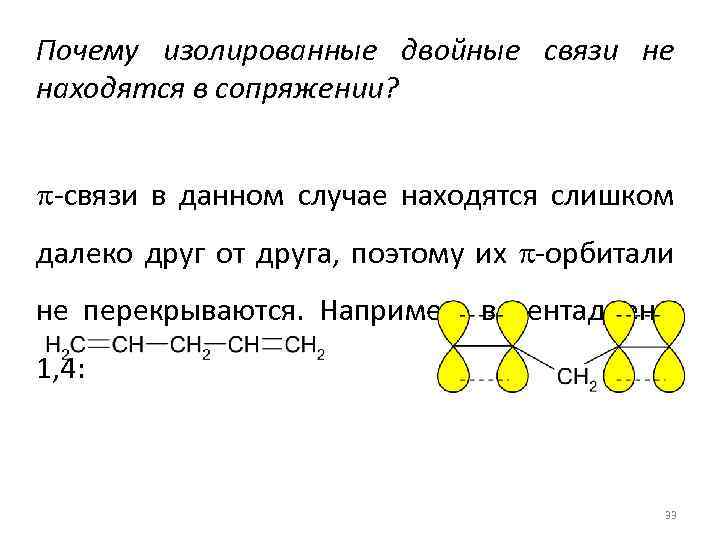
Почему изолированные двойные связи не находятся в сопряжении? p-связи в данном случае находятся слишком далеко друг от друга, поэтому их p-орбитали не перекрываются. Например, в пентадиене 1, 4: 33
![• p, p -сопряжение возникает в системе: [кратная связь, простая связь, p-орбиталь] На • p, p -сопряжение возникает в системе: [кратная связь, простая связь, p-орбиталь] На](https://present5.com/presentation/174770631_179473586/image-34.jpg)
• p, p -сопряжение возникает в системе: [кратная связь, простая связь, p-орбиталь] На p-орбитали может находится 2, 1 и 0 электронов: 34
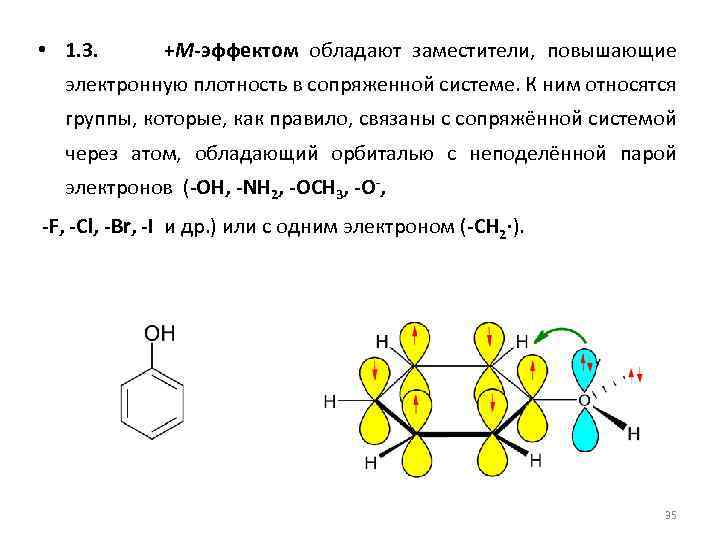
• 1. 3. +М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся группы, которые, как правило, связаны с сопряжённой системой через атом, обладающий орбиталью с неподелённой парой электронов (-OH, -NH 2, -OCH 3, -O-, -F, -Cl, -Br, -I и др. ) или с одним электроном (-CH 2∙). 35
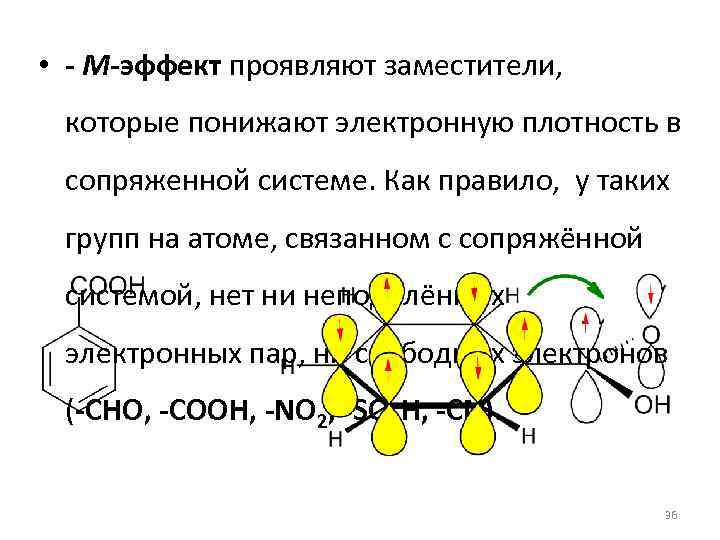
• - М-эффект проявляют заместители, которые понижают электронную плотность в сопряженной системе. Как правило, у таких групп на атоме, связанном с сопряжённой системой, нет ни неподелённых электронных пар, ни свободных электронов (-CHO, -COOH, -NO 2, -SO 3 H, -CN). 36
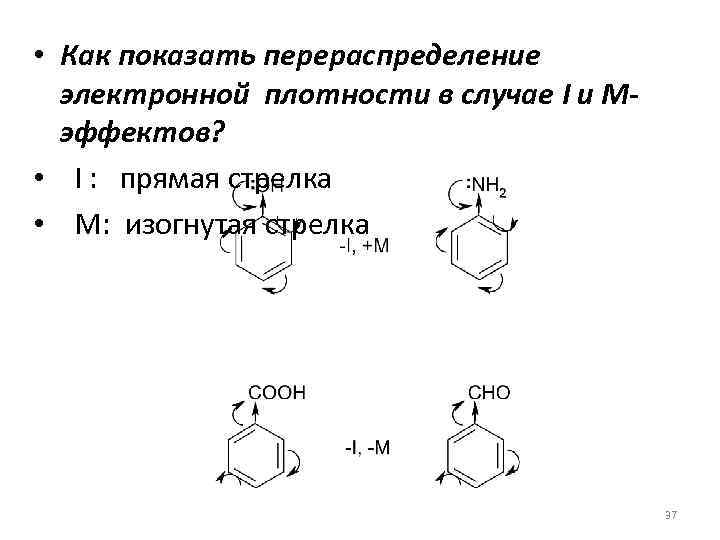
• Как показать перераспределение электронной плотности в случае I и Мэффектов? • I : прямая стрелка • М: изогнутая стрелка 37
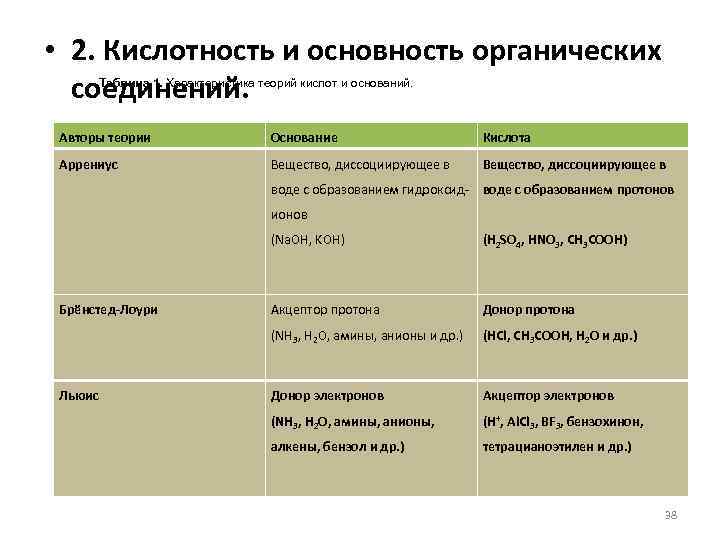
• 2. Кислотность и основность органических соединений. Таблица 1. Характеристика теорий кислот и оснований. Авторы теории Основание Кислота Аррениус Вещество, диссоциирующее в воде с образованием гидроксид- воде с образованием протонов ионов (Na. OH, KOH) Льюис (H 2 SO 4, HNO 3, CH 3 COOH) Акцептор протона Донор протона (NH 3, H 2 O, амины, анионы и др. ) Брёнстед-Лоури (HCl, CH 3 COOH, H 2 O и др. ) Донор электронов Акцептор электронов (NH 3, H 2 O, амины, анионы, (H+, Al. Cl 3, BF 3, бензохинон, алкены, бензол и др. ) тетрацианоэтилен и др. ) 38
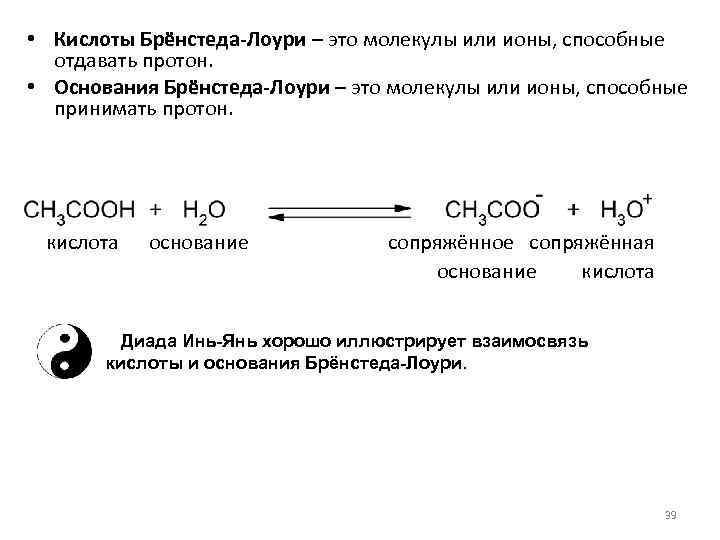
• Кислоты Брёнстеда-Лоури – это молекулы или ионы, способные отдавать протон. • Основания Брёнстеда-Лоури – это молекулы или ионы, способные принимать протон. кислота основание сопряжённое сопряжённая основание кислота Диада Инь-Янь хорошо иллюстрирует взаимосвязь кислоты и основания Брёнстеда-Лоури. 39
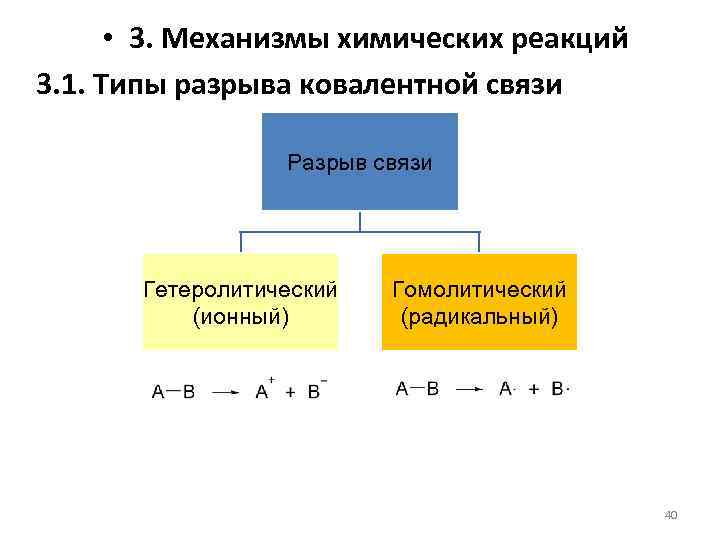
• 3. Механизмы химических реакций 3. 1. Типы разрыва ковалентной связи Разрыв связи Гетеролитический (ионный) Гомолитический (радикальный) 40

• 3. 1. 1. Классификация органических реакций по типу частиц, участвующих в реакции 1. Радикальные реакции (например, радикальное замещение SR, радикальное присоединение AR) 2. Электрофильные реакции (например, электрофильное замещение SE, электрофильное присоединение AE). Электрофилы - ("любящие электроны") – это частицы (катионы или молекулы), имеющие свободную орбиталь, на которую они могут принимать электроны (“электрофил” это синоним кислоты Льюиса). Примеры электрофилов: H+, Br+, Cl+, NO 2+ (катион нитрония), карбокатионы, Br 2, Cl 2, SO 3 3. Нуклеофильные нуклеофильные (например, нуклеофильное замещение SE, нуклеофильное присоединение AE) Нуклеофил (nucleus – ядро (а оно положительно заряжено!) filew - любить) – частица, имеющая отрицательный заряд или подвижную электронную пару. Нуклеофилы являются основаниями Льюиса. Примеры нуклеофилов: H-, F-, Cl-, Br-, I-, OH-, CH 3 O-, H 2 O, спирты, NH 3, амины 4. “Без механизма”. Реакции, протекающие без образования и участия радикалов или ионов. Например, реакция Дильса-Альдера. 41
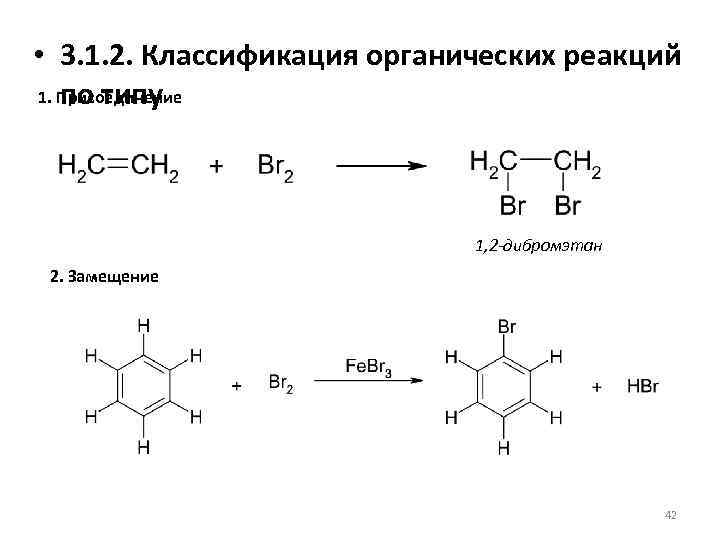
• 3. 1. 2. Классификация органических реакций 1. Присоединение по типу 1, 2 -дибромэтан 2. Замещение 42
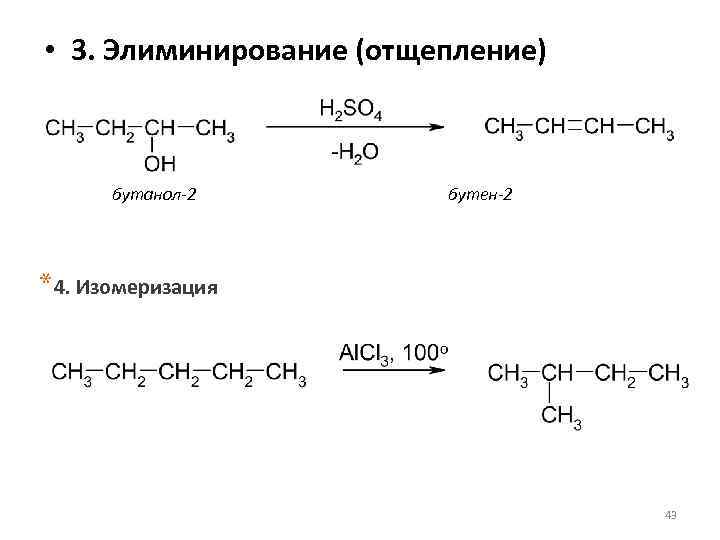
• 3. Элиминирование (отщепление) бутанол-2 бутен-2 *4. Изомеризация 43

• 5. Окислительно-восстановительные реакции (ОВ-реакции). Окисление – процесс перехода электронов от субстрата к окислителю. Восстановление – процесс перехода электронов от восстановителя к субстрату. 44
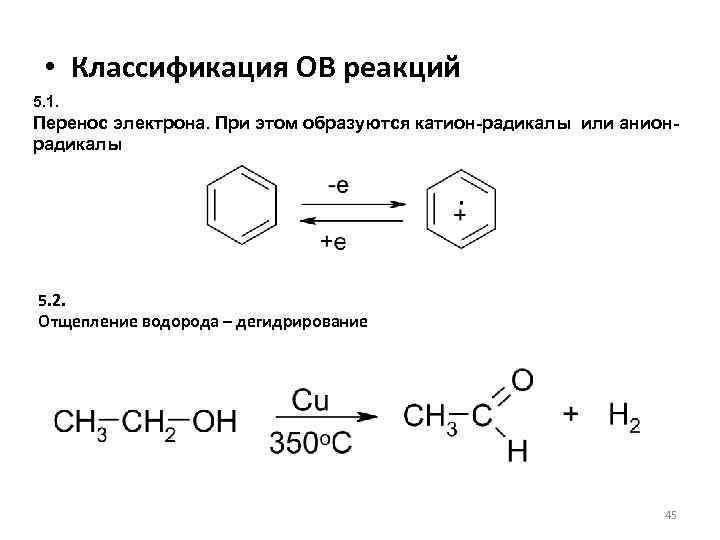
• Классификация ОВ реакций 5. 1. Перенос электрона. При этом образуются катион-радикалы или анионрадикалы 5. 2. Отщепление водорода – дегидрирование 45
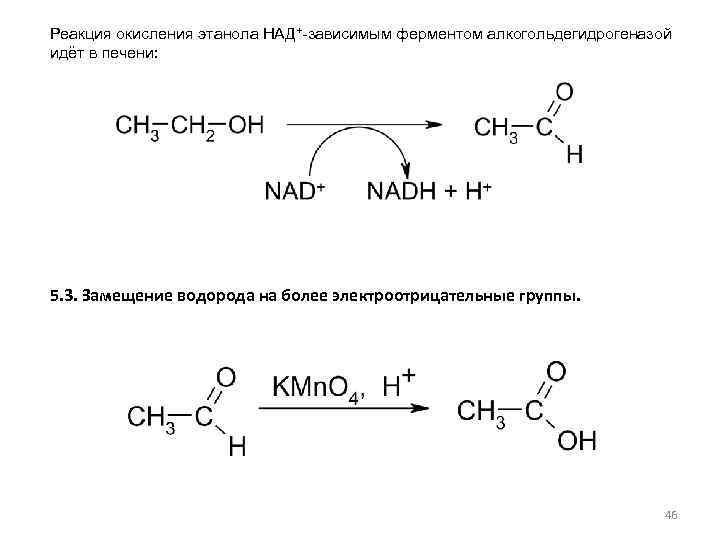
Реакция окисления этанола НАД+-зависимым ферментом алкогольдегидрогеназой идёт в печени: 5. 3. Замещение водорода на более электроотрицательные группы. 46
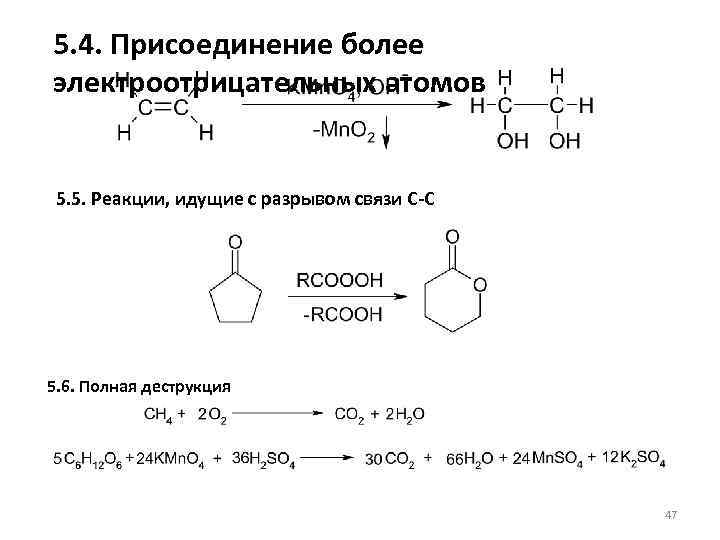
5. 4. Присоединение более электроотрицательных атомов 5. 5. Реакции, идущие с разрывом связи С-С 5. 6. Полная деструкция 47

• 4. Изомерия – явление существование веществ, имеющих одинаковую молекулярную формулу (т. е. имеющих одинаковый качественный и количественный состав), но различных по физическим и химическим свойствам. 48
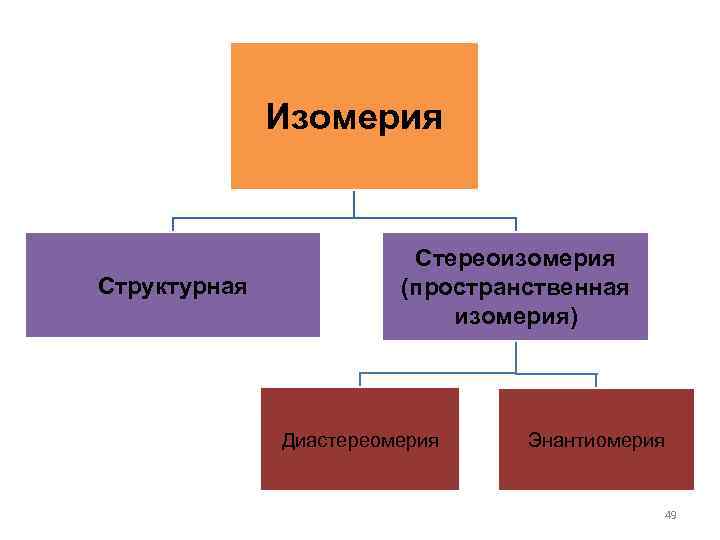
Изомерия Структурная Стереоизомерия (пространственная изомерия) Диастереомерия Энантиомерия 49
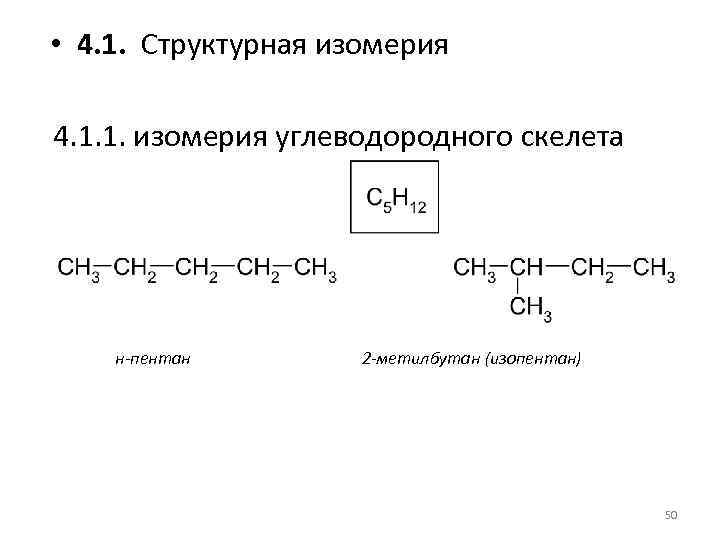
• 4. 1. Структурная изомерия 4. 1. 1. изомерия углеводородного скелета н-пентан 2 -метилбутан (изопентан) 50
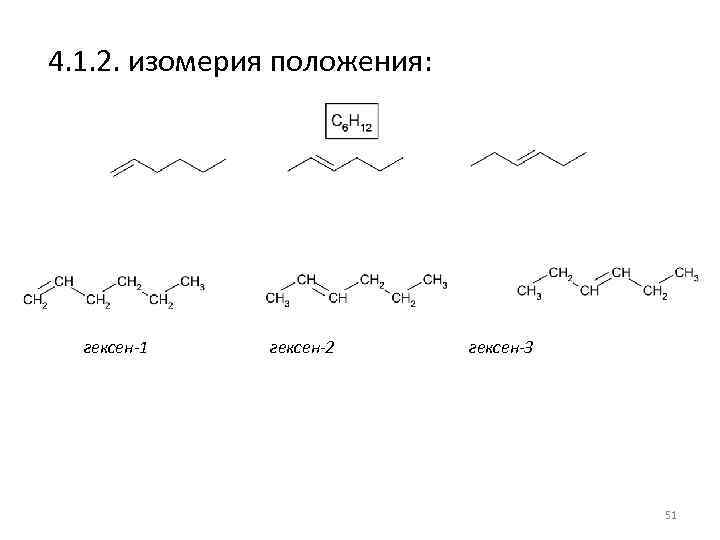
4. 1. 2. изомерия положения: гексен-1 гексен-2 гексен-3 51
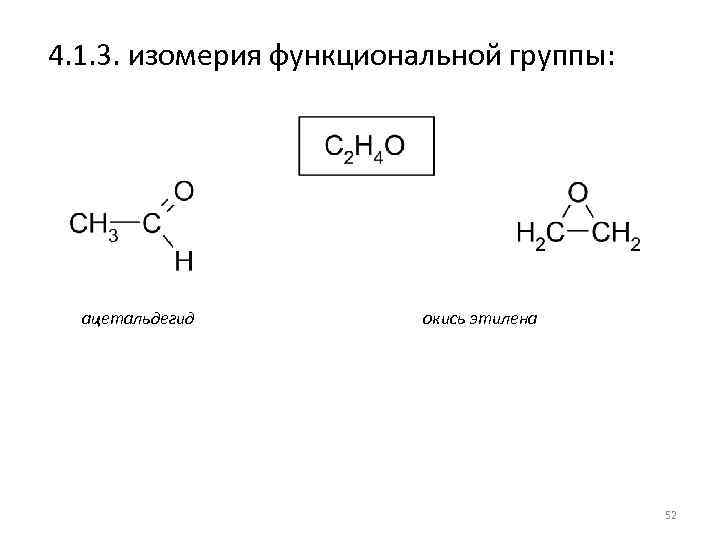
4. 1. 3. изомерия функциональной группы: ацетальдегид окись этилена 52
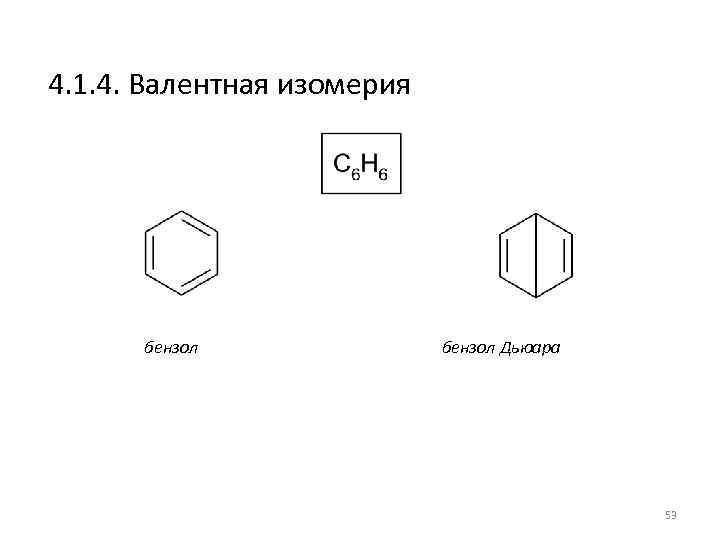
4. 1. 4. Валентная изомерия бензол Дьюара 53

• 4. 2. Стереоизомеры различаются пространственным расположением атомов в молекулах, т. е. стереоизомеры имеют различную конфигурацию. При этом последовательность связей в их молекулах одинакова. • Конфигурация – относительное пространственное расположение атомов в молекуле. 54
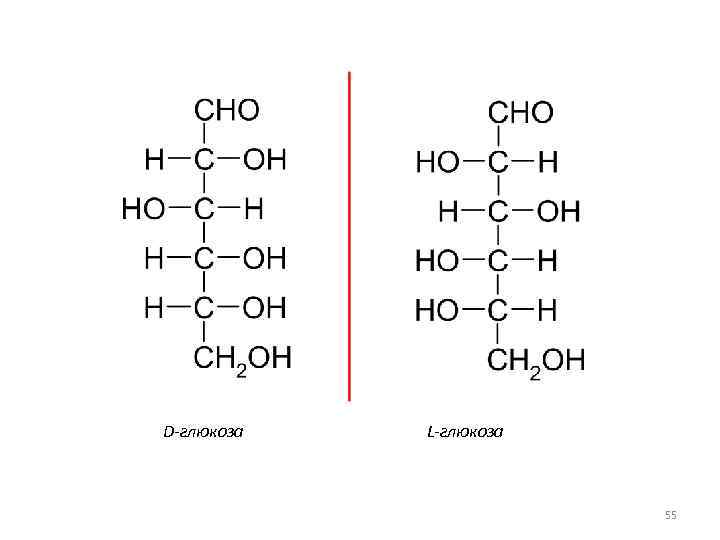
D-глюкоза L-глюкоза 55
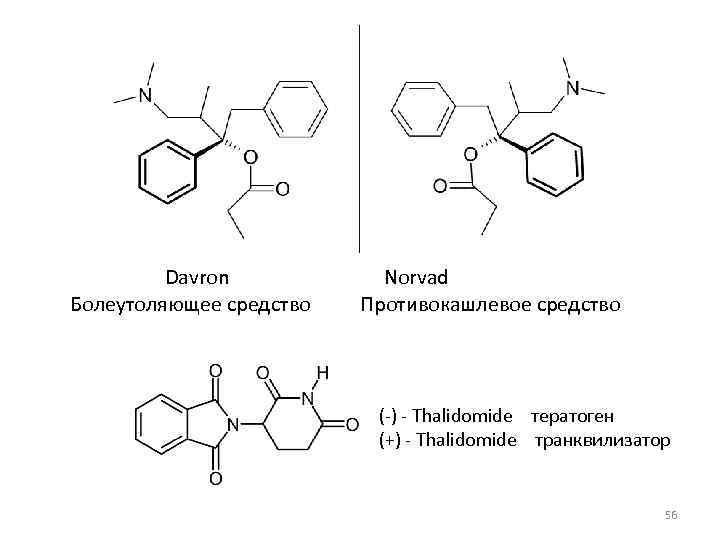
Davron Norvad Болеутоляющее средство Противокашлевое средство (-) - Thalidomide тератоген (+) - Thalidomide транквилизатор 56

• 4. 2. 2 Диастереомеры – пространственные изомеры, молекулы которых НЕ относятся между собой как предмет и несовместимое с ним зеркальное отображение. цис-бутен-2 транс-бутен-2 D-глюкоза D-галактоза 57

Спасибо за Ваше внимание! 58
Low-molecular biologic compounds 2-11.pptx