 LOGO Классификация неорганических веществ 8 класс
LOGO Классификация неорганических веществ 8 класс
 Неорганические вещества простые сложные
Неорганические вещества простые сложные
 Простые вещества Металлы Неметаллы (М; Ме) (не. М; не. Ме) Инертные газы
Простые вещества Металлы Неметаллы (М; Ме) (не. М; не. Ме) Инертные газы
 Сложные вещества Оксиды Основания Кислоты Соли
Сложные вещества Оксиды Основания Кислоты Соли
 Оксиды – это соединения двух элементов, один из которых кислород со степенью окисления -2. Общая формула Э m. О n m – число атомов элемента Э, n – число атомов кислорода Примеры: Na 2 O – оксид калия; Ca. O - оксид кальция; SO 2 –оксид серы.
Оксиды – это соединения двух элементов, один из которых кислород со степенью окисления -2. Общая формула Э m. О n m – число атомов элемента Э, n – число атомов кислорода Примеры: Na 2 O – оксид калия; Ca. O - оксид кальция; SO 2 –оксид серы.
 Классификация оксидов Оксиды Несолеобразующие* Солеобразующие* Основные* * - Выписать определения и примеры (с. 248, 250) Кислотные* Амфотерные
Классификация оксидов Оксиды Несолеобразующие* Солеобразующие* Основные* * - Выписать определения и примеры (с. 248, 250) Кислотные* Амфотерные
 Номенклатура оксидов Название оксида = «Оксид» + Название элемента в родит. падеже + Валентность элемента (римскими цифрами). Пример: СО – оксид углерода (II) Графическая формула: С=О
Номенклатура оксидов Название оксида = «Оксид» + Название элемента в родит. падеже + Валентность элемента (римскими цифрами). Пример: СО – оксид углерода (II) Графическая формула: С=О
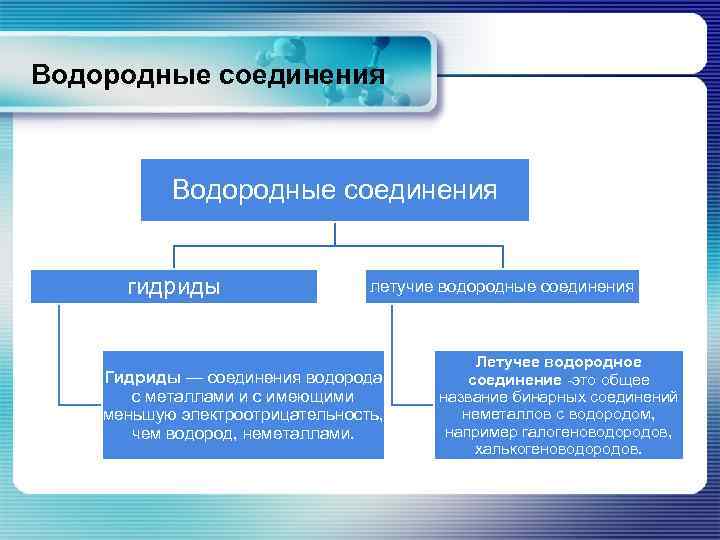 Водородные соединения гидриды летучие водородные соединения Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Летучее водородное соединение -это общее название бинарных соединений неметаллов с водородом, например галогеноводородов, халькогеноводородов.
Водородные соединения гидриды летучие водородные соединения Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Летучее водородное соединение -это общее название бинарных соединений неметаллов с водородом, например галогеноводородов, халькогеноводородов.
 Основания – это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксидных групп (ОН). Общая формула Ме(ОН)y у- число гидроксидных групп, равное валентности (а так же степени окисления) металла Ме, ОН – гидроксид-ион Примеры: Na. OH – гидроксид калия; Ca(OH)2 - гидроксид кальция; Fe(OH)3 – гидроксид железа.
Основания – это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксидных групп (ОН). Общая формула Ме(ОН)y у- число гидроксидных групп, равное валентности (а так же степени окисления) металла Ме, ОН – гидроксид-ион Примеры: Na. OH – гидроксид калия; Ca(OH)2 - гидроксид кальция; Fe(OH)3 – гидроксид железа.
 растворимость в воде Классификация оснований Основания растворимые (щелочи) нерастворимые Таблица растворимости
растворимость в воде Классификация оснований Основания растворимые (щелочи) нерастворимые Таблица растворимости
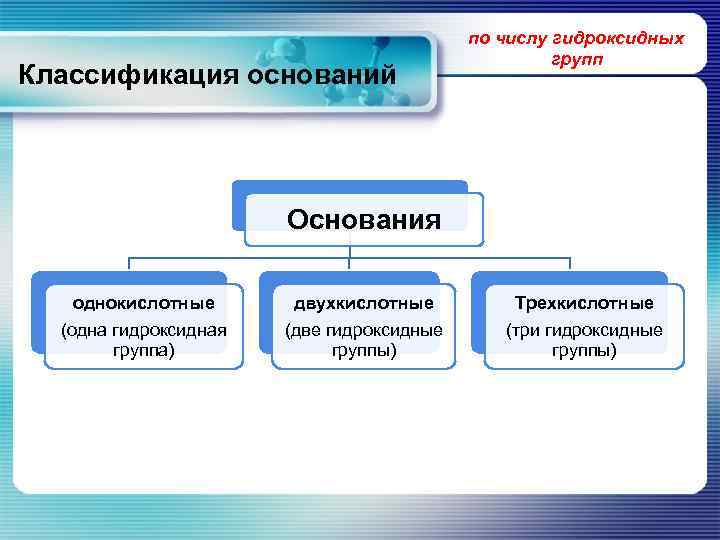 Классификация оснований по числу гидроксидных групп Основания однокислотные двухкислотные Трехкислотные (одна гидроксидная группа) (две гидроксидные группы) (три гидроксидные группы)
Классификация оснований по числу гидроксидных групп Основания однокислотные двухкислотные Трехкислотные (одна гидроксидная группа) (две гидроксидные группы) (три гидроксидные группы)
 Номенклатура оснований Название гиороксида = «Гидроксид» + Название металла в родит. падеже + Валентность элемента (римскими цифрами), если металл имеет переменную валентность. Пример: Na. OH – гидроксид натрия Ni(OH)2 – гидроксид никеля (II)
Номенклатура оснований Название гиороксида = «Гидроксид» + Название металла в родит. падеже + Валентность элемента (римскими цифрами), если металл имеет переменную валентность. Пример: Na. OH – гидроксид натрия Ni(OH)2 – гидроксид никеля (II)
 Амфотерные гидроксиды – это сложные вещества, которые имеют свойства как оснований так и кислот Общая формула Э(ОН)3 Н 3 ЭО 3 -Н 2 О Орто-форма Форма основания НЭО 2 Мета-форма Кислотная форма Al(ОН)3 Al 3 ЭО 3 Гидроксид алюминия Ортоалюминиева я кислота -Н 2 О НAl. О 2 Метаалюлюминие вая кислота
Амфотерные гидроксиды – это сложные вещества, которые имеют свойства как оснований так и кислот Общая формула Э(ОН)3 Н 3 ЭО 3 -Н 2 О Орто-форма Форма основания НЭО 2 Мета-форма Кислотная форма Al(ОН)3 Al 3 ЭО 3 Гидроксид алюминия Ортоалюминиева я кислота -Н 2 О НAl. О 2 Метаалюлюминие вая кислота
 Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
 Соли металлов в огне
Соли металлов в огне
 Индикаторы
Индикаторы