 LOGO
LOGO
 Цель урока: • изучение строения молекулы аммиака, его физических и химических свойств; • определение роли аммиака и его производных в жизни человека, их применение;
Цель урока: • изучение строения молекулы аммиака, его физических и химических свойств; • определение роли аммиака и его производных в жизни человека, их применение;
 Т Е С Т. 1)Укажите формулу водородного соединения элемента подгруппы азота с наиболее прочной химической связью: 1) а) Sb. H 3 б) NH 3 в) PH 3 г) As. H 3 2) На каких энергетических подуровнях не могут располагаться валентные электроны атома азота? а) 2 s б) 3 d в) 2 p г) 3 p 3) Формула вещества, в котором азот проявляет свою высшую степень окисления, это: а) NO 2 б) Ca 3 N 2 в) HNO 3 г) Ca(NO 3)2 4) Укажите формулы веществ, в которых азот проявляет свою минимальную степень окисления: а) NH 4 HSO 4 б) NH 3 в) Ca 3 N 2 г) HNO 2 5) Азот-восстановитель, реагируя с: а) водородом б) кислородом в) магнием г) фтором
Т Е С Т. 1)Укажите формулу водородного соединения элемента подгруппы азота с наиболее прочной химической связью: 1) а) Sb. H 3 б) NH 3 в) PH 3 г) As. H 3 2) На каких энергетических подуровнях не могут располагаться валентные электроны атома азота? а) 2 s б) 3 d в) 2 p г) 3 p 3) Формула вещества, в котором азот проявляет свою высшую степень окисления, это: а) NO 2 б) Ca 3 N 2 в) HNO 3 г) Ca(NO 3)2 4) Укажите формулы веществ, в которых азот проявляет свою минимальную степень окисления: а) NH 4 HSO 4 б) NH 3 в) Ca 3 N 2 г) HNO 2 5) Азот-восстановитель, реагируя с: а) водородом б) кислородом в) магнием г) фтором
 Ключ к ответам тестовых заданий: 1) б 2) б, г 3) в 4) а, б, в 5) б, г
Ключ к ответам тестовых заданий: 1) б 2) б, г 3) в 4) а, б, в 5) б, г
 разминка • K 2 O + HNO 3 =. . . • Ca. CO 3 + HCl =. . . • Al(OH)3 + H 3 PO 4 =. . . • Na. OH + Fe. Cl 3 = • К 2 S + Fe 2 (SO 4)3= • Fe(OH)3 + HNO 3 = SO 2 1 -→SO 3 2 -→ H 2 SO 4 3 -→ Na 2 SO 4 Домашнее задание Ba. O 1→Ва(ОН)2 2→ Ва. СО 3 3→ Ва. С 12 • • Na. OH + Fe. Cl 2 = • КOH + H 2 SO 4 = Na. OH + Fe 2(SO 4)3= •
разминка • K 2 O + HNO 3 =. . . • Ca. CO 3 + HCl =. . . • Al(OH)3 + H 3 PO 4 =. . . • Na. OH + Fe. Cl 3 = • К 2 S + Fe 2 (SO 4)3= • Fe(OH)3 + HNO 3 = SO 2 1 -→SO 3 2 -→ H 2 SO 4 3 -→ Na 2 SO 4 Домашнее задание Ba. O 1→Ва(ОН)2 2→ Ва. СО 3 3→ Ва. С 12 • • Na. OH + Fe. Cl 2 = • КOH + H 2 SO 4 = Na. OH + Fe 2(SO 4)3= •
 Чтоб продукты не пропали Вам поможет аммиак, И растениям, конечно, Аммиак совсем не враг. Если обморок случился – Может в чувство привести, Вывести из опьяненья, Глянец окнам навести.
Чтоб продукты не пропали Вам поможет аммиак, И растениям, конечно, Аммиак совсем не враг. Если обморок случился – Может в чувство привести, Вывести из опьяненья, Глянец окнам навести.
 История названия Аммиак (в европейских языках его название звучит как «аммониак» ) своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH 2)2 CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
История названия Аммиак (в европейских языках его название звучит как «аммониак» ) своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH 2)2 CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
 NH 3 1. Строение, химическая связь v H-N-H v | v H ( структурная формула) v NH 3 Связь ковалентная полярная. Молекула полярная.
NH 3 1. Строение, химическая связь v H-N-H v | v H ( структурная формула) v NH 3 Связь ковалентная полярная. Молекула полярная.
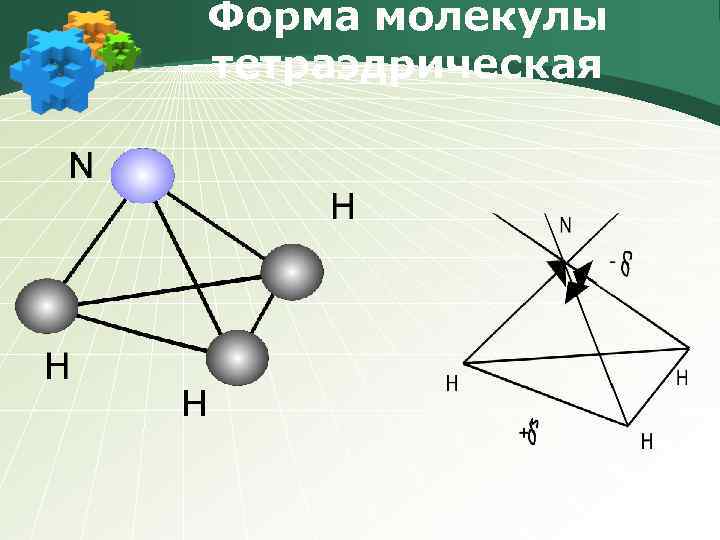 Форма молекулы тетраэдрическая
Форма молекулы тетраэдрическая
 Молекулы образуют ассоциации, благодаря чему аммиак – жидкость (при нормальных условиях) v. H v| -N… | H H | H– N…. | H H | H- N…… | H H | H–N … | H H | H- N. . | H
Молекулы образуют ассоциации, благодаря чему аммиак – жидкость (при нормальных условиях) v. H v| -N… | H H | H– N…. | H H | H- N…… | H H | H–N … | H H | H- N. . | H
 Это особый вид химической межмолекулярной связи и называется эта связьводородной v Водородная связь-это химическая связь между атомами водорода одной молекулы и атомами очень электроотрицательных элементов (фтора, кислорода, азота), имеющих неподелённые электронные пары. v Подобную связь образуют молекулы воды, спирта, фтороводорода.
Это особый вид химической межмолекулярной связи и называется эта связьводородной v Водородная связь-это химическая связь между атомами водорода одной молекулы и атомами очень электроотрицательных элементов (фтора, кислорода, азота), имеющих неподелённые электронные пары. v Подобную связь образуют молекулы воды, спирта, фтороводорода.
 2. Получение. v а) Промышленный способ: v P=30 МПа, t=450 C, k v N 2 +3 H 2=2 NH 3 +Q v где k-катализатор, в качестве которого используют Fe c Al 2 O 3 или Pt
2. Получение. v а) Промышленный способ: v P=30 МПа, t=450 C, k v N 2 +3 H 2=2 NH 3 +Q v где k-катализатор, в качестве которого используют Fe c Al 2 O 3 или Pt
 v б) Лабораторный способ: v 2 NH 4 Cl + Ca(OH)2=Ca. Cl 2 + 2 NH 3 +2 H 2 O v хлорид аммония v нашатырь
v б) Лабораторный способ: v 2 NH 4 Cl + Ca(OH)2=Ca. Cl 2 + 2 NH 3 +2 H 2 O v хлорид аммония v нашатырь
 3. Физические свойства: v Относительная молекулярная масса 17 v Почти в 2 раза легче воздуха. v а) газ v б) без цвета v в) с резким запахом ЯД v г) очень хорошо растворим в воде ( в 1 объёме воды растворяется 700 объёмов NH 3 v д)tкип= -33. 410 С tкр = -77, 730 C v е) при повышенном давлении легко сжижается. ё) при испарении жидкого аммиака из окружающей среды поглощается много тепла.
3. Физические свойства: v Относительная молекулярная масса 17 v Почти в 2 раза легче воздуха. v а) газ v б) без цвета v в) с резким запахом ЯД v г) очень хорошо растворим в воде ( в 1 объёме воды растворяется 700 объёмов NH 3 v д)tкип= -33. 410 С tкр = -77, 730 C v е) при повышенном давлении легко сжижается. ё) при испарении жидкого аммиака из окружающей среды поглощается много тепла.
 4. Химические свойства: v Реакции с изменением степени окисления азота v а) Разложение при нагревании v t v 2 NH 3= 3 N 2 +3 H 2 v б) Реакции окислении аммиака v 1. Горение v 4 NH 3 + 3 O 2 = 2 N 20 +6 H 2 O v Аммиак - сильный восстановитель. Например, он взаимодействует с кислородом, образуя азот и воду: 4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O v 2. Каталитическое окисление v v 4 NH 3 + Pt, Rh 5 O 2 = 4 NO + 6 H 2 O
4. Химические свойства: v Реакции с изменением степени окисления азота v а) Разложение при нагревании v t v 2 NH 3= 3 N 2 +3 H 2 v б) Реакции окислении аммиака v 1. Горение v 4 NH 3 + 3 O 2 = 2 N 20 +6 H 2 O v Аммиак - сильный восстановитель. Например, он взаимодействует с кислородом, образуя азот и воду: 4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O v 2. Каталитическое окисление v v 4 NH 3 + Pt, Rh 5 O 2 = 4 NO + 6 H 2 O
 Реакции без изменения степени окисления азота v в) Реакция с водой H H | | H + v H - N - H + H O H = [H -N - H ] + v. . v H v v [O H] = | [H- + N- H ][ . . H NH 3●H 2 O- молекулярная формула OH ]
Реакции без изменения степени окисления азота v в) Реакция с водой H H | | H + v H - N - H + H O H = [H -N - H ] + v. . v H v v [O H] = | [H- + N- H ][ . . H NH 3●H 2 O- молекулярная формула OH ]
![v H + . . v[H -N- H v v | H ] - v H + . . v[H -N- H v v | H ] -](https://present5.com/presentation/59425395_437048799/image-17.jpg) v H + . . v[H -N- H v v | H ] - ион аммония
v H + . . v[H -N- H v v | H ] - ион аммония
 v При нагревании с хлором, оксидом меди(II) и пероксидом водорода образуются молекулы свободного азота: 2 NH 3 + 3 Cl 2 = N 2 + 6 HCl 2 NH 3 + Cu. О = N 2 +Cu + Н 2 О v 2 NH 3 + 3 H 2 O 2 = N 2 + 6 H 2 O
v При нагревании с хлором, оксидом меди(II) и пероксидом водорода образуются молекулы свободного азота: 2 NH 3 + 3 Cl 2 = N 2 + 6 HCl 2 NH 3 + Cu. О = N 2 +Cu + Н 2 О v 2 NH 3 + 3 H 2 O 2 = N 2 + 6 H 2 O
 Донорно-акцепторная связь v Такой механизм образования ковалентной связи, которая возникает не в результате обобществления непарных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называется донорно-акцепторным. v донор- азот, акцептор – водород.
Донорно-акцепторная связь v Такой механизм образования ковалентной связи, которая возникает не в результате обобществления непарных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называется донорно-акцепторным. v донор- азот, акцептор – водород.
 гидроксид аммония (раствор называется нашатырным спиртом) v + _ v NH 3 +H 2 O NH 4 OH NH 4 +OH гидроксид аммония проявляет все свойства щелочей !!!
гидроксид аммония (раствор называется нашатырным спиртом) v + _ v NH 3 +H 2 O NH 4 OH NH 4 +OH гидроксид аммония проявляет все свойства щелочей !!!
 г) Реакции с кислотами v Аммиак слабое основание и водные растворы его обладают щелочной реакцией. NH 3 образует соли аммония (кислые и средние) почти со всеми известными кислотами:
г) Реакции с кислотами v Аммиак слабое основание и водные растворы его обладают щелочной реакцией. NH 3 образует соли аммония (кислые и средние) почти со всеми известными кислотами:
 v NH 3 + H 2 SO 4 = NH 4 HSO 4, v гидросульфат аммония 2 NH 3 + H 2 SO 4 = (NH 4)2 SO 4. сульфат аммония v NH 3 + HCl =NH 4 Cl v хлорид аммония
v NH 3 + H 2 SO 4 = NH 4 HSO 4, v гидросульфат аммония 2 NH 3 + H 2 SO 4 = (NH 4)2 SO 4. сульфат аммония v NH 3 + HCl =NH 4 Cl v хлорид аммония
 5. Применение. v а) производство азотной кислоты v б) производство удобрений v в) нашатырный спирт v г) взрывчатые вещества v д) в быту v е) в холодильных установках. v Д/З $24 упр. 1 -7
5. Применение. v а) производство азотной кислоты v б) производство удобрений v в) нашатырный спирт v г) взрывчатые вещества v д) в быту v е) в холодильных установках. v Д/З $24 упр. 1 -7
![v v Соли аммония состоят из катиона [NH 4] и аниона кислотного остатка. v v v Соли аммония состоят из катиона [NH 4] и аниона кислотного остатка. v](https://present5.com/presentation/59425395_437048799/image-24.jpg) v v Соли аммония состоят из катиона [NH 4] и аниона кислотного остатка. v Пример: v NH 4 Cl , NH 4 NO 3 - хлорид и нитрат v NH 4 HSO 4 , v NH 4 H 2 PO 4 ( NH 4)2 SO 4 (NH 4)2 HPO 4 - аммония гидросульфат и сульфат аммония (NH 4)3 PO 3 - v дигидрофосфат аммония, гидрофосфат аммония и фосфат аммония v.
v v Соли аммония состоят из катиона [NH 4] и аниона кислотного остатка. v Пример: v NH 4 Cl , NH 4 NO 3 - хлорид и нитрат v NH 4 HSO 4 , v NH 4 H 2 PO 4 ( NH 4)2 SO 4 (NH 4)2 HPO 4 - аммония гидросульфат и сульфат аммония (NH 4)3 PO 3 - v дигидрофосфат аммония, гидрофосфат аммония и фосфат аммония v.
 1. Получение: v а)NH 3+HCl = NH 4 Cl v б)NH 4 OH + HCl = NH 4 Cl +H 2 O v Напишите химические реакции взаимодействия аммиака и нашатырного спирта с азотной и серной кислотой.
1. Получение: v а)NH 3+HCl = NH 4 Cl v б)NH 4 OH + HCl = NH 4 Cl +H 2 O v Напишите химические реакции взаимодействия аммиака и нашатырного спирта с азотной и серной кислотой.
 2. Физические свойства: v а) твёрдые вещества белого цвета v исключение ( NH 4)2 SO 4 v б) кристаллического строенияионные кр. решётки v в) хорошо растворимые в воде.
2. Физические свойства: v а) твёрдые вещества белого цвета v исключение ( NH 4)2 SO 4 v б) кристаллического строенияионные кр. решётки v в) хорошо растворимые в воде.
 3. Химические свойства: v Общие с другими солями v + v а)NH 4 Cl=NH 4 +Cl v б)2 NH 4 Cl +H 2 SO 4= ( NH 4)2 SO 4 +2 HCl сухая соль v v в) NH 4 Cl +Ag. NO 3=3 Ag. Cl+ NH 4 NO 3 р-р р-р v Специфические v г)реакция с щелочами качественная реакция v NH 4 Cl +Na. OH=NH 4 OH+Na. Cl v / v NH 3 H 2 O Появляется резкий запах аммиака v д) при нагревании разлагаются v t v NH 4 CI=NH 3 +HCl
3. Химические свойства: v Общие с другими солями v + v а)NH 4 Cl=NH 4 +Cl v б)2 NH 4 Cl +H 2 SO 4= ( NH 4)2 SO 4 +2 HCl сухая соль v v в) NH 4 Cl +Ag. NO 3=3 Ag. Cl+ NH 4 NO 3 р-р р-р v Специфические v г)реакция с щелочами качественная реакция v NH 4 Cl +Na. OH=NH 4 OH+Na. Cl v / v NH 3 H 2 O Появляется резкий запах аммиака v д) при нагревании разлагаются v t v NH 4 CI=NH 3 +HCl
 4. Применение солей аммония: v NH 4 NO 3 - минеральное удобрение v NH 4 Cl нашатырь- используют при паянии, так как он очищает поверхность металла от оксидной пленки v NH 4 HCO 3 - используют в кондитерском деле (NH 4 HCO 3=NH 3+ H 2 O+CO 2) разрыхлитель v NH 4 NO 3 +C(уголь) +Al (пудра)-используют в качестве взрывчатого вещества. v $ 25 упр. 1 -5
4. Применение солей аммония: v NH 4 NO 3 - минеральное удобрение v NH 4 Cl нашатырь- используют при паянии, так как он очищает поверхность металла от оксидной пленки v NH 4 HCO 3 - используют в кондитерском деле (NH 4 HCO 3=NH 3+ H 2 O+CO 2) разрыхлитель v NH 4 NO 3 +C(уголь) +Al (пудра)-используют в качестве взрывчатого вещества. v $ 25 упр. 1 -5


