LZ11_Apparat_translyatsii.ppt
- Количество слайдов: 31
 LOGO Аппарат трансляции
LOGO Аппарат трансляции
 Основные компоненты аппарата трансляции § Аминоацил-т. РНК-синтетазы § т. РНК § Рибосомы § и. РНК § Белки – факторы инициации, элонгации и терминации
Основные компоненты аппарата трансляции § Аминоацил-т. РНК-синтетазы § т. РНК § Рибосомы § и. РНК § Белки – факторы инициации, элонгации и терминации
 Этапы трансляции § Инициация § Элонгация § Терминация
Этапы трансляции § Инициация § Элонгация § Терминация
 Аминоацил-т. РНКсинтетаза § Участвует в «дорибосомном» этапе биосинтеза белка, включающем реакцию аминоацилирования т. РНК. § Способна узнавать три субстрата: АТФ, аминокислоту и т. РНК. § В активном центре этого фермента осуществляется активация аминокислоты и присоединение её к концевому остатку рибозы т. РНК. § Каждой аминокислоте в клетке соответствует своя аминоацил-т. РНК-синтетаза.
Аминоацил-т. РНКсинтетаза § Участвует в «дорибосомном» этапе биосинтеза белка, включающем реакцию аминоацилирования т. РНК. § Способна узнавать три субстрата: АТФ, аминокислоту и т. РНК. § В активном центре этого фермента осуществляется активация аминокислоты и присоединение её к концевому остатку рибозы т. РНК. § Каждой аминокислоте в клетке соответствует своя аминоацил-т. РНК-синтетаза.
 Активация молекул т. РНК § Активация т. РНК – это присоединение аминокислотного остатка к т. РНК с образованием аминоацил-т. РНК § Карбоксильная группа аминокислоты + гидроксильная группа рибозы на 3’ – конце т. РНК → аминоацил-т. РНК § АТФ-зависимая реакция: АТФ → АМФ + 2 Р + Е § Их иногда называют «кодазы» или «шифразы» .
Активация молекул т. РНК § Активация т. РНК – это присоединение аминокислотного остатка к т. РНК с образованием аминоацил-т. РНК § Карбоксильная группа аминокислоты + гидроксильная группа рибозы на 3’ – конце т. РНК → аминоацил-т. РНК § АТФ-зависимая реакция: АТФ → АМФ + 2 Р + Е § Их иногда называют «кодазы» или «шифразы» .
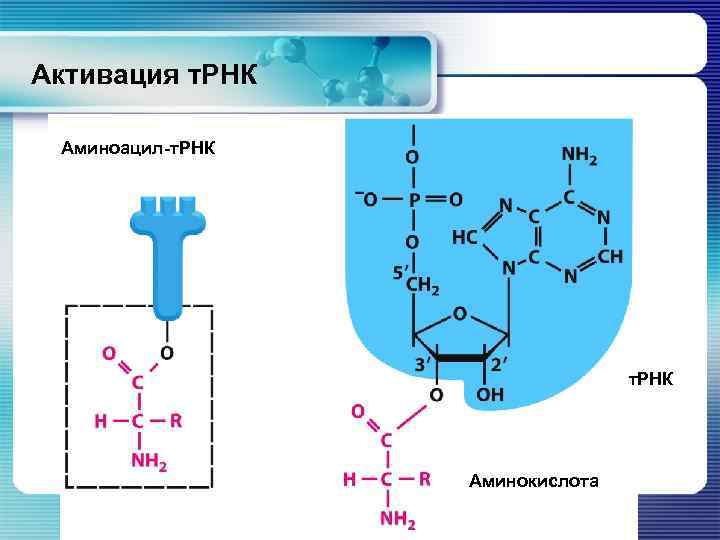 Активация т. РНК Аминоацил-т. РНК Аминокислота
Активация т. РНК Аминоацил-т. РНК Аминокислота
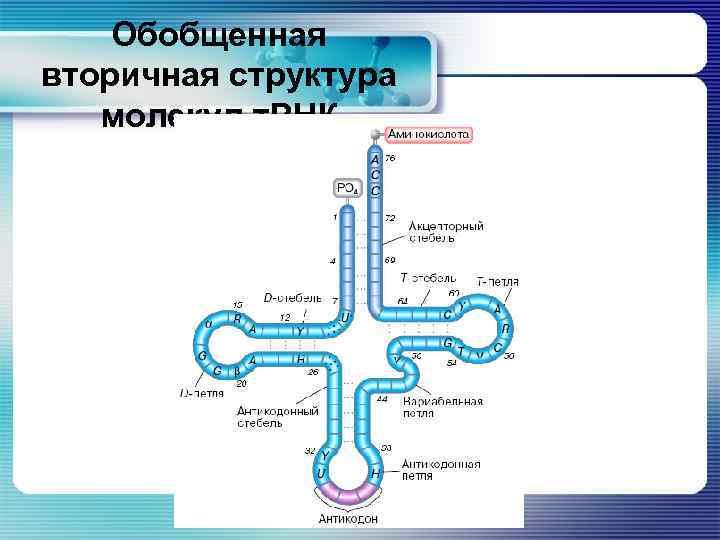 Обобщенная вторичная структура молекул т. РНК
Обобщенная вторичная структура молекул т. РНК
 Основные особенности структуры т. РНК § Молекула т. РНК состоит обычно из 75 – 85 нуклеотидов § Все т. РНК обладают характерной вторичной структурой – «клеверного листа» § Молекула т. РНК содержит 4 области
Основные особенности структуры т. РНК § Молекула т. РНК состоит обычно из 75 – 85 нуклеотидов § Все т. РНК обладают характерной вторичной структурой – «клеверного листа» § Молекула т. РНК содержит 4 области
 Основные особенности структуры т. РНК: акцепторный стебель § На 3' – конце молекулы всегда находятся 4 неспаренных нуклеотида, причем 3 из них – обязательно ССА. § 5‘ и 3‘ – концы цепи РНК образуют акцепторный стебель. § Цепи удерживаются вместе благодаря комплементарному спариванию 7 нуклеотидов 5‘ – конца с 7 нуклеотидами 3‘ – конца.
Основные особенности структуры т. РНК: акцепторный стебель § На 3' – конце молекулы всегда находятся 4 неспаренных нуклеотида, причем 3 из них – обязательно ССА. § 5‘ и 3‘ – концы цепи РНК образуют акцепторный стебель. § Цепи удерживаются вместе благодаря комплементарному спариванию 7 нуклеотидов 5‘ – конца с 7 нуклеотидами 3‘ – конца.
 Основные особенности структуры т. РНК: ТΨС – шпилька § Она содержит 2 необычных остатка: риботимидин (Т) и псевдоуридин (Ψ). § Шпилька состоит из двуцепочечного стебля из 5 спаренных оснований и петли длиной 7 нуклеотидов. § Тринуклеотид ТΨС всегда расположен в одном и том же месте петли.
Основные особенности структуры т. РНК: ТΨС – шпилька § Она содержит 2 необычных остатка: риботимидин (Т) и псевдоуридин (Ψ). § Шпилька состоит из двуцепочечного стебля из 5 спаренных оснований и петли длиной 7 нуклеотидов. § Тринуклеотид ТΨС всегда расположен в одном и том же месте петли.
 Основные особенности структуры т. РНК: антикодоновая шпилька § Стебель в ней всегда представлен семью спаренными основаниями. § Триплет, комплементарный родственному кодону, - антикодон, - находится в петле, состоящей из 7 нуклеотидов.
Основные особенности структуры т. РНК: антикодоновая шпилька § Стебель в ней всегда представлен семью спаренными основаниями. § Триплет, комплементарный родственному кодону, - антикодон, - находится в петле, состоящей из 7 нуклеотидов.
 Основные особенности структуры т. РНК: дигидроурациловая (DU) шпилька § Состоит из стебля длиной 3 – 4 пары нуклеотидов и петли варьирующего размера, часто содержащей урацил в восстановленной форме – дигидроурацил (DU).
Основные особенности структуры т. РНК: дигидроурациловая (DU) шпилька § Состоит из стебля длиной 3 – 4 пары нуклеотидов и петли варьирующего размера, часто содержащей урацил в восстановленной форме – дигидроурацил (DU).
 L – конфигурация т. РНК § Рентгеноструктурный анализ некоторых молекул т. РНК позволил выявить их характерную четвертичную структуру. Эта структура более компактна, чем структура «клеверного листа» . Она образуется благодаря внутримолекулярным взаимодействиям, сближающим DU и ТΨС шпильки. § В результате молекула т. РНК выглядит так, как будто она состоит из 2 взаимоперпендикулярных частей – в одной из них находится акцепторный участок, в другой – антикодон. § Из-за такого общего вида молекулы структура получила название L – конфигурации.
L – конфигурация т. РНК § Рентгеноструктурный анализ некоторых молекул т. РНК позволил выявить их характерную четвертичную структуру. Эта структура более компактна, чем структура «клеверного листа» . Она образуется благодаря внутримолекулярным взаимодействиям, сближающим DU и ТΨС шпильки. § В результате молекула т. РНК выглядит так, как будто она состоит из 2 взаимоперпендикулярных частей – в одной из них находится акцепторный участок, в другой – антикодон. § Из-за такого общего вида молекулы структура получила название L – конфигурации.
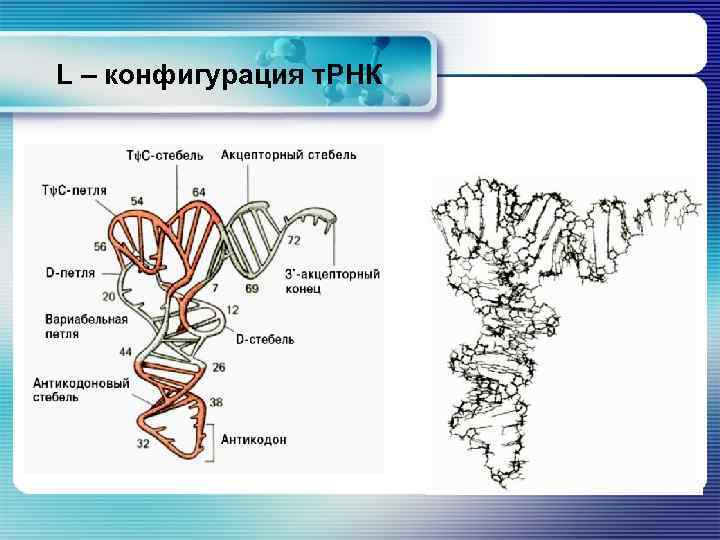 L – конфигурация т. РНК
L – конфигурация т. РНК
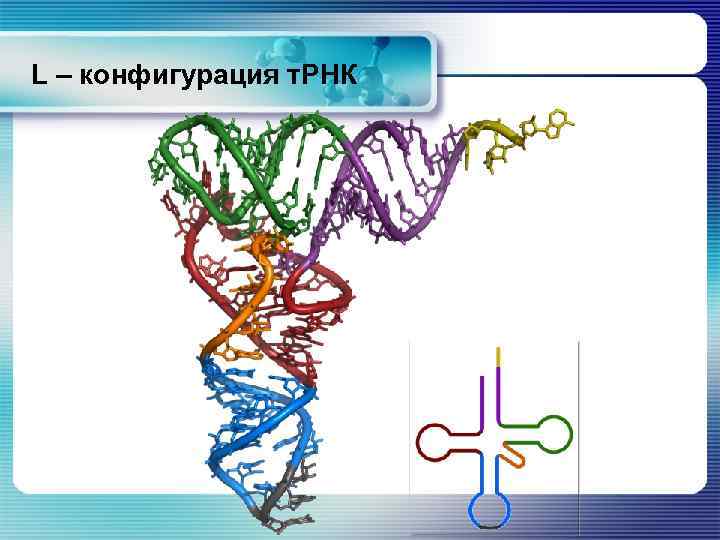 L – конфигурация т. РНК
L – конфигурация т. РНК
 Рибосомы § Играют ключевую роль в биосинтезе белка. § Число их в клетках колеблется от 20000 до 50000 в зависимости от белоксинтезирующей активности клетки. § Индифферентны в отношении синтезируемых ими белков. § Тип белка, синтезируемого рибосомой, диктуется м. РНК, с которой рибосома оказалась связанной. § Имеются некоторые отличия между рибосомами про- и эукариот вследствие: ü различий в структуре и организации про- и эукариотических м. РНК ü процессы транскрипции и трансляции у прокариот сопряжены во времени и пространстве.
Рибосомы § Играют ключевую роль в биосинтезе белка. § Число их в клетках колеблется от 20000 до 50000 в зависимости от белоксинтезирующей активности клетки. § Индифферентны в отношении синтезируемых ими белков. § Тип белка, синтезируемого рибосомой, диктуется м. РНК, с которой рибосома оказалась связанной. § Имеются некоторые отличия между рибосомами про- и эукариот вследствие: ü различий в структуре и организации про- и эукариотических м. РНК ü процессы транскрипции и трансляции у прокариот сопряжены во времени и пространстве.
 Канонические (природные) аминокислоты § § § § § Аланин (Ala) Аргинин (Arg) Аспарагиновая кислота (Asp) Аспарагин (Asn) Валин (Val) Гистидин (His) Глицин (Gly) Глутаминовая кислота (Glu) Глутамин (Gln) Изолейцин (Ile) § § § § § Лейцин (Leu) Лизин (Lys) Метионин (Met) Пролин (Pro) Серин (Ser) Тирозин (Tyr) Треонин (Thr) Триптофан (Trp) Фенилаланин (Phe) Цистеин (Cys)
Канонические (природные) аминокислоты § § § § § Аланин (Ala) Аргинин (Arg) Аспарагиновая кислота (Asp) Аспарагин (Asn) Валин (Val) Гистидин (His) Глицин (Gly) Глутаминовая кислота (Glu) Глутамин (Gln) Изолейцин (Ile) § § § § § Лейцин (Leu) Лизин (Lys) Метионин (Met) Пролин (Pro) Серин (Ser) Тирозин (Tyr) Треонин (Thr) Триптофан (Trp) Фенилаланин (Phe) Цистеин (Cys)
 Рибосомы § Впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом Джорджем Паладе в середине 1950 -х годов. Джордж Эмиль Паладе (19. 11. 1912 – 8. 10. 2008) § Термин «рибосома» был предложен Ричардом Робертсом в 1958 г.
Рибосомы § Впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом Джорджем Паладе в середине 1950 -х годов. Джордж Эмиль Паладе (19. 11. 1912 – 8. 10. 2008) § Термин «рибосома» был предложен Ричардом Робертсом в 1958 г.
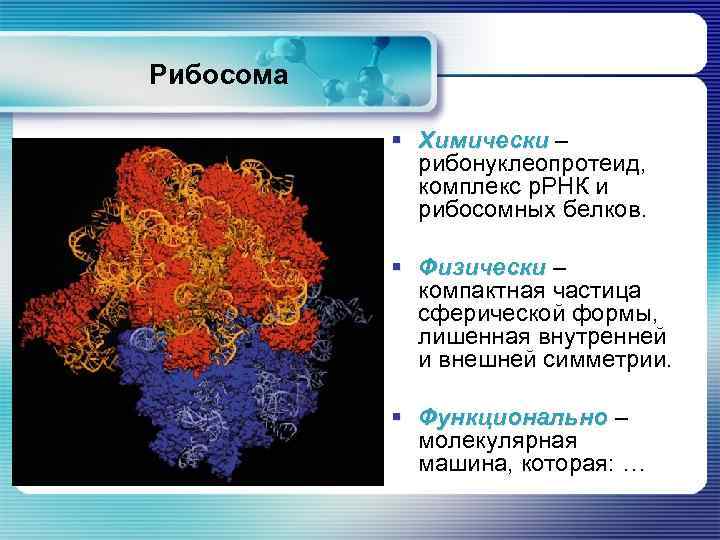 Рибосома § Химически – рибонуклеопротеид, комплекс р. РНК и рибосомных белков. § Физически – компактная частица сферической формы, лишенная внутренней и внешней симметрии. § Функционально – молекулярная машина, которая: …
Рибосома § Химически – рибонуклеопротеид, комплекс р. РНК и рибосомных белков. § Физически – компактная частица сферической формы, лишенная внутренней и внешней симметрии. § Функционально – молекулярная машина, которая: …
 … § Протягивает вдоль себя цепь м. РНК; § Считывает с неё генетическую информацию; § Синтезирует полипептидную цепь белка из поступающих в неё аминокислотных остатков в соответствии с генетическим кодом.
… § Протягивает вдоль себя цепь м. РНК; § Считывает с неё генетическую информацию; § Синтезирует полипептидную цепь белка из поступающих в неё аминокислотных остатков в соответствии с генетическим кодом.
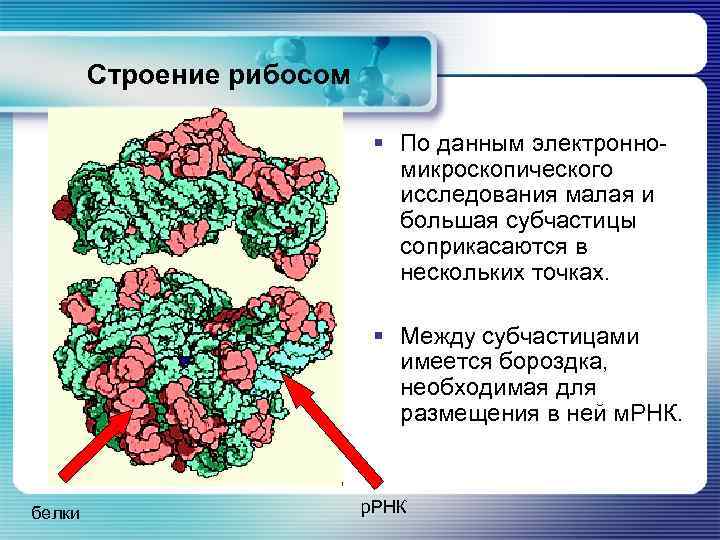 Строение рибосом § По данным электронномикроскопического исследования малая и большая субчастицы соприкасаются в нескольких точках. § Между субчастицами имеется бороздка, необходимая для размещения в ней м. РНК. белки р. РНК
Строение рибосом § По данным электронномикроскопического исследования малая и большая субчастицы соприкасаются в нескольких точках. § Между субчастицами имеется бороздка, необходимая для размещения в ней м. РНК. белки р. РНК
 Большая субъединица рибосомы
Большая субъединица рибосомы
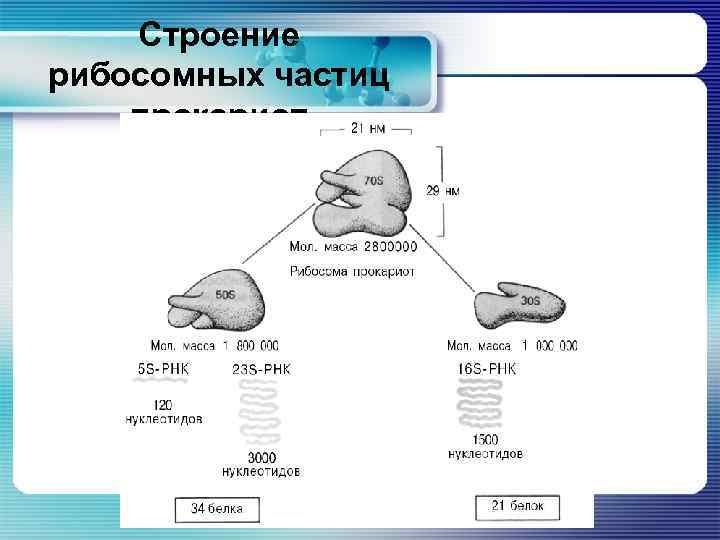 Строение рибосомных частиц прокариот
Строение рибосомных частиц прокариот
 Строение рибосомных частиц прокариот § Рибосомы прокариот (70 S) состоят из малых (30 S) и больших (50 S) субчастиц. § 30 S – субчастица состоит из единственной молекулы р. РНК (16 S) размером 1542 нуклеотида и 21 белка с разной молекулярной массой. § 50 S – субчастица содержит две р. РНК – большую (23 S), состоящую из 2904 нуклеотидов, более мелкую (5 S), из 120 нуклеотидов; они связаны с 34 разными белками.
Строение рибосомных частиц прокариот § Рибосомы прокариот (70 S) состоят из малых (30 S) и больших (50 S) субчастиц. § 30 S – субчастица состоит из единственной молекулы р. РНК (16 S) размером 1542 нуклеотида и 21 белка с разной молекулярной массой. § 50 S – субчастица содержит две р. РНК – большую (23 S), состоящую из 2904 нуклеотидов, более мелкую (5 S), из 120 нуклеотидов; они связаны с 34 разными белками.
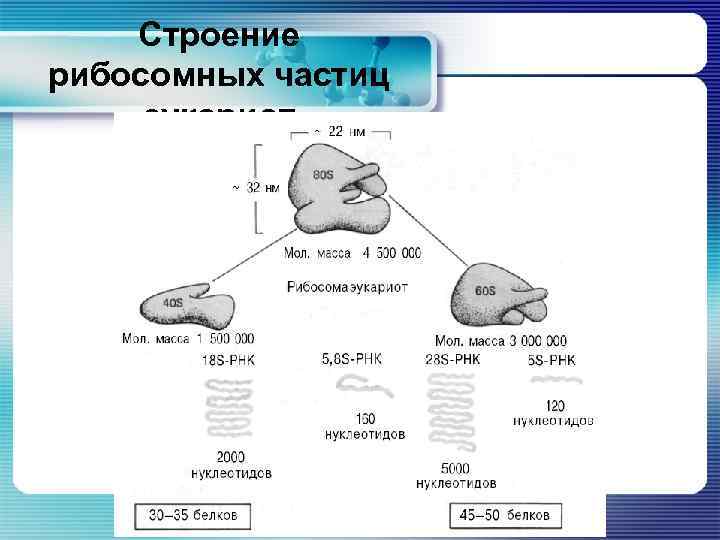 Строение рибосомных частиц эукариот
Строение рибосомных частиц эукариот
 Строение рибосомных частиц эукариот § Рибосомы эукариот (80 S) состоят из малой (40 S) и большой (60 S) субчастиц. § Малые субчастицы содержат 1 молекулу р. РНК (18 S) размером 1900 нуклеотидов и 30 – 35 белков. § Большая субчастица содержит 3 цепи РНК длиной 120 (5 S), 160 (5, 8 S) и 4800 (28 S) нуклеотидов и 45 – 50 белков.
Строение рибосомных частиц эукариот § Рибосомы эукариот (80 S) состоят из малой (40 S) и большой (60 S) субчастиц. § Малые субчастицы содержат 1 молекулу р. РНК (18 S) размером 1900 нуклеотидов и 30 – 35 белков. § Большая субчастица содержит 3 цепи РНК длиной 120 (5 S), 160 (5, 8 S) и 4800 (28 S) нуклеотидов и 45 – 50 белков.
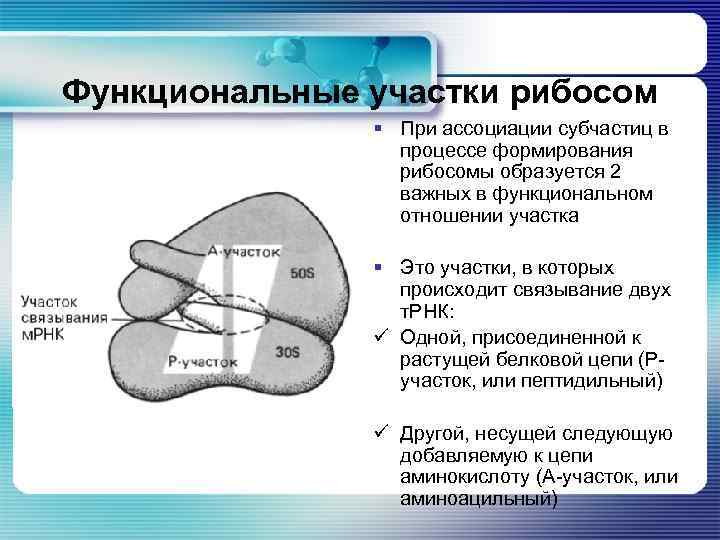 Функциональные участки рибосом § При ассоциации субчастиц в процессе формирования рибосомы образуется 2 важных в функциональном отношении участка § Это участки, в которых происходит связывание двух т. РНК: ü Одной, присоединенной к растущей белковой цепи (Ручасток, или пептидильный) ü Другой, несущей следующую добавляемую к цепи аминокислоту (А-участок, или аминоацильный)
Функциональные участки рибосом § При ассоциации субчастиц в процессе формирования рибосомы образуется 2 важных в функциональном отношении участка § Это участки, в которых происходит связывание двух т. РНК: ü Одной, присоединенной к растущей белковой цепи (Ручасток, или пептидильный) ü Другой, несущей следующую добавляемую к цепи аминокислоту (А-участок, или аминоацильный)
 § Белки – факторы инициации трансляции IF-1, IF-2, IF-3 – факторы, необходимые для инициации прокариот трансляции м. РНК. § IF-1 и IF-3 связываются с 30 S – субчастицей. § IF-2 связывается с инициаторной аминоацил-т. РНК, Fmetт. РНКf. Met. § Комплекс 30 S-субчастицы со всеми факторами инициации и Fmet-т. РНКf. Met узнает соответствующий AUG-кодон в м. РНК. § Когда формирование инициаторного комплекса завершается присоединением 50 S-субчастицы, все 3 инициаторных белка отсоединяются.
§ Белки – факторы инициации трансляции IF-1, IF-2, IF-3 – факторы, необходимые для инициации прокариот трансляции м. РНК. § IF-1 и IF-3 связываются с 30 S – субчастицей. § IF-2 связывается с инициаторной аминоацил-т. РНК, Fmetт. РНКf. Met. § Комплекс 30 S-субчастицы со всеми факторами инициации и Fmet-т. РНКf. Met узнает соответствующий AUG-кодон в м. РНК. § Когда формирование инициаторного комплекса завершается присоединением 50 S-субчастицы, все 3 инициаторных белка отсоединяются.
 § Белки-факторы элонгации трансляции прокариот EF-Tu, EF-Ts, EF-G – факторы элонгации, необходимые для доставки следующей аминоацилт. РНК к рибосоме. § EF-Tu с присоединенным к нему GTP связывает все аминоацил-т. РНК, кроме Fmet-т. РНКf. Met, и доставляет их к А-участку комплекса 70 S-рибосома-м. РНК. § Образуется EF-Tu-GDP, и для восстановления EF-Tu. GТP нужен EF-Ts § EF-G обеспечивает перемещение рибосомы по м. РНК при трансляции кодонов.
§ Белки-факторы элонгации трансляции прокариот EF-Tu, EF-Ts, EF-G – факторы элонгации, необходимые для доставки следующей аминоацилт. РНК к рибосоме. § EF-Tu с присоединенным к нему GTP связывает все аминоацил-т. РНК, кроме Fmet-т. РНКf. Met, и доставляет их к А-участку комплекса 70 S-рибосома-м. РНК. § Образуется EF-Tu-GDP, и для восстановления EF-Tu. GТP нужен EF-Ts § EF-G обеспечивает перемещение рибосомы по м. РНК при трансляции кодонов.
 Белки-факторы терминации трансляции § RF-1, прокариот факторы терминации RF-2, RF-3 – трансляции. § RF-1 вызывает отделение полипептидной цепи при считывании кодонов UAA, UAG. § RF-2 действует аналогичным образом при считывании UAA, UGA. § RF-3 облегчает работу двух других факторов.
Белки-факторы терминации трансляции § RF-1, прокариот факторы терминации RF-2, RF-3 – трансляции. § RF-1 вызывает отделение полипептидной цепи при считывании кодонов UAA, UAG. § RF-2 действует аналогичным образом при считывании UAA, UGA. § RF-3 облегчает работу двух других факторов.
 В клетках эукариот многообразие вспомогательных белков изучено значительно слабее, а их функции пока недостаточно ясны.
В клетках эукариот многообразие вспомогательных белков изучено значительно слабее, а их функции пока недостаточно ясны.


