лизоцим.цитокины.белки теплового шока..ppt
- Количество слайдов: 34

Лизоцим, цитокины, белки теплового шока Выполнили студентки 221 группы Чел. ГМА: Черноусова Яна, Загоскина Ксения, Ефремова Арина
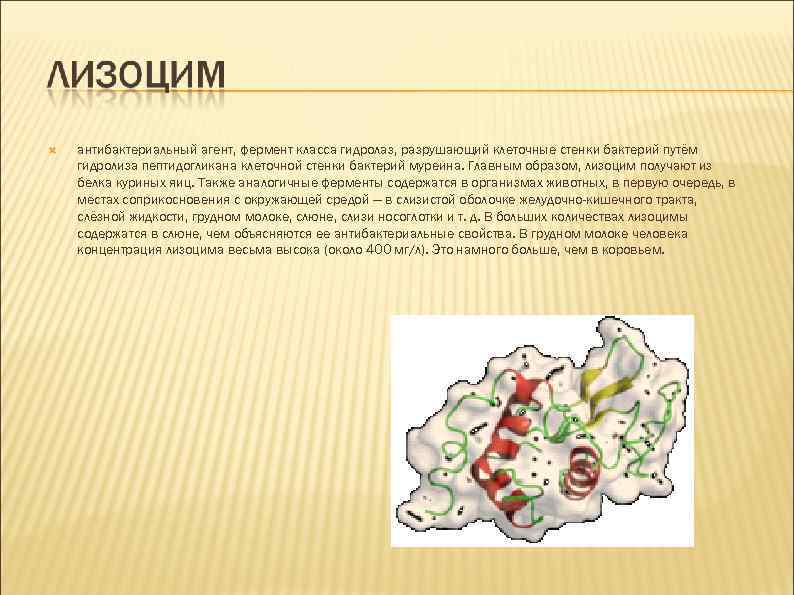
антибактериальный агент, фермент класса гидролаз, разрушающий клеточные стенки бактерий путём гидролиза пептидогликана клеточной стенки бактерий муреина. Главным образом, лизоцим получают из белка куриных яиц. Также аналогичные ферменты содержатся в организмах животных, в первую очередь, в местах соприкосновения с окружающей средой — в слизистой оболочке желудочно-кишечного тракта, слёзной жидкости, грудном молоке, слюне, слизи носоглотки и т. д. В больших количествах лизоцимы содержатся в слюне, чем объясняются ее антибактериальные свойства. В грудном молоке человека концентрация лизоцима весьма высока (около 400 мг/л). Это намного больше, чем в коровьем.

В 1909 г. П. Л. Лащенко открыл в курином белке протеолитический фермент, который селективно повреждал клеточные стенки, содержащие пептидогликаны. Выделил в чистом виде, описал и дал название «лизоцим» в 1922 Александр Флеминг. Трехмерная структура лизоцима впервые была получена Дэвидом Чилтоном Филлипсом (1924— 1999) в 1965, когда он получил первую модель с помощью рентгеновской кристаллографии.

В пищевой промышленности зарегистрирован в качестве пищевой добавки E 1105. В медицине в качестве местного антисептического средства.

Фермент атакует пептидогликаны (в частности, муреин), входящие в состав клеточных стенок бактерий Лизоцим гидролизует (1, 4β)-гликозидную связь между N-ацетилмурамовой кислотой и N-ацетилглюкозамином.
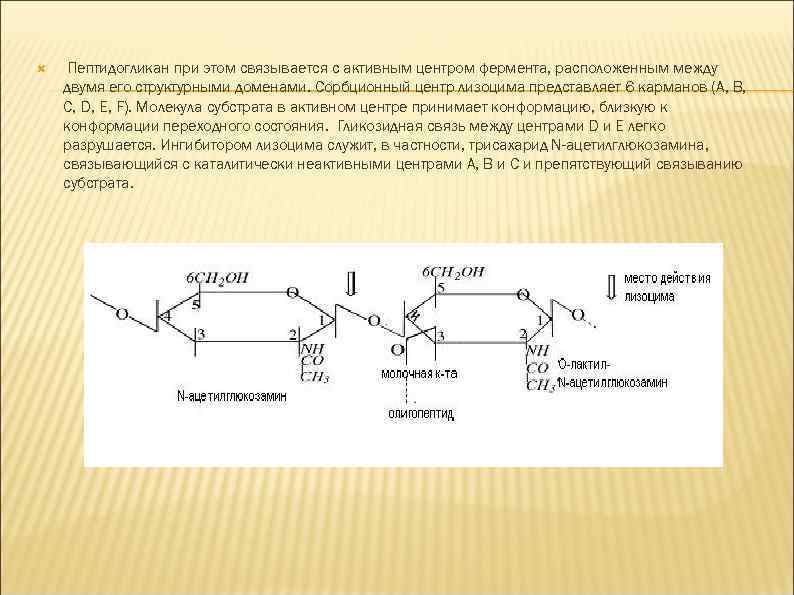
Пептидогликан при этом связывается с активным центром фермента, расположенным между двумя его структурными доменами. Сорбционный центр лизоцима представляет 6 карманов (A, B, C, D, E, F). Молекула субстрата в активном центре принимает конформацию, близкую к конформации переходного состояния. Гликозидная связь между центрами D и E легко разрушается. Ингибитором лизоцима служит, в частности, трисахарид N-ацетилглюкозамина, связывающийся с каталитически неактивными центрами A, B и C и препятствующий связыванию субстрата.
остатки глутаминовой кислоты и аспарагиновой кислоты критичны для функционирования фермента. Некоторые авторы полагают, что Glu выступает в качестве донора протона при разрыве гликозидной связи субстрата, разрушая связь, а Asp выступает в роли нуклеофила, при образовании интермедиата — гликозил-фермента. Затем гликозил-фермент реагирует с молекулой воды, в результате чего фермент возвращается в исходное состояние и образуется продукт гидролиза.

Цитокины представляют собой группу полипептидных медиаторов межклеточного взаимодействия, участвующих главным образом в формировании и регуляции защитных реакций организма при внедрении патогенов и нарушении целостности тканей, а также в регуляции ряда нормальных физиологических функций. За последние два десятилетия клонированы гены большинства цитокинов и получены рекомбинантные аналоги, полностью повторяющие биологические свойства природных молекул. Сейчас известно уже более 200 индивидуальных веществ, относящихся к семейству цитокинов.

К цитокинам относят интерфероны, колониестимулирующие факторы (КСФ), хемокины, трансформирующие ростовые факторы; фактор некроза опухолей; интерлейкины со сложившимися исторически порядковыми номерами и некоторые другие эндогенные медиаторы. Интерлейкины, имеющие порядковые номера, начиная с 1, не относятся к одной подгруппе цитокинов, связанных общностью функций. Они в свою очередь могут быть разделены на провоспалительные цитокины, ростовые и дифференцировочные факторы лимфоцитов, отдельные регуляторные цитокины.

Классификация цитокинов может проводиться по их биохимическим и биологическим свойствам, а также по типам рецепторов, посредством которых цитокины осуществляют свои биологические функции. Классификация цитокинов по строению (Табл. 1) учитывает не только аминокислотную последовательность, но прежде всего третичную структуру белка, более точно отражающую эволюционное происхождение молекул Таблица 1. Классификация цитокинов по строению. .

ование генов и анализ строения рецепторов цитокинов показали, что также, как и сами цитокины эти молекулы могут быть разделены на несколько типов согласно сходству аминокислотных последовательностей и особенностям организации внеклеточных доменов (Табл. 2). Одно из наиболее крупных семейств рецепторов цитокинов называется семейством гемопоэтиновых рецепторов или семейством цитокиновых рецепторов I типа. Особенностью строения этой группы рецепторов является наличие в молекуле 4 цистеинов и последовательности аминокислот Trp-Ser-X-Trp. Ser (WSXWS), расположенной на небольшом расстоянии от клеточной мембраны [Ihle e. a. , 1995]. II класс цитокиновых рецепторов взаимодействует с интерферонами и с ИЛ-10. Оба первых типа рецепторов имеют гомологию друг с другом. Следующие группы рецепторов обеспечивают взаимодействие с цитокинами семейства фактора некроза опухолей и семейства ИЛ-1. В настоящее время известно более 20 различных рецепторов хемокинов, взаимодействующих с разной степенью аффинности с одним или несколькими лигандами хемокинового семейства. Рецепторы хемокинов принадлежат к суперсемейству родопсиновых рецепторов, имеют 7 трансмембранных доменов и проводят сигнал с участием G-белков.


Многие рецепторы цитокинов состоят из 2 -3 субъединиц, кодируемых разными генами и экспрессируемых независимо. При этом для формирования высокоаффинного рецептора требуется одновременное взаимодействие всех субъединиц. Примером подобной организации рецепторов цитокинов служит строение рецепторного комплекса ИЛ-2. Присутствие общей сигнальной субъединицы в рецепторах цитокинов служит одним из подходов для их классификации, так как позволяет найти общность как в строении лигандов, так и в биологических эффектах. В таблице 3 приведена объединенная структурно-функциональная классификация, где все цитокины разделены на группы, в первую очередь с учетом их биологической активности, а также указанных выше особенностей строения молекул цитокинов и их рецепторов
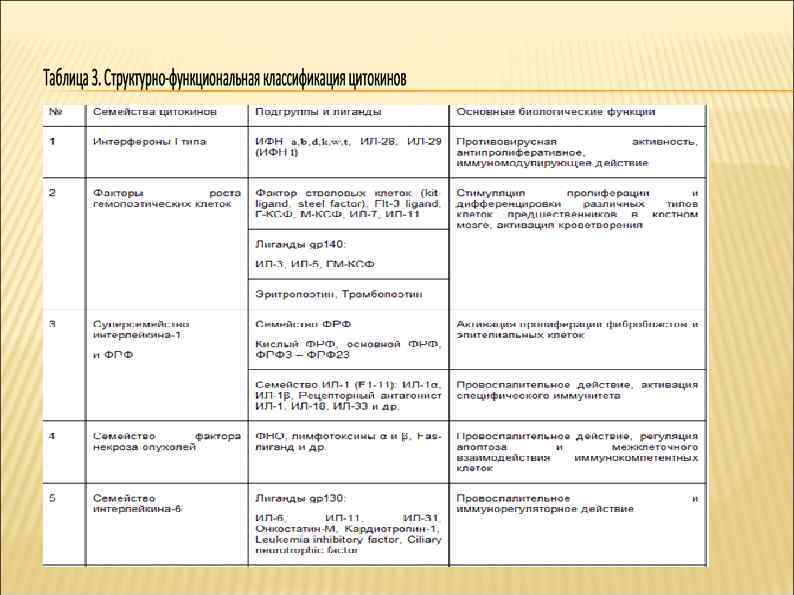



Первая группа включает интерфероны I типа и является наиболее простой по организации, так как все включенные в нее молекулы имеют сходное строение и во многом одинаковые функции, связанные с противовирусной защитой. Во вторую группу вошли факторы роста и дифференцировки гемопоэтических клеток, стимулирующие развитие кроветворных клеток-предшественников, начиная от стволовой клетки. В эту группу включены цитокины, узко специфичные для отдельных линий дифференцировки кроветворных клеток (эритропоэтин, тромбопоэтин, а также ИЛ-7, действующий на предшественники Т- В-лимфоцитов), а также цитокины с более широким спектром биологической активности, такие как ИЛ-3, ИЛ-11, колониестимулирующие факторы. В составе этой группы цитокинов выделены лиганды gp 140, имеющие общую рецепторную субъединицу, а также тромбопоэтин и эритропоэтин в силу сходства структурной организации молекул. Цитокины суперсемейства ФРФ и ИЛ-1 имеют высокую степень гомологии и сходное строение белков, что подтверждает общность происхождения. Тем не менее, по проявлениям биологической активности ФРФ во многом отличается от агонистов семейства ИЛ-1. Семейство молекул ИЛ-1 в настоящее время кроме функциональных названий имеет обозначения F 1 -F 11, где F 1 соответствует ИЛ-1α, F 2 - ИЛ-1β, F 3 – рецепторному антагонисту ИЛ-1, F 4 - ИЛ-18. Остальные члены семейства открыты в результате генетического анализа и обладают достаточно высокой гомологией с молекулами ИЛ-1, однако, их биологически функции полностью не выяснены.

Следующие группы цитокинов включают семейства ИЛ-6 , фактора некроза опухолей и хемокины, представленные наибольшим числом индивидуальных лигандов и перечисленные полностью в соответствующих главах. Семейство фактора некроза опухолей сформировано в основном на основании сходства в строении лигандов и их рецепторов, состоящих из трех нековалентно связанных одинаковых субъединиц, формирующих биологически активные молекулы. В то же время по биологическим свойствам в данное семейство включены цитокины с достаточно разными активностями. Например, ФНО является одним из наиболее ярких провоспалительных цитокинов, Fas-лиганд вызывает апоптоз клеток мишеней, а CD 40 -лиганд обеспечивает стимулирующий сигнал при межклеточном взаимодействии Т- и В-лимфоцитов. Такие различия в биологической активности структурно сходных молекул определяются в первую очередь особенностями экспрессии и строения их рецепторов, например наличием или отсутствием внутриклеточного домена «смерти» , определяющего апоптоз клеток. Семейства ИЛ-10 и ИЛ-12 в последние годы также пополнились новыми членами, получившими порядковые номера интерлейкинов. Далее следует очень сложная группа цитокинов, представляющая собой медиаторы функциональной активности Т-лимфоцитов хелперов. Включение в эту группу основано на двух основных принципах: 1) принадлежность к цитокинам, синтезируемым Тх1 или Тх2, что определяет развитие преимущественно гуморального или клеточного типа иммунологических реакций, 2) наличие общей рецепторной субъединицы – гамма цепи рецепторного комплекса ИЛ-2. Среди лигандов гамма цепи дополнительно выделен ИЛ-4, имеющий также общие рецепторные субъединицы с ИЛ-13, что во многом определяет частично перекрывающуюся биологическую активность этих цитокинов. Аналогично выделен ИЛ 7, имеющий общность строения рецепторов с ТСЛП.

1. Цитокины являются полипептидами или белками, часто гликозилированными, большинство из них имеют ММ от 5 до 50 к. Да. Биологически активные молекулы цитокинов могут состоять из одной, двух, трех и более одинаковых или разных субъединиц. 2. Цитокины не имеют антигенной специфичности биологического действия. Они влияют на функциональную активность клеток, принимающих участие в реакциях врожденного и приобретенного иммунитета. Тем не менее, воздействуя на Т- и В-лимфоциты, цитокины способны стимулировать индуцированные антигенами процессы в иммунной системе. 3. Для генов цитокинов существуют три варианта экспрессии: а) стадиоспецифическая экспрессия на определенных стадиях эмбрионального развития, б) конститутивная экспрессия для регуляции ряда нормальных физиологических функций, в) индуцибельный тип экспрессии, характерный для большинства цитокинов. Действительно, большинство цитокинов вне воспалительной реакции и иммунного ответа не синтезируются клетками. Экспрессия генов цитокинов начинается в ответ на проникновение в организм патогенов, антигенное раздражение или повреждение тканей. Одними из наиболее сильных индукторов синтеза провоспалительных цитокинов служат патоген-ассоциированные молекулярные структуры. Для запуска синтеза Т-клеточных цитокинов требуется активация клеток специфическим антигеном с участием Т-клеточного антигенного рецептора. 4. Цитокины синтезируются в ответ на стимуляцию короткий промежуток времени. Синтез прекращается за счет разнообразных механизмов ауторегуляции, включая повышенную нестабильность РНК, и за счет существования отрицательных обратных связей, опосредуемых простагландинами, кортикостероидными гормонами и другими факторами. 5. Один и тот же цитокин может продуцироваться различными по гистогенетическому происхождению типами клеток организма в разных органах.
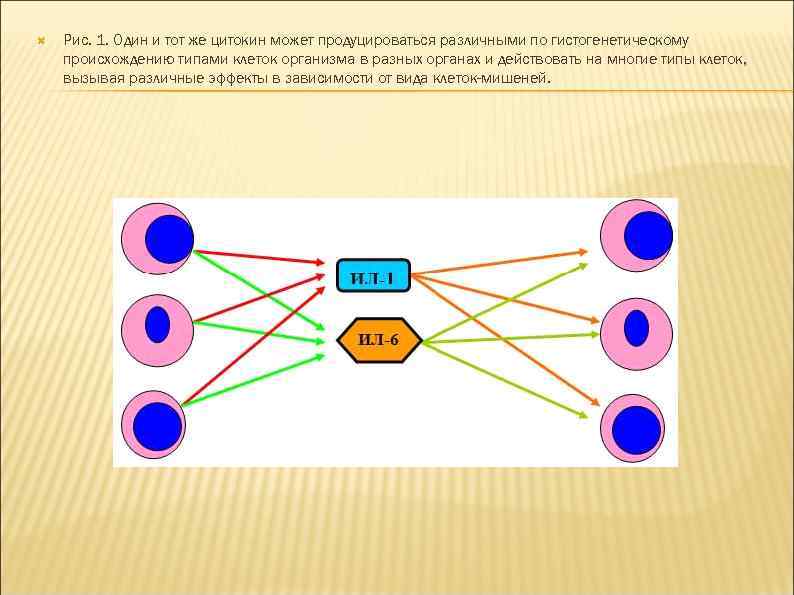
Рис. 1. Один и тот же цитокин может продуцироваться различными по гистогенетическому происхождению типами клеток организма в разных органах и действовать на многие типы клеток, вызывая различные эффекты в зависимости от вида клеток-мишеней.

6. Для цитокинов характерна взаимозаменяемость биологического действия. Несколько разных цитокинов могут вызывать один и тот же биологический эффект либо обладать похожей активностью. Цитокины индуцируют либо подавляют синтез самих себя, других цитокинов и их рецепторов. 7. В ответ на активационный сигнал происходит синтез клетками одновременно нескольких цитокинов, участвующих в формировании цитокиновой сети. Биологические эффекты в тканях и на уровне организма зависят от присутствия и концентрации других цитокинов с синергичным, аддитивным или противоположным действием. 8. Цитокины могут влиять на пролиферацию, дифференцировку и функциональную активность клеток-мишеней. 9. Цитокины действуют на клетки различными путями: аутокринно – на клетку, синтезирующую и секретирующую данный цитокин; паракринно – на клетки, расположенные вблизи клеткипродуцента, например, в очаге воспаления или в лимфоидном органе; эндокринно – дистантно на клетки любых органов и тканей после попадания в циркуляцию. В последнем случае действие цитокинов напоминает действие гормонов (рис. 2).
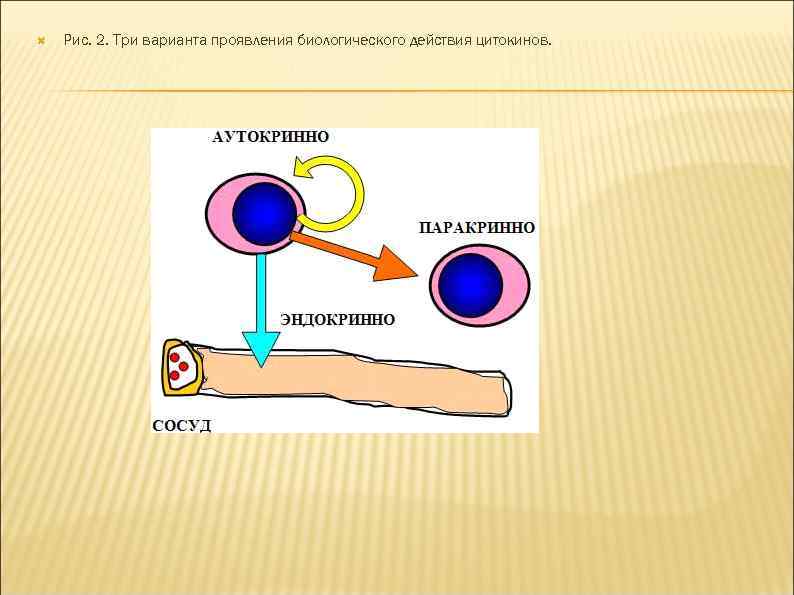
Рис. 2. Три варианта проявления биологического действия цитокинов.

Роль цитокинов в регуляции физиологических функций организма может быть разделена на 4 основных составляющих: 1. Регуляция эмбриогенеза, закладки и развития органов, в т. ч. органов иммунной системы. 2. Регуляция отдельных нормальных физиологических функций. 3. Регуляция защитных реакций организма на местном и системном уровне. 4. Регуляция процессов регенерации тканей.

1. Экспрессия генов отдельных цитокинов происходит стадиоспецифически на определенных этапах эмбрионального развития. Фактор стволовых клеток, трансформирующие ростовые факторы, цитокины семейства ФНО и хемокины регулируют дифференцировку и миграцию различных клеток и закладку органов иммунной системы. После этого синтез некоторых цитокинов может не возобновляться, тогда как другие продолжают регулировать нормальные физиологические процессы или участвуют в развитии защитныъх реакций.
2. Несмотря на то, что большинство цитокинов являются типичными индуцибельными медиаторами и в постнатальном периоде не синтезируются клетками вне воспалительной реакции и иммунного ответа, некоторые цитокины не подпадают под это правило. В результате конститутивной экспрессии генов часть из них синтезируются постоянно и в достаточно больших количествах находятся в циркуляции, регулируя пролиферацию и дифференцировку отдельных типов клеток в течение всей жизни. Примерами такого типа физиологической регуляции функций цитокинами может быть постоянно высокий уровень эритропоэтина и некоторых КСФ для обеспечения гемопоэза. 3. Регуляция защитных реакций организма цитокинами происходит не только в рамках иммунной системы, но и путем организации защитных реакций на уровне целостного организма за счет регуляции практически всех сторон развития воспаления и иммунного ответа. Эта важнейшая для всей системы цитокинов функция связана с двумя основными направлениями биологического действия цитокинов - защитой от инфекционных агентов и восстановлением поврежденных тканей. Цитокины в первую очередь регулируют развитие местных защитных реакций в тканях с участием различных типов клеток крови, эндотелия, соединительной ткани и эпителиев. Защита на местном уровне развивается путем формирования типичной воспалительной реакции с ее классическими проявлениями: гиперемией, развитием отека, появлением болевого синдрома и нарушением функции.

Синтез цитокинов начинается при проникновении в ткани патогенов либо нарушении их целостности, что обычно протекает параллельно. Продукция цитокинов является составной частью клеточного ответа, связанного с распознаванием клетками миеломоноцитарного ряда сходных структурных компонентов различных патогенов, называемых патогенассоциированными молекулярными паттернами. Примерами подобных структур патогенов служат липополисахариды грам-отрицательных бактерий, пептидогликаны грам-положительных микроорганизмов, флагеллин. Лейкоциты экспрессируют соответствующие паттернраспознающие рецепторы, называемые также Toll-like receptors (TLR) и специфичные для определенных структурных паттернов микроорганизмов [Brightbill, Modlin, 2000]. После взаимодействия микроорганизмов или их компонентов с TLR запускается внутриклеточный каскад передачи сигнала, приводящий к усилению функциональной активности лейкоцитов и экспрессии генов цитокинов. Активация TLR приводит к синтезу двух основых групп цитокинов: провоспалительных цитокинов и интерферонов I типа, главным образом ИФНα/β Ключевым по значимости событием является синтез комплекса провоспалительных цитокинов из семейств ИЛ-1, ИЛ-6, ФНО и хемокинов, стимулирующих большинство дальнейших событий в развитии воспалительной реакции и обеспечивающих веерное расширение активации различных типов клеток, участвующих в поддержании и регуляции воспаления, включая все типы лейкоцитов, дендритные клетки, Т и В-лимфоциты, НК клетки, эндотелиальные и эпителиальные клетки, фибробласты и другие. Это обеспечивает последовательные этапы развития воспалительной реакции, являющейся основным механизмом реализации врожденного иммунитета. Кроме того начинается синтез дендритными клетками цитокинов семейства ИЛ-12, стимулирующих дифференцировку Т-лимфоцитов хелперов, что служит своеобразным мостиком к началу развития реакций специфического иммунитета, связанных с распознаванием специфических антигенных структур микроорганизмов.

Второй не менее важный механизм, связанный с синтезом ИФН, обеспечивает реализацию противовирусной защиты. Интерфероны I типа проявляют 4 основных биологических свойства: 1. Прямое противовирусное действие за счет блокирования транскрипции. 2. Подавление пролиферации клеток, нужное для блокирования распространения вируса. 3. Активация функций НК клеток, обладающих способностью лизировать инфицированные вирусом клетки организма. 4. Усиление экспрессии молекул главного комплекса гистосовместимости I класса, нужное для увеличения эффективности представления вирусных антигенов инфицированными клетками цитотоксическим Т-лимфоцитам. Это приводит к активации специфического распознавания инфицированных вирусом клеток Т-лимфоцитами – первого этапа лизиса вирус-инфицированных клеток-мишеней.

4. На тканевом уровне цитокины ответственны за развития воспаления, а затем регенерации тканей. При развитии системной воспалительной реакции цитокины оказывают влияние практически на все органы и системы организма, участвующие в регуляции гомеостаза. Действие провоспалительных цитокинов на ЦНС приводит к снижению аппетита и изменению всего комплекса поведенческих реакций. Одно из первых проявлений системной воспалительной реакции, связанное с действием цитокинов на терморегуляторный центр гипоталамуса, заключается в подъеме температуры тела. Увеличение температуры является эффективной защитной реакцией, так как при повышенной температуре снижается способность ряда бактерий к размножению, но, напротив, возрастает пролиферация лимфоцитов. Таким образом при развитии системного воспаления цитокины проявляют огромный спектр биологических активностей и вмешиваются в работу практически всех систем организма. Однако ни одно из происходящих изменений не носит случайный характер: все они либо нужны для непосредственной активации защитных реакций либо выгодны в плане переключения энергетических потоков для одной лишь задачи – борьбы с внедрившимся патогеном. На уровне целостного организма цитокины осуществляют связь между иммунной, нервной, эндокринной, кроветворной и другими системами и служат для их вовлечения в организацию и регуляцию единой защитной реакции. Цитокины как раз и служат той организующей системой, которая формирует и регулирует весь комплекс защитных реакций организма при внедрении патогенов.

это класс функционально сходных белков, экспрессия которых усиливается при повышении температуры или при других стрессирующих клетку условиях. Повышение экспрессии генов, кодирующих белки теплового шока, регулируется на этапе транскрипции. Чрезвычайное усиление экспрессии генов, кодирующих белки теплового шока является частью клеточного ответа на тепловой шок и вызывается в основном фактором теплового шока (HSF англ. heat shock factor). Белки теплового шока обнаружены в клетках практически всех живых организмов, от бактерий до человека.

Было показано, что быстрое нагревание до сублетальных температур делает организмы нечувствительными к нагреванию до более высоких температур. В 1962 году Ритосса показал, что нагревание и ингибитор метаболизма динитрофенол вызывают сходные изменения в структуре пуффов политенных хромосом Дрозофилы. Это открытие далее привело к выделению белков теплового шока англ. heat-shock proteins (HSP) или белков стресса. Повышение экспрессии генов, кодирующих указанные белки у Дрозофилы было показано в 1974 году. Экспрессия повышалась после действия на мух стрессирующих факторов, например, теплового шока. Начиная с середины 1980 -х годов было показано, что многие белки теплового шока действуют как шапероны и играют важную роль в сворачивании белков, внутриклеточном транспорте белков и ренатурации белков, изменивших конформацию после теплового шока.

Точный механизм, по которому тепловой шок активирует экспрессию генов белков теплового шока, не выяснен. Однако, некоторые исследования свидетельствуют о том, что активация белков теплового шока происходит неправильно сложенными или поврежденными белками. Повышение синтеза при стрессе Высокие уровни белков теплового шока в клетке наблюдают после воздействия различных стрессирующих факторов — при инфекциях, воспалительных процессах, внешних воздействиях токсинов (этанол, мышьяк, тяжелые металлы), при ультрафиолетовом облучении, голодании, гипоксии, недостатке азота (у растений) или нехватке воды. Белки теплового шока называют белками стресса, так как повышение экспрессии соответствующих генов часто наблюдается при ответе на стресс.
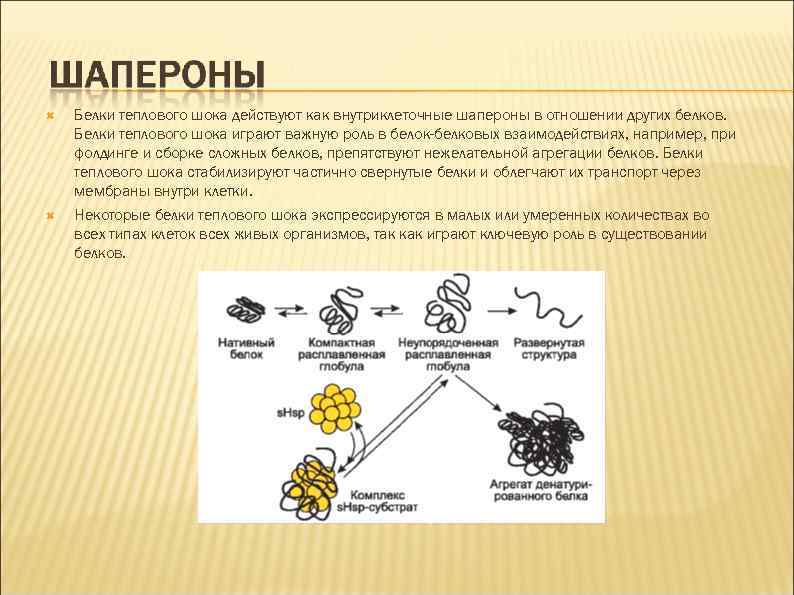
Белки теплового шока действуют как внутриклеточные шапероны в отношении других белков. Белки теплового шока играют важную роль в белок-белковых взаимодействиях, например, при фолдинге и сборке сложных белков, препятствуют нежелательной агрегации белков. Белки теплового шока стабилизируют частично свернутые белки и облегчают их транспорт через мембраны внутри клетки. Некоторые белки теплового шока экспрессируются в малых или умеренных количествах во всех типах клеток всех живых организмов, так как играют ключевую роль в существовании белков.

1)Внутриклеточные функции Белки теплового шока присутствуют в клетках и при нестрессовых условиях, как бы следят за белками в клетке. Белки теплового шока утилизируют старые белки в составе протеасомы и помогат корректно свернуться заново синтезированным белкам. 2)Сердечно-сосудистая система По-видимому, белки теплового шока играют важную роль в сердечно-сосудистой системе. Для белков теплового шока hsp 90, hsp 84, hsp 70, hsp 27, hsp 20, и альфа-B-кристаллин показана роль деятельности сердечно-сосудистой системы. Hsp 90 связывает эндотелиальную синтетазу оксида азота и гуанилатциклазу, которые в свою очередь участвуют в расслаблении сосудов. В системе передачи сигнала при помощи оксида азота далее протеинкиназа G фосфорилирует малый белок теплового шока, hsp 20, который принимает участие в расслаблении гладких мышц. Hsp 20 по-видимому, играет важную роль в развитии гладких мышц и предотвращает агрегацию тромбоцитов, предотвращает апоптоз после ишемического инсульта, а также имеет значение в функционировании скелетных мышц и ответе мышц на инсулин. Hsp 27 является главным фосфопротеином при мышечном сокращении. 3)Иммунитет Внеклеточные и связанные с плазматической мембраной, белки теплового шока, и особенно Hsp 70, участвуют в связывании и презентации антигенов

Так как некоторые белки теплового шока играют роль в презентации антигенов, их используют в качестве адъювантов для вакцин. Более того, некоторые исследователи считают, что белки теплового шока могут принимать участие в связывании белковых фрагментов разрушенных опухолевых клеток, осуществляя презентацию антигена иммунной системе. Некоторые белки теплового шока могут повышать эффективность вакцин против рака. Противораковые препараты Внутриклеточные белки теплового шока экспрессируются в раковых клетках и необходимы для выживания этих клеток. Показана роль малых молекул, ингибирующих белки теплового шока в качестве противораковых средств. Эффективный ингибитор Hsp 90 17 -N-аллиламино-17 деметоксигельданамицин проходит клинические испытания как средство против некоторых видов рака. Применение в сельском хозяйстве Исследована роль белков теплового шока в устойчивости к стрессу у гибридов растений, что может далее привести к выведению засухоустойчивых сортов, растущих на бедной почве
лизоцим.цитокины.белки теплового шока..ppt