Презентация липиды гфц сахара.ppt
- Количество слайдов: 123

Липиды содержатся в животных и растительных тканях Большая группа соединений, содержащих в своем составе сложно-эфирную связь, нерастворимых в воде и выполняющих в организме ряд важных функций 1

Структурные компоненты липидов • СПИРТЫ • ВЫСШИЕ ЖИРНЫЕ КАРБОНОВЫЕ КИСЛОТЫ • другие вещества 2
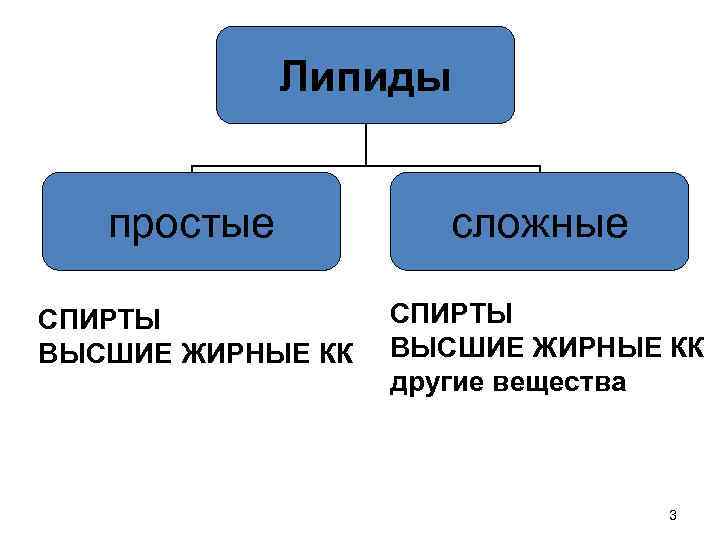
Липиды простые сложные СПИРТЫ ВЫСШИЕ ЖИРНЫЕ КК другие вещества 3
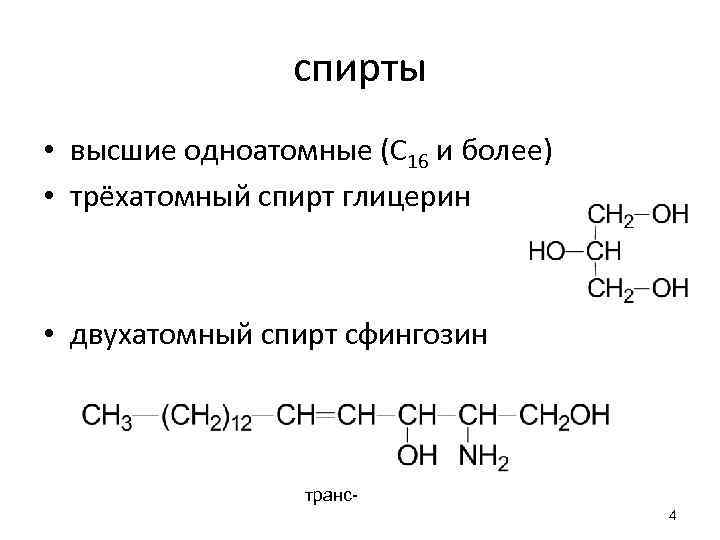
спирты • высшие одноатомные (С 16 и более) • трёхатомный спирт глицерин • двухатомный спирт сфингозин транс4

Простые липиды • • воски жиры и масла церамиды стериды 5
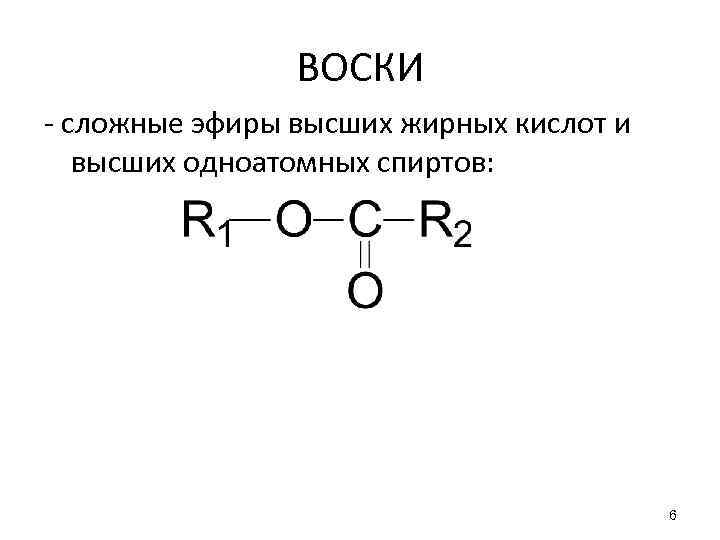
ВОСКИ - сложные эфиры высших жирных кислот и высших одноатомных спиртов: 6
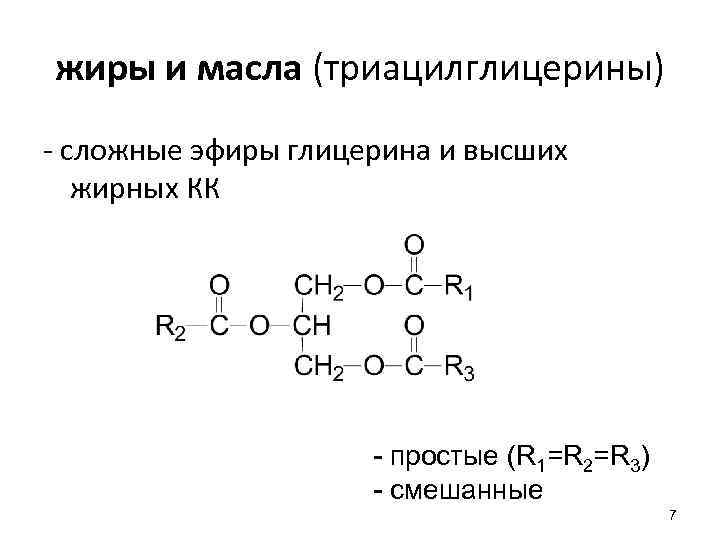
жиры и масла (триацилглицерины) - сложные эфиры глицерина и высших жирных КК - простые (R 1=R 2=R 3) - смешанные 7

церамиды - N-ацилированные производные спирта сфингозина 8

стериды - сложные эфиры высокосмолекулярного циклического спирта стерола и высокомолекулярной КК 9
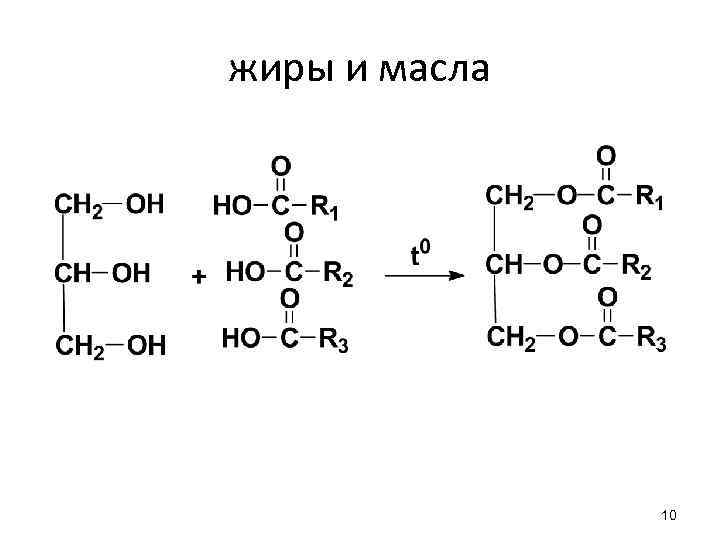
жиры и масла 10
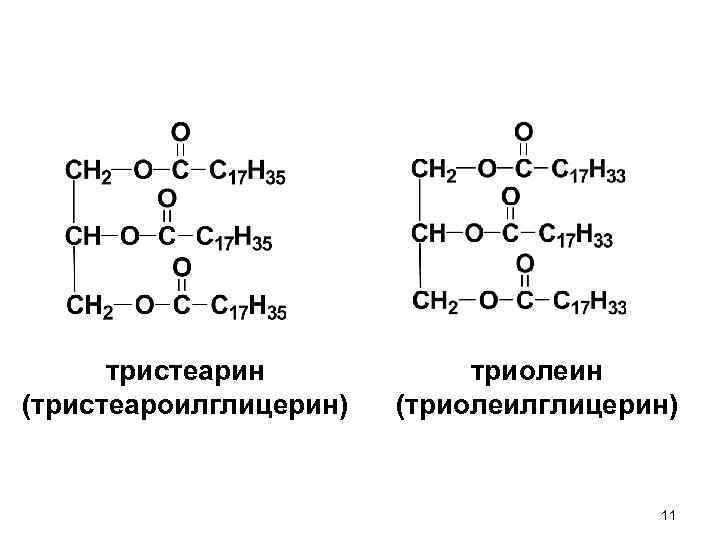
тристеарин (тристеароилглицерин) триолеин (триолеилглицерин) 11
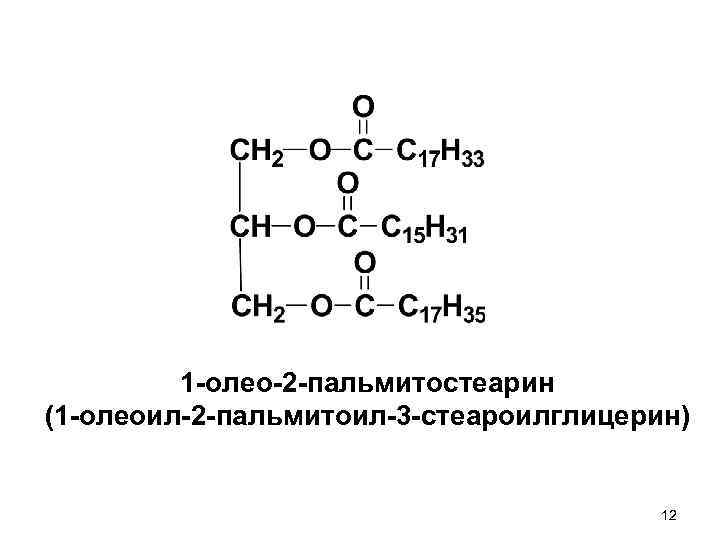
1 -олео-2 -пальмитостеарин (1 -олеоил-2 -пальмитоил-3 -стеароилглицерин) 12
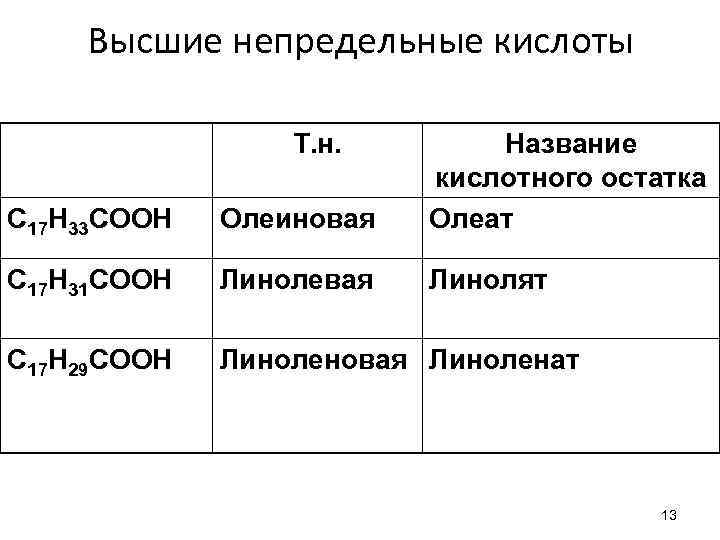
Высшие непредельные кислоты Т. н. C 17 H 33 COOH Олеиновая Название кислотного остатка Олеат C 17 H 31 COOH Линолевая Линолят C 17 H 29 COOH Линоленовая Линоленат 13
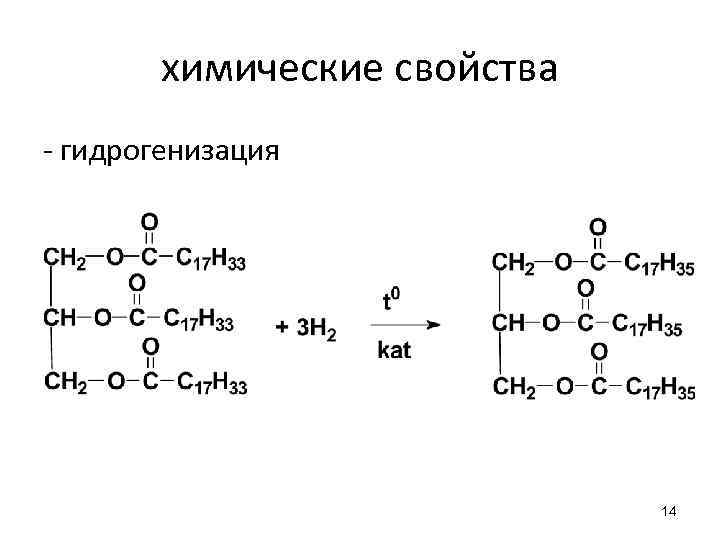
химические свойства - гидрогенизация 14
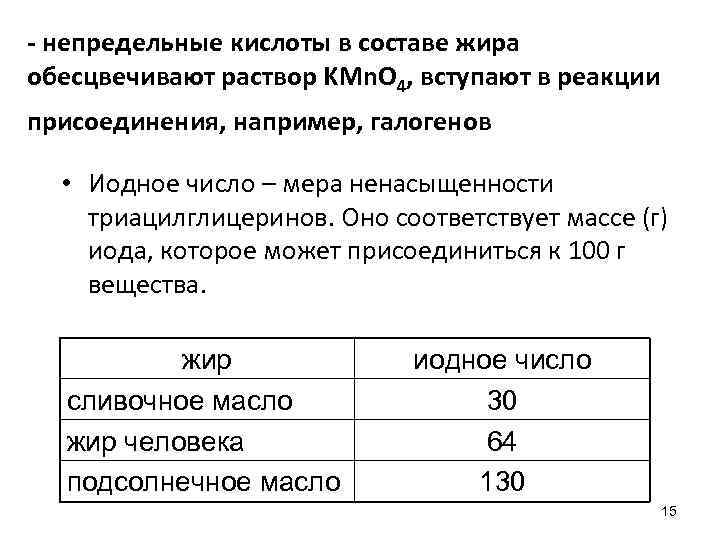
- непредельные кислоты в составе жира обесцвечивают раствор KMn. O 4, вступают в реакции присоединения, например, галогенов • Иодное число – мера ненасыщенности триацилглицеринов. Оно соответствует массе (г) иода, которое может присоединиться к 100 г вещества. жир сливочное масло жир человека подсолнечное масло иодное число 30 64 130 15
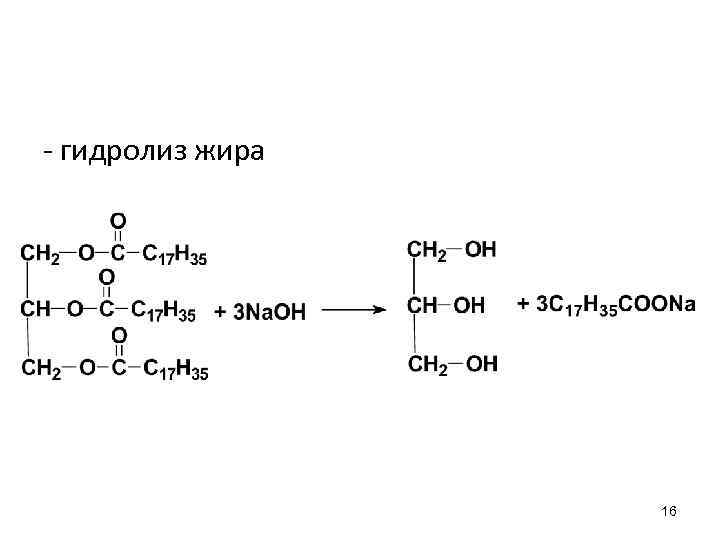
- гидролиз жира 16
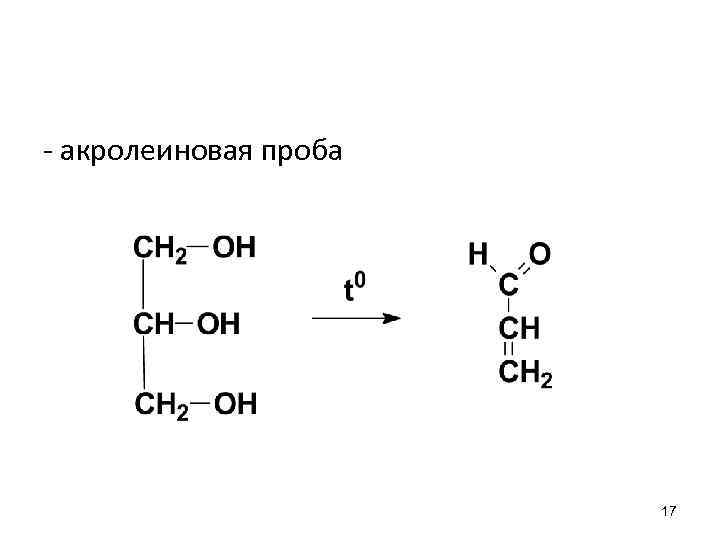
- акролеиновая проба 17

Биологическая роль жиров Энергетическая Структурная Резервная Механическая защита внутренних органов от повреждений • Термоизоляционная • Источник эндогенной воды • Растворяют жирорастворимые витамины (A, D, E, K) • • 18

Сложные липиды • Фосфолипиды • Сфинголипиды • Гликолипиды 19

Фосфолипиды - липиды, при гидролизе отщепляющие фосфорную кислоту Глицерофосфолипиды - сложные эфиры глицерина с высшими жирными кислотами и фосфорной кислотой. В состав фосфолипидов входят также азотсодержащие соединения, такие как холин, этаноламин или серин. 20

• Глицерофосфолипиды – главные липидные компоненты клеточных мембран. Они сопутствуют жирам в пище и служат источником фосфорной кислоты, необходимой для жизни человека. 21
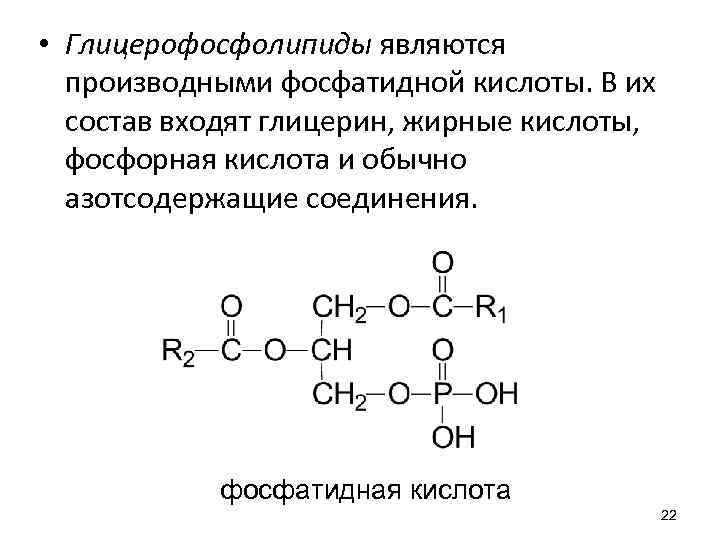
• Глицерофосфолипиды являются производными фосфатидной кислоты. В их состав входят глицерин, жирные кислоты, фосфорная кислота и обычно азотсодержащие соединения. фосфатидная кислота 22
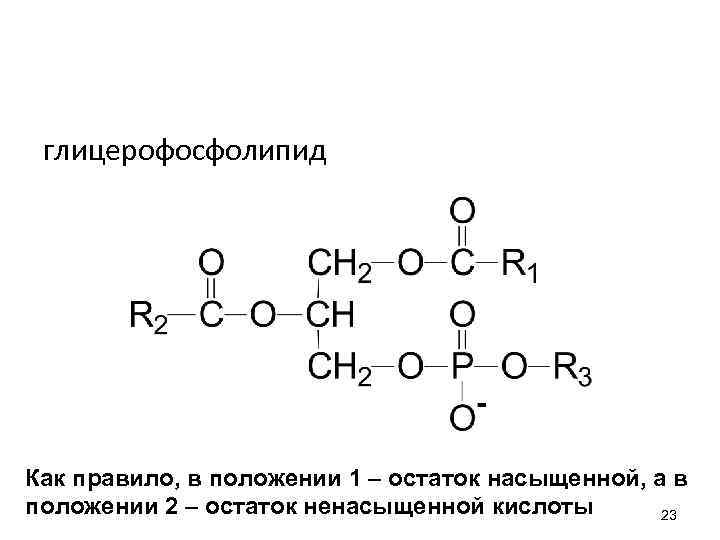
глицерофосфолипид Как правило, в положении 1 – остаток насыщенной, а в положении 2 – остаток ненасыщенной кислоты 23
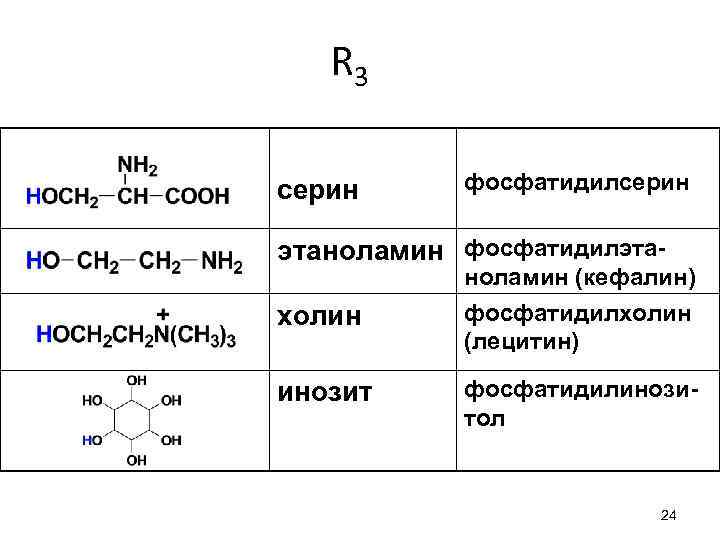
R 3 серин фосфатидилсерин этаноламин фосфатидилэтахолин ноламин (кефалин) фосфатидилхолин (лецитин) инозит фосфатидилинозитол 24
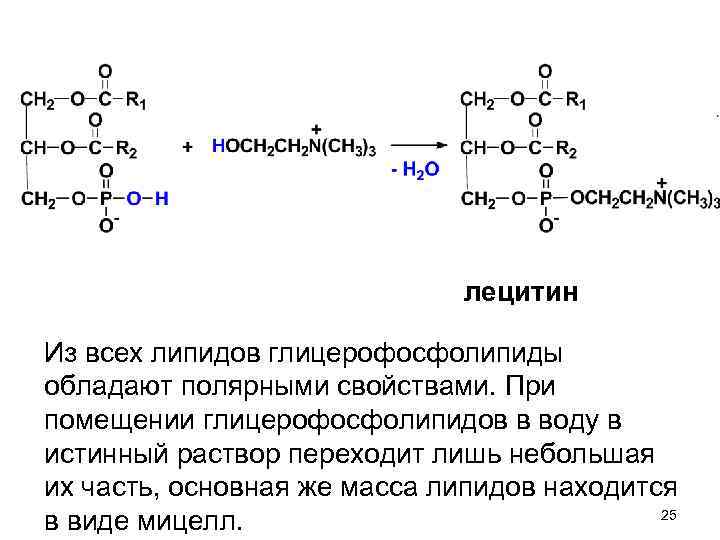
лецитин Из всех липидов глицерофосфолипиды обладают полярными свойствами. При помещении глицерофосфолипидов в воду в истинный раствор переходит лишь небольшая их часть, основная же масса липидов находится 25 в виде мицелл.

Биологическая роль фосфолипидов • Структурная - входят в состав клеточных мембран • Повышают растворимость холестерина и способствуют его выведению из организма • Препятствуют синтезу жира в печени 26

ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ (соединения со смешанными функциями) - соединения, в молекулах которых имеются различные функциональные группы
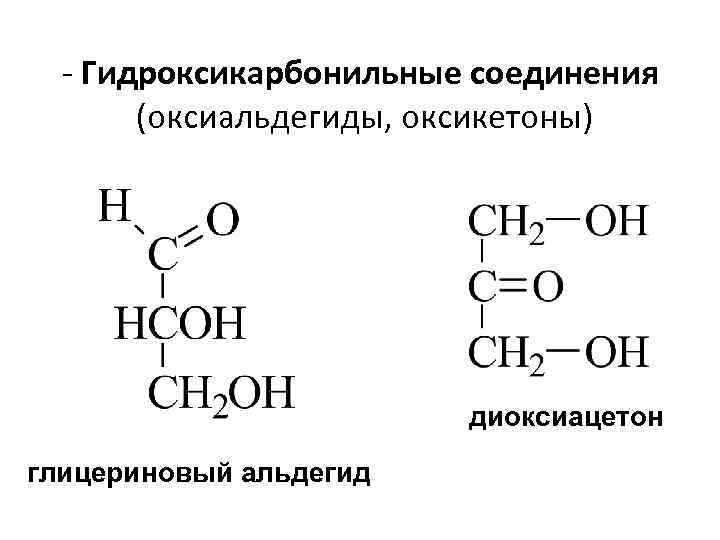
- Гидроксикарбонильные соединения (оксиальдегиды, оксикетоны) диоксиацетон глицериновый альдегид
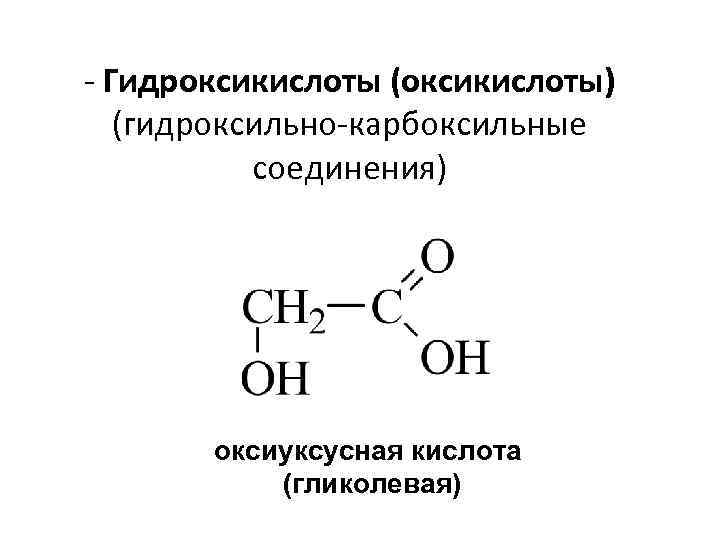
- Гидроксикислоты (оксикислоты) (гидроксильно-карбоксильные соединения) оксиуксусная кислота (гликолевая)
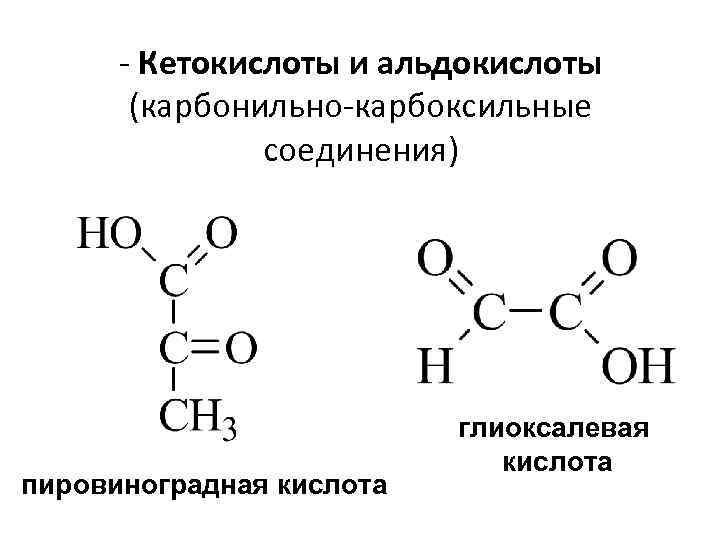
- Кетокислоты и альдокислоты (карбонильно-карбоксильные соединения) пировиноградная кислота глиоксалевая кислота
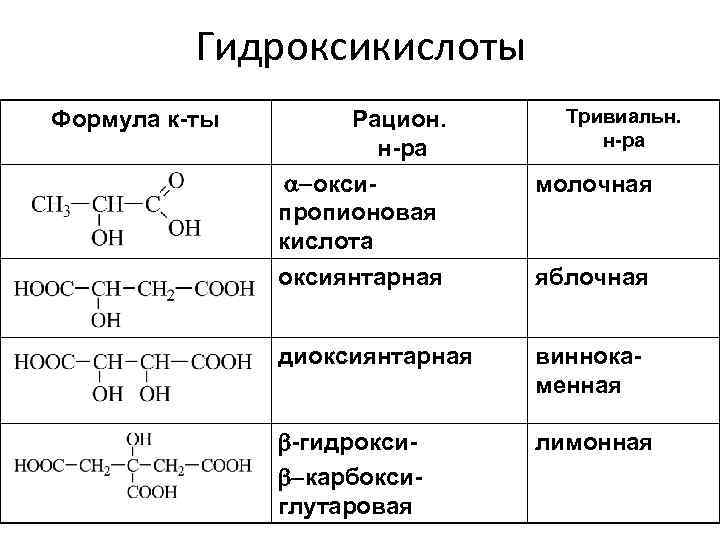
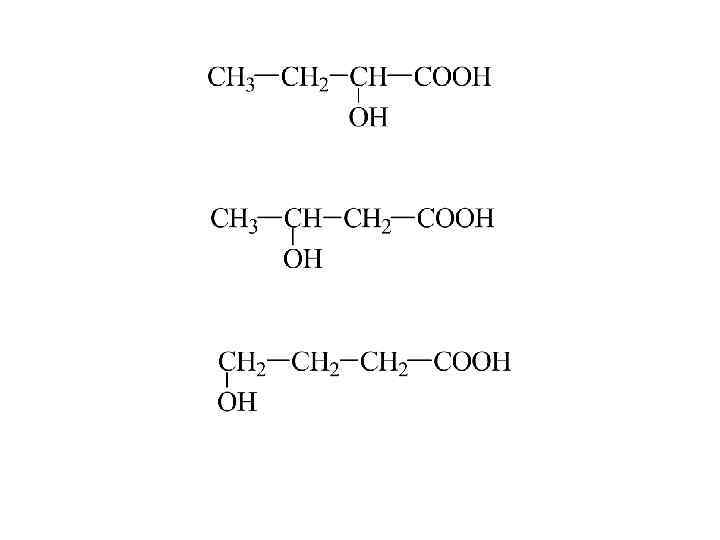
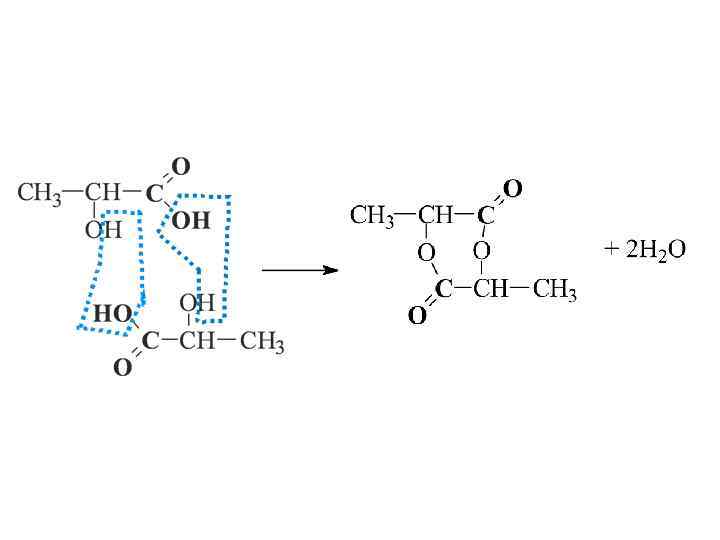
Гидроксикислоты Формула к-ты Тривиальн. н-ра Рацион. н-ра -оксипропионовая кислота молочная оксиянтарная яблочная диоксиянтарная виннокаменная -гидрокси- -карбоксиглутаровая лимонная
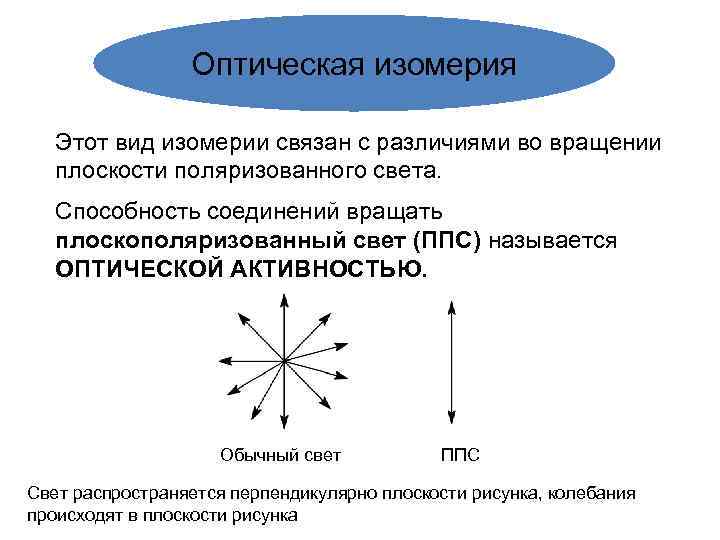
Оптическая изомерия Этот вид изомерии связан с различиями во вращении плоскости поляризованного света. Способность соединений вращать плоскополяризованный свет (ППС) называется ОПТИЧЕСКОЙ АКТИВНОСТЬЮ. Обычный свет ППС Свет распространяется перпендикулярно плоскости рисунка, колебания происходят в плоскости рисунка

Оптически активным веществом является вещество, которое вращает плоскость поляризованного света. Когда луч такого света, колебания которого происходили в определённой плоскости, выходит из оптически активного вещества, то его колебания уже совершаются в другой плоскости. Если соединение отклоняет пропущенный через него ППС вправо (по часовой стрелке), то оно правовращающее. Если соединение отклоняет пропущенный через него ППС влево (против часовой стрелки), то это левовращающее соединение. Соединения, вращающие ППС, имеют асимметрически построенные молекулы, т. е. они не имеют ни центра симметрии, ни плоскости симметрии.

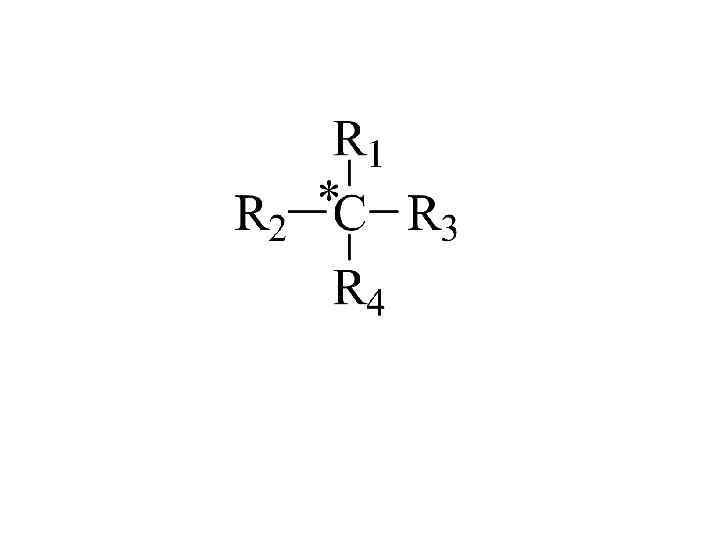
Оптически активные соединения имеют асимметрический атом углерода – атом, который связан с 4 различными атомами или атомными группировками. Асимметрический атом углерода называют хиральным центром. Молекула должна иметь хотя бы один хиральный центр, тогда она будет оптически активной. Соединение хиральное, если его молекула существует в виде пары энантиомеров (оптических изомеров) – несовместимых между собой в пространстве соединений, относящихся друг к другу как предмет и его зеркальное изображение. enantio (греч. ) - противоположный Энантиомеры – изомеры, которые являются зеркальными отображениями друга.

Связь пространственного строения соединений с их биологической активностью • Биохимические процессы стереоспецифичны: в реакцию вовлекаются определённые стереоизомеры и результатом реакции являются также стереохимически определённые продукты. • Как правило, один из энантиомеров проявляет биологическое действие, а другой неактивен, а иногда проявляет иное или даже противоположное действие.

Связь пространственного строения соединений с их биологической активностью • Многие лекарственные вещества проявляют фармакологический эффект при взаимодействии с рецепторами клетки. Конфигурация молекулы лекарственного вещества должна обеспечивать наиболее полное связывание с рецептором. Т. о. , биологическое действие биорегуляторов связано с пространственным строением их молекул.
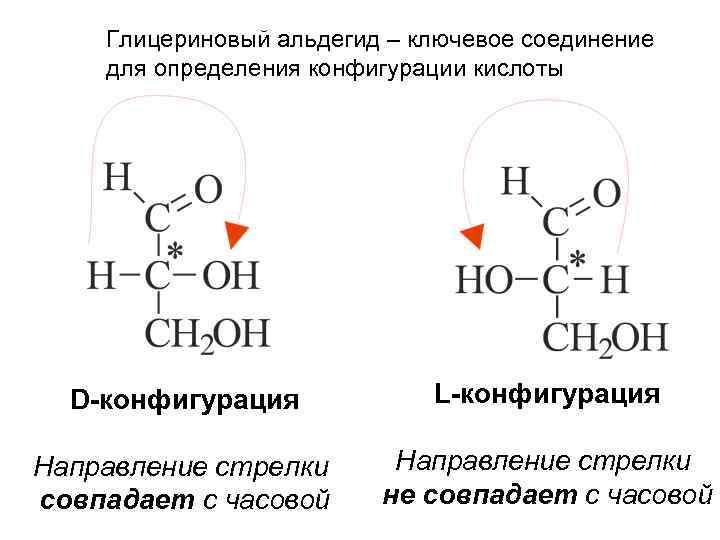
Глицериновый альдегид – ключевое соединение для определения конфигурации кислоты D-конфигурация L-конфигурация Направление стрелки совпадает с часовой Направление стрелки не совпадает с часовой

• «+» - правое вращение • «-» - левое вращение
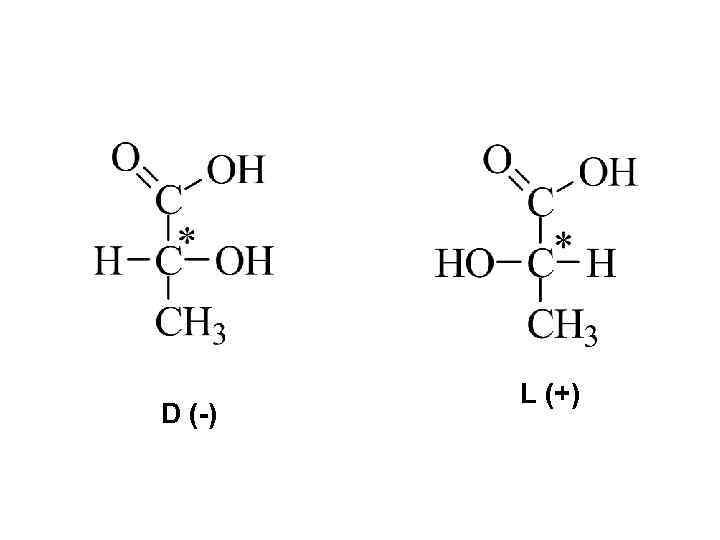
D (-) L (+)
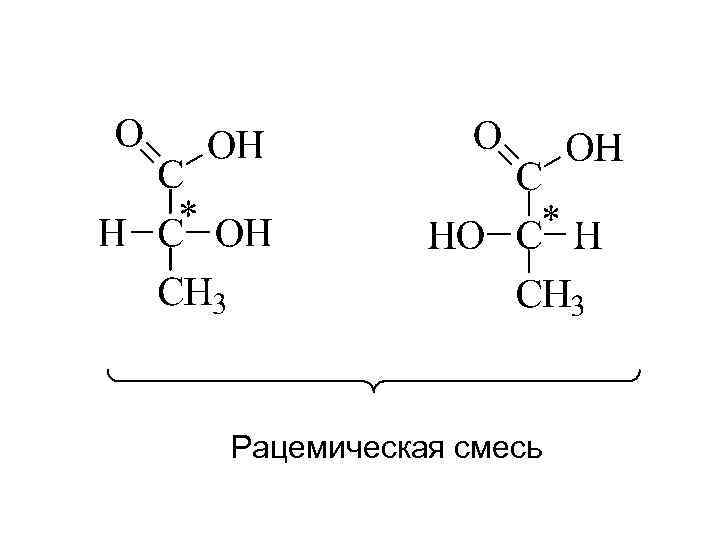
Рацемическая смесь
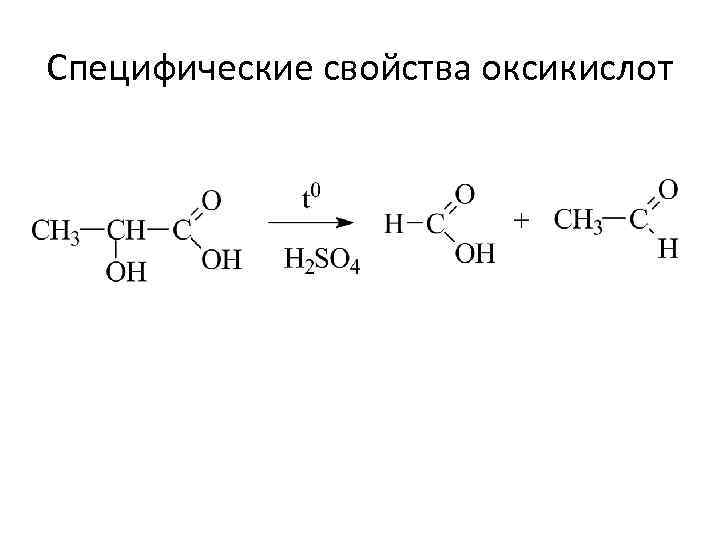
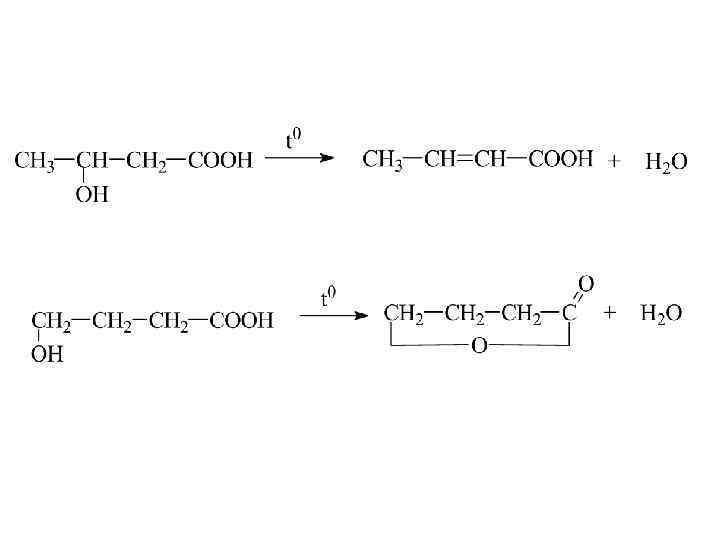
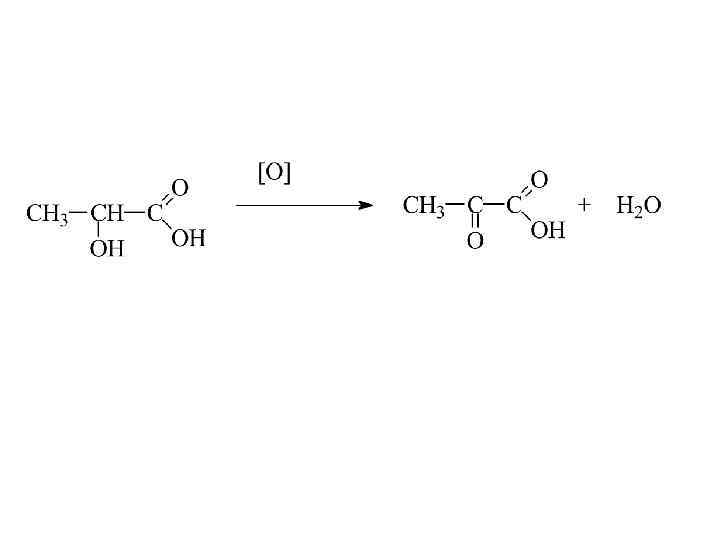
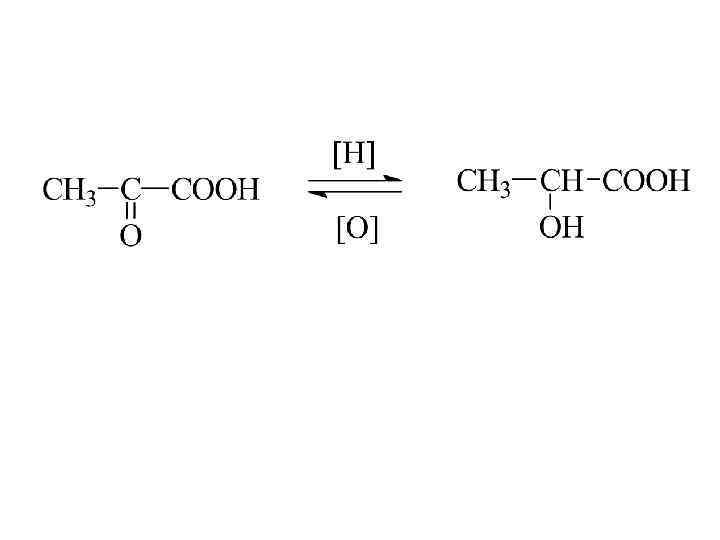
Специфические свойства оксикислот
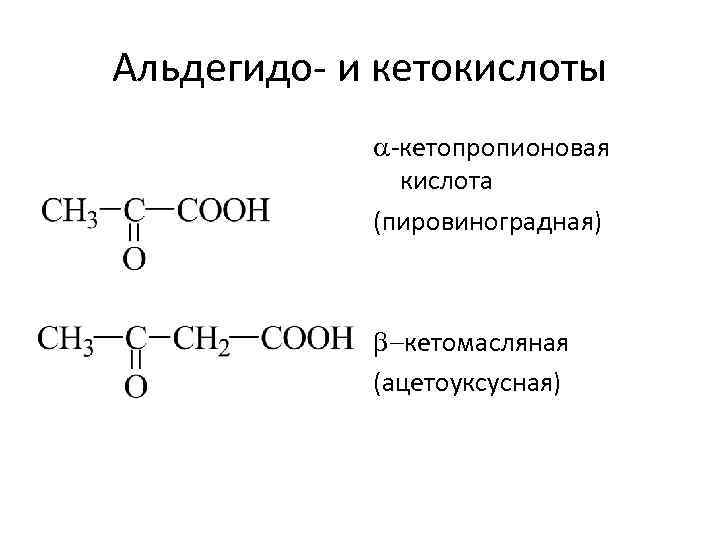
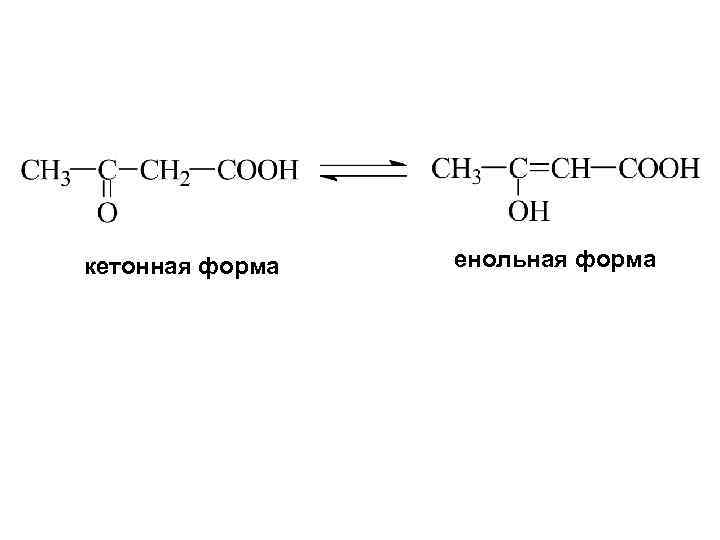
Альдегидо- и кетокислоты -кетопропионовая кислота (пировиноградная) b-кетомасляная (ацетоуксусная)
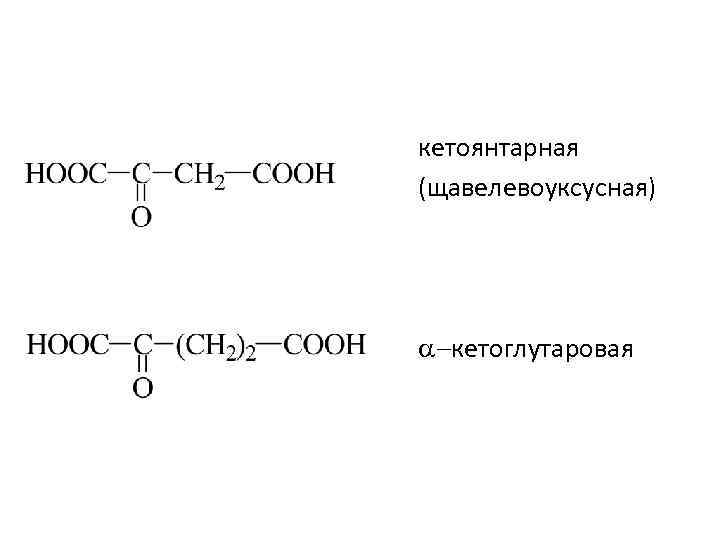
кетоянтарная (щавелевоуксусная) -кетоглутаровая
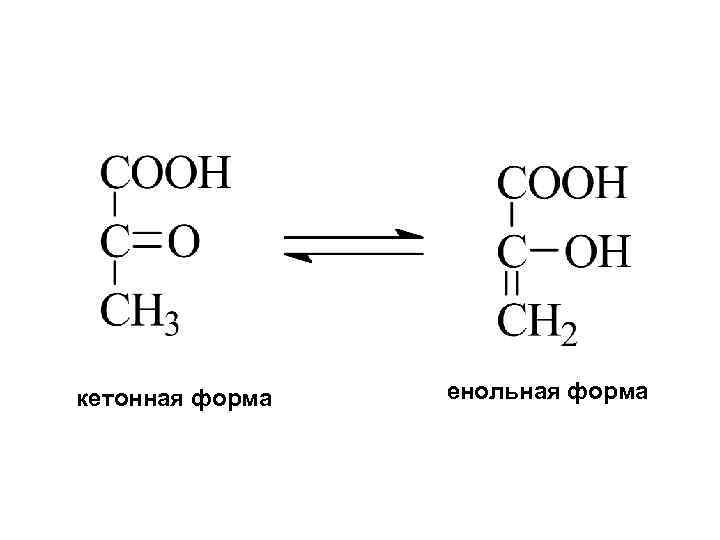
кетонная форма енольная форма
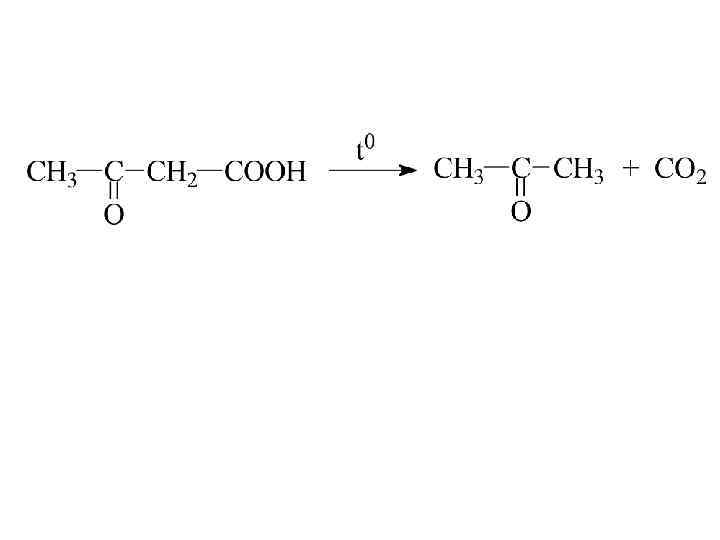
кетонная форма енольная форма
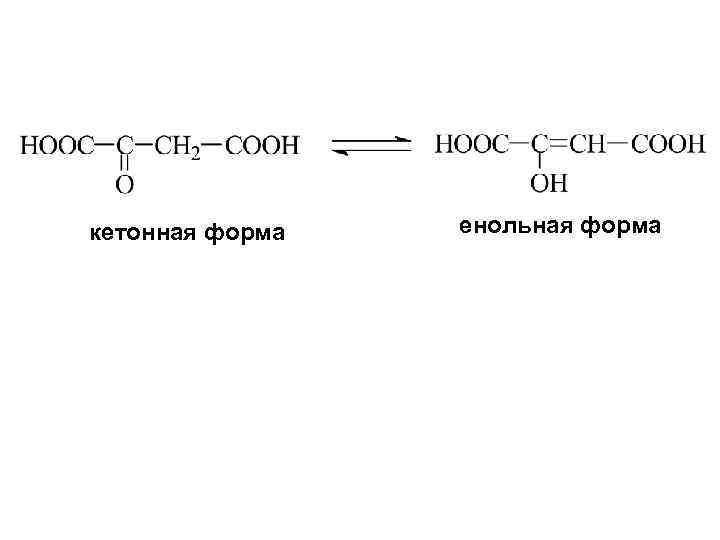
кетонная форма енольная форма
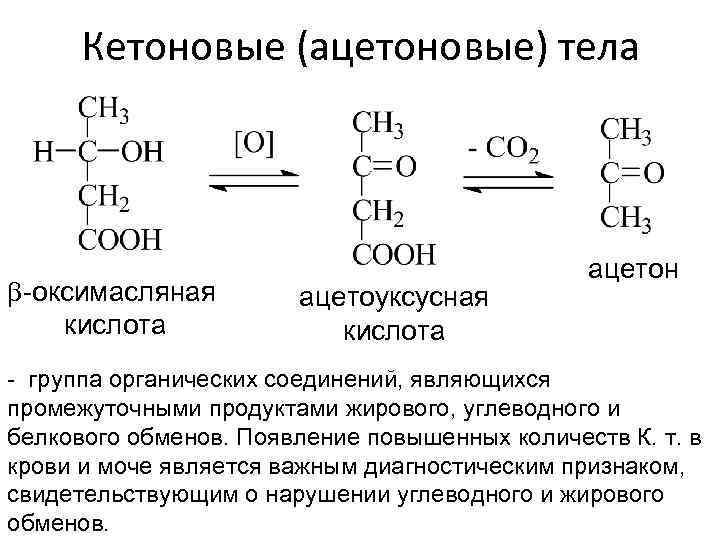
Кетоновые (ацетоновые) тела b-оксимасляная кислота ацетоуксусная кислота ацетон - группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. Появление повышенных количеств К. т. в крови и моче является важным диагностическим признаком, свидетельствующим о нарушении углеводного и жирового обменов.

• Кето новые тела (синоним ацетоновые тела) группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. К кетоновым телам относят β-оксимасляную и ацетоуксусную кислоты и ацетон, имеющие сходное строение и способные к взаимопревращениям. Появление повышенных количеств К. т. в крови и моче является важным диагностическим признаком, свидетельствующим о нарушении углеводного и жирового обменов.

УГЛЕВОДЫ

Углеводы • Входят в состав клеток и тканей всех растительных и животных организмов. • По массе составляют основную часть органического вещества на Земле: на долю углеводов приходится не менее 12% сухого веса любых организмов, они составляют основную часть биомассы растений (до 90 % сухого вещества).

Углеводы • Источники энергии в метаболических процессах (крахмал, гликоген) • Структурные компоненты клеточных стенок (целлюлоза, хитин и др. ) • Составные элементы жизненно важных веществ (нуклеиновые кислоты и др. ) • Используются как лекарственные средства

Углеводы • Образуются в растениях в процессе фотосинтеза из диоксида углерода и воды. • Животные организмы не способны синтезировать углеводы и получают их из растительных источников. • Углеводы служат основным ингредиентом пищи млекопитающих.

Углеводы • Класс углеводов (сахаров, карбогидратов) объединяет соединения, имеющие состав Сn. H 2 n. On и обладающие при этом весьма разнообразными свойствами.
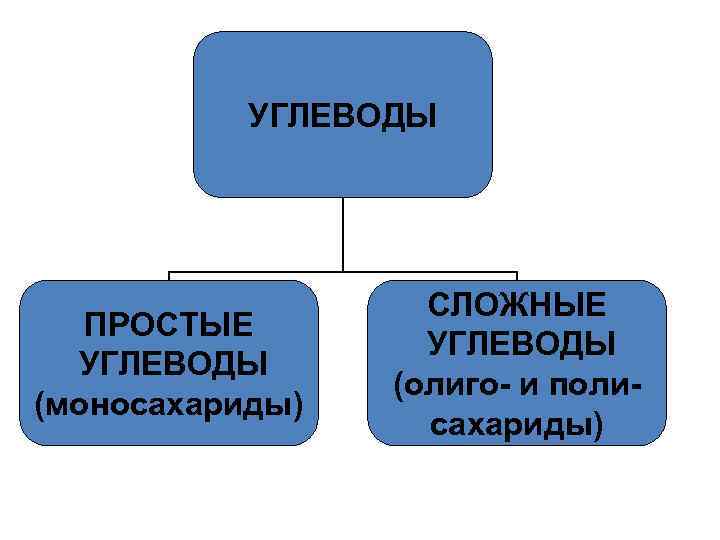
УГЛЕВОДЫ ПРОСТЫЕ УГЛЕВОДЫ (моносахариды) СЛОЖНЫЕ УГЛЕВОДЫ (олиго- и полисахариды)

Углеводы • По способности к гидролизу: - Моносахариды (простые сахара, монозы) не гидролизуются с образованием более простых углеводов. - Олигосахариды - соединения, имеющие в своем составе от 2 до 10 остатков моносахаридов, связанных О–гликозидными связями. - Полисахариды, представляющие собой высокомолекулярные вещества, соединенные О– гликозидными связями, со степенью полимеризации выше 10.

Моносахариды Гетерофункциональные соединения, содержат одновременно карбонильную и несколько гидроксильных групп: - полигидроксиальдегиды (альдозы) - полигидроксикетоны (кетозы) Для них характерна неразветвлённая углеродная цепь. Для названий моносахаридов используют суффикс -оза

• Все моносахариды представляют собой кристаллические вещества, хорошо растворимые в воде и обладающие, как правило, сладким вкусом. Они дают нейтральную реакцию на лакмус и в растворе существуют в открытой и циклической формах, которые находятся в состоянии динамического равновесия.
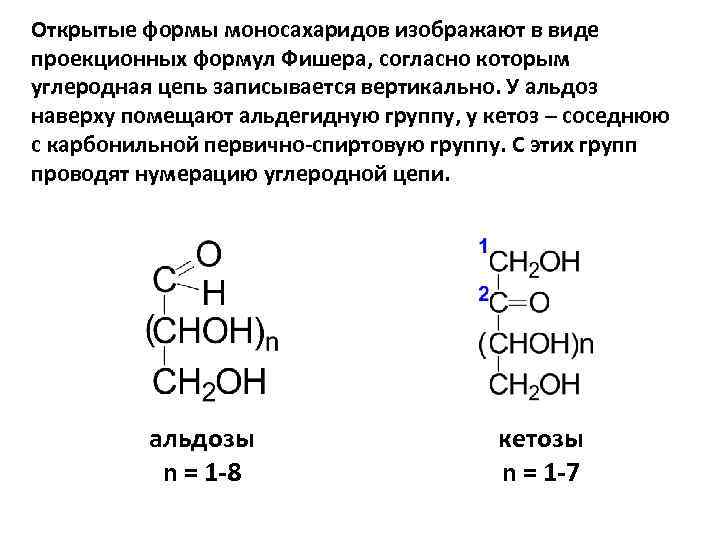
Открытые формы моносахаридов изображают в виде проекционных формул Фишера, согласно которым углеродная цепь записывается вертикально. У альдоз наверху помещают альдегидную группу, у кетоз – соседнюю с карбонильной первично-спиртовую группу. С этих групп проводят нумерацию углеродной цепи. альдозы n = 1 -8 кетозы n = 1 -7

Моносахариды • В зависимости от длины углеродной цепи (3 – 10 атомов): - триозы - тетрозы - пентозы - гексозы - гептозы

• Наличие в молекулах моносахаридов нескольких центров хиральности – причина существования большого числа стереоизомеров, соответствующих одной и той же структурной формуле.

Альдогексоза HOCH 2(*CHOH)4 CHO число стереоизомеров = 24 = 16 (8 пар энантиомеров) В биологических средах преимущественно распространены D-изомеры моносахаридов, что обусловлено особенностями их первичного синтеза в растениях. В связи с этим, человек, животные, а также микроорганизмы не способны усваивать L-изомеры.
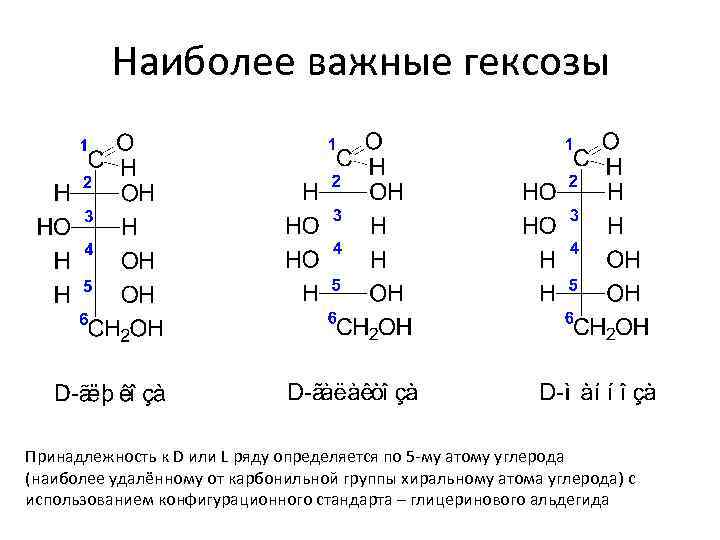
Наиболее важные гексозы Принадлежность к D или L ряду определяется по 5 -му атому углерода (наиболее удалённому от карбонильной группы хиральному атома углерода) с использованием конфигурационного стандарта – глицеринового альдегида
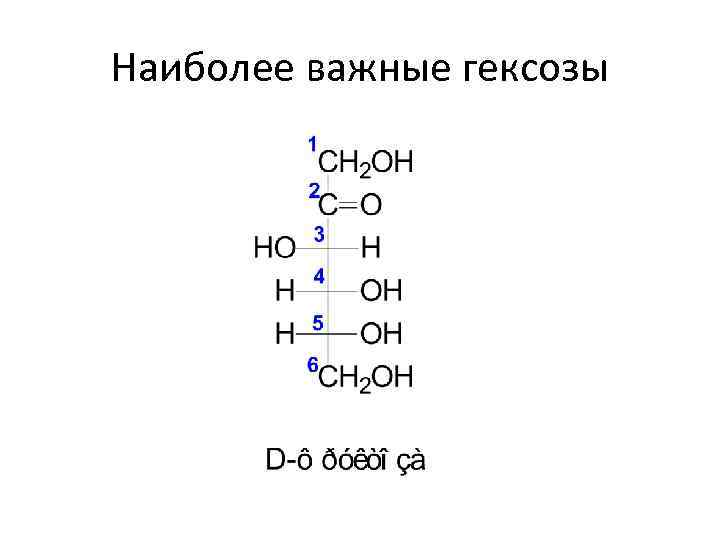
Наиболее важные гексозы
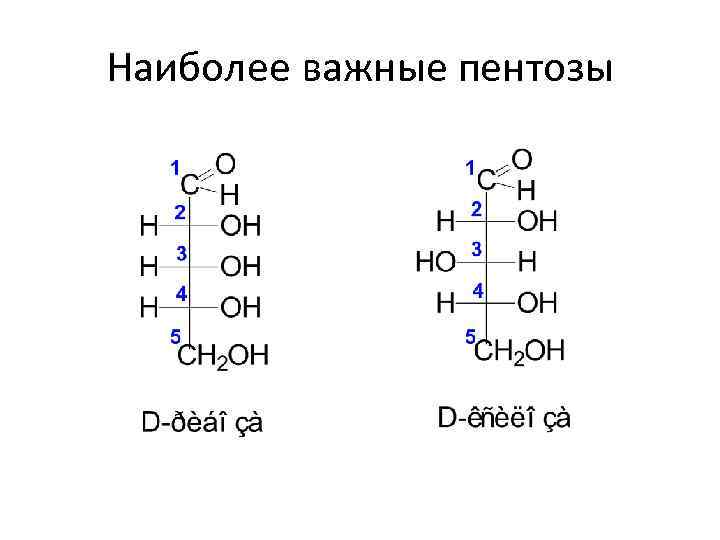
Наиболее важные пентозы
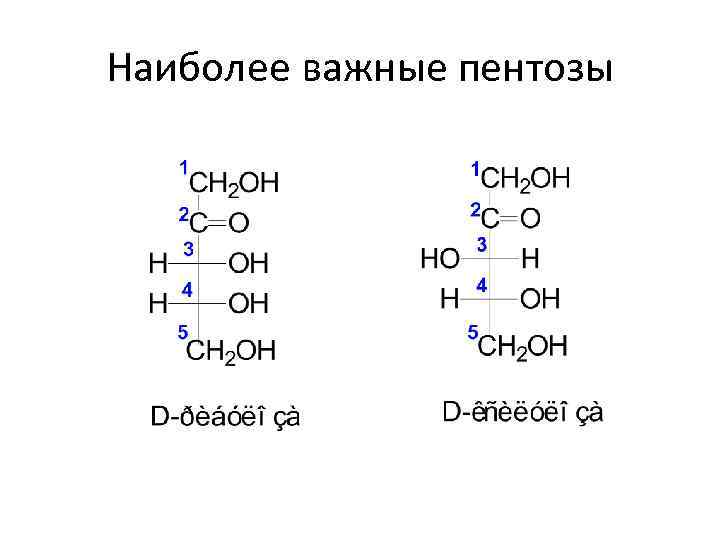
Наиболее важные пентозы

Циклические формы - по химической природе являются циклическими полуацеталями. Моносахариды за счет внутримолекулярного взаимодействия сближенных в пространстве карбонильной и гидроксильной групп, образуют устойчивые фуранозные (пятичленные) или пиранозные (шестичленные) циклы.
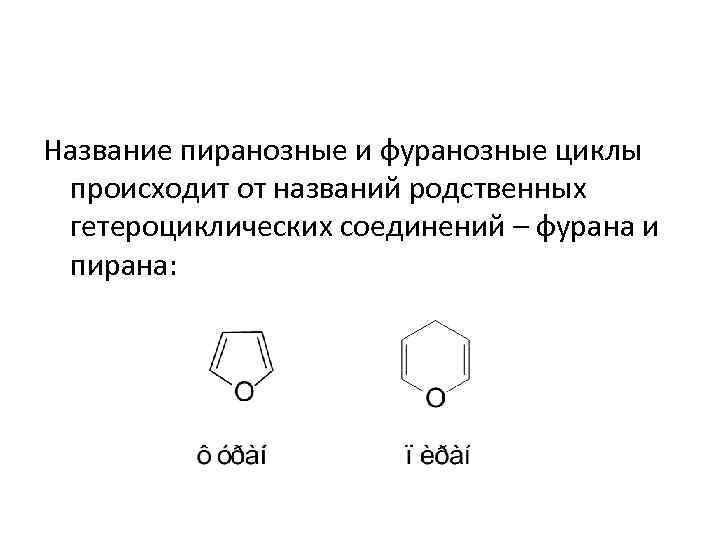
Название пиранозные и фуранозные циклы происходит от названий родственных гетероциклических соединений – фурана и пирана:
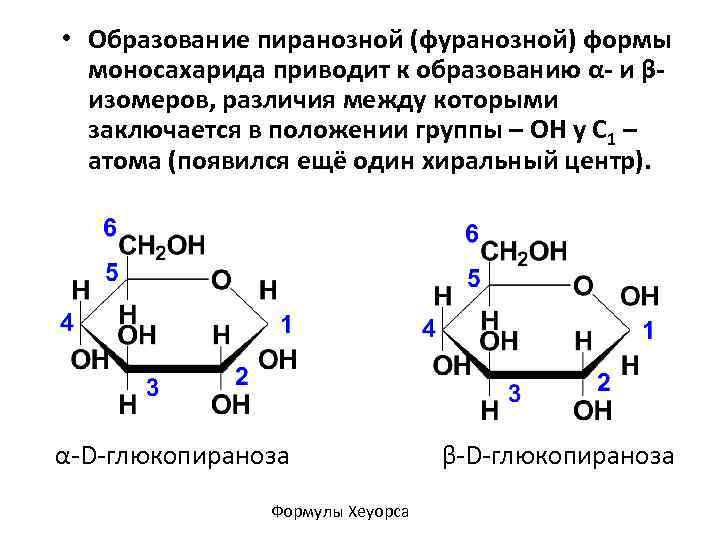
• Образование пиранозной (фуранозной) формы моносахарида приводит к образованию α- и β- изомеров, различия между которыми заключается в положении группы – ОН у С 1 – атома (появился ещё один хиральный центр). α-D-глюкопираноза Формулы Хеуорса β-D-глюкопираноза

• Появившаяся дополнительная гидроксильная группа, связанная с С 1 – атомом, называется гликозидной (полуацетальной). По свойствам она значительно отличается от спиртовых (гликозных) гидроксильных групп моносахарида.

• В растворах сахаров при стоянии наблюдается изменение угла отклонения плоскости поляризованного света, т. е. изменение оптической активности – мутаротация. • Объясняется установлением равновесия между циклической и нециклической формами , а также между α- и β- формами. После установления равновесия угол отклонения ППС принимает определённое значение.

ХИМИЧЕСКИЕ СВОЙСТВА МОНОСАХАРИДОВ • I. Химические реакции с участием гидроксильных групп. I. 1. Полуацетальный гидроксил непрочно связан с атомом углерода и может достаточно легко вступать во взаимодействие со спиртами, фенолами, карбоновыми кислотами, аминами и т. д. (как правило, в условиях кислотного катализа)
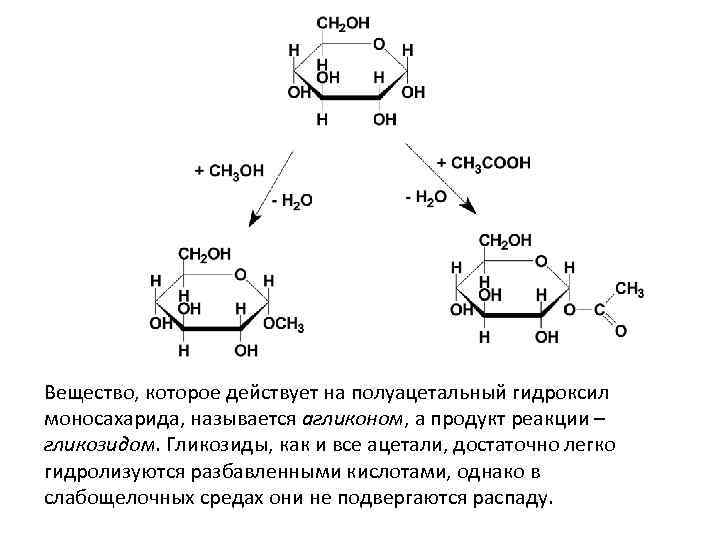
Вещество, которое действует на полуацетальный гидроксил моносахарида, называется агликоном, а продукт реакции – гликозидом. Гликозиды, как и все ацетали, достаточно легко гидролизуются разбавленными кислотами, однако в слабощелочных средах они не подвергаются распаду.

I. 2. При определённых условиях в реакцию вступает не только полуацетальный гидроксил, но и имеющиеся в молекуле спиртовые гидроксильные группы.
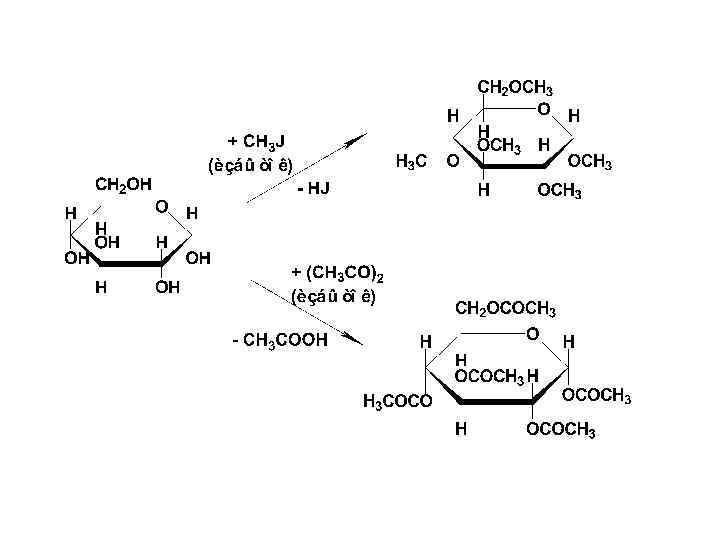
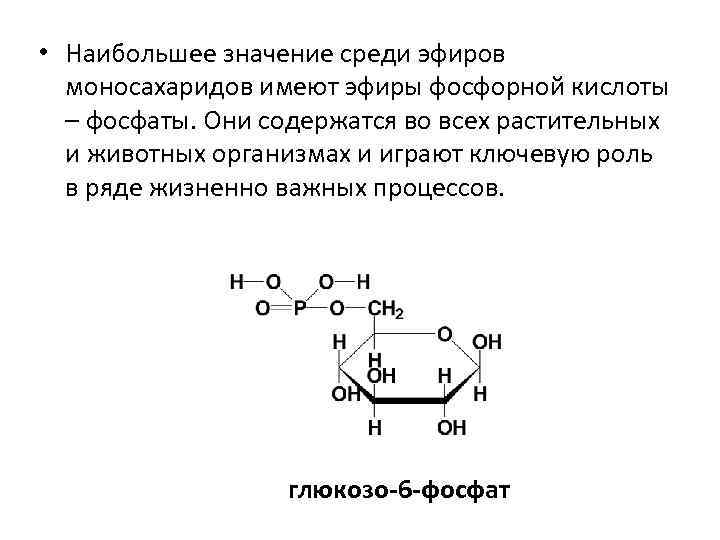
• Наибольшее значение среди эфиров моносахаридов имеют эфиры фосфорной кислоты – фосфаты. Они содержатся во всех растительных и животных организмах и играют ключевую роль в ряде жизненно важных процессов. глюкозо-6 -фосфат
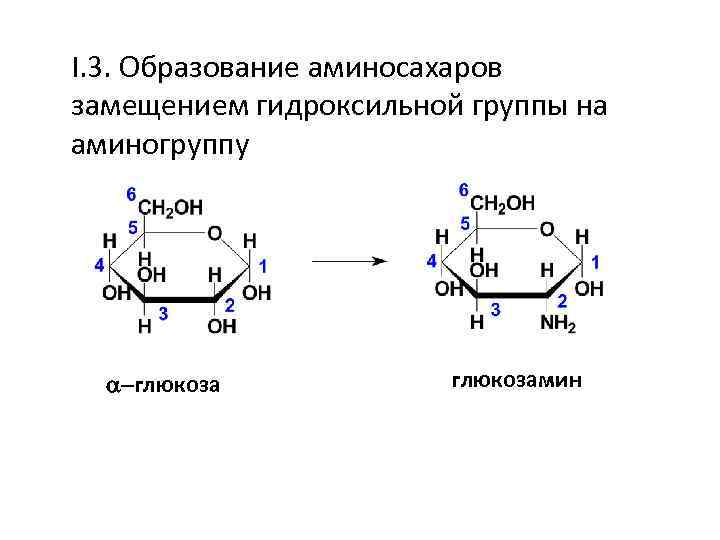
I. 3. Образование аминосахаров замещением гидроксильной группы на аминогруппу -глюкозамин
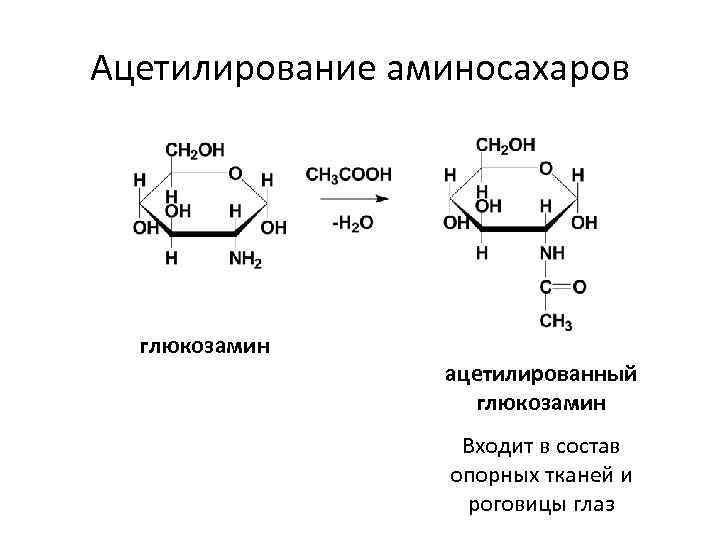
Ацетилирование аминосахаров глюкозамин ацетилированный глюкозамин Входит в состав опорных тканей и роговицы глаз
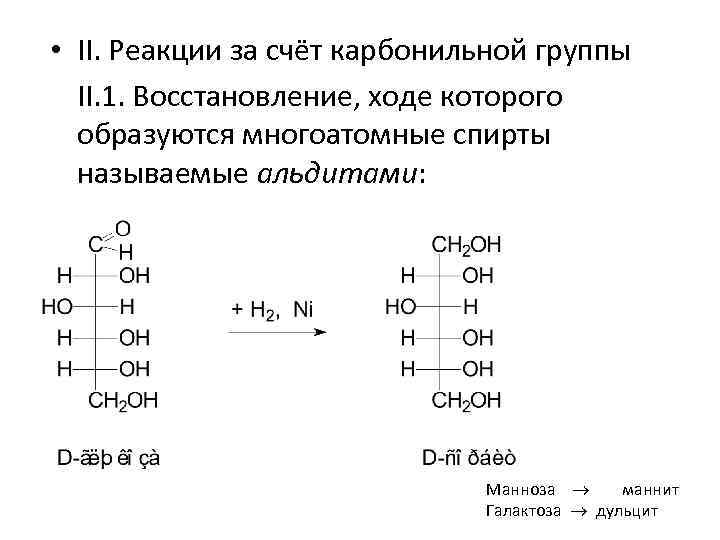
• II. Реакции за счёт карбонильной группы II. 1. Восстановление, ходе которого образуются многоатомные спирты называемые альдитами: Манноза маннит Галактоза дульцит

II. 2. Окисление - важная реакция в химии углеводов. Его используют для получения ряда соединений в структурных исследованиях и биохимических анализах. В зависимости от условий окисления моносахаридов образуются различные продукты. В щелочной среде окисление сопровождается разрушением углеродной цепи молекулы (реакция ”серебряного зеркала”). Окисление в нейтральной среде позволяет сохранить углеродный скелет.
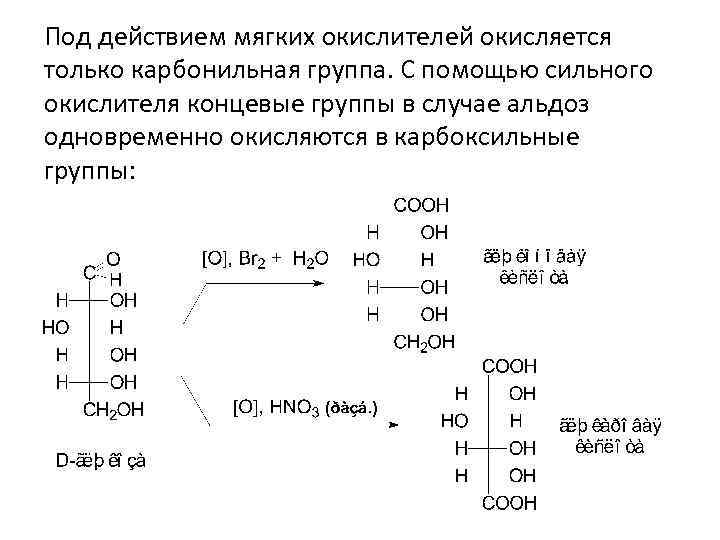
Под действием мягких окислителей окисляется только карбонильная группа. С помощью сильного окислителя концевые группы в случае альдоз одновременно окисляются в карбоксильные группы:
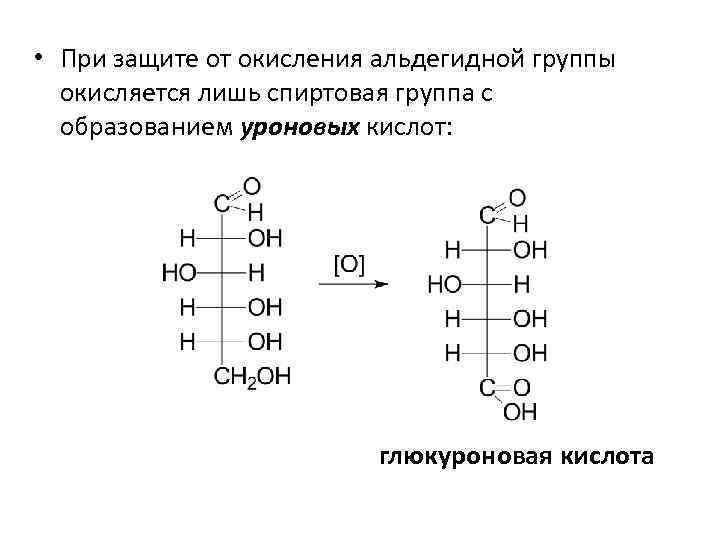
• При защите от окисления альдегидной группы окисляется лишь спиртовая группа с образованием уроновых кислот: глюкуроновая кислота

СЛОЖНЫЕ УГЛЕВОДЫ

Олигосахариды классифицируют: • в зависимости от числа моносахаридных фрагментов, входящих в олигосахарид (дисахариды, трисахариды, тетрасахариды и т. д. ); • по составу моносахаридных остатков (гомоолигосахариды, гетероолигосахариды); • в зависимости от порядка соединения мономеров (линейные, разветвленные); • на восстанавливающие и невосстанавливающие

• Из олигосахаридов в природе наиболее широко распространены дисахариды. Дисахариды - О-гликозиды (полные ацетали) С гликозидной природой связана способность дисахаридов гидролизоваться в кислой (но не в щелочной) среде с образованием моносахаридов. C 12 H 22 O 11 мальтоза + H 2 O D-глюкоза + D-глюкоза целлобиоза + H 2 O D-глюкоза + D-глюкоза лактоза + H 2 O D-глюкоза + D-галактоза сахароза + H 2 O D-глюкоза + D-фруктоза

• У восстанавливающих дисахаридов связь между моносахаридными остатками осуществляется за счет спиртового и полуацетального гидроксилов. При этом один из моносахаридных остатков сохраняет свободный полуацетальный гидроксил, который определяет восстанавливающие свойства и реакции, свойственные моносахаридам (сохраняется способность к раскрытию цикла).

• У невосстанавливающих дисахаридов гликозидная связь образована за счет полуацетальных гидроксилов обоих моносахаридов. Они не содержат свободного полуацетального гидроксила и не вступают в реакции, характерные для карбонильной группы.

• Представители восстанавливающих дисахаридов: - мальтоза, - целлобиоза, - лактоза

• Мальтоза (солодовый сахар) является основным продуктом расщепления крахмала под действием фермента β-амилазы, выделяемого слюнной железой. В мальтозе остатки двух молекул D-глюкопиранозы связаны α(1→ 4)-гликозидной связью.
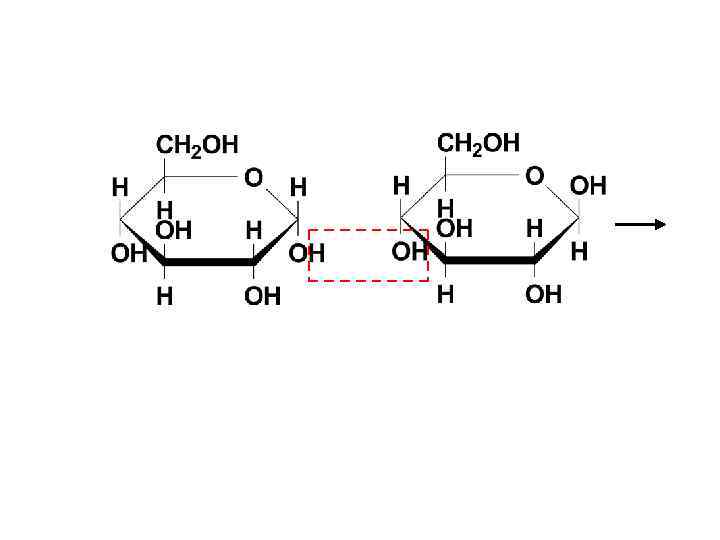
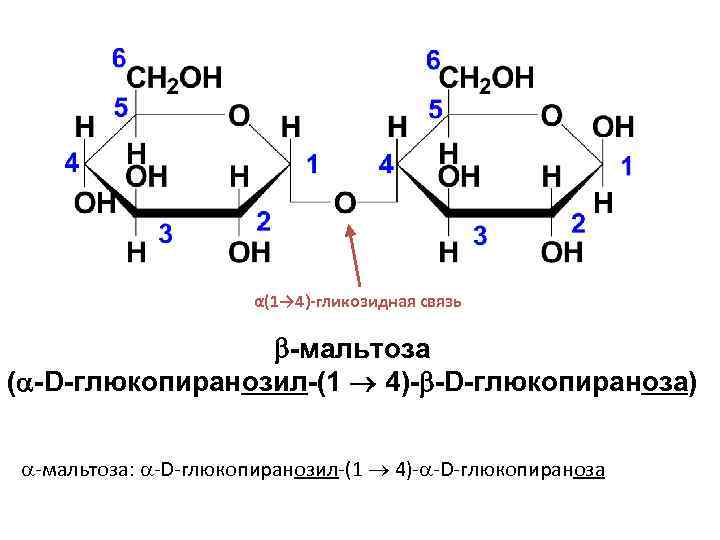
α(1→ 4)-гликозидная связь -мальтоза ( -D-глюкопиранозил-(1 4)- -D-глюкопираноза) -мальтоза: -D-глюкопиранозил-(1 4)- -D-глюкопираноза
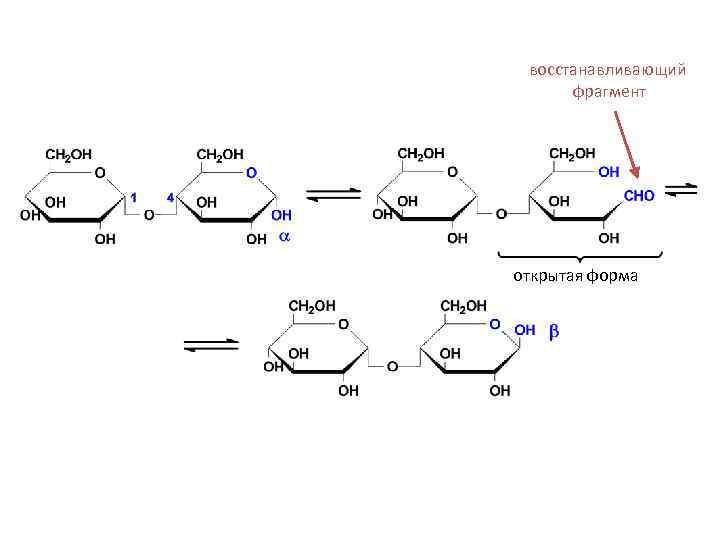
восстанавливающий фрагмент открытая форма

• Целлобиоза образуется при неполном гидролизе полисахарида целлюлозы. Она также построена из двух молекул глюкозы, но отличается от мальтозы тем, что в одной из молекул, образующих димер, в реакцию вступает полуацетальный гидроксил β-пиранозной формы. Т. о. , в целлобиозе остатки двух молекул D- глюкопиранозы связаны β(1→ 4)гликозидной связью.
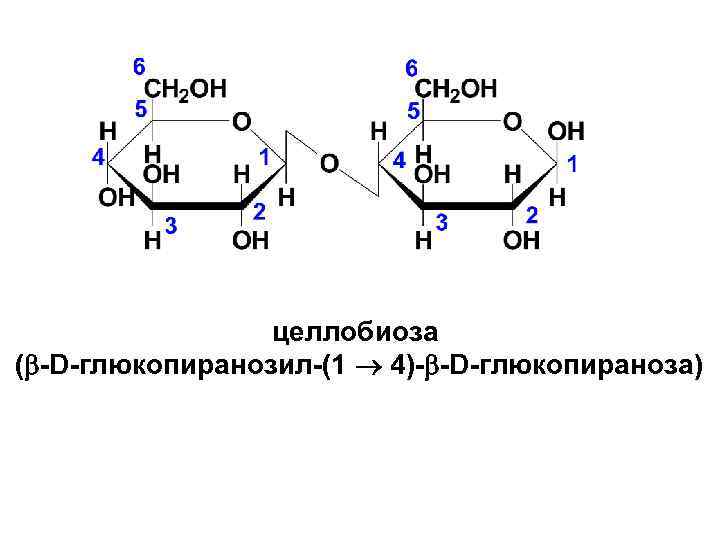
целлобиоза ( -D-глюкопиранозил-(1 4)- -D-глюкопираноза)

• мальтоза расщепляется в организме человека ферментом α-глюкозидазой (мальтазой) • целлобиоза расщепляется ферментом βглюкозидазой, который в организме человека отсутствует

• Лактоза содержится в молоке (4 -5%), получают из молочной сыворотки (молочный сахар). Лактоза построена из остатков D-галактопиранозы и D-глюкопиранозы, связанных -(1 4)-гликозидной связью.
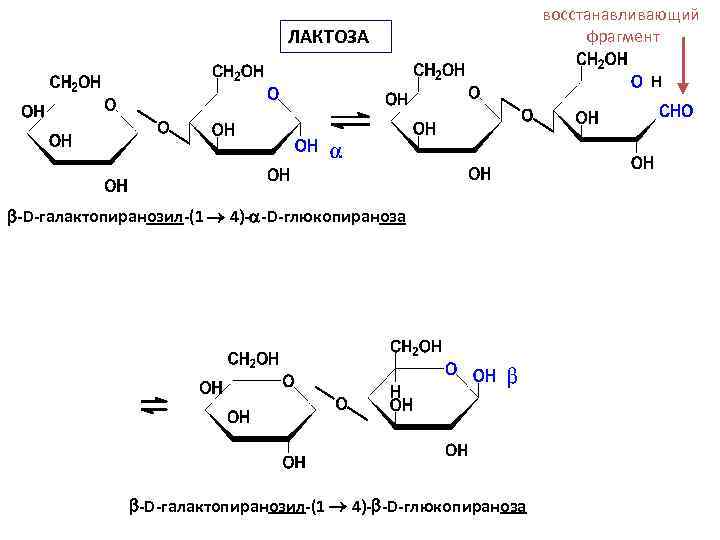
ЛАКТОЗА восстанавливающий фрагмент Н -D-галактопиранозил-(1 4)- -D-глюкопираноза

• Лактоза применяется - в фармацевтике при изготовлении порошков и таблеток (менее гигроскопична, чем сахар) - питательное средство для грудных детей (в женском молоке до 8 процентов)
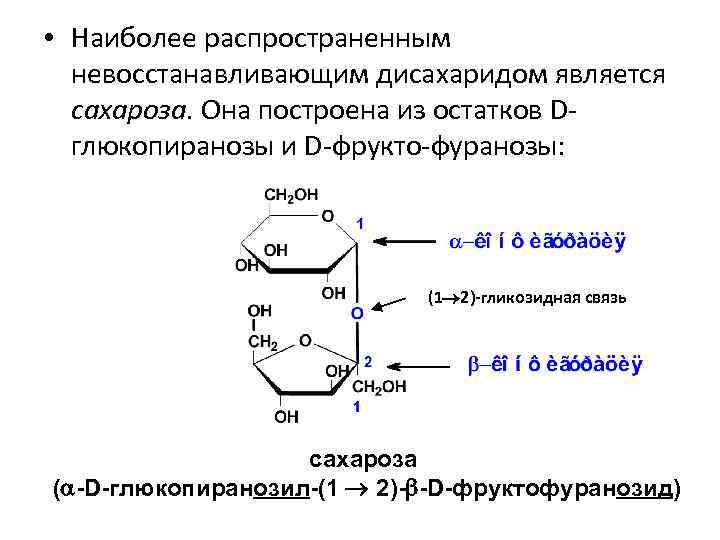
• Наиболее распространенным невосстанавливающим дисахаридом является сахароза. Она построена из остатков Dглюкопиранозы и D-фрукто-фуранозы: (1 2)-гликозидная связь сахароза ( -D-глюкопиранозил-(1 2)- -D-фруктофуранозид)
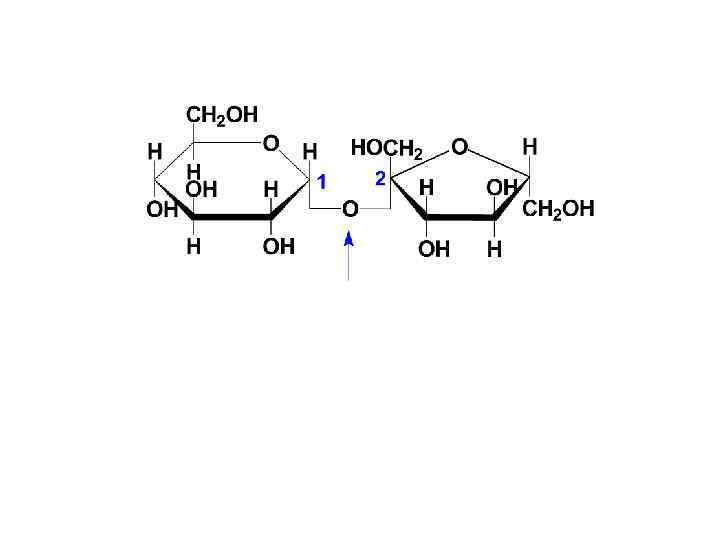

Химические свойства дисахаридов • I. ВСЕ: 1) подвергаются гидролизу (под действием ферментов, в кислой среде) 2) образуют эфиры с минеральными и органическими кислотами 3) образуют соли с гидроксидом меди (сахараты)

• II. Только ВОССТАНАВЛИВАЮЩИЕ: 1) обладают мутаротацией 2) проявляют восстановительные свойства: а) окисляются в гликобионовые кислоты
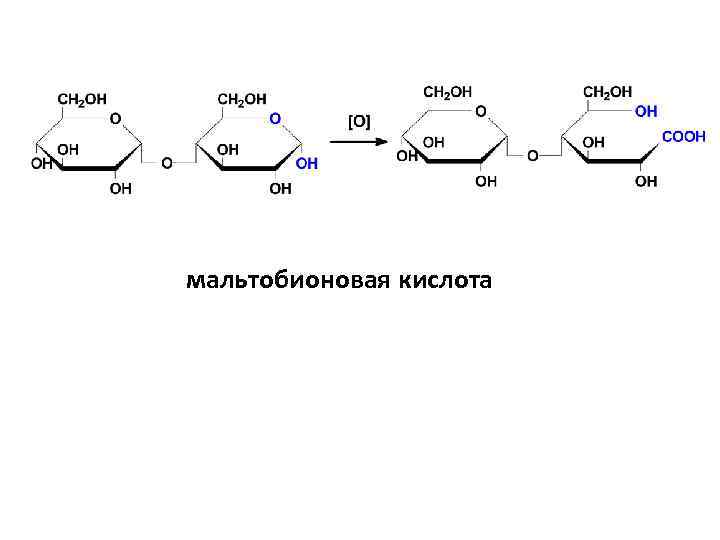
мальтобионовая кислота

• NB! Пробы Троммера, Фелинга и др. 3) реакции альдегидной группы

В отличие от большинства дисахаридов сахароза не имеет свободного полуацетального гидроксила и, как следствие, не обладает восстанавливающими свойствами.

Полисахариды • Полисахариды представляют собой продукты поликонденсации моносахаридов, которые связаны друг с другом гликозидными связями. Таким образом, по химической природе они являются полигликозидами (полиацеталями). В полисахаридах растительного происхождения в основном присутствуют (1→ 4)- и (1→ 6)гликозидные связи, а в полисахаридах животного и бактериального происхождения дополнительно имеются (1→ 3)- и (1→ 2)-гликозидные связи.

• Гликозидная природа полисахаридов обусловливает их способность к гидролизу в кислой среде. Полный гидролиз приводит к образованию моносахаридов и их производных, а неполный к образованию олигосахаридов, в том числе дисахаридов. В щелочной среде полисахариды обладают высокой устойчивостью и не подвергаются распаду.

• Крахмал (резервный гомополисахарид растений) представляет собой белое аморфное вещество, нерастворимое в холодной воде. При быстром нагревании крахмала за счет содержания в нем влаги происходит гидролитическое расщепление полимерной цепи на более мелкие осколки, называемые декстринами. Декстрины растворяются в воде лучше, чем крахмал. • Крахмал представляет собой смесь двух полимеров, построенных из D-глюкопиранозных остатков – амилозы (10 -20%) и амилопектина (80 -90%).

• В амилозе D-глюкопиранозные остатки связаны α-(1→ 4)-гликозидными связями, т. е. дисахаридным фрагментом амилозы является мальтоза. Цепь амилозы неразветвленная. Она включает 200 -1000 глюкозидных остатков. Макромолекула амилозы свернута в спираль. При этом на каждый виток спирали приходится шесть моносахаридных звеньев.
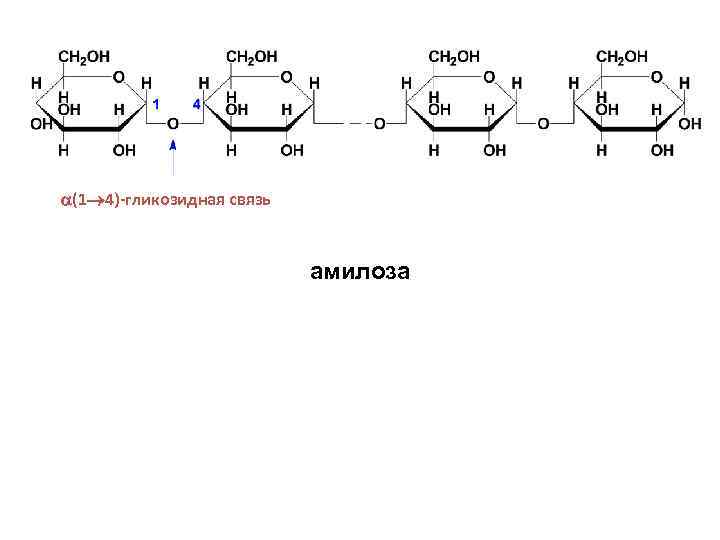
(1 4)-гликозидная связь амилоза

• Амилопектин отличается от амилозы высокоразветвленным строением. В линейных участках этого полисахарида Dглюкопиранозные остатки связаны α-(1→ 4)гликозидными связями, а в точках разветвления имеются дополнительные α(1→ 6)-гликозидные связи. Между точками разветвления располагаются 20 -25 остатков глюкозы.
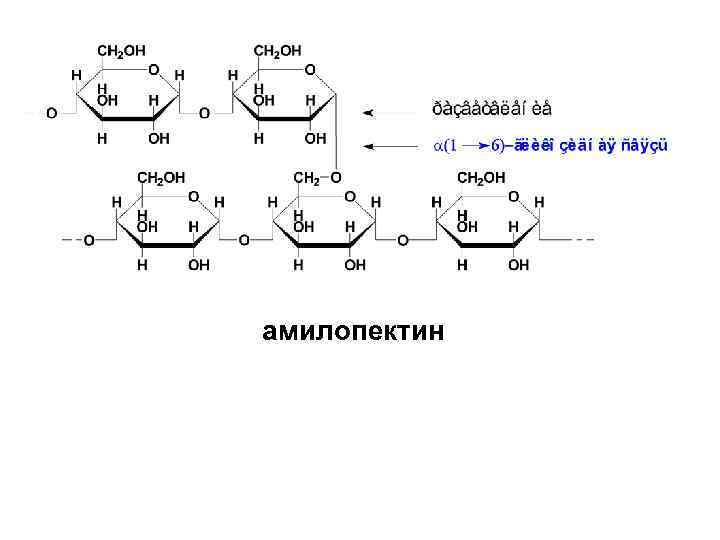
амилопектин

• Гликоген (резевный гомополисахарид животных организмов) является структурным и функциональным аналогом крахмала. По строению подобен амилопектину, но отличается от него большей разветвленностью и более жесткой упаковкой молекулы. Сильное разветвление способствует выполнению гликогеном энергетической функции, поскольку при наличии большого числа концевых остатков обеспечивается быстрое отщепление нужного количества глюкозы.

• Целлюлоза или клетчатка представляет собой наиболее распространенный структурный гомополисахарид растений. Она состоит из остатков D-глюкопиранозы, которые связанны β-(1→ 4)-гликозидными связями. Т. о. , дисахаридным фрагментом целлюлозы является целлобиоза. Полимерная цепь целлюлозы не имеет разветвлений. В ней содержится 2500 -12000 остатков глюкозы, что соответствует молекулярной массе от 400000 до 1 -2 млн.

• Макромолекула целлюлозы имеет строго линейное строение. Благодаря этому внутри цепи, а также между соседними цепями образуются водородные связи. Такая упаковка молекулы обеспечивает высокую механическую прочность, нерастворимость в воде и химическую инертность. Целлюлоза не расщепляется в желудочнокишечном тракте, поскольку в организме отсутствует фермент, способный гидролизовать β(1→ 4)-гликозидные связи. Несмотря на это, она является необходимым балластным веществом для нормального питания.
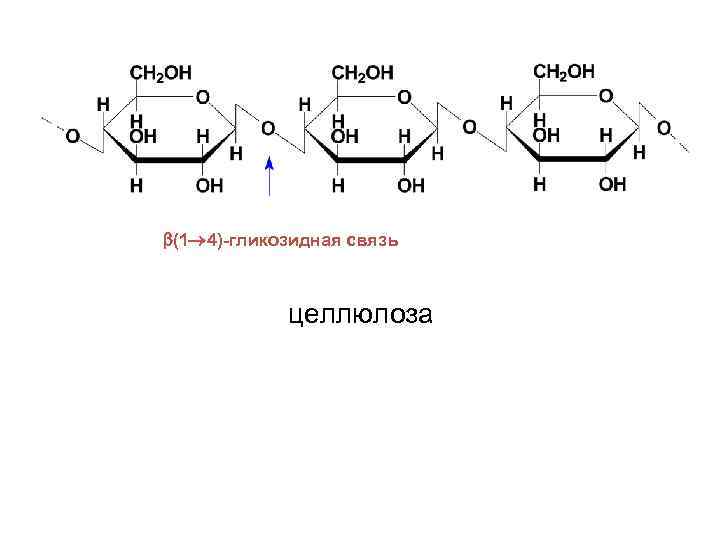
(1 4)-гликозидная связь целлюлоза

• Хитин является структурным гомополисахаридом наружного скелета членистоногих и некоторых других беспозвоночных животных, а также клеточных мембран грибов. хитин Хитин построен из остатков N-ацетил D-глюкозамина, связанных между собой α(1→ 4)-гликозидными связями. Макромолекула хитина не имеет разветвлений, а его пространственная упаковка подобна целлюлозе.
Презентация липиды гфц сахара.ppt