233d1d0c74cc8f7fc9306dcf14a2afa7.ppt
- Количество слайдов: 126

Les bactéries de l’extrême Bernard OLLIVIER, Jean-Louis GARCIA, Jean-Luc CAYOL et Pierre ROGER IRD-Marseille

• La planète terre existe depuis environ 4. 5 milliards d ’années
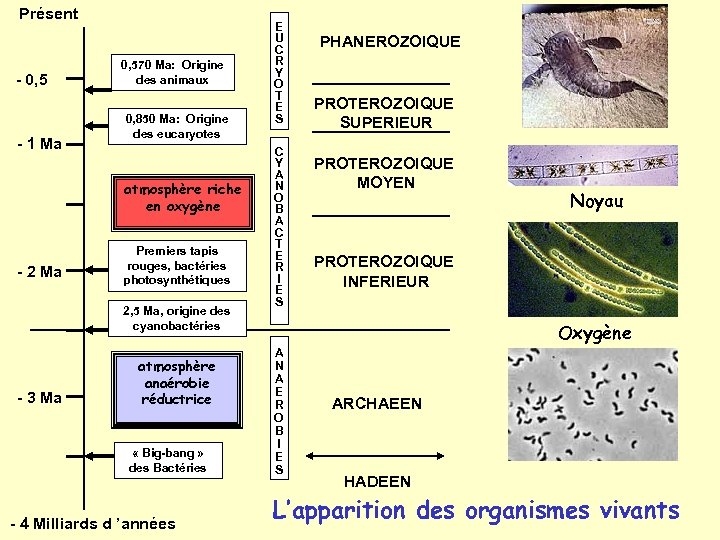
Présent - 0, 5 - 1 Ma 0, 570 Ma: Origine des animaux 0, 850 Ma: Origine des eucaryotes atmosphère riche en oxygène - 2 Ma Premiers tapis rouges, bactéries photosynthétiques 2, 5 Ma, origine des cyanobactéries - 3 Ma atmosphère anaérobie réductrice « Big-bang » des Bactéries 4 Ma - 4 Milliards d ’années E U C R Y O T E S C Y A N O B A C T E R I E S PHANEROZOIQUE PROTEROZOIQUE SUPERIEUR PROTEROZOIQUE MOYEN Noyau PROTEROZOIQUE INFERIEUR Oxygène A N A E R O B I E S ARCHAEEN HADEEN L’apparition des organismes vivants
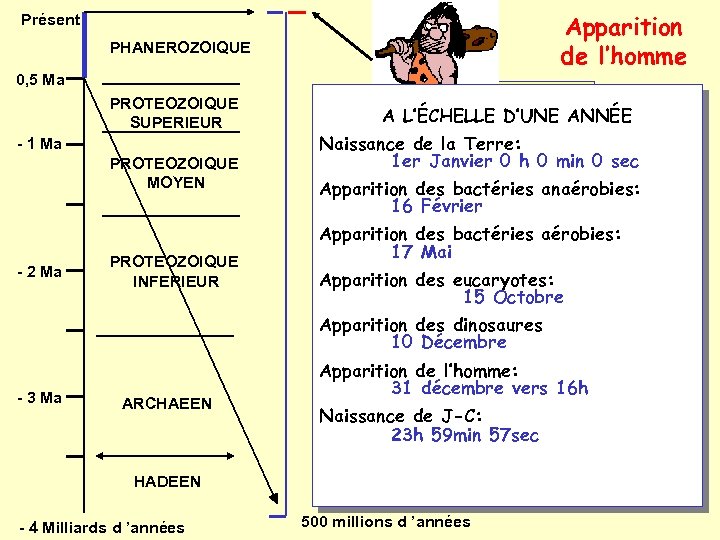
Apparition de l’homme Présent PHANEROZOIQUE 0, 5 Ma PROTEOZOIQUE SUPERIEUR - 1 Ma PROTEOZOIQUE MOYEN - 2 Ma PROTEOZOIQUE INFERIEUR Trop récent pour A L’ÉCHELLE D’UNE ANNÉE être visible sur Naissance de la Terre: cette échelle 0 min 0 sec 1 er Janvier 0 h Apparition des bactéries anaérobies: 16 Février Apparition des bactéries aérobies: 17 Mai Apparition des eucaryotes: 15 Octobre Apparition des dinosaures 10 Décembre - 3 Ma ARCHAEEN Apparition de l’homme: 31 décembre vers 16 h Naissance de J-C: 23 h 59 min 57 sec HADEEN - 4 Milliards d ’années 500 millions d ’années

• Les premiers systèmes biologiques sont apparus entre -3, 5 et -4 milliards d ’années • Passage de la chimie à la biochimie en 500 millions d ’années • Les conditions d ’environnement ont trés significativement changé au cours de cette période.

Les condition d’apparition de la vie • Avant: – Absence d ’oxygène et conditions réductrices – Températures élevées – Rayonnement UV important – Couverture aqueuse importante • Après: – Présence d ’oxygène – Refroidissement du globe – Protection contre les UV par la couche d ’ozone – Formation des continents
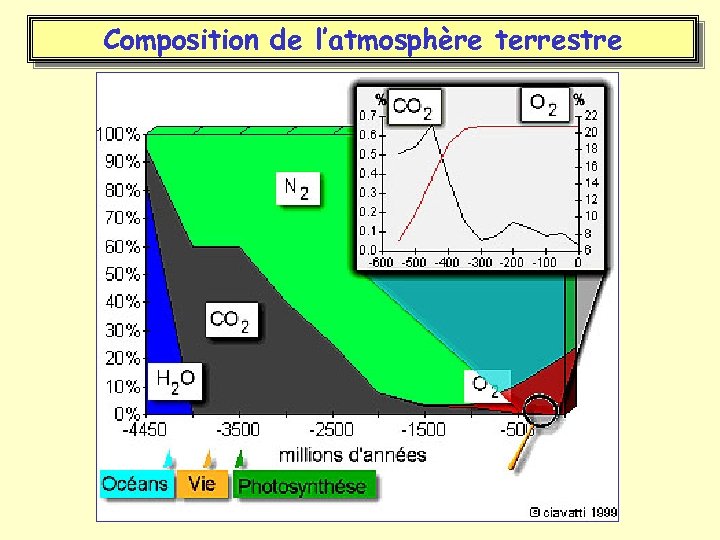
Composition de l’atmosphère terrestre

Les conditions d’apparition de la vie • Les premiers organismes apparus (bactéries) ont dû se protéger des rayons UV et de composés toxiques (cyanides et sulfures) • La vie s’est d’abord développée en milieu aqueux salé ou dulçaquicole • En particulier dans environnements salés (ou hypersalés ? ), profonds, chauds qui sont actuellement considérés comme des environnements extrêmes.

Les bactéries extrêmophiles • • Acidophiles: Alcalophiles: Thermophiles: Hyperthermophiles: Psychrophiles : Halophiles: Hyperhalophiles: Barophiles: p. H 2 - 6 p. H 8 - 11 60 - 70 °C 80 - 100°C 5 - 20°C 1 - 35 g/l Na. Cl 150 - 300 g/l Na. Cl P > 1 atm

Définition de l’extrêmophilie

• Les microorganismes des environnements extrêmes actuels peuvent être considérés comme les descendants des premiers microorganismes apparus sur terre. • En effet, les branches les plus basses de l ’arbre phylogénétique de la vie sont constituées par des procaryotes (Bacteria et Archaea) essentiellement extrêmophiles (thermophiles, hyperthermophiles) et anaérobies.
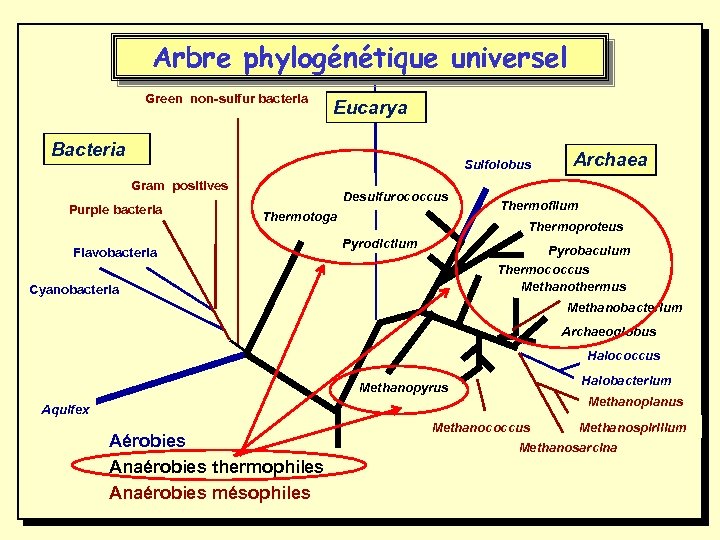
Arbre phylogénétique universel Green non-sulfur bacteria Eucarya Bacteria Sulfolobus Gram positives Purple bacteria Desulfurococcus Thermotoga Flavobacteria Archaea Thermofilum Thermoproteus Pyrodictium Pyrobaculum Thermococcus Methanothermus Cyanobacteria Methanobacterium Archaeoglobus Halococcus Halobacterium Methanopyrus Methanoplanus Aquifex Aérobies Anaérobies thermophiles Anaérobies mésophiles Methanococcus Methanospirillum Methanosarcina

Méthodes d’étude des microorganismes extrêmophiles • • Halophiles -> Composition du milieu Thermophiles -> Température d ’incubation Acidophiles Alcalinophiles -> p. H du milieu Hyperbares -> Dispositifs d ’incubation sous pression • Aérobies -> Méthodes classique • Anaérobies -> Méthodes spécifiques

Les méthodes de l’anaérobiose • Préparation des milieux sous flux d’azote. • Indicateur coloré d’oxydo - réduction (résazurine)

Les méthodes de l’anaérobiose • Transferts avec des seringues purgées à l’azote. • Stérilisation classique à la flamme
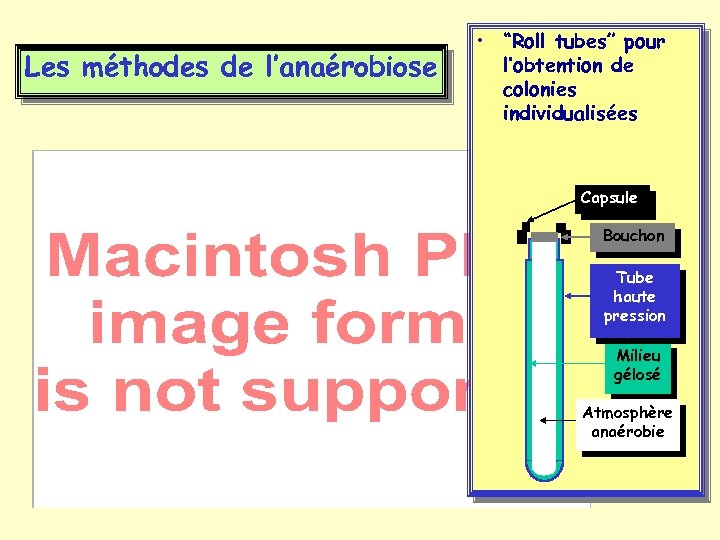
Les méthodes de l’anaérobiose • “Roll tubes” pour l’obtention de colonies individualisées Capsule Bouchon Tube haute pression Milieu gélosé Atmosphère anaérobie

Les méthodes de l’anaérobiose • Les échantillons sont manipulés dans une enceinte anaérobie

Dilutions

Les environnements extrêmes • Les écosystèmes extrêmes halophiles – Lacs salés • Great Salt Lake (USA) • Lac Retba (Lac rose) (Sénégal) – Marais salants. Chots • Les écosystèmes extrêmes thermophiles – Parc de Yellowstone (USA) • Les environnements pétroliers • Les sources hydrothermales profondes

Les environnements hypersalés
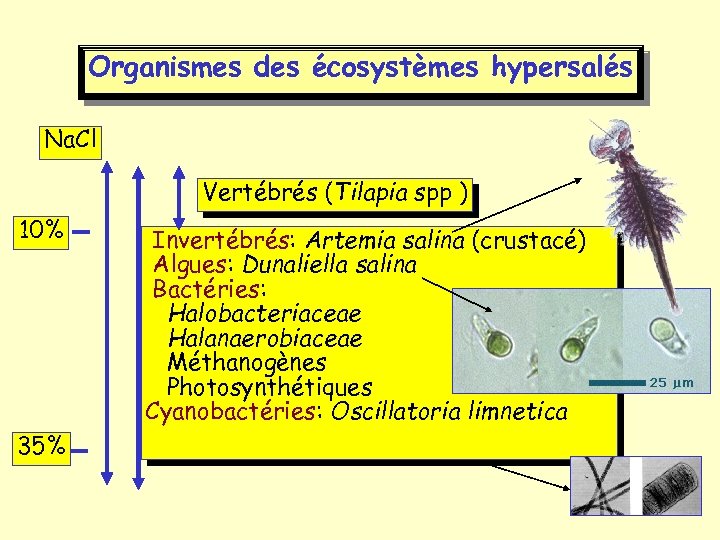
Organismes des écosystèmes hypersalés Na. Cl Vertébrés (Tilapia spp ) 10% 35% Invertébrés: Artemia salina (crustacé) Algues: Dunaliella salina Bactéries: Halobacteriaceae Halanaerobiaceae Méthanogènes Photosynthétiques Cyanobactéries: Oscillatoria limnetica

Caractéristiques d’écosystèmes hypersalés • Big Soda, Mono, Soap Lakes (Ouest USA) p. H 9 -10, salinité 89 -100 g/l, sulfates 21 g/l (Soap Lake) • Grand Lac Salé (USA) p. H 7, salinité 200 g/l, sulfates 2, 7 g/l, Na+ 105 g/l, Cl- 181 g/l • Mer Morte (Israel) p. H 7, salinité > 20%, Cl 225 g/l, Na+ 40 g/l, Mg++ 44 g/l, Ca++ 17 g/l, sulfates 0, 5 g/l • Lac Retba (Sénégal) p. H 7, 2, salinité 20 -35%, Na+ 80 g/l, Mg++ 14 g/l, K+ 8 g/l, Ca++ 2, 5 g/l • Puits pétrolier (France) p. H 6, 8, Na. Cl 87 g/l, Mg. Cl 2 11 g/l, Ca. Cl 2 14 g/l, KCl 0, 2 g/l

Sources de matière organique dans les écosystèmes hypersalés • Cellules et métabolites des organismes autochtones • Parois des cyanobactéries et des Halobacteriaceae: sucres, protéines et lipides • Osmolytes microbiens: glycine-bétaïne, -glutamine, N acétyl- -lysine, -glucosylglycérate (bactéries), ectoïne (Ectothiorhodospira )saccharose et tréhalose (cyanobactéries), glycérol (Dunaliella) • Chitine des invertébrés • Sources exogènes
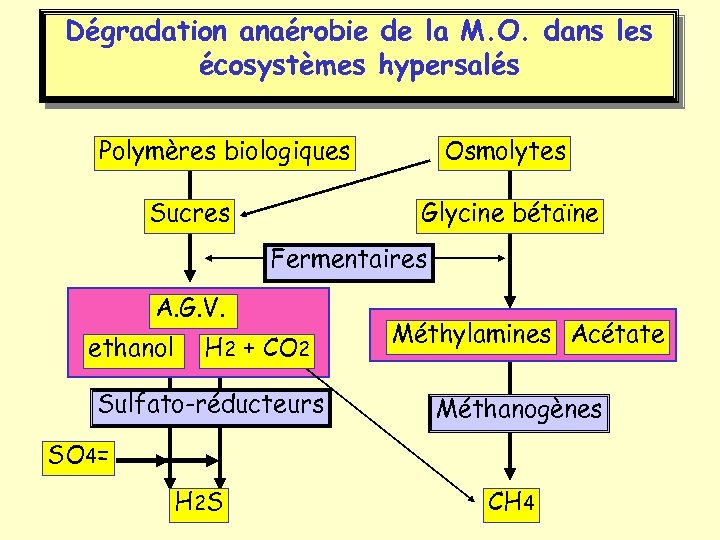
Dégradation anaérobie de la M. O. dans les écosystèmes hypersalés Polymères biologiques Sucres Osmolytes Glycine bétaïne Fermentaires A. G. V. ethanol H 2 + CO 2 Sulfato-réducteurs Méthylamines Acétate Méthanogènes SO 4= H 2 S CH 4

La biodiversité des bactéries des environnements hypersalés

Exigence en sel des bactéries halophiles Halophiles faibles Croissance optimum (% Na. Cl) (M) 2 -5 0, 34 - 0, 85 Halophiles modérées 5 - 20 0, 85 - 3, 40 Halophiles extrêmes 20 - 30 3, 40 - 5, 10
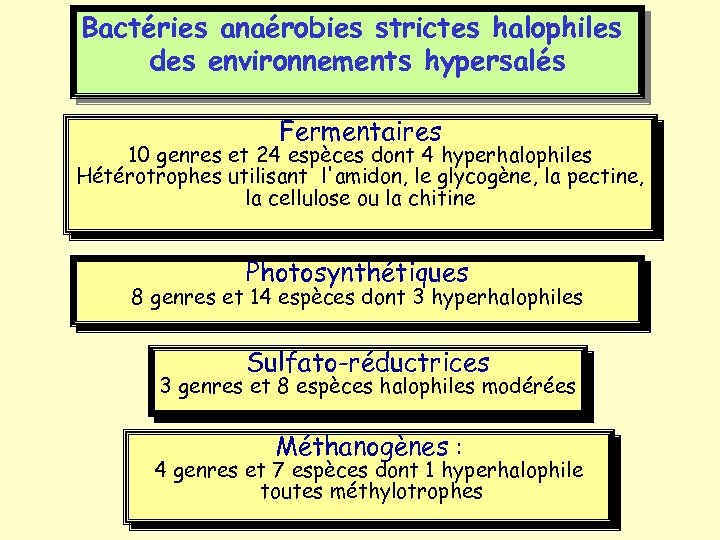
Bactéries anaérobies strictes halophiles des environnements hypersalés Fermentaires 10 genres et 24 espèces dont 4 hyperhalophiles Hétérotrophes utilisant l'amidon, le glycogène, la pectine, la cellulose ou la chitine Photosynthétiques 8 genres et 14 espèces dont 3 hyperhalophiles Sulfato-réductrices 3 genres et 8 espèces halophiles modérées Méthanogènes : 4 genres et 7 espèces dont 1 hyperhalophile toutes méthylotrophes

Bactéries fermentaires halophiles Halanaerobiales Na. Cl % min - max optimum Halanaerobium acetoethylicum 6 - 20 10 alcaliphilum 2, 5 - 25 10 congolense 4 - 24 10 kushneri 9 - 18 12 lacusrosei 6 - 34 20 praevalens 2 - 30 12, 5 saccharolyticum 3 - 30 7, 5 - 12, 5 salsuginis 6 - 24 9 Halothermothrix orenii 4 - 20 5 - 10 Halocella cellulolytica 5 - 20 15 Halanaerobacter chitinovorans 3 - 30 12 - 18 salinarius 5 - 30 14 - 15 Halobacteroides halobius 8 - 30 9 - 15 elegans 10 - 30 10 - 15 lacunaris 5 - 30 15 - 18

Bactéries fermentaires halophiles min - max Halanaerobiales (suite) optimum Na. Cl % Sporohalobacter lortetii 4 - 15 8 Orenia marismortui 3 - 18 3 - 12 salinaria 2 - 25 5 - 10 sivashensis 5 - 25 7 10 Acetohalobium arabaticum 10 - 25 15 - 18 Natrioniella acetigena 10 - 26 12 - 15 Clostridiales Clostridium halophilum 1, 5 - 10 6 Natronoincola histidinovorans 4 - 16 8 - 10 Thermohalobacter berrensis 2 - 15 5
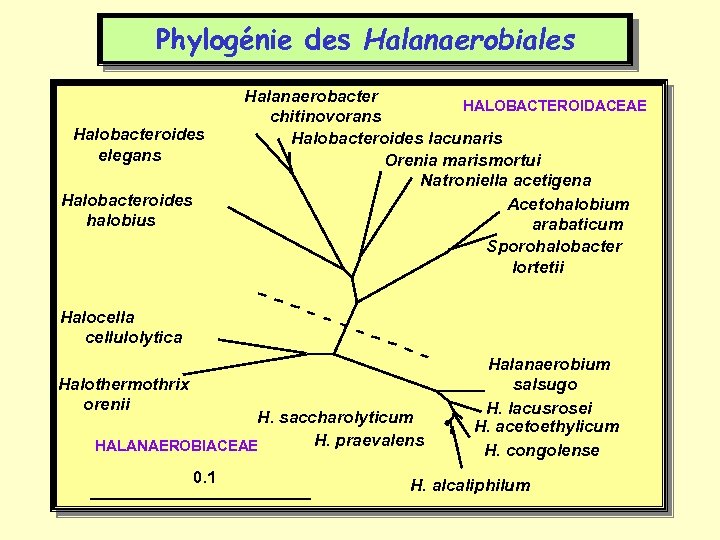
Phylogénie des Halanaerobiales Halobacteroides elegans Halobacteroides halobius Halanaerobacter HALOBACTEROIDACEAE chitinovorans Halobacteroides lacunaris Orenia marismortui Natroniella acetigena Acetohalobium arabaticum Sporohalobacter lortetii Halocella cellulolytica Halothermothrix orenii H. saccharolyticum H. praevalens HALANAEROBIACEAE 0. 1 Halanaerobium salsugo H. lacusrosei H. acetoethylicum H. congolense H. alcaliphilum

Molécules osmorégulatrices des microorganismes halophiles Eucarya : Acides aminés, polyols et sucres (Algues) Glycérol (Dunaliella ) Archaea : Acides aminés, K+, bétaïnes (Méthanogènes) K+, Na+ ( Halobacteriaceae ) Bacteria : Sucres, bétaïnes (Cyanobactéries) Glycine bétaïne (Pseudomonas, Rhizobium, Agrobacterium, Lactobacillus, etc. ) K+, Na+ (Halanaerobiaceae )

Bactéries sulfato-réductrices halophiles Na. Cl % min - max 1 - 17 optimum Desulfovibrio gabonensis 5 -6 halophilus 3 - 18 6 -7 oxyclinae 2, 5 - 22 5 - 10 profundus 0, 2 - 10 0, 6 8 vietnamensis 0 - 10 5 Desulfohalobium retbaense 0 - 24 10 Desulfocella halophila 5 2 - 19 4 -
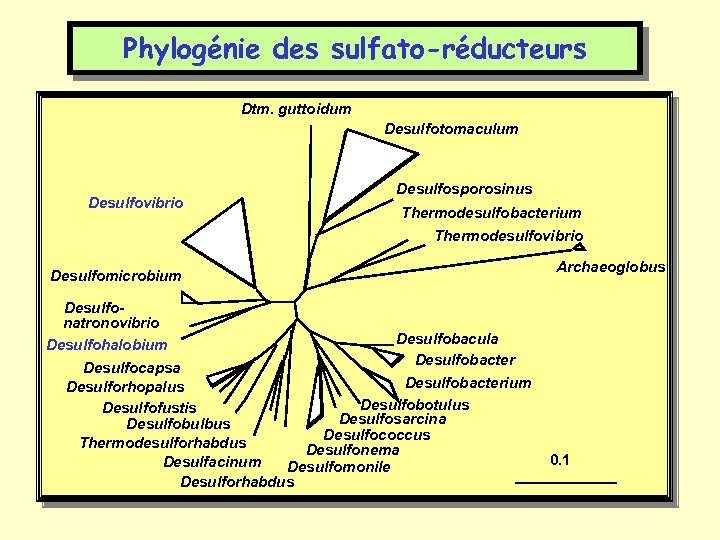
Phylogénie des sulfato-réducteurs Dtm. guttoidum Desulfotomaculum Desulfovibrio Desulfosporosinus Thermodesulfobacterium Thermodesulfovibrio Desulfomicrobium Archaeoglobus Desulfonatronovibrio Desulfobacula Desulfohalobium Desulfobacter Desulfocapsa Desulfobacterium Desulforhopalus Desulfobotulus Desulfofustis Desulfosarcina Desulfobulbus Desulfococcus Thermodesulforhabdus Desulfonema Desulfacinum Desulfomonile Desulforhabdus 0. 1
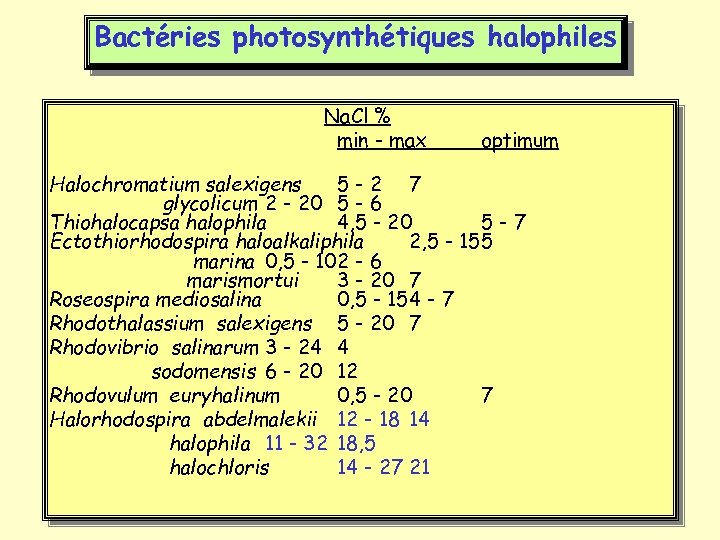
Bactéries photosynthétiques halophiles Na. Cl % min - max optimum Halochromatium salexigens 5 -2 7 glycolicum 2 - 20 5 - 6 Thiohalocapsa halophila 4, 5 - 20 5 -7 Ectothiorhodospira haloalkaliphila 2, 5 - 155 marina 0, 5 - 102 - 6 marismortui 3 - 20 7 Roseospira mediosalina 0, 5 - 154 - 7 Rhodothalassium salexigens 5 - 20 7 Rhodovibrio salinarum 3 - 24 4 sodomensis 6 - 20 12 Rhodovulum euryhalinum 0, 5 - 20 7 Halorhodospira abdelmalekii 12 - 18 14 halophila 11 - 32 18, 5 halochloris 14 - 27 21

Bactéries méthanogènes halophiles Na. Cl % min - max optimum Methanocalculus halotolerans 0 - 12 5 Methanohalophilus euhalobius 1 - 14 6 halophilus 2 - 21 4 -1 mahii 3 - 21 12 portucalensis 7 - 18 12 Methanosalsus zhilinae 1 - 13 4 Methanohalobium evestigatum 15 - 30 25
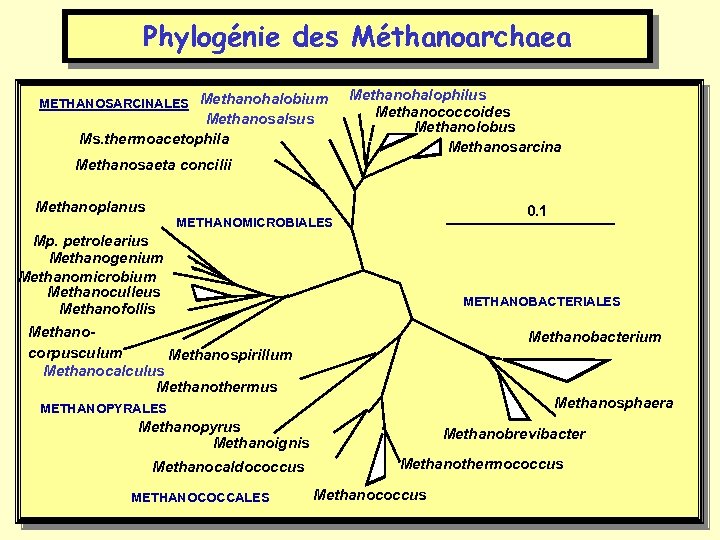
Phylogénie des Méthanoarchaea METHANOSARCINALES Methanohalobium Methanosalsus Ms. thermoacetophila Methanohalophilus Methanococcoides Methanolobus Methanosarcina Methanosaeta concilii Methanoplanus 0. 1 METHANOMICROBIALES Mp. petrolearius Methanogenium Methanomicrobium Methanoculleus Methanofollis Methanocorpusculum Methanospirillum Methanocalculus Methanothermus METHANOBACTERIALES Methanobacterium Methanosphaera METHANOPYRALES Methanopyrus Methanoignis Methanocaldococcus METHANOCOCCALES Methanobrevibacter Methanothermococcus Methanococcus

Archaea aérobies halophiles des environnements hypersalés 16 genres et 50 espèces hyperhalophiles appartenant à: un seul phylum, une seule classe, un seul ordre et une seule famille ! Hétérotrophes utilisant les sucres, les acides aminés, les peptides, l'amidon

Archaea aérobies halophiles des environnements hypersalés (2) Domaine: Archaea, Phylum: Euryarchaeota Classe: Halobacteria, Ordre: Halobacteriales Famille: Halobacteriaceae Genres: Halobacterium, Haloarcula, Halobaculum, Halococcus, Haloferax, Halogeometricum, Halorhabdus, Halorubrum, Haloterrigena, Halosimplex, Natrialba, Natrinema, Natronobacterium, Natronococcus, Natronomonas, Natronorubrum
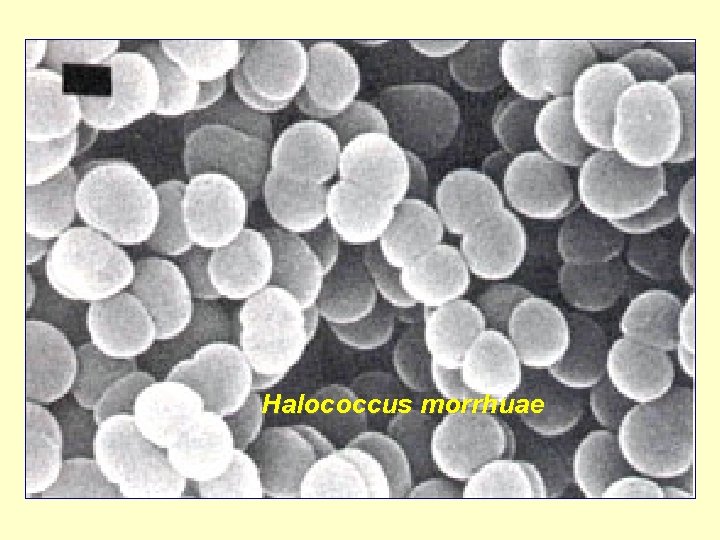
Halococcus morrhuae

Haloferax volcanii
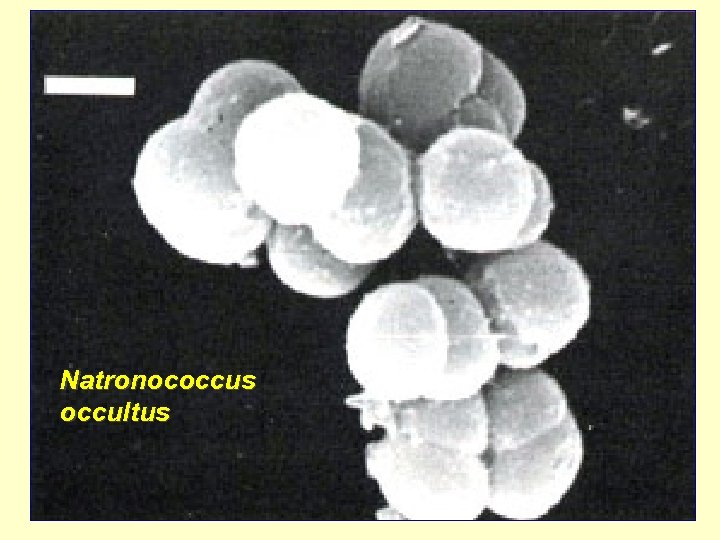
Natronococcus occultus

Les écosystèmes extrêmes halophiles. Exemples du Great Salt Lake (USA) et du lac Retba (lac rose) (sénégal) Montana Idaho Wyoming Utah Great Salt Lake

Great Salt Lake, USA • Vues partielles

Great Salt Lake, USA Caractéristiques principales de l’écosystème • Lac hypersalé ( Na. Cl : 180 g/l en moyenne). • p. H légèrement alcalin. • Faune pratiquement limitée à Artemia qui est exploitée pour l’industrie des cosmétiques et la nourriture des poissons d’aquarium. • Microflore halophile anaérobie comprenant plusieurs espèces originales dont Halanaerobium alcaliphilum, H. praevalens , Methanohalophilus mahii • Microflore halophile aérobie comprenant des espèces des genres Halobacterium, Halococcus et Halorhabdus.

Haloanaerobium alcaliphilum • Isolé de sédiments du Grand Lac Salé, Utah, USA. • Bacille mobile non sporulé, Gram négatif, Halophile modéré et alcalotolérant. • Anaérobie strict, fermente les sucres en acétate, lactate, butyrate, H 2, CO 2. Temp. opt. : 37°C (25 -50°C), p. H opt. : 6, 7 -7 (5, 8 -10), Na. Cl opt. : 10% (2, 5 -25%)
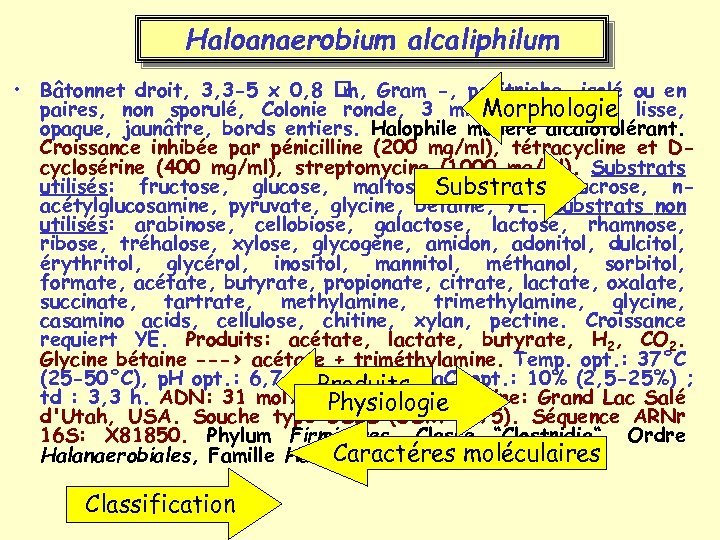
Haloanaerobium alcaliphilum • Bâtonnet droit, 3, 3 -5 x 0, 8 Gram -, peritriche, isolé ou en m, paires, non sporulé, Colonie ronde, 3 mm Morphologie lisse, Ø, convexe, opaque, jaunâtre, bords entiers. Halophile modéré alcalotolérant. Croissance inhibée par pénicilline (200 mg/ml), tétracycline et Dcyclosérine (400 mg/ml), streptomycine (1000 mg/ml). Substrats utilisés: fructose, glucose, maltose, Substrats sucrose, nmannose, acétylglucosamine, pyruvate, glycine, betaine, YE. Substrats non utilisés: arabinose, cellobiose, galactose, rhamnose, ribose, tréhalose, xylose, glycogène, amidon, adonitol, dulcitol, érythritol, glycérol, inositol, mannitol, méthanol, sorbitol, formate, acétate, butyrate, propionate, citrate, lactate, oxalate, succinate, tartrate, methylamine, trimethylamine, glycine, casamino acids, cellulose, chitine, xylan, pectine. Croissance requiert YE. Produits: acétate, lactate, butyrate, H 2, CO 2. Glycine bétaine ---> acétate + triméthylamine. Temp. opt. : 37°C (25 -50°C), p. H opt. : 6, 7 -7 (5, 8 -10), Na. Cl opt. : 10% (2, 5 -25%) ; Produits td : 3, 3 h. ADN: 31 mol% G+C (HPLC). Origine: Grand Lac Salé Physiologie d'Utah, USA. Souche type GSLS (DSM 8275). Séquence ARNr 16 S: X 81850. Phylum Firmicutes, Classe “Clostridia“, Ordre Caractéres Halanaerobiales, Famille Halanaerobiaceae moléculaires Classification

Les écosystèmes extrêmes halophiles. Exemples du Great Salt Lake (usa) et du lac Retba (lac rose) (Sénégal) Montana Idaho Wyoming Utah Great Salt Lake

Vue générale du lac Retba • Dunes à Filaos Lac • Tapis algaire • Zone sableuse • Microbiologistes • Zone à Salicornes

Le lac Retba ou Lac rose (Sénégal) 350 g Cl. Na /L ->belle poussée d’Archimède !

Extraction du sel au lac Retba 1

Extraction du sel au lac Retba 2
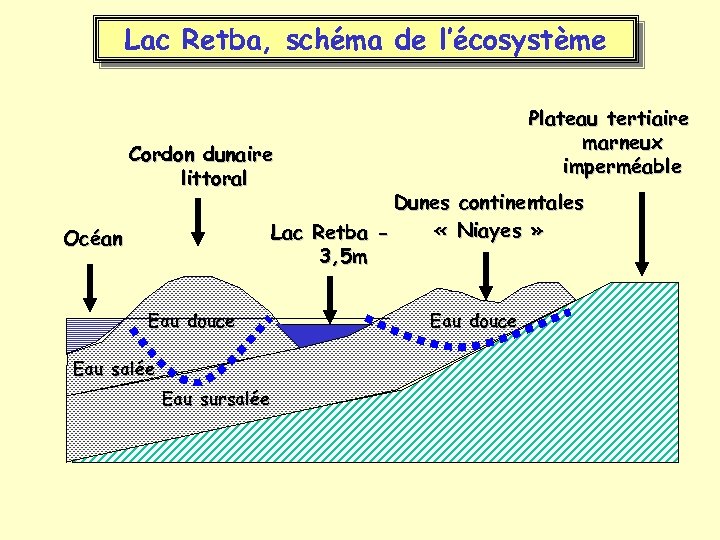
Lac Retba, schéma de l’écosystème Plateau tertiaire marneux imperméable Cordon dunaire littoral Dunes continentales « Niayes » Lac Retba 3, 5 m Océan Eau douce Eau salée Eau sursalée Eau douce

Caractéristiques principales du lac Retba • Lac hypersalé inter-dunaire. • Concentrations en sel variant de 120 à 350 g/l. • Fort gradient de salinité entre le pied de la dune (eau douce) et l ’eau du lac (eau sursalée) • Les apports en matière organique dans le lac sont dûs principalement aux tapis microbiens se développant sur la berge et entrainés par les eaux de ruissellement ou la montée du niveau du lac. • Faune pratiquement limitée à Artemia salina. • Microflore halophile anaérobie comprenant plusieurs espèces originales
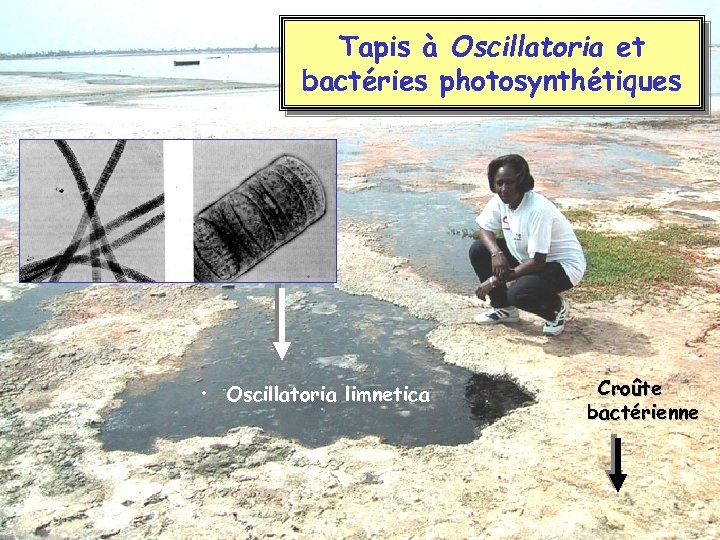
Tapis à Oscillatoria et bactéries photosynthétiques • Oscillatoria limnetica Croûte bactérienne

Coupe de la croûte bactérienne Algues eucaryotes et cyanobactéries + sable Bactéries photosynthétiques pourpres et vertes Sulfato-réduction
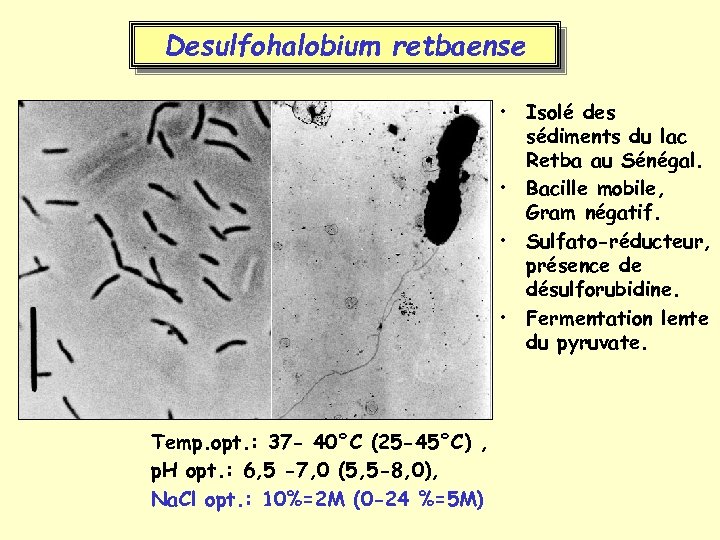
Desulfohalobium retbaense • Isolé des sédiments du lac Retba au Sénégal. • Bacille mobile, Gram négatif. • Sulfato-réducteur, présence de désulforubidine. • Fermentation lente du pyruvate. Temp. opt. : 37 - 40°C (25 -45°C) , p. H opt. : 6, 5 -7, 0 (5, 5 -8, 0), Na. Cl opt. : 10%=2 M (0 -24 %=5 M)
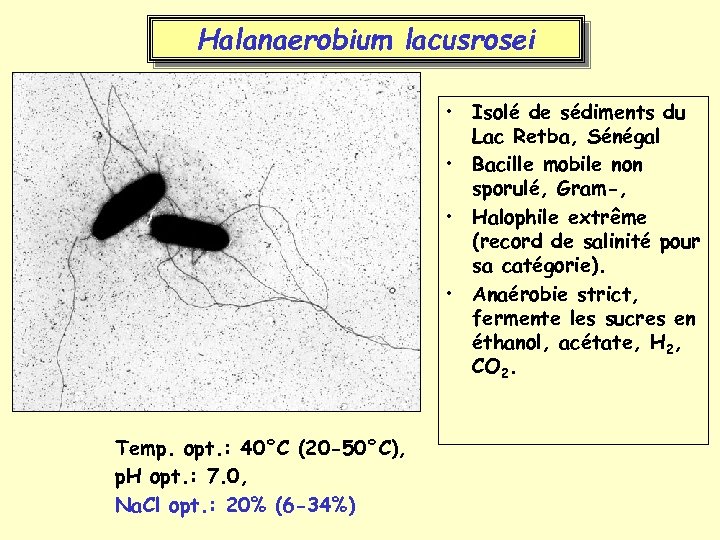
Halanaerobium lacusrosei • Isolé de sédiments du Lac Retba, Sénégal • Bacille mobile non sporulé, Gram-, • Halophile extrême (record de salinité pour sa catégorie). • Anaérobie strict, fermente les sucres en éthanol, acétate, H 2, CO 2. Temp. opt. : 40°C (20 -50°C), p. H opt. : 7. 0, Na. Cl opt. : 20% (6 -34%)

Halanaerobium saccharolyticum subsp. senegalensis • Isolé de sédiments du Lac Retba, Sénégal. • Bacille mobile non sporulé, Gram -, Halophile. • Anaérobie strict, fermente les sucres en acétate, H 2, CO 2 Temp. opt. : 40°C (20 -45°C), p. H opt. : 7, 0 (6, 3 -8, 7), Na. Cl opt. : 7, 5 -12, 5% (5 -25%)

Autres souches isolées d’environnements salés • Les souches halophiles peuvent être simultanément thermophiles, en particulier: • 1. celles isolées des tapis algaires des marais salants ou la lame d ’eau peu épaisse atteint en plein soleil des températures élévées. • Tapis algaire
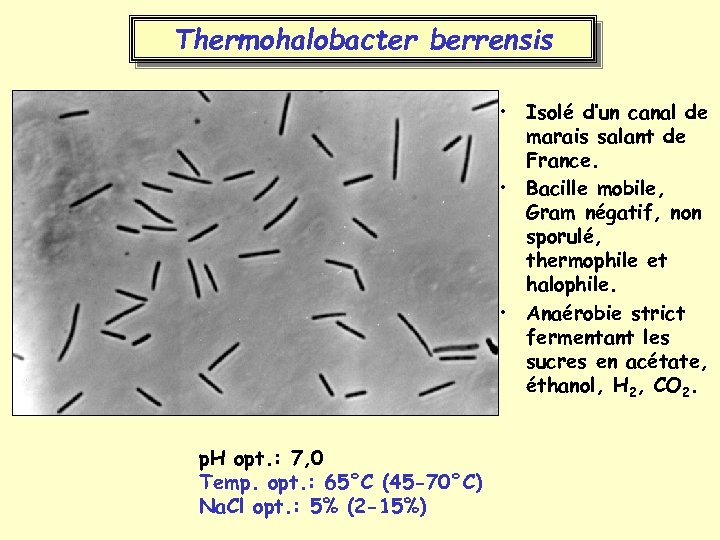
Thermohalobacter berrensis • Isolé d’un canal de marais salant de France. • Bacille mobile, Gram négatif, non sporulé, thermophile et halophile. • Anaérobie strict fermentant les sucres en acétate, éthanol, H 2, CO 2. p. H opt. : 7, 0 Temp. opt. : 65°C (45 -70°C) Na. Cl opt. : 5% (2 -15%)

Autres souches isolées d’environnements salés • Les souches halophiles peuvent être simultanément thermophiles, en particulier : • 2. celles isolées des mares salées temporaires telles que les chotts tunisiens (ici le Chott El Jerid) http: //i-cias. com/tunisia/chott_el_jerid. htm
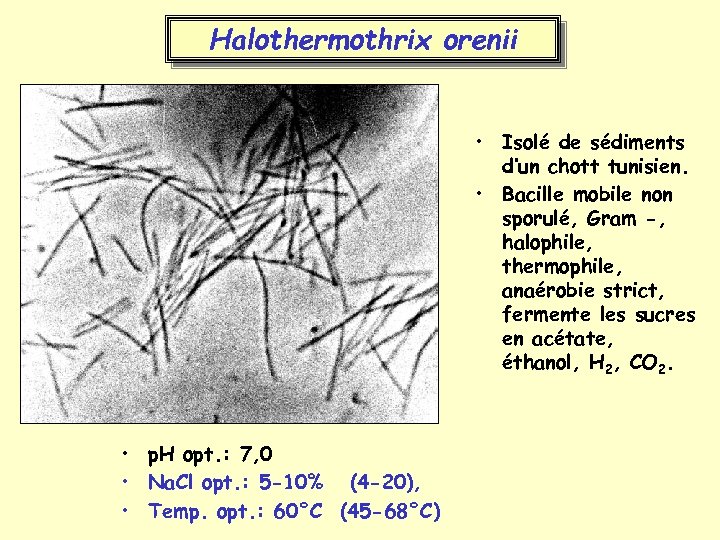
Halothermothrix orenii • Isolé de sédiments d’un chott tunisien. • Bacille mobile non sporulé, Gram -, halophile, thermophile, anaérobie strict, fermente les sucres en acétate, éthanol, H 2, CO 2. • p. H opt. : 7, 0 • Na. Cl opt. : 5 -10% (4 -20), • Temp. opt. : 60°C (45 -68°C)

Applications industrielles des halophiles • Industrie Pharmaceutique – Antibiotiques – Glycérol – Osmolytes – Surfactants • Agro-industrie – Carotènes

Les environnements chauds

Accepteurs d’électrons possibles disponibles dans les puits pétroliers S 2 O 324 H 2 + S 2 O 32 --> 2 H 2 S + H 2 O + 2 OH- - Thermotoga - Desulfotomaculum - Archeoglobus Oxydation de la matière organique couplée à la réduction du thiosulfate - Thermoanaerobacter - Thermotoga
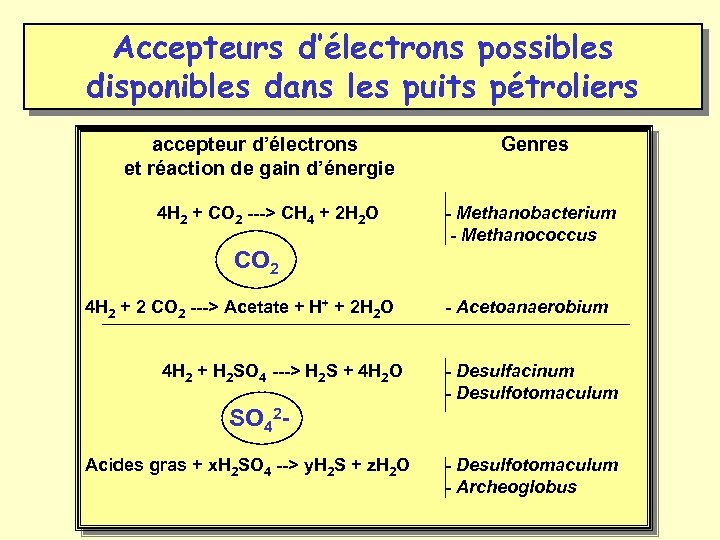
Accepteurs d’électrons possibles disponibles dans les puits pétroliers accepteur d’électrons Genres et réaction de gain d’énergie 4 H 2 + CO 2 ---> CH 4 + 2 H 2 O - Methanobacterium - Methanococcus CO 2 4 H 2 + 2 CO 2 ---> Acetate + H+ + 2 H 2 O 4 H 2 + H 2 SO 4 ---> H 2 S + 4 H 2 O - Acetoanaerobium - Desulfacinum - Desulfotomaculum SO 42 - Acides gras + x. H 2 SO 4 --> y. H 2 S + z. H 2 O - Desulfotomaculum - Archeoglobus

La biodiversité des bactéries anaérobies des environnements chauds
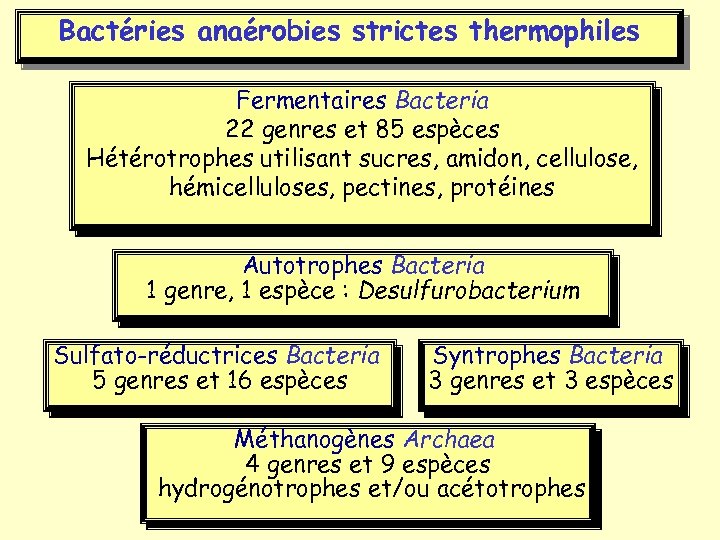
Bactéries anaérobies strictes thermophiles Fermentaires Bacteria 22 genres et 85 espèces Hétérotrophes utilisant sucres, amidon, cellulose, hémicelluloses, pectines, protéines Autotrophes Bacteria 1 genre, 1 espèce : Desulfurobacterium Sulfato-réductrices Bacteria 5 genres et 16 espèces Syntrophes Bacteria 3 genres et 3 espèces Méthanogènes Archaea 4 genres et 9 espèces hydrogénotrophes et/ou acétotrophes
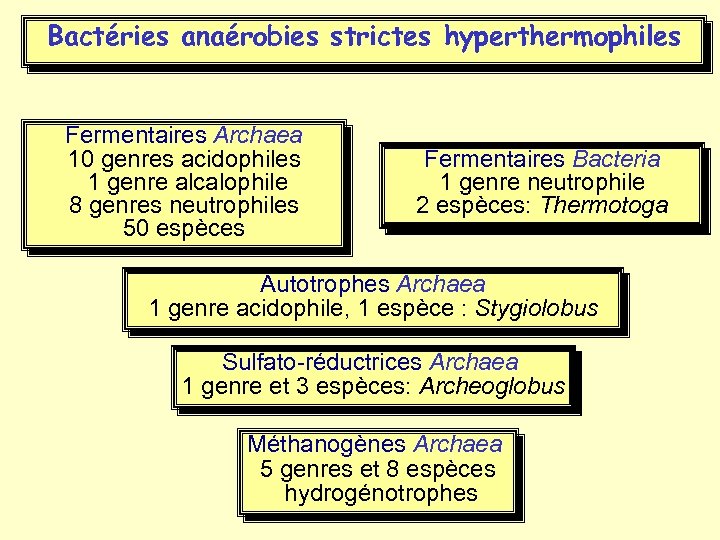
Bactéries anaérobies strictes hyperthermophiles Fermentaires Archaea 10 genres acidophiles 1 genre alcalophile 8 genres neutrophiles 50 espèces Fermentaires Bacteria 1 genre neutrophile 2 espèces: Thermotoga Autotrophes Archaea 1 genre acidophile, 1 espèce : Stygiolobus Sulfato-réductrices Archaea 1 genre et 3 espèces: Archeoglobus Méthanogènes Archaea 5 genres et 8 espèces hydrogénotrophes

Bactéries fermentaires thermophiles (1) Clostridiales Température °C min - max optimum Habitat Clostridium 26 - 66 48 - 65 compost, digesteur Anaerobaculum 28 - 60 55 puits de pétrole Anaerobranca 30 - 66 57 source chaude Anaerocellum 40 - 83 72 - 75 source chaude Caldicellulosiruptor 45 - 80 68 - 75 source chaude Caloramator 30 - 80 55 - 68 source chaude Carboxydothermus 40 - 78 70 - 72 source chaude Deferribacter 50 - 65 60 puits de pétrole Moorella 36 - 70 55 - 60 source chaude Thermobrachium 35 - 75 62 - 66 s. c. , compost Thermohydrogenium 45 - 75 65 levure Thermoterrabacterium 50 - 74 65 source chaude Coprothermobacter 35 - 70 55 - 63 digesteurs
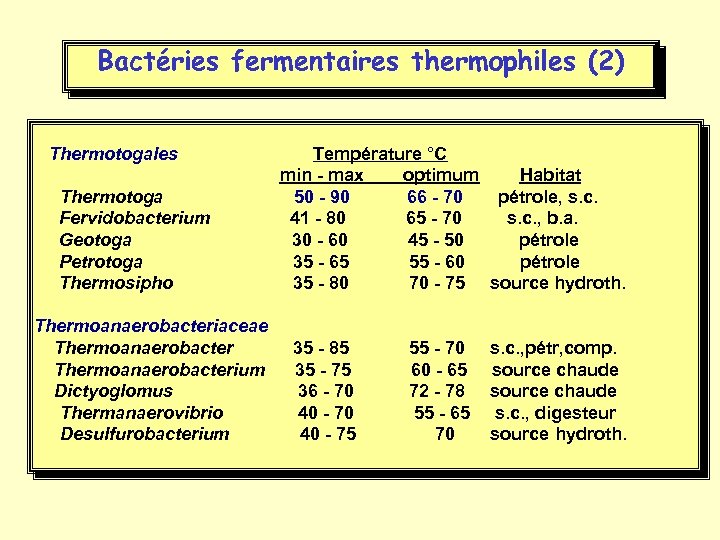
Bactéries fermentaires thermophiles (2) Thermotogales Température °C min - max optimum Habitat Thermotoga 50 - 90 66 - 70 pétrole, s. c. Fervidobacterium 41 - 80 65 - 70 s. c. , b. a. Geotoga 30 - 60 45 - 50 pétrole Petrotoga 35 - 65 55 - 60 pétrole Thermosipho 35 - 80 70 - 75 source hydroth. Thermoanaerobacteriaceae Thermoanaerobacterium Dictyoglomus Thermanaerovibrio Desulfurobacterium 35 - 85 55 - 70 s. c. , pétr, comp. 35 - 75 60 - 65 source chaude 36 - 70 72 - 78 source chaude 40 - 70 55 - 65 s. c. , digesteur 40 - 75 70 source hydroth.
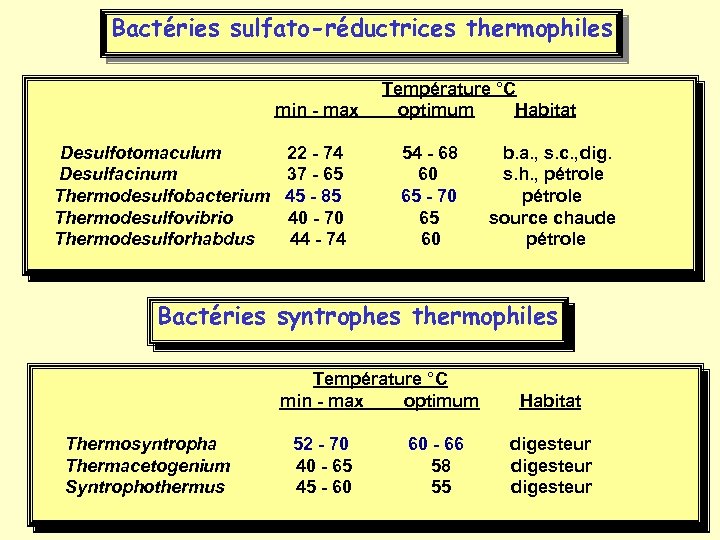
Bactéries sulfato-réductrices thermophiles Température °C min - max optimum Habitat Desulfotomaculum 22 - 74 54 - 68 b. a. , s. c. , dig. Desulfacinum 37 - 65 60 s. h. , pétrole Thermodesulfobacterium 45 - 85 65 - 70 pétrole Thermodesulfovibrio 40 - 70 65 source chaude Thermodesulforhabdus 44 - 74 60 pétrole Bactéries syntrophes thermophiles Température °C min - max optimum Habitat Thermosyntropha Thermacetogenium Syntrophothermus 52 - 70 60 - 66 digesteur 40 - 65 58 digesteur 45 - 60 55 digesteur
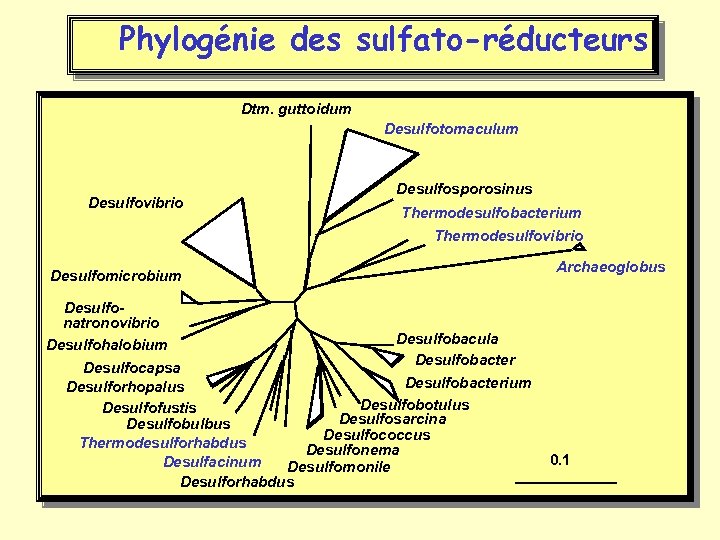
Phylogénie des sulfato-réducteurs Dtm. guttoidum Desulfotomaculum Desulfovibrio Desulfosporosinus Thermodesulfobacterium Thermodesulfovibrio Desulfomicrobium Archaeoglobus Desulfonatronovibrio Desulfobacula Desulfohalobium Desulfobacter Desulfocapsa Desulfobacterium Desulforhopalus Desulfobotulus Desulfofustis Desulfosarcina Desulfobulbus Desulfococcus Thermodesulforhabdus Desulfonema Desulfacinum Desulfomonile Desulforhabdus 0. 1
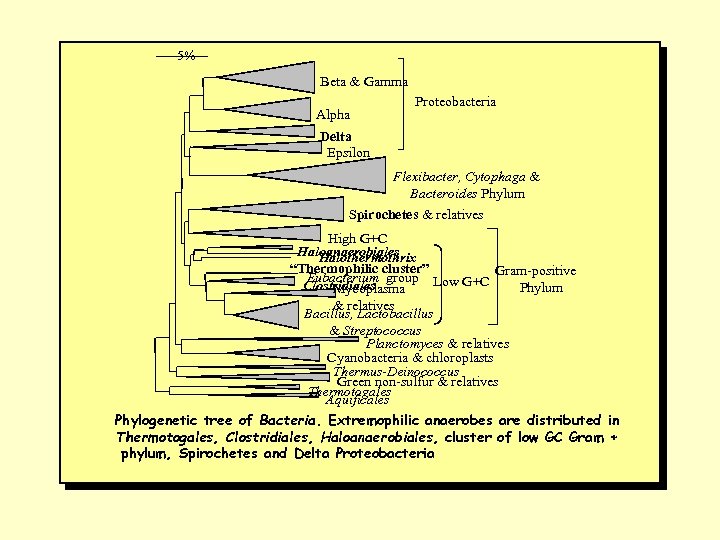
5% Beta & Gamma Alpha Proteobacteria Delta Epsilon Flexibacter, Cytophaga & Bacteroides Phylum Spirochetes & relatives High G+C Haloanaerobiales Halothermothrix “Thermophilic cluster” Eubacterium group Low G+C Gram-positive Clostridiales Phylum Mycoplasma & relatives Bacillus, Lactobacillus & Streptococcus Planctomyces & relatives Cyanobacteria & chloroplasts Thermus-Deinococcus Green non-sulfur & relatives Thermotogales Aquificales Phylogenetic tree of Bacteria. Extremophilic anaerobes are distributed in Thermotogales, Clostridiales, Haloanaerobiales, cluster of low GC Gram + phylum, Spirochetes and Delta Proteobacteria

Méthanoarchaea Thermophiles Température °C min - max optimum Habitat Methanobacterium Methanothermobacter Methanosarcina Methanosaeta 38 - 75 55 - 65 compost, digesteurs 35 - 80 55 - 70 compost, digesteurs 30 - 69 50 - 55 digesteurs nd 60 digesteurs Hyperthermophiles Température °C min - max optimum Habitat Methanothermus Methanothermococcus Methanocaldococcus Methanoignis Methanopyrus 55 - 97 83 - 88 solfatars 30 - 91 65 - 85 source hydrothermales 50 - 85 sédiments marins 45 - 91 88 source hydrothermales 84 - 110 98 source hydrothermales
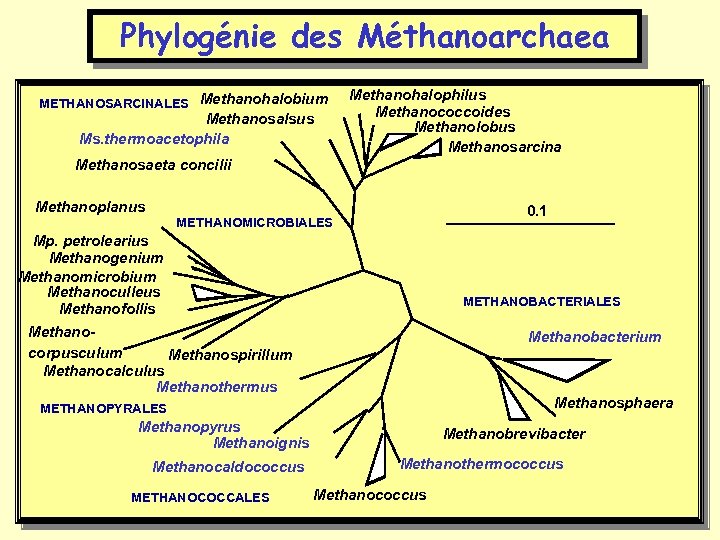
Phylogénie des Méthanoarchaea METHANOSARCINALES Methanohalobium Methanosalsus Ms. thermoacetophila Methanohalophilus Methanococcoides Methanolobus Methanosarcina Methanosaeta concilii Methanoplanus 0. 1 METHANOMICROBIALES Mp. petrolearius Methanogenium Methanomicrobium Methanoculleus Methanofollis Methanocorpusculum Methanospirillum Methanocalculus Methanothermus METHANOBACTERIALES Methanobacterium Methanosphaera METHANOPYRALES Methanopyrus Methanoignis Methanocaldococcus METHANOCOCCALES Methanobrevibacter Methanothermococcus Methanococcus

Archaea fermentaires hyperthermophiles (1) Thermococcales Température °C min - max optimum Habitat Thermococcus 50 - 103 75 - 88 s. h. , solfatars Caldococcus 55 - 100 88 source hydroth. Thermodiscus nd 88 solfatars Stetteria 68 - 102 95 source hydroth. Pyrococcus 67 - 104 96 - 103 séd. profonds Ferroglobus 65 - 95 85 source hydroth. Paleococcus 60 - 88 83 source hydroth. Thermoproteales Thermoproteus Pyrobaculum Thermocladium Caldivirga Thermofilum 78 - 100 75 - 88 source chaude 75 - 104 100 solfatars 42 - 82 75 source chaude 60 - 92 85 source chaude nd - 100 85 - 90 solfatars

Archaea fermentaires hyperthermophiles (2) Température °C min - max optimum Habitat Sulfolobales Stygiolobus nd - 90 80 volcan Igneococcales Desulfurococcus Thermosphaera Staphylothermus Pyrodictium Pyrolobus Hyperthermus 76 - 97 85 - 90 solfatars 67 - 90 85 solfatars 62 - 98 92 source hydroth. 80 - 110 97 - 105 séd. profonds 90 - 113 106 source hydroth. nd 95 - 107 source hydroth.
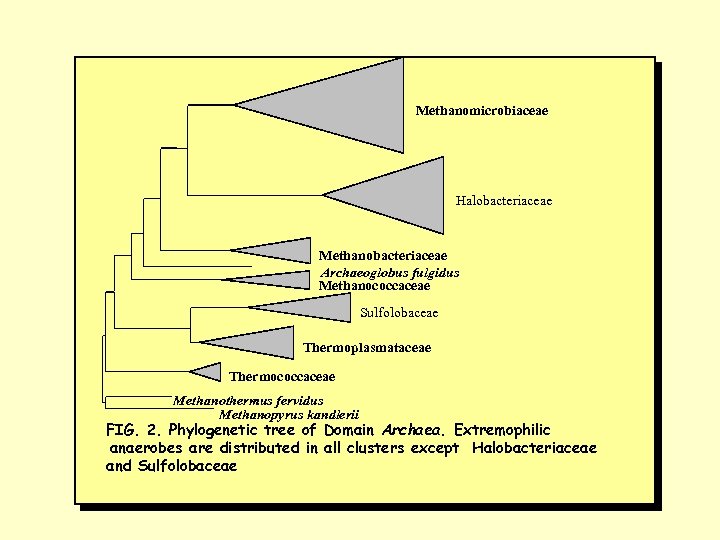
Methanomicrobiaceae Halobacteriaceae Methanobacteriaceae Archaeoglobus fulgidus Methanococcaceae Sulfolobaceae Thermoplasmataceae Thermococcaceae Methanothermus fervidus Methanopyrus kandlerii FIG. 2. Phylogenetic tree of Domain Archaea. Extremophilic anaerobes are distributed in all clusters except Halobacteriaceae and Sulfolobaceae
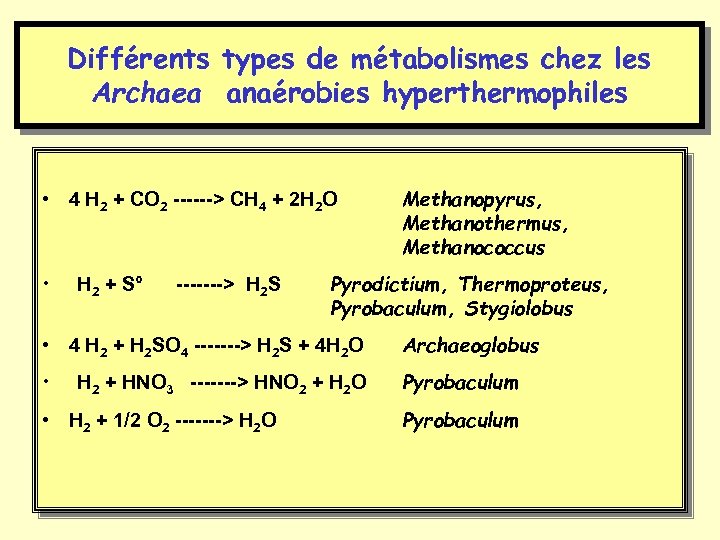
Différents types de métabolismes chez les Archaea anaérobies hyperthermophiles • 4 H 2 + CO 2 ------> CH 4 + 2 H 2 O • H 2 + S° -------> H 2 S Methanopyrus, Methanothermus, Methanococcus Pyrodictium, Thermoproteus, Pyrobaculum, Stygiolobus • 4 H 2 + H 2 SO 4 -------> H 2 S + 4 H 2 O Archaeoglobus • Pyrobaculum H 2 + HNO 3 -------> HNO 2 + H 2 O • H 2 + 1/2 O 2 -------> H 2 O Pyrobaculum

Utilisation du thiosulfate comme accepteur d’électrons par les Archaea anaérobies hyperthermophiles • Le soufre élémentaire a longtemps été considéré comme l’élément majeur du cycle microbien du soufre • La sulfo-réduction est considérée comme un métabolisme ancestral clé chez les Archaea hyperthermophiles • Le thiosulfate est également utilisé par des Archaea hyperthermophiles des ordres des Thermoproteales (Thermoproteus et Pyrobaculum ) et Pyrodictiales (Pyrodictium ), une des branches les plus basses de l’arbre phylogénétique • L’existence d’une Archaea hyperthermophile thiosulfato-réductrice appartenant à l’ordre des Desulfurococcales vient d’être rapportée (Stetteria hydrogenophila )

Les écosystèmes extrêmes thermophiles Exemple du Parc de Yellowstone (USA) Montana Idaho Wyoming • • Surface > 5 000 km 2 Point le plus élevé 3 462 m 5 % de la surface en eau Zone ayant subi trois cycles volcaniques intenses il y a 2, 0 ; 1, 3 et 0, 64 millions d’années • La partie centrale est une caldera de 45 à 65 km de diamètre, constellée de geysers (200 -250), de sources d ’eau et de boues chaudes, et de fumeroles (10 000)

Yellowstone Park, USA, la faune Faune très variée comprenant 7 espèces d’ongulés (bisons, antilopes, cerfs, élans), 2 espèces d’ours, 50 espèces d’autres mammifères (loups, coyotes, marmotes), 18 espèces de poissons, 6 espèces de reptiles, 4 espèces d’amphibiens et de nombreuses espèces d’oiseaux (oies, canards, aigles, buses…).

Yellowstone Park, USA • Source chaude acide

Microbiologistes au travail • Parcours de visite aménagé pour protéger l ’écosystème.

Yellowstone Park, USA • Sources chaudes sulfureuses

Yellowstone Park, USA • Source chaude avec dépôts carbonatés (travertin)

Les geysers • Intervalle d ’éruption: 40 -126 min

Schéma d’un geyser

Yellowstone Park, USA Solfatare (environ 50 cm de diamètre)

Yellowstone Park, USA • Dépôts de soufre natif • Développement de microorganismes filamenteux

Yellowstone Park, USA, la microflore • Microflore thermophile comprenant plusieurs espèces originales : – Aérobies – Thermus aquaticus – Anaérobies – Thermosphaera aggregans, – Thermoterrabacterium ferrireducens, – Anaerobranca horikoshii, – Thermanaerobacterium saccharolyticum, – T. thermosulfurigenes, T. xylanolyticum, – Moorella glycerini, M. thermautotrophica

Les environnements pétroliers Milieux extrêmes profonds, chauds et/ou salés
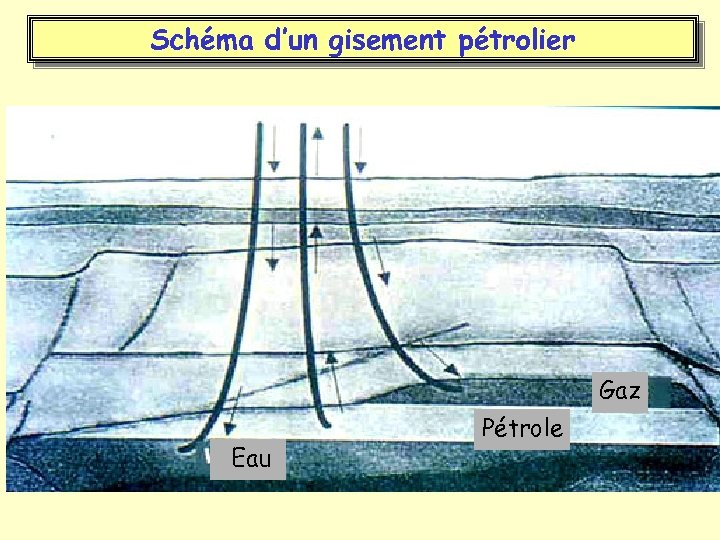
Schéma d’un gisement pétrolier Gaz Eau Pétrole

Corrosion dans les pipelines
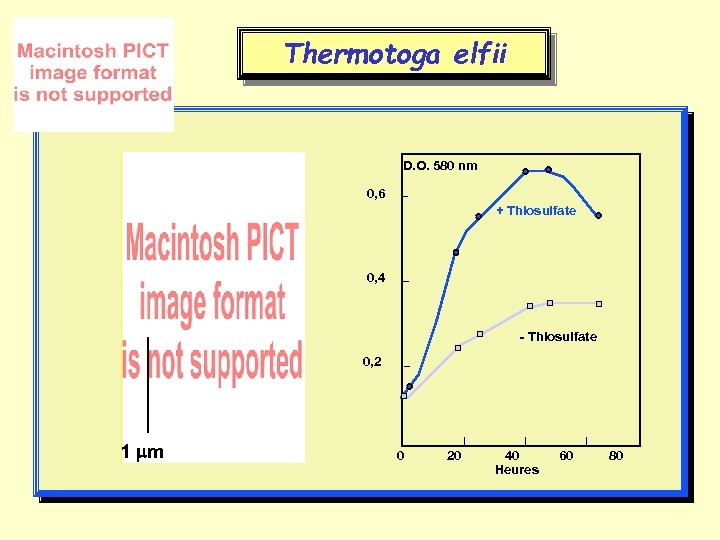
Thermotoga elfii D. O. 580 nm 0, 6 + Thiosulfate 0, 4 - Thiosulfate 0, 2 1 m 0 20 40 60 80 Heures

Thermotoga hypogea • Isolée d’un puits pétrolier du Cameroun (Elf) • L’organisme le plus thermophile du domaine des Bacteria • Température optimale : 70 - 75°C • Intervalle de température de croissance : 56 - 92°C • Anaérobie thiosulfato-réductrice
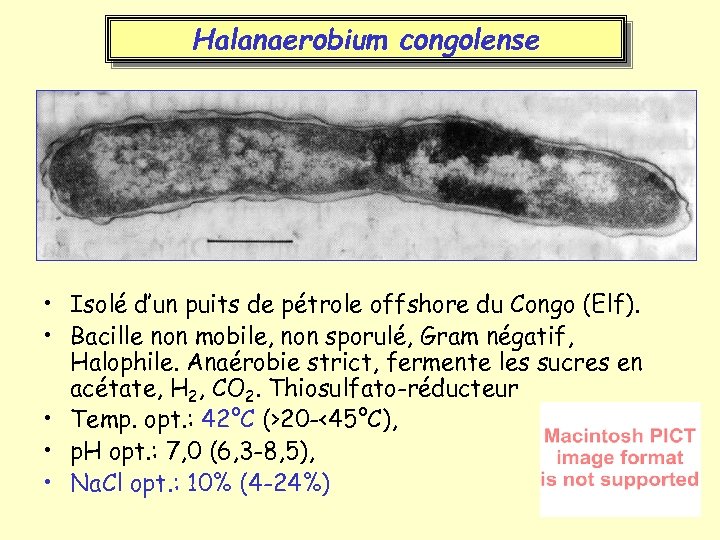
Halanaerobium congolense • Isolé d’un puits de pétrole offshore du Congo (Elf). • Bacille non mobile, non sporulé, Gram négatif, Halophile. Anaérobie strict, fermente les sucres en acétate, H 2, CO 2. Thiosulfato-réducteur • Temp. opt. : 42°C (>20 -<45°C), • p. H opt. : 7, 0 (6, 3 -8, 5), • Na. Cl opt. : 10% (4 -24%)
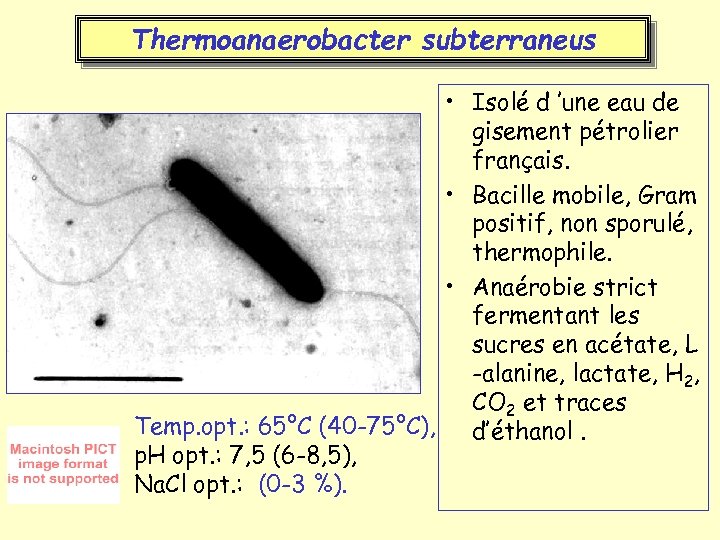
Thermoanaerobacter subterraneus • Isolé d ’une eau de gisement pétrolier français. • Bacille mobile, Gram positif, non sporulé, thermophile. • Anaérobie strict fermentant les sucres en acétate, L -alanine, lactate, H 2, CO 2 et traces Temp. opt. : 65°C (40 -75°C), d’éthanol. p. H opt. : 7, 5 (6 -8, 5), Na. Cl opt. : (0 -3 %).
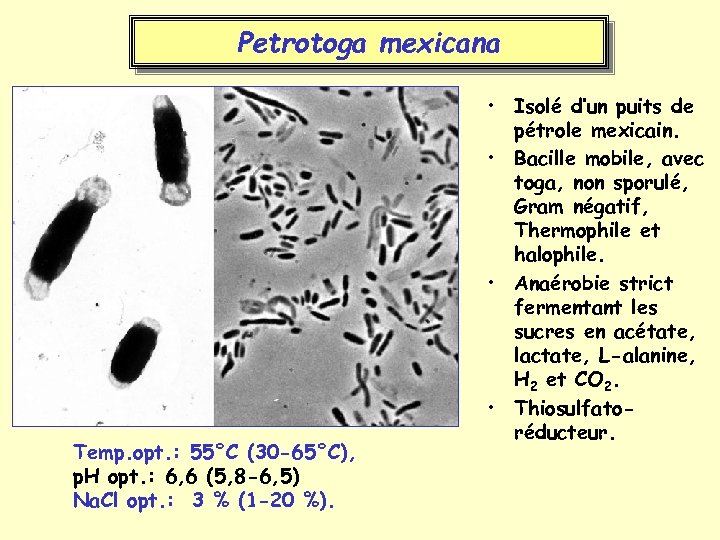
Petrotoga mexicana Temp. opt. : 55°C (30 -65°C), p. H opt. : 6, 6 (5, 8 -6, 5) Na. Cl opt. : 3 % (1 -20 %). • Isolé d’un puits de pétrole mexicain. • Bacille mobile, avec toga, non sporulé, Gram négatif, Thermophile et halophile. • Anaérobie strict fermentant les sucres en acétate, lactate, L-alanine, H 2 et CO 2. • Thiosulfatoréducteur.

Les sources hydrothermales profondes Fumeur noir : un milieu extrême où l’activité photosynthétique est absente et où la vie microbienne est fondée sur le cycle du soufre

L’Atalante, navire océanographique de l’IFREMER L'Atalante Mise à l'eau du Victor 6000

Le Victor 6000 L’Atalante : mise à l’eau du Victor 6000 > 2630 mètres de fond : prélèvements et Bras source hydrothermale par mesures sur unede prélèvement le bras télémanipulateur du Victor 6000 Photos : Copyright Ifremer / Campagne Phare 2002

Le fond nu au niveau de la dorsale

A proximité de la zone des fumeurs. . .

Les crabes deviennent plus nombreux

Base d’un fumeur avec des Riftias (vers)

L ’écosystème Cheminée hydrothermale sur la dorsale "EPR 13°N". Campagne Hope 99 (photo : Ifremer) Photos : Copyright Ifremer

La faune Ver de Pompéi (Alvinella pompejana) Vers géants Riftia



Dépôts de soufre Dans cet environnement, la vie microbienne est essentiellement fondée sur le cycle du soufre.
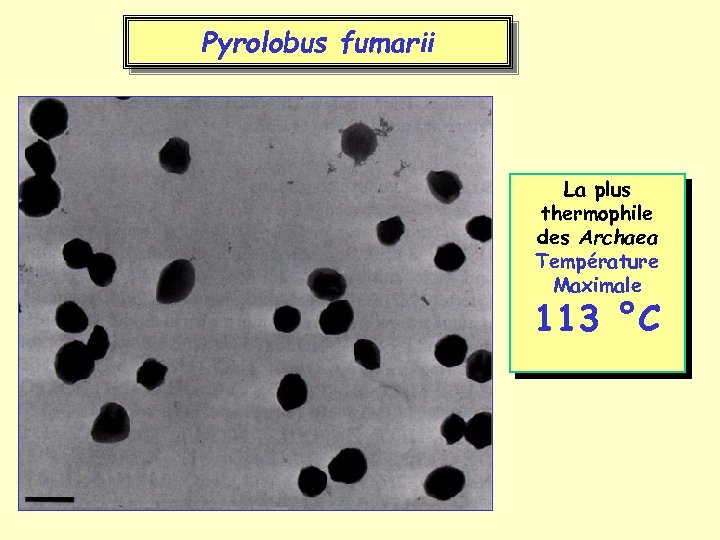
Pyrolobus fumarii La plus thermophile des Archaea Température Maximale 113 °C

Desulfonauticus submarinus Temp. opt. : 45°C (30 -60°C), Na. Cl opt. : 2 % (0 -5 %). • Isolé d’un fumeur noir du Pacifique. • Bacille incurvé non sporulé, mobile, Gram négatif, thermotolérant. Sulfato-réducteur n’utilisant que H 2 + CO 2. Présence de désulforubidine. • Phylogénétiquement le plus ancien des sulfato-réducteurs connus.
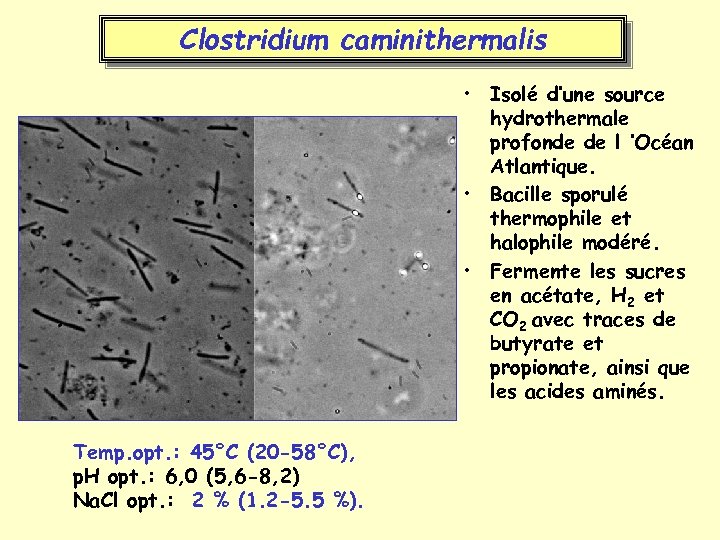
Clostridium caminithermalis • Isolé d’une source hydrothermale profonde de l ’Océan Atlantique. • Bacille sporulé thermophile et halophile modéré. • Fermente les sucres en acétate, H 2 et CO 2 avec traces de butyrate et propionate, ainsi que les acides aminés. Temp. opt. : 45°C (20 -58°C), p. H opt. : 6, 0 (5, 6 -8, 2) Na. Cl opt. : 2 % (1. 2 -5. 5 %).

Bactéries extrêmophiles et technologie • Production d’enzymes stables en conditions extrêmes – Xylanases thermostables (pâte à papier) – Autres hydrolases thermostables • Production de biosurfactants – Récupération assistée du pétrole • Source de gènes d’intérêt industriel • Supports génétiques pour la production industrielle de produits d’intérêt, en conditions extrêmes non stériles • Lutte contre les extrêmophiles thiosulfato-réducteurs responsables de la biocorrosion (milieu pétrolier)

Applications industrielles des thermophiles • • ADN polymérase: Thermus aquaticus ->Génie génétique (PCR) a-Amylases: Clostridium thermohydrosulfuricum Thermanaerobacterium thermosulfurigenes Pyrococcus furiosus ->Détergents Xylanases: Clostridium thermocellum, Dictyoglomus sp. Thermanaerobacterium thermosulfurigenes ->Pâte à papier Protéases: Thermococcus litoralis Thermococcus celer, Staphylothermus marinus ->Fromagerie Alcool déshydrogénases: Thermanaerobacter brockii Pectinases: Thermanaerobacterium thermosulfurigenes ->Industrie alimentaire Acides Gras polyinsaturés ->Industrie pharmaceutique

Exemple d’utilisation d’enzymes thermostables • TRANSFORMATION DE L’AMIDON DE MAÏS • Liquéfaction: amylase (Température 98°C, p. H 6) • Saccharification: amyloglucosidase, pullulanase (Température 60°C, p. H 4) • Isomérisation: Glucose isomérase (Température 75°C, p. H 8)

Influence de la température sur l’activité xylanolytique Thermotoga sp.

Thermostabilité de la xylanase à p. H 6, 5 Thermotoga sp. 70°C 82°C 90°C

Bacillus thermoamylovorans • Microaérophile • Thermophile modérée (optimum 52°C) • Isolée du vin de palme au Sénégal • Hétérolactique • Position taxonomique controversée (nouveau genre ? ) • 3ème alternative à la production industrielle d’acide L(+) lactique (Brevet IRD) Rhizopus oryzae: biomasse Lactobacillus delbrueckii: besoin de facteurs de croissance Bacillus thermoamylovorans: substrat moins coûteux

Utilisation industrielle de Bacillus thermoamylovorans • Souche isolée: hétérolactique produisant: -> 50% de L(+) lactate + 50% (acétate + formate + éthanol) • Identification des paramétres de fermentation qui contrôlent le % de L(+) lactate -> production de 0 à 90 % de L(+) lactate • Conception du procédé et brevet • Mise au point d’un dispositif de culture informatisé (2 litres) • Démonstrations intermédiaires chez des industriels • Changement d’échelle: – Passage à l’échelle pilote (10 m 3) – Passage à l’échelle industrielle (200 m 3)

Applications Biotechnologiques des Psychrophiles (5 - 20 °C) • ADN Polymérases Génie génétique • Protéases Fromagerie • Amylases • Lipases Détergents • Acides Gras polyinsaturés Industrie pharmaceutique

Applications biotechnologiques d’autres bactéries extrêmophiles • Acidophiles (p. H < 2) – Oxydation des sulfures -> désulfurisation du charbon – Biolixiviation -> industrie minière • Alcaliphiles (p. H > 9) – Protéases, amylases -> agro-industrie – Lipases -> détergents – Cyclodextrines -> stabilisation de substances volatiles

Conclusion • Les environnement extrêmes constituent un réservoir encore mal connu de biodiversité microbienne. • Les souches isolées ont des potentialités élevées pour une utilisation en biotechnologie. • L’étude de ces écosystèmes contribue très significativement à la compréhension des phénomènes à l ’origine de la vie sur terre.

Merci pour votre attention
233d1d0c74cc8f7fc9306dcf14a2afa7.ppt