Lektsia_5-6_Himicheskaya_svyaz.pptx
- Количество слайдов: 67
 Лекция
Лекция
 Химическая связь - это сила, удерживающая вместе два или несколько атомов, ионов, молекул или любую комбинацию из них. Величина этой силы зависит от электронной конфигурации внешней оболочки атомов.
Химическая связь - это сила, удерживающая вместе два или несколько атомов, ионов, молекул или любую комбинацию из них. Величина этой силы зависит от электронной конфигурации внешней оболочки атомов.
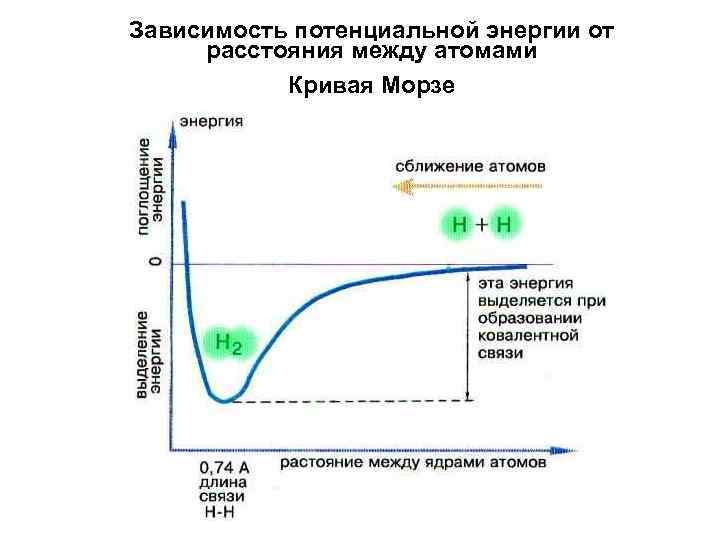 Зависимость потенциальной энергии от расстояния между атомами Кривая Морзе
Зависимость потенциальной энергии от расстояния между атомами Кривая Морзе
 Энергия связи - энергия, необходимая для того, чтобы разделить два связанных между собой атома и удалить их друг от на расстояние, на котором они уже не испытывают силы притяжения друг к другу. ! Главное при образования химической связи – минимум энергии
Энергия связи - энергия, необходимая для того, чтобы разделить два связанных между собой атома и удалить их друг от на расстояние, на котором они уже не испытывают силы притяжения друг к другу. ! Главное при образования химической связи – минимум энергии
 Валентность - способность атомов образовывать химические связи. Валентная оболочка - внешняя оболочка атома, которая содержит валентные электроны. H 1 s 1 Cl 1 s 2 2 p 6 3 s 2 3 p 5
Валентность - способность атомов образовывать химические связи. Валентная оболочка - внешняя оболочка атома, которая содержит валентные электроны. H 1 s 1 Cl 1 s 2 2 p 6 3 s 2 3 p 5
 Валентные электроны - электроны, принимающие участие в образовании химических связей, они находятся на самых высоких по энергии орбиталях атома.
Валентные электроны - электроны, принимающие участие в образовании химических связей, они находятся на самых высоких по энергии орбиталях атома.
 В. Коссель (1888 - 1956) Г. Льюис (1875 - 1946)
В. Коссель (1888 - 1956) Г. Льюис (1875 - 1946)
 Г. Н. Льюис и В. Коссель, 1916 Согласно электронной теории валентности, атомы, образуя связи, приближаются к наиболее устойчивой (т. е. имеющей наиболее низкую энергию) электронной конфигурации. Атомы могут достичь этого двумя способами. приобретение или потеря электронов обобществление электронов
Г. Н. Льюис и В. Коссель, 1916 Согласно электронной теории валентности, атомы, образуя связи, приближаются к наиболее устойчивой (т. е. имеющей наиболее низкую энергию) электронной конфигурации. Атомы могут достичь этого двумя способами. приобретение или потеря электронов обобществление электронов
 Правило октета - когда атом какого либо элемента образует химическую связь, обретая, теряя, обобществляя электроны, его электронная конфигурация становится такой же, как у атома благородного газа, расположенного в конце того же периода, что и данный элемент, либо в конце предыдущего периода.
Правило октета - когда атом какого либо элемента образует химическую связь, обретая, теряя, обобществляя электроны, его электронная конфигурация становится такой же, как у атома благородного газа, расположенного в конце того же периода, что и данный элемент, либо в конце предыдущего периода.
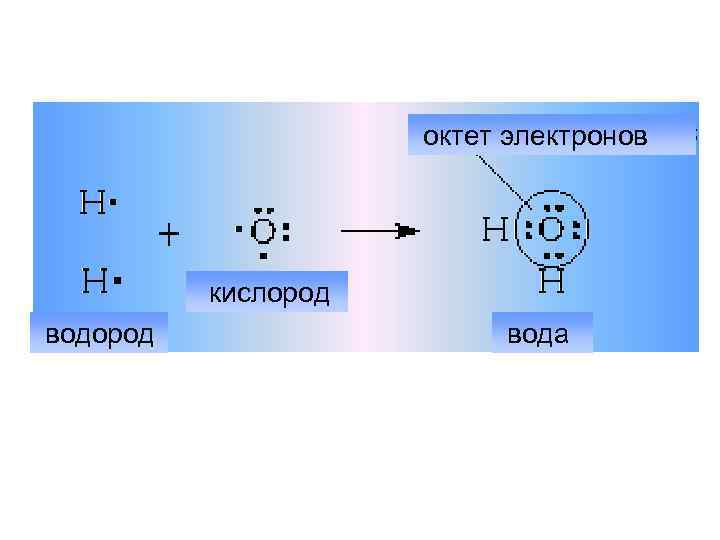 октет электронов кислород вода
октет электронов кислород вода
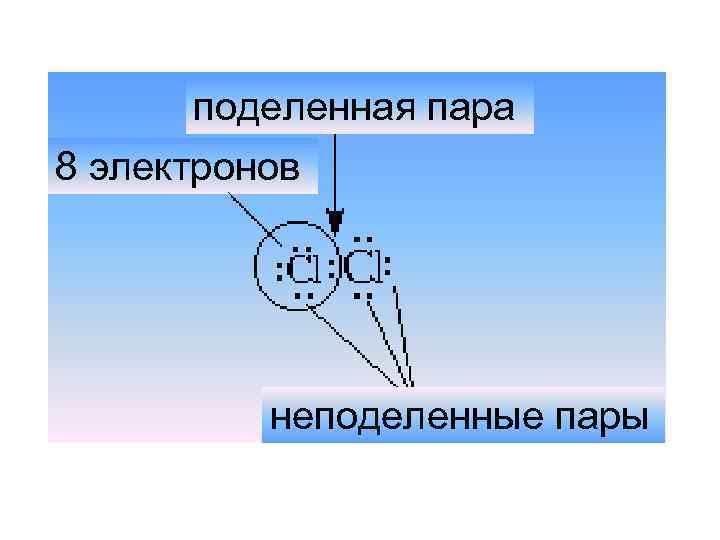 поделенная пара 8 электронов неподеленные пары
поделенная пара 8 электронов неподеленные пары
 Примеры обозначения химической связи Хлороводород Кислород Ацетилен Формула Cтруктура Модель точек и крестиков HCl O 2 H – Cl O–O H–C=C–H O H C Н • Сl: C 2 H 2 O C H Формулы Льюиса H – Cl O=O H–C=C–H Правило октета H : Cl : O: : O H: C: : : C: H Простая ковалентная связь Двойная ковалентная связь Тройная ковалентная связь
Примеры обозначения химической связи Хлороводород Кислород Ацетилен Формула Cтруктура Модель точек и крестиков HCl O 2 H – Cl O–O H–C=C–H O H C Н • Сl: C 2 H 2 O C H Формулы Льюиса H – Cl O=O H–C=C–H Правило октета H : Cl : O: : O H: C: : : C: H Простая ковалентная связь Двойная ковалентная связь Тройная ковалентная связь
 Чисто ионная или чисто ковалетная связь встречаются редко. Обычно в молекулах присутствуют химические связи с частично ионным или ковалентным характером.
Чисто ионная или чисто ковалетная связь встречаются редко. Обычно в молекулах присутствуют химические связи с частично ионным или ковалентным характером.
 Электроотрицательность – cпособность атома в молекуле притягивать к себе электроны
Электроотрицательность – cпособность атома в молекуле притягивать к себе электроны
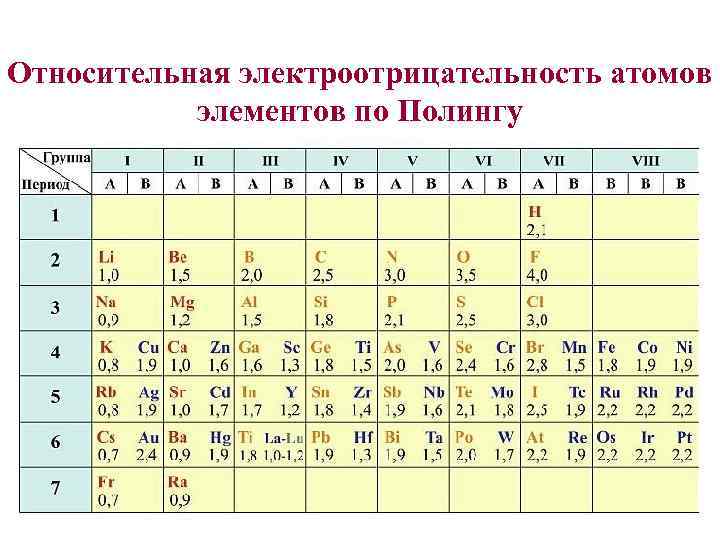 Относительная электроотрицательность атомов элементов по Полингу
Относительная электроотрицательность атомов элементов по Полингу
 Ионный и ковалентный характер связи Δ Е- разность Н-F - + Na-Cl δ+ H-H • Ионная связь - + H-Cl электроотрицательностей δ- • Ионная с частично ковалентным характером Полярная ковалентная связь Неполярная ковалентная связь Δ Е > 2, 1 ионный характер связи Δ Е < 2, 1 ковалентный характер связи 3, 0 2, 1 0, 5 0
Ионный и ковалентный характер связи Δ Е- разность Н-F - + Na-Cl δ+ H-H • Ионная связь - + H-Cl электроотрицательностей δ- • Ионная с частично ковалентным характером Полярная ковалентная связь Неполярная ковалентная связь Δ Е > 2, 1 ионный характер связи Δ Е < 2, 1 ковалентный характер связи 3, 0 2, 1 0, 5 0
 Электрический диполь - совокупность разноименных, одинаковых по абсолютному значению, расположенных на близком друг от друга расстоянии электрических зарядов
Электрический диполь - совокупность разноименных, одинаковых по абсолютному значению, расположенных на близком друг от друга расстоянии электрических зарядов
 Электрический дипольный момент определяется произведением заряда и расстояния между центрами положительного и отрицательного зарядов электрического диполя
Электрический дипольный момент определяется произведением заряда и расстояния между центрами положительного и отрицательного зарядов электрического диполя
 Поляризация - явление образования диполя (дипольного момента) под действием поля
Поляризация - явление образования диполя (дипольного момента) под действием поля
 Поляризующая способность – способность катиона притягивать электроны и поляризовать анион
Поляризующая способность – способность катиона притягивать электроны и поляризовать анион
 К. Фаянс (1897 -1975) В 1923 году предположил, что все соединения характеризуются определенной степенью ковалентности.
К. Фаянс (1897 -1975) В 1923 году предположил, что все соединения характеризуются определенной степенью ковалентности.
 Правила Фаянса Степень ковалентности велика в случае: 1. больших зарядов на ионах С 4+ - ковалентный характер связи Na+ - ионный характер связи 2. малых размеров катиона С 4+ Na+ - 0, 015 нм - ковалентный характер связи 0, 095 нм - ионный характер связи 3. больших размерах аниона - - 0, 216 нм - ковалентный характер связи I - - 0, 136 нм - ионный характер связи F
Правила Фаянса Степень ковалентности велика в случае: 1. больших зарядов на ионах С 4+ - ковалентный характер связи Na+ - ионный характер связи 2. малых размеров катиона С 4+ Na+ - 0, 015 нм - ковалентный характер связи 0, 095 нм - ионный характер связи 3. больших размерах аниона - - 0, 216 нм - ковалентный характер связи I - - 0, 136 нм - ионный характер связи F
 Ионные соединения è Твердые вещества с высокой Тпл > 400 0 C è Многие растворяются в полярных растворителях è Большинство нерастворимы в неполярных растворителях (С 6 Н 14) è Расплавы соединений проводят электричество, т. к. состоят из мобильных заряженных частиц – ионов è Водные растворы проводят электричество, т. к. содержат подвижные заряженные частицы – ионы
Ионные соединения è Твердые вещества с высокой Тпл > 400 0 C è Многие растворяются в полярных растворителях è Большинство нерастворимы в неполярных растворителях (С 6 Н 14) è Расплавы соединений проводят электричество, т. к. состоят из мобильных заряженных частиц – ионов è Водные растворы проводят электричество, т. к. содержат подвижные заряженные частицы – ионы
 Примеры ионных соединений Соли Бромид серебра Сульфат бария Нитрат калия Ag. Br Ba. SO 4 KNO 3 Минеральные кислоты Хлороводородная HCl Азотная кислота HNO 3 Серная кислота H 2 SO 4 Основания Гидроксид калия Гидроксид натрия КOН Na. OH
Примеры ионных соединений Соли Бромид серебра Сульфат бария Нитрат калия Ag. Br Ba. SO 4 KNO 3 Минеральные кислоты Хлороводородная HCl Азотная кислота HNO 3 Серная кислота H 2 SO 4 Основания Гидроксид калия Гидроксид натрия КOН Na. OH
 Энергия ионизации – энергия, необходимая для такого возбуждения электрона, чтобы он смог отделиться от атома. Первая и вторая энергии ионизации Na (г) Na+ (г) + e. Na 2+ (г) + e- ΔH° 1, m= + 495 к. Дж/моль ΔH° 1, m= + 4563 к. Дж/моль
Энергия ионизации – энергия, необходимая для такого возбуждения электрона, чтобы он смог отделиться от атома. Первая и вторая энергии ионизации Na (г) Na+ (г) + e. Na 2+ (г) + e- ΔH° 1, m= + 495 к. Дж/моль ΔH° 1, m= + 4563 к. Дж/моль
 Сродство к электрону - энергия абсорбции электрона присоединении к изолированному атому в газовой фазе с образованием однозарядного отрицательного иона.
Сродство к электрону - энергия абсорбции электрона присоединении к изолированному атому в газовой фазе с образованием однозарядного отрицательного иона.
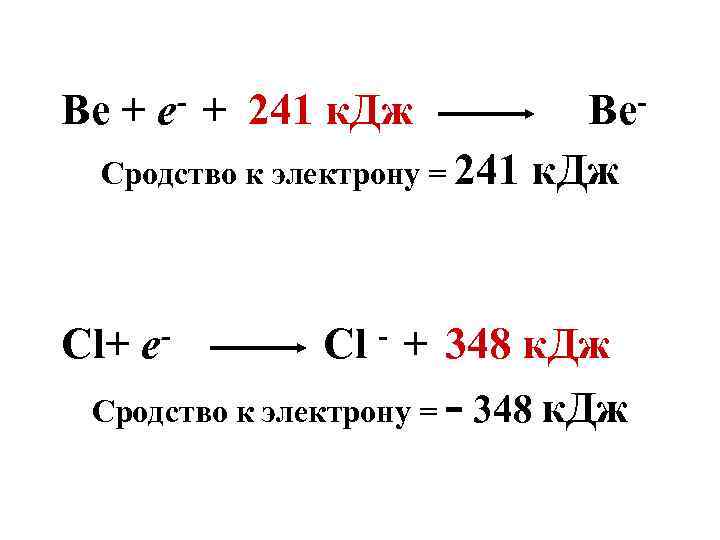 Be + 241 к. Дж Сродство к электрону = 241 Cl+ e- Be к. Дж Cl - + 348 к. Дж Сродство к электрону = - 348 к. Дж
Be + 241 к. Дж Сродство к электрону = 241 Cl+ e- Be к. Дж Cl - + 348 к. Дж Сродство к электрону = - 348 к. Дж
 Устойчивость ионных соединений • Большинство ионных соединений устойчивы в виде кристаллических решеток. • Энергия кристаллической решетки – энергия, необходимая для соединения одного моля катионов и анионов, находящихся в газообразном состоянии, в кристаллическую решетку.
Устойчивость ионных соединений • Большинство ионных соединений устойчивы в виде кристаллических решеток. • Энергия кристаллической решетки – энергия, необходимая для соединения одного моля катионов и анионов, находящихся в газообразном состоянии, в кристаллическую решетку.
 + Na (г) + Сl (г) = +Cl. Na (тв) Энергия решетки = -787 к. Дж/моль Понижение энергии решетки – повышение устойчивости ионного соединения
+ Na (г) + Сl (г) = +Cl. Na (тв) Энергия решетки = -787 к. Дж/моль Понижение энергии решетки – повышение устойчивости ионного соединения
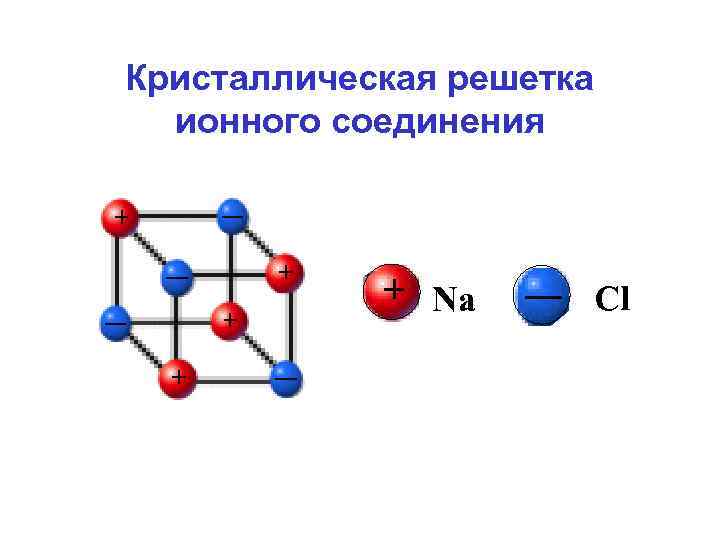 Кристаллическая решетка ионного соединения Na Cl
Кристаллическая решетка ионного соединения Na Cl
 Ковалентная связь Ковалентные соединения è Газообразные, жидкие или твердые вещества с низкой Тпл < 300 0 C è Многие не растворяются в полярных растворителях è Большинство растворимы в неполярных растворителях, таких как гексан С 6 Н 14 è Жидкие соединения или расплавы соединений не проводят электричество è Водные растворы обычно плохо проводят электричество, т. к. не содержат заряженных частиц
Ковалентная связь Ковалентные соединения è Газообразные, жидкие или твердые вещества с низкой Тпл < 300 0 C è Многие не растворяются в полярных растворителях è Большинство растворимы в неполярных растворителях, таких как гексан С 6 Н 14 è Жидкие соединения или расплавы соединений не проводят электричество è Водные растворы обычно плохо проводят электричество, т. к. не содержат заряженных частиц
 Примеры ковалентных соединений Неорганические соединения Вода H 2 O Диоксид углерода CO 2 Аммиак NH 3 Диоксид азота NO 2 Органические соединения Метан СH 4 Этанол C 2 H 5 OH Глюкоза C 6 H 12 O 6 Фенол OH
Примеры ковалентных соединений Неорганические соединения Вода H 2 O Диоксид углерода CO 2 Аммиак NH 3 Диоксид азота NO 2 Органические соединения Метан СH 4 Этанол C 2 H 5 OH Глюкоза C 6 H 12 O 6 Фенол OH
 Правила для написания формул Льюиса 1. Определяем какие атомы образуют связи H Сl 2. Определяем количество всех валентных электронов H • • Cl 3. Помещаем по 2 электрона для каждой связи H: Cl 4. Завершаем «строение» молекулы добавлением электронных пар так, H: Cl чтобы центральный атом имел октет
Правила для написания формул Льюиса 1. Определяем какие атомы образуют связи H Сl 2. Определяем количество всех валентных электронов H • • Cl 3. Помещаем по 2 электрона для каждой связи H: Cl 4. Завершаем «строение» молекулы добавлением электронных пар так, H: Cl чтобы центральный атом имел октет
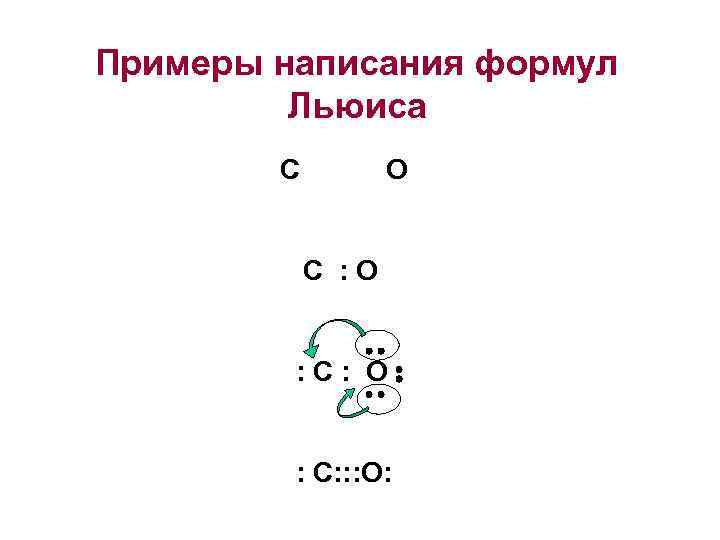 Примеры написания формул Льюиса С О С : О : С : О : С: : : О:
Примеры написания формул Льюиса С О С : О : С : О : С: : : О:
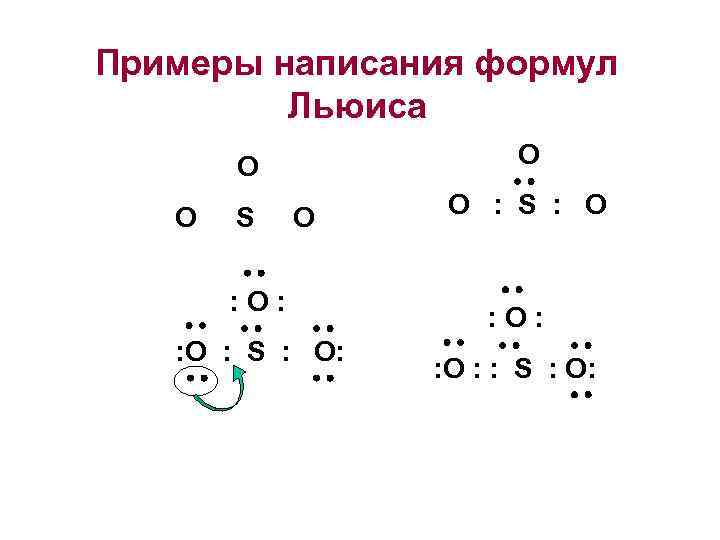 Примеры написания формул Льюиса O O O S О O : S : О : O : S : О: : O : : S : О:
Примеры написания формул Льюиса O O O S О O : S : О : O : S : О: : O : : S : О:
 Понимание природы ковалентной связи является центральным вопросом химии. Связывание атомов в молекулу является ключом к молекулярной структуре. Структура определяет физические и химические свойства вещества.
Понимание природы ковалентной связи является центральным вопросом химии. Связывание атомов в молекулу является ключом к молекулярной структуре. Структура определяет физические и химические свойства вещества.
 Представления о ковалентной связи можно разделить на три группы: Теория отталкивания валентных электронных пар (теория ОВЭП) Теория валентных связей (теория ВС) Теория молекулярных орбиталей (теория МО)
Представления о ковалентной связи можно разделить на три группы: Теория отталкивания валентных электронных пар (теория ОВЭП) Теория валентных связей (теория ВС) Теория молекулярных орбиталей (теория МО)
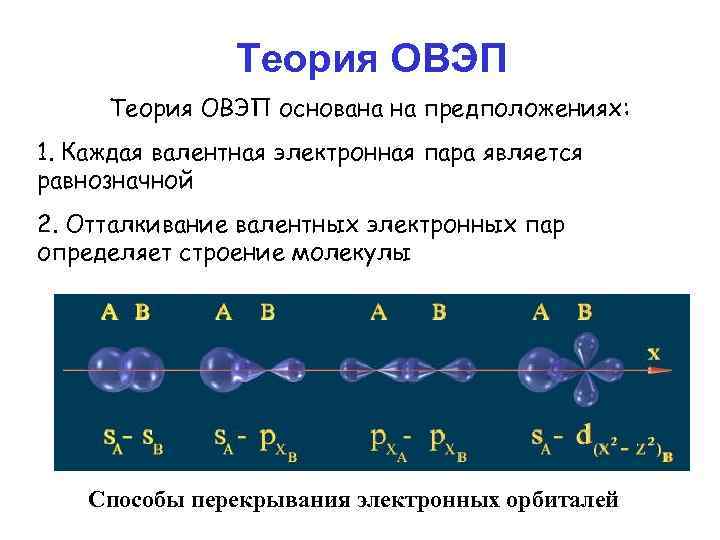 Теория ОВЭП основана на предположениях: 1. Каждая валентная электронная пара является равнозначной 2. Отталкивание валентных электронных пар определяет строение молекулы Способы перекрывания электронных орбиталей
Теория ОВЭП основана на предположениях: 1. Каждая валентная электронная пара является равнозначной 2. Отталкивание валентных электронных пар определяет строение молекулы Способы перекрывания электронных орбиталей
 Теория ВС
Теория ВС
 Гибридизация - взаимодействие определенной серии атомных орбиталей с образованием новой серии атомных орбиталей с тем же общим числом электронов и со свойствами и энергией промежуточной по сравнению с негибридизованными орбиталями
Гибридизация - взаимодействие определенной серии атомных орбиталей с образованием новой серии атомных орбиталей с тем же общим числом электронов и со свойствами и энергией промежуточной по сравнению с негибридизованными орбиталями
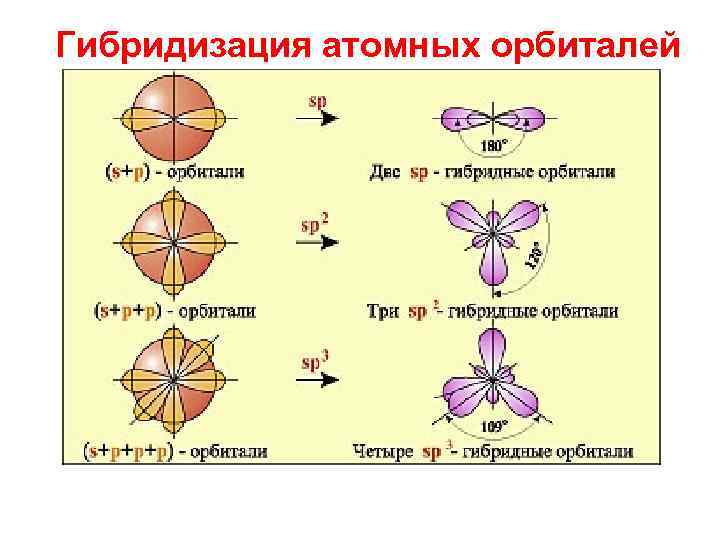 Гибридизация атомных орбиталей
Гибридизация атомных орбиталей
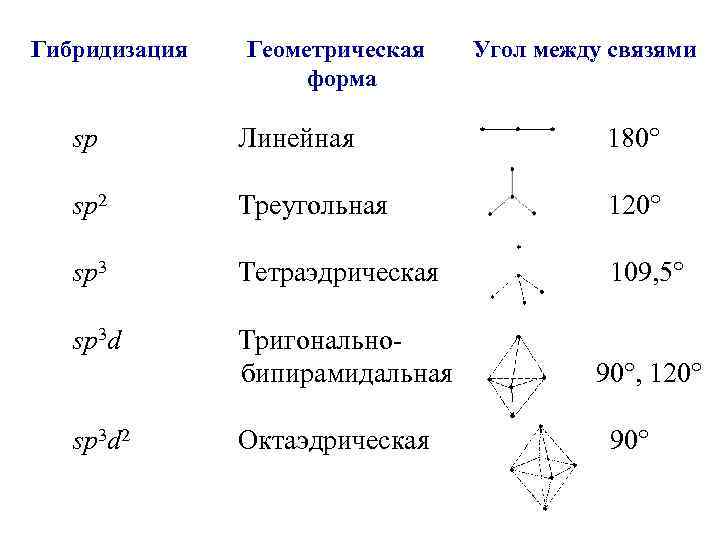 Гибридизация Геометрическая форма Угол между связями sp Линейная 180° sp 2 Треугольная 120° sp 3 Тетраэдрическая 109, 5° sp 3 d Тригональнобипирамидальная 90°, 120° sp 3 d 2 Октаэдрическая 90°
Гибридизация Геометрическая форма Угол между связями sp Линейная 180° sp 2 Треугольная 120° sp 3 Тетраэдрическая 109, 5° sp 3 d Тригональнобипирамидальная 90°, 120° sp 3 d 2 Октаэдрическая 90°
 Теория МО Малликен Роберт Сандерсон (1896 -1986) Молекулярная орбиталь – алгебраическая сумма (линейная комбинация) атомных орбиталей
Теория МО Малликен Роберт Сандерсон (1896 -1986) Молекулярная орбиталь – алгебраическая сумма (линейная комбинация) атомных орбиталей
 Основные положения теории МО F Состояние каждого электрона в молекуле описывается волновой функцией φ (МО), так что /φ/2 в любой точке пространства, занимаемого молекулой, представляет собой вероятность нахождения электрона в объеме dv вокруг этой точки. Функции φ являются многоцентровыми и отвечают нахождению электрона в поле нескольких ядер. FУ каждой МО своя энергия. FВыполняются принцип Паули и правило Хунда.
Основные положения теории МО F Состояние каждого электрона в молекуле описывается волновой функцией φ (МО), так что /φ/2 в любой точке пространства, занимаемого молекулой, представляет собой вероятность нахождения электрона в объеме dv вокруг этой точки. Функции φ являются многоцентровыми и отвечают нахождению электрона в поле нескольких ядер. FУ каждой МО своя энергия. FВыполняются принцип Паули и правило Хунда.
 Основные положения теории МО F Энергия МО будет наименьшей (и молекулой достигается наиболее стабильное состояние), если АО перекрываются максимально. Максимальное перекрывание АО достигается, если АО имеют примерно равные энергии. FАО с разной симметрией не взаимодействуют. FДля электронов в сложных молекулах принимают «одноэлектронное приближение» : электрон вблизи данного атомного ядра считают находящимся в поле данного атомного ядра и суммарном поле всех остальных электронов молекулы.
Основные положения теории МО F Энергия МО будет наименьшей (и молекулой достигается наиболее стабильное состояние), если АО перекрываются максимально. Максимальное перекрывание АО достигается, если АО имеют примерно равные энергии. FАО с разной симметрией не взаимодействуют. FДля электронов в сложных молекулах принимают «одноэлектронное приближение» : электрон вблизи данного атомного ядра считают находящимся в поле данного атомного ядра и суммарном поле всех остальных электронов молекулы.
 Основные положения теории МО F Если энергия АО очень низкая или не находит партнерские АО сходные по симметрии, то АО не участвует в образовании МО, а электроны на этих АО называются несвязывающими. FПри взаимодействии двух АО со сходной энергией и одинаковой симметрией образуются две МО, одна из которых имеет более низкую энергию, а другая – более высокую по сравнению со средней энергией взаимодействующих АО.
Основные положения теории МО F Если энергия АО очень низкая или не находит партнерские АО сходные по симметрии, то АО не участвует в образовании МО, а электроны на этих АО называются несвязывающими. FПри взаимодействии двух АО со сходной энергией и одинаковой симметрией образуются две МО, одна из которых имеет более низкую энергию, а другая – более высокую по сравнению со средней энергией взаимодействующих АО.
 Основные положения теории МО F Более низкую по энергии МО называют связывающей МО. Нахождение на ней электронов энергетически выгодно и приводит к упрочнению связи в молекуле. FОрбиталь с более высокой энергией, чем средняя энергия взаимодействующих АО, называется разрыхляющей МО (или антисвязывающей). Размещение на ней электронов дестабилизирует химическую связь.
Основные положения теории МО F Более низкую по энергии МО называют связывающей МО. Нахождение на ней электронов энергетически выгодно и приводит к упрочнению связи в молекуле. FОрбиталь с более высокой энергией, чем средняя энергия взаимодействующих АО, называется разрыхляющей МО (или антисвязывающей). Размещение на ней электронов дестабилизирует химическую связь.
 Итак: Молекулярные орбитали бывают 3 -х типов: связывающие несвязывающие разрыхляющие
Итак: Молекулярные орбитали бывают 3 -х типов: связывающие несвязывающие разрыхляющие
 Связывающие орбитали образуются в результате перекрывания атомных орбиталей двух соседних атомов (σ- и π-орбитали, соответствующие σ - и π-связям) σсв- и πсв-орбитали
Связывающие орбитали образуются в результате перекрывания атомных орбиталей двух соседних атомов (σ- и π-орбитали, соответствующие σ - и π-связям) σсв- и πсв-орбитали
 Разрыхляющие орбитали электроны, находящиеся на этих орбиталях способствуют разъединению молекулы ( «разрыхляют» химическую связь в молекуле) σ*- и π*-орбитали
Разрыхляющие орбитали электроны, находящиеся на этих орбиталях способствуют разъединению молекулы ( «разрыхляют» химическую связь в молекуле) σ*- и π*-орбитали
 Несвязывающие орбитали электроны на этих орбиталях не принимают участия в образовании химической связи, так как их энергия очень низкая или не находится «партнеров» сходных по симметрии. σнесв- и πнесв-орбитали
Несвязывающие орбитали электроны на этих орбиталях не принимают участия в образовании химической связи, так как их энергия очень низкая или не находится «партнеров» сходных по симметрии. σнесв- и πнесв-орбитали
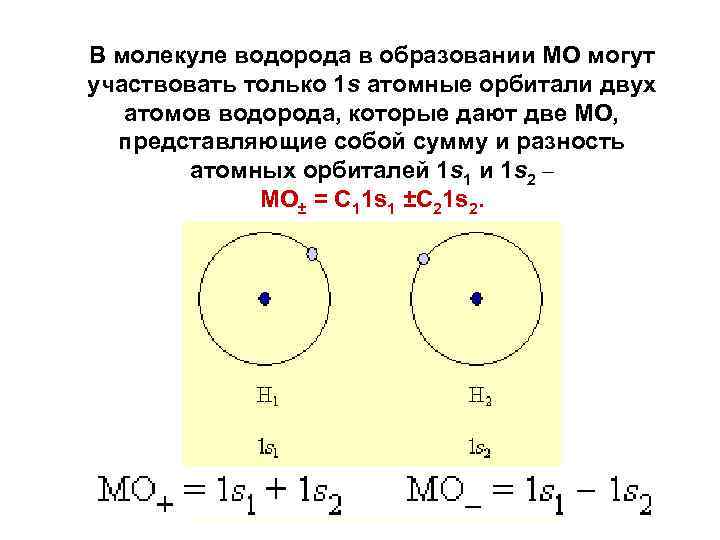 В молекуле водорода в образовании МО могут участвовать только 1 s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1 s 1 и 1 s 2 – МО± = C 11 s 1 ±C 21 s 2.
В молекуле водорода в образовании МО могут участвовать только 1 s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1 s 1 и 1 s 2 – МО± = C 11 s 1 ±C 21 s 2.
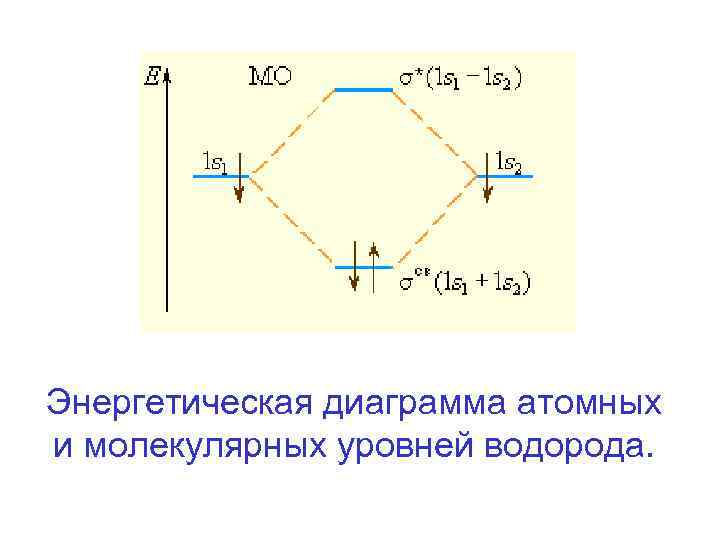 Энергетическая диаграмма атомных и молекулярных уровней водорода.
Энергетическая диаграмма атомных и молекулярных уровней водорода.
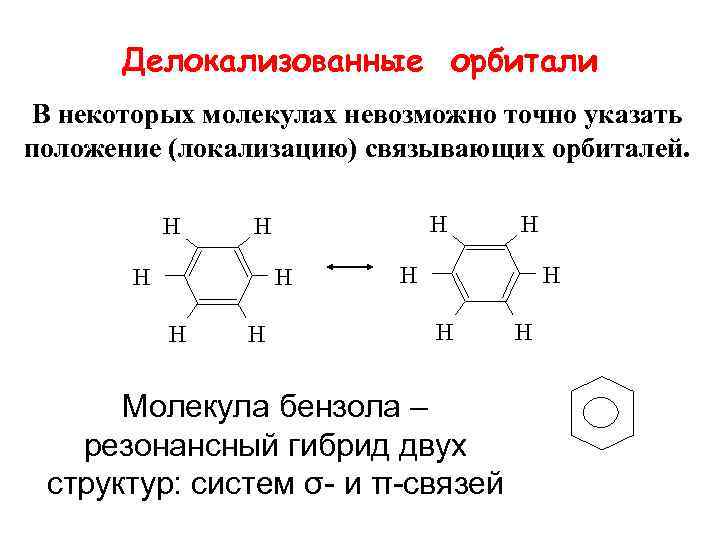 Делокализованные орбитали В некоторых молекулах невозможно точно указать положение (локализацию) связывающих орбиталей. Н Н Н Молекула бензола – резонансный гибрид двух структур: систем σ- и π-связей Н
Делокализованные орбитали В некоторых молекулах невозможно точно указать положение (локализацию) связывающих орбиталей. Н Н Н Молекула бензола – резонансный гибрид двух структур: систем σ- и π-связей Н
 Резонансная структура – гибрид из всевозможных распределений электронов. Различные распределения электронов – канонические структуры (канонические формы)
Резонансная структура – гибрид из всевозможных распределений электронов. Различные распределения электронов – канонические структуры (канонические формы)
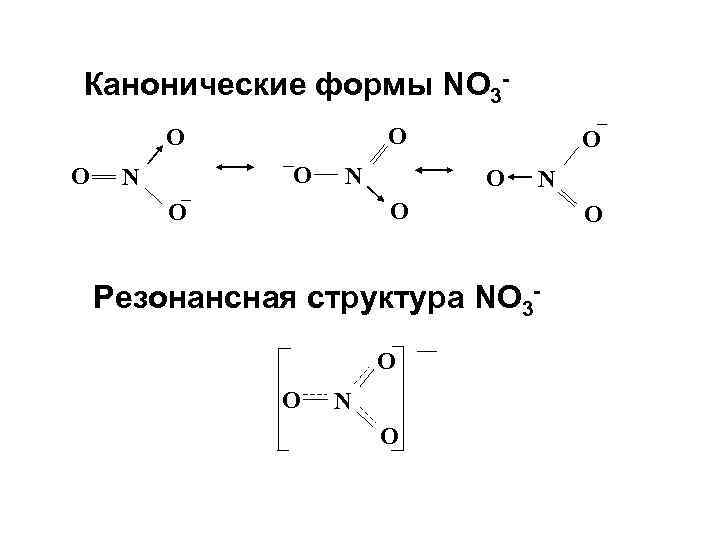 Канонические формы NO 3 O O N N O O Резонансная структура NO 3 O O N O O
Канонические формы NO 3 O O N N O O Резонансная структура NO 3 O O N O O
 Другие типы химической связи • Металлическая связь • Водородная связь • Вандерваальсовы силы
Другие типы химической связи • Металлическая связь • Водородная связь • Вандерваальсовы силы
 Металлическая связь В твердом состоянии металлы состоят из положительно заряженных ионов, плотно упакованных в кристаллическую решетку и удерживаемых вместе свободными электронами, которые создают вокруг ионов «электронный газ» .
Металлическая связь В твердом состоянии металлы состоят из положительно заряженных ионов, плотно упакованных в кристаллическую решетку и удерживаемых вместе свободными электронами, которые создают вокруг ионов «электронный газ» .
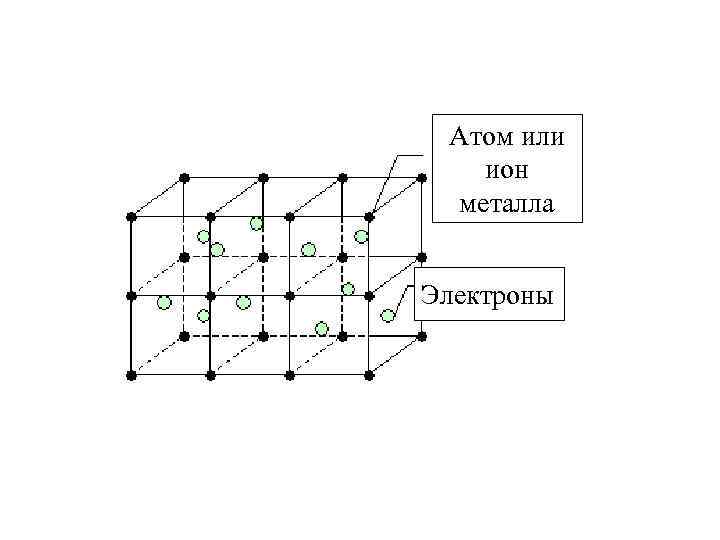 Атом или ион металла Электроны
Атом или ион металла Электроны
 Водородная связь Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S).
Водородная связь Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S).
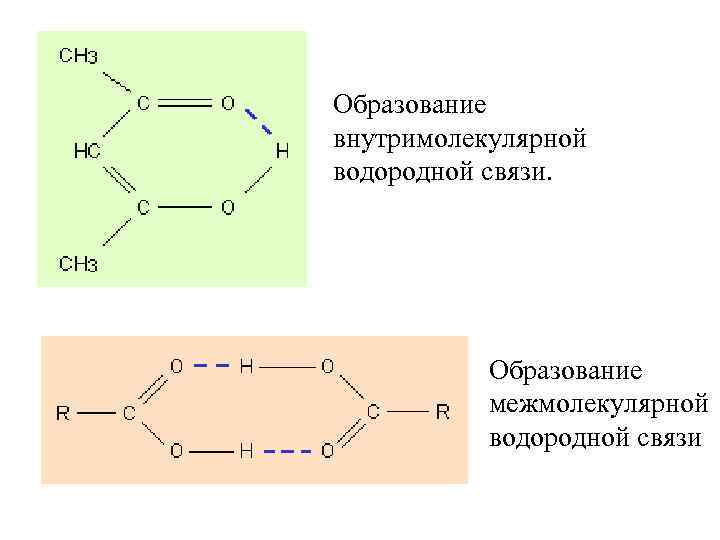 Образование внутримолекулярной водородной связи. Образование межмолекулярной водородной связи
Образование внутримолекулярной водородной связи. Образование межмолекулярной водородной связи
 Слабые и сильные водородные связи Энергия связи, Длина связи, к. Дж/моль нм Слабые водородные связи (водородные связи в воде, 10 -30 30 аммиаке, метаноле) Сильные водородные связи (существуют в ионах: водороддифтор-ион [F-H-F]гидратированный [OH-H-OH]- ) гидроксид-ион 400 23 -24
Слабые и сильные водородные связи Энергия связи, Длина связи, к. Дж/моль нм Слабые водородные связи (водородные связи в воде, 10 -30 30 аммиаке, метаноле) Сильные водородные связи (существуют в ионах: водороддифтор-ион [F-H-F]гидратированный [OH-H-OH]- ) гидроксид-ион 400 23 -24
 Ван-дер-ваальсова (межмолекулярная) связь наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – мгновенный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь).
Ван-дер-ваальсова (межмолекулярная) связь наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – мгновенный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь).
 Дипольные моменты молекул Дип. момент, Молекула Дебай Аргон Ar 0 Диоксид углерода CO 2 0 Хлороводород HCl 1. 05 Аммиак NH 3 1. 48 Диоксид серы SO 2 1. 63 Хлорбензол C 6 H 5 Cl 1. 67 Вода H 2 O 1. 84 Структура Неполярная молекула σ+ σ- σ+ O=C=O σ+ σ+ σH-Cl H - σ : N H σ+ σ O H+ + σS σ σ O σ+ σCl Hσ+ σ: O H σ+
Дипольные моменты молекул Дип. момент, Молекула Дебай Аргон Ar 0 Диоксид углерода CO 2 0 Хлороводород HCl 1. 05 Аммиак NH 3 1. 48 Диоксид серы SO 2 1. 63 Хлорбензол C 6 H 5 Cl 1. 67 Вода H 2 O 1. 84 Структура Неполярная молекула σ+ σ- σ+ O=C=O σ+ σ+ σH-Cl H - σ : N H σ+ σ O H+ + σS σ σ O σ+ σCl Hσ+ σ: O H σ+
 Атомный объем химического элемента – объем 1 моля его атомов. Атомный радиус Зная атомный объем можно вычислить объем одного атома, так как в 1 моле вещества содержится 6· 1023 атомов. Исходя из этих данных вычислим атомный радиус. v Объем и радиус атома зависят от того, как связан он с другими атомами
Атомный объем химического элемента – объем 1 моля его атомов. Атомный радиус Зная атомный объем можно вычислить объем одного атома, так как в 1 моле вещества содержится 6· 1023 атомов. Исходя из этих данных вычислим атомный радиус. v Объем и радиус атома зависят от того, как связан он с другими атомами
 Атомный радиус b Ra=b/2 Равен половине наименьшего межъядерного расстояния между одинаковыми атомами. k. Вандерваальсов радиус k. Ковалентный радиус k. Металлический радиус k. Ионный радиус
Атомный радиус b Ra=b/2 Равен половине наименьшего межъядерного расстояния между одинаковыми атомами. k. Вандерваальсов радиус k. Ковалентный радиус k. Металлический радиус k. Ионный радиус


