Слайды потенциалы.ppt
- Количество слайдов: 28

Лекция Восстановление химических соединений металлов • Общие закономерности процессов восстановления • Металлотермическое восстановление • Кинетика процесса восстановления • Механизм восстановления химических соединений металлов • Получение порошков железа восстановлением оксидов углеродом • Способы получения порошков железа восстановлением оксидов углеродом Физико-химические методы получения порошков 1

Лекция Общие закономерности процессов восстановления Под восстановлением в порошковой металлургии понимают процесс получения металла из его химического соединения путем отнятия неметаллической составляющей (кислорода, солевого остатка и др. ) при помощи какого-либо вещества, называемого восстановителем. Всякий процесс восстановления одновременно является и процессом окисления: когда исходное химическое соединение металла теряет неметаллическую составляющую (восстанавливается), восстановитель вступает с ней во взаимодействие (окисляется). Физико-химические методы получения порошков 2

Лекция Общие закономерности процессов восстановления В общем случае простейшую реакцию восстановления можно представить как Ме. А + X Ме + ХА ± Q, где Ме – металл, порошок которого хотят получать; А – неметаллическая составляющая (кислород, хлор, фтор, солевой остаток и др. ) восстанавливаемого соединения Ме. А; X – восстановитель; Q – тепловой эффект реакции. Восстановитель – это вещество, которое при заданной температуре процесса обладает большим химическим сродством к неметаллической составляющей восстанавливаемого соединения, чем металл, входящий в это соединение. Физико-химические методы получения порошков 3

Лекция Общие закономерности процессов восстановления Для оценки возможности протекания реакции восстановления сравнивают величины, характеризующие прочность химических связей в соединениях Ме. А и ХА. Количественной мерой этих величин (принято говорить «мерой химического сродства» ) служит величина свободной энергии Гиббса Q 0 T, высвобождающейся при образовании соответствующего химического соединения: чем больше высвобождается энергии, тем прочнее химическое соединение. Физико-химические методы получения порошков 4

Лекция Общие закономерности процессов восстановления В простейшем виде для стандартных условий (компоненты находятся в чистом виде, давление газа в реакционном пространстве равно атмосферному) выражение для Q 0 T реакции имеет вид Q 0 T = Q 0 XA – Q 0 Me. A = – R T ln. KP , где Q 0 XA, Q 0 Me. A – стандартные свободные энергии образования соединений ХА и Ме. А при температуре Т, KP – константа равновесия реакции; R – газовая постоянная; Т – температура проведения процесса восстановления. Когда реакция идет с участием газообразных веществ, для ее развития в нужном направлении наряду с температурой важно отношение их парциальных давлений. Физико-химические методы получения порошков 5

Лекция Общие закономерности процессов восстановления Механизм восстановления химических соединений металлов твердыми или газообразными восстановителями основан на адсорбционно- автокаталитической теории. Процесс превращения происходит в следующей последовательности: 1) внешняя диффузия молекул газообразного восстановителя к поверхности восстанавливаемого соединения и физическая адсорбция молекул на этой поверхности, 2) активирование адсорбированных молекул за счет усиления действия на них силового поля кристаллической решетки. Физико-химические методы получения порошков 6

Лекция Общие закономерности процессов восстановления 3) отдача адсорбированными атомами электронов в решетку восстанавливаемого соединения, в результате чего образуются нейтральные атомы металла (на поверхности восстанавливаемого соединения), ионы восстановителя и ионы неметаллической составляющей восстанавливаемого соединения, 4) отрыв неметаллических ионов от поверхности восстанавливаемого соединения и их переход на более выгодные (с энергетической позиций) места в молекуле восстановителя, 5) десорбция нейтральных (энергетически пассивных) молекул соединения восстановителя с поверхности раздела фаз и их диффузия вглубь газообразного слоя восстановителя под давлением активных молекул. Физико-химические методы получения порошков 7

Лекция Получение порошков железа восстановлением углеродом Сырьем для получения порошков служат оксиды железа, рудные концентраты или его хлористые соединения. В соответствии с диаграммой состояния системы “железо– кислород” существуют три оксида железа: Fe 2 O 3 или гематит (30, 06 % О), Fe 3 O 4 или магнетит (27, 64 % О) и Fe. O, который должен содержать 22, 27 % кислорода. Однако в реальных условиях последнего соединения не существует, в связи с тем, что на диаграмме состояния Fe–O в данной области присутствует соединение с широкой областью гомогенности на основе Fe. O, обогащенное кислородом. Его название – “вюстит”, а общая формула Feх. O. При температуре ниже 572 о. С вюстит неустойчив и распадается на железо и Fe 3 O 4. Физико-химические методы получения порошков 8

Лекция Получение порошков железа восстановлением углеродом Наиболее распространенным сырьем являются окисленные руды железа или прокатная окалина. В высокообогащенном рудном концентрате железо находится в виде гематита, магнетита, лимонита (HFe. O 2) и сидерита (Fe. CO 3). Физико-химические методы получения порошков 9

Лекция Получение порошков железа восстановлением углеродом Получение порошков железа и его сплавов Реакция восстановления оксидов железа твердым углеродом протекает по следующему механизму: Fe 2 O 3 + C = 2 Fe 3 O 4 + 2 CO (1) 6 Fe 2 O 3 + C = 4 Fe 3 O 4 + CO 2 (2) х. Fe 3 O 4 + C = 2 Feх O + CO 2 (3) 2 Fe 3 O 4 + C = 6 Feх. O + CO 2 (4) Feх. O + C = х. Fe + СO 2 (5) 2 Feх. O + C = 2 х. Fe 3 O 4 + 2 CO (6) Fe 3 O 4 + 4 C = 3 Fe + 4 CO (7) 2 Fe 3 O 4 + 3 C = 3 Fe + 2 CO 2 (8) Физико-химические методы получения порошков 10

Лекция Получение порошков железа восстановлением углеродом Практическое восстановление оксидов железа на всех последующих этапах процесса обеспечивает СО, образующийся при окислении углерода: С + О 2 = СО 2 С + СО 2 = 2 СО _______ 2 С + О 2 = 2 СО Физико-химические методы получения порошков 11

Лекция Получение порошков железа восстановлением углеродом Получение порошков железа и его сплавов Реакции, протекающие с участием газовой, выглядят следующим образом: 2 Fe 2 O 3 + CО = 2 Fe 3 O 4 + CO 2 + Q (9) х. Fe 3 O 4 + CО = 3 Feх. O + CO 2 – Q (10) Feх. O + CО = х. Fe + СO 2 + Q (11) Все приведенные реакции являются суммарными, идущими с образованием окислов углерода: Ме. О + СО = Ме + СО 2 С + СО 2 = 2 СО _______ Ме. О + С = Ме + СО 2 Физико-химические методы получения порошков 12
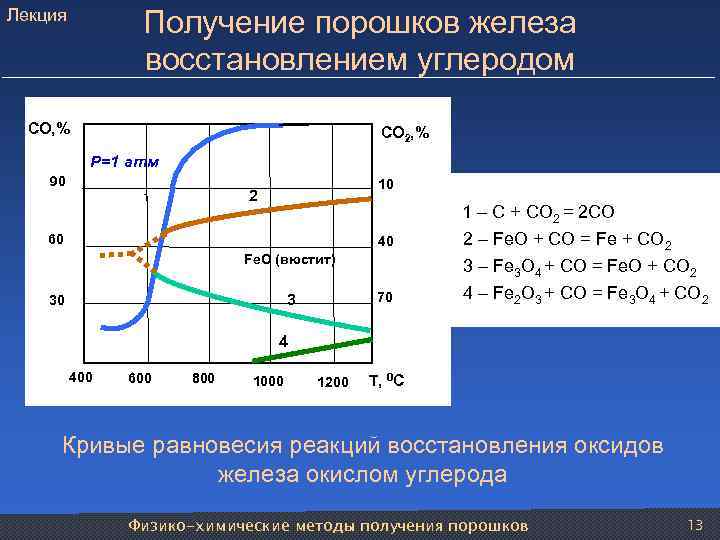
Лекция Получение порошков железа восстановлением углеродом СО, % СО 2, % Р=1 атм 90 10 1 2 1 – С + СО 2 = 2 СО 60 40 2 – Fe. O + CO = Fe + CO 2 Fe. O (вюстит) 3 – Fe 3 O 4 + CO = Fe. O + CO 2 30 3 70 4 – Fe 2 O 3 + CO = Fe 3 O 4 + CO 2 4 400 600 800 1000 1200 Т, 0 С Кривые равновесия реакций восстановления оксидов железа окислом углерода Физико-химические методы получения порошков 13

Лекция Способы получения порошков железа Основные технологические варианты получения порошков железа с использованием в качестве восстановителя углерода: - восстановление твердым углеродом; - восстановление сажистым железом; - комбинированное восстановление; - содовый способ. Физико-химические методы получения порошков 14

Лекция Способы получения порошков железа Восстановление твердым углеродом В качестве восстановителя используют молотый графит, кокс, термощлыб. Состав шихты в тигле: 60– 69 % оксидного сырья, 25– 33 % термошлыба или кокса, 6– 7 % известняка. Температура Восстановитель восстановления 1175– 1200 о. С, время 30– 40 ч. Восстанавливаемое Тигель соединение Общее время пребывания тиглей в проходной тоннельной печи может составлять до 90 часов Физико-химические методы получения порошков 15

Лекция Способы получения порошков железа Восстановление сажистым железом Сажистое железо получают путем термокаталитического разложения углеводородных газов в порах железной губки при температуре 700– 900 о. С. Оптимальное содержание углерода в сажистом железе составляет от 20 до 50 %. Основная масса углерода в сажистом железе находится в свободном состоянии в виде отдельных субмикронных частиц сажи. Введение сажистого железа в восстанавливаемую шихту позволяет ускорить процесс восстановления и уменьшить температуру восстановления на 100– 200 о. С. Это связано с тем, что присутствие в зоне реакции сажистого железа приводит к образованию на начальном этапе восстановления большого количества центров активации процесса (зародышей металлической фазы), действующих каталитически. Физико-химические методы получения порошков 16
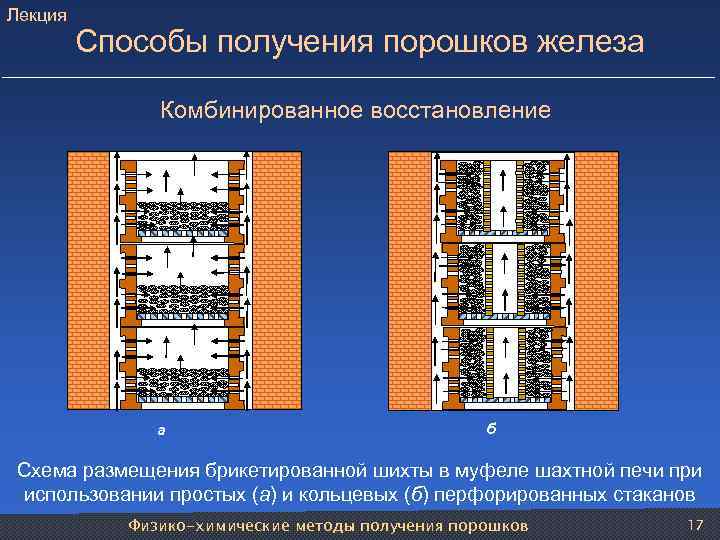
Лекция Способы получения порошков железа Комбинированное восстановление а б Схема размещения брикетированной шихты в муфеле шахтной печи при использовании простых (а) и кольцевых (б) перфорированных стаканов Физико-химические методы получения порошков 17

Лекция Способы получения порошков железа Содовый способ Сущность содового способа заключается в совмещении процесса восстановления и химического рафинирования железосодержащего сырья кальцинированной содой (Na 2 CO 3). Процесс восстановления осуществляют при нагреве шихты из смеси оксида железа, углерода и соды до температуры выше 700 о. С. . Физико-химические методы получения порошков 18

Лекция Способы получения порошков железа Содовый способ Примеси, содержащиеся в шихте (кислородные соединения кальция, кремния, марганца, мышьяка, фосфора и пр. ), образуют растворимые в воде и разбавленных кислотах соединения на основе натрия (Na 2 O, Al 2 O 3, 2 Si. O 2, Na 2 Si. O 3, Na 3 PО 4 и пр. ). Соду берут с четырех– пятикратным избытком от необходимого на связывание примесей. Сода при восстановлении действует каталитически, ускоряя газификацию углерода и кристаллохимические превращения в восстанавливаемом материале. Физико-химические методы получения порошков 19

Лекция Список рекомендуемой литературы 1. Либенсон, Г. А. Процессы порошковой металлургии : учебник для вузов в 2 ч. / Г. А. Либенсон, В. Ю. Лопатин, Г. В. Комарницкий – М. : МИСИС, 2001. 2. Якименко, В. Б. Железные порошки. Технология, состав, структура, свойства, экономика / В. Б. Якименко, В. Я. Буланов, В. В. Рукин и др. – М. : Наука, 1982. – 264 с. 3. Роман, О. В. Актуальные проблемы порошковой металлургии / О. В. Роман, В. С. Аруначалам, И. М. Федоренко и др. – М. : Металлургия, 1990. 231 с. Физико-химические методы получения порошков 20

Лекция Получение порошков железа восстановлением химических соединений • Методы восстановления оксидов железа водородом • Хлоридный способ получения порошков железа • Металлотермические методы получения порошков железа Физико-химические методы получения порошков 21

Лекция Методы восстановления железа водородом Процесс восстановления Fe 2 O 3 до железа происходит по трехступенчатой (выше 572 о. С) Fe 2 O 3 Fe 3 O 4 Fex. O Fe или двухступенчатой (ниже 572 о. С) Fe 2 O 3 Fe 3 O 4 Fe схемам: 3 Fe 2 O 3 + H 2 = 2 Fe 3 O 4 + H 2 O + Q x. Fe 3 O 4 + H 2 = 3 Fex. O + H 2 O – Q Fex. O + H 2 = x. Fe + H 2 O – Q Fe 3 O 4 + 4 H 2 = 3 Fe + 4 H 2 O – Q Физико-химические методы получения порошков 22

Лекция Методы восстановления железа водородом На практике используют несколько основных вариантов процесса восстановления оксида железа водородом: - восстановление в стационарном слое; - восстановление во вращающейся печи; - восстановление в кипящем слое. Физико-химические методы получения порошков 23
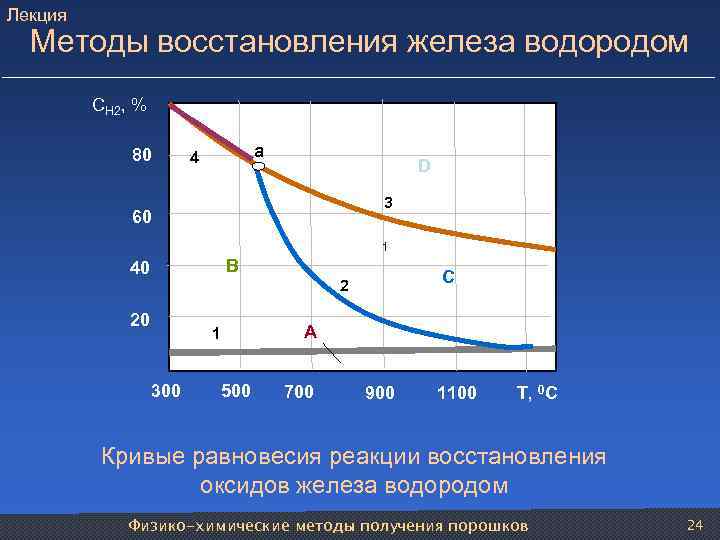
Лекция Методы восстановления железа водородом СН 2, % 80 4 a D 3 60 1 40 1 B 2 С 20 1 A 300 500 700 900 1100 T, 0 C Кривые равновесия реакции восстановления оксидов железа водородом Физико-химические методы получения порошков 24
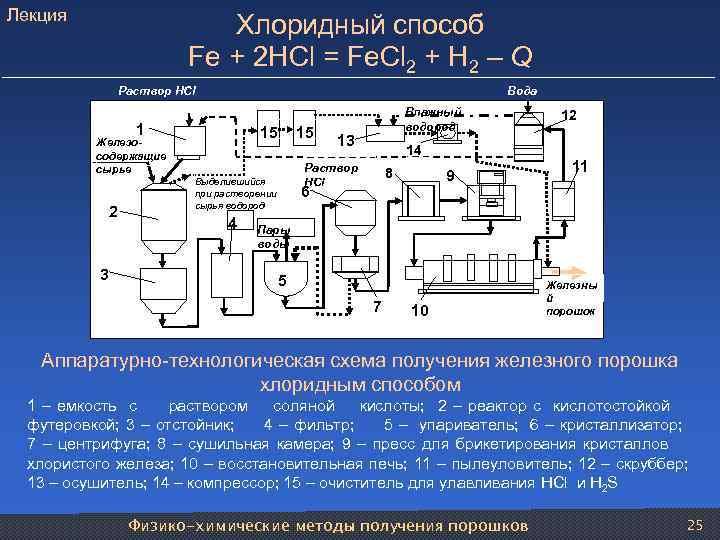
Лекция Хлоридный способ Fe + 2 HCl = Fe. Cl 2 + H 2 – Q Раствор НCl Вода Влажный 12 1 водород Железо- 15 13 содержащие 14 сырье Раствор 8 11 Выделившийся НCl 9 при растворении 6 сырья водород 2 4 Пары воды 3 5 Железны й 7 10 порошок Аппаратурно-технологическая схема получения железного порошка хлоридным способом 1 – емкость с раствором соляной кислоты; 2 – реактор с кислотостойкой футеровкой; 3 – отстойник; 4 – фильтр; 5 – упариватель; 6 – кристаллизатор; 7 – центрифуга; 8 – сушильная камера; 9 – пресс для брикетирования кристаллов хлористого железа; 10 – восстановительная печь; 11 – пылеуловитель; 12 – скруббер; 13 – осушитель; 14 – компрессор; 15 – очиститель для улавливания HCl и H 2 S Физико-химические методы получения порошков 25

Лекция Карбидотермический метод Железные порошки высокой чистоты получают восстановлением прокатной окалины или богатой окисленной железной руды карбидом кальция Fe 2 O 3 + ЗСа = 2 Fe + ЗСа. О Fe 2 O 3 + ЗС = 2 Fe + ЗСО Физико-химические методы получения порошков 26

Лекция Гидридно-кальциевый метод Порошки сталей и сплавов сложного состава получают совместным восстановлением смеси оксидов (или смеси оксидов и металлических порошков) гидридом кальция. где n – порядковый номер (от 1 до k) компонента шихты (оксида) и соответствующего ему металла в готовом продукте (порошке сплава); k – максимальное число оксидов в шихте; an – число атомов металла в молекуле соответствующего оксида (от 1 до 3); bn – число атомов кислорода в молекуле соответствующего оксида (от 1 до 5, для компонента, вводимого в виде металлического порошка, bn = 0); Аn – количество грамм-молекул в соответствии с заданным составом сплава Физико-химические методы получения порошков 27

Лекция Список рекомендуемой литературы 1. Либенсон, Г. А. Процессы порошковой металлургии : учебник для вузов в 2 ч. / Г. А. Либенсон, В. Ю. Лопатин, Г. В. Комарницкий. – М. : МИСИС, 2001. 2. Якименко, В. Б. Железные порошки. Технология, состав, структура, свойства, экономика / В. Б. Якименко, В. Я. Буланов, В. В. Рукин и др. – М. : Наука, 1982. – 264 с. 3. Роман, О. В. Актуальные проблемы порошковой металлургии / О. В. Роман, В. С. Аруначалам, И. М. Федоренко и др. – М. : Металлургия, 1990. 231 с. Физико-химические методы получения порошков 28
Слайды потенциалы.ppt