Лекция 7 Межмолекулярные взаимодействия.ppt
- Количество слайдов: 34
 Лекция
Лекция
 Типы межмолекулярных взаимодействий • Вандерваальсовы силы • Водородная связь
Типы межмолекулярных взаимодействий • Вандерваальсовы силы • Водородная связь
 Ван-дер-ваальсова связь наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – мгновенный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь).
Ван-дер-ваальсова связь наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – мгновенный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь).
 Диполь – дипольное притяжение осуществляется между молекулами с постоянными дипольными моментами. Дипольным моментом обладают только молекулы с полярными ковалентными связями.
Диполь – дипольное притяжение осуществляется между молекулами с постоянными дипольными моментами. Дипольным моментом обладают только молекулы с полярными ковалентными связями.
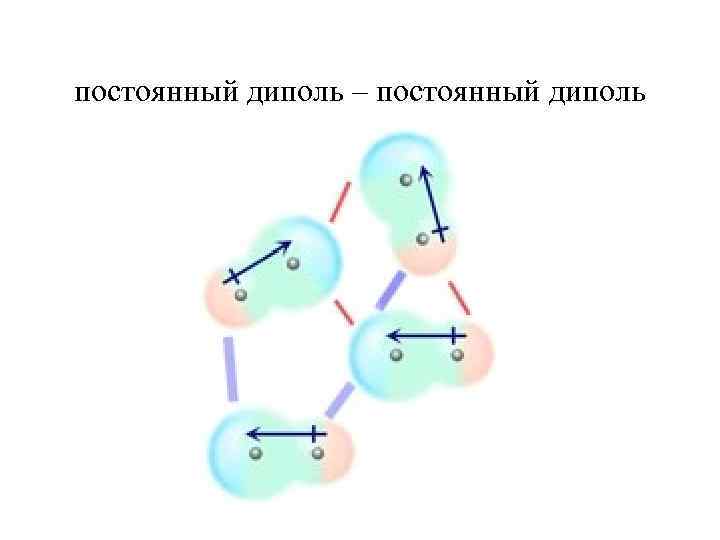 постоянный диполь – постоянный диполь
постоянный диполь – постоянный диполь
 Индукционное притяжение осуществляется между полярными молекулами и некоторыми неполярными молекулами. Оно обусловлено возникновением у неполярной молекулы под влиянием диполя расположенной неподалеку полярной молекулы индуцированного (наведенного) диполя
Индукционное притяжение осуществляется между полярными молекулами и некоторыми неполярными молекулами. Оно обусловлено возникновением у неполярной молекулы под влиянием диполя расположенной неподалеку полярной молекулы индуцированного (наведенного) диполя
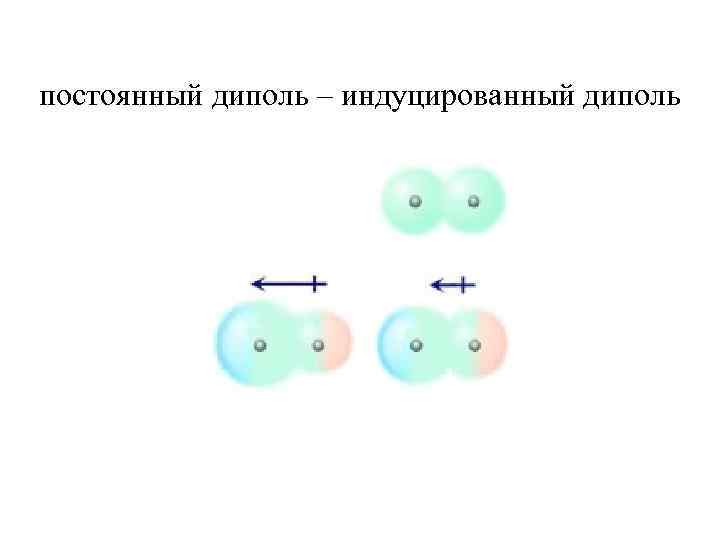 постоянный диполь – индуцированный диполь
постоянный диполь – индуцированный диполь
 Дисперсионное притяжение возникает в результате мгновенных флуктуаций электронной плотности в молекулах. Электронные облака искажаются, что приводит к появлению в молекуле мгновенного диполя, который способен индуцировать диполь в соседней молекуле. (Ф. Лондон)
Дисперсионное притяжение возникает в результате мгновенных флуктуаций электронной плотности в молекулах. Электронные облака искажаются, что приводит к появлению в молекуле мгновенного диполя, который способен индуцировать диполь в соседней молекуле. (Ф. Лондон)
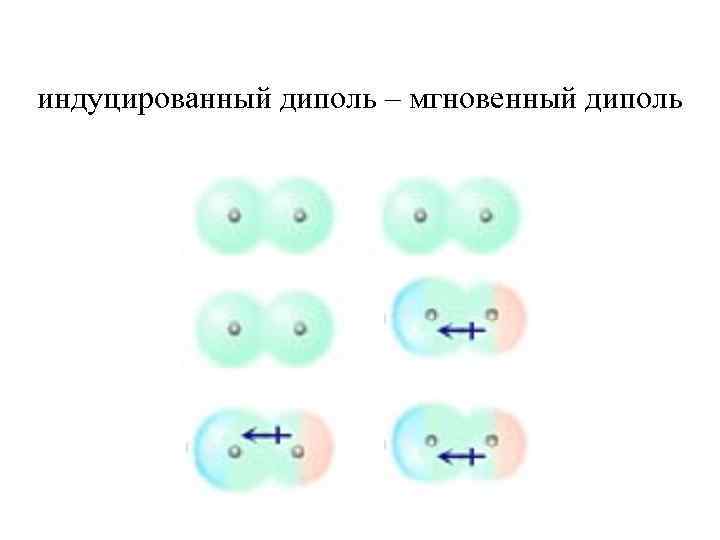 индуцированный диполь – мгновенный диполь
индуцированный диполь – мгновенный диполь
 Дипольные моменты молекул Молекула Дип. момент, Дебай Аргон Ar Диоксид углерода CO 2 Хлороводород HCl Аммиак NH 3 Диоксид серы SO 2 Хлорбензол C 6 H 5 Cl Вода H 2 O 0 0 1. 05 1. 48 1. 63 1. 67 1. 84 Структура Неполярная молекула σ+ σ- σ+ O=C=O σ+ σH-Cl σ+ H - σ : N H σ+ σ O H+ + σS σ σ O σ+ σCl Hσ+ σ: O H σ+
Дипольные моменты молекул Молекула Дип. момент, Дебай Аргон Ar Диоксид углерода CO 2 Хлороводород HCl Аммиак NH 3 Диоксид серы SO 2 Хлорбензол C 6 H 5 Cl Вода H 2 O 0 0 1. 05 1. 48 1. 63 1. 67 1. 84 Структура Неполярная молекула σ+ σ- σ+ O=C=O σ+ σH-Cl σ+ H - σ : N H σ+ σ O H+ + σS σ σ O σ+ σCl Hσ+ σ: O H σ+
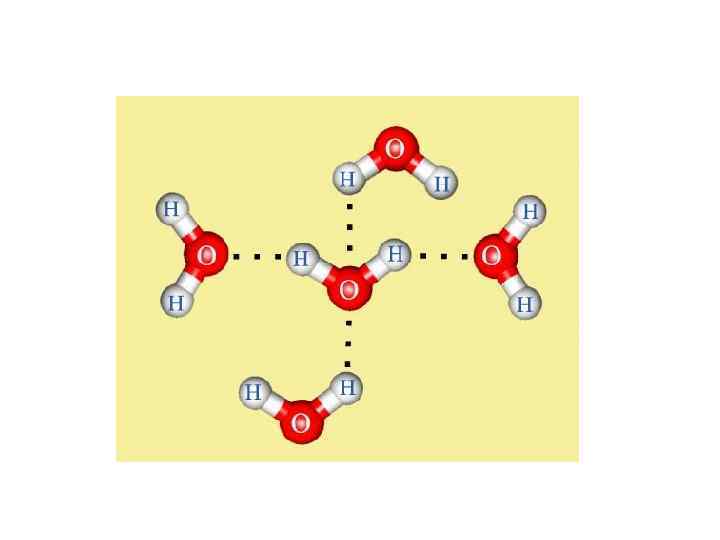
 Водородная связь сила притяжения, возникающая между атомом водорода и электроотрицательным атомом
Водородная связь сила притяжения, возникающая между атомом водорода и электроотрицательным атомом
 Водородная связь Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S).
Водородная связь Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S).
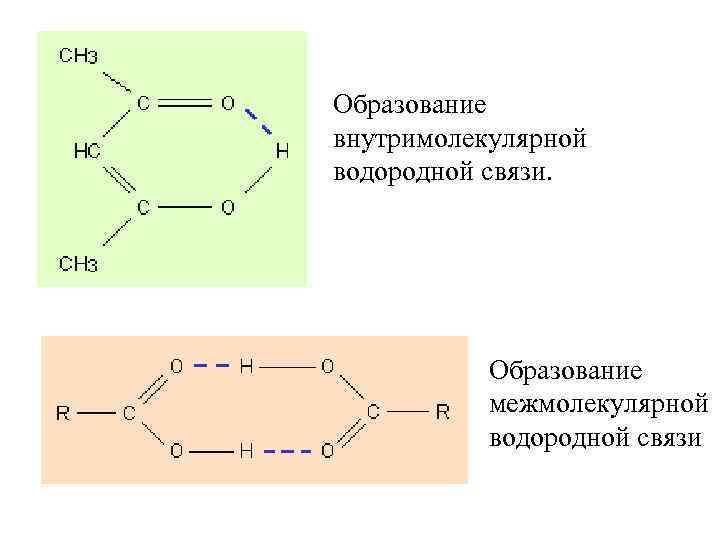 Образование внутримолекулярной водородной связи. Образование межмолекулярной водородной связи
Образование внутримолекулярной водородной связи. Образование межмолекулярной водородной связи
 Слабые и сильные водородные связи Энергия связи, Длина связи, к. Дж/моль нм Слабые водородные связи (водородные связи в воде, 10 -30 30 аммиаке, метаноле) Сильные водородные связи (существуют в ионах: водороддифтор-ион [F-H-F]гидратированный [OH-H-OH]- ) гидроксид-ион 400 23 -24
Слабые и сильные водородные связи Энергия связи, Длина связи, к. Дж/моль нм Слабые водородные связи (водородные связи в воде, 10 -30 30 аммиаке, метаноле) Сильные водородные связи (существуют в ионах: водороддифтор-ион [F-H-F]гидратированный [OH-H-OH]- ) гидроксид-ион 400 23 -24
 Атомный объем химического элемента – объем 1 моля его атомов.
Атомный объем химического элемента – объем 1 моля его атомов.
 Атомный радиус Зная атомный объем можно вычислить объем одного атома, так как в 1 моле вещества содержится 6· 1023 атомов. Исходя из этих данных вычислим атомный радиус. v Объем и радиус атома зависят от того, как связан он с другими атомами
Атомный радиус Зная атомный объем можно вычислить объем одного атома, так как в 1 моле вещества содержится 6· 1023 атомов. Исходя из этих данных вычислим атомный радиус. v Объем и радиус атома зависят от того, как связан он с другими атомами
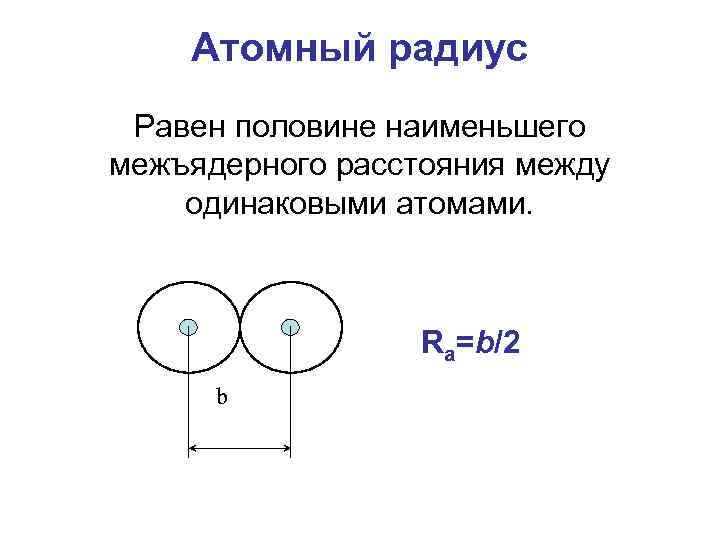 Атомный радиус Равен половине наименьшего межъядерного расстояния между одинаковыми атомами. Ra=b/2 b
Атомный радиус Равен половине наименьшего межъядерного расстояния между одинаковыми атомами. Ra=b/2 b
 Атомный радиус k. Вандерваальсов радиус k. Ковалентный радиус k. Металлический радиус k. Ионный радиус
Атомный радиус k. Вандерваальсов радиус k. Ковалентный радиус k. Металлический радиус k. Ионный радиус
 Вандерваальсов радиус Равен половине наименьшего межъядерного расстояния между несвязанными атомами. Ra=b/2 b Ra - вандерваальсов радиус
Вандерваальсов радиус Равен половине наименьшего межъядерного расстояния между несвязанными атомами. Ra=b/2 b Ra - вандерваальсов радиус
 Ковалентный радиус Равен половине межъядерного расстояния (длины связи) между двумя одинаковыми атомами, связанными друг с другом ковалентной связью. Ra=b/2 b Ra - ковалентный радиус b - длина связи
Ковалентный радиус Равен половине межъядерного расстояния (длины связи) между двумя одинаковыми атомами, связанными друг с другом ковалентной связью. Ra=b/2 b Ra - ковалентный радиус b - длина связи
 Молекула хлора Сl 2 Длина связи 0, 1988 нм Ковалентный радиус 0, 0944 нм Молекула хлорметана СН 3 Сl Длина связи С-Сl 0, 1767 нм Ковалентный радиус Сl 0, 0944 нм Ковалентный радиус С 0, 0773 нм Принцип аддитивности – атомные радиусы подчиняются простому закону сложения
Молекула хлора Сl 2 Длина связи 0, 1988 нм Ковалентный радиус 0, 0944 нм Молекула хлорметана СН 3 Сl Длина связи С-Сl 0, 1767 нм Ковалентный радиус Сl 0, 0944 нм Ковалентный радиус С 0, 0773 нм Принцип аддитивности – атомные радиусы подчиняются простому закону сложения
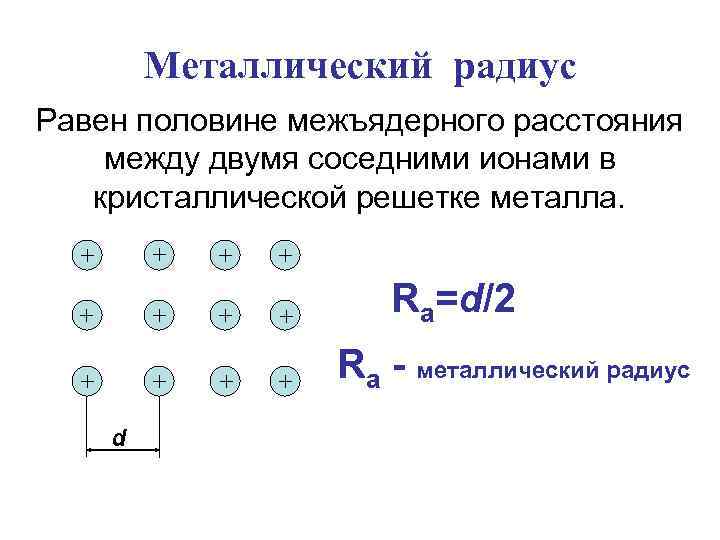 Металлический радиус Равен половине межъядерного расстояния между двумя соседними ионами в кристаллической решетке металла. Ra=d/2 Ra - металлический радиус d
Металлический радиус Равен половине межъядерного расстояния между двумя соседними ионами в кристаллической решетке металла. Ra=d/2 Ra - металлический радиус d
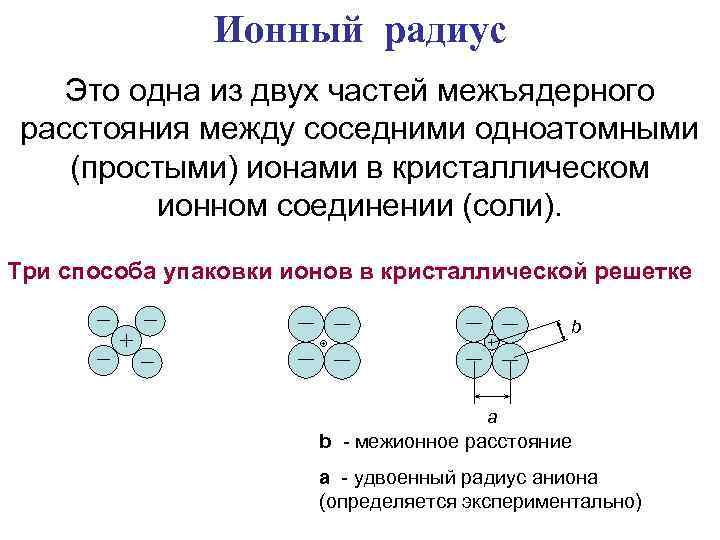 Ионный радиус Это одна из двух частей межъядерного расстояния между соседними одноатомными (простыми) ионами в кристаллическом ионном соединении (соли). Три способа упаковки ионов в кристаллической решетке b a b - межионное расстояние a - удвоенный радиус аниона (определяется экспериментально)
Ионный радиус Это одна из двух частей межъядерного расстояния между соседними одноатомными (простыми) ионами в кристаллическом ионном соединении (соли). Три способа упаковки ионов в кристаллической решетке b a b - межионное расстояние a - удвоенный радиус аниона (определяется экспериментально)
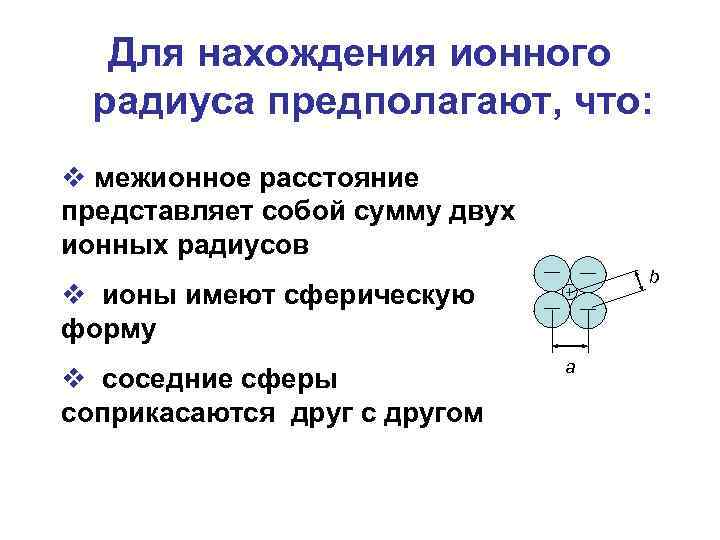 Для нахождения ионного радиуса предполагают, что: v межионное расстояние представляет собой сумму двух ионных радиусов b v ионы имеют сферическую форму v соседние сферы соприкасаются друг с другом a
Для нахождения ионного радиуса предполагают, что: v межионное расстояние представляет собой сумму двух ионных радиусов b v ионы имеют сферическую форму v соседние сферы соприкасаются друг с другом a
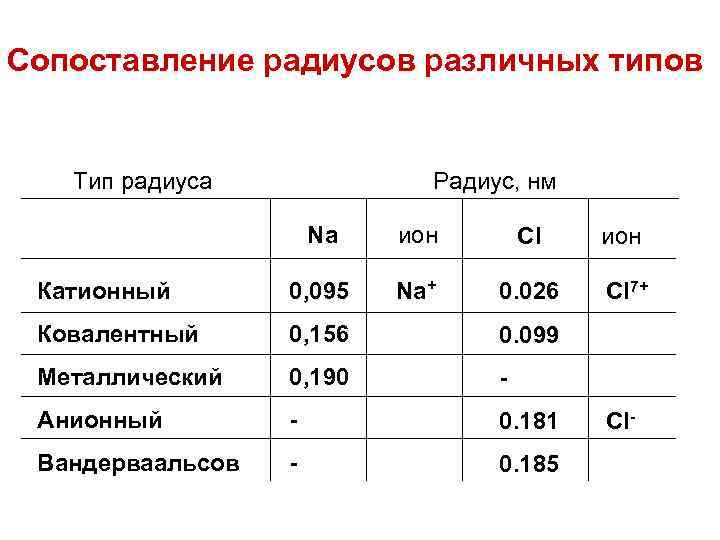 Сопоставление радиусов различных типов Тип радиуса Радиус, нм Na ион Cl ион Катионный 0, 095 Na+ 0. 026 Cl 7+ Ковалентный 0, 156 0. 099 Металлический 0, 190 - Анионный - 0. 181 Вандерваальсов - 0. 185 Cl-
Сопоставление радиусов различных типов Тип радиуса Радиус, нм Na ион Cl ион Катионный 0, 095 Na+ 0. 026 Cl 7+ Ковалентный 0, 156 0. 099 Металлический 0, 190 - Анионный - 0. 181 Вандерваальсов - 0. 185 Cl-
 Влияние межмолекулярных сил на структуру и свойства Диполь-дипольное притяжение обуславливает втягивание молекул воды с поверхности внутрь жидкости, капли сферической формы, и объясняет существование вогнутого мениска воды.
Влияние межмолекулярных сил на структуру и свойства Диполь-дипольное притяжение обуславливает втягивание молекул воды с поверхности внутрь жидкости, капли сферической формы, и объясняет существование вогнутого мениска воды.
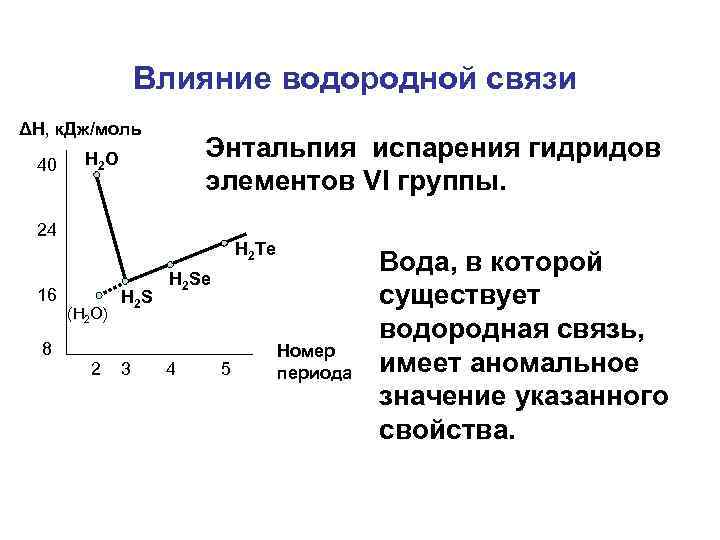 Влияние водородной связи ΔH, к. Дж/моль 40 Энтальпия испарения гидридов элементов VI группы. H 2 O 24 H 2 Te 16 (H 2 O) H 2 S H 2 Se 8 2 3 4 5 Номер периода Вода, в которой существует водородная связь, имеет аномальное значение указанного свойства.
Влияние водородной связи ΔH, к. Дж/моль 40 Энтальпия испарения гидридов элементов VI группы. H 2 O 24 H 2 Te 16 (H 2 O) H 2 S H 2 Se 8 2 3 4 5 Номер периода Вода, в которой существует водородная связь, имеет аномальное значение указанного свойства.
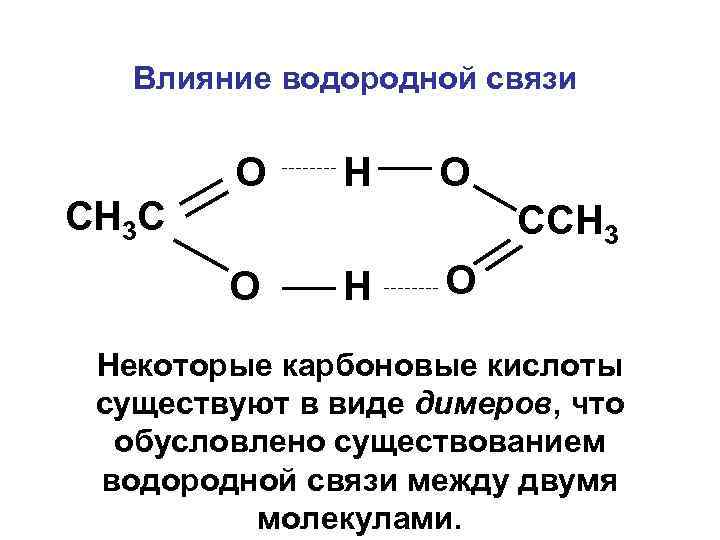 Влияние водородной связи СН 3 С О Н О ССН 3 О Некоторые карбоновые кислоты существуют в виде димеров, что обусловлено существованием водородной связи между двумя молекулами.
Влияние водородной связи СН 3 С О Н О ССН 3 О Некоторые карбоновые кислоты существуют в виде димеров, что обусловлено существованием водородной связи между двумя молекулами.
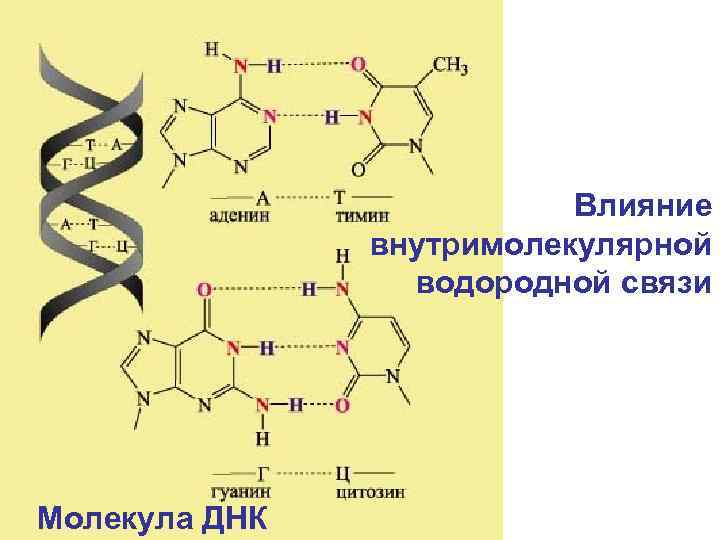 Влияние внутримолекулярной водородной связи Молекула ДНК
Влияние внутримолекулярной водородной связи Молекула ДНК
 Влияние вандерваальсовых сил Молекулы с большим числом электронов и более диффузным распределением электронов притягиваются друг к другу сильнее, чем с малым молекулы с тесно связанными электронами.
Влияние вандерваальсовых сил Молекулы с большим числом электронов и более диффузным распределением электронов притягиваются друг к другу сильнее, чем с малым молекулы с тесно связанными электронами.
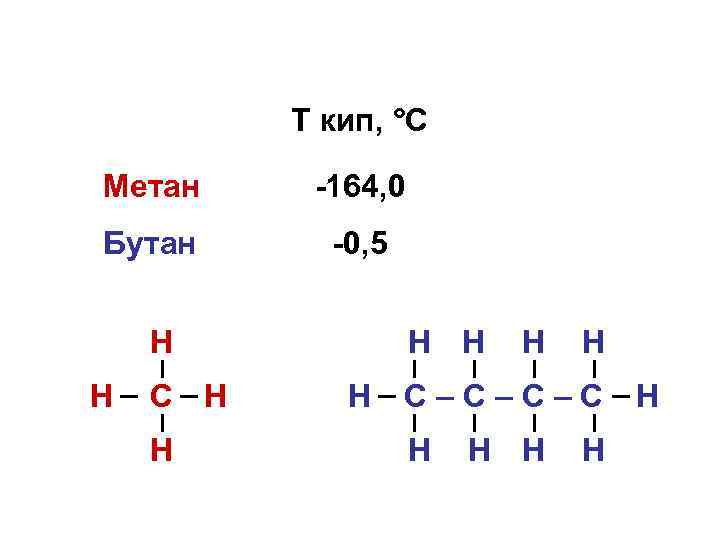 Т кип, °С Метан -164, 0 Бутан -0, 5 Н Н С Н Н Н Н С–С–С–С Н Н Н
Т кип, °С Метан -164, 0 Бутан -0, 5 Н Н С Н Н Н Н С–С–С–С Н Н Н
 Т кип, °С Йод J 2 165 106 электронов Хлор Cl 2 -35 34 электрона
Т кип, °С Йод J 2 165 106 электронов Хлор Cl 2 -35 34 электрона
 Вандерваальсовы силы обуславливают также связывающее взаимодействие между соседними слоями в кристаллах со слоистой структурой, как в графите или йодиде кадмия.
Вандерваальсовы силы обуславливают также связывающее взаимодействие между соседними слоями в кристаллах со слоистой структурой, как в графите или йодиде кадмия.


