Lektsiya_yak_-an_-anion.pptx
- Количество слайдов: 17
 Лекція Тема: Якісний аналіз аніонів. План: 1. Класифікація аніонів. 2. Реакції аніонів І аналітичної групи; 3. Реакції аніонів ІІ аналітичної групи; 4. Реакції аніонів ІІІ аналітичної групи; 5. Аналіз суміші аніонів.
Лекція Тема: Якісний аналіз аніонів. План: 1. Класифікація аніонів. 2. Реакції аніонів І аналітичної групи; 3. Реакції аніонів ІІ аналітичної групи; 4. Реакції аніонів ІІІ аналітичної групи; 5. Аналіз суміші аніонів.
 За окисно-відновними властивостями аніони поділяють на: • - аніони-окисники, в яких елемент має вищий ступінь окиснення (Cr. O 42 -, Сl. O 4 -, NО 3 -); • – аніони-відновники, які містять хімічний елемент з мінімальним ступенем окиснення (С 1 -, Br-, S 2 -); • – нейтральні аніони не виявляють ні окисних, ні відновних властивостей, наприклад СО 32 -, РO 43 -, SO 42 -. Але іони SO 42 - у концентрованій сульфатній кислоті можуть проявляти властивості окисника.
За окисно-відновними властивостями аніони поділяють на: • - аніони-окисники, в яких елемент має вищий ступінь окиснення (Cr. O 42 -, Сl. O 4 -, NО 3 -); • – аніони-відновники, які містять хімічний елемент з мінімальним ступенем окиснення (С 1 -, Br-, S 2 -); • – нейтральні аніони не виявляють ні окисних, ні відновних властивостей, наприклад СО 32 -, РO 43 -, SO 42 -. Але іони SO 42 - у концентрованій сульфатній кислоті можуть проявляти властивості окисника.
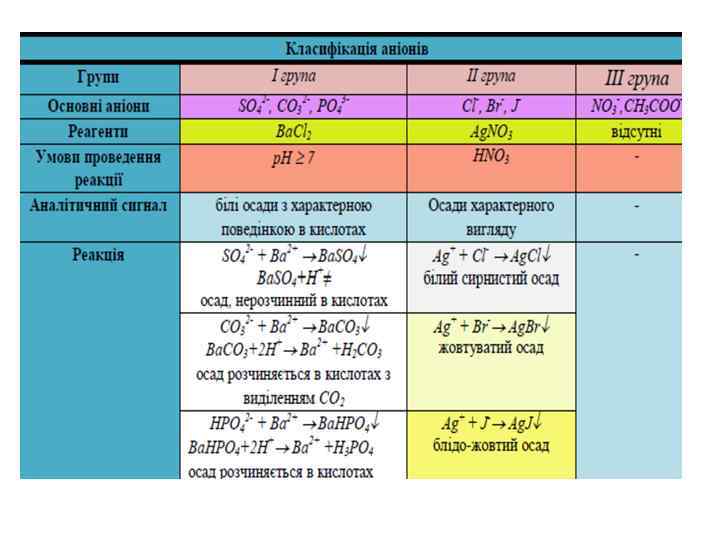
 І група аніонів • - солі барію у воді нерозчиняються: SО 42 -, SO 32 -, CО 2 -, РО 3 -, S O 2 -, С О 2 -, В О 2 -, IO -, 3 4 2 3 2 4 4 7 4 3 3 -, As. O 3 -, F-, Cr. O 2 - і Сr О 2 -, а також деякі As. O 4 3 4 2 7 аніони органічних кислот: тартрат-аніони C 4 H 4 O 62 -, цитрат-аніони C 6 H 5 O 73 -. • Аніони I аналітичної групи утворюють нерозчинні у воді осади барієвих солей, які розчинні в кислотах, за винятком сульфату барію. Тому осадження аніонів I аналітичної групи проводять у нейтральному або слаболужному середовищі.
І група аніонів • - солі барію у воді нерозчиняються: SО 42 -, SO 32 -, CО 2 -, РО 3 -, S O 2 -, С О 2 -, В О 2 -, IO -, 3 4 2 3 2 4 4 7 4 3 3 -, As. O 3 -, F-, Cr. O 2 - і Сr О 2 -, а також деякі As. O 4 3 4 2 7 аніони органічних кислот: тартрат-аніони C 4 H 4 O 62 -, цитрат-аніони C 6 H 5 O 73 -. • Аніони I аналітичної групи утворюють нерозчинні у воді осади барієвих солей, які розчинні в кислотах, за винятком сульфату барію. Тому осадження аніонів I аналітичної групи проводять у нейтральному або слаболужному середовищі.
 ІІ група аніонів • – солі срібла не розчиняються у воді й нітратній кислоті: Cl-, Br-, I-, SCN-, C 6 H 5 COO- (бензоат-аніон). • Аніони I групи також утворюють осади солей срібла, але ці осади розчинні в нітратній кислоті, тому в присутності HNO 3 осадження I групи не відбувається.
ІІ група аніонів • – солі срібла не розчиняються у воді й нітратній кислоті: Cl-, Br-, I-, SCN-, C 6 H 5 COO- (бензоат-аніон). • Аніони I групи також утворюють осади солей срібла, але ці осади розчинні в нітратній кислоті, тому в присутності HNO 3 осадження I групи не відбувається.
 III група аніонів • солі барію і срібла розчинні у воді: NO 3 -, NO 2 -, СН 3 СОО-, Вr. О 3 -, Cl. O 4 -, саліцилатаніони. • Загального групового реагенту ці аніони не мають. • Аніони III групи у розчині безбарвні.
III група аніонів • солі барію і срібла розчинні у воді: NO 3 -, NO 2 -, СН 3 СОО-, Вr. О 3 -, Cl. O 4 -, саліцилатаніони. • Загального групового реагенту ці аніони не мають. • Аніони III групи у розчині безбарвні.
 Реакції аніонів І аналітичної групи • Реакції сульфат-аніонів • • 1. SO 42 -+ Ba 2+ = Ba. SO 4↓ (білий осад) 2. SO 4 2 -+ Pb 2+ = Pb. SO 4↓ (білий осад) • • Pb. SO 4 + 4 Na. OH = Na 2[Pb(OH)4] + Na 2 SO 4 Pb. SO 4 + 4 CH 3 COONH 4 = (NH 4)2[Pb(CH 3 COO)4] + (NH 4)2 SO 4 Реакції сульфіт-аніонів 1. SO 32 -+ 2 H+ = H 2 SO 3→ SO 2↑ + H 2 O SO 2 + I 2 + 2 H 2 O = H 2 SO 4 + 2 HI (знебарвлення) 5 SO 2 + 2 KMn. O 4 + 2 H 2 O = K 2 SO 4 + 2 Mn. SO 4+ 2 H 2 SO 4 2. SO 32 -+ Ва 2+ = Ва. SO 3↓ • Ba. SO 3 + 2 HCl = H 2 SO 3 + Ba. Cl 2 • H 2 SO 3 = SO 2↑ + H 2 O 3. Дія окисників. 5 K 2 SO 3 + 2 KMn. O 4 +3 H 2 SO 4 = 6 K 2 SO 4 + 2 Mn. SO 4 + 3 H 2 O 4. Дія відновників. Na 2 SO 3 + 3 Zn + 8 HCl= 2 Na. Cl + H 2 S+3 Zn. Cl 2+3 H 2 O 5. SO 32 -+ 2 Н 2 S + 2 Н+ = 3 S ↓+ ЗН 2 O. 6. Дія органічних барвників. Фуксин і малахітовий зелений знебарвлюються нейтральними розчинами сульфітів.
Реакції аніонів І аналітичної групи • Реакції сульфат-аніонів • • 1. SO 42 -+ Ba 2+ = Ba. SO 4↓ (білий осад) 2. SO 4 2 -+ Pb 2+ = Pb. SO 4↓ (білий осад) • • Pb. SO 4 + 4 Na. OH = Na 2[Pb(OH)4] + Na 2 SO 4 Pb. SO 4 + 4 CH 3 COONH 4 = (NH 4)2[Pb(CH 3 COO)4] + (NH 4)2 SO 4 Реакції сульфіт-аніонів 1. SO 32 -+ 2 H+ = H 2 SO 3→ SO 2↑ + H 2 O SO 2 + I 2 + 2 H 2 O = H 2 SO 4 + 2 HI (знебарвлення) 5 SO 2 + 2 KMn. O 4 + 2 H 2 O = K 2 SO 4 + 2 Mn. SO 4+ 2 H 2 SO 4 2. SO 32 -+ Ва 2+ = Ва. SO 3↓ • Ba. SO 3 + 2 HCl = H 2 SO 3 + Ba. Cl 2 • H 2 SO 3 = SO 2↑ + H 2 O 3. Дія окисників. 5 K 2 SO 3 + 2 KMn. O 4 +3 H 2 SO 4 = 6 K 2 SO 4 + 2 Mn. SO 4 + 3 H 2 O 4. Дія відновників. Na 2 SO 3 + 3 Zn + 8 HCl= 2 Na. Cl + H 2 S+3 Zn. Cl 2+3 H 2 O 5. SO 32 -+ 2 Н 2 S + 2 Н+ = 3 S ↓+ ЗН 2 O. 6. Дія органічних барвників. Фуксин і малахітовий зелений знебарвлюються нейтральними розчинами сульфітів.
 • • • Реакції тіосульфат-аніонів 1. S 2 O 32 -+ 2 H+ = H 2 S 2 O 3 → SO 2 + S↓ + H 2 O 2. 2 Ag+ + S 2 O 32 -= Ag 2 S 2 O 3, • Ag 2 S 2 O 3↓ + H 2 O = Ag 2 S↓ + H 2 SO 4 3. S 2 O 32 -+ Ba 2+ = Ba. S 2 O 3↓ • Ba. S 2 O 3↓ + 2 HCl = Ba. Cl 2 + SO 2 ↑+ S↓ + H 2 O 4. 2 Na 2 S 2 O 3 + I 2 = Na 2 S 4 O 6 + 2 Na. I • Реакції карбонат-аніонів 1. CO 32 -+ 2 H+ = H 2 CO 3 → CO 2↑ + H 2 O • Ca(OH)2 + CO 2 = Ca. CO 3 ↓+ H 2 O • 2. CO 32 -+ Mg 2+ = Mg. CO 3 ↓ • 3. CO 32 -+ Ba 2+ = Ba. CO 3, ↓ • Ba. CO 3 + 2 H+= CO 2↑ + H 2 O + Ba 2+ • Ba. CO 3 + 2 NH 4 Cl = Ba. Cl 2 + 2 NH 3 + H 2 O + CO 2↑
• • • Реакції тіосульфат-аніонів 1. S 2 O 32 -+ 2 H+ = H 2 S 2 O 3 → SO 2 + S↓ + H 2 O 2. 2 Ag+ + S 2 O 32 -= Ag 2 S 2 O 3, • Ag 2 S 2 O 3↓ + H 2 O = Ag 2 S↓ + H 2 SO 4 3. S 2 O 32 -+ Ba 2+ = Ba. S 2 O 3↓ • Ba. S 2 O 3↓ + 2 HCl = Ba. Cl 2 + SO 2 ↑+ S↓ + H 2 O 4. 2 Na 2 S 2 O 3 + I 2 = Na 2 S 4 O 6 + 2 Na. I • Реакції карбонат-аніонів 1. CO 32 -+ 2 H+ = H 2 CO 3 → CO 2↑ + H 2 O • Ca(OH)2 + CO 2 = Ca. CO 3 ↓+ H 2 O • 2. CO 32 -+ Mg 2+ = Mg. CO 3 ↓ • 3. CO 32 -+ Ba 2+ = Ba. CO 3, ↓ • Ba. CO 3 + 2 H+= CO 2↑ + H 2 O + Ba 2+ • Ba. CO 3 + 2 NH 4 Cl = Ba. Cl 2 + 2 NH 3 + H 2 O + CO 2↑
 • Реакції фосфат-аніонів • 1. 3 Ag+ + PO 43 -= Ag 3 PO 4↓ (жовтий осад) • Ag 3 PO 4 + 3 H+ = 3 Ag+ + H 3 PO 4 • Ag 3 PO 4 + 6 NH 3 = 3[Ag(NH 3)2]+ + PO 43 • 2. HPO 42 -+ NH 3 + Mg 2+ = Mg. NH 4 PO 4↓ • Реакції оксалат-аніонів • 1. C 2 O 42 -+ Ca 2+ = Ca. C 2 O 4 • Ca. C 2 O 4 + 2 H+ = Ca 2+ + H 2 C 2 O 4 • (крім ацетатної к-ти) • 2. C 2 O 42 -+ Ba 2+ = Ba. C 2 O 4 • Ba. C 2 O 4 + 2 H+= H 2 C 2 O 4 + Ba 2+ • 3. 2 Mn. O 4 - + 5 C 2 O 42 -+ 16 H+ = 10 CO 2 + 2 Mn 2+ + 8 H 2 O • (знебарвлення р-ну)
• Реакції фосфат-аніонів • 1. 3 Ag+ + PO 43 -= Ag 3 PO 4↓ (жовтий осад) • Ag 3 PO 4 + 3 H+ = 3 Ag+ + H 3 PO 4 • Ag 3 PO 4 + 6 NH 3 = 3[Ag(NH 3)2]+ + PO 43 • 2. HPO 42 -+ NH 3 + Mg 2+ = Mg. NH 4 PO 4↓ • Реакції оксалат-аніонів • 1. C 2 O 42 -+ Ca 2+ = Ca. C 2 O 4 • Ca. C 2 O 4 + 2 H+ = Ca 2+ + H 2 C 2 O 4 • (крім ацетатної к-ти) • 2. C 2 O 42 -+ Ba 2+ = Ba. C 2 O 4 • Ba. C 2 O 4 + 2 H+= H 2 C 2 O 4 + Ba 2+ • 3. 2 Mn. O 4 - + 5 C 2 O 42 -+ 16 H+ = 10 CO 2 + 2 Mn 2+ + 8 H 2 O • (знебарвлення р-ну)
 • Реакції арсенат-аніонів • • 1. As. O 43 - + 3 Ag+ = Ag 3 As. O 4↓ (коричневий ) • Ag 3 As. O 4 + H+ = 3 Ag+ + H 3 As. O 4 • Ag 3 As. O 4 + 6 NH 3 = 3[Ag(NH 3)2]+ + As. O 432. 2 As. O 43 -+ 3 Ba 2+ = Ba 3(As. O 4)2↓ (білий) • Ba 3(As. O 4)2+ 6 H+ = 2 H 3 As. O 4 + 3 Ba 2+ 3. As. O 43 - + Mg 2+ + NH 4+ = Mg. NH 4 As. O 4↓ (білий) 4. As. O 43 -+ 2 H+ + 2 I- = As. O 33 -+ H 2 O + I 2 (забарвлює р-н хлороформу у фіолетовий колір) • Реакція арсеніт-аніонів • • • 1. As. O 33 -+ 3 H 2 S = As 2 S 3↓+ 6 H 2 O • Осад не розчиняється в HCl, • As 2 S 3 + 3 H 2 O + 6 NH 3 = (NH 4)3 As. O 3 + (NH 4)3 As. S 3 2. 3 Ag+ + As. O 33 -= Ag 3 As. O 3↓(жовтого кольору) • Ag 3 As. O 3 + 3 HNO 3 = 3 Ag. NO 3 + H 3 As. O 3 • Ag 3 As. O 3 + 6 NH 3 = [Ag(NH 3)2]3 As. O 3 3. As. O 33 -+ 2 OH-+ I 2 = As. O 43 -+ H 2 O + 2 I- (знебарвлення розчину йоду)
• Реакції арсенат-аніонів • • 1. As. O 43 - + 3 Ag+ = Ag 3 As. O 4↓ (коричневий ) • Ag 3 As. O 4 + H+ = 3 Ag+ + H 3 As. O 4 • Ag 3 As. O 4 + 6 NH 3 = 3[Ag(NH 3)2]+ + As. O 432. 2 As. O 43 -+ 3 Ba 2+ = Ba 3(As. O 4)2↓ (білий) • Ba 3(As. O 4)2+ 6 H+ = 2 H 3 As. O 4 + 3 Ba 2+ 3. As. O 43 - + Mg 2+ + NH 4+ = Mg. NH 4 As. O 4↓ (білий) 4. As. O 43 -+ 2 H+ + 2 I- = As. O 33 -+ H 2 O + I 2 (забарвлює р-н хлороформу у фіолетовий колір) • Реакція арсеніт-аніонів • • • 1. As. O 33 -+ 3 H 2 S = As 2 S 3↓+ 6 H 2 O • Осад не розчиняється в HCl, • As 2 S 3 + 3 H 2 O + 6 NH 3 = (NH 4)3 As. O 3 + (NH 4)3 As. S 3 2. 3 Ag+ + As. O 33 -= Ag 3 As. O 3↓(жовтого кольору) • Ag 3 As. O 3 + 3 HNO 3 = 3 Ag. NO 3 + H 3 As. O 3 • Ag 3 As. O 3 + 6 NH 3 = [Ag(NH 3)2]3 As. O 3 3. As. O 33 -+ 2 OH-+ I 2 = As. O 43 -+ H 2 O + 2 I- (знебарвлення розчину йоду)
 • • Реакції хромат-аніонів і дихромат-аніонів 1. Cr. O 42 -+ Ba 2+ = Ba. Cr. O 4↓ (жовтий осад ) 2. Cr 2 O 72 -+ 2 Ba 2+ + H 2 O = 2 Ba. Cr. O 4↓+ 2 H+ 3. Cr 2 O 72 -+ 14 H+ + 6 I-= 2 Cr 3+ + 7 H 2 O + 3 I 2 • Реакції силікат-аніонів 1. Si. O 32 -+ Ba 2+ = Ba. Si. O 3 ↓ • Осад розкладається під дією кислот і утворює осад змінного складу n. Si. O 2·m. H 2 O (H 2 Si. O 3): 2. Na 2 Si. O 3 + 2 NH 4 Cl = H 2 Si. O 3↓ + 2 NH 3 + 2 Na. Cl • Реакція фторид-аніонів 1. Ba 2+ + 2 F―= Ba. F 2↓ (білий осад) • Ba. F 2 + 2 HCl = Ba. Cl 2 + 2 HF 2. Ca. F 2 + H 2 SO 4 = Ca. SO 4 + 2 HF↑ • Si. O 2 (скло пробірок)+ 4 HF = Si. F 4↑+ 2 H 2 O • Si. F 4 + 3 H 2 O = H 2 Si. O 3 + 4 HF
• • Реакції хромат-аніонів і дихромат-аніонів 1. Cr. O 42 -+ Ba 2+ = Ba. Cr. O 4↓ (жовтий осад ) 2. Cr 2 O 72 -+ 2 Ba 2+ + H 2 O = 2 Ba. Cr. O 4↓+ 2 H+ 3. Cr 2 O 72 -+ 14 H+ + 6 I-= 2 Cr 3+ + 7 H 2 O + 3 I 2 • Реакції силікат-аніонів 1. Si. O 32 -+ Ba 2+ = Ba. Si. O 3 ↓ • Осад розкладається під дією кислот і утворює осад змінного складу n. Si. O 2·m. H 2 O (H 2 Si. O 3): 2. Na 2 Si. O 3 + 2 NH 4 Cl = H 2 Si. O 3↓ + 2 NH 3 + 2 Na. Cl • Реакція фторид-аніонів 1. Ba 2+ + 2 F―= Ba. F 2↓ (білий осад) • Ba. F 2 + 2 HCl = Ba. Cl 2 + 2 HF 2. Ca. F 2 + H 2 SO 4 = Ca. SO 4 + 2 HF↑ • Si. O 2 (скло пробірок)+ 4 HF = Si. F 4↑+ 2 H 2 O • Si. F 4 + 3 H 2 O = H 2 Si. O 3 + 4 HF
 Реакції аніонів ІІ аналітичної групи • Реакції хлорид-аніонів • 1. Cl― + Ag+ = Ag. Cl↓ (білий) • Осад розчиняється в розчині амоніаку: • Ag. Cl + 2 NH 3 = [Ag(NH 3)2]Cl • Реакції бромід-аніонів • 1. Br- + Ag+ = Ag. Br↓ (жовтий осад) • Осад погано розчиняється в розчині амоніаку, • Ag. Br + 2 Na 2 S 2 O 3 = Na 3[Ag(S 2 O 3)2] + Na. Br • 2. 2 КBr + Cl 2 = Br 2 + 2 КCl (забарвлює шар органічного р-ка у бурий колір)
Реакції аніонів ІІ аналітичної групи • Реакції хлорид-аніонів • 1. Cl― + Ag+ = Ag. Cl↓ (білий) • Осад розчиняється в розчині амоніаку: • Ag. Cl + 2 NH 3 = [Ag(NH 3)2]Cl • Реакції бромід-аніонів • 1. Br- + Ag+ = Ag. Br↓ (жовтий осад) • Осад погано розчиняється в розчині амоніаку, • Ag. Br + 2 Na 2 S 2 O 3 = Na 3[Ag(S 2 O 3)2] + Na. Br • 2. 2 КBr + Cl 2 = Br 2 + 2 КCl (забарвлює шар органічного р-ка у бурий колір)
 • Реакції йодид-аніонів • 1. І- + Ag+ = AgІ↓ (жовтий осад) • AgІ + 2 Na 2 S 2 O 3 = Na 3[Ag(S 2 O 3)2] + NaІ • AgІ + 2 Na. CN = Na[Ag(CN)2] + NaІ • Осад не розчиняється у розчині амоніаку • 2. 2 Na. I + 2 Na. NO 2 + 2 H 2 SO 4 = I 2 + 2 NO + 2 Na 2 SO 4 + 2 H 2 O • 3. р-ція “золотого дощу” • I―+ Pb 2+ = Pb. I 2↓ • Реакції сульфід-аніонів • 1. S 2 -+ 2 Ag + = Ag 2 S↓ (чорний осад) • 2. S 2 - + Cd 2+ = Cd. S↓ (жовтий осад) • 3. Na 2 S + 2 HCl = 2 Na. Cl + H 2 S↑ • H 2 S + Pb(CH 3 COO)2 = Pb. S↓ + 2 CH 3 COOH (почорніння паперу) • 4. Na 2 S + Na 2[Fe(CN)5 NO] = Na 4[Fe(CN)5 NOS] (червоно • фіолетовеий)
• Реакції йодид-аніонів • 1. І- + Ag+ = AgІ↓ (жовтий осад) • AgІ + 2 Na 2 S 2 O 3 = Na 3[Ag(S 2 O 3)2] + NaІ • AgІ + 2 Na. CN = Na[Ag(CN)2] + NaІ • Осад не розчиняється у розчині амоніаку • 2. 2 Na. I + 2 Na. NO 2 + 2 H 2 SO 4 = I 2 + 2 NO + 2 Na 2 SO 4 + 2 H 2 O • 3. р-ція “золотого дощу” • I―+ Pb 2+ = Pb. I 2↓ • Реакції сульфід-аніонів • 1. S 2 -+ 2 Ag + = Ag 2 S↓ (чорний осад) • 2. S 2 - + Cd 2+ = Cd. S↓ (жовтий осад) • 3. Na 2 S + 2 HCl = 2 Na. Cl + H 2 S↑ • H 2 S + Pb(CH 3 COO)2 = Pb. S↓ + 2 CH 3 COOH (почорніння паперу) • 4. Na 2 S + Na 2[Fe(CN)5 NO] = Na 4[Fe(CN)5 NOS] (червоно • фіолетовеий)
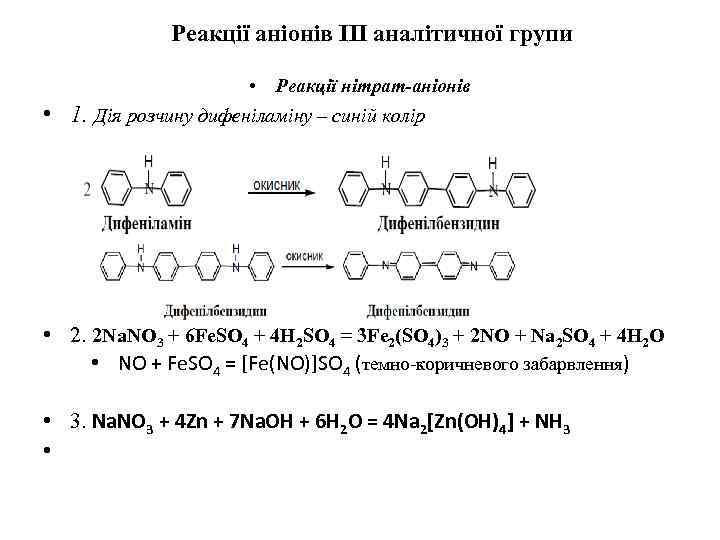 Реакції аніонів ІІІ аналітичної групи • Реакції нітрат-аніонів • 1. Дія розчину дифеніламіну – синій колір • 2. 2 Na. NO 3 + 6 Fe. SO 4 + 4 H 2 SO 4 = 3 Fe 2(SO 4)3 + 2 NO + Na 2 SO 4 + 4 H 2 O • NO + Fe. SO 4 = [Fe(NO)]SO 4 (темно-коричневого забарвлення) • 3. Na. NO 3 + 4 Zn + 7 Na. OH + 6 H 2 O = 4 Na 2[Zn(OH)4] + NH 3 •
Реакції аніонів ІІІ аналітичної групи • Реакції нітрат-аніонів • 1. Дія розчину дифеніламіну – синій колір • 2. 2 Na. NO 3 + 6 Fe. SO 4 + 4 H 2 SO 4 = 3 Fe 2(SO 4)3 + 2 NO + Na 2 SO 4 + 4 H 2 O • NO + Fe. SO 4 = [Fe(NO)]SO 4 (темно-коричневого забарвлення) • 3. Na. NO 3 + 4 Zn + 7 Na. OH + 6 H 2 O = 4 Na 2[Zn(OH)4] + NH 3 •
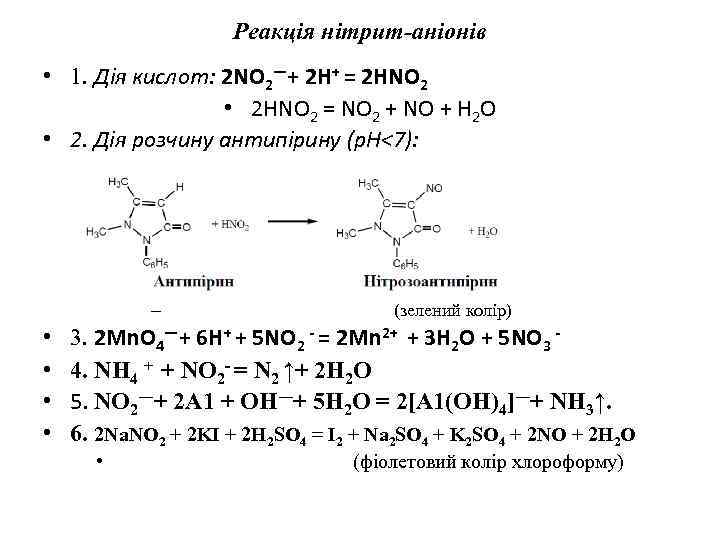 Реакція нітрит-аніонів • 1. Дія кислот: 2 NO 2―+ 2 H+ = 2 HNO 2 • 2 HNO 2 = NO 2 + NO + H 2 O • 2. Дія розчину антипірину (р. Н<7): – • • (зелений колір) 3. 2 Mn. O 4―+ 6 H+ + 5 NO 2 - = 2 Mn 2+ + 3 H 2 O + 5 NO 3 4. NH 4 + + NO 2 - = N 2 ↑+ 2 H 2 O 5. NO 2―+ 2 А 1 + ОН―+ 5 Н 2 O = 2[А 1(OH)4]―+ NH 3↑. 6. 2 Na. NO 2 + 2 KI + 2 H 2 SO 4 = I 2 + Na 2 SO 4 + K 2 SO 4 + 2 NO + 2 H 2 O • (фіолетовий колір хлороформу)
Реакція нітрит-аніонів • 1. Дія кислот: 2 NO 2―+ 2 H+ = 2 HNO 2 • 2 HNO 2 = NO 2 + NO + H 2 O • 2. Дія розчину антипірину (р. Н<7): – • • (зелений колір) 3. 2 Mn. O 4―+ 6 H+ + 5 NO 2 - = 2 Mn 2+ + 3 H 2 O + 5 NO 3 4. NH 4 + + NO 2 - = N 2 ↑+ 2 H 2 O 5. NO 2―+ 2 А 1 + ОН―+ 5 Н 2 O = 2[А 1(OH)4]―+ NH 3↑. 6. 2 Na. NO 2 + 2 KI + 2 H 2 SO 4 = I 2 + Na 2 SO 4 + K 2 SO 4 + 2 NO + 2 H 2 O • (фіолетовий колір хлороформу)
 • Аналіз суміші аніонів • 1. Попередні досліди. • Для аніонів не використовують систематичний хід аналізу. Розділення на групи використовують лише для того, щоб можна було після проведення групових реакцій переконатись у наявності чи відсутності певної група аніонів. Після цього характерними реакціями виявляють можливі аніони групи. • 2. Визначення реакції середовища у досліджуваному розчині. • Якщо реакція досліджуваного розчину кисла, то в ньому не можуть бути аніони слабких кислот, а також у розчині немає аніонів, солі яких розкладаються кислотами: CO 32 -, NO 2 -, SO 32 -, S 2 O 32 -. • 3. Виявлення аніонів окисників. • Якщо розчин, що аналізується, немає забарвлення, то роблять висновок про відсутність у такому розчині аніонів Сr. О 42 - (жовтого кольору), Сr 2 О 7 2 - (оранжевого кольору), Мn. О 4 - (червоно-фіолетового кольору).
• Аналіз суміші аніонів • 1. Попередні досліди. • Для аніонів не використовують систематичний хід аналізу. Розділення на групи використовують лише для того, щоб можна було після проведення групових реакцій переконатись у наявності чи відсутності певної група аніонів. Після цього характерними реакціями виявляють можливі аніони групи. • 2. Визначення реакції середовища у досліджуваному розчині. • Якщо реакція досліджуваного розчину кисла, то в ньому не можуть бути аніони слабких кислот, а також у розчині немає аніонів, солі яких розкладаються кислотами: CO 32 -, NO 2 -, SO 32 -, S 2 O 32 -. • 3. Виявлення аніонів окисників. • Якщо розчин, що аналізується, немає забарвлення, то роблять висновок про відсутність у такому розчині аніонів Сr. О 42 - (жовтого кольору), Сr 2 О 7 2 - (оранжевого кольору), Мn. О 4 - (червоно-фіолетового кольору).
 Аналіз суміші аніонів • 4. Виявлення аніонів-відновників. • Знебарвлення розчину перманганату калію свідчить про наявність одного або кількох аніонів-відновників: S 2 -, SO 3 2 -, S 2 О 32 -, NО 2―, Аs. О 2―. • 5. Виявлення аніонів І групи. До окремої проби (р. Н=7) додають розчин барій хлориду. Випадання осаду є підтвердженням наявності аніонів цієї групи. • 6. Виявлення аніонів II групи. До 3– 5 крапель досліджуваного розчину додають розчин арґентум нітрату і спостерігають за утворенням осаду. В цю ж пробірку додають нітратну кислоту; якщо осад не розчиняється - в досліджуваному розчині є аніони II групи; коли осад повністю розчиняється - аніонів ІІ групи немає. • 7. Аніони, відсутність яких не доведено попередніми дослідами, виявляють за допомогою окремих реакцій.
Аналіз суміші аніонів • 4. Виявлення аніонів-відновників. • Знебарвлення розчину перманганату калію свідчить про наявність одного або кількох аніонів-відновників: S 2 -, SO 3 2 -, S 2 О 32 -, NО 2―, Аs. О 2―. • 5. Виявлення аніонів І групи. До окремої проби (р. Н=7) додають розчин барій хлориду. Випадання осаду є підтвердженням наявності аніонів цієї групи. • 6. Виявлення аніонів II групи. До 3– 5 крапель досліджуваного розчину додають розчин арґентум нітрату і спостерігають за утворенням осаду. В цю ж пробірку додають нітратну кислоту; якщо осад не розчиняється - в досліджуваному розчині є аніони II групи; коли осад повністю розчиняється - аніонів ІІ групи немає. • 7. Аніони, відсутність яких не доведено попередніми дослідами, виявляють за допомогою окремих реакцій.


