 Лекция: СОВМЕЩЕННЫЕ РАВНОВЕСИЯ И КОНКУРИРУЮЩИЕ ПРОЦЕССЫ РАЗНЫХ ТИПОВ
Лекция: СОВМЕЩЕННЫЕ РАВНОВЕСИЯ И КОНКУРИРУЮЩИЕ ПРОЦЕССЫ РАЗНЫХ ТИПОВ
 1. Протолитические — гетерогенные равновесия и процессы
1. Протолитические — гетерогенные равновесия и процессы
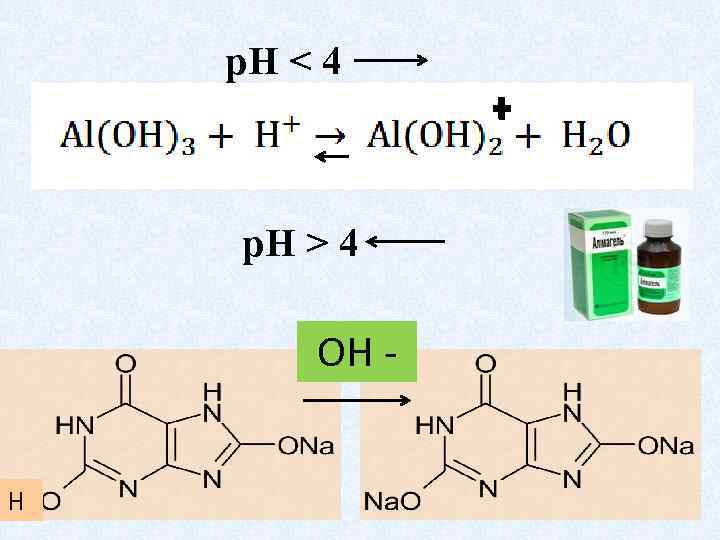 р. Н ˂ 4 р. Н > 4 ОН Н
р. Н ˂ 4 р. Н > 4 ОН Н
 2. Протолитические — лиганднообменные равновесия и процессы
2. Протолитические — лиганднообменные равновесия и процессы
 - + H+ HHb ↔ Hb p. Ka = 8, 2 - + H+ HHb. O 2↔ Hb. O 2 p. Ka = 6, 96
- + H+ HHb ↔ Hb p. Ka = 8, 2 - + H+ HHb. O 2↔ Hb. O 2 p. Ka = 6, 96
 3. Редокс — протолитические равновесия и процессы
3. Редокс — протолитические равновесия и процессы
 4. Гетерогенные — лигандообменные равновесия и процессы
4. Гетерогенные — лигандообменные равновесия и процессы
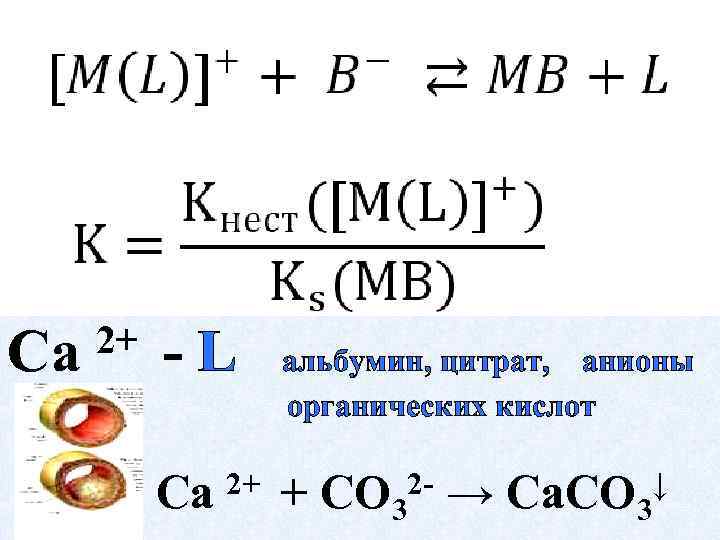 Са 2+ -L Са 2+ альбумин, цитрат, анионы органических кислот + 2 CO 3 → Са. CO 3 ↓
Са 2+ -L Са 2+ альбумин, цитрат, анионы органических кислот + 2 CO 3 → Са. CO 3 ↓
 5. Редокс - гетерогенные равновесия и процессы 3 Cu. S↓ + 8 НNO 3 → ЗСu(NO 3)2 + 3 S↓+ 2 NO↑ + 4 Н 2 О Ni. S↓ + 2 НС 1 + Н 2 О 2→Ni. С 12 +S↓+2 Н 2 О Ag +Сl (т) + ē ↔ Ag°(т) + Cl–
5. Редокс - гетерогенные равновесия и процессы 3 Cu. S↓ + 8 НNO 3 → ЗСu(NO 3)2 + 3 S↓+ 2 NO↑ + 4 Н 2 О Ni. S↓ + 2 НС 1 + Н 2 О 2→Ni. С 12 +S↓+2 Н 2 О Ag +Сl (т) + ē ↔ Ag°(т) + Cl–
 6. Редокс - лигандообменные равновесия и процессы
6. Редокс - лигандообменные равновесия и процессы
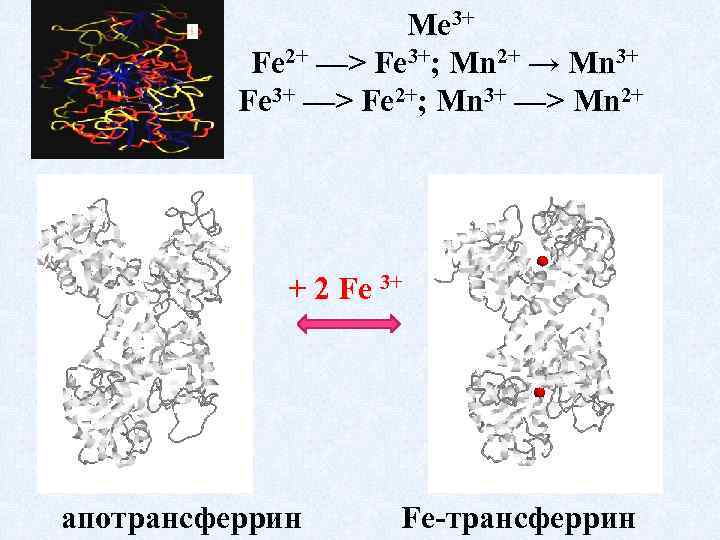 Ме 3+ Fe 2+ —> Fe 3+; Мn 2+ → Мn 3+ Fe 3+ —> Fe 2+; Мn 3+ —> Мn 2+ + 2 Fe 3+ апотрансферрин Fe-трансферрин
Ме 3+ Fe 2+ —> Fe 3+; Мn 2+ → Мn 3+ Fe 3+ —> Fe 2+; Мn 3+ —> Мn 2+ + 2 Fe 3+ апотрансферрин Fe-трансферрин
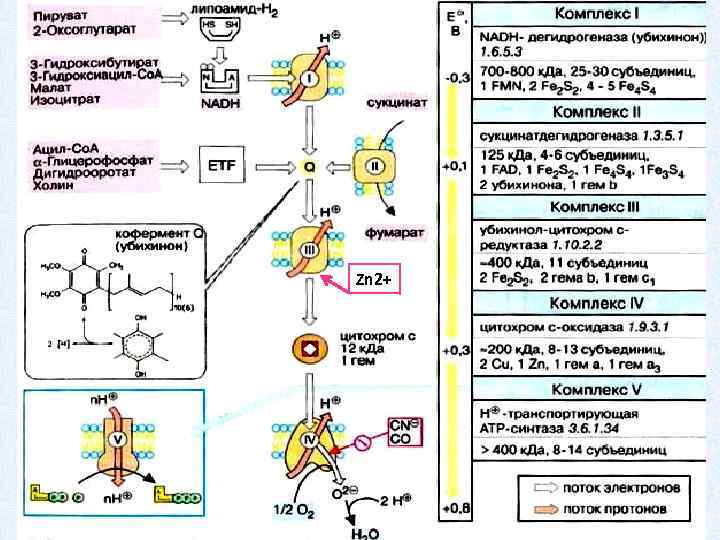 Zn 2+
Zn 2+
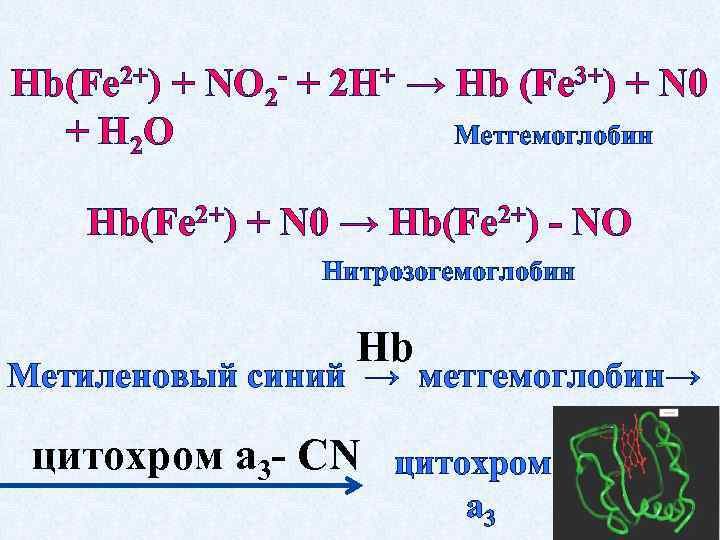 Hb(Fe 2+) + NО 2 - + 2 Н+ → Hb (Fe 3+) + N 0 + Н 2 О Метгемоглобин Hb(Fe 2+) + N 0 → Hb(Fe 2+) - NО Нитрозогемоглобин Нb Метиленовый синий → метгемоглобин→ цитохром а 3 - СN цитохром а 3
Hb(Fe 2+) + NО 2 - + 2 Н+ → Hb (Fe 3+) + N 0 + Н 2 О Метгемоглобин Hb(Fe 2+) + N 0 → Hb(Fe 2+) - NО Нитрозогемоглобин Нb Метиленовый синий → метгемоглобин→ цитохром а 3 - СN цитохром а 3
![7. Сочетание трех разнотипных процессов и более [Ag(NH 3)2]OH +ЗНСl↔Аg. Сl + 2 NН 7. Сочетание трех разнотипных процессов и более [Ag(NH 3)2]OH +ЗНСl↔Аg. Сl + 2 NН](https://present5.com/presentation/1/59762310_134169396.pdf-img/59762310_134169396.pdf-19.jpg) 7. Сочетание трех разнотипных процессов и более [Ag(NH 3)2]OH +ЗНСl↔Аg. Сl + 2 NН 4 Сl +Н 2 О Аg. Сl ↔Аg+ + Сl. Н 2 О ↔ H+ + ОНNН 4+ ↔ NH 3 + Н+ [Ag(NH 3)2]+↔ Ag+ + 2 NН 3 К = Кн ([Ag(NH 3)2]+ ) Кs (Аg. Сl ) Ka (Н 2 О ) K a 2 (NН 4+ ) Ka( Н 2 О)= Kw / c(Н 2 О ) = 1∙ 10 -4: 55, 6 М=18 ∙ 10 -16
7. Сочетание трех разнотипных процессов и более [Ag(NH 3)2]OH +ЗНСl↔Аg. Сl + 2 NН 4 Сl +Н 2 О Аg. Сl ↔Аg+ + Сl. Н 2 О ↔ H+ + ОНNН 4+ ↔ NH 3 + Н+ [Ag(NH 3)2]+↔ Ag+ + 2 NН 3 К = Кн ([Ag(NH 3)2]+ ) Кs (Аg. Сl ) Ka (Н 2 О ) K a 2 (NН 4+ ) Ka( Н 2 О)= Kw / c(Н 2 О ) = 1∙ 10 -4: 55, 6 М=18 ∙ 10 -16
 СПАСИБО ЗА ВНИМАНИЕ ! ЛЕКЦИЮ МОЖНО ПРОСМОТРЕТЬ НА САЙТЕ: www. Ustinova-essent-chem. narod 2. ru
СПАСИБО ЗА ВНИМАНИЕ ! ЛЕКЦИЮ МОЖНО ПРОСМОТРЕТЬ НА САЙТЕ: www. Ustinova-essent-chem. narod 2. ru