Лекция 6 Бор, алюминий.ppt
- Количество слайдов: 57

Лекция Р-элементы III группы B, Al, Ga, In, Tl

• Бор, В – металлоид • Алюминий, Галлий, Индий, Таллий, Al, Ga, In, Tl – металлы
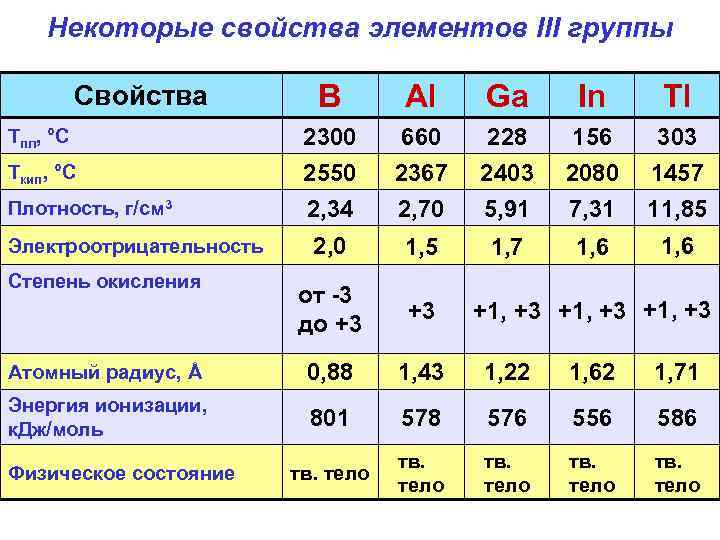
Некоторые свойства элементов III группы B Al Ga In Tl Тпл, °С 2300 660 228 156 303 Ткип, °С 2550 2, 34 2367 2, 70 2403 5, 91 2080 7, 31 1457 11, 85 2, 0 1, 5 1, 7 1, 6 от -3 до +3 +3 Атомный радиус, Å 0, 88 1, 43 1, 22 1, 62 1, 71 Энергия ионизации, к. Дж/моль 801 578 576 556 586 тв. тело тв. тело Свойства Плотность, г/см 3 Электроотрицательность Степень окисления Физическое состояние +1, +3

Электронная конфигурация и структура атомов ns 2 np 1 - 3 е- на внешней оболочке

Соединения: оксиды и гидроксиды В ряду оксидов(III) Э 2 О 3 и гидроксидов(III) Э(ОН)3 наблюдается усиление основных свойств от B к Tl: B(ОН)3 слабая кислота Al(ОН)3 амфотерное основание Tl(ОН)3 слабое основание

Бор Природный бор состоит из двух стабильных нуклидов 10 В (20%) и 11 В (80%). По твердости бор среди простых веществ занимает второе (после алмаза) место.

Кристаллы бора темно-коричневого или черного цвета, тугоплавкие, диамагнитные, обладают полупроводниковыми свойствами.

В природе бор в свободном виде не встречается. Важнейшие минералы: • бура — Na 2 B 4 O 7· 10 H 2 O, тетраборат натрия, • кернит — Na 2 B 4 O 7· 4 H 2 O и другие бораты, • сассолин (борная кислота) — H 3 BO 3. Соединения бора входят в состав вулканических и осадочных пород. Присутствует в воде озер и морей. В земной коре 1· 10– 3 % по массе (28 место), в воде океанов 4, 41· 10– 4% (4, 4 мг/л).

Получение бора Методы металлотермии • B 2 O 3 + 3 Mg = 3 Mg. O + 2 B • КBF 4 + 3 Na = 3 Na. F + KF + B • 2 Na 2 B 4 O 7 + 3 Na = B + 7 Na. BO 2

Бор высокой чистоты • Перекристаллизация, • В промышленности получают электролизом расплавленных фтороборатов или термическим разложением паров бромида бора BBr 3 на раскаленной до 1000 -1500°C танталовой проволоке в присутствии водорода: 2 BBr 3 + 3 H 2 = 2 B + 6 HBr, • Крекинг бороводородов: В 4 H 10 = 4 B + 5 H 2.

• При нагревании В окисляется кислородом, серой, азотом и фосфором: 400 -700º 4 B + 3 O 2 = 2 B 2 O 3 2 B + 3 S = B 2 S 3 1200º 2 B + N 2 = 2 BN 1000º B + P = BP

Химические свойства бора • При комнатной температуре В взаимодействует только со фтором: 2 B + 3 F 2 = 2 BF 3 • При нагревании бор реагирует с другими галогенами с образованием тригалогенидов.

• При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов: 3 Si. O 2 + 4 B = 3 Si + 2 B 2 O 3, 3 Р 2 О 5 + 10 В = 5 В 2 О 3 + 6 Р.

• В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H 3 BO 3: B + 3 HNO 3 = H 3 BO 3 + NO 2

• По отношению к воздуху и воде - устойчив, с водой реагирует только при температуре красного каления: 2 B + 3 Н 2 О = В 2 О 3 + Н 2

• С металлами образует бориды различного состава, они являются жаростойкими и химически устойчивыми соединениями. Бориды широко применяются. М + В = Мх. Ву

Бороводороды • Бораны, гидриды бора: B 2 H 6 и B 4 H 10 — газы, B 5 H 9 — жидкость, B 10 H 14 и другие — кристаллы. • Бороводороды насыщенного ряда: Вn. H 2 n+2 • Бороводороды ненасыщенного ряда: Вn. H 2 n Бороводороды ядовиты, неприятно пахнут.

Применение боранов • Перспективны для получения чистого бора, термостойких полимеров, в синтезе гидридов, карборанов и др.

Получение бороводородов • C водородом В не взаимодействует, бороводороды (бораны) различного состава получают при обработке боридов щелочных или щелочноземельных металлов кислотой или водой: Mg 3 B 2 + 6 HCl = B 2 H 6 + 3 Mg. Cl 2

Свойства бороводородов • Разлагаются: 120° 2 B 2 H 6 = B 4 H 10 + Н 2 • На воздухе самовоспламеняются: B 2 H 6 + 3 О 2= B 2 О 3 + 3 Н 2 О • Медленно реагируют с водой: B 2 H 6 + 6 Н 2 О = 2 B(ОН)3 + 6 Н 2 • Продуцируют борогидриды (боранаты) 2 Li. H + B 2 H 6 = 2 Li. BH 4

• Cоединения бора образуют трехцентровые двухэлектронные связи. Такая связь является молекулярной орбиталью, образованной тремя sp 3 -гибридизованными атомными орбиталями бора. В В В
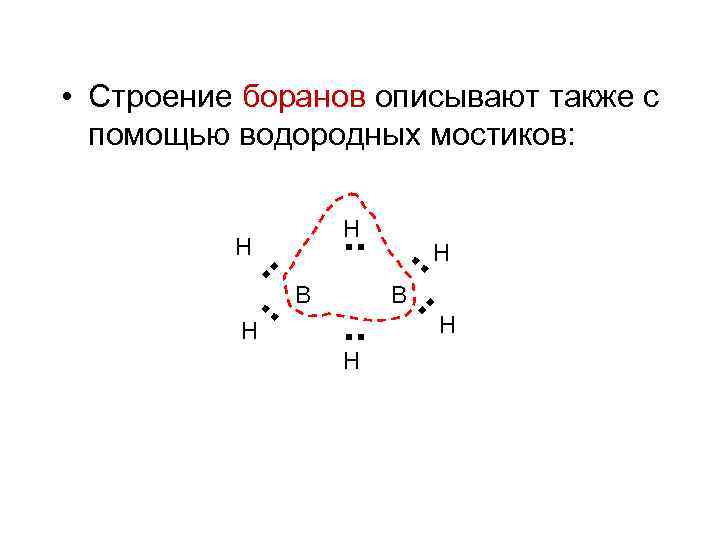
• Строение боранов описывают также с помощью водородных мостиков: . . Н Н Н . . В . . Н В . . Н Н

Оксид бора и борная кислота • Оксид бора В 2 О 3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты: В 2 О 3 + 3 Н 2 О = 2 H 3 BO 3
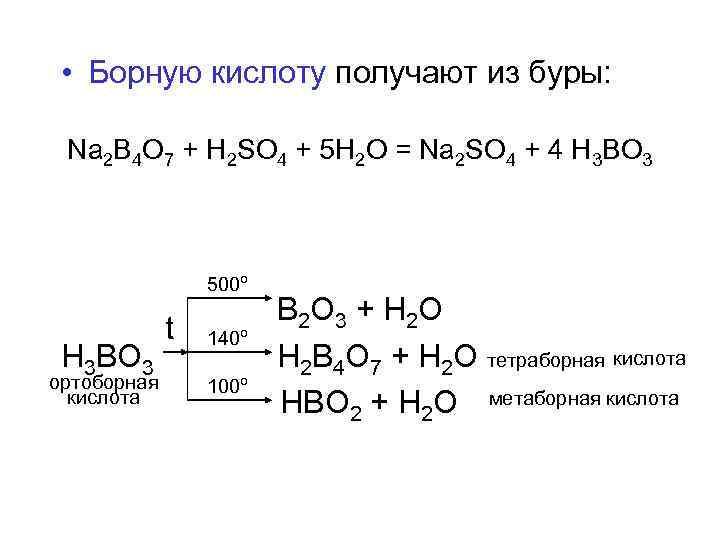
• Борную кислоту получают из буры: Na 2 B 4 O 7 + H 2 SO 4 + 5 H 2 O = Na 2 SO 4 + 4 H 3 BO 3 500º В 2 О 3 + Н 2 О t 140º H 3 BO 3 H 2 B 4 O 7 + Н 2 О тетраборная кислота ортоборная 100º кислота HBO 2 + Н 2 О метаборная кислота

• Слабокислая реакция борной кислоты в водной среде обусловлена не депротонизацией, а присоединением гидроксила воды. Борная кислота одноосновна: H 3 BO 3 + Н 2 О = H 4 BO 4 - + Н+

• При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO 33 -), а тетрабораты, например: 4 H 3 BO 3 + 2 Na. OH = Na 2 B 4 O 7 + 7 Н 2 О Na 2 B 4 O 7 + 2 Na. OH(изб) = Na. BO 2 + Н 2 О
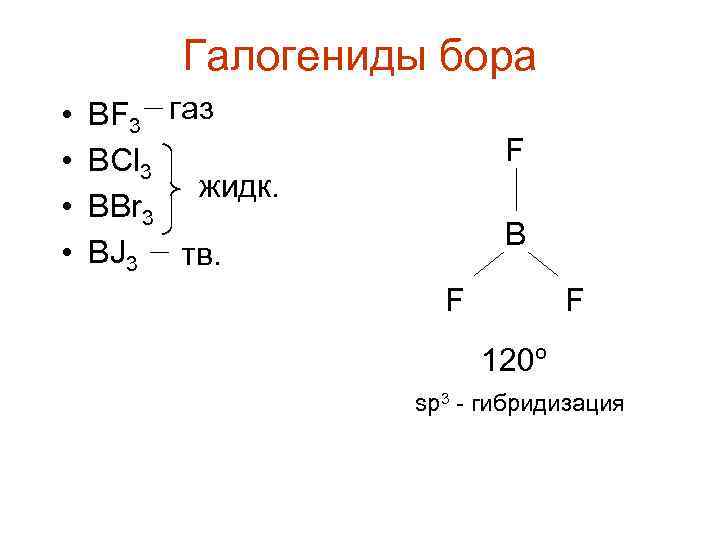
Галогениды бора • • BF 3 газ BCl 3 жидк. BBr 3 BJ 3 тв. F B F F 120º sp 3 - гибридизация

• Галогениды бора – льюисовы кислоты: BF 3 + NH 3 = BF 3 NH 3 • Взаимодействуют с водой: BCl 3 + 3 H 2 O = B(OH)3 + 3 HCl • Реакция обмена между галогенидами бора: BBr 3 + BCl 3 BBr 2 Cl + BBr. Cl 2
![BF 3 + F- = [BF 4]- BF 3 + HF = H[BF 4] BF 3 + F- = [BF 4]- BF 3 + HF = H[BF 4]](https://present5.com/presentation/126659746_100832730/image-29.jpg)
BF 3 + F- = [BF 4]- BF 3 + HF = H[BF 4] Большинство солей бесцветны и хорошо растворимы в воде

Алюминий • Типичный амфотерный элемент. • Природный алюминий состоит из одного стабильного изотопа 27 Al и радиоактивных изотопов 28 Al, 29 Al.

Простое вещество алюминий — мягкий легкий серебристо-белый металл

Характерные соединения Al • Оксид Al 2 O 3 • Гидроксид Al(OH)3 • «Катионные» соли Al(NO)3 Al 2(SO)4 и др. • «Анионные» соли алюминаты М 1 Al(OH)4 M 1 Al. O 2

Получение Al Бокситы — главное сырье при промышленном получении алюминия. В России месторождения бокситов имеются в Сибири и на Урале. 1000° Al 2 O 3 ·z. H 2 O = Al 2 O 3 + z. H 2 O

• Электролиз Al 2 O 3 проводят в расплаве криолита Na 3 Al. F 6 (температура расплава немного ниже 1000°C): 2 Al 2 O 3 4 Al + 3 O 2 Для производства 1 т алюминия чернового требуется 1, 920 т глинозёма, 0, 065 т криолита, 0, 035 т фторида алюминия, 0, 600 т анодной массы и 17 тыс. к. Вт·ч электроэнергии постоянного тока.

Химические свойства Al • Защитная поверхностная пленка на алюминии образуется на воздухе, а также, если его поместить в конц. азотную или серную кислоту. • С разбавленными горячими растворами НСl и Н 2 SO 4 алюминий активно реагирует: 6 НСl + 2 Al = 2 Al. Cl 3 + 3 H 2, 3 Н 2 SO 4 + 2 Al = Al 2(SO 4)3 + 3 H 2.

• Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка: Al 2 О 3 + 2 Na. OH + 3 H 2 O = 2 Na[Al(OH)4]. • Затем протекают реакции: 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2, Na. OH + Al(OH)3 = Na[Al(OH)4], или суммарно: 2 Al + 6 H 2 O + 2 Na. OH = Na[Al(OH)4] + 3 Н 2

• При нагревании алюминий реагирует с галогенами: 2 Al + 3 Cl 2 = 2 Al. Cl 3, 2 Al + 3 Br 2 = 2 Al. Br 3. • Взаимодействует с серой при нагревании, образуется сульфид алюминия: 2 Al + 3 S = Al 2 S 3, который легко разлагается водой: Al 2 S 3 + 6 Н 2 О = 2 Al(ОН)3 + 3 Н 2 S.

• Алюминотермия (способ получения металлов): 3 Fe 3 O 4 + 8 Al = 4 Al 2 O 3 + 9 Fe 3 Са. О + 2 Al = Al 2 О 3 + 3 Са.

Гидроксид алюминия • В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями: Al 2(SO 4)3 + 6 Na. OH = 2 Al(OH)3 + 3 Na 2 SO 4, или за счет добавления соды к раствору соли алюминия: 2 Al. Cl 3 + 3 Na 2 CO 3 + 3 H 2 O = 2 Al(OH)3 + 6 Na. Cl + 3 CO 2, а также добавлением раствора аммиака к раствору соли алюминия: Al. Cl 3 + 3 NH 3·H 2 O = Al(OH)3 + 3 H 2 O + 3 NH 4 Cl.

Свойства гидроксида алюминия • Амфотерный - растворяется в кислотах: 2 Al(OH)3 + 3 H 2 SO 4 = Al 2(SO 4)3 + 6 H 2 O • Растворяется в щелочах: Al(OH)3 + KOH = K[Al(OH)4]
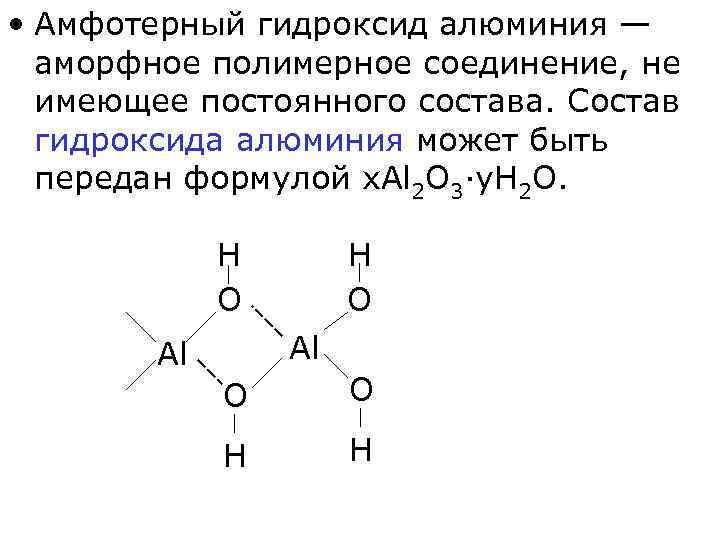
• Амфотерный гидроксид алюминия — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой x. Al 2 O 3·y. H 2 O. H O Al Al O O H H
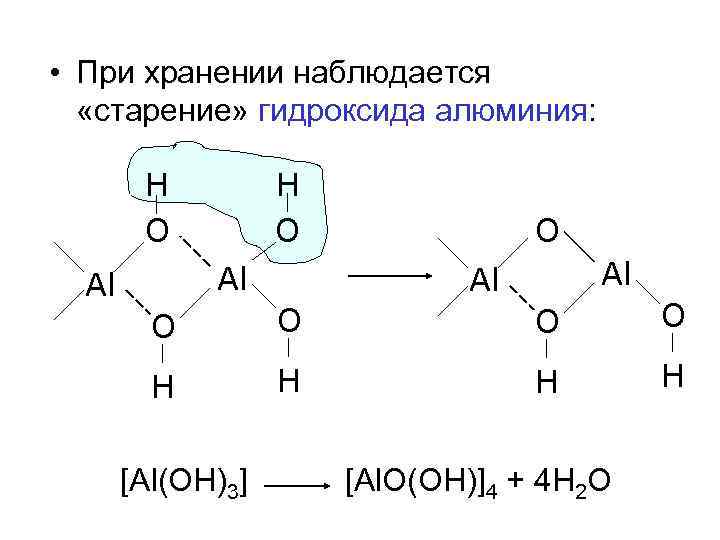
• При хранении наблюдается «старение» гидроксида алюминия: H O Al Al O O O O H H [Al(OH)3] [Al. O(OH)]4 + 4 H 2 O

Другие соединения алюминия • Алюмосиликаты x. Al 2 O 3·y. Si. O 2: аморфные и кристаллические (цеолиты). Находят широкое применение в качестве сорбентов, молекулярных сит, катализаторов.

Цеолиты Реагенты и продукты Структура цеолита Каталитическая реакция

Синтез упорядоченных мезопористых материалов на основе неорганических оксидов (Mobil, 1992) ПАВ (темплат) Соединения Si и Al Т воздух Структурированный осадок * ПАВ – цетилтриметиламмоний хлорид (бромид), C 16 H 33(CH 3)3 N+Cl- (Br-) 45

Синтез мезопористых металлосиликатов зольгель методом (РГУ нефти и газа, 2006) Золь (раствор прекурсоров и темплата) Влажный гель Ксерогель Мезопористый металлосиликат Гидролиз, гидротермальная Сушка, прокаливание обработка

Химия помогает решать экономические вопросы. Цеолиты и молекулярные сита, используемые в процессах переработки нефти, позволяют получать на 40% больше бензина с барреля чистой нефти, чем прежние катализаторы. Данные технологии позволяют только в США экономить 400 млн. баррелей нефти в год. 3 D-модель цеолитной структуры 3 D-модель структуры мезопористого материала

• Квасцы – двойные соли, имеющие общую формулу: M(I) M(III) (SO 4)2 • 12 H 2 O M(I) – Na+, K+, NH 4+ и др. M(III) – Al 3+, Cr 3+, Fe 3+

Применение бора • • Добавки при получении коррозионно устойчивых и жаропрочных сплавов. Карбиды бора (В 4 С и В 13 С 2) обладают высокой твердостью, это — хорошие абразивные материалы. Ранее их широко использовали для изготовления сверл, применяемых зубными врачами (отсюда название бормашина). Бор и его соединения — нитрид BN и другие — используются как полупроводниковые материриалы и диэлектрики. Газообразный BF используют в счетчиках тепловых нейтронов. Около 50% природных и искусственных соединений бора используют при производстве стекол (так называемые боросиликатные стекла), около 30% — при производстве моющих средств. Примерно 4 -5% соединений бора расходуется при производстве эмалей, глазурей, металлургических флюсов. В медицине как антисептические средства находят применение бура и борная кислота (в виде водно-спиртовых растворов). В быту буру или борную кислоту используют для уничтожения бытовых насекомых.

Применение Al • Чистый алюминий применяют для изготовления проволоки. • Фольга, используемой как упаковочный материал. • Основную массу алюминия используют для получения легких сплавов — дуралюмина (94% Al, 4% Cu, по 0, 5% Mg, Mn, Fe и Si), силумина (85 -90% Al, 10 -14% Si, 0, 1% Na) и др. • Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. • Алюминий применяют в производстве взрывчатых веществ. • Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию. • Бытовая посуда для нейтральных продуктов (кипячение воды).

• Оксид алюминия Al 2 O 3 – лежит в кристаллической основе большинства драгоценных камней. • Различные примеси придают Al 2 O 3 определенный цвет и свойства.

ДРАГОЦЕННЫЕ И ПОДЕЛОЧНЫЕ КАМНИ • Учение о драгоценных и поделочных камнях называется геммологией. Известно свыше 100 драгоценных и поделочных камней. • Карат = 1/5 грамма = 200 мг • Гран = ¼ карата = 50 мг

• Корунд - минерал подкласса простых оксидов, Al 2 O 3. Примеси Cr, Fe, Ti и др. Твердость 9; плотность ок. 4 г/см 3. • Наждак — смесь корунда (60 -70%) с магнетитом, гематитом и шпинелью. • Корунд - абразивный материал. Прозрачные разновидности — драгоценные камни (рубин, сапфир и др. ). Синтетический корунд с добавками Cr 3+, Fe 3+ получают в промышленных масштабах для квантовой электроники, часовой, ювелирной промышленности и др. Синтетический корунд без добавок (лейкосапфир) используют в радиоэлектронной промышленности.

• РУБИН, минерал, прозрачная разновидность корунда, окрашенная примесью Cr 3+ в розовый до густо-красного цвет. Драгоценный камень I класса. Месторождения в Бирме, Афганистане, Индии и др. Изготовляются синтетические рубины, которые используются в ювелирном деле, а также в квантовой электронике, часовой промышленности и др.

• Сапфир - минерал, голубая или синяя, окрашенная примесью Fe 3+ и Ti 4+ разновидность корунда. Драгоценный камень I класса. В ювелирном деле сапфиром называют все окрашенные прозрачные корунды, кроме красных. Получают также синтетический бесцветный сапфир, кристаллы которого используются в микроэлектронике, инфракрасной технике и др. областях.

• Основными критериями для отнесения минерала к драгоценным и поделочным служат красота (цвет, блеск, прозрачность, «игра» , опалесценция, рисунок и др. ), прочность (твердость — для сохранения качества огранки и полировки, вязкость — для устойчивости изделия и др. ).

• В 1902 Н. Вернейль во Франции впервые синтезировал рубин и сапфир. • Рубины добываются из речных россыпей в Индии, Таиланде, Кении, Танзании, Мьянме (наиболее ценные кроваво-красные камни с легким фиолетовым оттенком — «голубиная кровь» ). Цены на таиландские рубины — 5003000 дол/карат; рубины из Мьянмы стоят в несколько раз дороже. • Сапфиры добываются в Мьянме (вместе с рубинами), Таиланде, Камбодже, Шри-Ланке. Самыми ценными считаются васильковосиние сапфиры из Мьянмы, стоимость которых от 700 до 2000 дол/карат. Еще дороже ценятся звездчатые голубые сапфиры, при полировке которых кабошоном выявляется шестилучевая звезда (астеризм), обусловленная тонкоигольчатыми включениями рутила.
Лекция 6 Бор, алюминий.ppt