лекция 12 по химии, сера и ее соединения.pptx
- Количество слайдов: 21
 Лекция по химии № 12 Химия элементов VI группы главной подгруппы Сера и ее соединения.
Лекция по химии № 12 Химия элементов VI группы главной подгруппы Сера и ее соединения.
 План Общая характеристика подгруппы класса Вода. Химические и физические свойства. Вода как растворитель Сероводород. Получение. Свойства. Роль в ОВР. Серная кислота. Роль в ОВР. Сульфаты. Соединение серы +4. роль в ОВР.
План Общая характеристика подгруппы класса Вода. Химические и физические свойства. Вода как растворитель Сероводород. Получение. Свойства. Роль в ОВР. Серная кислота. Роль в ОВР. Сульфаты. Соединение серы +4. роль в ОВР.
 Строение атома ns 2 np 4 – общая электронная формула внешнего слоя. О 1 s 22 p 4 S 1 s 22 p 63 s 23 p 4 Se 1 s 22 p 63 s 23 p 63 d 104 s 24 p 4 Te 1 s 22 p 63 s 23 p 63 d 104 s 24 p 64 d 105 s 25 p 4 Сверху вниз : увеличивается радиус атома, усиливаются металлические свойства, усиливаются восстан. св. , уменьшается электро отрицательность.
Строение атома ns 2 np 4 – общая электронная формула внешнего слоя. О 1 s 22 p 4 S 1 s 22 p 63 s 23 p 4 Se 1 s 22 p 63 s 23 p 63 d 104 s 24 p 4 Te 1 s 22 p 63 s 23 p 63 d 104 s 24 p 64 d 105 s 25 p 4 Сверху вниз : увеличивается радиус атома, усиливаются металлические свойства, усиливаются восстан. св. , уменьшается электро отрицательность.
 Степени окисления кислорода О -2 -1 0 Оксиды Основания Кислоты Соли H 2 O 2 Na 2 O 2 O 3 +2 OF 2
Степени окисления кислорода О -2 -1 0 Оксиды Основания Кислоты Соли H 2 O 2 Na 2 O 2 O 3 +2 OF 2
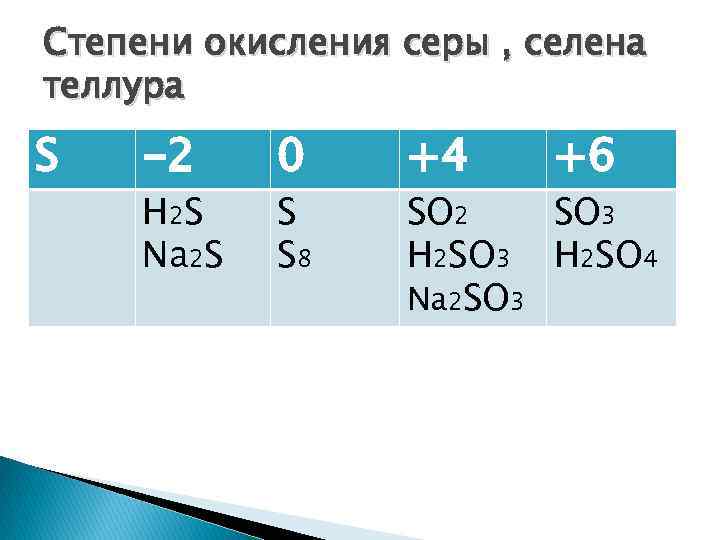 Степени окисления серы , селена теллура S -2 H 2 S Na 2 S 0 S S 8 +4 +6 SO 2 SO 3 H 2 SO 4 Na 2 SO 3
Степени окисления серы , селена теллура S -2 H 2 S Na 2 S 0 S S 8 +4 +6 SO 2 SO 3 H 2 SO 4 Na 2 SO 3
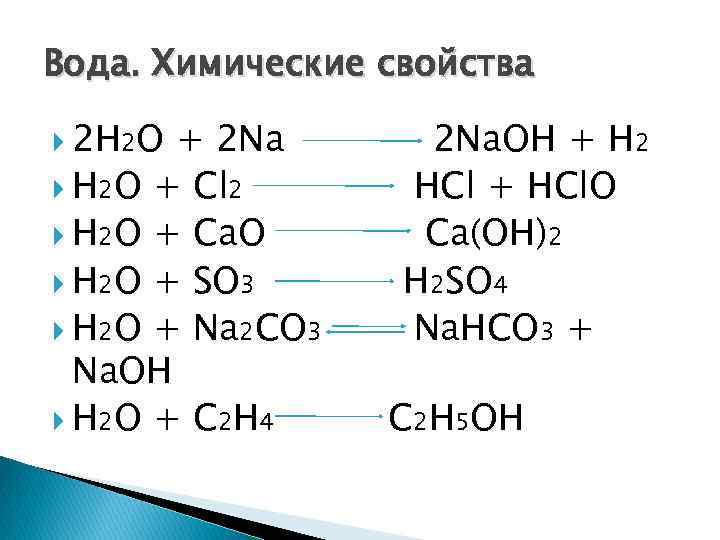 Вода. Химические свойства 2 H 2 O + 2 Na H 2 O + Cl 2 H 2 O + Ca. O H 2 O + SO 3 H 2 O + Na 2 CO 3 Na. OH H 2 O + C 2 H 4 2 Na. OH + H 2 HCl + HCl. O Ca(OH)2 H 2 SO 4 Na. HCO 3 + C 2 H 5 OH
Вода. Химические свойства 2 H 2 O + 2 Na H 2 O + Cl 2 H 2 O + Ca. O H 2 O + SO 3 H 2 O + Na 2 CO 3 Na. OH H 2 O + C 2 H 4 2 Na. OH + H 2 HCl + HCl. O Ca(OH)2 H 2 SO 4 Na. HCO 3 + C 2 H 5 OH
 Сероводород H 2 S H 2 + S H 2 S Na 2 S + 2 HCl H 2 S + 2 Na. Cl Хим. св. в ОВР - восстановитель Получение: -2 +4 0 H 2 S + SO 2 в-ль -2 S + H 2 O ок-ль 0 S -2 e S +4 0 S +4 e -2 S 4 2 1 Сероводородная кислота - слабая
Сероводород H 2 S H 2 + S H 2 S Na 2 S + 2 HCl H 2 S + 2 Na. Cl Хим. св. в ОВР - восстановитель Получение: -2 +4 0 H 2 S + SO 2 в-ль -2 S + H 2 O ок-ль 0 S -2 e S +4 0 S +4 e -2 S 4 2 1 Сероводородная кислота - слабая
 Серная кислота. Взаимодействие с Ме. 1) H 2 SO 4 разб + Me 2) взаимодейтвие концентрированной Н 2 SО 4 с металлами: H 2 SO 4 Me. SO 4 + H 2 S + Me. SO 4 + H 2 O + Me ( Li- Fe) недост. S + Me. SO 4 +H 20 правее Fe SO 2 + Me. SO 4 + H 2 O ( Li – Fe)изб.
Серная кислота. Взаимодействие с Ме. 1) H 2 SO 4 разб + Me 2) взаимодейтвие концентрированной Н 2 SО 4 с металлами: H 2 SO 4 Me. SO 4 + H 2 S + Me. SO 4 + H 2 O + Me ( Li- Fe) недост. S + Me. SO 4 +H 20 правее Fe SO 2 + Me. SO 4 + H 2 O ( Li – Fe)изб.
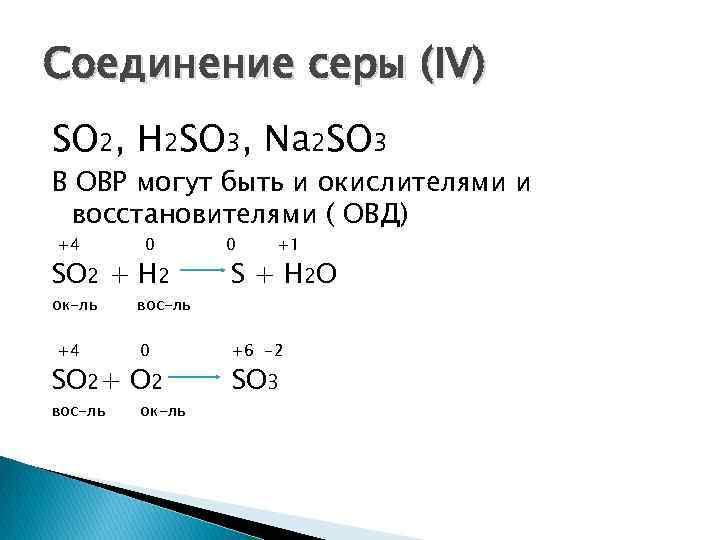 Соединение серы (IV) SO 2, H 2 SO 3, Na 2 SO 3 В ОВР могут быть и окислителями и восстановителями ( ОВД) +4 0 SO 2 + H 2 ок-ль +4 вос-ль 0 SO 2+ O 2 вос-ль ок-ль 0 +1 S + H 2 O +6 -2 SO 3
Соединение серы (IV) SO 2, H 2 SO 3, Na 2 SO 3 В ОВР могут быть и окислителями и восстановителями ( ОВД) +4 0 SO 2 + H 2 ок-ль +4 вос-ль 0 SO 2+ O 2 вос-ль ок-ль 0 +1 S + H 2 O +6 -2 SO 3
 Химия элементов V группы главной подгруппы План : Общая хар-ка подгруппы азота Аммиак. Получение. Свойства. Роль в ОВР Азотная кислота. Взаимодействие с Ме. Нитраты. Азотистая кислота. Роль в ОВР. Нитриты Биологическая роль азота и фосфора Мышьяк и его соединения. Обнаружение. Влияние на живой организм
Химия элементов V группы главной подгруппы План : Общая хар-ка подгруппы азота Аммиак. Получение. Свойства. Роль в ОВР Азотная кислота. Взаимодействие с Ме. Нитраты. Азотистая кислота. Роль в ОВР. Нитриты Биологическая роль азота и фосфора Мышьяк и его соединения. Обнаружение. Влияние на живой организм
 Строение атома ns 2 np 3 – внешний электронный слой N 1 s 22 p 3 P 1 s 22 p 63 s 23 p 3 As 1 s 22 p 63 s 23 p 63 d 104 s 24 p 3 Sb 1 s 22 p 63 s 23 p 63 d 104 s 24 p 64 d 105 s 25 p 3 Bi 1 s 22 p 63 s 23 p 63 d 104 s 24 p 64 d 104 f 145 s 25 p 65 d 10 Сверху вниз : радиус атома увеличивается, металлические свойства усиливаются , восстановительные свойства усиливаются, электротрицательность уменьшается.
Строение атома ns 2 np 3 – внешний электронный слой N 1 s 22 p 3 P 1 s 22 p 63 s 23 p 3 As 1 s 22 p 63 s 23 p 63 d 104 s 24 p 3 Sb 1 s 22 p 63 s 23 p 63 d 104 s 24 p 64 d 105 s 25 p 3 Bi 1 s 22 p 63 s 23 p 63 d 104 s 24 p 64 d 104 f 145 s 25 p 65 d 10 Сверху вниз : радиус атома увеличивается, металлические свойства усиливаются , восстановительные свойства усиливаются, электротрицательность уменьшается.
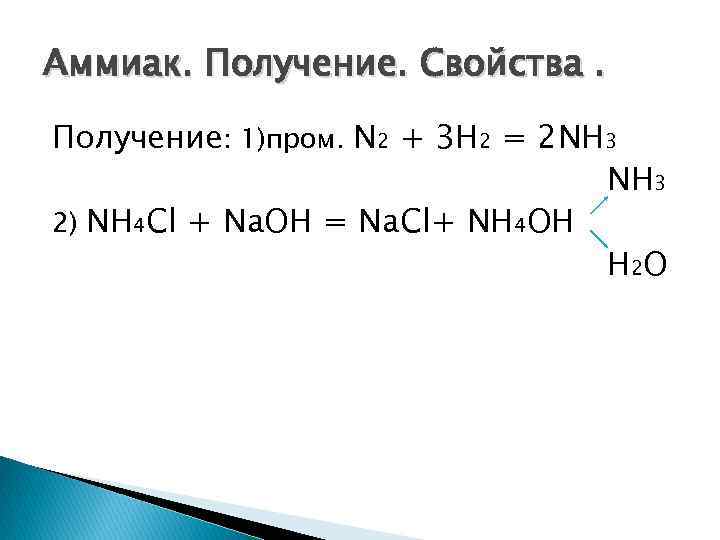 Аммиак. Получение. Свойства. Получение: 1)пром. N 2 + 3 H 2 = 2 NH 3 2) NH 4 Cl + Na. OH = Na. Cl+ NH 4 OH H 2 O
Аммиак. Получение. Свойства. Получение: 1)пром. N 2 + 3 H 2 = 2 NH 3 2) NH 4 Cl + Na. OH = Na. Cl+ NH 4 OH H 2 O
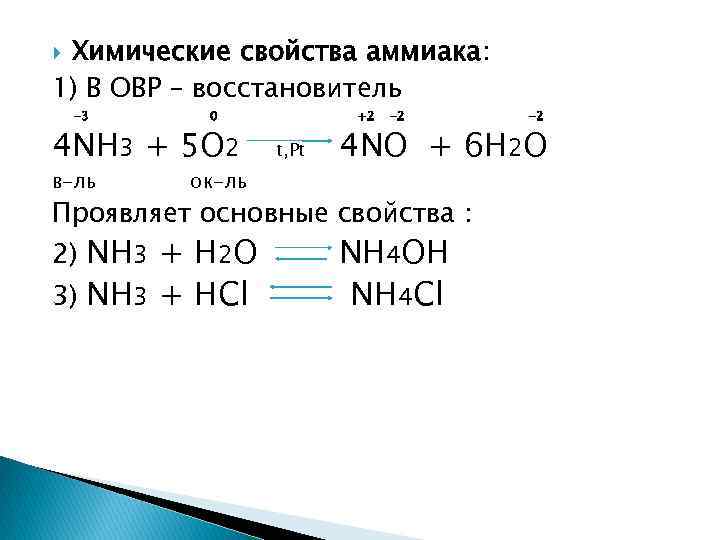 Химические свойства аммиака: 1) В ОВР – восстановитель -3 0 4 NH 3 + 5 O 2 в-ль ок-ль +2 t, Рt -2 4 NO + 6 H 2 O Проявляет основные свойства : 2) NH 3 + H 2 O 3) NH 3 + HCl -2 NH 4 OH NH 4 Cl
Химические свойства аммиака: 1) В ОВР – восстановитель -3 0 4 NH 3 + 5 O 2 в-ль ок-ль +2 t, Рt -2 4 NO + 6 H 2 O Проявляет основные свойства : 2) NH 3 + H 2 O 3) NH 3 + HCl -2 NH 4 OH NH 4 Cl
 Соединения азота. Азотная кислота Сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации смоноклинной и ромбической решётками.
Соединения азота. Азотная кислота Сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации смоноклинной и ромбической решётками.
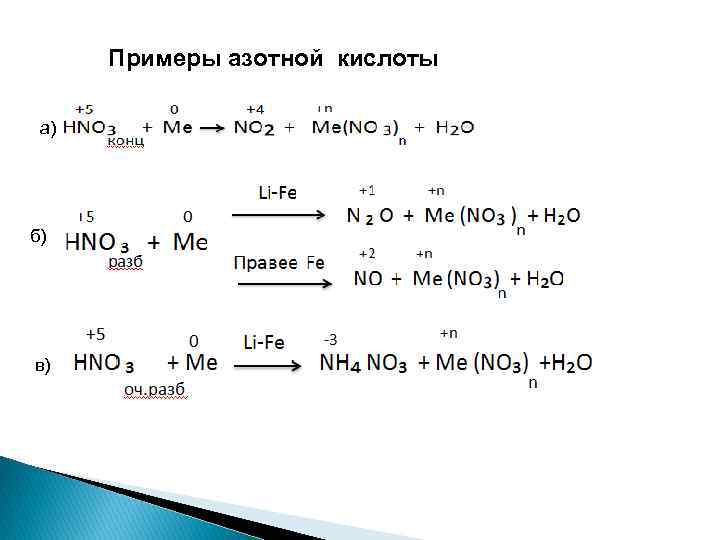 Примеры азотной кислоты а) б) в)
Примеры азотной кислоты а) б) в)
 Высококонцентрированная HNO 3 имеет бурую окраску вследствие происходящего на свету процесса разложения: HNO 3 = 2 NO 2 + 2 H 2 O - выделяется бурый газ (NO 2), кислород и вода. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении: -Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций -остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией
Высококонцентрированная HNO 3 имеет бурую окраску вследствие происходящего на свету процесса разложения: HNO 3 = 2 NO 2 + 2 H 2 O - выделяется бурый газ (NO 2), кислород и вода. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении: -Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций -остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией
 1. При взаимодействии с активными металлами : 8 Na + 10 HNO 3 разб. = 8 Na. NO 3 + N 2 O↑ + 5 H 2 O 2. Разбавленная азотная кислота, реагируя с малоактивными металлами : 3 Сu + 8 HNO 3 = 3 Cu(NO 3)2 + 2 NO↑ + 4 H 2 O 3 Ag + 4 HNO 3 = 3 Ag. NO 3 + NO↑ + 2 H 2 O 3. При взаимодействии с очень разбавленной кислотой с активными металлами : 4 Mg + 10 HNO 3 (сильно разб. ) = 4 Mg(NO 3)2 + NН 4 NO 3 + 3 H 2 O Образование NН 4 NO 3 при реакции металла с сильно разбавленной азотной кислотой объясняется взаимодействием выделяющегося аммиака с избытком HNO 3 в растворе.
1. При взаимодействии с активными металлами : 8 Na + 10 HNO 3 разб. = 8 Na. NO 3 + N 2 O↑ + 5 H 2 O 2. Разбавленная азотная кислота, реагируя с малоактивными металлами : 3 Сu + 8 HNO 3 = 3 Cu(NO 3)2 + 2 NO↑ + 4 H 2 O 3 Ag + 4 HNO 3 = 3 Ag. NO 3 + NO↑ + 2 H 2 O 3. При взаимодействии с очень разбавленной кислотой с активными металлами : 4 Mg + 10 HNO 3 (сильно разб. ) = 4 Mg(NO 3)2 + NН 4 NO 3 + 3 H 2 O Образование NН 4 NO 3 при реакции металла с сильно разбавленной азотной кислотой объясняется взаимодействием выделяющегося аммиака с избытком HNO 3 в растворе.
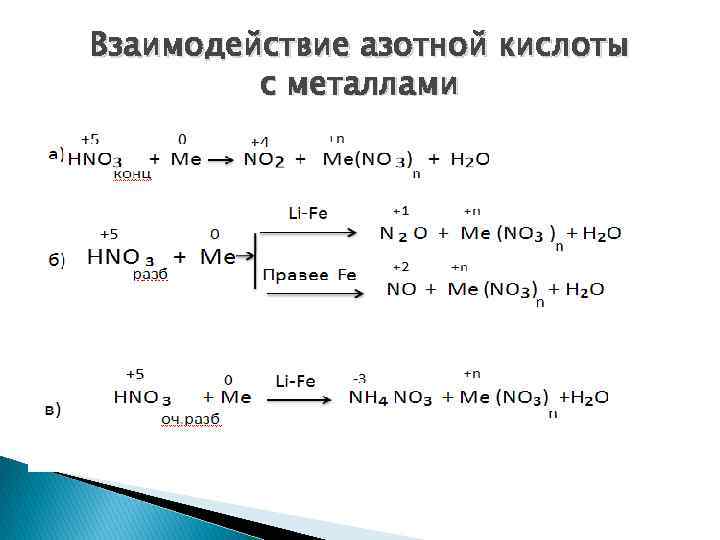 Взаимодействие азотной кислоты с металлами
Взаимодействие азотной кислоты с металлами
 Азотистая кислота HNO 2, нитриты (Na. NO 2) HNO 2 - слабая кислота HNO 2 H + NO 2 Азотистая кислота и нитриты в ОВР могут быть и окислителями и восстановителями NO 2 + в-ль H NO + … NO 2 + ок-ль NO 3 + …
Азотистая кислота HNO 2, нитриты (Na. NO 2) HNO 2 - слабая кислота HNO 2 H + NO 2 Азотистая кислота и нитриты в ОВР могут быть и окислителями и восстановителями NO 2 + в-ль H NO + … NO 2 + ок-ль NO 3 + …
 Биологическая роль азота и фосфора N – входит в состав всех аминокислот KNO 3, Na. NO 3, NH 4 NO 3 – азотные удобрения NH 4 Cl, NH 4 OH – для дезинфекции N 2 O – средство для наркоза P – входит в состав костей( Ca 3(PO 4)2) и зубов ( Ca 3(PO 4)2 · Ca. F 2 ) P – входит в состав АДФ, АТФ Na 2 HPO 4· 12 H 2 O – используют как средство снижения кислотности желудочного сока
Биологическая роль азота и фосфора N – входит в состав всех аминокислот KNO 3, Na. NO 3, NH 4 NO 3 – азотные удобрения NH 4 Cl, NH 4 OH – для дезинфекции N 2 O – средство для наркоза P – входит в состав костей( Ca 3(PO 4)2) и зубов ( Ca 3(PO 4)2 · Ca. F 2 ) P – входит в состав АДФ, АТФ Na 2 HPO 4· 12 H 2 O – используют как средство снижения кислотности желудочного сока
 Мышьяк и его соединения – яды! As 2 O 3 – « зооцид» Обнаружение мышьяка ( проба Марша) : 2 Zn+As 2 O 3+6 H 2 SO 4 = 6 Zn. SO 4+2 As. H 3 +3 H 2 O 2 As. H 3 t 2 As + 3 H 2
Мышьяк и его соединения – яды! As 2 O 3 – « зооцид» Обнаружение мышьяка ( проба Марша) : 2 Zn+As 2 O 3+6 H 2 SO 4 = 6 Zn. SO 4+2 As. H 3 +3 H 2 O 2 As. H 3 t 2 As + 3 H 2


