Лекция Основные понятия и законы термодинамики Термодинамика –

























































![Обозначения, размерности. Давление P [мм.рт.ст.; атм.; Па; кПа], Объем V Обозначения, размерности. Давление P [мм.рт.ст.; атм.; Па; кПа], Объем V](https://present5.com/presentacii-2/20171208\10266-l_9-10_td.ppt\10266-l_9-10_td_65.jpg)


![Энергия (греч.) – это мера способности совершать работу. Размерность в СИ [Дж]. Формы Энергия (греч.) – это мера способности совершать работу. Размерность в СИ [Дж]. Формы](https://present5.com/presentacii-2/20171208\10266-l_9-10_td.ppt\10266-l_9-10_td_68.jpg)











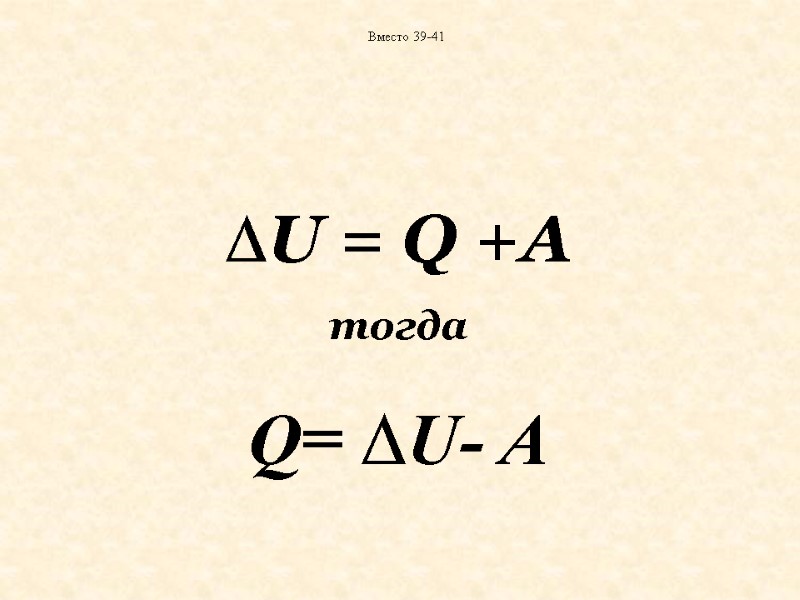


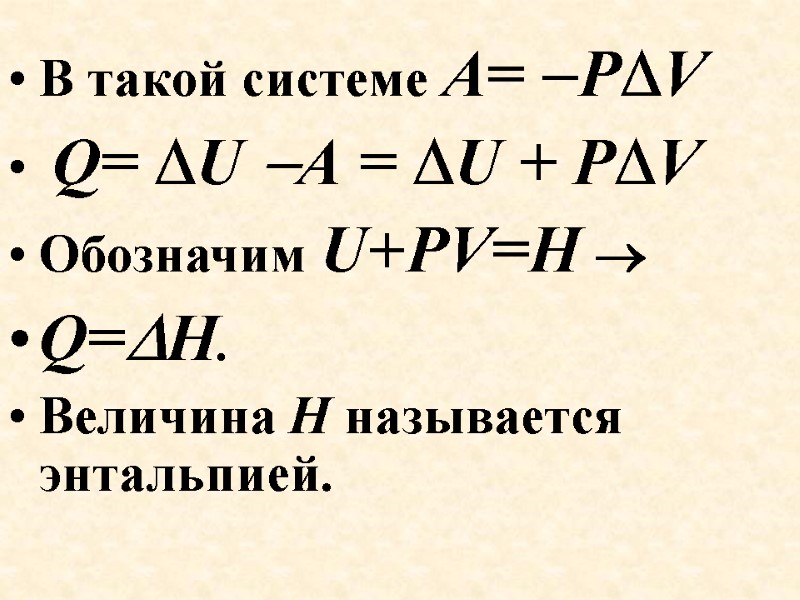






























10266-l_9-10_td.ppt
- Количество слайдов: 120
 Лекция Основные понятия и законы термодинамики
Лекция Основные понятия и законы термодинамики
 Термодинамика – наука об энергии, ее формах и превращениях.
Термодинамика – наука об энергии, ее формах и превращениях.
 Энергия способность выполнять работу или переносить тело. Энергия.
Энергия способность выполнять работу или переносить тело. Энергия.
 Единицы измерения энергии Джоуль – кинетическая энергия тела массой 2 кг движущегося со скоростью 1м/сек
Единицы измерения энергии Джоуль – кинетическая энергия тела массой 2 кг движущегося со скоростью 1м/сек
 Калория количество энергии необходимое для нагрева 1 г воды на 100С
Калория количество энергии необходимое для нагрева 1 г воды на 100С
 продолжение 1 кал = 4,184 Дж Пищевая Калория – 1 ккал (1000 кал)
продолжение 1 кал = 4,184 Дж Пищевая Калория – 1 ккал (1000 кал)
 Топливные ресурсы Деятельность современного общества невозможна без надежных источников достаточно дешевой энергии.
Топливные ресурсы Деятельность современного общества невозможна без надежных источников достаточно дешевой энергии.
 продолжение В качестве источников энергии используются топливные ресурсы.
продолжение В качестве источников энергии используются топливные ресурсы.
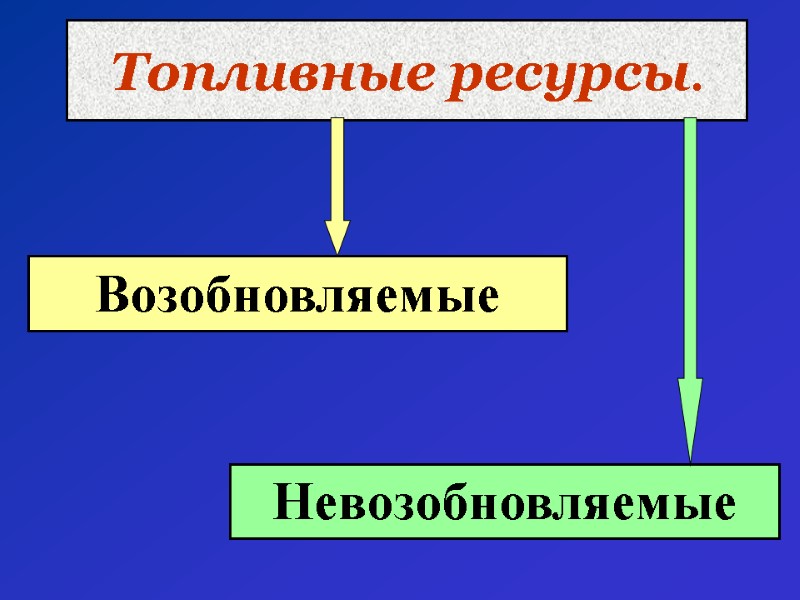
 Топливные ресурсы. Возобновляемые Невозобновляемые
Топливные ресурсы. Возобновляемые Невозобновляемые
 Возобновляемые возможно естественное восполнение за короткий промежуток времени. Доступны. Солнечная энергия, гидроэлектроэнергия.
Возобновляемые возможно естественное восполнение за короткий промежуток времени. Доступны. Солнечная энергия, гидроэлектроэнергия.
 Невозобновляемые невозможно восполнение после использования. Горючие ископаемые, ядерное топливо. Главные источники горючих ископаемых – уголь, ПГ, нефть.
Невозобновляемые невозможно восполнение после использования. Горючие ископаемые, ядерное топливо. Главные источники горючих ископаемых – уголь, ПГ, нефть.
 Уголь(антрацит) – 95% углерода. Состав топлив
Уголь(антрацит) – 95% углерода. Состав топлив
 Природный газ смесь газов 90-95% метан(СН4), остальное этан (С2Н6), пропан (С3Н8) бутан (С4Н10).
Природный газ смесь газов 90-95% метан(СН4), остальное этан (С2Н6), пропан (С3Н8) бутан (С4Н10).
 Нефть смесь жидких углеводородов и др. органических веществ.
Нефть смесь жидких углеводородов и др. органических веществ.
 Синтетические топлива бензин, керосин, дизельное топливо и др. жидкие и тяжелые углеводороды.
Синтетические топлива бензин, керосин, дизельное топливо и др. жидкие и тяжелые углеводороды.
 Экологически чистое топливо – ВОДОРОД.
Экологически чистое топливо – ВОДОРОД.
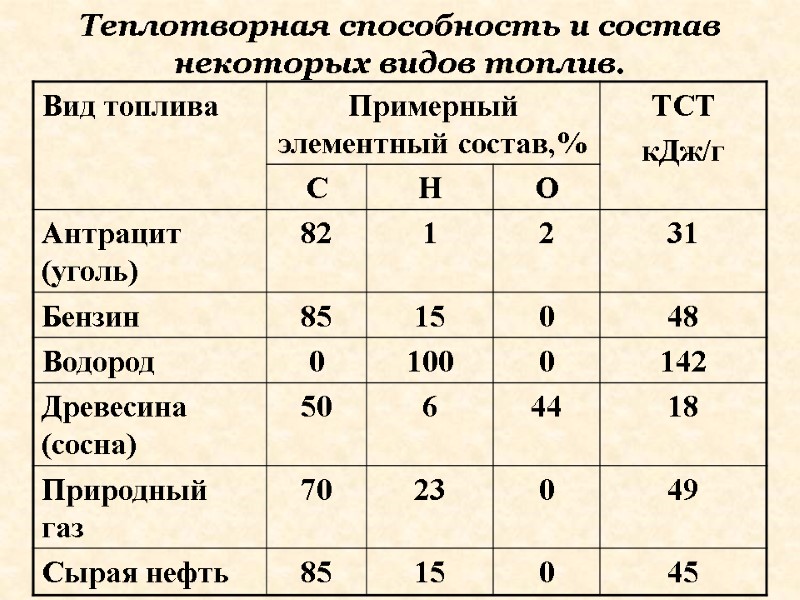
 Эффективность топлива оценивается теплотворной способностью (ТСТ). Топливо – как правило смесь компонентов, теплотворная способность указывается на единицу массы (г или кг)
Эффективность топлива оценивается теплотворной способностью (ТСТ). Топливо – как правило смесь компонентов, теплотворная способность указывается на единицу массы (г или кг)
 ТСТ – тепловой эффект сгорания 1 единицы массы жидкого или твердого топлива и 1 М3- газообразного. Единицы измерения кДж/кг кДж/м3.
ТСТ – тепловой эффект сгорания 1 единицы массы жидкого или твердого топлива и 1 М3- газообразного. Единицы измерения кДж/кг кДж/м3.
 Теплотворная способность и состав некоторых видов топлив.
Теплотворная способность и состав некоторых видов топлив.
 Нахождение в покое и теплом помещении 6300 кДж (1500 ккал) Энергетическая потребность организма (в сутки)
Нахождение в покое и теплом помещении 6300 кДж (1500 ккал) Энергетическая потребность организма (в сутки)
 Выполнение работы средней интенсивности 10000-13000 кДж (2500-3000 ккал) Это эквивалентно количеству энергии необходимой для работы лампы в 100 Вт в течение 24 часов
Выполнение работы средней интенсивности 10000-13000 кДж (2500-3000 ккал) Это эквивалентно количеству энергии необходимой для работы лампы в 100 Вт в течение 24 часов
 Теплотворная способность (калорийность) пищи Углеводы+жиры+белкиэнергия в организме. энергия пищи необходима на: поддержание температуры тела + мускульная активность + перегруппировка атомов пищи + др.(запасается в виде жиров)
Теплотворная способность (калорийность) пищи Углеводы+жиры+белкиэнергия в организме. энергия пищи необходима на: поддержание температуры тела + мускульная активность + перегруппировка атомов пищи + др.(запасается в виде жиров)
 Продолжение Жиры СО2+Н2О Калорийность – 38 кДж/г (9ккал/г)
Продолжение Жиры СО2+Н2О Калорийность – 38 кДж/г (9ккал/г)
 Белки разные продукты, в т.ч. азот. Калорийность – 17 кДж/г (4ккал/г)
Белки разные продукты, в т.ч. азот. Калорийность – 17 кДж/г (4ккал/г)
 Углеводы глюкоза СО2+Н2О Калорийность углеводов 17кДж/кг (4ккал/г)
Углеводы глюкоза СО2+Н2О Калорийность углеводов 17кДж/кг (4ккал/г)
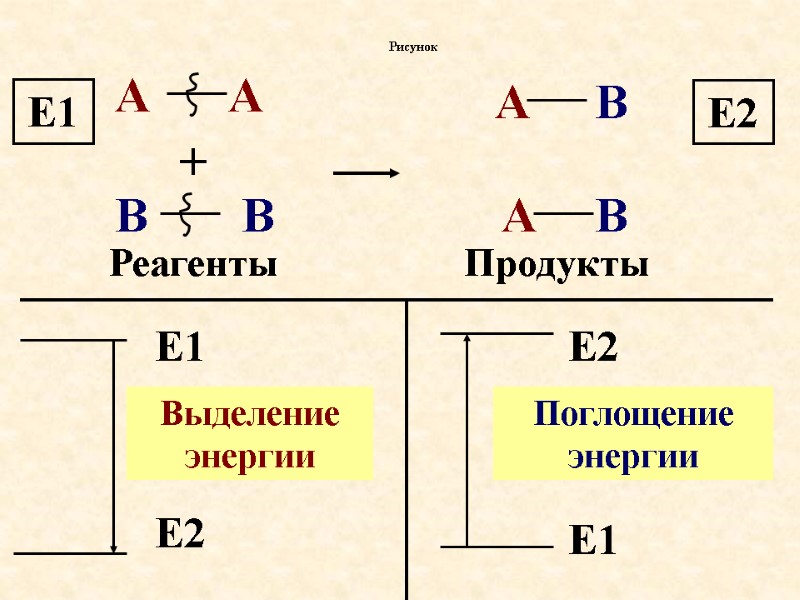
 Предмет химии – химическая реакция. В результате химической реакции разрушаются связи в исходных веществах (реагентах) и образуются новые связи, появляется новое вещество (продукты). В результате протекания процесса выделяется или поглощается энергия. Т.о. химическая реакция сопровождается как изменением строения так и изменением энергии. Энергия и химическая реакция.
Предмет химии – химическая реакция. В результате химической реакции разрушаются связи в исходных веществах (реагентах) и образуются новые связи, появляется новое вещество (продукты). В результате протекания процесса выделяется или поглощается энергия. Т.о. химическая реакция сопровождается как изменением строения так и изменением энергии. Энергия и химическая реакция.
 Энергия и химическая реакция Предмет химии – химическая реакция.
Энергия и химическая реакция Предмет химии – химическая реакция.
 продолжение В результате химической реакции разрушаются связи в исходных веществах (реагентах) и образуются новые связи, появляется новое вещество (продукты).
продолжение В результате химической реакции разрушаются связи в исходных веществах (реагентах) и образуются новые связи, появляется новое вещество (продукты).
 продолжение В результате протекания процесса выделяется или поглощается энергия. Т.о. химическая реакция сопровождается как изменением строения так и изменением энергии.
продолжение В результате протекания процесса выделяется или поглощается энергия. Т.о. химическая реакция сопровождается как изменением строения так и изменением энергии.
 А А + В В А А В В Рисунок Реагенты Продукты Е1 Е1 Е2 Выделение энергии Е2 Е2 Е1 Поглощение энергии
А А + В В А А В В Рисунок Реагенты Продукты Е1 Е1 Е2 Выделение энергии Е2 Е2 Е1 Поглощение энергии
 Термодинамика – наука о взаимных превращениях различных видов энергии (механическаятепловая; тепловая механическая; химическаятепловая; химическаяэлектрическая; и т.д. Термодинамика
Термодинамика – наука о взаимных превращениях различных видов энергии (механическаятепловая; тепловая механическая; химическаятепловая; химическаяэлектрическая; и т.д. Термодинамика
 Термодинамика занимается изучением энергии, превращениями энергии из одной формы в другую, вопросами использования энергии с целью получения полезной работы.
Термодинамика занимается изучением энергии, превращениями энергии из одной формы в другую, вопросами использования энергии с целью получения полезной работы.
 Химическая термодинамика Химическая термодинамика изучает превращения энергии в химических реакциях и способность систем выполнять полезную работу.
Химическая термодинамика Химическая термодинамика изучает превращения энергии в химических реакциях и способность систем выполнять полезную работу.
 Химическая термодинамика является очень важным разделом. В нем рассматриваются следующие важнейшие вопросы:
Химическая термодинамика является очень важным разделом. В нем рассматриваются следующие важнейшие вопросы:
 1 возможность протекания химической реакции в результате смешения 2-х веществ;
1 возможность протекания химической реакции в результате смешения 2-х веществ;
 направление протекания процесса при заданных условиях 2
направление протекания процесса при заданных условиях 2
 3 вычисления количества энергии, которое теоретически необходимо для протекания реакции или, наоборот, которое должно выделится при ее самопроизвольном протекании
3 вычисления количества энергии, которое теоретически необходимо для протекания реакции или, наоборот, которое должно выделится при ее самопроизвольном протекании
 4 позволяет оценить реакционную способность веществ.
4 позволяет оценить реакционную способность веществ.
 Термохимия Термохимия – раздел химической термодинамики, изучающий тепловые эффекты химических реакций.
Термохимия Термохимия – раздел химической термодинамики, изучающий тепловые эффекты химических реакций.
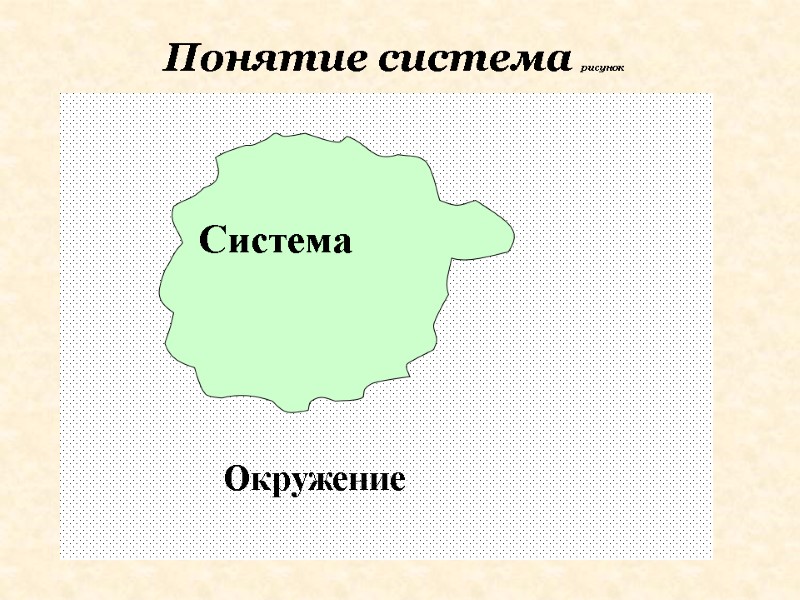
 Дадим определения некоторым понятиям, которые мы будем использовать при рассмотрении этой темы. Все превращения веществ происходят в системах. Система – та часть материального мира, которая является предметом нашего наблюдения (проведение эксперимента или вычисления). Система. Окружение.
Дадим определения некоторым понятиям, которые мы будем использовать при рассмотрении этой темы. Все превращения веществ происходят в системах. Система – та часть материального мира, которая является предметом нашего наблюдения (проведение эксперимента или вычисления). Система. Окружение.
 Остальная часть окружающего мира – за пределами условно выделенной из него системы – называется окружением.
Остальная часть окружающего мира – за пределами условно выделенной из него системы – называется окружением.
 Окружение Окружение включает все остальные объекты, которые могут влиять на исследуемую систему.
Окружение Окружение включает все остальные объекты, которые могут влиять на исследуемую систему.
 Понятие система рисунок
Понятие система рисунок
 1. По взаимодействию с окружающей средой открытые замкнутые (закрытые) изолированная Виды систем
1. По взаимодействию с окружающей средой открытые замкнутые (закрытые) изолированная Виды систем
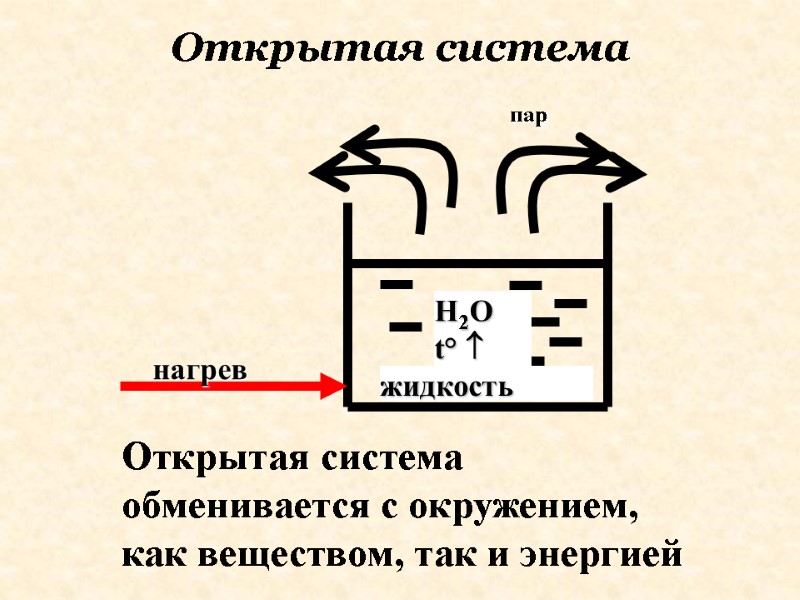
 Открытая система обменивается с окружением, как веществом, так и энергией Открытая система
Открытая система обменивается с окружением, как веществом, так и энергией Открытая система
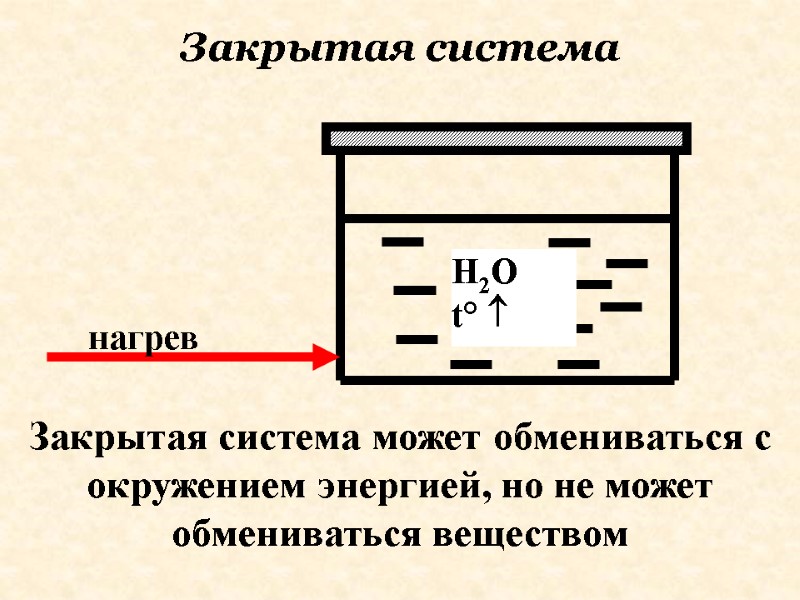
 Закрытая система может обмениваться с окружением энергией, но не может обмениваться веществом Закрытая система
Закрытая система может обмениваться с окружением энергией, но не может обмениваться веществом Закрытая система
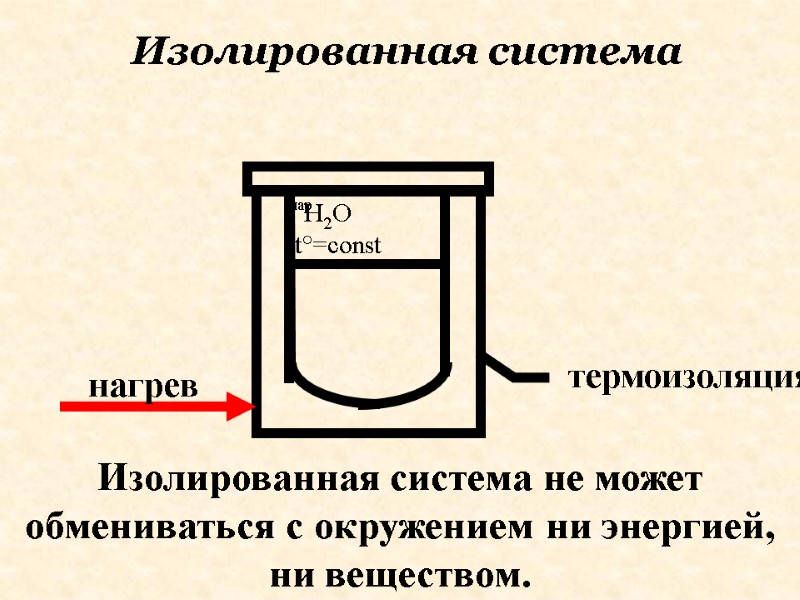
 Изолированная система не может обмениваться с окружением ни энергией, ни веществом. Изолированная система
Изолированная система не может обмениваться с окружением ни энергией, ни веществом. Изолированная система
 Реакции в химических системах.ПО направлению Реакции, протекающие в химических системах можно классифицировать по следующим признакам: Pb(NO3)2+2KIPbI2 +2KNO3, Zn+2HClZnCl2+ H2 HCl+NaOHNaCl+H2O
Реакции в химических системах.ПО направлению Реакции, протекающие в химических системах можно классифицировать по следующим признакам: Pb(NO3)2+2KIPbI2 +2KNO3, Zn+2HClZnCl2+ H2 HCl+NaOHNaCl+H2O
 I. По направлению а) необратимые реакции (идут до конца). Pb(NO3)2+2KIPbI2 +2KNO3,
I. По направлению а) необратимые реакции (идут до конца). Pb(NO3)2+2KIPbI2 +2KNO3,
 Б) образование газообразного вещества Zn+2HClZnCl2+ H2
Б) образование газообразного вещества Zn+2HClZnCl2+ H2
 В) образование слабого электролита HCl+NaOHNaCl+H2O
В) образование слабого электролита HCl+NaOHNaCl+H2O
 обратимые – реакции, идущие в прямом и обратном направлении 2NO2N2O4 продолжение
обратимые – реакции, идущие в прямом и обратном направлении 2NO2N2O4 продолжение
 Некоторые реакции необратимые при одних условиях могут стать обратимыми в других. Так осадок иодида свинца при нагревании может растворяться. Pb(NO3)2+2KI PbI2 +2KNO3 t0C
Некоторые реакции необратимые при одних условиях могут стать обратимыми в других. Так осадок иодида свинца при нагревании может растворяться. Pb(NO3)2+2KI PbI2 +2KNO3 t0C
 а) гомогенные – реагирующие вещества находятся в одном агрегатном состоянии (нет поверхности раздела между веществами в системе (идеальные растворы, воздух) II. По агрегатному состоянию веществ
а) гомогенные – реагирующие вещества находятся в одном агрегатном состоянии (нет поверхности раздела между веществами в системе (идеальные растворы, воздух) II. По агрегатному состоянию веществ
 б) гетерогенные (неоднородные) - вещества находятся в разных агрегатных состояниях (металл +кислота; порошок железа и оксида железа; кислород и медная проволока). Между веществами в системе есть граница раздела.
б) гетерогенные (неоднородные) - вещества находятся в разных агрегатных состояниях (металл +кислота; порошок железа и оксида железа; кислород и медная проволока). Между веществами в системе есть граница раздела.
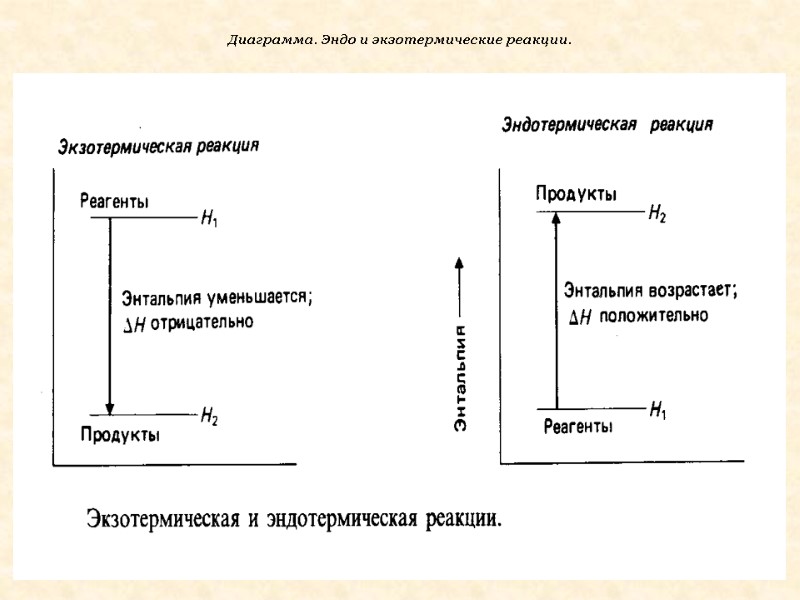
 реакции, идущие с выделением тепла Н<0 - экзотермические (реакции нейтрализации, горения); III. По энерегетическому признаку
реакции, идущие с выделением тепла Н<0 - экзотермические (реакции нейтрализации, горения); III. По энерегетическому признаку
 реакции, идущие с поглощением тепла H>0 – эндотермические (разложение веществ) H – теплосодержание системы (энтальпия)
реакции, идущие с поглощением тепла H>0 – эндотермические (разложение веществ) H – теплосодержание системы (энтальпия)
 Диаграмма. Эндо и экзотермические реакции.
Диаграмма. Эндо и экзотермические реакции.
 Работа (А) и теплота (Q) Теплота и работа не являются функциями состояния, т.к. служат формой передачи энергии и связаны с процессом, а не состоянием системы. Величины, используемые в химической термодинамике
Работа (А) и теплота (Q) Теплота и работа не являются функциями состояния, т.к. служат формой передачи энергии и связаны с процессом, а не состоянием системы. Величины, используемые в химической термодинамике
 Работа – форма передачи энергии. Система выполняет работу, если действует с некоторой силой, направленной на преодоление сопротивления. Работа
Работа – форма передачи энергии. Система выполняет работу, если действует с некоторой силой, направленной на преодоление сопротивления. Работа
 Работа связана с перемещением частиц, против действия какой-либо силы. Например работа расширения А= PV
Работа связана с перемещением частиц, против действия какой-либо силы. Например работа расширения А= PV
 Теплота – количество энергии, вызываемое разностью температур между системой и ее окружением, или одной системой и другой. q ~mT Теплота Обозначение Q. Размерность – кал/моль
Теплота – количество энергии, вызываемое разностью температур между системой и ее окружением, или одной системой и другой. q ~mT Теплота Обозначение Q. Размерность – кал/моль
 Температура – величина, служащая мерой средней кинетической энергии всех частиц в системе. При подводе энергии к системе возрастает кинетическая энергия, а след и температура.
Температура – величина, служащая мерой средней кинетической энергии всех частиц в системе. При подводе энергии к системе возрастает кинетическая энергия, а след и температура.
 Протекание процесса зависит от условий и характеризуется следующими параметрами давление, температура, концентрация. Параметры процесса
Протекание процесса зависит от условий и характеризуется следующими параметрами давление, температура, концентрация. Параметры процесса
![>Обозначения, размерности. Давление P [мм.рт.ст.; атм.; Па; кПа], Объем V >Обозначения, размерности. Давление P [мм.рт.ст.; атм.; Па; кПа], Объем V](https://present5.com/presentacii-2/20171208\10266-l_9-10_td.ppt\10266-l_9-10_td_65.jpg) Обозначения, размерности. Давление P [мм.рт.ст.; атм.; Па; кПа], Объем V [мл; л; М3] Температура T [К; 0С], концентрация C [моль/л].
Обозначения, размерности. Давление P [мм.рт.ст.; атм.; Па; кПа], Объем V [мл; л; М3] Температура T [К; 0С], концентрация C [моль/л].
 Энергия Е, U – изменение внутренней энергии; H – изменение энтальпии; S – энтропия; G – изменение энергии Гиббса, Функции состояния
Энергия Е, U – изменение внутренней энергии; H – изменение энтальпии; S – энтропия; G – изменение энергии Гиббса, Функции состояния
 Изменение этих величин однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс.
Изменение этих величин однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс.
![>Энергия (греч.) – это мера способности совершать работу. Размерность в СИ [Дж]. Формы >Энергия (греч.) – это мера способности совершать работу. Размерность в СИ [Дж]. Формы](https://present5.com/presentacii-2/20171208\10266-l_9-10_td.ppt\10266-l_9-10_td_68.jpg) Энергия (греч.) – это мера способности совершать работу. Размерность в СИ [Дж]. Формы существования энергии: химическая, электрическая, механическая, ядерная, солнечная. Определение энергии виды энергии
Энергия (греч.) – это мера способности совершать работу. Размерность в СИ [Дж]. Формы существования энергии: химическая, электрическая, механическая, ядерная, солнечная. Определение энергии виды энергии
 Виды энергии: кинетическая – энергия, связанная с движением тела. Зависит от массы тела и скорости. Ек=1/2mv2.
Виды энергии: кинетическая – энергия, связанная с движением тела. Зависит от массы тела и скорости. Ек=1/2mv2.
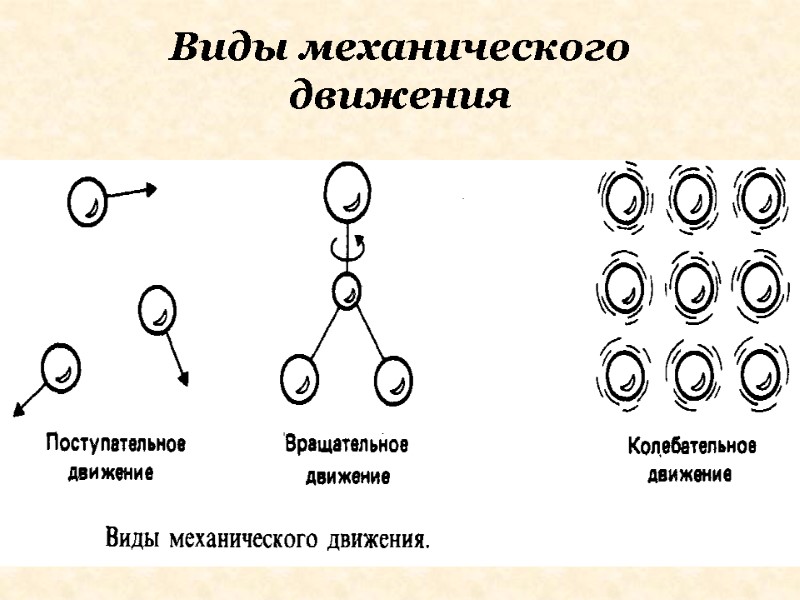
 Кинетическая энергия обусловлена механическим движением частиц: вращательным, поступательным, колебательным.
Кинетическая энергия обусловлена механическим движением частиц: вращательным, поступательным, колебательным.
 Виды механического движения
Виды механического движения
 Потенциальная энергия – энергия запасенная телом. Потенциальная обусловлена электростатическими силами притяжения между частицами и внутри самих частиц. Потенциальная энергия
Потенциальная энергия – энергия запасенная телом. Потенциальная обусловлена электростатическими силами притяжения между частицами и внутри самих частиц. Потенциальная энергия
 Еп=q1q2/r q1 и q2 заряды частиц (электрона) r-расстояние между центрами зарядов. Так энергия связи — один из видов потенциальной энергии ( кривая Морзе).
Еп=q1q2/r q1 и q2 заряды частиц (электрона) r-расстояние между центрами зарядов. Так энергия связи — один из видов потенциальной энергии ( кривая Морзе).
 Любое химическое вещество состоит из атомов, молекул и ионов в любой их комбинации. Все эти частицы обладают кинетической и потенциальной энергией. Внутренняя энергия
Любое химическое вещество состоит из атомов, молекул и ионов в любой их комбинации. Все эти частицы обладают кинетической и потенциальной энергией. Внутренняя энергия
 Внутренняя энергия системы (U) – сумма кинетической и потенциальной энергии всех частиц в системе (молекул, атомов, атомных групп, движения электронов и т.д.) U = Eк + Eп
Внутренняя энергия системы (U) – сумма кинетической и потенциальной энергии всех частиц в системе (молекул, атомов, атомных групп, движения электронов и т.д.) U = Eк + Eп
 Внутренняя энергия не включает потенциальную энергию положения системы и кинетическую энергию системы в целом.
Внутренняя энергия не включает потенциальную энергию положения системы и кинетическую энергию системы в целом.
 Абсолютное значение U определить невозможно, т. к. нельзя привести систему в состояние лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, U= U2- U1. Продолжение
Абсолютное значение U определить невозможно, т. к. нельзя привести систему в состояние лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, U= U2- U1. Продолжение
 Энергия не создается и не уничтожается, но может превращаться из одной формы в другую. Полная энергия системы остается неизменной. Первый закон термодинамики
Энергия не создается и не уничтожается, но может превращаться из одной формы в другую. Полная энергия системы остается неизменной. Первый закон термодинамики
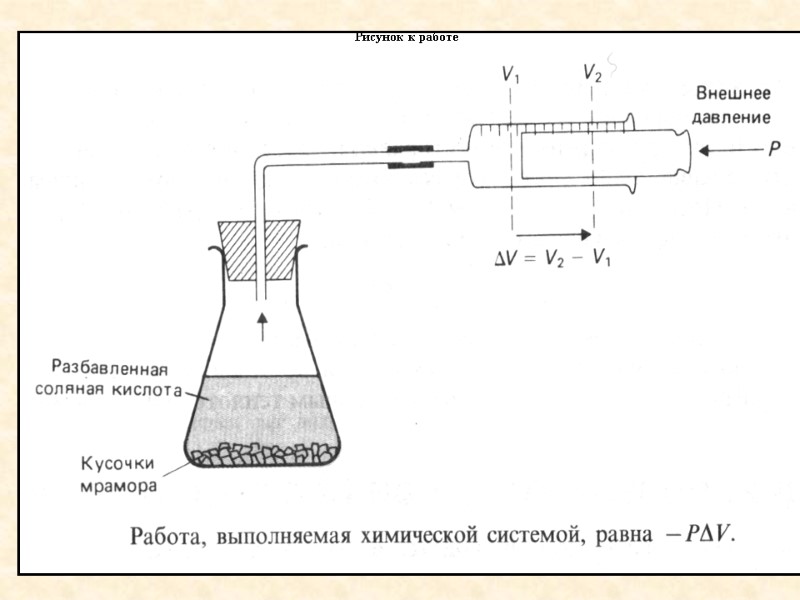
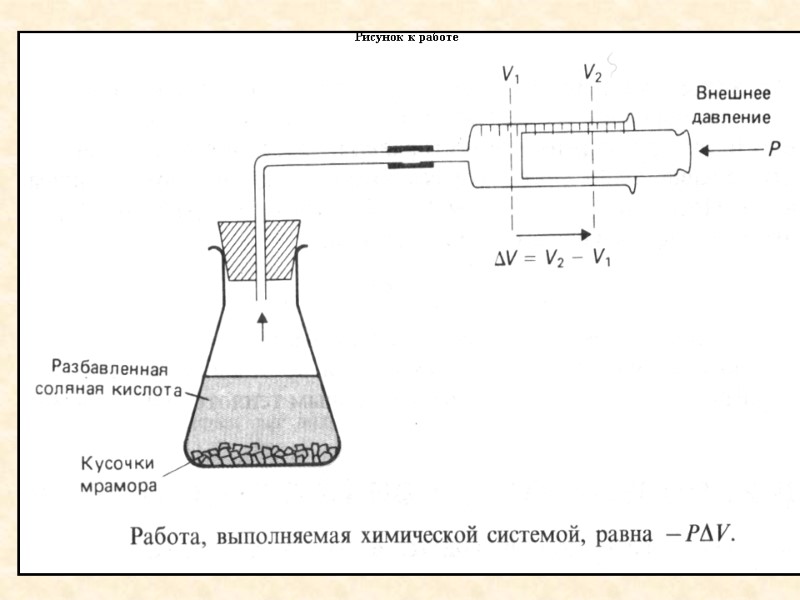
 Работа в химической реакции Рассмотрим химическую систему, в которой протекает реакция СаСО3+2HClCaCl2+CO2+H2O
Работа в химической реакции Рассмотрим химическую систему, в которой протекает реакция СаСО3+2HClCaCl2+CO2+H2O
 Рисунок к работе
Рисунок к работе
 U может быть обусловлено только передачей энергии системе или от нее. Такая передача энергии может осуществляться в форме теплоты и работы
U может быть обусловлено только передачей энергии системе или от нее. Такая передача энергии может осуществляться в форме теплоты и работы
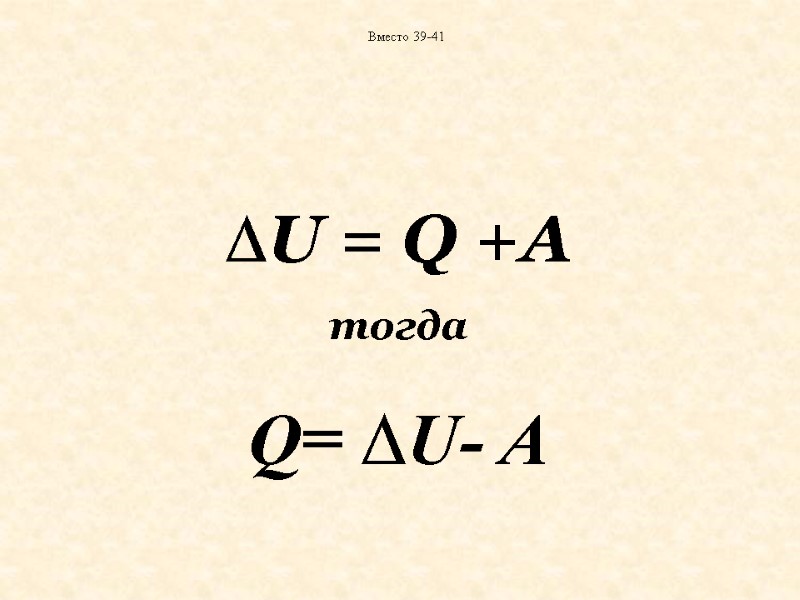 U = Q +А тогда Q= U- А Вместо 39-41
U = Q +А тогда Q= U- А Вместо 39-41
 Для изолированной системы Р и Т – постоянны (изобарно-изотермический процесс).
Для изолированной системы Р и Т – постоянны (изобарно-изотермический процесс).
 Работа в химической реакции Рассмотрим химическую систему, в которой протекает реакция СаСО3+2HClCaCl2+CO2+H2O
Работа в химической реакции Рассмотрим химическую систему, в которой протекает реакция СаСО3+2HClCaCl2+CO2+H2O
 Рисунок к работе
Рисунок к работе
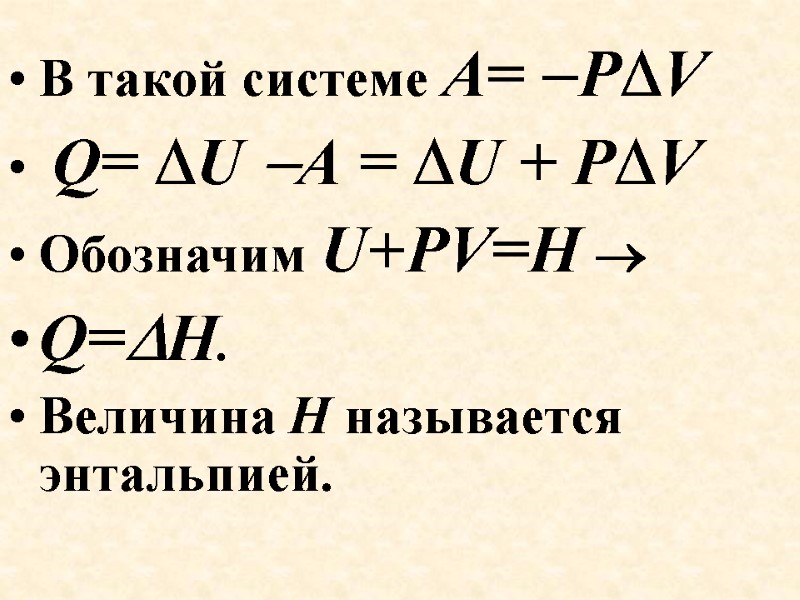 В такой системе А= PV Q= U А = U + PV Обозначим U+PV=Н Q=H. Величина Н называется энтальпией.
В такой системе А= PV Q= U А = U + PV Обозначим U+PV=Н Q=H. Величина Н называется энтальпией.
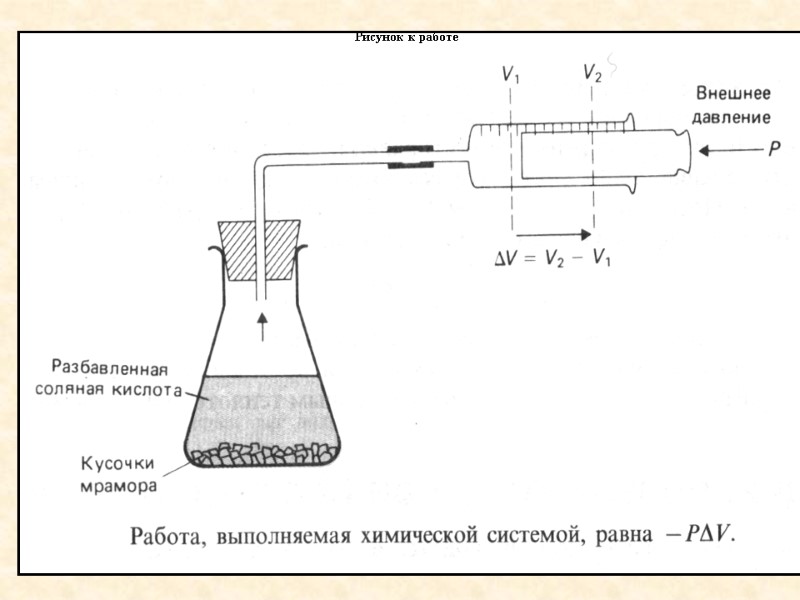
 Работа в химической реакции Рассмотрим химическую систему, в которой протекает реакция СаСО3+2HClCaCl2+CO2+H2O
Работа в химической реакции Рассмотрим химическую систему, в которой протекает реакция СаСО3+2HClCaCl2+CO2+H2O
 Рисунок к работе
Рисунок к работе
 Мы имеем дело с изолированной системой. Р и Т – постоянны (изобарно-изотермический процесс). U = Q +А Q= U А как мы определили выше А= PV, Q=U+PV= =(U2-U1)+P(V2-V1)=(U2+PV2) (U1+PV1). Обозначим U+PV=Н Q=H2 H1=H. Величина Н называется энтальпией. Пояснения к рисунку
Мы имеем дело с изолированной системой. Р и Т – постоянны (изобарно-изотермический процесс). U = Q +А Q= U А как мы определили выше А= PV, Q=U+PV= =(U2-U1)+P(V2-V1)=(U2+PV2) (U1+PV1). Обозначим U+PV=Н Q=H2 H1=H. Величина Н называется энтальпией. Пояснения к рисунку
 Энтальпия- теплосодержание системы (тепловой эффект реакции, протекающей в системе) при постоянном давлении. Обозначение: Н Размерность: кДж/моль Энтальпия
Энтальпия- теплосодержание системы (тепловой эффект реакции, протекающей в системе) при постоянном давлении. Обозначение: Н Размерность: кДж/моль Энтальпия
 Одной из задач термохимии является расчет тепловых эффектов реакции (энтальпии реакции). Все термохимические расчеты производятся на основании закона Гесса (1840). Задача термохимии
Одной из задач термохимии является расчет тепловых эффектов реакции (энтальпии реакции). Все термохимические расчеты производятся на основании закона Гесса (1840). Задача термохимии
 Портрет Гесса Гесс Герман Иванович 07.08.1802 – 12.12.1850 Русский химик. Академик Петербургской АН
Портрет Гесса Гесс Герман Иванович 07.08.1802 – 12.12.1850 Русский химик. Академик Петербургской АН
 Закон Гесса Тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Закон Гесса Тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
 Тепловой эффект химической реакции равен сумме теплот образования продуктов за вычетом суммы теплот образовании исходных веществ. . Следствие из закона Гесса
Тепловой эффект химической реакции равен сумме теплот образования продуктов за вычетом суммы теплот образовании исходных веществ. . Следствие из закона Гесса
 где индекс «0» у энтальпий образования веществ обозначает стандартные условия: температура 25°С (298 К), давление 1 атм (760 мм рт. ст., 101,3 кПа), количество вещества 1 моль
где индекс «0» у энтальпий образования веществ обозначает стандартные условия: температура 25°С (298 К), давление 1 атм (760 мм рт. ст., 101,3 кПа), количество вещества 1 моль
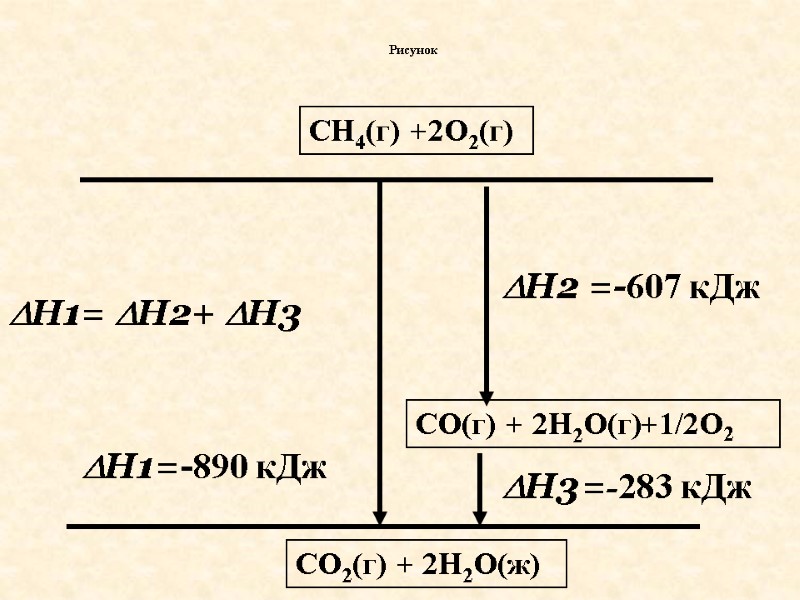
 Рисунок H1 H2 H3 CH4(г) +2O2(г) CO2(г) + 2H2O(ж) CO(г) + 2H2O(г)+1/2О2 H1= H2+ H3 =-890 кДж =-607 кДж =-283 кДж
Рисунок H1 H2 H3 CH4(г) +2O2(г) CO2(г) + 2H2O(ж) CO(г) + 2H2O(г)+1/2О2 H1= H2+ H3 =-890 кДж =-607 кДж =-283 кДж
 Значения энтальпии образования вещества при стандартных условиях приводятся в таблицах. Энтальпия образования простого вещества принята равной 0. Продолжение
Значения энтальпии образования вещества при стандартных условиях приводятся в таблицах. Энтальпия образования простого вещества принята равной 0. Продолжение
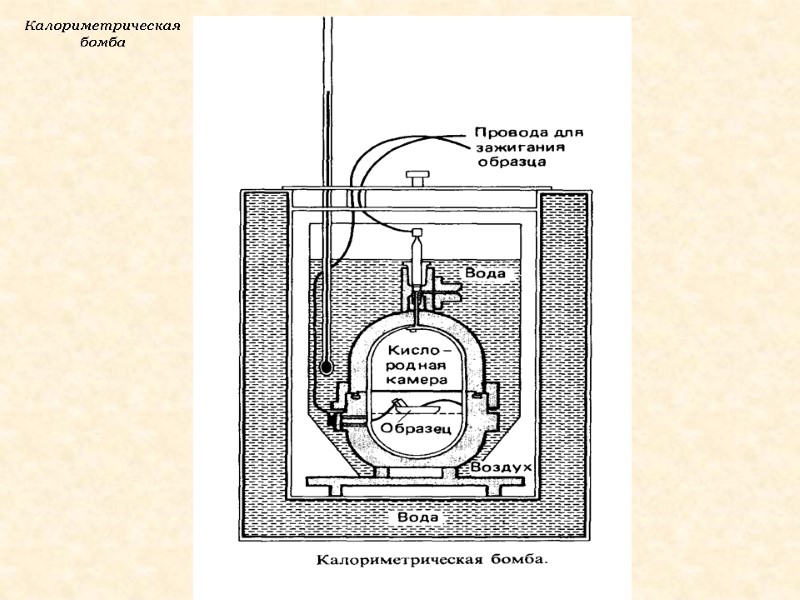
 Энтальпию образования некоторых веществ можно определить экспериментально Энтальпии образования некоторых веществ определяют эмпирически, т.к. их невозможно получить из простых веществ (некоторые оксиды (СО), соли, органические соединения)
Энтальпию образования некоторых веществ можно определить экспериментально Энтальпии образования некоторых веществ определяют эмпирически, т.к. их невозможно получить из простых веществ (некоторые оксиды (СО), соли, органические соединения)
 Калориметрическая бомба
Калориметрическая бомба
 Для рассчета энтальпии реакции необходимо составить термохимическое уравнение. Термохимическое уравнение – уравнение химической реакции, в котором обязательно указывается агрегатное состояние вещества и численные значения тепловых эффектов. Термохимическое уравнение
Для рассчета энтальпии реакции необходимо составить термохимическое уравнение. Термохимическое уравнение – уравнение химической реакции, в котором обязательно указывается агрегатное состояние вещества и численные значения тепловых эффектов. Термохимическое уравнение
 H0х.р.=(2НН2О+НСО2)-(2НО2+НСН4)= (2(-241,84)+(-393,51))-(20+(-74,85))= - 802,34 H0х.р.= - 802,34 кДж/моль CH4(г) +2O2(г) CO2(г) + 2H2O(г) Hх.р.=? Пример
H0х.р.=(2НН2О+НСО2)-(2НО2+НСН4)= (2(-241,84)+(-393,51))-(20+(-74,85))= - 802,34 H0х.р.= - 802,34 кДж/моль CH4(г) +2O2(г) CO2(г) + 2H2O(г) Hх.р.=? Пример
 Возможно ли по тепловому эффекту судить о возможности протекания химической реакции или устойчивости какого-либо химического соединения? Первоначально ученые считали, что самопроизвольно могут протекать только экзотермические реакции. Но по мере развития науки выяснилось, что и эндотермические реакции могут протекать самопроизвольно. Реакция, идущая при данной температуре с выделением теплоты, при другой температуре будет протекать в обратном направлении. Здесь проявляется диалектический закон единства и борьбы противоположностей. Продолжение
Возможно ли по тепловому эффекту судить о возможности протекания химической реакции или устойчивости какого-либо химического соединения? Первоначально ученые считали, что самопроизвольно могут протекать только экзотермические реакции. Но по мере развития науки выяснилось, что и эндотермические реакции могут протекать самопроизвольно. Реакция, идущая при данной температуре с выделением теплоты, при другой температуре будет протекать в обратном направлении. Здесь проявляется диалектический закон единства и борьбы противоположностей. Продолжение
 С одной стороны система стремится к упорядочению (агрегации) уменьшению Н, с другой стороны система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением температуры, а вторая с повышением температуры. Тенденцию к беспорядку характеризует величина, называемая энтропией. S0298 - энтропия образования вещества при стандартных условиях (приводится в таблицах). Размерность [Дж/моль K]. Энтропия
С одной стороны система стремится к упорядочению (агрегации) уменьшению Н, с другой стороны система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением температуры, а вторая с повышением температуры. Тенденцию к беспорядку характеризует величина, называемая энтропией. S0298 - энтропия образования вещества при стандартных условиях (приводится в таблицах). Размерность [Дж/моль K]. Энтропия
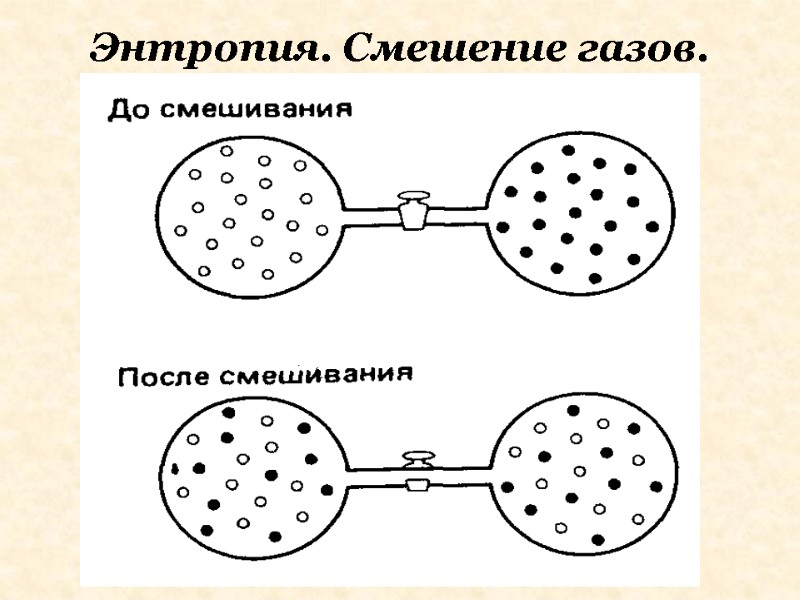
 Рассмотрим систему из 2-х сосудов. В сосудах находятся разные газы. Если открыть кран газы будут смешиваться в результате диффузии. В результате степень беспорядка окажется больше, чем до смешения большая. Энтропия увеличивается. Однако изменения энергии не происходит. Суммарная энтальпия газов не изменяется. Система из 2-х газов Уменьшение энтропии — конденсация, полимеризация, упрочнение связей S<0. Возрастание - лед-жидкость-пар S>0.
Рассмотрим систему из 2-х сосудов. В сосудах находятся разные газы. Если открыть кран газы будут смешиваться в результате диффузии. В результате степень беспорядка окажется больше, чем до смешения большая. Энтропия увеличивается. Однако изменения энергии не происходит. Суммарная энтальпия газов не изменяется. Система из 2-х газов Уменьшение энтропии — конденсация, полимеризация, упрочнение связей S<0. Возрастание - лед-жидкость-пар S>0.
 Энтропия. Смешение газов.
Энтропия. Смешение газов.
 Постулат Планка Энтропия индивидуального кристаллического вещества в виде идеального твердого тела при абсолютном нуле (0 К) равна 0 Идеальное твердое кристаллическое тело – твердое вещество с идеальной кристаллической решеткой, в которой все узлы заняты атомами или молекулами. Следствие: температуры абсолютного 0 реально достичь нельзя.
Постулат Планка Энтропия индивидуального кристаллического вещества в виде идеального твердого тела при абсолютном нуле (0 К) равна 0 Идеальное твердое кристаллическое тело – твердое вещество с идеальной кристаллической решеткой, в которой все узлы заняты атомами или молекулами. Следствие: температуры абсолютного 0 реально достичь нельзя.
 Для некоторых реакций мы можем предположить как изменяется энтропия СаСО3(кр.)СаО(кр.)+СО2(г) увеличивается. S Энтропия является функцией состояния системы. Поэтому для определения величины изменения энтропии также используется следствие из закона Гесса: Пример
Для некоторых реакций мы можем предположить как изменяется энтропия СаСО3(кр.)СаО(кр.)+СО2(г) увеличивается. S Энтропия является функцией состояния системы. Поэтому для определения величины изменения энтропии также используется следствие из закона Гесса: Пример
 Пример расчета CH4(г)+2O2(г)CO2(г)+2H2O(г) S0х.р.=? S0х.р.=(2188,7+213,65)-(2205,0+186,2)= 367,3 кДж/моль•К
Пример расчета CH4(г)+2O2(г)CO2(г)+2H2O(г) S0х.р.=? S0х.р.=(2188,7+213,65)-(2205,0+186,2)= 367,3 кДж/моль•К
 Самопроизвольно могут протекать процессы, сопровождающиеся увеличением суммарной энтропии системы и ее окружения. Этот закон является одним из наиболее общих положений всей науки в целом. Существует много различных формулировок этого закона. Основная мысль этих формулировок: в любой изолированной системе с течением времени происходит постоянное изменение энтропии. Второй закон термодинамики
Самопроизвольно могут протекать процессы, сопровождающиеся увеличением суммарной энтропии системы и ее окружения. Этот закон является одним из наиболее общих положений всей науки в целом. Существует много различных формулировок этого закона. Основная мысль этих формулировок: в любой изолированной системе с течением времени происходит постоянное изменение энтропии. Второй закон термодинамики
 Для определения возможности протекания процесса важно знать как изменение энтальпии так и изменение энтропии. При постоянных давлении и температуре движущей силой процесса или мерой химического сродства является величина энергии Гиббса - G G0298- энергия Гиббса образования вещества при стандартных условиях или потенциал Гиббса (приводится в таблицах) Размерность кДж/моль Энергия Гиббса.
Для определения возможности протекания процесса важно знать как изменение энтальпии так и изменение энтропии. При постоянных давлении и температуре движущей силой процесса или мерой химического сродства является величина энергии Гиббса - G G0298- энергия Гиббса образования вещества при стандартных условиях или потенциал Гиббса (приводится в таблицах) Размерность кДж/моль Энергия Гиббса.
 Портрет Гиббса Гиббс Джошуа Уиллард 11.02.1839 – 28.04.1903 Американский физик и физикохимик. Член национальной АН США
Портрет Гиббса Гиббс Джошуа Уиллард 11.02.1839 – 28.04.1903 Американский физик и физикохимик. Член национальной АН США
 Изменение энтальпии с температурой незначительно. Величина энтропии растет с повышением температуры. Точнее меру беспорядка характеризует энтропийный фактор ТS. Энтропийный фактор
Изменение энтальпии с температурой незначительно. Величина энтропии растет с повышением температуры. Точнее меру беспорядка характеризует энтропийный фактор ТS. Энтропийный фактор
 Математическое выражение второго закона термодинамики G=H-TS. Математическое выражение второго закона термодинамики Энергия Гиббса также является функцией состояния, поэтому ее изменение при стандартных условиях вычисляется на основании следствия из закона Гесса.
Математическое выражение второго закона термодинамики G=H-TS. Математическое выражение второго закона термодинамики Энергия Гиббса также является функцией состояния, поэтому ее изменение при стандартных условиях вычисляется на основании следствия из закона Гесса.
 G определяет термодинамическую вероятность протекания процесса. G0<0 при заданных условиях самопроизвольно протекает прямая реакция; G0>0 при заданных условиях реакция не может самопроизвольно протекать в прямом направлении, протекает обратная реакция; G0=0 при заданных условиях вероятны и прямая и обратная реакция - равновесие. Направление протекания процесса
G определяет термодинамическую вероятность протекания процесса. G0<0 при заданных условиях самопроизвольно протекает прямая реакция; G0>0 при заданных условиях реакция не может самопроизвольно протекать в прямом направлении, протекает обратная реакция; G0=0 при заданных условиях вероятны и прямая и обратная реакция - равновесие. Направление протекания процесса
 CH4(г) +2O2(г) CO2(г) + 2H2O(г). Пример G0х.р=(2(-228,6)+(-394,38))-((20+(-50,79)) = = - 800,79 кДж/моль Самопроизвольно протекают процессы идущие в сторону уменьшения любой энергии или потенциала. Следовательно данная реакция
CH4(г) +2O2(г) CO2(г) + 2H2O(г). Пример G0х.р=(2(-228,6)+(-394,38))-((20+(-50,79)) = = - 800,79 кДж/моль Самопроизвольно протекают процессы идущие в сторону уменьшения любой энергии или потенциала. Следовательно данная реакция
 Анализ уравнения Гиббса
Анализ уравнения Гиббса
 Внутренняя энергия, энтальпия, энтропия, энергия Гиббса – функции состояния системы. Являются свойствами вещества, пропорциональными их количеству, обладают аддитивными свойствами,т.е. при соприкосновении суммируются. Заключение
Внутренняя энергия, энтальпия, энтропия, энергия Гиббса – функции состояния системы. Являются свойствами вещества, пропорциональными их количеству, обладают аддитивными свойствами,т.е. при соприкосновении суммируются. Заключение
 Итак вернемся к энергии Гиббса. Любая энергия - способность совершать работу. При переходе из одного вида энергии в другой совершается работа. Например хим. энергия переходит в тепловую. Суммарная энергия будет складываться из полезной (Н) и бесполезной (энтропия). Т.К. энтропии в системе увеличивается, то доля бесполезной энергии тоже увеличивается, а полезной уменьшается. Следовательно, наша задача - рационально использовать полученную полезную энергию. Давайте рассмотрим на что расходуется солнечная энергия. Полезная и бесполезная энергия
Итак вернемся к энергии Гиббса. Любая энергия - способность совершать работу. При переходе из одного вида энергии в другой совершается работа. Например хим. энергия переходит в тепловую. Суммарная энергия будет складываться из полезной (Н) и бесполезной (энтропия). Т.К. энтропии в системе увеличивается, то доля бесполезной энергии тоже увеличивается, а полезной уменьшается. Следовательно, наша задача - рационально использовать полученную полезную энергию. Давайте рассмотрим на что расходуется солнечная энергия. Полезная и бесполезная энергия
 Солнечная энергия 47%- нагревание земной поверхности 30%-отражается обратно в космос частицами пыли и облаками, 22%-круговорот воды в природе, 0,1%- ветры, волны, океанические течения, 0,1%-процесс фотосинтеза. Но именно благодаря фотосинтезу мы имеем формы запасенной энергии - горючие ископаемые и биомассу (вещества животного и растительного происхождения в составе живых и неживых организмов. Пища, древесина.) БиомассаБиогаз.
Солнечная энергия 47%- нагревание земной поверхности 30%-отражается обратно в космос частицами пыли и облаками, 22%-круговорот воды в природе, 0,1%- ветры, волны, океанические течения, 0,1%-процесс фотосинтеза. Но именно благодаря фотосинтезу мы имеем формы запасенной энергии - горючие ископаемые и биомассу (вещества животного и растительного происхождения в составе живых и неживых организмов. Пища, древесина.) БиомассаБиогаз.
 Однако бывает так, что реакция термодинамически возможна, но протекает с очень малой скоростью, что экономически нецелесообразно. Ни знак, ни величина энергии Гиббса не отвечают на вопросы о скорости и пути протекания реакции. Переход к кинетике
Однако бывает так, что реакция термодинамически возможна, но протекает с очень малой скоростью, что экономически нецелесообразно. Ни знак, ни величина энергии Гиббса не отвечают на вопросы о скорости и пути протекания реакции. Переход к кинетике

