OKIS_VOSST_REAK.ppt
- Количество слайдов: 54
 Лекция
Лекция
 Окислительно-восстановительный процесс или редокс- процесс (ОВП) qэто процесс, в ходе которого происходит частичный или полный перенос электронов от одних атомов или ионов к другим. Признаком протекания редокс- процесса служит изменение степеней окисления Окисление Возрастание степени окисления (отдача электронов) Восстановление Убывание степени окисления (принятие электронов)
Окислительно-восстановительный процесс или редокс- процесс (ОВП) qэто процесс, в ходе которого происходит частичный или полный перенос электронов от одних атомов или ионов к другим. Признаком протекания редокс- процесса служит изменение степеней окисления Окисление Возрастание степени окисления (отдача электронов) Восстановление Убывание степени окисления (принятие электронов)
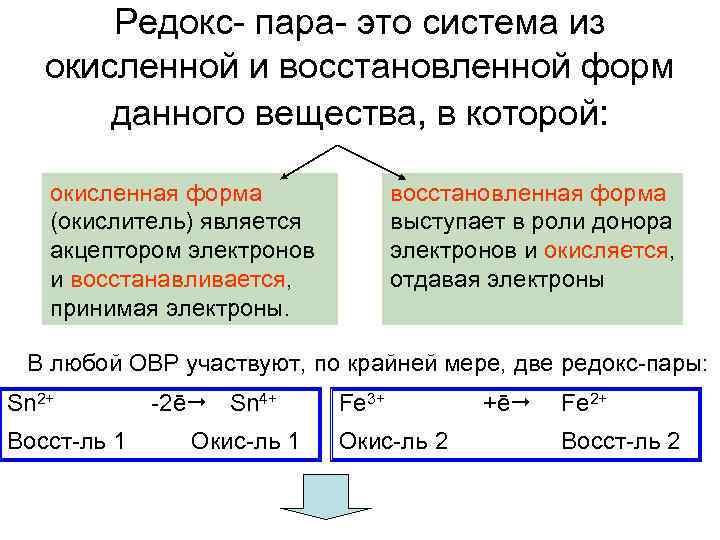 Редокс- пара- это система из окисленной и восстановленной форм данного вещества, в которой: окисленная форма (окислитель) является акцептором электронов и восстанавливается, принимая электроны. восстановленная форма выступает в роли донора электронов и окисляется, отдавая электроны В любой ОВР участвуют, по крайней мере, две редокс-пары: Sn 2+ -2ē Sn 4+ Восст-ль 1 Окис-ль 1 Fe 3+ Окис-ль 2 +ē Fe 2+ Восст-ль 2
Редокс- пара- это система из окисленной и восстановленной форм данного вещества, в которой: окисленная форма (окислитель) является акцептором электронов и восстанавливается, принимая электроны. восстановленная форма выступает в роли донора электронов и окисляется, отдавая электроны В любой ОВР участвуют, по крайней мере, две редокс-пары: Sn 2+ -2ē Sn 4+ Восст-ль 1 Окис-ль 1 Fe 3+ Окис-ль 2 +ē Fe 2+ Восст-ль 2
 Процессы окисления и восстановления протекают одновременно: Sn 2+ -2ē Sn 4+ Fe 3+ Fe 2+ +ē 2 1 окисление 2 восстановление Здесь имеются две редокс- пары Fe 3+/Fe 2+ и Sn 4+/ Sn 2+, каждая из которых содержит: окисленную форму: Fe 3+ , Sn 4+ и восстановленную форму: Fe 2+ и Sn 2+
Процессы окисления и восстановления протекают одновременно: Sn 2+ -2ē Sn 4+ Fe 3+ Fe 2+ +ē 2 1 окисление 2 восстановление Здесь имеются две редокс- пары Fe 3+/Fe 2+ и Sn 4+/ Sn 2+, каждая из которых содержит: окисленную форму: Fe 3+ , Sn 4+ и восстановленную форму: Fe 2+ и Sn 2+
 Примеры окислителей и восстановителей Окислители и восстановители: S и др. неметаллы, SO 2, KNO 2, HCl, H 2 O 2
Примеры окислителей и восстановителей Окислители и восстановители: S и др. неметаллы, SO 2, KNO 2, HCl, H 2 O 2
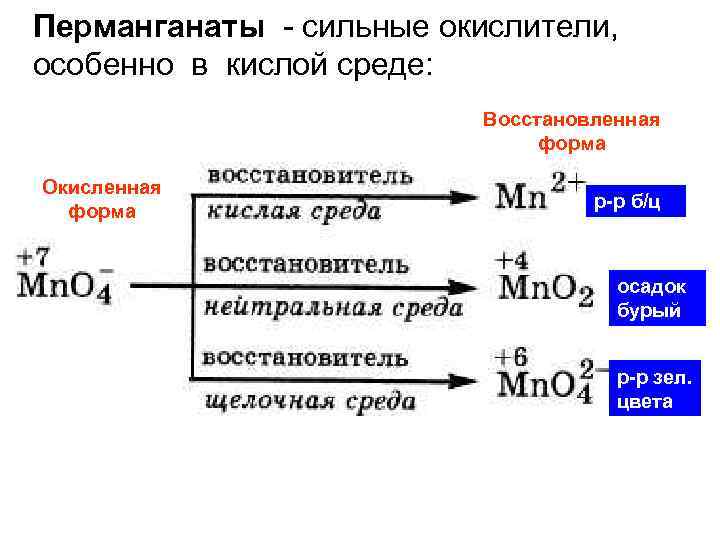 Перманганаты - сильные окислители, особенно в кислой среде: Восстановленная форма Окисленная форма р-р б/ц осадок бурый р-р зел. цвета
Перманганаты - сильные окислители, особенно в кислой среде: Восстановленная форма Окисленная форма р-р б/ц осадок бурый р-р зел. цвета
 Для организма перманганаты ядовиты • Для обезвреживания острых отравлений перманганатом KMn. O 4 используют восстановитель - 3 % раствор пероксида водорода H 2 O 2 в уксуснокислой среде СН 3 СООН: В результате реакции между ядом и противоядием образуется нетоксичное или малотоксичное соединение • Химические противоядия, как антидоты прямого действия могут действовать в любом месте – qдо проникновения яда в кровь, qпри циркуляции яда в крови, qи после фиксации в тканях.
Для организма перманганаты ядовиты • Для обезвреживания острых отравлений перманганатом KMn. O 4 используют восстановитель - 3 % раствор пероксида водорода H 2 O 2 в уксуснокислой среде СН 3 СООН: В результате реакции между ядом и противоядием образуется нетоксичное или малотоксичное соединение • Химические противоядия, как антидоты прямого действия могут действовать в любом месте – qдо проникновения яда в кровь, qпри циркуляции яда в крови, qи после фиксации в тканях.
 Электронно-ионный баланс (метод полуреакций При использовании этого метода: • Степени окисления элементов в составе реагирующих веществ не определяют. • В полуреакциях записывают ионы или молекулы сопряженных окисленной и восстановленной форм в том виде, в каком они существуют в растворе в условиях проведения реакции. • Слабые электролиты, газы и малорастворимые вещества записывают в молекулярном виде. • При уравнивании масс кислорода и водорода в правой и левой частях полуреакции можно использовать молекулы H 2 O, а также ионы Н+ и ОН-, образующиеся при ионизации воды.
Электронно-ионный баланс (метод полуреакций При использовании этого метода: • Степени окисления элементов в составе реагирующих веществ не определяют. • В полуреакциях записывают ионы или молекулы сопряженных окисленной и восстановленной форм в том виде, в каком они существуют в растворе в условиях проведения реакции. • Слабые электролиты, газы и малорастворимые вещества записывают в молекулярном виде. • При уравнивании масс кислорода и водорода в правой и левой частях полуреакции можно использовать молекулы H 2 O, а также ионы Н+ и ОН-, образующиеся при ионизации воды.
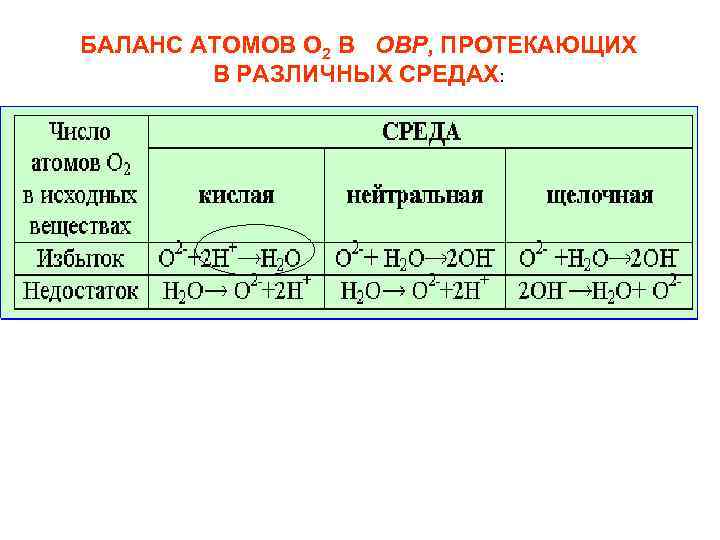 БАЛАНС АТОМОВ O 2 В ОВР, ПРОТЕКАЮЩИХ В РАЗЛИЧНЫХ СРЕДАХ:
БАЛАНС АТОМОВ O 2 В ОВР, ПРОТЕКАЮЩИХ В РАЗЛИЧНЫХ СРЕДАХ:
 Эквивалент окислителя – реальная или условная частица его, которая в процессе восстановления принимает 1ē. Эквивалент восстановителя -реальная или условная частица его, которая в процессе восстановления отдает 1ē. Молярная масса эквивалентов окислителя и восстановителя численно равна произведению молярной массы окислителя или восстановителя на фактор эквивалентности этого окислителя или восстановителя в данной реакции:
Эквивалент окислителя – реальная или условная частица его, которая в процессе восстановления принимает 1ē. Эквивалент восстановителя -реальная или условная частица его, которая в процессе восстановления отдает 1ē. Молярная масса эквивалентов окислителя и восстановителя численно равна произведению молярной массы окислителя или восстановителя на фактор эквивалентности этого окислителя или восстановителя в данной реакции:
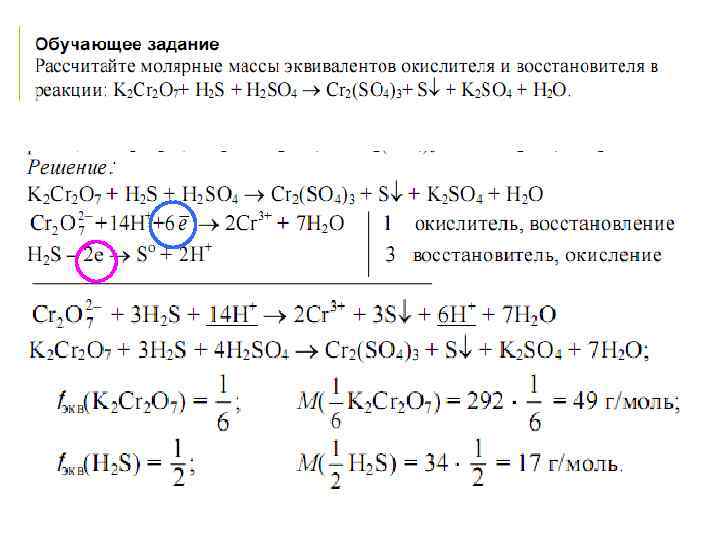
 Направление самопроизвольного протекания ОВР • Согласно второму закону термодинамики, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением свободной энергии Гиббса (ΔG < 0). • В случае реакций обмена это наблюдается, если в результате взаимодействия образуется газ, малорастворимое вещество или слабый электролит. • Для ОВ реакций ΔG < 0 в том случае, если из более сильных окислителя и восстановителя образуются более слабые.
Направление самопроизвольного протекания ОВР • Согласно второму закону термодинамики, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением свободной энергии Гиббса (ΔG < 0). • В случае реакций обмена это наблюдается, если в результате взаимодействия образуется газ, малорастворимое вещество или слабый электролит. • Для ОВ реакций ΔG < 0 в том случае, если из более сильных окислителя и восстановителя образуются более слабые.
 Окислительно-восстановительный потенциал (ОВП или редокс-потенциал) как мера окислительной и восстановительной способности веществ • ОВП (φ или Е)- количественная характеристика относительной силы различных окислительновосстановительных пар. Стандартный ОВП • Значения, которое принимает φ (или Е) при концентрациях равных 1 моль/л всех участников процесса и температуре 298 К (1 атм) называется стандардным окислительно-восстановительным потенциалом и обозначают φо или Ео.
Окислительно-восстановительный потенциал (ОВП или редокс-потенциал) как мера окислительной и восстановительной способности веществ • ОВП (φ или Е)- количественная характеристика относительной силы различных окислительновосстановительных пар. Стандартный ОВП • Значения, которое принимает φ (или Е) при концентрациях равных 1 моль/л всех участников процесса и температуре 298 К (1 атм) называется стандардным окислительно-восстановительным потенциалом и обозначают φо или Ео.
 Способа определения абсолютного значения φо не существует, • поэтому пользуются относительными величинами, характеризующими потенциалы сопряженных ОВ пар относительно эталонной пары: 2 H++2ē↔H 2, потенциал которой при стандартных условиях условно принят равным 0.
Способа определения абсолютного значения φо не существует, • поэтому пользуются относительными величинами, характеризующими потенциалы сопряженных ОВ пар относительно эталонной пары: 2 H++2ē↔H 2, потенциал которой при стандартных условиях условно принят равным 0.
 Условием самопроизвольного протекания ОВР является положительное значение её ЭДС Δφ= Если Δφ > 0, то реакция протекает в прямом направлении в соответствии с записью уравнения реакции. Если Δφ < 0, то реакция протекает в обратном направлении согласно записи уравнения реакции. Если Δφ = 0, то система находится в состоянии устойчивого химического равновесия.
Условием самопроизвольного протекания ОВР является положительное значение её ЭДС Δφ= Если Δφ > 0, то реакция протекает в прямом направлении в соответствии с записью уравнения реакции. Если Δφ < 0, то реакция протекает в обратном направлении согласно записи уравнения реакции. Если Δφ = 0, то система находится в состоянии устойчивого химического равновесия.

 Определение направления ОВР по значениям окислительных потенциалов систем • В таблице стандартных потенциалов окислительно-восстановительные пары чаще всего располагаются в порядке убывания соответствующих им значений потенциалов (см. табл. ). • Например ионы Мп. О 4 - в кислой среде (φо = 1, 51 В) могут служить окислителями для ионов Сl- (φо = 1, 36 В), превращая их в Cl 2 и образуя сами ионы Мn 2+.
Определение направления ОВР по значениям окислительных потенциалов систем • В таблице стандартных потенциалов окислительно-восстановительные пары чаще всего располагаются в порядке убывания соответствующих им значений потенциалов (см. табл. ). • Например ионы Мп. О 4 - в кислой среде (φо = 1, 51 В) могут служить окислителями для ионов Сl- (φо = 1, 36 В), превращая их в Cl 2 и образуя сами ионы Мn 2+.
 Зависимость р. Н раствора выражается уравнением Нернста -Петерса 1 • где φ - OB потенциал данной пары, В; • φ° - стандартный ОВ потенциал той же пары, В; • R - универсальная газовая постоянная, равная 8, 314 Дж/(моль К); • Т - абсолютная температура, К;
Зависимость р. Н раствора выражается уравнением Нернста -Петерса 1 • где φ - OB потенциал данной пары, В; • φ° - стандартный ОВ потенциал той же пары, В; • R - универсальная газовая постоянная, равная 8, 314 Дж/(моль К); • Т - абсолютная температура, К;
 • n -число электронов в полуреакции перехода окисленной формы в восстановленную; • F - число Фарадея, т. е. заряд 1 моль электронов, равный 96 500 Кл/моль; • [окисл. ], [восст. ] - активные концентрации окисленной и восстановленной форм, моль/л.
• n -число электронов в полуреакции перехода окисленной формы в восстановленную; • F - число Фарадея, т. е. заряд 1 моль электронов, равный 96 500 Кл/моль; • [окисл. ], [восст. ] - активные концентрации окисленной и восстановленной форм, моль/л.
 • Из уравнения (1) следует, что чем выше температура, больше концентрация окисленной формы и меньше концентрация восстановленной формы в растворе, тем больше значение потенциала φ и выше окислительная способность системы. • В стандартных условиях [окисл. ] = [восст. ] и ln ([окисл. |/{восст. ]) = 0. Тогда φ = φo. • Если в уравнение (1) подставить численные значения констант и перейти от натуральных к десятичным логарифмам (ln. N = 2, 303 lg. N), то для температуры 298 К получим:
• Из уравнения (1) следует, что чем выше температура, больше концентрация окисленной формы и меньше концентрация восстановленной формы в растворе, тем больше значение потенциала φ и выше окислительная способность системы. • В стандартных условиях [окисл. ] = [восст. ] и ln ([окисл. |/{восст. ]) = 0. Тогда φ = φo. • Если в уравнение (1) подставить численные значения констант и перейти от натуральных к десятичным логарифмам (ln. N = 2, 303 lg. N), то для температуры 298 К получим:
 Окислительно-восстановительный электрод это электрод, состоящий из инертного материала (металлические платина, золото, вольфрам, титан, а также графит), погруженного в водный раствор, в котором имеются окисленная и восстановленная форма данного вещества. В общем виде схему сложного окислительновосстановительного электрода можно записать следующим образом восстановление окисление Потенциал такого электрода зависит не только от активности окисленных и восстановленных частиц, но и активности ионов водорода.
Окислительно-восстановительный электрод это электрод, состоящий из инертного материала (металлические платина, золото, вольфрам, титан, а также графит), погруженного в водный раствор, в котором имеются окисленная и восстановленная форма данного вещества. В общем виде схему сложного окислительновосстановительного электрода можно записать следующим образом восстановление окисление Потенциал такого электрода зависит не только от активности окисленных и восстановленных частиц, но и активности ионов водорода.

 Глубина протекания ОВР • Чем больше стандартный потенциал реакции (φо), тем выше ее константа равновесия (Кр) и тем больше глубина протекания реакции. n – количество перераспределенных электронов
Глубина протекания ОВР • Чем больше стандартный потенциал реакции (φо), тем выше ее константа равновесия (Кр) и тем больше глубина протекания реакции. n – количество перераспределенных электронов
 Гальванический элемент
Гальванический элемент
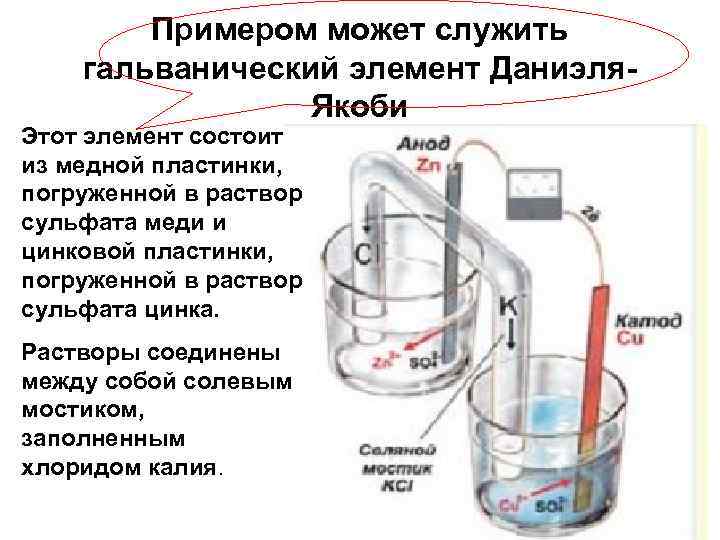 Примером может служить гальванический элемент Даниэля. Якоби Этот элемент состоит из медной пластинки, погруженной в раствор сульфата меди и цинковой пластинки, погруженной в раствор сульфата цинка. Растворы соединены между собой солевым мостиком, заполненным хлоридом калия.
Примером может служить гальванический элемент Даниэля. Якоби Этот элемент состоит из медной пластинки, погруженной в раствор сульфата меди и цинковой пластинки, погруженной в раствор сульфата цинка. Растворы соединены между собой солевым мостиком, заполненным хлоридом калия.
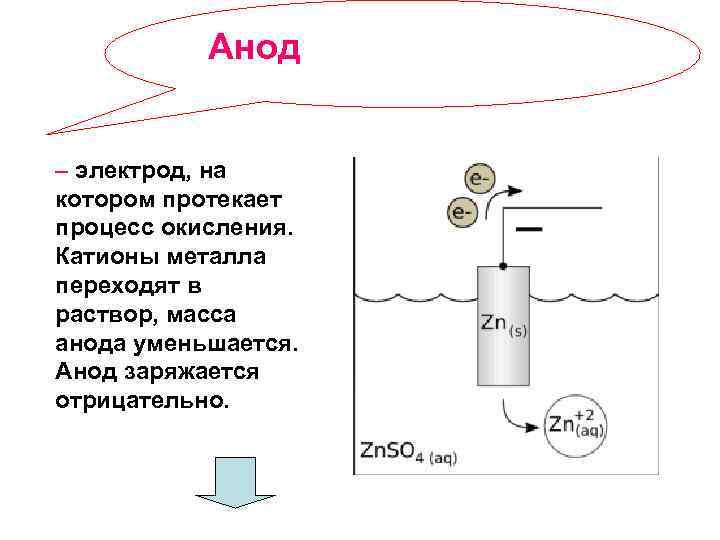 Анод – электрод, на котором протекает процесс окисления. Катионы металла переходят в раствор, масса анода уменьшается. Анод заряжается отрицательно.
Анод – электрод, на котором протекает процесс окисления. Катионы металла переходят в раствор, масса анода уменьшается. Анод заряжается отрицательно.
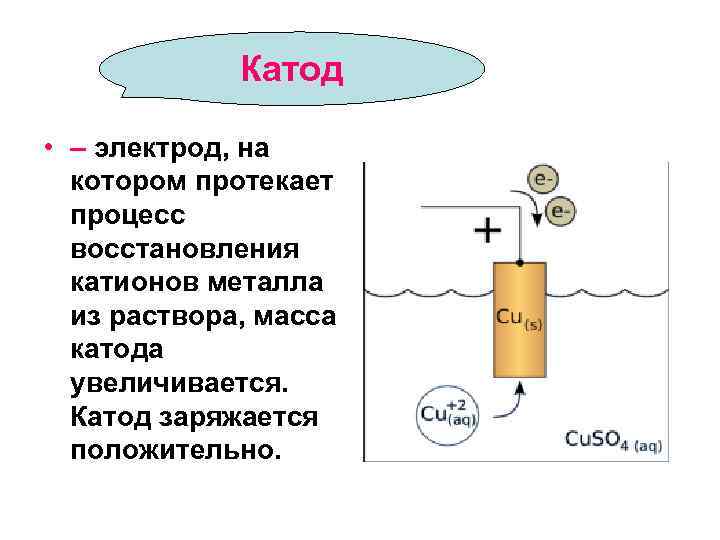 Катод • – электрод, на котором протекает процесс восстановления катионов металла из раствора, масса катода увеличивается. Катод заряжается положительно.
Катод • – электрод, на котором протекает процесс восстановления катионов металла из раствора, масса катода увеличивается. Катод заряжается положительно.
 Условная запись гальванического элемента • В схеме гальванического элемента согласно правилам ИЮПАК (Международный союз теоретической и прикладной химии) слева записывают анод, справа – катод. • Границу раздела м/у металлом и раствором обозначают одной вертикальной чертой. • Границу раздела двух растворов – двумя сплошными вертикальными чертами. Компоненты одной фазы записывают через запятую.
Условная запись гальванического элемента • В схеме гальванического элемента согласно правилам ИЮПАК (Международный союз теоретической и прикладной химии) слева записывают анод, справа – катод. • Границу раздела м/у металлом и раствором обозначают одной вертикальной чертой. • Границу раздела двух растворов – двумя сплошными вертикальными чертами. Компоненты одной фазы записывают через запятую.

 1 2 3 4 5
1 2 3 4 5


 Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов- это последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φо (фи) или Ео, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me.
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов- это последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φо (фи) или Ео, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me.
 • Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе: Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu 2+ → Zn 2+ + Cu возможно только в прямом направлении.
• Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе: Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu 2+ → Zn 2+ + Cu возможно только в прямом направлении.
 • Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой. • Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют. • При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
• Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой. • Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют. • При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
 Электрохимический ряд напряжений металлов Убывание восстановительной активности Н
Электрохимический ряд напряжений металлов Убывание восстановительной активности Н
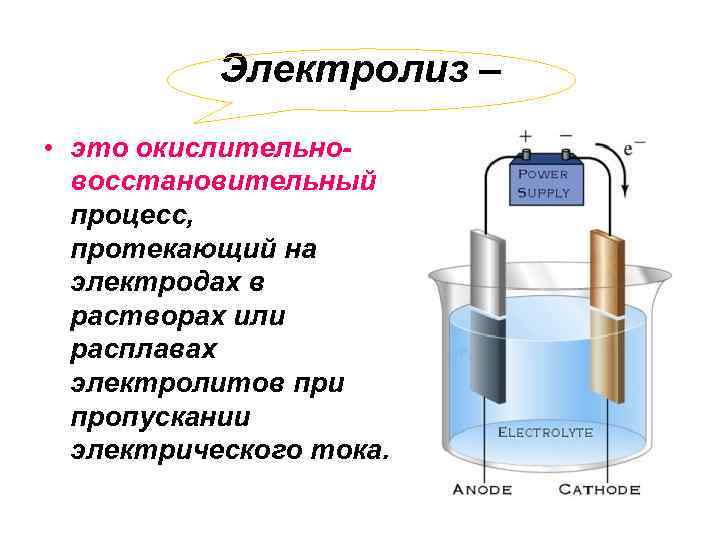 Электролиз – • это окислительновосстановительный процесс, протекающий на электродах в растворах или расплавах электролитов при пропускании электрического тока.
Электролиз – • это окислительновосстановительный процесс, протекающий на электродах в растворах или расплавах электролитов при пропускании электрического тока.
 Сущность электролиза • заключается в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Сущность электролиза • заключается в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
 Электролиз в расплавах На катоде происходит процесс восстановления • В расплавах катионы металла восстанавливаются до свободного металла: Мn+ + nē = М 0
Электролиз в расплавах На катоде происходит процесс восстановления • В расплавах катионы металла восстанавливаются до свободного металла: Мn+ + nē = М 0
 • В расплавах анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например: 2 Cl– – 2ē = Cl 20 • Кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов: SO 42– – 2ē = SO 20 + O 20.
• В расплавах анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например: 2 Cl– – 2ē = Cl 20 • Кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов: SO 42– – 2ē = SO 20 + O 20.
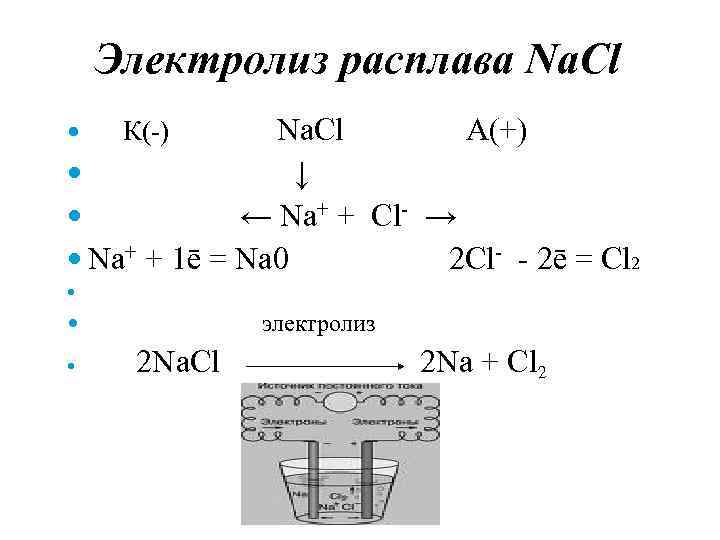 Электролиз расплава Na. Cl А(+) ↓ ← Na+ + Cl- → Na+ + 1ē = Na 0 2 Cl- - 2ē = Cl 2 К(-) электролиз 2 Na. Cl 2 Na + Cl 2
Электролиз расплава Na. Cl А(+) ↓ ← Na+ + Cl- → Na+ + 1ē = Na 0 2 Cl- - 2ē = Cl 2 К(-) электролиз 2 Na. Cl 2 Na + Cl 2
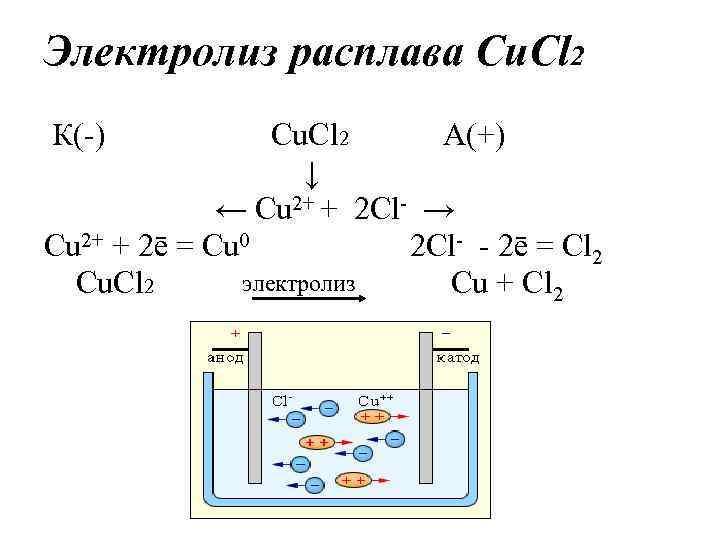 Электролиз расплава Cu. Cl 2 К(-) Cu. Cl 2 А(+) ↓ ← Cu 2+ + 2 Cl- → Cu 2+ + 2ē = Cu 0 2 Cl- - 2ē = Cl 2 электролиз Cu. Cl 2 Cu + Cl 2
Электролиз расплава Cu. Cl 2 К(-) Cu. Cl 2 А(+) ↓ ← Cu 2+ + 2 Cl- → Cu 2+ + 2ē = Cu 0 2 Cl- - 2ē = Cl 2 электролиз Cu. Cl 2 Cu + Cl 2
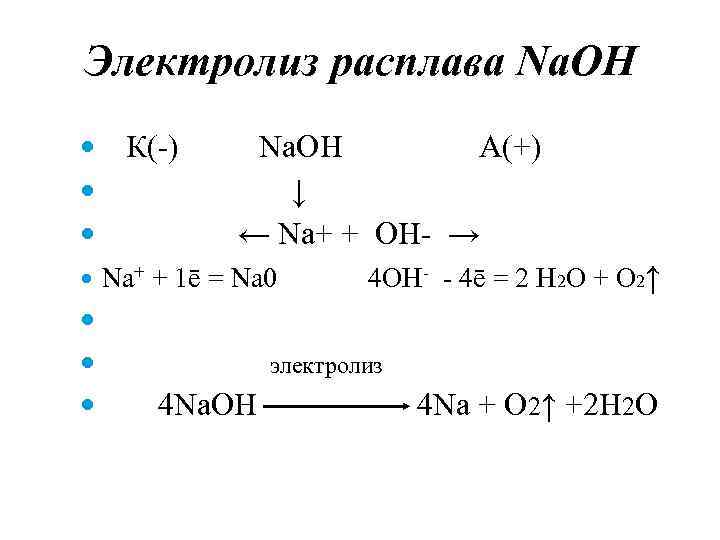 Электролиз расплава Na. OH К(-) Na. OH А(+) ↓ ← Na+ + OH- → Na+ + 1ē = Na 0 4 OH- - 4ē = 2 H 2 O + O 2↑ электролиз 4 Na. OH 4 Na + O 2↑ +2 H 2 O
Электролиз расплава Na. OH К(-) Na. OH А(+) ↓ ← Na+ + OH- → Na+ + 1ē = Na 0 4 OH- - 4ē = 2 H 2 O + O 2↑ электролиз 4 Na. OH 4 Na + O 2↑ +2 H 2 O
 Электролиз в растворах (процесс на катоде) • В растворах процесс на катоде не зависит от материала катода, а зависит от активности восстанавливаемого металла. а) Если металл расположен в ряду напряжений от Li до Al включительно, то на катоде идет процесс восстановления воды: 2 Н 2 О + 2ē = H 20 + 2 OH–
Электролиз в растворах (процесс на катоде) • В растворах процесс на катоде не зависит от материала катода, а зависит от активности восстанавливаемого металла. а) Если металл расположен в ряду напряжений от Li до Al включительно, то на катоде идет процесс восстановления воды: 2 Н 2 О + 2ē = H 20 + 2 OH–
 б) Если металл расположен в ряду напряжений между Al и H 2 , то на катоде идут одновременно процессы восстановления воды и катионов металла: 2 Н 2 О + 2ē = H 20 + 2 OH– Мn+ + nē = М 0 в) Если металл расположен в ряду напряжений после Н 2, то на катоде идет процесс восстановления катионов металла: Мn+ + nē = М 0 При электролизе растворов кислот идет процесс восстановления ионов водорода: 2 Н+ + 2ē = H 20
б) Если металл расположен в ряду напряжений между Al и H 2 , то на катоде идут одновременно процессы восстановления воды и катионов металла: 2 Н 2 О + 2ē = H 20 + 2 OH– Мn+ + nē = М 0 в) Если металл расположен в ряду напряжений после Н 2, то на катоде идет процесс восстановления катионов металла: Мn+ + nē = М 0 При электролизе растворов кислот идет процесс восстановления ионов водорода: 2 Н+ + 2ē = H 20
 Процесс на аноде В растворах процесс на аноде зависит от материала анода и от природы аниона. Аноды могут быть двух видов – растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза) - и нерастворимые, или инертные (уголь, графит, платина, золото) а) Если анод растворимый, то независимо от природы аниона всегда идет окисление металла анода, например: Cu 0 – 2ē = Cu 2+
Процесс на аноде В растворах процесс на аноде зависит от материала анода и от природы аниона. Аноды могут быть двух видов – растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза) - и нерастворимые, или инертные (уголь, графит, платина, золото) а) Если анод растворимый, то независимо от природы аниона всегда идет окисление металла анода, например: Cu 0 – 2ē = Cu 2+
 Процесс на аноде б) Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление анионов: 2 Cl– – 2ē = Cl 20 В случае кислородсодержащих анионов и фторидов идет процесс окисления воды, анион при этом не окисляется и остается в растворе: 2 H 2 O – 4ē = O 20 + 4 H+ При электролизе растворов щелочей идет окисление гидроксид-ионов: 4 OH– – 4ē = O 20 + 2 H 2 O
Процесс на аноде б) Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление анионов: 2 Cl– – 2ē = Cl 20 В случае кислородсодержащих анионов и фторидов идет процесс окисления воды, анион при этом не окисляется и остается в растворе: 2 H 2 O – 4ē = O 20 + 4 H+ При электролизе растворов щелочей идет окисление гидроксид-ионов: 4 OH– – 4ē = O 20 + 2 H 2 O
 Электролиз раствора Na. Cl на инертном аноде Na. Cl А(+) ↓ ← Na+ + Cl- → 2 Н 2 О + 2ē = H 2 + 2 OH 2 Cl- - 2ē = Cl 2↑ К(-) электролиз 2 Na. Cl + 2 H 2 O H 2 + Cl 2 +2 Na. OH
Электролиз раствора Na. Cl на инертном аноде Na. Cl А(+) ↓ ← Na+ + Cl- → 2 Н 2 О + 2ē = H 2 + 2 OH 2 Cl- - 2ē = Cl 2↑ К(-) электролиз 2 Na. Cl + 2 H 2 O H 2 + Cl 2 +2 Na. OH
 Электролиз раствора Cu. SO 4 на инертном аноде К(-) ← Cu 2+ + 2ē = Cu 0 Cu. SO 4 ↓ + SO 42 - → А(+) 2 H 2 O – 4ē = O 2↑ + 4 H+ электролиз 2 Cu. SO 4 + 2 H 2 O 2 Cu + O 2 + 2 H 2 SO 4
Электролиз раствора Cu. SO 4 на инертном аноде К(-) ← Cu 2+ + 2ē = Cu 0 Cu. SO 4 ↓ + SO 42 - → А(+) 2 H 2 O – 4ē = O 2↑ + 4 H+ электролиз 2 Cu. SO 4 + 2 H 2 O 2 Cu + O 2 + 2 H 2 SO 4
 Электролиз раствора Na. Cl на растворимом аноде К(-) Na. Cl ↓ ← Na+ + Cl- → Cu 2+ + 2ē = Cu 0 А(+) (Cu) Cu 0 – 2ē =Cu 2+ (т. к. Cu 2+ в ряду напряжений стоят после H+) Происходит переход ионов меди с анода на катод. Концентрация Na. Cl в растворе не меняется.
Электролиз раствора Na. Cl на растворимом аноде К(-) Na. Cl ↓ ← Na+ + Cl- → Cu 2+ + 2ē = Cu 0 А(+) (Cu) Cu 0 – 2ē =Cu 2+ (т. к. Cu 2+ в ряду напряжений стоят после H+) Происходит переход ионов меди с анода на катод. Концентрация Na. Cl в растворе не меняется.
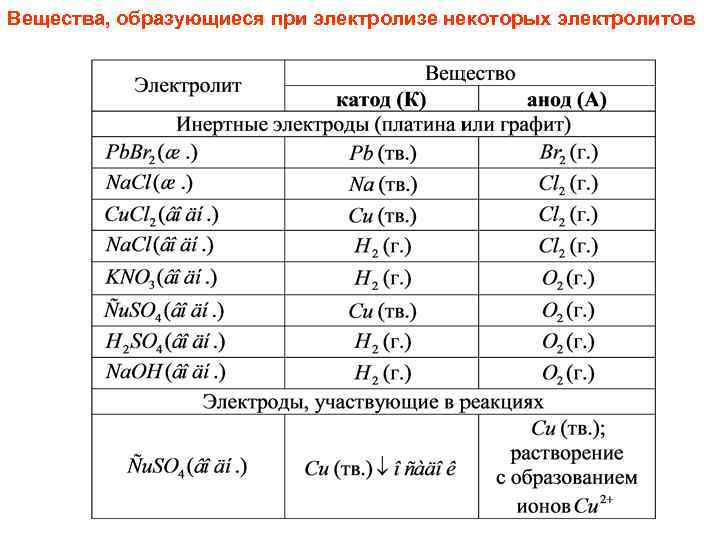 Вещества, образующиеся при электролизе некоторых электролитов
Вещества, образующиеся при электролизе некоторых электролитов
 Коррозией называется процесс разрушения металлов вследствие химического или электрохимического взаимодействия их с внешней средой. Химическая коррозия развивается в агрессивных средах, не проводящих электрического тока, например, газах при высоких температурах, Так, железо при нагревании соединяется с кислородом воздуха с образованием оксидов (окалины) наблюдается в зубопротезировании в основном при изготовлении и починке протезов. В условиях эксплуатации протезов может развиваться электрохимическая коррозия
Коррозией называется процесс разрушения металлов вследствие химического или электрохимического взаимодействия их с внешней средой. Химическая коррозия развивается в агрессивных средах, не проводящих электрического тока, например, газах при высоких температурах, Так, железо при нагревании соединяется с кислородом воздуха с образованием оксидов (окалины) наблюдается в зубопротезировании в основном при изготовлении и починке протезов. В условиях эксплуатации протезов может развиваться электрохимическая коррозия
 лита
лита


