Лекция 7 Металлы.ppt
- Количество слайдов: 52

Лекция Металлы. Общие свойства.

Что такое металлы? Как определить?

• Мета ллы (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.

• Температурный коэффициент сопротивления (Тс) характеризует зависимость электрического сопротивления от температуры и измеряется в кельвинах в минус первой степени (K− 1). • Также часто применяется термин «температурный коэффициент проводимости» (Тп). Он равен коэффициенту сопротивления с противоположным знаком. • Для большинства металлов Тп положителен: их сопротивление растёт с ростом температуры. • Для полупроводников без примесей Тп отрицателен (сопротивление с ростом температуры падает).

• Однако необходимо учитывать не только физические, но и химические свойства. Важная характеристика металлич. Элементов - их способность образовывать основные оксиды и гидроксиды.

• У металлов главных подгрупп периодич. системы основность оксидов и гидроксидов растет сверху вниз, в побочных подгруппах (кроме I - III) - обратная зависимость. По периодам и рядам с ростом порядкового номера элемента основность убывает. У металлов, имеющих несколько степеней окисления, как d- и f-металлы, с ростом степени окисления основность оксидов уменьшается и высшие оксиды имеют кислотный характер.

Металлы составляют ~75% элементов периодической системы. Металлические свойства усиливаются:

В зависимости от плотности, металлы делят на лёгкие (0, 53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22, 5 г/см³). Самым лёгким металлом является литий (плотность 0. 53 г/см³).

Свойства металлов: • • • твердые при обычных условиях, хорошо проводят тепло и электрический ток, образуют стабильные ионные соединения, металлическая связь(электронная природа), ковкость, пластичность, кристалличность, в большинстве случаев оксиды и гидроксиды имеют основной характер(особенно в низких степенях окисления), • в большинстве случаев проявляют положительные степени окисления.

Металлы образуют большее число связей на один атом, чем неметаллы. При сравнении заселенности орбиталей легко заметить, что металлы имеют слишком мало электронов для заполнения имеющихся у них атомных орбиталей, тогда как атомные орбитали неметаллов заполнены более чем наполовину до состояния соответствующего благородного газа.
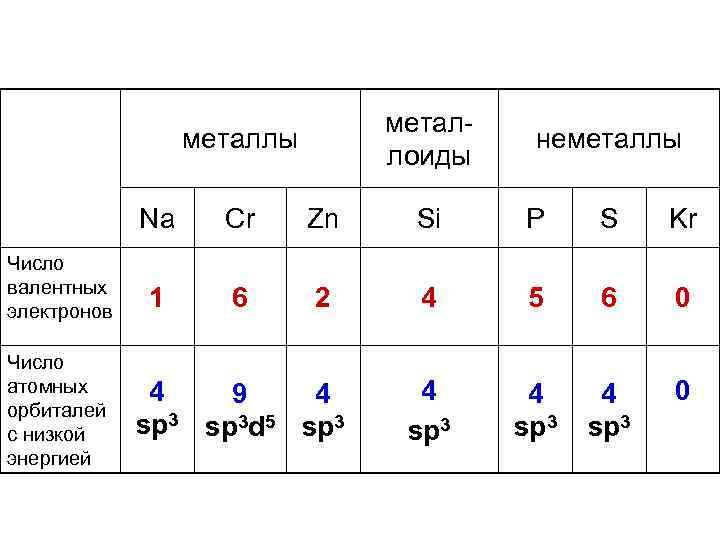
металлоиды металлы неметаллы Na Число валентных электронов Число атомных орбиталей с низкой энергией Cr Zn Si P S Kr 1 6 2 4 5 6 0 4 sp 3 0 4 9 4 sp 3 d 5 sp 3

Металлы элементы, имеющие малое число электронов для заполнения своих орбиталей при небольших координационных числах. Электронодефицитные элементы.

Неметаллы элементы, имеющие достаточное число электронов для заполнения соответствующих орбиталей. У этих атомов часто остаются валентные электроны, не участвующие в образовании связей.

Металлоиды элементы, которым, как правило, хватает электронов для заполнения орбиталей при невысоких координационных числах (обычно кч=4), но в образовании связей не участвует лишь незначительное число валентных электронов или вообще ни одного не остается «про запас» .

Одним из следствий наличия у металлов большего числа орбиталей, чем электронов, является делокализация электронного облака, обуславливающая свойства металлов. Напротив неметаллы имеют локализованные электронные облака, поскольку все орбитали с низкой энергией у них заполнены, и принцип Паули запрещает делокализацию электронов.
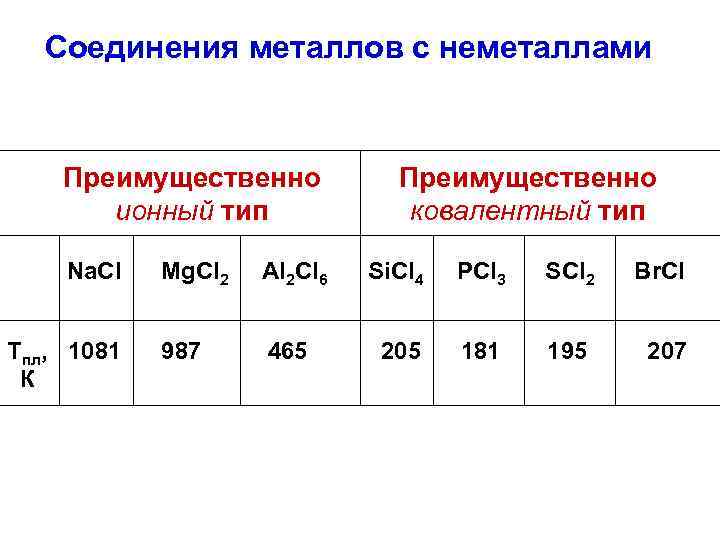
Соединения металлов с неметаллами Преимущественно ионный тип Преимущественно ковалентный тип Na. Cl Mg. Cl 2 Al 2 Cl 6 Si. Cl 4 PCl 3 SCl 2 Br. Cl Tпл, 1081 987 465 205 181 195 207 К

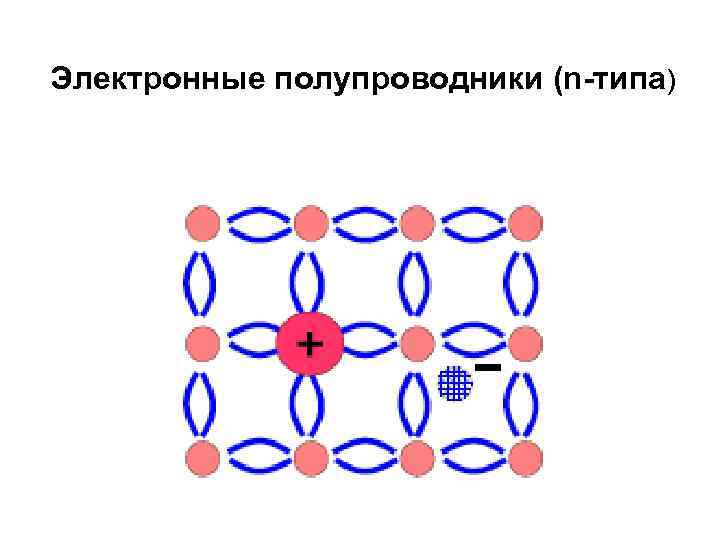
Дефектные соединения 1. Аниондефицитные: Zn. О, Na. WO 3, Cu 2 O, Fe 2 O 3, Cd. O. Ca 0, 1 WO 3 (вместо Ca 0, 1 WO 3, 1) 1. О 2 -(кр) ½О 2(г) + 2 е-(кр) 2. Полупроводники n-типа

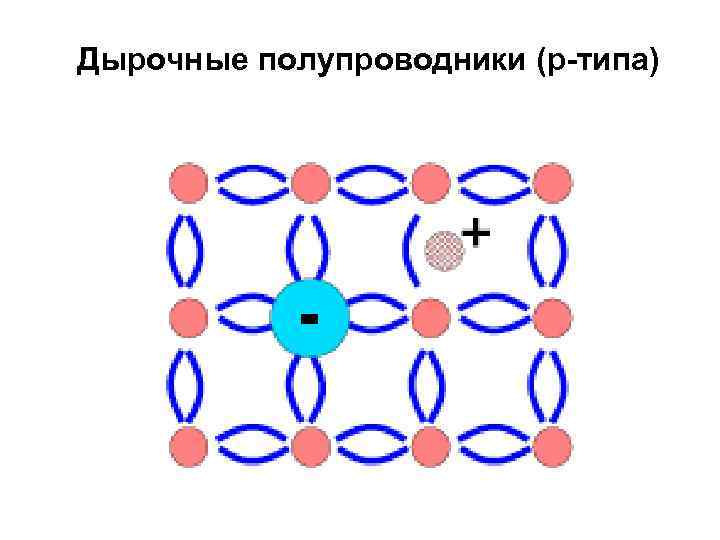
2. Катиондефицитные: Fe. O, Fe. S 2, Fe. S Fe 0, 95 O, Fe 0, 91 S 2, Fe 0, 86 S Полупроводники р-типа

Полупроводники — материалы, которые по своей удельной проводимости занимают промежуточное место между проводниками и диэлектриками и отличаются от проводников сильной зависимостью удельной проводимости от концентрации примесей, температуры и различных видов излучения. Основным свойством этих материалов является увеличение электрической проводимости с ростом температуры. Проводимость полупроводников сильно зависит от температуры. Вблизи абсолютного нуля температуры полупроводники имеют свойства диэлектриков.
Электронные полупроводники (n-типа)
Дырочные полупроводники (р-типа)

Дырка Во время разрыва связи между электроном и ядром появляется свободное место в электронной оболочке атома. Это обуславливает переход электрона с другого атома на атом со свободным местом. На атом, откуда перешёл электрон, входит другой электрон из другого атома и т. д. Это обуславливается ковалентными связями атомов. Таким образом, происходит перемещение положительного заряда без перемещения самого атома. Этот условный положительный заряд называют дыркой. Обычно подвижность дырок в полупроводнике ниже подвижности электронов.

Металлургия В природе металлы встречаются в виде минералов и руд. • Минерал – природное неорганическое твердое вещество с кристаллической структурой. • Руда –залежи, в которых металл содержится в экономически оправданных концентрациях. • Пустая порода – ненужные вещества, присутствующие в руде.

Примеры руд • • Сильвит KCl Известняк Ca. CO 3 Боксит Al 2 O 3·x. H 2 O Гематит Fe 2 O 3·x. H 2 O Халькопирит Cu. Fe. S 2 Самородное золото Au Магнезит Mg. CO 3

Металлургия – область науки и техники и отрасль промышленности, связанные с извлечением металлов из руд и получением их в виде, пригодном для использования.

• По основному технологическому процессу подразделяется на: пирометаллургию (плавка) и гидрометаллургию (извлечение металлов в химических растворах).

• Металлургия подразделяется на чёрную и цветную. • Чёрная металлургия включает добычу и обогащение руд чёрных металлов, производство чугуна, стали и ферросплавов. • К цветной металлургии относят добычу, обогащение руд цветных металлов, производство цветных металлов и их сплавов.

• К чёрным металлам относят железо. • Все остальные — цветные.
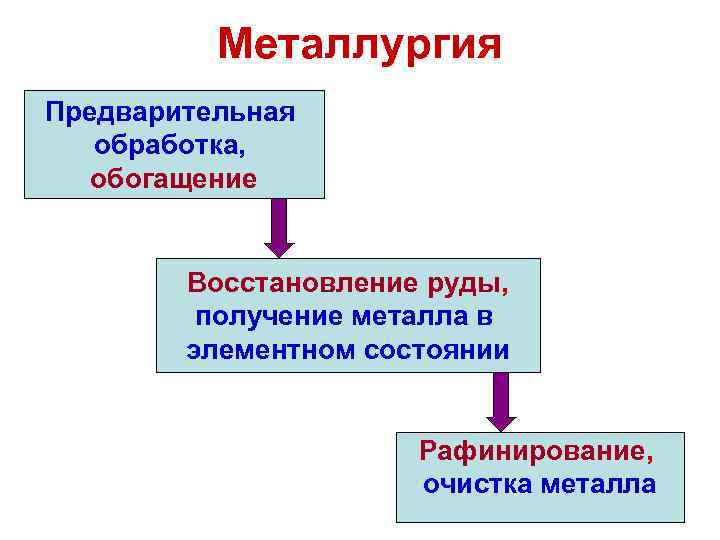
Металлургия Предварительная обработка, обогащение Восстановление руды, получение металла в элементном состоянии Рафинирование, очистка металла

Обогащение руды Флотация Выщелачивание Прокаливание

Флотация Руду мелко размалывают и затем смешивают с маслом и водой в большом баке. Смесь вспенивают, пропуская через нее поток воздуха. Масляная пена захватывает необходимый минерал и всплывает к верхнему краю бака, откуда ее снимают.

Выщелачивание Экстракция металла в составе какойнибудь его растворимой соли из приготовленного водного раствора. 4 Ag(тв) + 8 CN- +O 2 +2 H 2 O = 4 Ag(CN)2 -(вод) + 4 OH- Обработка руды , содержащей медь(II), разбавленной серной кислотой: Cu. O(тв) + 2 H+(вод) = Cu 2+(вод) + H 2 O(ж)

Прокаливание После предварительного удаления пустой породы многие руды прокаливают для того, чтобы удалить летучие примеси, выжечь органические вещества, превратить карбонаты и сульфиды в оксиды.

Восстановление Электролитическое Химическое

Электролитическое восстановление Электролиз проводят с помощью инертных электродов (графита) для таких активных металлов как алюминий, магний, натрий. Металлы восстанавливаются на катоде в жидком виде и накапливаются на дне электролизера. Электролитическое получение кальция из хлорида кальция: Cа 2+(ж) + 2 е- = Са(тв)

Химическое восстановление Менее активные металлы могут быть восстановлены из оксидных руд при помощи углерода или оксида углерода. Примеры: 1) Fe 2 O 3(тв) + 3 CO(г) = 2 Fe(ж) + 3 CO 2(г) 2) 2 Zn. S(тв) + 3 O 2(г) = 2 SO 2(г) + 2 Zn. O(тв) + CO(г) = Zn(тв) + CO 2 (г)
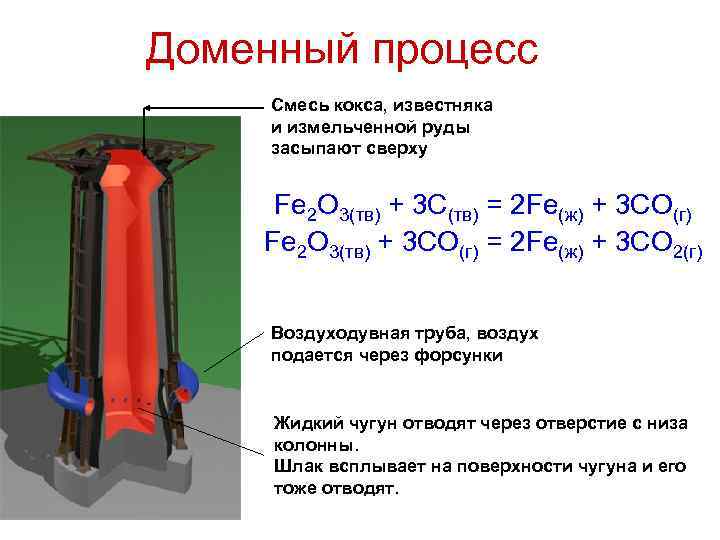
Доменный процесс Смесь кокса, известняка и измельченной руды засыпают сверху Fe 2 O 3(тв) + 3 C(тв) = 2 Fe(ж) + 3 CO(г) Fe 2 O 3(тв) + 3 CO(г) = 2 Fe(ж) + 3 CO 2(г) Воздуходувная труба, воздух подается через форсунки Жидкий чугун отводят через отверстие с низа колонны. Шлак всплывает на поверхности чугуна и его тоже отводят.

Рафинирование Электролиз Перегонка Кислородно-конвертерный процесс Зонная плавка

Рафинирование электролизом Используется для получения очень чистых металлов. Например, для меди содержание 0, 03% мышьяка снижает электропроводность на 14%.

Перегонка Используется для рафинирования ртути.

Кислородно-конвертерный процесс Используется при превращении чугуна в сталь. В кислородноконвертерном процессе в расплавленное железо добавляют известняк, который образует шлак, содержащий фосфор и кремний. При продувании через железо кислорода под высоким давлением в нем выгорают примеси серы и углерода.

Зонная плавка Используется для очистки кремния или германия, применяемых в полупроводниковой технике. Вдоль стержня металла, подвергаемого очистке, медленно перемещают спиральный нагреватель, вдоль стержня перемещается расплавленная зона, в которой концентрируются примеси и выводятся таким образом к концу слитка. Этот конец отрезают, а оставшийся слиток свободен от примесей.
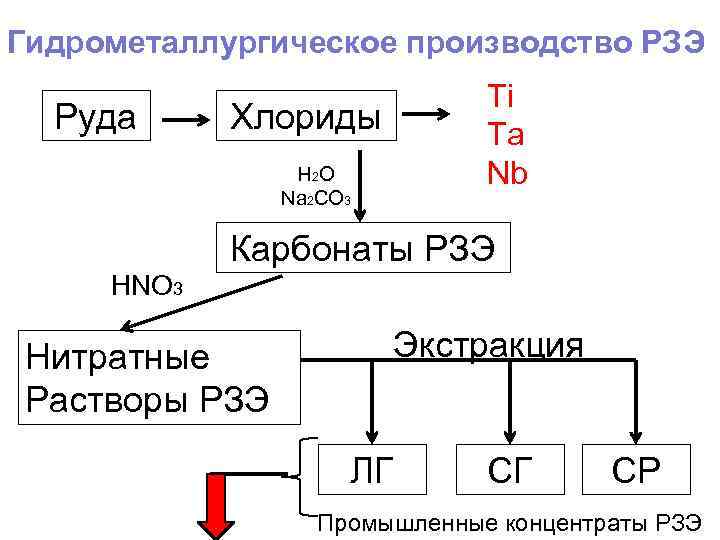
Гидрометаллургическое производство РЗЭ Руда Ti Ta Nb Хлориды H 2 O Na 2 CO 3 Карбонаты РЗЭ HNO 3 Нитратные Растворы РЗЭ Экстракция ЛГ СГ СР Промышленные концентраты РЗЭ
Индивидуальные Оксиды Металлы

Соединения металлов с металлами СПЛАВЫ - макроскопические однородные системы, состоящие из двух или более металлов (режеметаллов и неметаллов) с характерными металлическими свойствами.
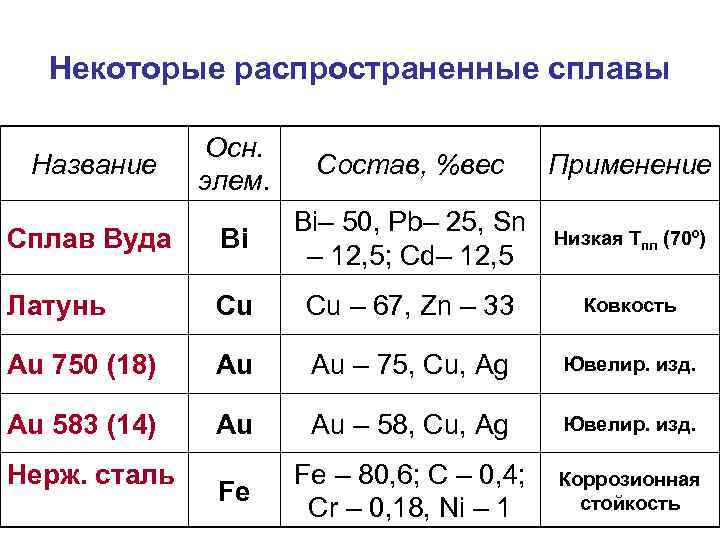
Некоторые распространенные сплавы Осн. элем. Состав, %вес Применение Сплав Вуда Bi Bi– 50, Pb– 25, Sn – 12, 5; Cd– 12, 5 Низкая Тпл (70º) Латунь Cu Cu – 67, Zn – 33 Au 750 (18) Au Au – 75, Cu, Ag Ювелир. изд. Au 583 (14) Au Au – 58, Cu, Ag Ювелир. изд. Fe Fe – 80, 6; C – 0, 4; Cr – 0, 18, Ni – 1 Коррозионная стойкость Название Нерж. сталь Ковкость

Сплавы разделяют на: • Твердые растворы • Гетерогенные смеси • Интерметаллические соединения

Твердые растворы Представляют собой гомогенные смеси, компоненты которых хаотически и равномерно распределены в объеме сплава. Различают растворы замещения и растворы внедрения.
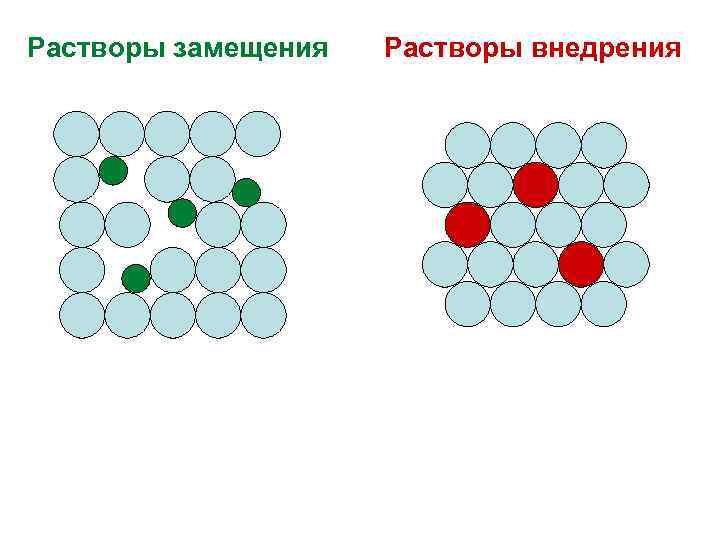
Растворы замещения Растворы внедрения

Гетерогенные смеси Компоненты сплава распределены по объему неравномерно. Смеси обычно не имеют характерной температуры плавления. Свинец Олово Сплав, 64% олова Тпл 237 Сº 232 Сº 181 Сº Смесь с минимальной температурой плавления называется эвтектической.

Интерметаллические соединения Интерметалли д (интерметаллическое соединение) — химическое соединение из двух или более металлов. Однородны по составу и имеют четко определенный свойства и состав. Пример: Сu. Al 2 - дюралюмин.
Лекция 7 Металлы.ppt