_complex_2.ppt
- Количество слайдов: 87
 ЛЕКЦИЯ №ЧЧ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
ЛЕКЦИЯ №ЧЧ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
![ПРИМЕРЫ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ [NH 4]Cl [Al(H 2 O)6]Cl 3 K[I(I)2] H 2[Sn. Cl 6] ПРИМЕРЫ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ [NH 4]Cl [Al(H 2 O)6]Cl 3 K[I(I)2] H 2[Sn. Cl 6]](https://present5.com/presentation/5166196_60606078/image-2.jpg) ПРИМЕРЫ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ [NH 4]Cl [Al(H 2 O)6]Cl 3 K[I(I)2] H 2[Sn. Cl 6] K 2[Be(OH)4] K[Bi. I 4] [Al(H 2 O)3(OH)3] [NH 4]2[Be(CO 3)2]
ПРИМЕРЫ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ [NH 4]Cl [Al(H 2 O)6]Cl 3 K[I(I)2] H 2[Sn. Cl 6] K 2[Be(OH)4] K[Bi. I 4] [Al(H 2 O)3(OH)3] [NH 4]2[Be(CO 3)2]
![ИОННЫЙ МЕХАНИЗМ NH 3 + H+ = [NH 4]+ BF 3 + F- = ИОННЫЙ МЕХАНИЗМ NH 3 + H+ = [NH 4]+ BF 3 + F- =](https://present5.com/presentation/5166196_60606078/image-3.jpg) ИОННЫЙ МЕХАНИЗМ NH 3 + H+ = [NH 4]+ BF 3 + F- = [BF 4]Fe 2+ + 6 CN- = [Fe(CN)6]4 -
ИОННЫЙ МЕХАНИЗМ NH 3 + H+ = [NH 4]+ BF 3 + F- = [BF 4]Fe 2+ + 6 CN- = [Fe(CN)6]4 -
 КОМПЛЕКСЫ - ЭТО сложные частицы, образованные из реально существующих более простых частиц и способные к самостоятельному существованию в узлах кристаллической решетки и в растворах. SO 42 - - не комплексное соединение (КС), т. к. не существуют частицы S 6+и O 2 -
КОМПЛЕКСЫ - ЭТО сложные частицы, образованные из реально существующих более простых частиц и способные к самостоятельному существованию в узлах кристаллической решетки и в растворах. SO 42 - - не комплексное соединение (КС), т. к. не существуют частицы S 6+и O 2 -
 КТО? ? ? Альфред ВЕРНЕР (Нобелевская премия 1913 г. ) Координационная теория 1893 г.
КТО? ? ? Альфред ВЕРНЕР (Нобелевская премия 1913 г. ) Координационная теория 1893 г.
![СХЕМА Na 4[Fe(CN)6] [Cu(NH 3)2](OH) внешн. сфера центральный атом лиганд [Ni(NH 3)6]2[Fe(CN)6] внутр. сфера СХЕМА Na 4[Fe(CN)6] [Cu(NH 3)2](OH) внешн. сфера центральный атом лиганд [Ni(NH 3)6]2[Fe(CN)6] внутр. сфера](https://present5.com/presentation/5166196_60606078/image-6.jpg) СХЕМА Na 4[Fe(CN)6] [Cu(NH 3)2](OH) внешн. сфера центральный атом лиганд [Ni(NH 3)6]2[Fe(CN)6] внутр. сфера [Cr(CO)6]0
СХЕМА Na 4[Fe(CN)6] [Cu(NH 3)2](OH) внешн. сфера центральный атом лиганд [Ni(NH 3)6]2[Fe(CN)6] внутр. сфера [Cr(CO)6]0
![КОМПЛЕКСООБРАЗОВАТЕЛЬ (ЦЕНТРАЛЬНЫЙ АТОМ) ±n, 0 (ЧАЩЕ ВСЕГО d-ЭЛЕМЕНТ) М 0 [Ni(CO)4] +III [BH 4]-III КОМПЛЕКСООБРАЗОВАТЕЛЬ (ЦЕНТРАЛЬНЫЙ АТОМ) ±n, 0 (ЧАЩЕ ВСЕГО d-ЭЛЕМЕНТ) М 0 [Ni(CO)4] +III [BH 4]-III](https://present5.com/presentation/5166196_60606078/image-7.jpg) КОМПЛЕКСООБРАЗОВАТЕЛЬ (ЦЕНТРАЛЬНЫЙ АТОМ) ±n, 0 (ЧАЩЕ ВСЕГО d-ЭЛЕМЕНТ) М 0 [Ni(CO)4] +III [BH 4]-III [NH 4]+
КОМПЛЕКСООБРАЗОВАТЕЛЬ (ЦЕНТРАЛЬНЫЙ АТОМ) ±n, 0 (ЧАЩЕ ВСЕГО d-ЭЛЕМЕНТ) М 0 [Ni(CO)4] +III [BH 4]-III [NH 4]+
 ЛИГАНДЫ от lat. связывать ±n, 0 L H+ CO NH 3 H- F-
ЛИГАНДЫ от lat. связывать ±n, 0 L H+ CO NH 3 H- F-
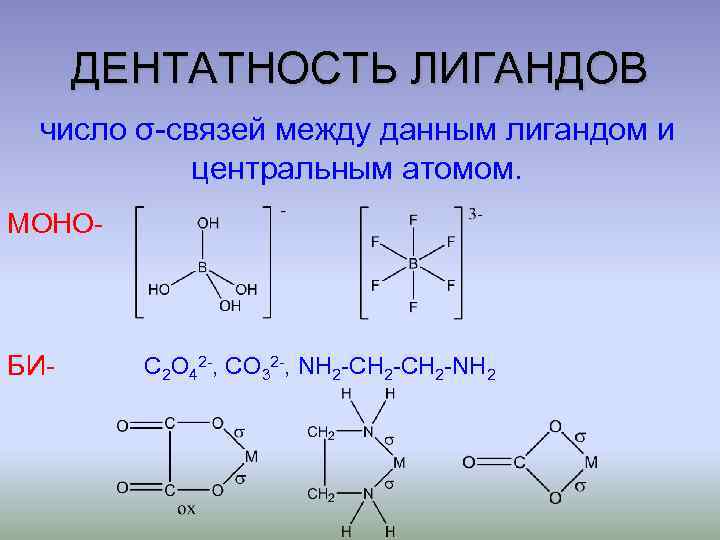 ДЕНТАТНОСТЬ ЛИГАНДОВ число σ-связей между данным лигандом и центральным атомом. МОНО- БИ- C 2 O 42 -, CO 32 -, NH 2 -CH 2 -NH 2
ДЕНТАТНОСТЬ ЛИГАНДОВ число σ-связей между данным лигандом и центральным атомом. МОНО- БИ- C 2 O 42 -, CO 32 -, NH 2 -CH 2 -NH 2
 ДЕНТАТНОСТЬ ЛИГАНДОВ АМБИ- : SCN-, : NCS-, : SO 32 -, : OSO 22 -, : SO 3 S 2 -, : OSO 2 S 2 -, : NO 2 -, : ONO- Также существуют ПОЛИдентатные лиганды
ДЕНТАТНОСТЬ ЛИГАНДОВ АМБИ- : SCN-, : NCS-, : SO 32 -, : OSO 22 -, : SO 3 S 2 -, : OSO 2 S 2 -, : NO 2 -, : ONO- Также существуют ПОЛИдентатные лиганды
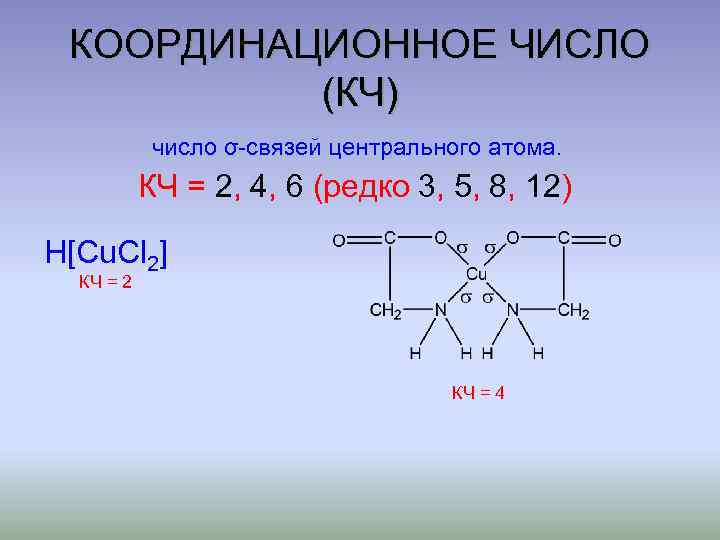 КООРДИНАЦИОННОЕ ЧИСЛО (КЧ) число σ-связей центрального атома. КЧ = 2, 4, 6 (редко 3, 5, 8, 12) H[Cu. Cl 2] КЧ = 2 КЧ = 4
КООРДИНАЦИОННОЕ ЧИСЛО (КЧ) число σ-связей центрального атома. КЧ = 2, 4, 6 (редко 3, 5, 8, 12) H[Cu. Cl 2] КЧ = 2 КЧ = 4
 ФОРМЫ КОМПЛЕКСНЫХ ЧАСТИЦ КЧ = 2 КЧ = 3 КЧ = 4 sp dsp 2 sp 3, dp 3 sp 2 КЧ = 5 sp 3 d, dsp 3 d 2 sp 2 КЧ = 6 КЧ = 7 sp 3 d 2 sp 3 d 3 КЧ = 8 sp 3 d 4
ФОРМЫ КОМПЛЕКСНЫХ ЧАСТИЦ КЧ = 2 КЧ = 3 КЧ = 4 sp dsp 2 sp 3, dp 3 sp 2 КЧ = 5 sp 3 d, dsp 3 d 2 sp 2 КЧ = 6 КЧ = 7 sp 3 d 2 sp 3 d 3 КЧ = 8 sp 3 d 4
![НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ [M(L+)k(L 0)m(L-)g]0, n± НАЗЫВАЮТСЯ С КОНЦА НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ [M(L+)k(L 0)m(L-)g]0, n± НАЗЫВАЮТСЯ С КОНЦА](https://present5.com/presentation/5166196_60606078/image-13.jpg) НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ [M(L+)k(L 0)m(L-)g]0, n± НАЗЫВАЮТСЯ С КОНЦА
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ [M(L+)k(L 0)m(L-)g]0, n± НАЗЫВАЮТСЯ С КОНЦА
 КОМПЛЕКСЫ С АНИОННЫМИ ЛИГАНДАМИ
КОМПЛЕКСЫ С АНИОННЫМИ ЛИГАНДАМИ
 КОМПЛЕКСЫ С КАТИОННЫМИ ЛИГАНДАМИ Н+ - гидро N 2 H 5+ - гидразиний
КОМПЛЕКСЫ С КАТИОННЫМИ ЛИГАНДАМИ Н+ - гидро N 2 H 5+ - гидразиний
 КОМПЛЕКСЫ С НЕЙТРАЛЬНЫМИ ЛИГАНДАМИ NO – нитрозил H 2 O – аква NH 3 – аммин CO – карбонил NH 2–CH 2–NH 2 – en – этилендиамин
КОМПЛЕКСЫ С НЕЙТРАЛЬНЫМИ ЛИГАНДАМИ NO – нитрозил H 2 O – аква NH 3 – аммин CO – карбонил NH 2–CH 2–NH 2 – en – этилендиамин
![ПРИМЕР Co(NH )Cl NO [Co(NH 3)4(NO 2)Cl]NO 3 нитрат хлоронитротетраамминкобальта(II) ПРИМЕР Co(NH )Cl NO [Co(NH 3)4(NO 2)Cl]NO 3 нитрат хлоронитротетраамминкобальта(II)](https://present5.com/presentation/5166196_60606078/image-17.jpg) ПРИМЕР Co(NH )Cl NO [Co(NH 3)4(NO 2)Cl]NO 3 нитрат хлоронитротетраамминкобальта(II)
ПРИМЕР Co(NH )Cl NO [Co(NH 3)4(NO 2)Cl]NO 3 нитрат хлоронитротетраамминкобальта(II)
 АМБИДЕНТАТНЫЕ ЛИГАНДЫ (-NO 2)- - нитро (-O-N-O-)- - нитрито (-SCN)- - тиоционато(S) (-NCS)- - тиоционато(N) (-CN)- - циано(С) (-NC)- - циано(N) [MLn]0 – одно слово в именительном падеже
АМБИДЕНТАТНЫЕ ЛИГАНДЫ (-NO 2)- - нитро (-O-N-O-)- - нитрито (-SCN)- - тиоционато(S) (-NCS)- - тиоционато(N) (-CN)- - циано(С) (-NC)- - циано(N) [MLn]0 – одно слово в именительном падеже
![ПРИМЕРЫ [Ni(CO)4]0 – тетракарбонилникель [Co(NH 3)3 Cl 3]0 – трихлортриамминкобальт(III) ПРИМЕРЫ [Ni(CO)4]0 – тетракарбонилникель [Co(NH 3)3 Cl 3]0 – трихлортриамминкобальт(III)](https://present5.com/presentation/5166196_60606078/image-19.jpg) ПРИМЕРЫ [Ni(CO)4]0 – тетракарбонилникель [Co(NH 3)3 Cl 3]0 – трихлортриамминкобальт(III)
ПРИМЕРЫ [Ni(CO)4]0 – тетракарбонилникель [Co(NH 3)3 Cl 3]0 – трихлортриамминкобальт(III)
![[MLn]+Xназывается внешний анион, затем комплекс в родительном падеже, название центрального атома – производное от [MLn]+Xназывается внешний анион, затем комплекс в родительном падеже, название центрального атома – производное от](https://present5.com/presentation/5166196_60606078/image-20.jpg) [MLn]+Xназывается внешний анион, затем комплекс в родительном падеже, название центрального атома – производное от русского названия элемента (СО ЦА) [Ag(NH 3)2]Cl – хлорид диамминсеребра(I) [Al(H 2 O)6]Cl 3 – хлорид гексаакваалюминия(III)
[MLn]+Xназывается внешний анион, затем комплекс в родительном падеже, название центрального атома – производное от русского названия элемента (СО ЦА) [Ag(NH 3)2]Cl – хлорид диамминсеребра(I) [Al(H 2 O)6]Cl 3 – хлорид гексаакваалюминия(III)
![X+[MLn]называется комплексный анион (название центрального атома от латинского корня + <ат>), затем внешнесферный катион. X+[MLn]называется комплексный анион (название центрального атома от латинского корня + <ат>), затем внешнесферный катион.](https://present5.com/presentation/5166196_60606078/image-21.jpg) X+[MLn]называется комплексный анион (название центрального атома от латинского корня + <ат>), затем внешнесферный катион. K 2[Pb(OH)4] – тетрагидроксоплюмбат(II) калия Na 4[Fe(CN)6] – гексацианоферрат(II) натрия
X+[MLn]называется комплексный анион (название центрального атома от латинского корня + <ат>), затем внешнесферный катион. K 2[Pb(OH)4] – тетрагидроксоплюмбат(II) калия Na 4[Fe(CN)6] – гексацианоферрат(II) натрия
![[MLn]+[M’L’m]- [Cl(F)2][Sb. F 6] – гексафторостибат(V) дифторохлора(III) [K(H 2 O)6][Al(H 2 O)6](SO 4)2 – [MLn]+[M’L’m]- [Cl(F)2][Sb. F 6] – гексафторостибат(V) дифторохлора(III) [K(H 2 O)6][Al(H 2 O)6](SO 4)2 –](https://present5.com/presentation/5166196_60606078/image-22.jpg) [MLn]+[M’L’m]- [Cl(F)2][Sb. F 6] – гексафторостибат(V) дифторохлора(III) [K(H 2 O)6][Al(H 2 O)6](SO 4)2 – сульфат гексаакваалюминия-гексааквакалия
[MLn]+[M’L’m]- [Cl(F)2][Sb. F 6] – гексафторостибат(V) дифторохлора(III) [K(H 2 O)6][Al(H 2 O)6](SO 4)2 – сульфат гексаакваалюминия-гексааквакалия
 МНОГОЯДЕРНЫЕ КС ди( -карбонил) - бис(трикабонилкобальт) сульфат ди( -гидроксо) – бис(тетраакваалюминия) декакарбонилдимарганец
МНОГОЯДЕРНЫЕ КС ди( -карбонил) - бис(трикабонилкобальт) сульфат ди( -гидроксо) – бис(тетраакваалюминия) декакарбонилдимарганец
 МНОГОЯДЕРНЫЕ КС несколько центральных атомов комплексном соединении: а) с мостиковыми лигандами б) кластеры в одном
МНОГОЯДЕРНЫЕ КС несколько центральных атомов комплексном соединении: а) с мостиковыми лигандами б) кластеры в одном
![С МОСТИКОВЫМИ ЛИГАНДАМИ [Cl 2 Al. Cl 2] ЯДРО КС [Al 2(H 2 O)8(OH)2]4+ С МОСТИКОВЫМИ ЛИГАНДАМИ [Cl 2 Al. Cl 2] ЯДРО КС [Al 2(H 2 O)8(OH)2]4+](https://present5.com/presentation/5166196_60606078/image-25.jpg) С МОСТИКОВЫМИ ЛИГАНДАМИ [Cl 2 Al. Cl 2] ЯДРО КС [Al 2(H 2 O)8(OH)2]4+ ЯДРО КС
С МОСТИКОВЫМИ ЛИГАНДАМИ [Cl 2 Al. Cl 2] ЯДРО КС [Al 2(H 2 O)8(OH)2]4+ ЯДРО КС
![КЛАСТЕРЫ имеют непосредственные связи центральными атомами – связи М-М: [Mn 2(CO)10] = [(CO)5 Mn-Mn(CO)5] КЛАСТЕРЫ имеют непосредственные связи центральными атомами – связи М-М: [Mn 2(CO)10] = [(CO)5 Mn-Mn(CO)5]](https://present5.com/presentation/5166196_60606078/image-26.jpg) КЛАСТЕРЫ имеют непосредственные связи центральными атомами – связи М-М: [Mn 2(CO)10] = [(CO)5 Mn-Mn(CO)5] между
КЛАСТЕРЫ имеют непосредственные связи центральными атомами – связи М-М: [Mn 2(CO)10] = [(CO)5 Mn-Mn(CO)5] между
 АКВАКОМПЛЕКСЫ M : OH 2 (H 2 O) Мυ+ + m. H 2 O [M(H 2 O)m]υ+ β ~ 103 ÷ 107 НЕ ОБРАЗУЮТ: Ag+, Au+, Hg 2+
АКВАКОМПЛЕКСЫ M : OH 2 (H 2 O) Мυ+ + m. H 2 O [M(H 2 O)m]υ+ β ~ 103 ÷ 107 НЕ ОБРАЗУЮТ: Ag+, Au+, Hg 2+
![СВОЙСТВА АКВАКОМПЛЕКСОВ Аквакомплексы – катионные кислоты H+ H+ [Cr(H 2 O)6]3+ + H 2 СВОЙСТВА АКВАКОМПЛЕКСОВ Аквакомплексы – катионные кислоты H+ H+ [Cr(H 2 O)6]3+ + H 2](https://present5.com/presentation/5166196_60606078/image-28.jpg) СВОЙСТВА АКВАКОМПЛЕКСОВ Аквакомплексы – катионные кислоты H+ H+ [Cr(H 2 O)6]3+ + H 2 O [Cr(H 2 O)5 OH]2+ + H 3 O+ Аквакомплексы склонны к обмену лигандов
СВОЙСТВА АКВАКОМПЛЕКСОВ Аквакомплексы – катионные кислоты H+ H+ [Cr(H 2 O)6]3+ + H 2 O [Cr(H 2 O)5 OH]2+ + H 3 O+ Аквакомплексы склонны к обмену лигандов
 УДАЛЕНИЕ ВОДЫ ПРИ НАГРЕВАНИИ Кристаллогидраты – аквакомплексы Al. Cl 3 6 H 2 O ≡ [Al(H 2 O)6]Cl 3 Cu. SO 4 5 H 2 O ≡ [Cu(H 2 O)4]SO 4 H 2 O t 2[Al(H 2 O)6]Cl 3 Al 2 O 3 + 6 HCl + 9 H 2 O t [Cu(H 2 O)4]SO 4 H 2 O [Cu(H 2 O)4]SO 4 + H 2 O
УДАЛЕНИЕ ВОДЫ ПРИ НАГРЕВАНИИ Кристаллогидраты – аквакомплексы Al. Cl 3 6 H 2 O ≡ [Al(H 2 O)6]Cl 3 Cu. SO 4 5 H 2 O ≡ [Cu(H 2 O)4]SO 4 H 2 O t 2[Al(H 2 O)6]Cl 3 Al 2 O 3 + 6 HCl + 9 H 2 O t [Cu(H 2 O)4]SO 4 H 2 O [Cu(H 2 O)4]SO 4 + H 2 O
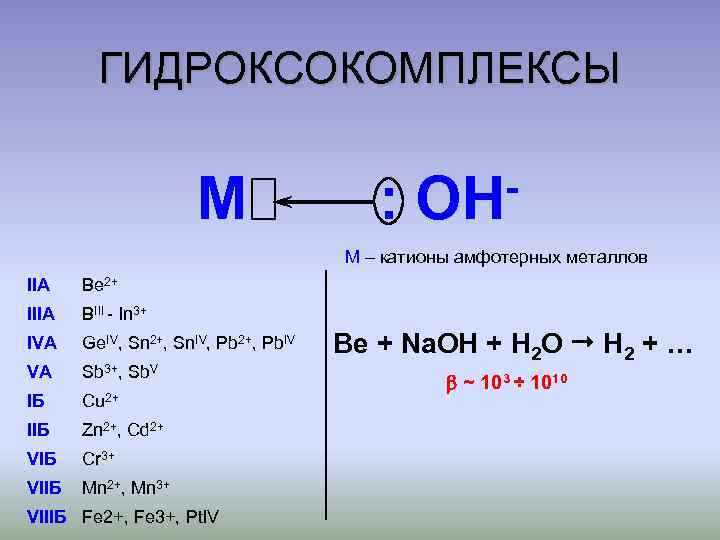 ГИДРОКСОКОМПЛЕКСЫ M : OH M – катионы амфотерных металлов IIA Be 2+ IIIA BIII - In 3+ IVA Ge. IV, Sn 2+, Sn. IV, Pb 2+, Pb. IV VA Sb 3+, Sb. V IБ Cu 2+ IIБ Zn 2+, Cd 2+ VIБ Cr 3+ VIIБ Mn 2+, Mn 3+ VIIIБ Fe 2+, Fe 3+, Pt. IV Be + Na. OH + H 2 O H 2 + … ~ 103 ÷ 1010
ГИДРОКСОКОМПЛЕКСЫ M : OH M – катионы амфотерных металлов IIA Be 2+ IIIA BIII - In 3+ IVA Ge. IV, Sn 2+, Sn. IV, Pb 2+, Pb. IV VA Sb 3+, Sb. V IБ Cu 2+ IIБ Zn 2+, Cd 2+ VIБ Cr 3+ VIIБ Mn 2+, Mn 3+ VIIIБ Fe 2+, Fe 3+, Pt. IV Be + Na. OH + H 2 O H 2 + … ~ 103 ÷ 1010
![ПОЛУЧЕНИЕ Zn. O + 2 KOH + H 2 O = K 2[Zn(OH)4] Be(OH)2 ПОЛУЧЕНИЕ Zn. O + 2 KOH + H 2 O = K 2[Zn(OH)4] Be(OH)2](https://present5.com/presentation/5166196_60606078/image-31.jpg) ПОЛУЧЕНИЕ Zn. O + 2 KOH + H 2 O = K 2[Zn(OH)4] Be(OH)2 + 2 Na. OH = Na 2[Be(OH)4] Al. Cl 3 + 4 KOH = K[Al(OH)4] + 3 KCl 2 KAl. O 2 + 2 H 2 O K[Al(OH)4] Гидроксокомплексы устойчивы только в СИЛЬНОЩЕЛОЧНОЙ СРЕДЕ
ПОЛУЧЕНИЕ Zn. O + 2 KOH + H 2 O = K 2[Zn(OH)4] Be(OH)2 + 2 Na. OH = Na 2[Be(OH)4] Al. Cl 3 + 4 KOH = K[Al(OH)4] + 3 KCl 2 KAl. O 2 + 2 H 2 O K[Al(OH)4] Гидроксокомплексы устойчивы только в СИЛЬНОЩЕЛОЧНОЙ СРЕДЕ
 АММИАКАТЫ M : NH 3 M – катионы d-элементов IБ Cu. I, Cu. II, Ag. I IIБ Zn. II, Cd. II, Hg. II VIIIБ Co. II, Co. III, Ni. II Cl- + [Cu(H 2 O)4]2+ +NH 3 H 2 O = [Cu(H 2 O)3 OH]Cl + NH 4+ [Cu(H 2 O)3 OH]Cl(тв. ) + 3 NH 3 H 2 O + NH 4+ = = [Cu(NH 3)4]2+ + 7 H 2 O + Cl- : Cu. Cl 2 + 4 NH 3 H 2 O = [Cu(NH 3)4]Cl 2 + 4 H 2 O
АММИАКАТЫ M : NH 3 M – катионы d-элементов IБ Cu. I, Cu. II, Ag. I IIБ Zn. II, Cd. II, Hg. II VIIIБ Co. II, Co. III, Ni. II Cl- + [Cu(H 2 O)4]2+ +NH 3 H 2 O = [Cu(H 2 O)3 OH]Cl + NH 4+ [Cu(H 2 O)3 OH]Cl(тв. ) + 3 NH 3 H 2 O + NH 4+ = = [Cu(NH 3)4]2+ + 7 H 2 O + Cl- : Cu. Cl 2 + 4 NH 3 H 2 O = [Cu(NH 3)4]Cl 2 + 4 H 2 O
 СВОЙСТВА β ~ 1010 ÷ 1032 устойчивее аква-к. с. и гидроксо-к. с. в водных растворах существуют при избытке NH 3 [Ni(NH 3)6]2+ + 2 H 2 O [Ni(NH 3)5 H 2 O]2+ + NH 3 H 2 O в кислотной среде – разлагаются (в аква-к. с. ) 2 H 2 O + [Zn(NH 3)4]2+ + 4 H 3 O+ = [Zn(H 2 O)6]2+ + 4 NH 4+ термически нестойки (NH 3 ) t [Cu(NH 3)4]SO 4 = Cu. SO 4 + 4 NH 3
СВОЙСТВА β ~ 1010 ÷ 1032 устойчивее аква-к. с. и гидроксо-к. с. в водных растворах существуют при избытке NH 3 [Ni(NH 3)6]2+ + 2 H 2 O [Ni(NH 3)5 H 2 O]2+ + NH 3 H 2 O в кислотной среде – разлагаются (в аква-к. с. ) 2 H 2 O + [Zn(NH 3)4]2+ + 4 H 3 O+ = [Zn(H 2 O)6]2+ + 4 NH 4+ термически нестойки (NH 3 ) t [Cu(NH 3)4]SO 4 = Cu. SO 4 + 4 NH 3
 АЦИДОКОМПЛЕКСЫ M : n. А M – катионы s, p, d-элементов L – анионы кислот F-, Cl-, Br-, I-, CN-, NCS-, NO 2 -, C 2 O 42 -, S 2 O 32 -, S 2 - …
АЦИДОКОМПЛЕКСЫ M : n. А M – катионы s, p, d-элементов L – анионы кислот F-, Cl-, Br-, I-, CN-, NCS-, NO 2 -, C 2 O 42 -, S 2 O 32 -, S 2 - …
![ПРИМЕРЫ [Be(CO 3)2]2[Si. F 6]2[Fe(NCS)6]3 - ПРИМЕРЫ [Be(CO 3)2]2[Si. F 6]2[Fe(NCS)6]3 -](https://present5.com/presentation/5166196_60606078/image-35.jpg) ПРИМЕРЫ [Be(CO 3)2]2[Si. F 6]2[Fe(NCS)6]3 -
ПРИМЕРЫ [Be(CO 3)2]2[Si. F 6]2[Fe(NCS)6]3 -
![ПОЛУЧЕНИЕ Hg + 4 HI = H 2 + H 2[Hg. I 4] β ПОЛУЧЕНИЕ Hg + 4 HI = H 2 + H 2[Hg. I 4] β](https://present5.com/presentation/5166196_60606078/image-36.jpg) ПОЛУЧЕНИЕ Hg + 4 HI = H 2 + H 2[Hg. I 4] β ~ 1038 3 Pt + 4 HNO 3 + 6 HCl = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O β ~ 1016 2 Au + 4 KCN + H 2 O + 1/2 O 2 = 2 K[Au(CN)2] + 2 KOH β ~ 1038 Ag. I(тв. ) + 2 Na 2 S 2 O 3 = Na 3[Ag(S 2 O 3)2] + Na. I β ~ 1013 [Fe(H 2 O)6]3+ + 3 NCS- [Fe(H 2 O)3(NCS)3]0 + 3 H 2 O β ~ 103 [Fe(H 2 O)6]3+ + 6 CN- = [Fe(CN)6]3 - + 6 H 2 O β ~ 1044 [Cu(H 2 O)4 ]2+ HBr [Cu. Br 4]2 HO 2 β 2 ~ 106
ПОЛУЧЕНИЕ Hg + 4 HI = H 2 + H 2[Hg. I 4] β ~ 1038 3 Pt + 4 HNO 3 + 6 HCl = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O β ~ 1016 2 Au + 4 KCN + H 2 O + 1/2 O 2 = 2 K[Au(CN)2] + 2 KOH β ~ 1038 Ag. I(тв. ) + 2 Na 2 S 2 O 3 = Na 3[Ag(S 2 O 3)2] + Na. I β ~ 1013 [Fe(H 2 O)6]3+ + 3 NCS- [Fe(H 2 O)3(NCS)3]0 + 3 H 2 O β ~ 103 [Fe(H 2 O)6]3+ + 6 CN- = [Fe(CN)6]3 - + 6 H 2 O β ~ 1044 [Cu(H 2 O)4 ]2+ HBr [Cu. Br 4]2 HO 2 β 2 ~ 106
![РАЗРУШЕНИЕ + OH+ S 2 и т. д. ПРИМЕРЫ: K 2[Hg. I 4] + РАЗРУШЕНИЕ + OH+ S 2 и т. д. ПРИМЕРЫ: K 2[Hg. I 4] +](https://present5.com/presentation/5166196_60606078/image-37.jpg) РАЗРУШЕНИЕ + OH+ S 2 и т. д. ПРИМЕРЫ: K 2[Hg. I 4] + K 2 S = Hg. S + 4 KI (NH 4)2[Sn. S 3] + 2 H 3 O+ = Sn. S 2 + 2 NH 4+ + H 2 S + 2 H 2 O
РАЗРУШЕНИЕ + OH+ S 2 и т. д. ПРИМЕРЫ: K 2[Hg. I 4] + K 2 S = Hg. S + 4 KI (NH 4)2[Sn. S 3] + 2 H 3 O+ = Sn. S 2 + 2 NH 4+ + H 2 S + 2 H 2 O
![ГИДРИДОКОМПЛЕКСЫ M : H [BH 4][Al. H 4][Ga. H 4]- растет усотйчивость к. с. ГИДРИДОКОМПЛЕКСЫ M : H [BH 4][Al. H 4][Ga. H 4]- растет усотйчивость к. с.](https://present5.com/presentation/5166196_60606078/image-38.jpg) ГИДРИДОКОМПЛЕКСЫ M : H [BH 4][Al. H 4][Ga. H 4]- растет усотйчивость к. с. M – IIIA группа K[BH 4] + H 2 O ≠ Na[Al. H 4] + 4 H 2 O = Al(OH)3 + Na. OH + 4 H 2 Na[Al(OH)4] t Li[Ga. H 4] = Li. H + Ga + 3/2 H 2 СИЛЬНЫЕ ВОССТАНОВИТЕЛИ
ГИДРИДОКОМПЛЕКСЫ M : H [BH 4][Al. H 4][Ga. H 4]- растет усотйчивость к. с. M – IIIA группа K[BH 4] + H 2 O ≠ Na[Al. H 4] + 4 H 2 O = Al(OH)3 + Na. OH + 4 H 2 Na[Al(OH)4] t Li[Ga. H 4] = Li. H + Ga + 3/2 H 2 СИЛЬНЫЕ ВОССТАНОВИТЕЛИ
 [Mn 2(CO)10](тв. ) [Mo(CO)6](тв. ) КАРБОНИЛЫ M : CO M – d-элементы [Cr(CO)6](тв. ) [Mn 2(CO)10](тв. ) [Mo(CO)6](тв. )](https://present5.com/presentation/5166196_60606078/image-39.jpg) КАРБОНИЛЫ M : CO M – d-элементы [Cr(CO)6](тв. ) [Mn 2(CO)10](тв. ) [Mo(CO)6](тв. ) [W(CO)6](тв. ) [Fe(CO)5](ж. ) [Co 2(CO)8](тв. ) [Re 2(CO)10](тв. ) [Ni(CO)4](ж. ) Правило Сиджвика: при образовании карбонильных комплексов вокруг атома М образуется устойчивая 18 -электронная оболочка: s 2 p 6 d 10 ПРИМЕР: Fe 0 4 s 23 d 6 10 e, КЧ = 10/2 = 5 [Fe(CO)5]
КАРБОНИЛЫ M : CO M – d-элементы [Cr(CO)6](тв. ) [Mn 2(CO)10](тв. ) [Mo(CO)6](тв. ) [W(CO)6](тв. ) [Fe(CO)5](ж. ) [Co 2(CO)8](тв. ) [Re 2(CO)10](тв. ) [Ni(CO)4](ж. ) Правило Сиджвика: при образовании карбонильных комплексов вокруг атома М образуется устойчивая 18 -электронная оболочка: s 2 p 6 d 10 ПРИМЕР: Fe 0 4 s 23 d 6 10 e, КЧ = 10/2 = 5 [Fe(CO)5]
![ПРИМЕР (продолжение): Co 0 4 s 23 d 7 9 e 2[ Co(CO)4] [Co ПРИМЕР (продолжение): Co 0 4 s 23 d 7 9 e 2[ Co(CO)4] [Co](https://present5.com/presentation/5166196_60606078/image-40.jpg) ПРИМЕР (продолжение): Co 0 4 s 23 d 7 9 e 2[ Co(CO)4] [Co 2(CO)8] [Ni(CO)x] x-? Ni 0 4 s 23 d 8 18 – 10 = 8 e [Ni(CO)4] [Mn(CO)x] x-? Ni 0 4 s 23 d 5 18 – 7 = 11 e 2[ Mn(CO)5] [Mn 2(CO)10] [V(CO)x] x-? V 0 4 s 23 d 3 18 – 5 = 13 e 2[ V(CO)6] [V 2(CO)12] K+[V-I(CO)6]
ПРИМЕР (продолжение): Co 0 4 s 23 d 7 9 e 2[ Co(CO)4] [Co 2(CO)8] [Ni(CO)x] x-? Ni 0 4 s 23 d 8 18 – 10 = 8 e [Ni(CO)4] [Mn(CO)x] x-? Ni 0 4 s 23 d 5 18 – 7 = 11 e 2[ Mn(CO)5] [Mn 2(CO)10] [V(CO)x] x-? V 0 4 s 23 d 3 18 – 5 = 13 e 2[ V(CO)6] [V 2(CO)12] K+[V-I(CO)6]
 ПОЛУЧЕНИЕ КАРБОНИЛОВ > 200 C < 50 C Ni(тв. ) + 4 CO(г. ) = [Ni(CO)4](г. ) = Ni(тв. ) + 4 CO tкип. = 43ºC 200 C > 300 C Fe(тв. )+5 CO(г. ) = [Fe(CO)5](ж. ) = Fe(тв. ) + 5 CO 150 атм
ПОЛУЧЕНИЕ КАРБОНИЛОВ > 200 C < 50 C Ni(тв. ) + 4 CO(г. ) = [Ni(CO)4](г. ) = Ni(тв. ) + 4 CO tкип. = 43ºC 200 C > 300 C Fe(тв. )+5 CO(г. ) = [Fe(CO)5](ж. ) = Fe(тв. ) + 5 CO 150 атм
![ХИМИЧЕСКИЕ СВОЙСТВА ПО ХИМИЧЕСКОМУ ПОВЕДЕНИЮ ИДЕНТИЧНЫ МЕТАЛЛАМ [Ni(CO)4] + Br 2 = Ni. Br ХИМИЧЕСКИЕ СВОЙСТВА ПО ХИМИЧЕСКОМУ ПОВЕДЕНИЮ ИДЕНТИЧНЫ МЕТАЛЛАМ [Ni(CO)4] + Br 2 = Ni. Br](https://present5.com/presentation/5166196_60606078/image-42.jpg) ХИМИЧЕСКИЕ СВОЙСТВА ПО ХИМИЧЕСКОМУ ПОВЕДЕНИЮ ИДЕНТИЧНЫ МЕТАЛЛАМ [Ni(CO)4] + Br 2 = Ni. Br 2 + 4 CO [Fe(CO)5] + 2 H 3 O+ = Fe 2+ + H 2 + 5 CO + 2 H 2 O
ХИМИЧЕСКИЕ СВОЙСТВА ПО ХИМИЧЕСКОМУ ПОВЕДЕНИЮ ИДЕНТИЧНЫ МЕТАЛЛАМ [Ni(CO)4] + Br 2 = Ni. Br 2 + 4 CO [Fe(CO)5] + 2 H 3 O+ = Fe 2+ + H 2 + 5 CO + 2 H 2 O
![АНИОНГАЛОГЕНАТЫ [I(I)2]- [I(Cl)4]- [Br. F 6]- [I(Br)2]- [I(Cl 3 F)]- [IF 6]- [I(Br. Cl)]- АНИОНГАЛОГЕНАТЫ [I(I)2]- [I(Cl)4]- [Br. F 6]- [I(Br)2]- [I(Cl 3 F)]- [IF 6]- [I(Br. Cl)]-](https://present5.com/presentation/5166196_60606078/image-43.jpg) АНИОНГАЛОГЕНАТЫ [I(I)2]- [I(Cl)4]- [Br. F 6]- [I(Br)2]- [I(Cl 3 F)]- [IF 6]- [I(Br. Cl)]- [Br. F 4]- [IF 8]- [Br(Br. Cl)]- [Cl. F 4]- ЛИГАНД И КОМПЛЕКСООБРАЗОВАТЕЛЬ – ГАЛОГЕНЫ
АНИОНГАЛОГЕНАТЫ [I(I)2]- [I(Cl)4]- [Br. F 6]- [I(Br)2]- [I(Cl 3 F)]- [IF 6]- [I(Br. Cl)]- [Br. F 4]- [IF 8]- [Br(Br. Cl)]- [Cl. F 4]- ЛИГАНД И КОМПЛЕКСООБРАЗОВАТЕЛЬ – ГАЛОГЕНЫ
![ПОЛУЧЕНИЕ H 2 O KI + I 2 = K[I(I)2] Cs. I + Br. ПОЛУЧЕНИЕ H 2 O KI + I 2 = K[I(I)2] Cs. I + Br.](https://present5.com/presentation/5166196_60606078/image-44.jpg) ПОЛУЧЕНИЕ H 2 O KI + I 2 = K[I(I)2] Cs. I + Br. Cl = Cs[I(Br)(Cl)]
ПОЛУЧЕНИЕ H 2 O KI + I 2 = K[I(I)2] Cs. I + Br. Cl = Cs[I(Br)(Cl)]
![ХИМИЧЕСКИЕ СВОЙСТВА t K[I(I)2] = KI + I 2 Cs[I(Br)(Cl)] = Cs. Cl + ХИМИЧЕСКИЕ СВОЙСТВА t K[I(I)2] = KI + I 2 Cs[I(Br)(Cl)] = Cs. Cl +](https://present5.com/presentation/5166196_60606078/image-45.jpg) ХИМИЧЕСКИЕ СВОЙСТВА t K[I(I)2] = KI + I 2 Cs[I(Br)(Cl)] = Cs. Cl + IBr
ХИМИЧЕСКИЕ СВОЙСТВА t K[I(I)2] = KI + I 2 Cs[I(Br)(Cl)] = Cs. Cl + IBr
![КАТИОНГАЛОГЕНЫ [Cl. F 2]+ [IF 4]+ [Br. F 2]+ [ICl 2]+ УСТОЙЧИВЫ ПРИ НИЗКИХ КАТИОНГАЛОГЕНЫ [Cl. F 2]+ [IF 4]+ [Br. F 2]+ [ICl 2]+ УСТОЙЧИВЫ ПРИ НИЗКИХ](https://present5.com/presentation/5166196_60606078/image-46.jpg) КАТИОНГАЛОГЕНЫ [Cl. F 2]+ [IF 4]+ [Br. F 2]+ [ICl 2]+ УСТОЙЧИВЫ ПРИ НИЗКИХ ТЕМПЕРАТУРАХ
КАТИОНГАЛОГЕНЫ [Cl. F 2]+ [IF 4]+ [Br. F 2]+ [ICl 2]+ УСТОЙЧИВЫ ПРИ НИЗКИХ ТЕМПЕРАТУРАХ
 ПОЛУЧЕНИЕ +III +IV Cl. F 3(ж. ) + Sb. F 5(ж. ) = [Cl. F 2][Sb. F 6]
ПОЛУЧЕНИЕ +III +IV Cl. F 3(ж. ) + Sb. F 5(ж. ) = [Cl. F 2][Sb. F 6]
![ХИМИЧЕСКИЕ СВОЙСТВА K[IF 6] + [IF 4][Sb. F 6] = K[Sb. F 6] + ХИМИЧЕСКИЕ СВОЙСТВА K[IF 6] + [IF 4][Sb. F 6] = K[Sb. F 6] +](https://present5.com/presentation/5166196_60606078/image-48.jpg) ХИМИЧЕСКИЕ СВОЙСТВА K[IF 6] + [IF 4][Sb. F 6] = K[Sb. F 6] + 2 IF 6 осн. к-та Льюиса растворитель
ХИМИЧЕСКИЕ СВОЙСТВА K[IF 6] + [IF 4][Sb. F 6] = K[Sb. F 6] + 2 IF 6 осн. к-та Льюиса растворитель
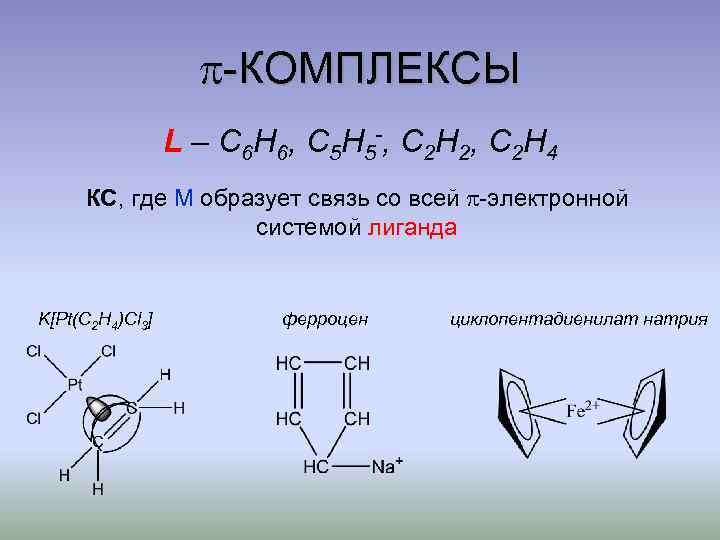 -КОМПЛЕКСЫ L – C 6 H 6 , C 5 H 5 -, C 2 H 2 , C 2 H 4 КС, где М образует связь со всей -электронной системой лиганда K[Pt(C 2 H 4)Cl 3] ферроцен циклопентадиенилат натрия
-КОМПЛЕКСЫ L – C 6 H 6 , C 5 H 5 -, C 2 H 2 , C 2 H 4 КС, где М образует связь со всей -электронной системой лиганда K[Pt(C 2 H 4)Cl 3] ферроцен циклопентадиенилат натрия
 МЕТАЛЛОЦЕНЫ «сэндвичевые» соединения Fe. Cl 2 + 2 C 5 H 5 Na = [Fe(C 5 H 5)2]0 + 2 Na. Cl
МЕТАЛЛОЦЕНЫ «сэндвичевые» соединения Fe. Cl 2 + 2 C 5 H 5 Na = [Fe(C 5 H 5)2]0 + 2 Na. Cl
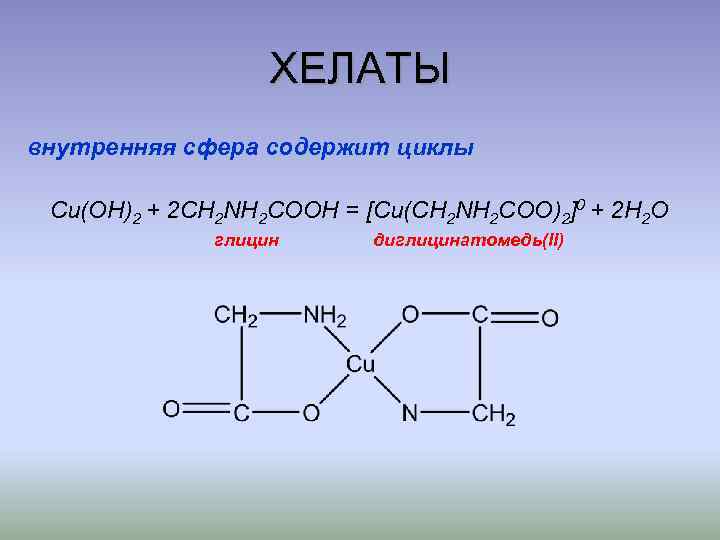 ХЕЛАТЫ внутренняя сфера содержит циклы Cu(OH)2 + 2 CH 2 NH 2 COOH = [Cu(CH 2 NH 2 COO)2]0 + 2 H 2 O глицин диглицинатомедь(II)
ХЕЛАТЫ внутренняя сфера содержит циклы Cu(OH)2 + 2 CH 2 NH 2 COOH = [Cu(CH 2 NH 2 COO)2]0 + 2 H 2 O глицин диглицинатомедь(II)
![2 H 2 dmg + Ni 2+ + 2 NH 3 = [Ni(Hdmg)2]0 + 2 H 2 dmg + Ni 2+ + 2 NH 3 = [Ni(Hdmg)2]0 +](https://present5.com/presentation/5166196_60606078/image-52.jpg) 2 H 2 dmg + Ni 2+ + 2 NH 3 = [Ni(Hdmg)2]0 + 2 NH 4+
2 H 2 dmg + Ni 2+ + 2 NH 3 = [Ni(Hdmg)2]0 + 2 NH 4+
![ox ox ox [Co(C 2 O 4)3]3 - ox ox ox [Co(C 2 O 4)3]3 -](https://present5.com/presentation/5166196_60606078/image-53.jpg) ox ox ox [Co(C 2 O 4)3]3 -
ox ox ox [Co(C 2 O 4)3]3 -
 КРИПТАТ
КРИПТАТ
 КРАУН-ЭФИРЫ представляют собой макроциклические кислороддонорные лиганды. Их применение перспективно для разработки новых эффективных методов выделения и избирательного концентрирования ЩЭ из сложных смесей. диглогексил-14 -краун-4 бензо-18 -краун-6
КРАУН-ЭФИРЫ представляют собой макроциклические кислороддонорные лиганды. Их применение перспективно для разработки новых эффективных методов выделения и избирательного концентрирования ЩЭ из сложных смесей. диглогексил-14 -краун-4 бензо-18 -краун-6
 ХИМИЧЕСКАЯ СВЯЗЬ В КС. Метод валентных связей. 1. СВЯЗЬ В КС ОБРАЗОВАНА ПО ДОНОРНОАКЦЕПТОРНОМУ МЕХАНИЗМУ M : L M–L 2. ВАКАНТНЫЕ (НЕЗАПОЛНЕННЫЕ) АО М ГИБРИДИЗУЮТСЯ, КОГДА ИХ ЗАНИМАЮТ ПАРЫ ЭЛЕКТРОНОВ ДОНОРОВ-ЛИГАНДОВ
ХИМИЧЕСКАЯ СВЯЗЬ В КС. Метод валентных связей. 1. СВЯЗЬ В КС ОБРАЗОВАНА ПО ДОНОРНОАКЦЕПТОРНОМУ МЕХАНИЗМУ M : L M–L 2. ВАКАНТНЫЕ (НЕЗАПОЛНЕННЫЕ) АО М ГИБРИДИЗУЮТСЯ, КОГДА ИХ ЗАНИМАЮТ ПАРЫ ЭЛЕКТРОНОВ ДОНОРОВ-ЛИГАНДОВ
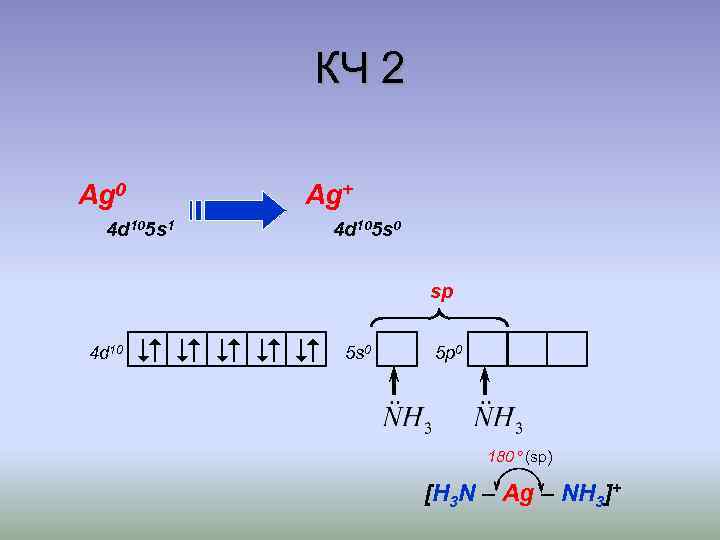 КЧ 2 Ag 0 Ag+ 4 d 105 s 1 4 d 105 s 0 sp 4 d 10 5 s 0 5 p 0 180 (sp) [H 3 N – Ag – NH 3]+
КЧ 2 Ag 0 Ag+ 4 d 105 s 1 4 d 105 s 0 sp 4 d 10 5 s 0 5 p 0 180 (sp) [H 3 N – Ag – NH 3]+
 КЧ 4 (тетраэдр) Mn 0 Mn. II 3 d 54 s 2 3 d 54 s 0 sp 3 3 d 5 4 s 0 4 p 0 Cl. ПАРАМАГНИТЕН Cl- Cl-
КЧ 4 (тетраэдр) Mn 0 Mn. II 3 d 54 s 2 3 d 54 s 0 sp 3 3 d 5 4 s 0 4 p 0 Cl. ПАРАМАГНИТЕН Cl- Cl-
 КЧ 4 (квадрат) Ni 0 Ni. II 3 d 84 s 2 3 d 84 s 0 dsp 2 3 d 8 CN- CNCN- Ni. II 4 s 0 4 p 0 CN-CN- CN- диамагнитен (эксперимент), т. е. все электроны спарены
КЧ 4 (квадрат) Ni 0 Ni. II 3 d 84 s 2 3 d 84 s 0 dsp 2 3 d 8 CN- CNCN- Ni. II 4 s 0 4 p 0 CN-CN- CN- диамагнитен (эксперимент), т. е. все электроны спарены
 КЧ 4 (тетраэдр) Ni 0 Ni. II 3 d 84 s 2 3 d 84 s 0 sp 3 3 d 8 4 s 0 4 p 0 NH 3 ПАРАМАГНИТЕН NH 3
КЧ 4 (тетраэдр) Ni 0 Ni. II 3 d 84 s 2 3 d 84 s 0 sp 3 3 d 8 4 s 0 4 p 0 NH 3 ПАРАМАГНИТЕН NH 3
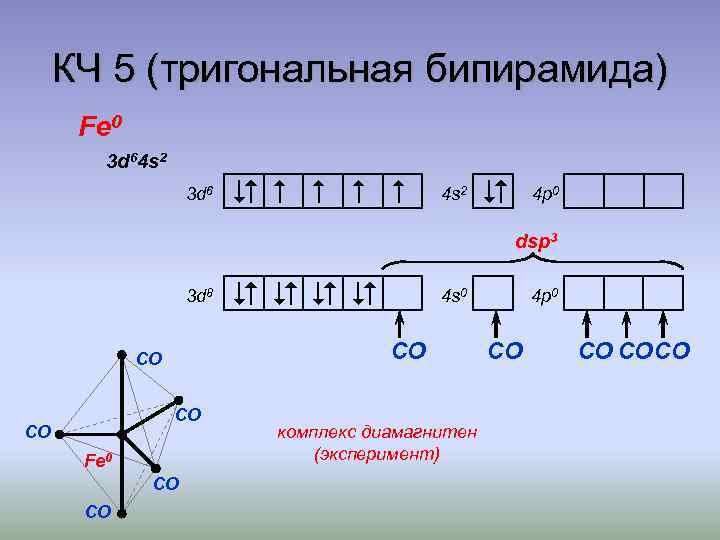 КЧ 5 (тригональная бипирамида) Fe 0 3 d 64 s 2 3 d 6 4 s 2 4 p 0 dsp 3 3 d 8 CO Fe 0 CO CO 4 s 0 CO CO CO комплекс диамагнитен (эксперимент) 4 p 0 CO CO
КЧ 5 (тригональная бипирамида) Fe 0 3 d 64 s 2 3 d 6 4 s 2 4 p 0 dsp 3 3 d 8 CO Fe 0 CO CO 4 s 0 CO CO CO комплекс диамагнитен (эксперимент) 4 p 0 CO CO
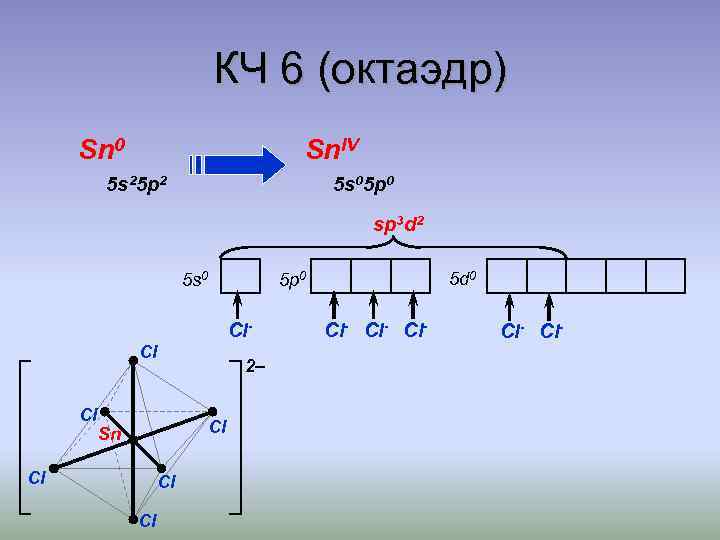 КЧ 6 (октаэдр) Sn 0 Sn. IV 5 s 25 p 2 5 s 05 p 0 sp 3 d 2 5 s 0 Cl. Cl Cl 2– Cl Sn Cl Cl Cl 5 d 0 5 p 0 Cl- Cl- Cl-
КЧ 6 (октаэдр) Sn 0 Sn. IV 5 s 25 p 2 5 s 05 p 0 sp 3 d 2 5 s 0 Cl. Cl Cl 2– Cl Sn Cl Cl Cl 5 d 0 5 p 0 Cl- Cl- Cl-
 НЕДОСТАТКИ МЕТОДА ВС ПРИ ОБЪЯСНЕНИИ СТРОЕНИЯ И ХИМИЧЕСКОЙ СВЯЗИ В КС 1. НЕ ПРЕДСКАЗЫВАЕТ МАГНИТНЫЕ СВОЙСТВА КС 2. НЕОПРЕДЕЛЕННОСТЬ В ОБЪЯСНЕНИИ СТРОЕНИЯ КС внутриорбитальные КС, внешнеорбитальные КС (почему в связи участвуют разные орбитали)
НЕДОСТАТКИ МЕТОДА ВС ПРИ ОБЪЯСНЕНИИ СТРОЕНИЯ И ХИМИЧЕСКОЙ СВЯЗИ В КС 1. НЕ ПРЕДСКАЗЫВАЕТ МАГНИТНЫЕ СВОЙСТВА КС 2. НЕОПРЕДЕЛЕННОСТЬ В ОБЪЯСНЕНИИ СТРОЕНИЯ КС внутриорбитальные КС, внешнеорбитальные КС (почему в связи участвуют разные орбитали)
 ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ 1929 г. Бете, Ван-Флек ОСНОВНЫЕ ПОЛОЖЕНИЯ: 1. Взаимодействие между центральным атомом М и лигандами L электростатическое, т. е. связи во внутренней сфере принимаются чисто ионными. 2. Лиганды рассматриваются как точечные заряды, химическая природа их не учитывается. 3. В К. С. лиганды располагаются в вершинах правильных многогранников.
ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ 1929 г. Бете, Ван-Флек ОСНОВНЫЕ ПОЛОЖЕНИЯ: 1. Взаимодействие между центральным атомом М и лигандами L электростатическое, т. е. связи во внутренней сфере принимаются чисто ионными. 2. Лиганды рассматриваются как точечные заряды, химическая природа их не учитывается. 3. В К. С. лиганды располагаются в вершинах правильных многогранников.
 4. Центральный атом М в поле лигандов: энергетический подуровень d-АО расщепляется. Характер расщепления dподуровня зависит от поля лигандов.
4. Центральный атом М в поле лигандов: энергетический подуровень d-АО расщепляется. Характер расщепления dподуровня зависит от поля лигандов.
 РАСЩЕПЛЕНИЕ d-АО В РАЗЛИЧНЫХ ЭЛЕКТРОСТАТИЧЕСКИХ ПОЛЯХ ЛИГАНДОВ Z L +1. 028 0, 114 M X -0. 628 Y L
РАСЩЕПЛЕНИЕ d-АО В РАЗЛИЧНЫХ ЭЛЕКТРОСТАТИЧЕСКИХ ПОЛЯХ ЛИГАНДОВ Z L +1. 028 0, 114 M X -0. 628 Y L
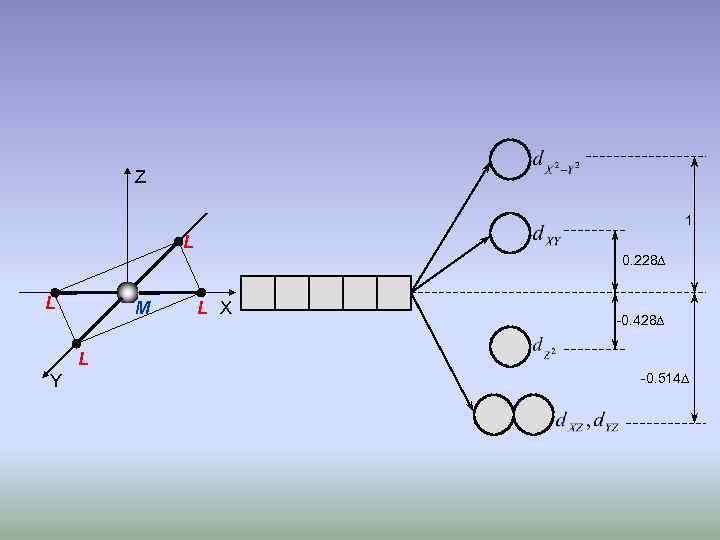 Z 1 L L M 0. 228 L X -0. 428 L Y -0. 514
Z 1 L L M 0. 228 L X -0. 428 L Y -0. 514
 Z L L M L Y 0, 187 X L -0. 267
Z L L M L Y 0, 187 X L -0. 267
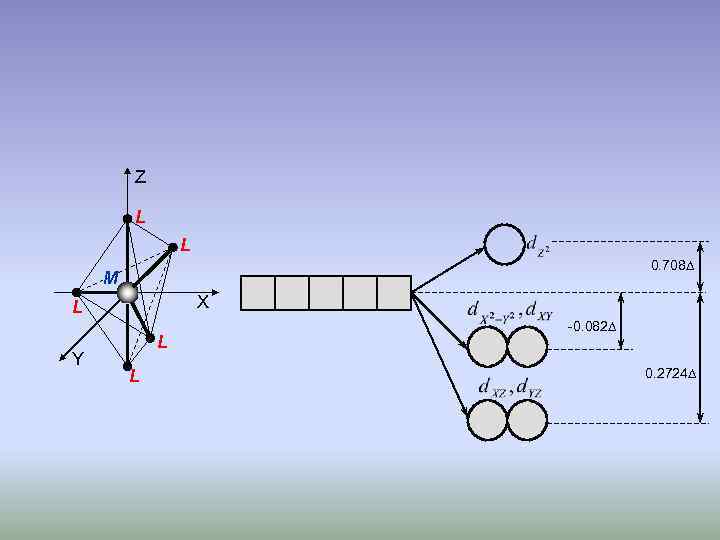 Z L L 0. 708 M X L Y L L -0. 082 0. 2724
Z L L 0. 708 M X L Y L L -0. 082 0. 2724
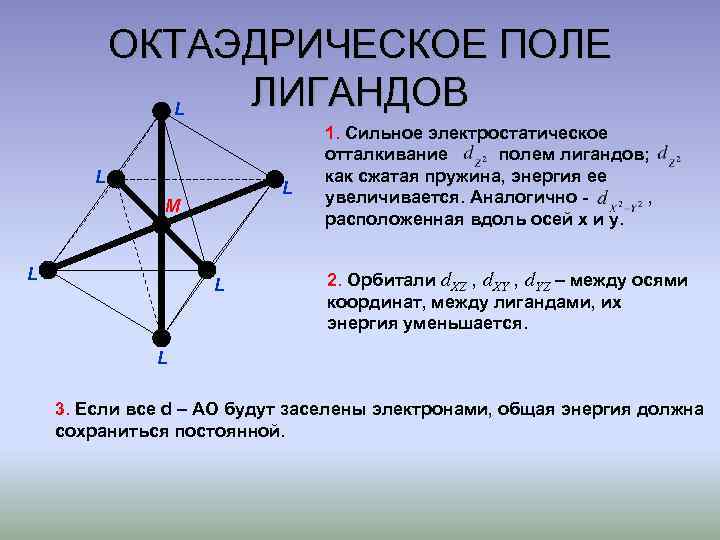 ОКТАЭДРИЧЕСКОЕ ПОЛЕ ЛИГАНДОВ L L L M L L 1. Сильное электростатическое отталкивание полем лигандов; как сжатая пружина, энергия ее увеличивается. Аналогично , расположенная вдоль осей х и у. 2. Орбитали d. XZ , d. XY , d. YZ – между осями координат, между лигандами, их энергия уменьшается. L 3. Если все d – АО будут заселены электронами, общая энергия должна сохраниться постоянной.
ОКТАЭДРИЧЕСКОЕ ПОЛЕ ЛИГАНДОВ L L L M L L 1. Сильное электростатическое отталкивание полем лигандов; как сжатая пружина, энергия ее увеличивается. Аналогично , расположенная вдоль осей х и у. 2. Орбитали d. XZ , d. XY , d. YZ – между осями координат, между лигандами, их энергия уменьшается. L 3. Если все d – АО будут заселены электронами, общая энергия должна сохраниться постоянной.
 Но если электроны только на dε , то выигрыш в энергии: Δ 0 измеряется в см-1 (волновое число) 1 см-1 ~ 12 Дж/моль Δ 0 от 5000 см-1 (~60 к. Дж/моль) до 60000 см-1 (~700 к. Дж/моль) Есп. e ~ 23500 см-1 (~270 к. Дж/моль) Δ 0 < Есп. слабое поле Δ 0 < Есп. сильное поле
Но если электроны только на dε , то выигрыш в энергии: Δ 0 измеряется в см-1 (волновое число) 1 см-1 ~ 12 Дж/моль Δ 0 от 5000 см-1 (~60 к. Дж/моль) до 60000 см-1 (~700 к. Дж/моль) Есп. e ~ 23500 см-1 (~270 к. Дж/моль) Δ 0 < Есп. слабое поле Δ 0 < Есп. сильное поле
![ПАРАМЕТР РАСЩЕПЛЕНИЯ ЗАВИСИТ СО(ЦА) N(ЦА) Δ 0 [Mn. II(H 2 O)6]2+ Δ 0 = ПАРАМЕТР РАСЩЕПЛЕНИЯ ЗАВИСИТ СО(ЦА) N(ЦА) Δ 0 [Mn. II(H 2 O)6]2+ Δ 0 =](https://present5.com/presentation/5166196_60606078/image-72.jpg) ПАРАМЕТР РАСЩЕПЛЕНИЯ ЗАВИСИТ СО(ЦА) N(ЦА) Δ 0 [Mn. II(H 2 O)6]2+ Δ 0 = 7800 cм-1 [Co(NH 3)6]3+ 22900 cм-1 [Mn. III(H 2 O)6]3+ Δ 0 = 21000 cм-1 [Rh(NH 3)6]3+ 34100 cм-1 [Ir(NH 3)6]3+ 41000 cм-1 ЗАВИСИТ ОТ ПРИРОДЫ ЛИГАНДА Спектрохимический ряд лигандов слабое поле зависит от ЦА сильное поле I- < Br- < Cl- < : SCN- < F- < OH- < C 2 O 22 - < H 2 O < : NCS- < en < NH 3 < NO 2 - < CN- ~ CO
ПАРАМЕТР РАСЩЕПЛЕНИЯ ЗАВИСИТ СО(ЦА) N(ЦА) Δ 0 [Mn. II(H 2 O)6]2+ Δ 0 = 7800 cм-1 [Co(NH 3)6]3+ 22900 cм-1 [Mn. III(H 2 O)6]3+ Δ 0 = 21000 cм-1 [Rh(NH 3)6]3+ 34100 cм-1 [Ir(NH 3)6]3+ 41000 cм-1 ЗАВИСИТ ОТ ПРИРОДЫ ЛИГАНДА Спектрохимический ряд лигандов слабое поле зависит от ЦА сильное поле I- < Br- < Cl- < : SCN- < F- < OH- < C 2 O 22 - < H 2 O < : NCS- < en < NH 3 < NO 2 - < CN- ~ CO
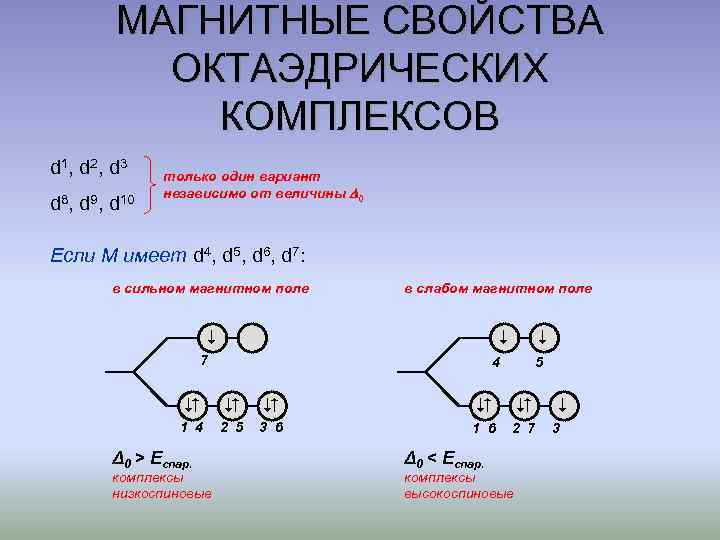 МАГНИТНЫЕ СВОЙСТВА ОКТАЭДРИЧЕСКИХ КОМПЛЕКСОВ d 1 , d 2 , d 3 d 8, d 9, d 10 только один вариант независимо от величины 0 Если М имеет d 4, d 5, d 6, d 7: в сильном магнитном поле в слабом магнитном поле 7 4 5 1 4 2 5 3 6 1 6 2 7 Δ 0 > Еспар. комплексы низкоспиновые Δ 0 < Еспар. комплексы высокоспиновые 3
МАГНИТНЫЕ СВОЙСТВА ОКТАЭДРИЧЕСКИХ КОМПЛЕКСОВ d 1 , d 2 , d 3 d 8, d 9, d 10 только один вариант независимо от величины 0 Если М имеет d 4, d 5, d 6, d 7: в сильном магнитном поле в слабом магнитном поле 7 4 5 1 4 2 5 3 6 1 6 2 7 Δ 0 > Еспар. комплексы низкоспиновые Δ 0 < Еспар. комплексы высокоспиновые 3
 Если М имеет d 8, d 9, d 10: 7 9 8 10 4 9 5 10 1 4 2 5 3 6 1 6 2 7 3 8 d 10 – все КС диамагнитны
Если М имеет d 8, d 9, d 10: 7 9 8 10 4 9 5 10 1 4 2 5 3 6 1 6 2 7 3 8 d 10 – все КС диамагнитны
 ПРИМЕР Fe. II - 3 d 64 s 0 в сильном магнитном поле в слабом магнитном поле 4 5 1 4 [Fe. II(CN)6]4 - 2 5 3 6 1 6 2 7 [Fe. IIF 6]4 -, [Fe(H 2 O)6]2+ 3
ПРИМЕР Fe. II - 3 d 64 s 0 в сильном магнитном поле в слабом магнитном поле 4 5 1 4 [Fe. II(CN)6]4 - 2 5 3 6 1 6 2 7 [Fe. IIF 6]4 -, [Fe(H 2 O)6]2+ 3
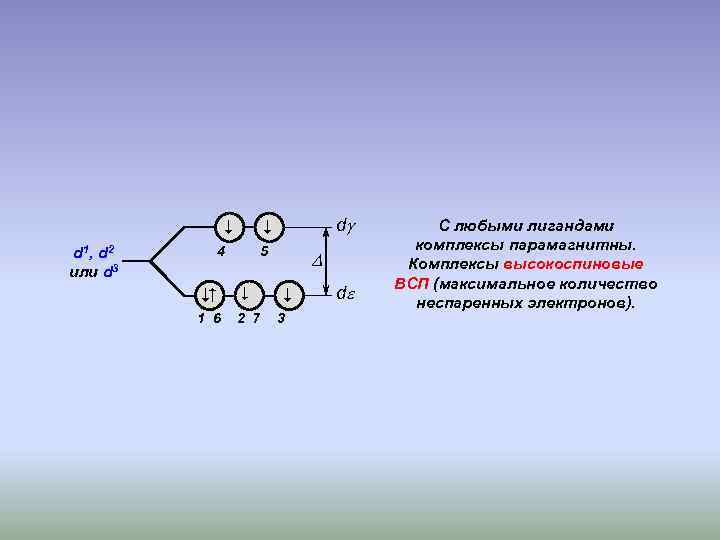 d 1, d 2 или d 3 d 4 5 1 6 2 7 3 d С любыми лигандами комплексы парамагнитны. Комплексы высокоспиновые ВСП (максимальное количество неспаренных электронов).
d 1, d 2 или d 3 d 4 5 1 6 2 7 3 d С любыми лигандами комплексы парамагнитны. Комплексы высокоспиновые ВСП (максимальное количество неспаренных электронов).
 d 4 1 d 5 2 4 14 25 ВСП 5 16 27 d 8 d 10 4 9 5 10 16 27 38 3 7 3 НСП
d 4 1 d 5 2 4 14 25 ВСП 5 16 27 d 8 d 10 4 9 5 10 16 27 38 3 7 3 НСП
 ОКРАСКА КС Окраска КС связана с поглощением света при переходе электронов с d на dγ подуровень [Ti. III(H 2 O)6]3+ Ti 0 3 d 24 s 2 hν – Δ d Ti. III 3 d 14 s 0 3 d 14 s 2 d hv фиолетовая окраска [Sc. III(H 2 O)6]3+ Sc 0 Sc. III 3 d 04 s 0 нет окраски
ОКРАСКА КС Окраска КС связана с поглощением света при переходе электронов с d на dγ подуровень [Ti. III(H 2 O)6]3+ Ti 0 3 d 24 s 2 hν – Δ d Ti. III 3 d 14 s 0 3 d 14 s 2 d hv фиолетовая окраска [Sc. III(H 2 O)6]3+ Sc 0 Sc. III 3 d 04 s 0 нет окраски
![[Cd. II(NH 3)6]2+ Cd 0 4 d 105 s 2 Cd. II 4 d [Cd. II(NH 3)6]2+ Cd 0 4 d 105 s 2 Cd. II 4 d](https://present5.com/presentation/5166196_60606078/image-79.jpg) [Cd. II(NH 3)6]2+ Cd 0 4 d 105 s 2 Cd. II 4 d 105 s 0 нет окраски d d
[Cd. II(NH 3)6]2+ Cd 0 4 d 105 s 2 Cd. II 4 d 105 s 0 нет окраски d d
 ОКРАСКА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Окраска комплексных соединений связана с поглощением и излучением квантов света при переходе е с dε на dγ и обратно, кванты с энергией, равной Δ 0, поглощаются, а остальная часть излучения пропускается (в результате – окрашивание). окраска [Cu(H 2 O)4]2+ [Cu(NH 3)4]2+ [Cu(CN)4]2 - поглощается голубой оранжевый синий желтый фиолетовый зеленый
ОКРАСКА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Окраска комплексных соединений связана с поглощением и излучением квантов света при переходе е с dε на dγ и обратно, кванты с энергией, равной Δ 0, поглощаются, а остальная часть излучения пропускается (в результате – окрашивание). окраска [Cu(H 2 O)4]2+ [Cu(NH 3)4]2+ [Cu(CN)4]2 - поглощается голубой оранжевый синий желтый фиолетовый зеленый
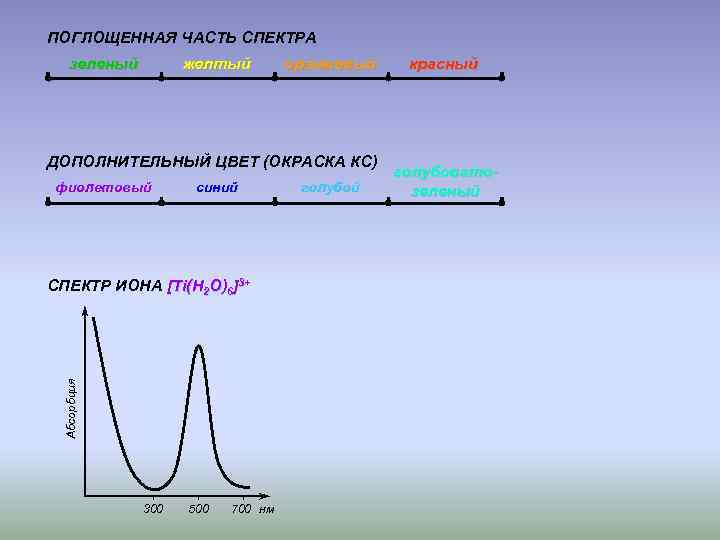 ПОГЛОЩЕННАЯ ЧАСТЬ СПЕКТРА зеленый желтый оранжевый ДОПОЛНИТЕЛЬНЫЙ ЦВЕТ (ОКРАСКА КС) фиолетовый синий Абсорбция СПЕКТР ИОНА [Ti(H 2 O)6]3+ 300 500 700 нм голубой красный голубоватозеленый
ПОГЛОЩЕННАЯ ЧАСТЬ СПЕКТРА зеленый желтый оранжевый ДОПОЛНИТЕЛЬНЫЙ ЦВЕТ (ОКРАСКА КС) фиолетовый синий Абсорбция СПЕКТР ИОНА [Ti(H 2 O)6]3+ 300 500 700 нм голубой красный голубоватозеленый
![РЕАКЦИИ КС В ВОДНЫХ РАСТВОРАХ СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ H+ H[Au. Cl 4] + H 2 РЕАКЦИИ КС В ВОДНЫХ РАСТВОРАХ СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ H+ H[Au. Cl 4] + H 2](https://present5.com/presentation/5166196_60606078/image-82.jpg) РЕАКЦИИ КС В ВОДНЫХ РАСТВОРАХ СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ H+ H[Au. Cl 4] + H 2 O = [Au. Cl 4]- + H 3 O+ [Cu(NH 3)4](OH)2 = [Cu(NH 3)4]2+ + 2 OHКОМПЛЕКСНЫЕ ИОНЫ – СЛАБЫЕ ЭЛЕКТРОЛИТЫ [Fe. F 6]3 - + H 2 O [Fe(H 2 O)F 5]2 - + F[Fe(H 2 O)F 5]2 - + H 2 O [Fe(H 2 O)2 F 4]- + F[Fe(H 2 O)5 F]2+ + H 2 O [Fe(H 2 O)6]3+ + F-
РЕАКЦИИ КС В ВОДНЫХ РАСТВОРАХ СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ H+ H[Au. Cl 4] + H 2 O = [Au. Cl 4]- + H 3 O+ [Cu(NH 3)4](OH)2 = [Cu(NH 3)4]2+ + 2 OHКОМПЛЕКСНЫЕ ИОНЫ – СЛАБЫЕ ЭЛЕКТРОЛИТЫ [Fe. F 6]3 - + H 2 O [Fe(H 2 O)F 5]2 - + F[Fe(H 2 O)F 5]2 - + H 2 O [Fe(H 2 O)2 F 4]- + F[Fe(H 2 O)5 F]2+ + H 2 O [Fe(H 2 O)6]3+ + F-
![КОНСТАНТЫ УСТОЙЧИВОСТИ Fe 3+(p) + F- [Fe. F]2+ K 1 = β 1 = КОНСТАНТЫ УСТОЙЧИВОСТИ Fe 3+(p) + F- [Fe. F]2+ K 1 = β 1 =](https://present5.com/presentation/5166196_60606078/image-83.jpg) КОНСТАНТЫ УСТОЙЧИВОСТИ Fe 3+(p) + F- [Fe. F]2+ K 1 = β 1 = 106 [Fe. F]2+ + F- [Fe. F 2]+ K 2 = 104, 7 [Fe. F 2]+ + F- [Fe. F 3]0 K 3 = 103 [Fe. F 3]0 + F- [Fe. F 4]- K 4 = 102 2 = K 1 K 2 = 1010, 7 3 = K 1 K 2 K 3 = 1013, 7 4 = K 1 K 2 K 3 K 4 = 1015, 7 K 1 > K 2 > K 3 > … > Kn
КОНСТАНТЫ УСТОЙЧИВОСТИ Fe 3+(p) + F- [Fe. F]2+ K 1 = β 1 = 106 [Fe. F]2+ + F- [Fe. F 2]+ K 2 = 104, 7 [Fe. F 2]+ + F- [Fe. F 3]0 K 3 = 103 [Fe. F 3]0 + F- [Fe. F 4]- K 4 = 102 2 = K 1 K 2 = 1010, 7 3 = K 1 K 2 K 3 = 1013, 7 4 = K 1 K 2 K 3 K 4 = 1015, 7 K 1 > K 2 > K 3 > … > Kn
![ПРИМЕР Cd 2+ + NH 3 [Cd(NH 3)]2+ K 1=102, 65 [Cd(NH 3)]2+ + ПРИМЕР Cd 2+ + NH 3 [Cd(NH 3)]2+ K 1=102, 65 [Cd(NH 3)]2+ +](https://present5.com/presentation/5166196_60606078/image-84.jpg) ПРИМЕР Cd 2+ + NH 3 [Cd(NH 3)]2+ K 1=102, 65 [Cd(NH 3)]2+ + NH 3 [Cd(NH 3)2]2+ K 2=102, 10 [Cd(NH 3)2]2+ + NH 3 [Cd(NH 3)3]2+ K 3=101, 44 [Cd(NH 3)3]2+ + NH 3 [Cd(NH 3)4]2+ K 4=100, 93 ПРИЧИНЫ: Изменение заряда Пространственные
ПРИМЕР Cd 2+ + NH 3 [Cd(NH 3)]2+ K 1=102, 65 [Cd(NH 3)]2+ + NH 3 [Cd(NH 3)2]2+ K 2=102, 10 [Cd(NH 3)2]2+ + NH 3 [Cd(NH 3)3]2+ K 3=101, 44 [Cd(NH 3)3]2+ + NH 3 [Cd(NH 3)4]2+ K 4=100, 93 ПРИЧИНЫ: Изменение заряда Пространственные
 ПОЛНАЯ И СТУПЕНЧАТАЯ КОНСТАНТЫ СТУПЕНЧАТАЯ КОНСТАНТА ОБРАЗОВАНИЯ (УСТОЙЧИВОСТИ) Кi – это константа равновесия реакции образования КС по одной из ступеней. ПОЛНАЯ КОНСТАНТА ОБРАЗОВАНИЯ (УСТОЙЧИВОСТИ) n – это константа равновесия суммарной реакции образования КС по всем ступеням сразу. n = К 1 К 2 К 3 … Кn
ПОЛНАЯ И СТУПЕНЧАТАЯ КОНСТАНТЫ СТУПЕНЧАТАЯ КОНСТАНТА ОБРАЗОВАНИЯ (УСТОЙЧИВОСТИ) Кi – это константа равновесия реакции образования КС по одной из ступеней. ПОЛНАЯ КОНСТАНТА ОБРАЗОВАНИЯ (УСТОЙЧИВОСТИ) n – это константа равновесия суммарной реакции образования КС по всем ступеням сразу. n = К 1 К 2 К 3 … Кn
 СВОЙСТВА ПОЛНОЙ КОНСТАНТЫ УСТОЙЧИВОСТИ 1. Полная константа устойчивости по группе, как правило растет снизу вверх [Cu(NH 3)2]+ [Ag(NH ) ]+ 3 2 2. β 2 = 1010, 86 β 2 = 107, 21 Полная константа устойчивости растет с увеличением СО центрального атома [Co. II(NH 3)6]2+ β 6 = 104, 39 [Co. III(NH 3)6]3+β 6 = 1035, 21 2. Зависит от природы лиганда [Ag(SO 3)2]3[Ag(NH 3)2]+ β 2 = 109 β 2 = 107
СВОЙСТВА ПОЛНОЙ КОНСТАНТЫ УСТОЙЧИВОСТИ 1. Полная константа устойчивости по группе, как правило растет снизу вверх [Cu(NH 3)2]+ [Ag(NH ) ]+ 3 2 2. β 2 = 1010, 86 β 2 = 107, 21 Полная константа устойчивости растет с увеличением СО центрального атома [Co. II(NH 3)6]2+ β 6 = 104, 39 [Co. III(NH 3)6]3+β 6 = 1035, 21 2. Зависит от природы лиганда [Ag(SO 3)2]3[Ag(NH 3)2]+ β 2 = 109 β 2 = 107
 ХЕЛАТНЫЙ ЭФФЕКТ рост устойчивости КС при замещении монодентатных лигандов на полидентатные (Чугаев Л. А. , 1905 г. ) β 6 ~ 108 β 3 ~ 1019 [Ni(NH 3)6]2+ + 3 en [Ni(en)3]2+ + 6 NH 3 ΔS > 0 ΔH ~ 0 ΔG < 0 KС = β 3/β 6 ≈ 1011
ХЕЛАТНЫЙ ЭФФЕКТ рост устойчивости КС при замещении монодентатных лигандов на полидентатные (Чугаев Л. А. , 1905 г. ) β 6 ~ 108 β 3 ~ 1019 [Ni(NH 3)6]2+ + 3 en [Ni(en)3]2+ + 6 NH 3 ΔS > 0 ΔH ~ 0 ΔG < 0 KС = β 3/β 6 ≈ 1011


