Лекция. Биологическое окисление. Основные пути образования энергии в клетке.pptx
- Количество слайдов: 78
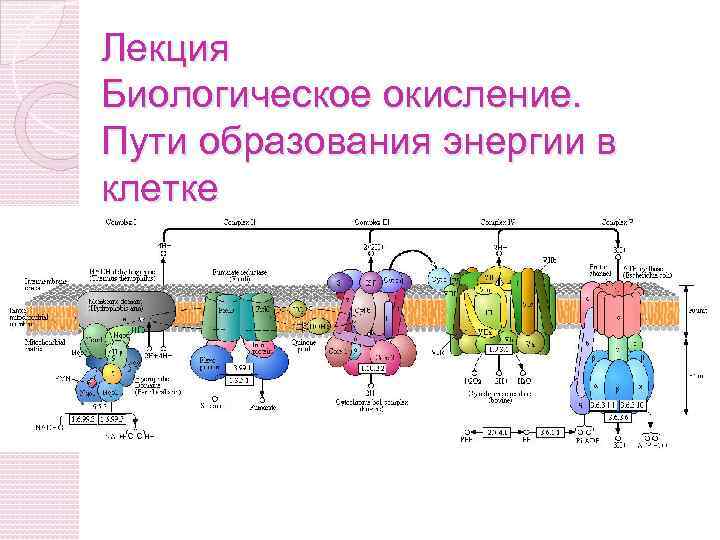
Лекция Биологическое окисление. Пути образования энергии в клетке

Основные вопросы лекции Биологическое окисление. Определение. Теории биологического окисления. Ферменты и коферменты биологического окисления. Макроэргические соединения. Субстраты биологического окисления. Схема энергетического обмена. Механизм окислительного фосфирилирования. Строение электронотранспортной цепи. Регуляция окислительного фосфорилирования.
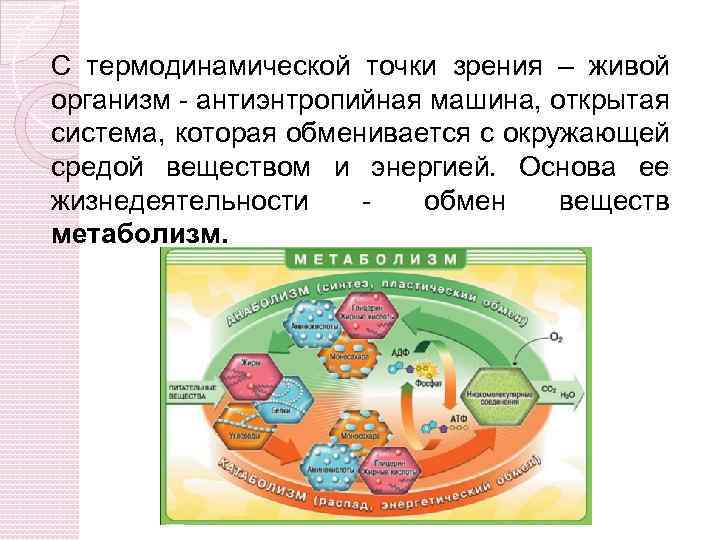
С термодинамической точки зрения – живой организм - антиэнтропийная машина, открытая система, которая обменивается с окружающей средой веществом и энергией. Основа ее жизнедеятельности обмен веществ метаболизм.

Биологическое окисление - то система окислительновосстановительных реакций, которые являются источником энергии в живых организмах и протекают при участии ферментов. Сходство с горением: Протекают с поглощением О 2 и выделением СО 2, Н 2 О и энергии. Отличие от горения: 1. Это ферментативный процесс. 2. Многоступенчатый процесс. 3. Около 40% энергии запасается в виде энергии химической связи молекул АТФ и др. 4. Протекает при 37 -400 С. 5. Происходит в водных растворах.

Теории биологического окисления. Древние философы отмечали взаимосвязь между процессами жизнедеятельности и дыханием. Они также провели параллель между дыханием и горением. Платон утверждал, что воздух нужен для охлаждения внутреннего жара сгорающего вещества. Аристотель считал, что воздух нужен для поддержания внутреннего горения.

В XVIII в. широкое признание получила теория горючего начала – флогистона (phlogistos – горючий), созданная Г. Шталем. Все горючие вещества состоят из флогистона, выделяемого при горении и золы. Несмотря на ошибочность эта теория обобщила «…множество реакций (окисления), и это было очень важным шагом в науке» Д. И. Менделеев Опровергнута работами Ломоносова и Лавуазье, открывшими закон сохранения вещества.

В 1774 г. Лавуазье доказал сходство процессов горения и дыхания, т. к. образуются идентичные продукты. Лавуазье назвал дыхание медленным горением, позднее на этой основе было установлен процесс окисление глюкозы в организме: C 6 H 12 O 6 + 6 O 2 ------> 6 CO 2 + 6 H 2 O + Q В 1751 г. Ломоносов подробно изучал процессы горения и окисления. Однако трудно было объяснить противоречие: - процесс горения идет в воздушной среде с высокой tº, дыхание - в среде с пониженной tº

В начале XIX в. стали известны катализаторы, с помощью которых осуществлялись процессы окисления. Это были металлы, обладающие «внутренней силой» . В XIX в. появилось понятие о ферментах и причину своеобразного течения реакций биологического окисления (БО) попытались объяснить с позиции «активации» кислорода в клетках организма. Первая теория, систематизировавшая знания о БО сделана одновременно русским ученым А. Н. Бахом и немецким К. Энглером.

Согласно этой теории, «активация» молекулярного кислорода происходит в результате разрыва связи и присоединения к ферментам оксигеназам (А) : A + O 2 AО 2 + SH 2 S + A +Н 2 О 2 Образованный Н 2 О 2 расщепляется каталазой Н 2 О 2 + Н 2 О 2 2 Н 2 О + O 2 или перокидазой SН 2 + Н 2 О 2 S + 2 Н 2 О 2 GSH + H 2 O 2 2 H 2 O

3 «уязвимых» положения теории Баха: В тканях не было обнаружено высокой: активности оксидазы, концентрации H 2 O 2. активности ферментов, разлагающих H 2 O 2 (каталазы и пероксидазы)

В 1912 г. была сформулирована теория В. И. Палладина - Г. Виланда, согласно которой в организме есть промежуточные вещества, способные акцептировать электроны и протоны от субстрата с последующей передачей электронов и протонов на кислород. Согласно этой теории весь процесс БО можно разбить на 2 этапа:


В. И. Палладин, исследуя растительные пигменты, способных к изменению цвета, в зависимости от О-В состояния окисления предположил, что существует несколько промежуточных переносчиков, позволяющих организму поэтапно освобождать химическую энергию и кислород выступает в качестве конечного акцептора электронов и протонов.


Современные представления о БО базируются на сущности трактовки ОВП, а также на общих законах термодинамики: 1 закон - закон сохранения энергии: энергия никуда не исчезает, а только переходит из одной формы в другую, т. е. сохраняется. 2 закон - все тела и химические процессы стремятся к минимуму энергии, к состоянию покоя и беспорядка, т. е. к энтропии.

В последующем установили, что роль промежуточных переносчиков (хромогенов) выполняют коферменты оксидоредуктаз - NAD; NADP; FAD; FMN. В дальнейшем развитие учения о БО, шло по пути изучения хромогенов. В 1925 г. были открыты цитохромы. В 1932 г. В. А. Энгельгардт показал, что процесс окисления идет с образованием АТФ (окислительное фосфорилирование). В 1945 году Ленинджер и Кенеди впервые показали, что процесс окисления веществ, цикл Кребса локализован в митохондриях.
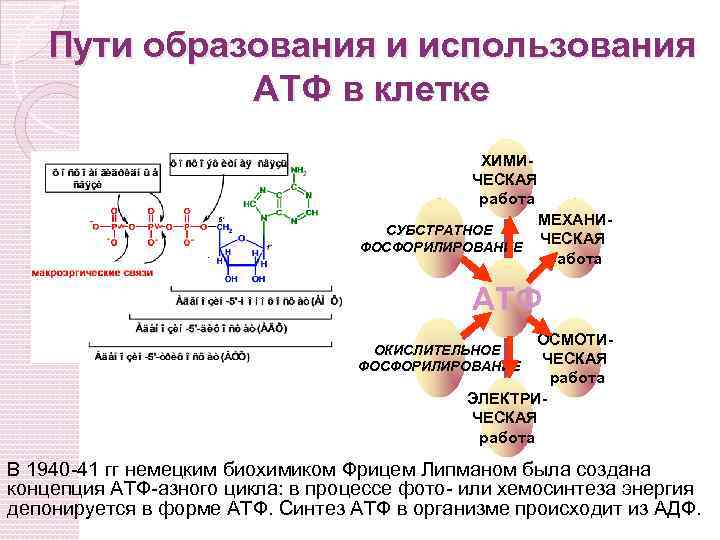
Пути образования и использования АТФ в клетке ХИМИЧЕСКАЯ работа МЕХАНИСУБСТРАТНОЕ ЧЕСКАЯ ФОСФОРИЛИРОВАНИЕ работа АТФ ОСМОТИЧЕСКАЯ работа ЭЛЕКТРИЧЕСКАЯ работа ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ В 1940 -41 гг немецким биохимиком Фрицем Липманом была создана концепция АТФ-азного цикла: в процессе фото- или хемосинтеза энергия депонируется в форме АТФ. Синтез АТФ в организме происходит из АДФ.

БО - это совокупность биохимических реакций, приводящих к образованию полезной конвертируемой энергии за счет деградации компонентов пищи. Принципиальной особенностью БО или тканевого дыхания является то, что оно протекает постепенно, через многочисленные промежуточные стадии, т. е. происходит многократная передача протонов и электронов от донора к акцептору.
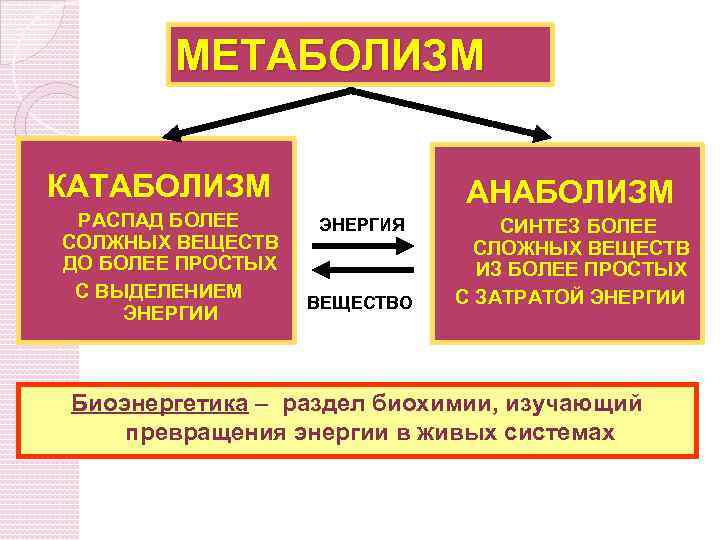
МЕТАБОЛИЗМ КАТАБОЛИЗМ РАСПАД БОЛЕЕ СОЛЖНЫХ ВЕЩЕСТВ ДО БОЛЕЕ ПРОСТЫХ С ВЫДЕЛЕНИЕМ ЭНЕРГИИ АНАБОЛИЗМ ЭНЕРГИЯ ВЕЩЕСТВО СИНТЕЗ БОЛЕЕ СЛОЖНЫХ ВЕЩЕСТВ ИЗ БОЛЕЕ ПРОСТЫХ С ЗАТРАТОЙ ЭНЕРГИИ Биоэнергетика – раздел биохимии, изучающий превращения энергии в живых системах

Нобелевская премия по химии за работы по биоэнергетике живой клетки 1997 г. Пол Бойер (США), Джон Уокер (Великобритания) и Йенс Скоу (Дания)

Ферменты и коферменты биологического окисления По характеру кофермента - эти ферменты делят на 4 группы: 1. Анаэробные дегидрогеназы (пиридинзависимые) Содержат коферменты НАД и НАДФ Функции: забирают 2 Н от субстрата с переносом его на другие соединения ( не на О). Так окисляются спирты и альдегиды 2. Аэробные дегидрогеназы (оксидазы, флавинзависимые). Содержат коферменты ФАД и ФМН. Функции: забирают 2 Н от субстрата или НАД с переносом на цитохромы или кислород. Так окисляются аминокислотыты, янтарная кислота
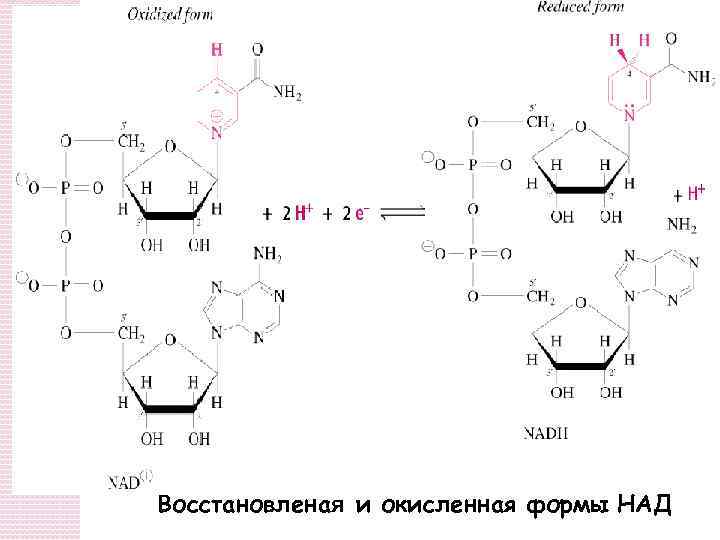
Восстановленая и окисленная формы НАД
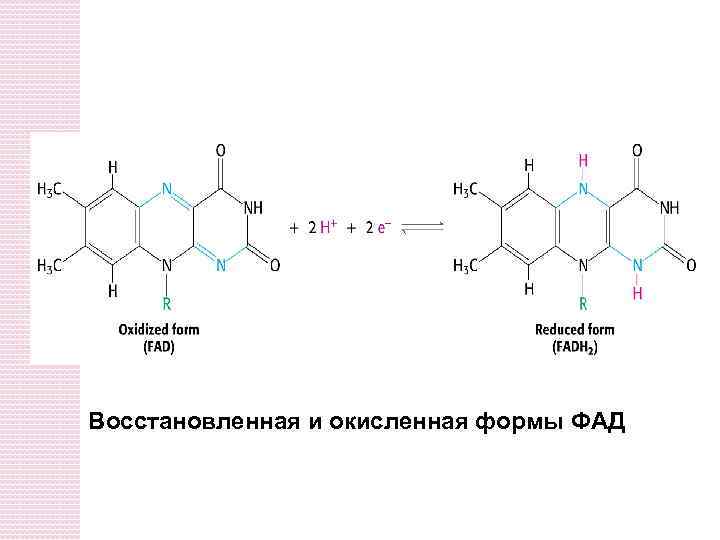
Восстановленная и окисленная формы ФАД

3. Убихиноны - содержат кофермент Q Функции: переносят электроны от ФАД - Н 2 на цитохромы 4. Ферменты геминовой природы (содержат гем). Сюда входят: цитохромы а, в, с, цитохромоксидаза (аа 3 ), каталаза и пероксидаза
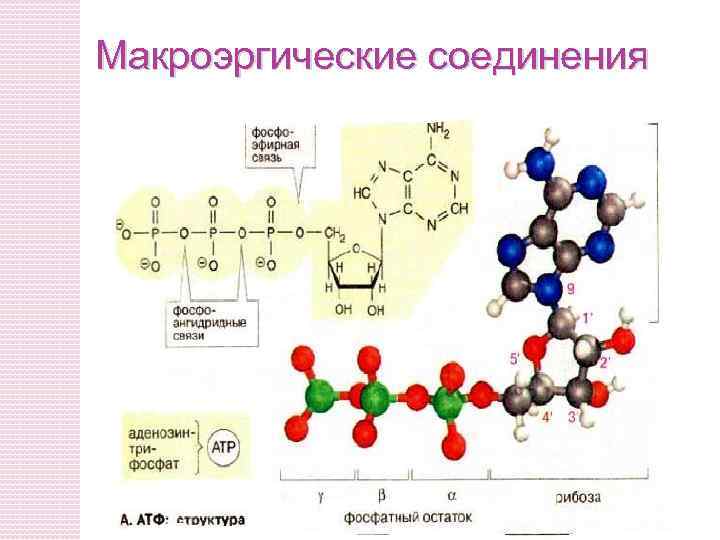
Макроэргические соединения

Природа макроэргичности АТФ. Роль АТФ - депонирование «биологической» энергии. В 1 молекуле АТФ имеется 2 макроэргические связи. При их расщеплении высвобождается 32, 5 к. Дж энергии. АТФ + Н 2 О АДФ + Н 3 РО 4 + 32, 5 к. Дж/моль АТФ + 2 Н 2 О АМФ + 2 Н 3 РО 4 + 34, 7 к. Дж/моль
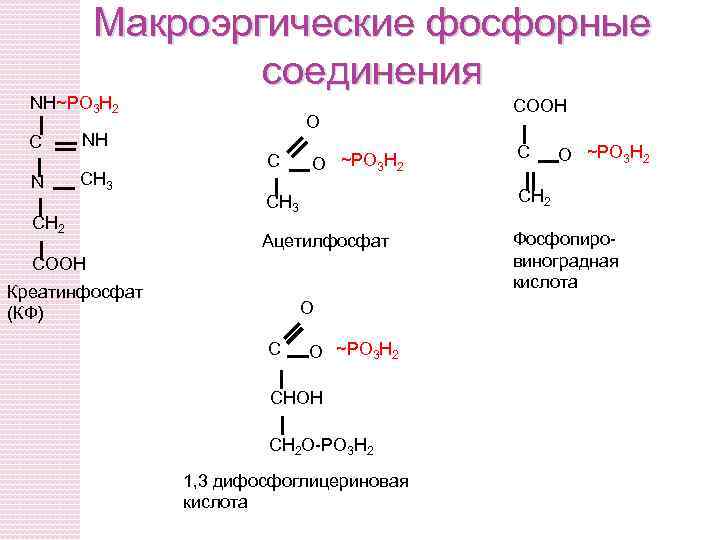
Макроэргические фосфорные соединения NН~РО 3 Н 2 С NН N СН 3 О СН 2 С О ~РО 3 Н 2 Ацетилфосфат СООН О С С О ~РО 3 Н 2 СН 3 Креатинфосфат (КФ) СООН О ~РО 3 Н 2 СНОН СН 2 О-РО 3 Н 2 1, 3 дифосфоглицериновая кислота Фосфопировиноградная кислота

Три источника образования АТФ Окислительное фосфорилирование – механизм образования АТФ, использующий для этого энергию градиента электрохимического потенциала, возникающего на внутренней мембране митохондрий. Субстратное фосфорилирование – механизм синтеза АТФ, использующий энергию макроэргических соединений, образующихся в процессе метаболизма (1, 3 - дифосфоглицериновая кислота, сукцинил-Ко. А и т. д. ). Синтез АТФ с использованием макроэргов, выполняющих своеобразную роль молекул – депо макроэргических связей (креатинфосфат).

АТФ присутствует в клетках в диссоциированной форме: АТФ 4 -------> АДФ 3 - + Фн 2 - + Н+, в соответствующих концентрациях: 10 -3. (АТФ 4 -); 10 -3. (АДФ 3 -); 10 -3. (Фн 2 -): 10 -7. (Н+, ). Любая работа в клетке сопровождается образованием H+, которые захватываются буферами. 1 причина макроэргичности: т. к. концентрация АТФ, АДФ и Фн одинакова (по 10 -3 моль), а концентрация Н+ = 10 -7 моль.

согласно закону соотношения действующих масс равновесие сдвинуто вправо. 2 причина: в структуре АТФ имеется 3 фосфата и 2 ангидридные связи, за счет этого на хвосте молекулы АТФ создается конформационная напряженность, возникает сила электростатического отталкивания и АТФ отдает молекулу фосфата. И при этом она переходит в более выгодное состояние АДФ + Фн, которое более устойчиво, это 3 -я причина макроэргичности.
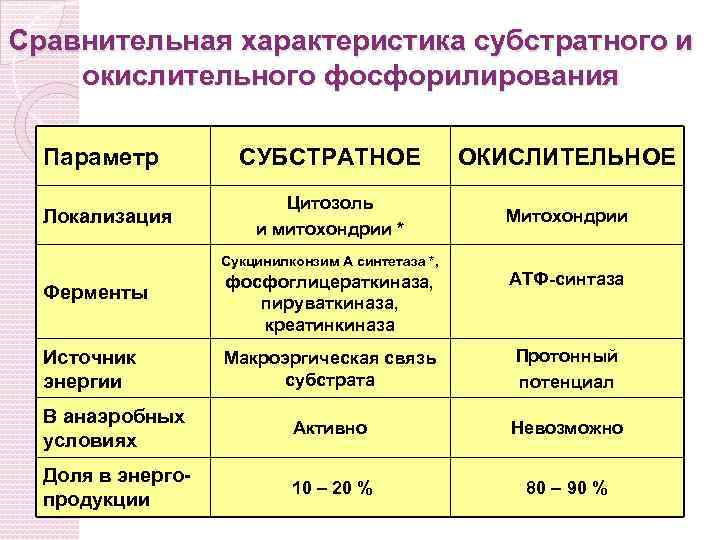
Сравнительная характеристика субстратного и окислительного фосфорилирования Параметр Локализация СУБСТРАТНОЕ ОКИСЛИТЕЛЬНОЕ Цитозоль и митохондрии * Митохондрии Сукцинилконзим А синтетаза *, фосфоглицераткиназа, пируваткиназа, креатинкиназа АТФ-синтаза Макроэргическая связь субстрата Протонный потенциал В анаэробных условиях Активно Невозможно Доля в энергопродукции 10 – 20 % 80 – 90 % Ферменты Источник энергии

Субстраты биологического окисления Субстратом БО является любое вещество, способное поставлять электроны и протоны, энергия которых трансформируется в полезную конвертируемую форму. Субстраты БО: метаболиты восстанавливающие НАД+ ФАД+.

Схема энергетического обмена Основные компоненты пищи - белки, липиды и углеводы проходят 3 этапа энергетического обмена
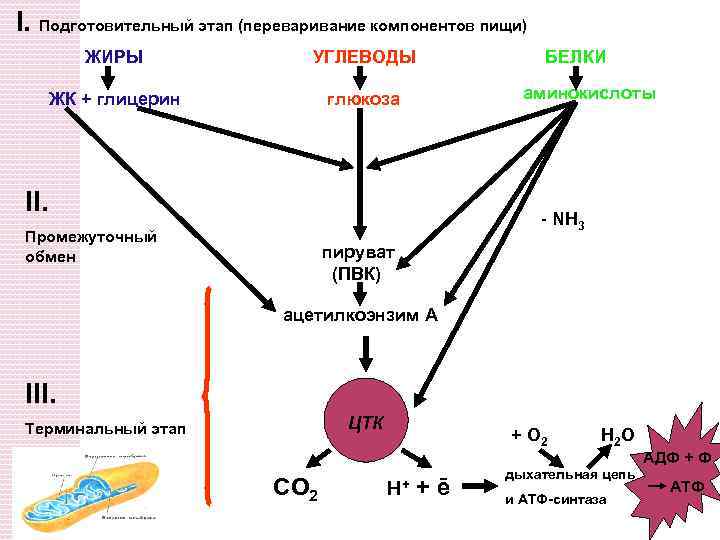
I. Подготовительный этап (переваривание компонентов пищи) ЖИРЫ УГЛЕВОДЫ ЖК + глицерин глюкоза БЕЛКИ аминокислоты II. - NH 3 Промежуточный обмен пируват (ПВК) ацетилкоэнзим А III. ЦТК Терминальный этап + О 2 Н 2 О АДФ + Ф СО 2 H+ +ē дыхательная цепь и АТФ-синтаза АТФ

1. ЖКТ - происходит деполимеризация сложных соединений: крахмал и гликоген → Глюкоза олиго и дисахариды → моносахариды белки (пептидов) → Аминокислоты Липиды → глицерин и СЖК 2. С момента поступления мономеров в клетку начинается цитозольный этап: происходит дальнейший распад мономеров и унификация субстратов, превращение их в Пируват, СН 3 -SKo. A

3. Митохондриальный этап – это унификация субстратов. Процесс продолжается в митохондриальном матриксе, где субстраты подвергаются окислению путем вовлечения в цикл Кребса, который снимает с них электроны и Н+ и трансформирует их энергию в конвертируемую форму АТФ.

Схема образования субстратов биологического окисления БЕЛКИ УГЛЕВОДЫ ЛИПИДЫ Энергия | | | I АК Гл ЖК: Гн 0. 5% Окисление субстратов на уровне ЖКТ дает клетке всего 0. 5% энергии.

Цитоплазматический этап: переход аминокислот в ЩУК СН 3 -СО-SКо. А Жирных кислот в СН 3 -СО-SКо. А Глюкозы в 3 ФГА- ПВК - Ацетил. Ко. А На этом пути образуется 2. 5 % энергии

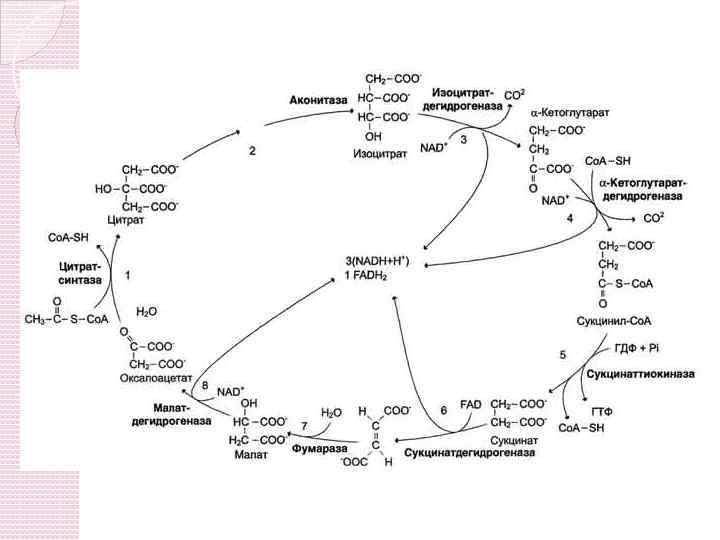
Митохондриальный этап: Цикл Кребса | NAD 1/2 O 2 ------ АДФ + Фн Цитрат NAD. H 2 Н 2 О АТФ работа На этом этапе образуется 97% энергии.
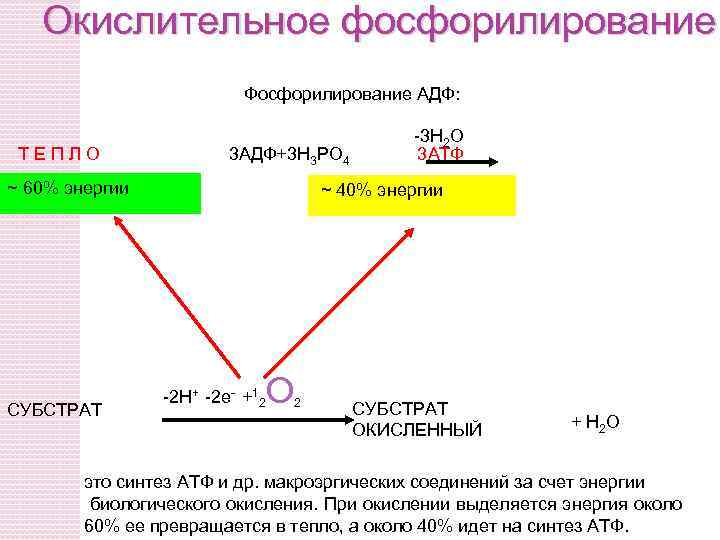
Окислительное фосфорилирование Фосфорилирование АДФ: ТЕПЛО 3 АДФ+3 Н 3 РО 4 ~ 60% энергии СУБСТРАТ -3 Н 2 О 3 АТФ ~ 40% энергии -2 Н+ -2 е- +12 О 2 СУБСТРАТ ОКИСЛЕННЫЙ + Н 2 О это синтез АТФ и др. макроэргических соединений за счет энергии биологического окисления. При окислении выделяется энергия около 60% ее превращается в тепло, а около 40% идет на синтез АТФ.
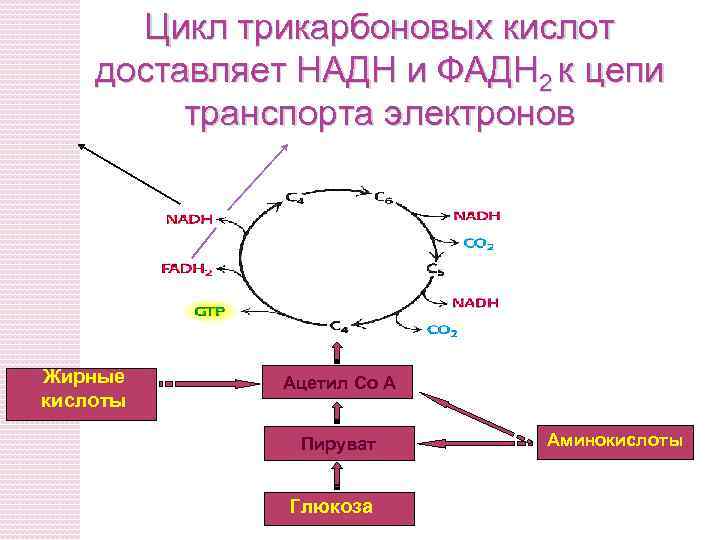
Цикл трикарбоновых кислот доставляет НАДН и ФАДH 2 к цепи транспорта электронов Жирные кислоты Ацетил Co A Пируват Глюкоза Аминокислоты

Коферменты НАДН и ФАДH 2 образуются в матриксе при: (1) Окислительном декарбоксилировании пирувата в ацетил Co. A (2) Аэробном окислении ацетил-Co. A в цикле трикарбоновых кислот (3) Окислении жирных кислот и аминокислот НАДH и ФАДH 2 – энергетически богатые молекулы потому что содержат пару электронов, которые имеют высокий трансферный потенциал
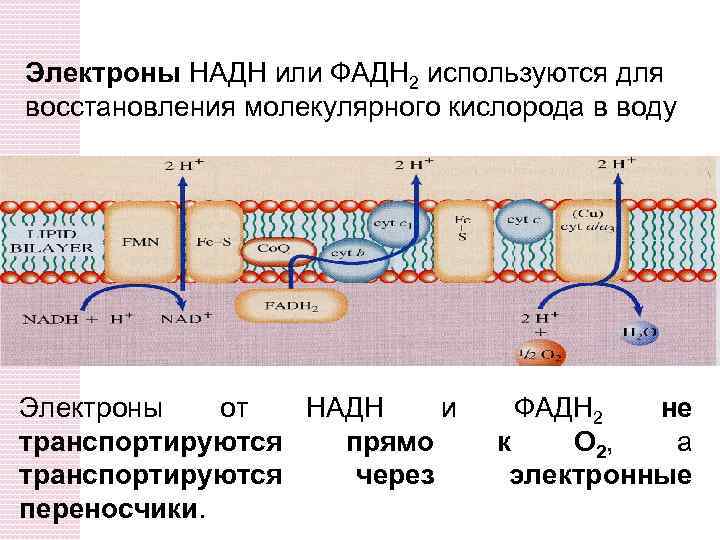
Электроны НАДН или ФАДH 2 используются для восстановления молекулярного кислорода в воду Электроны от НАДН и транспортируются прямо транспортируются через переносчики. ФАДH 2 не к O 2, а электронные

СУММАРНОЕ УРАВНЕНИЕ и ЭНЕРГЕТИЧЕСКИЙ БАЛАНС ЦИКЛА КРЕБСА Ганс Адольф КРЕБС (1900 -1981) Нобелевская премия (совместно с Липманном) 1953 г. Ф.

ТКАНЕВОЕ ДЫХАНИЕ – потребление кислорода в дыхательной цепи митохондрий с энергетической целью. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ – синтез АТФ на внутренней мембране митохондрий в присутствии кислорода. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ 1. 2. 3. Тканевое дыхание – главный потребитель кислорода, ОФ – главный поставщик АТФ. Обеспечивают конечный этап окисления БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ: органических веществ до неорганических – образуется метаболическая вода. Поддержание постоянной температуры (несократительный термогенез).

ХЕМИОСМОТИЧЕСКАЯ ТЕОРИЯ 1. Движение электронов по дыхательной цепи служит источником энергии для переноса протонов через мембрану. 2. Трансмембранный электрохимический потенциал служит сопрягающим звеном между тканевым дыханием и окислительным фосфорилированием. Питер Митчелл (Нобелевская премия 1978 г) Владимир Скулачев
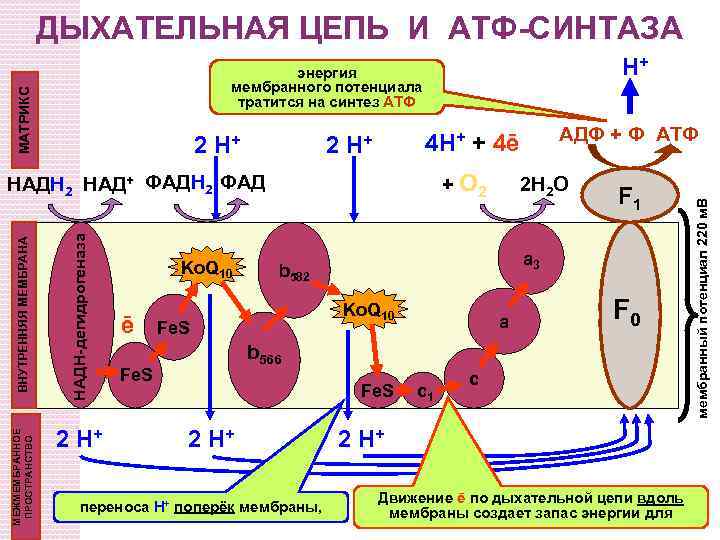
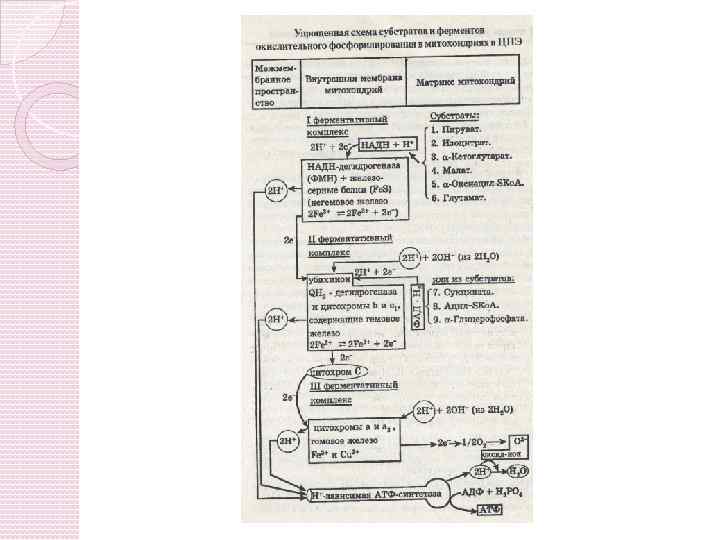
ДЫХАТЕЛЬНАЯ ЦЕПЬ И АТФ-СИНТАЗА H+ 2 H+ + O 2 ВНУТРЕННЯЯ МЕМБРАНА НАДН-дегидрогеназа МЕЖМЕМБРАННОЕ ПРОСТРАНСТВО НАДН 2 НАД+ ФАДН 2 ФАД 2 H+ Ko. Q 10 ē 2 H 2 O F 1 a 3 b 582 Ko. Q 10 Fe. S АДФ + Ф АТФ 4 H+ + 4ē 2 H+ a F 0 b 566 Fe. S 2 H+ переноса Н+ поперёк мембраны, c 1 c 2 H+ Движение ē по дыхательной цепи вдоль мембраны создает запас энергии для мембранный потенциал 220 м. В МАТРИКС энергия мембранного потенциала тратится на синтез АТФ
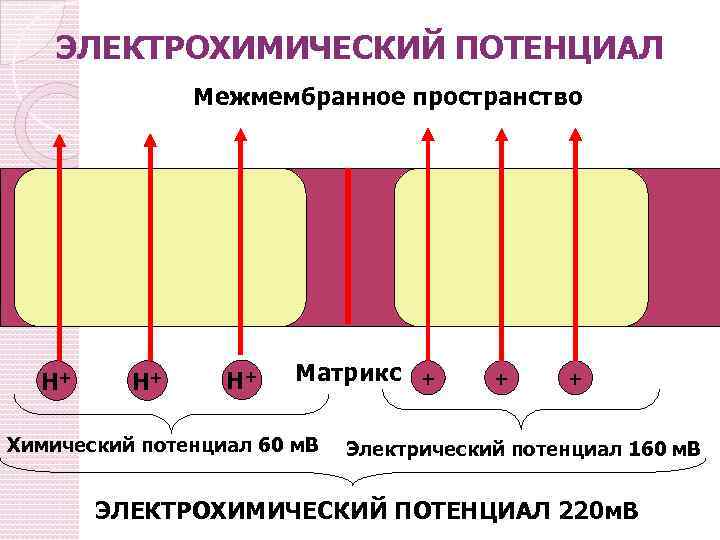
ЭЛЕКТРОХИМИЧЕСКИЙ ПОТЕНЦИАЛ Межмембранное пространство Н+ Н+ Н+ Матрикс Химический потенциал 60 м. В + + + Электрический потенциал 160 м. В ЭЛЕКТРОХИМИЧЕСКИЙ ПОТЕНЦИАЛ 220 м. В
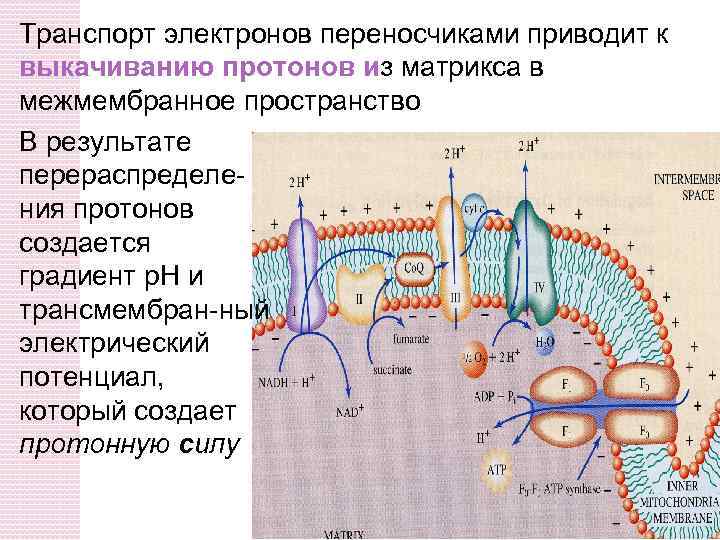
Транспорт электронов переносчиками приводит к выкачиванию протонов из матрикса в межмембранное пространство В результате перераспределения протонов создается градиент p. H и трансмембран-ный электрический потенциал, который создает протонную силу
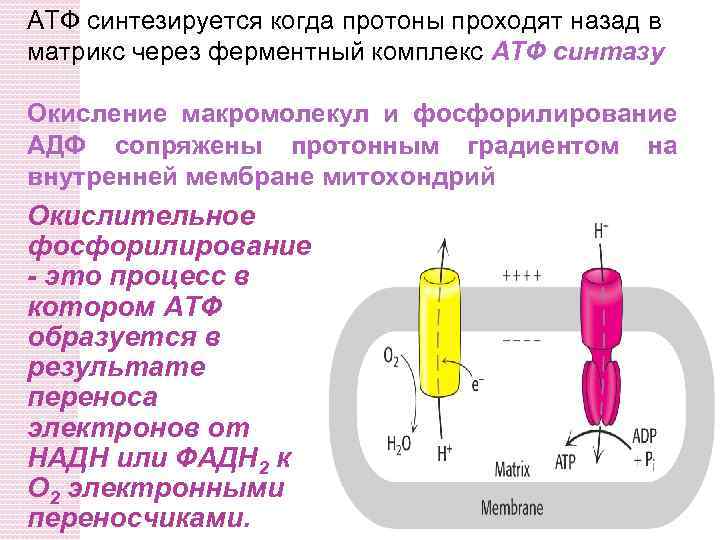
АТФ синтезируется когда протоны проходят назад в матрикс через ферментный комплекс АТФ синтазу Окисление макромолекул и фосфорилирование АДФ сопряжены протонным градиентом на внутренней мембране митохондрий Окислительное фосфорилирование - это процесс в котором АТФ образуется в результате переноса электронов от НАДН или ФАДH 2 к O 2 электронными переносчиками.
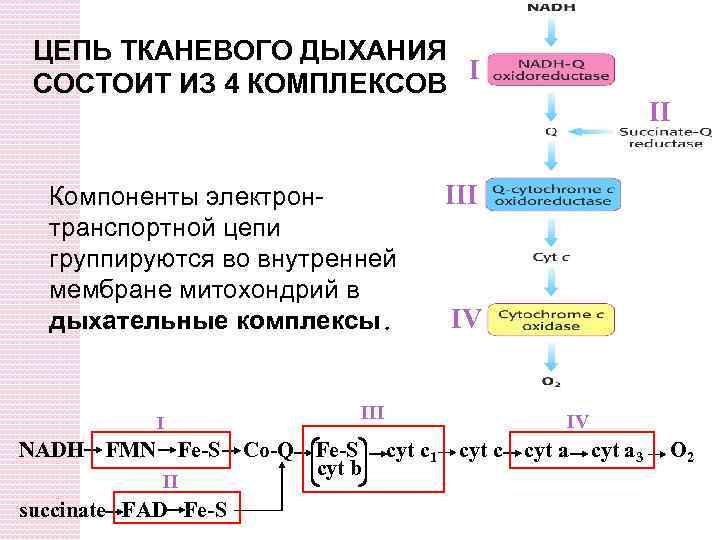
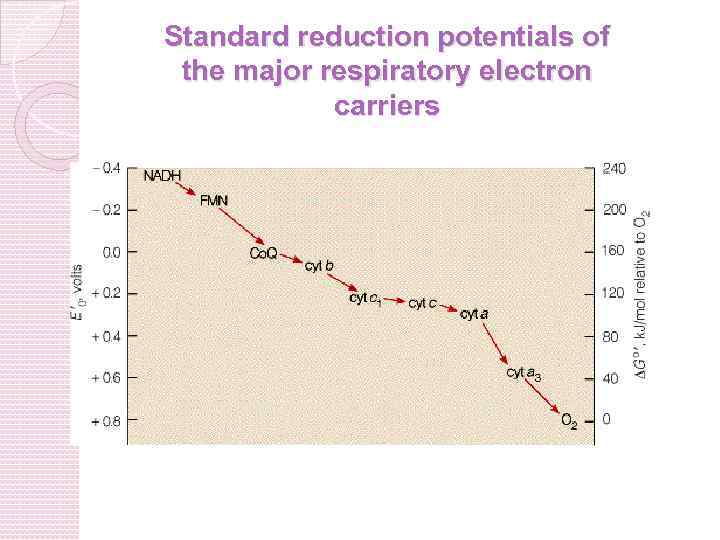
ЦЕПЬ ТКАНЕВОГО ДЫХАНИЯ I СОСТОИТ ИЗ 4 КОМПЛЕКСОВ Компоненты электронтранспортной цепи группируются во внутренней мембране митохондрий в дыхательные комплексы. III I NADH FMN Fe-S II succinate FAD Fe-S Co-Q Fe-S cyt b II IV IV cyt c 1 cyt c cyt a 3 O 2

При окислительном фосфорилировании электрон трансферный потенциал НАДН или ФАДH 2 превращается в фосфорилтрансферный потенциал АТФ. Фосфорилтрансферний потенциал – это G°' (энергия освобождается при гидролизе фосфатного соединения). G°' для АТФ = -7. 3 ккал/моль Электронтрансферный потенциал называется редокс потенциал, или восстановительный потенциал). E'o, (также окислительно-
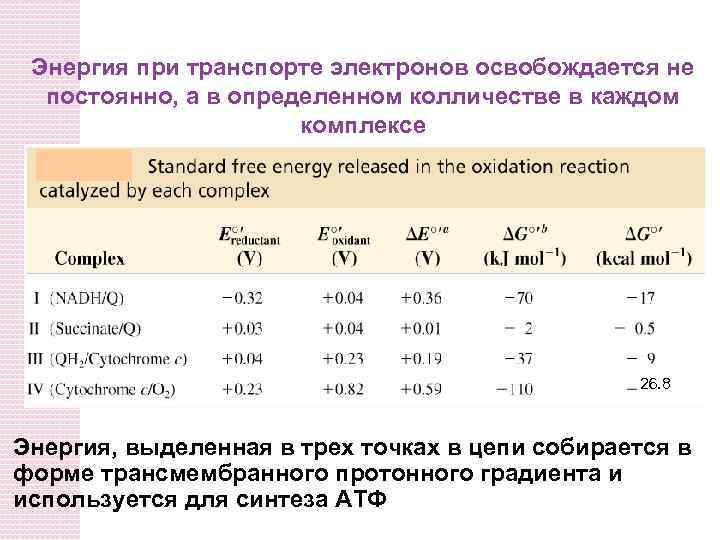
Энергия при транспорте электронов освобождается не постоянно, а в определенном колличестве в каждом комплексе 26. 8 Энергия, выделенная в трех точках в цепи собирается в форме трансмембранного протонного градиента и используется для синтеза АТФ
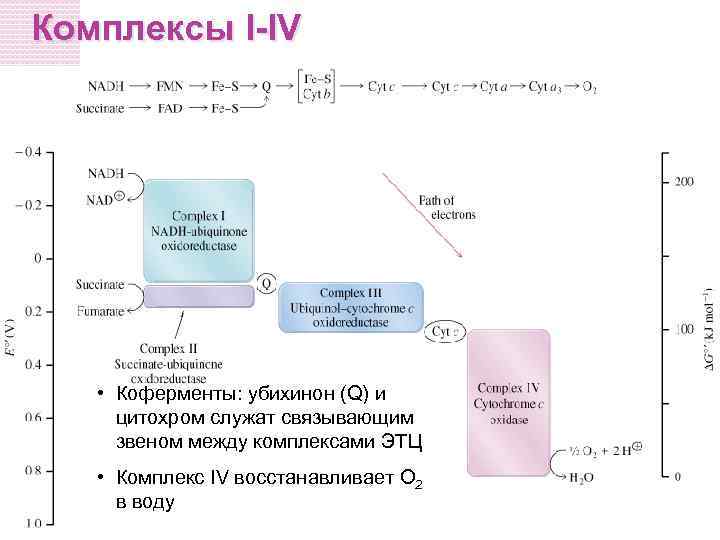
Комплексы I-IV • Коферменты: убихинон (Q) и цитохром служат связывающим звеном между комплексами ЭТЦ • Комплекс IV восстанавливает O 2 в воду
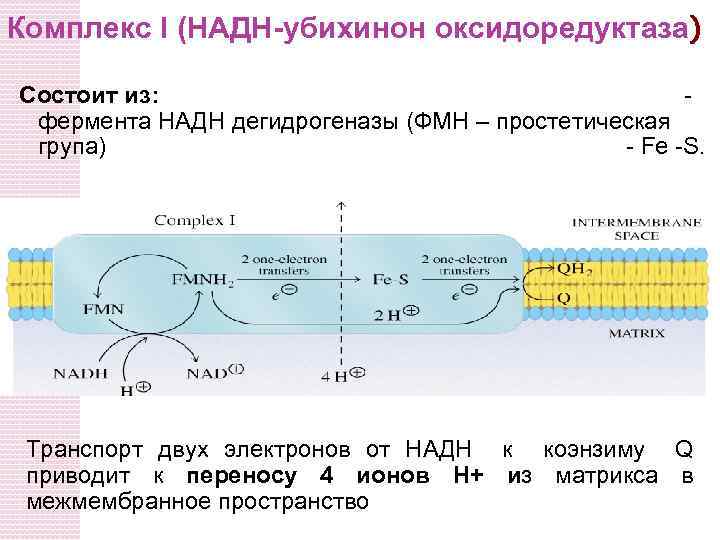
Комплекс I (НАДH-убихинон оксидоредуктаза) Состоит из: фермента НАДH дегидрогеназы (ФМН – простетическая група) - Fe -S. Транспорт двух электронов от НАДH к коэнзиму Q приводит к переносу 4 ионов Н+ из матрикса в межмембранное пространство
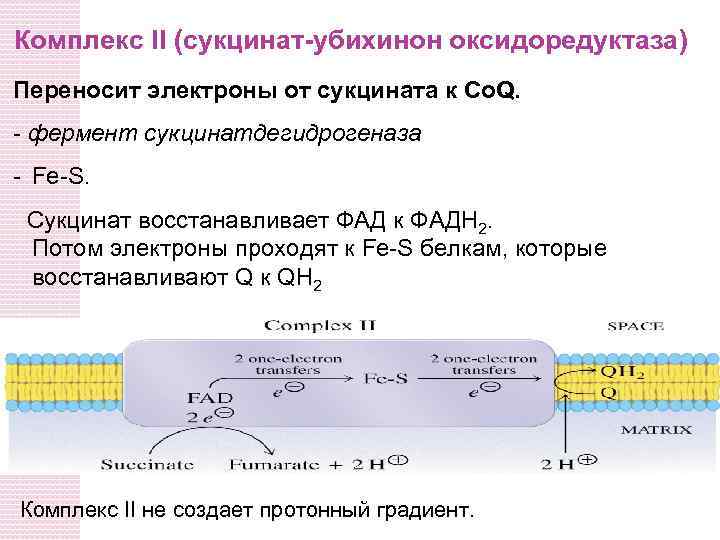
Комплекс II (сукцинат-убихинон оксидоредуктаза) Переносит электроны от сукцината к Co. Q. - фермент сукцинатдегидрогеназа - Fe-S. Сукцинат восстанавливает ФАД к ФАДH 2. Потом электроны проходят к Fe-S белкам, которые восстанавливают Q к QH 2 Комплекс II не создает протонный градиент.
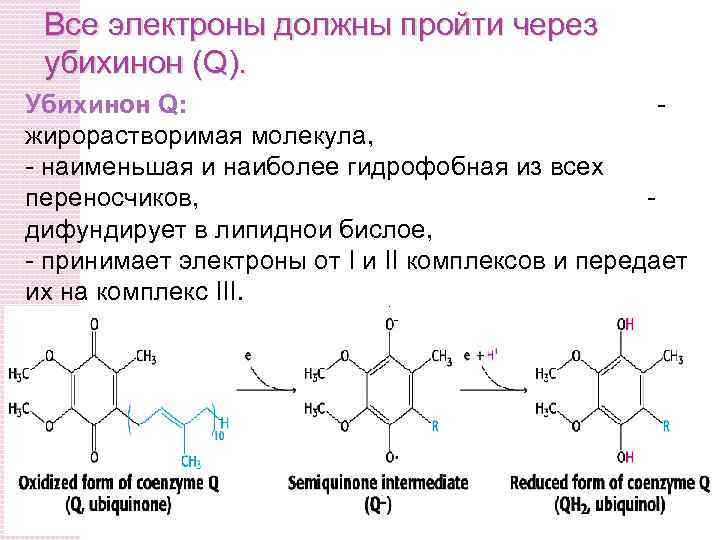
Все электроны должны пройти через убихинон (Q). Убихинон Q: жирорастворимая молекула, - наименьшая и наиболее гидрофобная из всех переносчиков, дифундирует в липиднои бислое, - принимает электроны от I и II комплексов и передает их на комплекс III.
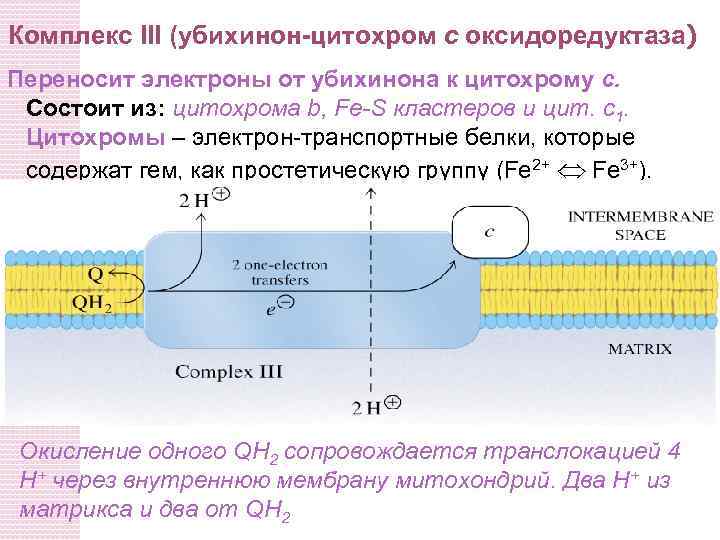
Комплекс III (убихинон-цитохром c оксидоредуктаза) Переносит электроны от убихинона к цитохрому c. Состоит из: цитохрома b, Fe-S кластеров и цит. c 1. Цитохромы – электрон-транспортные белки, которые содержат гем, как простетическую группу (Fe 2+ Fe 3+). Окисление одного QH 2 сопровождается транслокацией 4 H+ через внутреннюю мембрану митохондрий. Два H+ из матрикса и два от QH 2
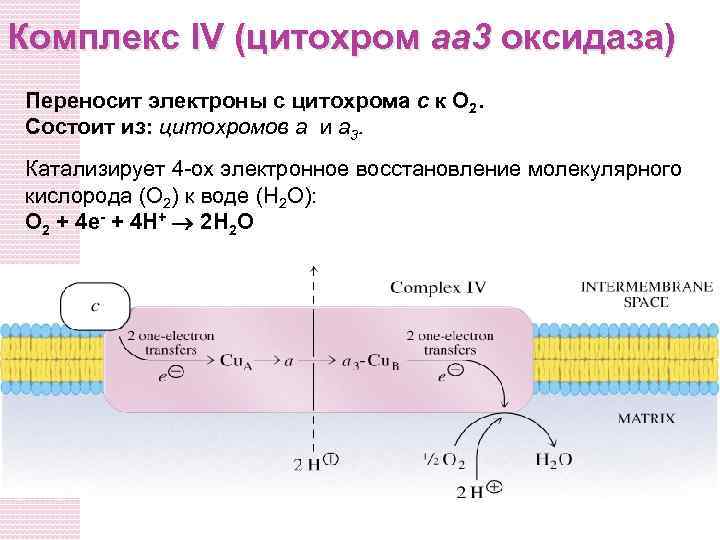
Комплекс IV (цитохром аа 3 оксидаза) Переносит электроны с цитохрома c к O 2. Состоит из: цитохромов a и a 3. Катализирует 4 -ох электронное восстановление молекулярного кислорода (O 2) к воде (H 2 O): O 2 + 4 e- + 4 H+ 2 H 2 O
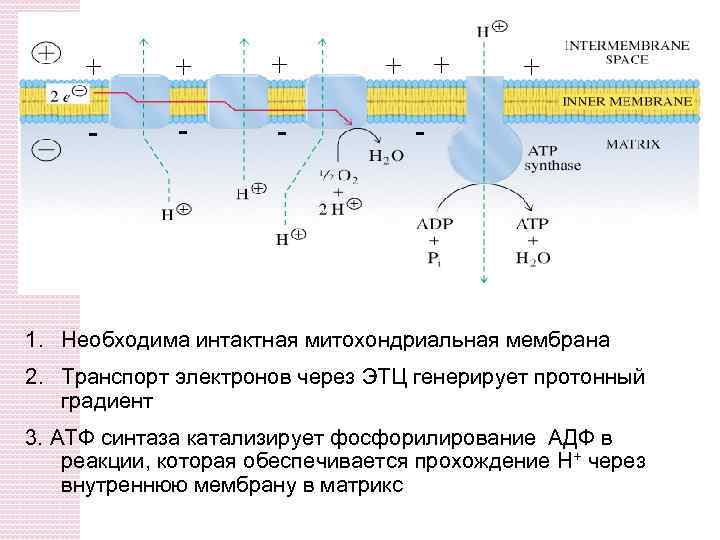
+ + + - - - + + + - 1. Необходима интактная митохондриальная мембрана 2. Транспорт электронов через ЭТЦ генерирует протонный градиент 3. AТФ синтаза катализирует фосфорилирование АДФ в реакции, которая обеспечивается прохождение Н+ через внутреннюю мембрану в матрикс
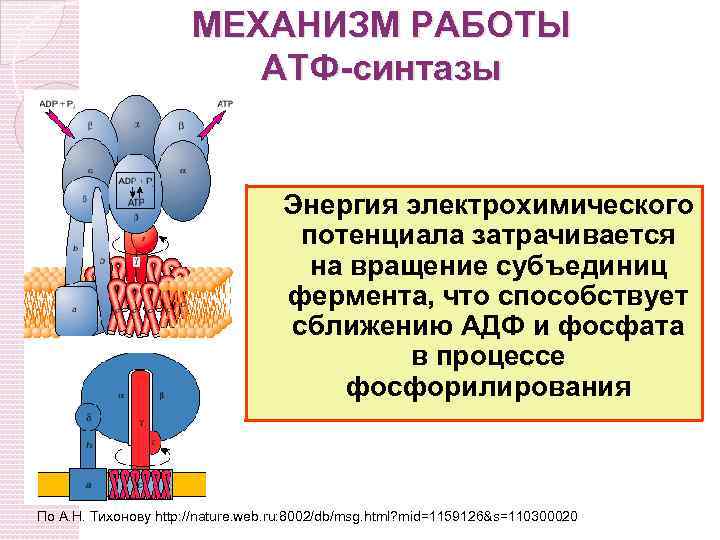
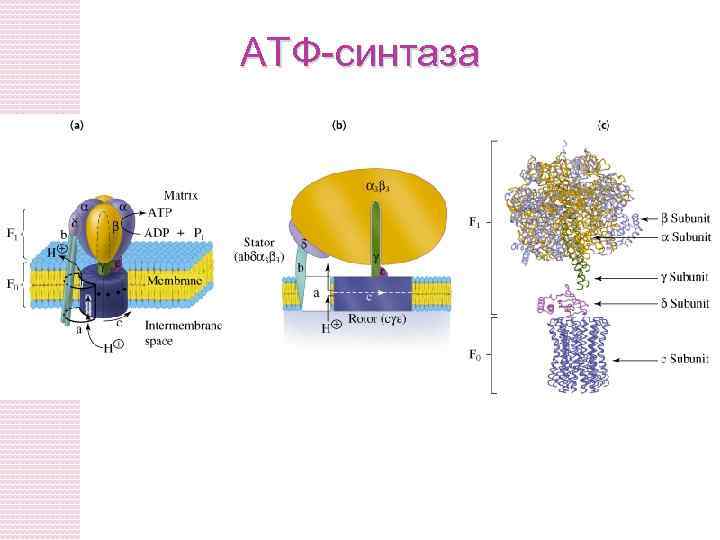
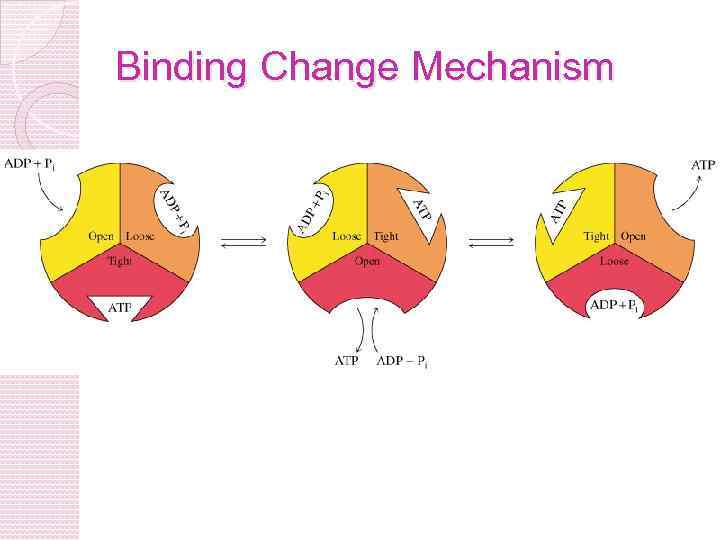
МЕХАНИЗМ РАБОТЫ АТФ-синтазы Энергия электрохимического потенциала затрачивается на вращение субъединиц фермента, что способствует сближению АДФ и фосфата в процессе фосфорилирования По А. Н. Тихонову http: //nature. web. ru: 8002/db/msg. html? mid=1159126&s=110300020
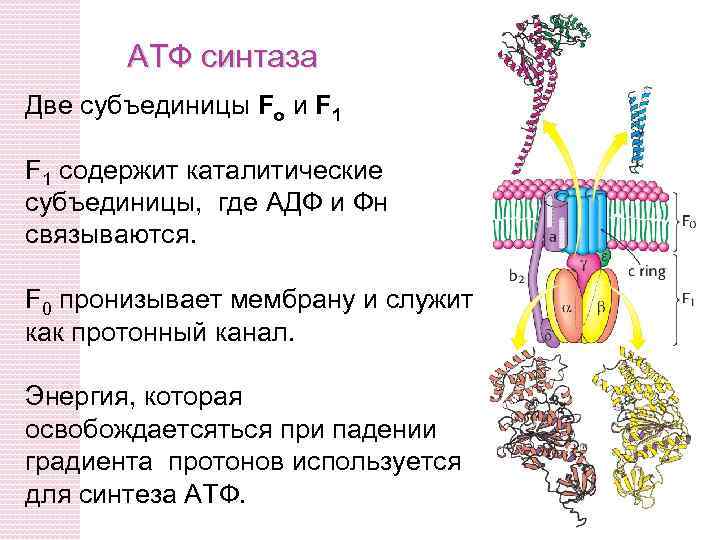
АТФ синтаза Две субъединицы Fo и F 1 содержит каталитические субъединицы, где АДФ и Фн связываются. F 0 пронизывает мембрану и служит как протонный канал. Энергия, которая освобождаетсяться при падении градиента протонов используется для синтеза АТФ.
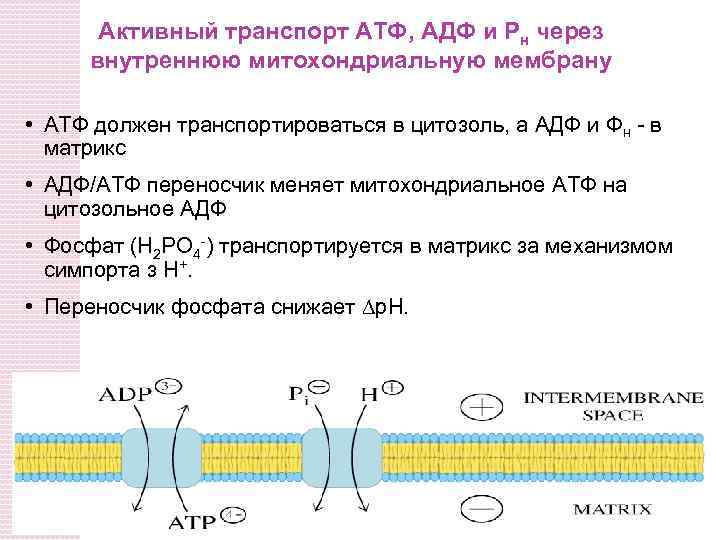
Активный транспорт ATФ, AДФ и Pн через внутреннюю митохондриальную мембрану • АТФ должен транспортироваться в цитозоль, а АДФ и Фн - в матрикс • AДФ/ATФ переносчик меняет митохондриальное ATФ на цитозольное АДФ • Фосфат (H 2 PO 4 -) транспортируется в матрикс за механизмом симпорта з H+. • Переносчик фосфата снижает p. H.
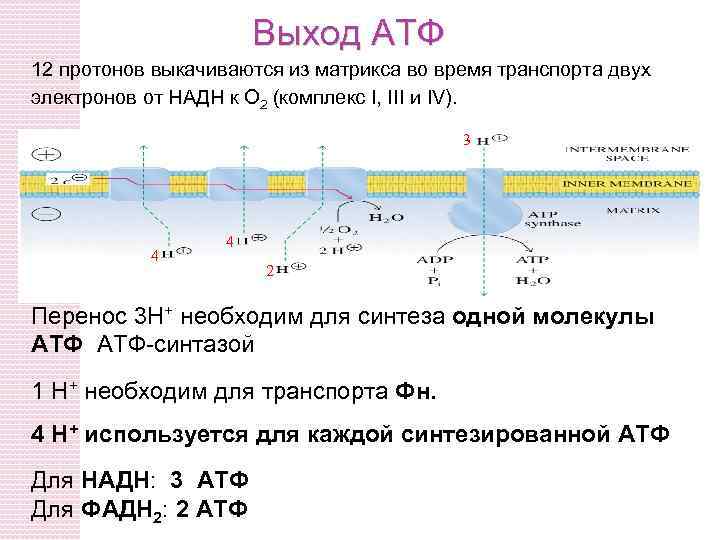
Выход АТФ 12 протонов выкачиваются из матрикса во время транспорта двух электронов от НАДН к O 2 (комплекс I, III и IV). 3 4 4 2 Перенос 3 H+ необходим для синтеза одной молекулы АТФ-синтазой 1 H+ необходим для транспорта Фн. 4 H+ используется для каждой синтезированной АTФ Для НАДН: 3 АТФ Для ФАДН 2: 2 ATФ
АТФ-синтаза
Binding Change Mechanism

Освобождающаяся при окислении ацетил-Ко. А энергия, расходуется на образование макроэргических связей АТФ. Из 4 пар атомов водорода, 3 пары переносятся через НАД и одна пара через ФАД. На каждую пару атомов водорода в системе БО образуется 3 АТФ (1 НАДН 2 = 1 АТФ).

Следовательно, всего 9 АТФ; одна пара атомов попадает в систему БО через ФАД, - в результате образуется 2 АТФ. Кроме этого в ходе сукцинатикиокиназной реакции образуется 1 ГТФ = 1 АТФ. Поэтому в целом, в ходе цикла Кребса образуется 12 АТФ.
Standard reduction potentials of the major respiratory electron carriers

РЕГУЛЯЦИЯ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ Сопряжение тканевого дихания с окислительным фосфорилированием Транспорт электронов тесно связан с фосфорилированием. АТФ не может быть синтезирован путем окислительного фосфорилирования если нет энергии освобожденной при электронном транспорте. Электроны не проходят через электрон-транспортную цепь если АДФ не фосфорилируется к АТФ. Основные регуляторы: НАДН, O 2, AДФ Внутримитохондриальное соотношение АТФ/АДФ является контрольным механизмом Высокое соотношение ингибирует так как АТФ аллостерически связывается с комлексом IV

ОСНОВОНОЙ ПРИНЦИП РЕГУЛЯЦИИ ЭНЕРГЕТИЧЕСКОГО ОБМЕНА: продукция АТФ регулируется потребностью клетки в энергии 1. Аллостерическая регуляция ферментов ЦТК: а) активаторы: НАД+, АМФ, АДФ. б) ингибиторы: НАДН 2, АТФ. 2. Гормональная регуляция: Инсулин стимулирует окислительное декарбоксилирование α-кетоглутарата за счет дефосфорилирования полиферментного комплекса. Тиреоидные гормоны стимулируют перенос АДФ в митохондрию и синтез АТФ.
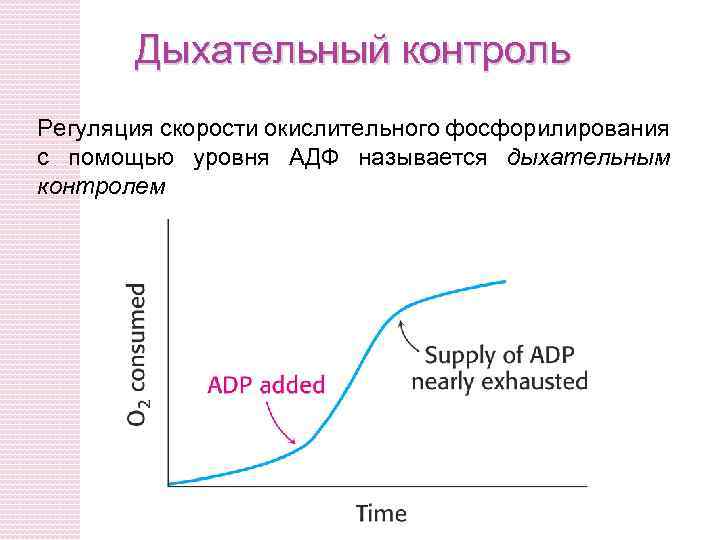
Дыхательный контроль Регуляция скорости окислительного фосфорилирования с помощью уровня АДФ называется дыхательным контролем
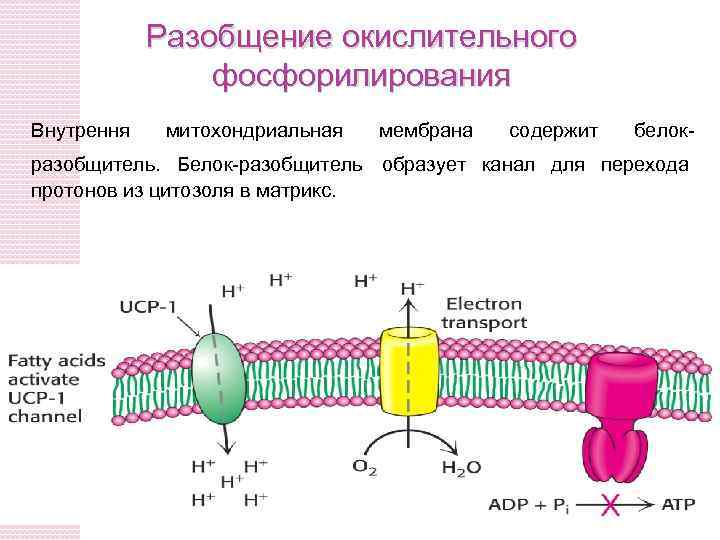
Разобщение окислительного фосфорилирования Внутрення митохондриальная мембрана содержит белок- разобщитель. Белок-разобщитель образует канал для перехода протонов из цитозоля в матрикс.
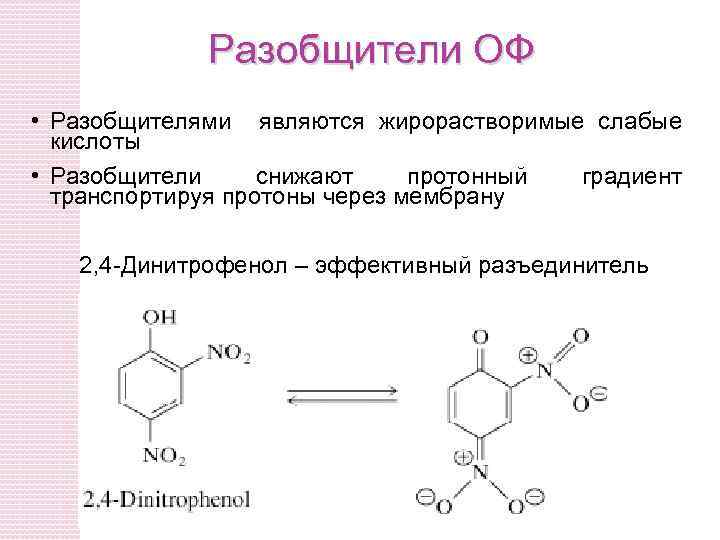
Разобщители ОФ • Разобщителями являются жирорастворимые слабые кислоты • Разобщители снижают протонный градиент транспортируя протоны через мембрану 2, 4 -Динитрофенол – эффективный разъединитель
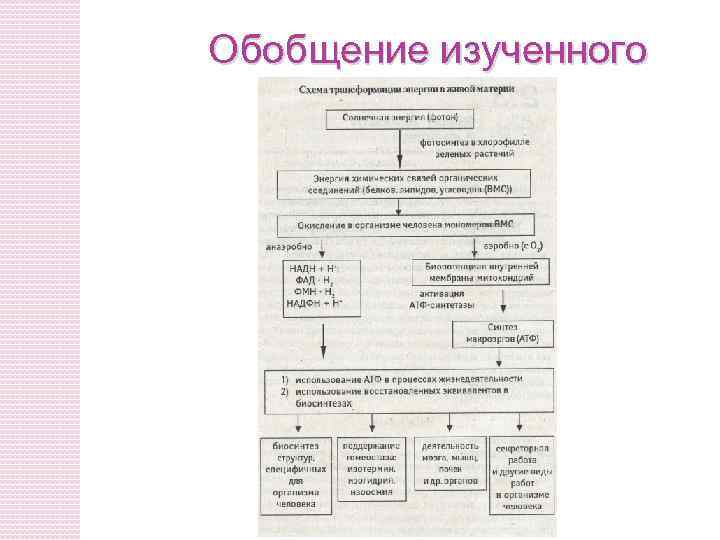
Обобщение изученного
Лекция. Биологическое окисление. Основные пути образования энергии в клетке.pptx