2 Лекция. аминокислоты.пептиды. белки.ppt
- Количество слайдов: 76

Лекция Аминокислоты. Пептиды. Белки. 1

Аминокислоты – производные карбоновых кислот, в которых атом водорода заменён на аминогруппу (NH 2). ОБЩАЯ ФОРМУЛА 2
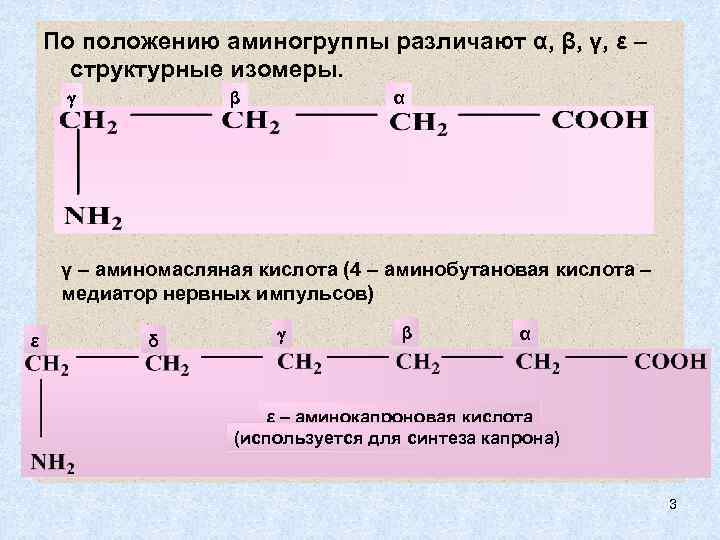
По положению аминогруппы различают α, β, γ, ε – структурные изомеры. β α γ – аминомасляная кислота (4 – аминобутановая кислота – медиатор нервных импульсов) ε δ β α ε – аминокапроновая кислота (используется для синтеза капрона) 3
– аминомасляная кислота принимает участие в обменных процессах головного мозга, является нейромедиатором. В медицинской практике под названием гаммалон или аминалон применяется при лечении нервно-психических заболеваний. 4

Отношение к нагреванию Структурные изомеры можно различить по их отношению к нагреванию (специфические свойства аминокислот при нагревании). Эти свойства аналогичны поведению α, β, γ – гидроксикислот при нагревании. 5

1) - аминокислоты образуют при нагревании дипептиды, а затем – дикетопиперазины H O N H 2 C H 3 HO C t + C OH N H 2 O C C H 3 o 2 H 2 O H - аминопропионовая кислота C H 3 CH C C 5 4 NH 6 3 O 1 C 2 CH C H 3 NH 1, 4 – дикетопиперазин 6 (глистогонный препарат)

2) - аминокислоты образуют непредельные кислоты CH 2 COOH to NH 3 CH 2 CH COOH NH 2 3 -аминопропановая кислота Пропеновая, акриловая кислота (циклическое соединение из двух молекул не образуется, так как получающееся при этом циклобутановое кольцо неустойчиво) 7
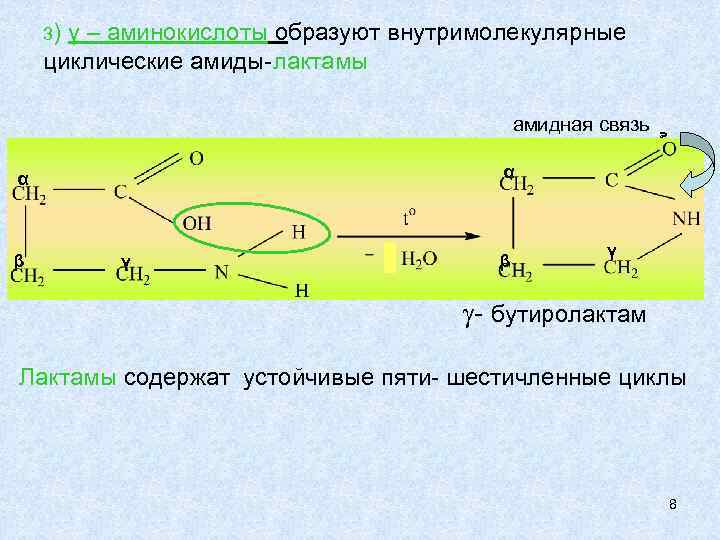
3) γ – аминокислоты образуют внутримолекулярные циклические амиды-лактамы амидная связь α α β γ - бутиролактам Лактамы содержат устойчивые пяти- шестичленные циклы 8

α - аминокислоты Структурной единицей пептидов и белков является α – аминокислота. ОБЩАЯ ФОРМУЛА 9

КЛАССИФИКАЦИЯ АМИНОКИСЛОТ Для аминокислот существует несколько классификаций в зависимости от того, какой признак положен в основу. 1. По химической природе углеводородного радикала: а) алифатические: глицин, аланин, валин, лейцин, изолейцин содержащие ОН- группу: серин, треонин содержащие СООН – группу: аспарагиновая, глутаминовая содержащие NH 2 CO – группу: аспарагин, глутамин содержащие NH 2 – группу: лизин, аргинин серусодержащие: цистеин, цистин, метионин б) ароматические: фенилаланин, тирозин в) гетероциклические: триптофан, гистидин г) иминокислоты: пролин 10

11

12

2. По полярности бокового радикала неполярные (гидрофобные) полярные незаряженные положительно заряженные отрицательно заряженные 13

3. По количеству амино - и карбоксильных групп : - 1 амино- и 1 карбоксильная группа – нейтральные - 1 амино- 2 карбоксильные группы – кислые - 2 амино- 1 карбоксильная группа - основные В водных растворах они заряжаются по-разному. 14
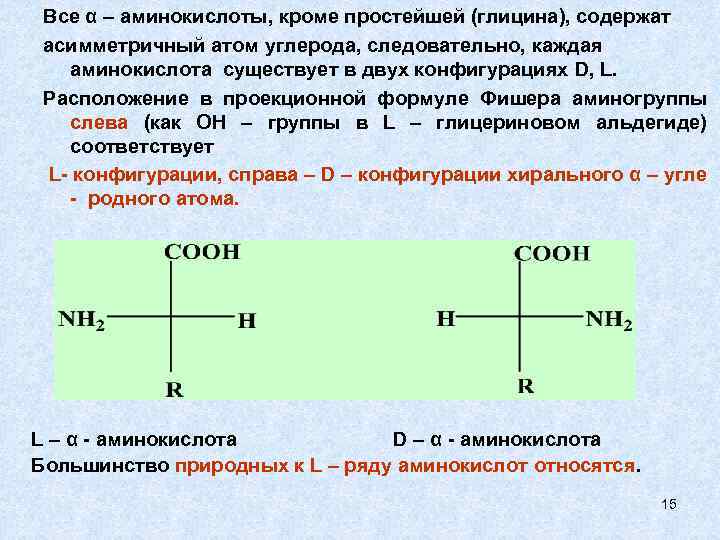
Все α – аминокислоты, кроме простейшей (глицина), содержат асимметричный атом углерода, следовательно, каждая аминокислота существует в двух конфигурациях D, L. Расположение в проекционной формуле Фишера аминогруппы слева (как ОН – группы в L – глицериновом альдегиде) соответствует L- конфигурации, справа – D – конфигурации хирального α – угле - родного атома. L – α - аминокислота D – α - аминокислота Большинство природных к L – ряду аминокислот относятся. 15

Энантиомеры имеют разные знаки удельного вращения: L может быть как левовращающей, так и правовращающей аминокислотой. Кроме того, всегда существует рацемическая смесь (при химическом способе получения аминокислот). Некоторые аминокислоты имеют два асимметричных атома (изолейцин, треонин, цистин и гидроксипролин) – две пары энантиомеров. 16

Для построения белков человеческого организма используются только аминокислоты L – ряда. Это имеет важное значение для формирования пространственной структуры белка. Ферменты, также построенные из α – аминокислот, вступают во взаимодействие только с субстратами определённой конфигурации. 17

D – аминокислоты (неприродные) встречаются, например, во многих природных пептидах, образованных с помощью микроорганизмов, в антибиотиках (грамицидин, актиномидин), а также в составе биополимеров клеточной стенки бактерий сибирской язвы (D – глутаминовая кислота). Против этого вида бактерий бессильны расщепляющие ферменты человека и животных. 18

У α – аминокислот разных стереохимических рядов наблюдается различие во вкусе. D – глутаминовая кислота безвкусна, а L – глутаминовая кислота имеет вкус мяса. 19

ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ В АМИНОКИСЛОТАХ основная группа кислотная функциональная группа боковой радикал 20

Для аминокислот характерны: а) кислотно-основные свойства, то есть амфотерные б) свойства карбоксильной группы (образование функциональных производных – реакции SN). в) свойства аминогруппы (ацилирование, алкилирование и др. ) г) специфические свойства, обусловленные взаимным влиянием функциональных групп друг на друга (декарбоксилирование, дезаминирование). 21

Амфотерность Все аминокислоты хорошо растворяются в воде, что важно для их биологической роли – хорошо всасываются, легко перемещаются по кровеносному руслу. В кристаллическом состоянии молекула α – аминокислоты существует в виде: изоэлектрическое состояние В водном растворе в зависимости от р. Н среды могут существовать катионная, анионная форма, цвиттер-ион или же их смесь. 22
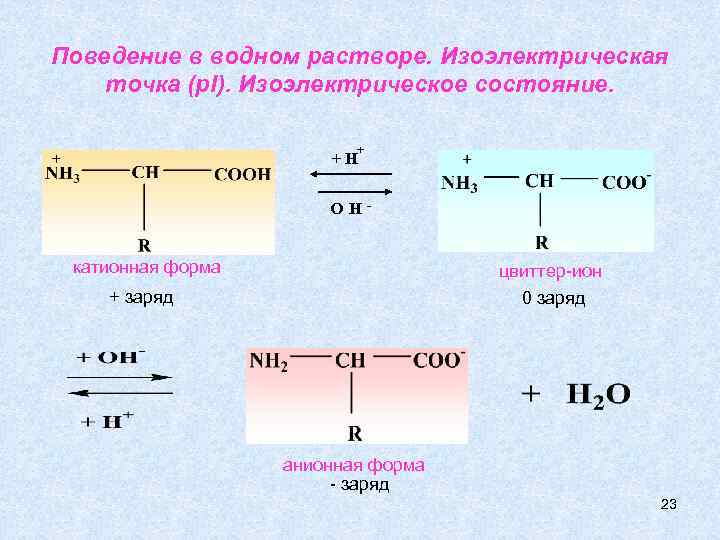
Поведение в водном растворе. Изоэлектрическая точка (p. I). Изоэлектрическое состояние. + +H OH- катионная форма цвиттер-ион + заряд 0 заряд анионная форма - заряд 23

катионная форма + заряд цвиттер-ион 0 заряд p. H p. I < < анионная форма - заряд p. H меняя р. Н, можно сместить равновесие в сторону существования одной из форм. Значение р. Н, при котором концентрация биполярных ионов максимальна, а катионных и анионных форм минимальна, называют изоэлектрической точкой (p. I). Состояние электронейтральности аминокислоты называют изоэлектрическим (суммарный заряд аминокислоты равен нулю. ) Для определения p. I используют формулу: p. I = p. Kk + p. Ko 2 24

Для большинства аминокислот слабокислой области. p. I лежит в Если в аминокислоте две карбоксильные группы, то p. I – в сильнокислой области: глутаминовая (3, 2), аспарагиновая (3, 0) Если в аминокислоте две аминогруппы, то p. I - в щелочной области: лизин (9, 8), аргинин (10, 8). 25

В изоэлектрической точке аминокислота обладает особыми свойствами: - минимальной электрофоретической подвижностью - минимальной растворимостью - максимальным осаждением 26

Практическое значение образования зарядов – смесь аминокислот при электрофорезе можно разделить на отдельные аминокислоты. in vivo ни одна аминокислота не находится в изоэлектрическом состоянии. 27

Диссоциация полярной отрицательно заряженной аминокислоты: + OH - H+ Асп p. H < цвиттер-ион p. I = 3, 0 p. I Катионная форма + OH - H+ p. H = 7 анионная форма p. H > 7 дианионная форма 28

Химические свойства аминокислот 29
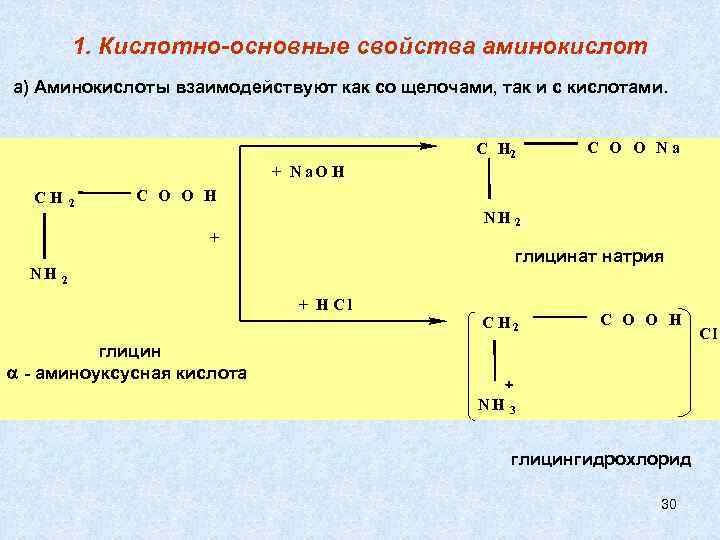
1. Кислотно-основные свойства аминокислот а) Аминокислоты взаимодействуют как со щелочами, так и с кислотами. C H 2 C O O Na + N a. O H CH 2 C O O H NH + NH 2 глицинат натрия 2 + HCl C H 2 C O O H глицин - аминоуксусная кислота NH 3 глицингидрохлорид 30 - Cl
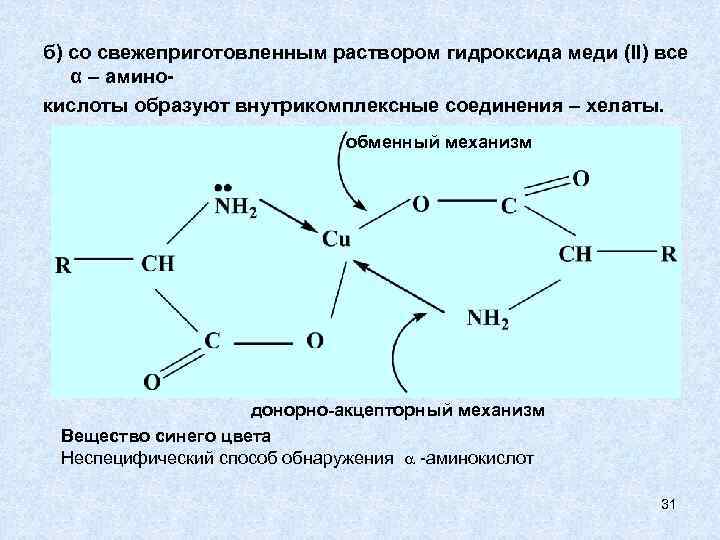
б) со свежеприготовленным раствором гидроксида меди (II) все α – аминокислоты образуют внутрикомплексные соединения – хелаты. обменный механизм донорно-акцепторный механизм Вещество синего цвета Неспецифический способ обнаружения -аминокислот 31

2. Реакции СООН - группы Все свойства карбоновых кислот – образование эфиров, галогенангидридов, хлорангидридов, амидов – характерны и для аминокислот. 1) Образование эфиров: C H 3 CH N H 2 2) C 2 H 5 OH , HC l сухой COOH - H 2 O аланин O C H 3 CH C O C 2 H 5 C l N H 3 O N H 3 - NH 4 Cl C H 3 CH C O C 2 H 5 N H 2 этиловый эфир аланина 32

2) N H 2 Образование хлорангидридов: CH C H 2 C 6 H 5 фенилаланин COOH + P Cl 5 N H 2 CH C O C l + POCl 3 + HCl C H 2 C 6 H 5 хлорангидрид фенилаланина 33

3) Образование амидов: O N H 2 C H NH 2 C O O H+ 2 N H 3 CH C N H 2 - NH 4 O H C H 2 O H серин C H 2 O H амид серина 34

4) Декарбоксилирование – образование биогенных аминов декарбоксилаза + пиридоксальфосфат серин коламин (идёт на синтез липидов) 35

3. Реакции NH 2 - группы 1) Образование N-ацильных производных – реакция используется при синтезе пептидов для защиты NH 2 – группы. RCH N H 2 COOH + R/CO Cl -HCl R CH NHCOR COOH / 36

2) Реакция карбоксилирования + - H S C H 2 C O OH C H + CO 2 цистеин (цис) N H 2 H S C H 2 H C O O H N C O O H карбоксицистеин 37

4. Биохимические превращения аминокислот α – аминокислоты и белки не запасаются организмами и должны поступать пищей. Поступая с пищей (экзогенный источник), они всасываются в пищеварительном тракте, переносятся кровью в печень и другие ткани и органы. Вторым источником α – аминокислот – эндогенным – служат тканевые белки организма. Они, подвергаясь метаболизму, освобождают входящие в них α – аминокислоты. 38

Аминокислоты делятся на заменимые и незаменимые. Незаменимые – это те, которые не могут синтезироваться в организме и должны поступать с пищей. Это валин (вал), лейцин (лей), изолейцин (иле), лизин (лиз), треонин (тре), метионин (мет), фенилаланин (фен), триптофан (три). 39

Большинство реакций превращения аминокислот протекает в печени. Для каждой аминокислоты существует индивидуальный способ обмена, но всё же существует ряд превращений, общий почти для всех аминокислот. 40

1) Декарбоксилирование – образование биогенных аминов ( лиз, цис, три, сер, асп) – метаболическое превращение аминокислот N H 2 CH COOH in vivo C O 2 + NH 2 C H 2 декарбоксилаза + CH 2 O H серин пиридоксальфосфат OH коламин (идёт на синтез липидов) 41

гистидин гистамин 42

Гистамин имеет отношение к аллергическим реакциям в организме. 43

Реакция декарбоксилирования необратима. После смерти происходит интенсивно декарбоксилирование лизина, образуется кадаверин in vitro эти реакции проводят при кипячении с Ca(OH)2 или Ba(OH)2, образуются те же продукты, что и в процессе метаболизма. Декарбоксилированию подвергаются все аминокислоты, под действием декарбоксилазы соответствующей аминокислоты. 44
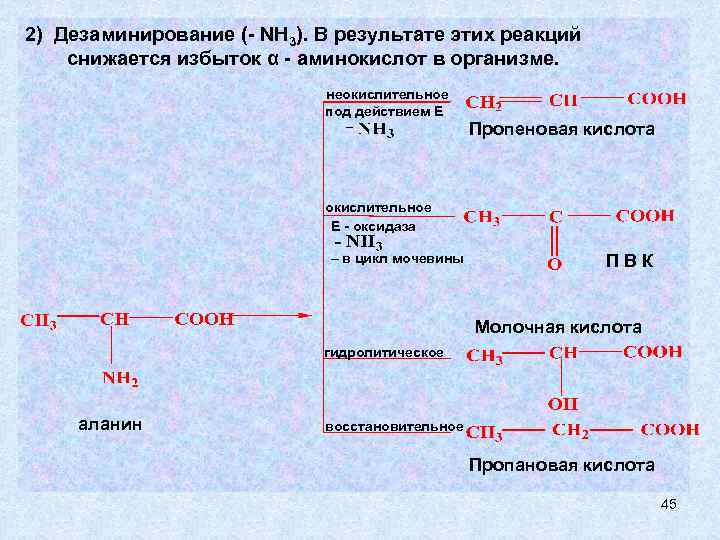
2) Дезаминирование (- NH 3). В результате этих реакций снижается избыток α - аминокислот в организме. неокислительное под действием Е Пропеновая кислота окислительное Е - оксидаза – в цикл мочевины ПВК Молочная кислота гидролитическое аланин восстановительное Пропановая кислота 45

Схема окислительного дезаминирования: В организме окислительное дезаминирование осуществляется с участием ферментов дегидрогеназ и кофермента НАД+ и НАДФ+ Вне организма реакция дезаминирования происходит под действием HNO 2 46

3) Трансаминирование (переаминирование) – основной путь биосинтеза заменимых α – аминокислот. Переаминирование сводится в химическом плане к взаимному обмену NH 2 – группы аминокислоты на группу кетокислоты, под действием ферментов трансаминаз и кофермента пиридоксальфосфата. Пиридоксальфосфат используется как камера хранения NH 2 – группы, где она временно находится при передаче её от α – аминокислоты к кетонокислоте. Процесс переаминирования является связующим звеном между метаболизмом белков (аминокислоты) и углеводов (кетонокислоты). С помощью этого процесса устраняется избыток отдельных α – аминокислот и таким образом регулируется содержание α – аминокислот в клетках. 47

Получение в организме L – глутаминовой кислоты из L – аспарагиновой: O O O H 2 N CH C С трансаминаза + пиридоксальфосфат C H 2 + C C OH С Н 2 OH C H 2 C O O OH - кетоглутаровая кислота II OH L – аспарагиновая кислота I O O С C OH C H 2 C O + OH щавелевоуксусная кислота I 48 L – глутаминовая кислота II
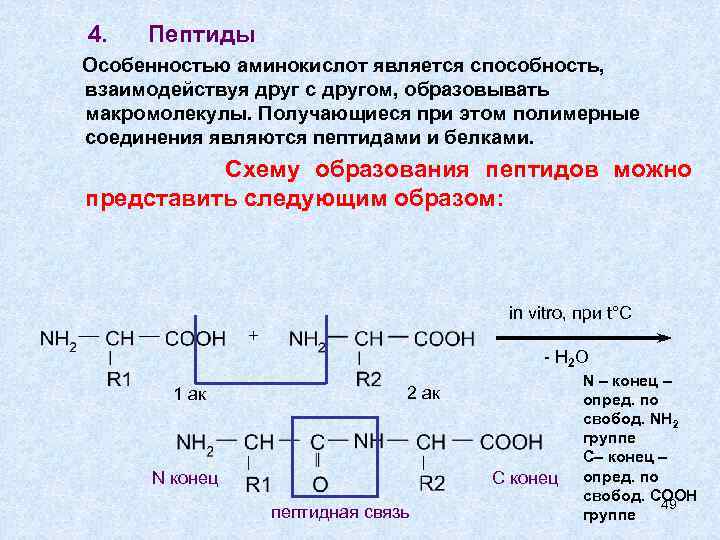
4. Пептиды Особенностью аминокислот является способность, взаимодействуя друг с другом, образовывать макромолекулы. Получающиеся при этом полимерные соединения являются пептидами и белками. Схему образования пептидов можно представить следующим образом: in vitro, при t°C + - H 2 O 1 ак 2 ак N конец С конец пептидная связь N – конец – опред. по свобод. NH 2 группе С– конец – опред. по свобод. COOH 49 группе

5. Аналитические реакции аминокислот (за счет NH 2 - группы) 1) c HNO 2 – количественное определение NH 2, выделение N 2, по объёму выделившегося N 2 судят о количестве NH 2 – групп – метод Ван. Слайка. лейцин (лей) 2 -гидрокси, 4 -метилпентановая кислота Если две аминогруппы, то азота выделяется больше! Продукт всегда α – гидроксикислота! 50

2) с - образование метилольного производного, или формольное титрование. (так как аминокислота – амфотерное соединение, титровать щёлочью неудобно, закрепляют в устойчивую NH 2 – группу, а затем титруют щёлочью). H 2 C H O N H 2 C тирозин + CH H O + - O C H O H H H O H 2 C N C H 2 OH CH C O N to H O H 2 C H 2 O CH C O O H N – метилольное производное карбиноламин C H 2 метилентирозин 51

Качественные реакции 1) с нингидрином – общая реакция для всех аминокислот – даёт синефиолетовое окрашивание (за исключением пролина) а) O C OH + C H 3 C H 2 C CH CH OH C нингидрин N H 2 O C H 3 C изолейцин 100 о O OH H C O 2 + NH 3 + H 3 C CH 2 CH C C H 3 O + 52

б) 53

2) качественная реакция на пептидные связи – биуретовая – образуется комплекс с Сu(OH)2 – фиолетового цвета. 54
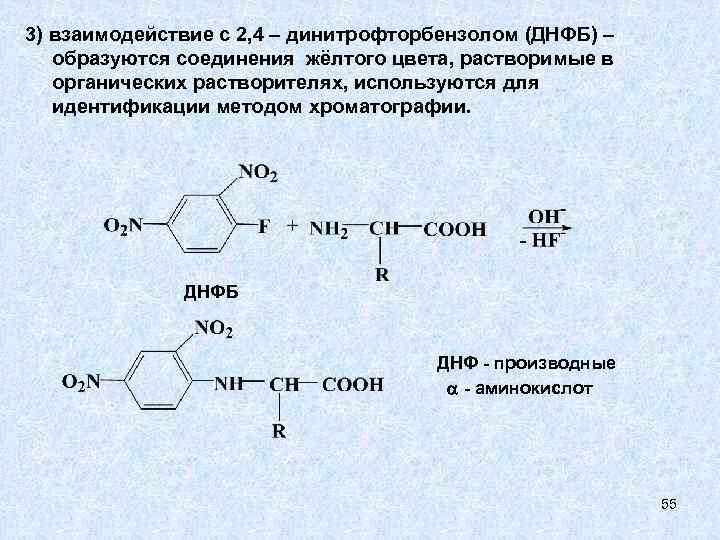
3) взаимодействие с 2, 4 – динитрофторбензолом (ДНФБ) – образуются соединения жёлтого цвета, растворимые в органических растворителях, используются для идентификации методом хроматографии. ДНФБ ДНФ - производные - аминокислот 55
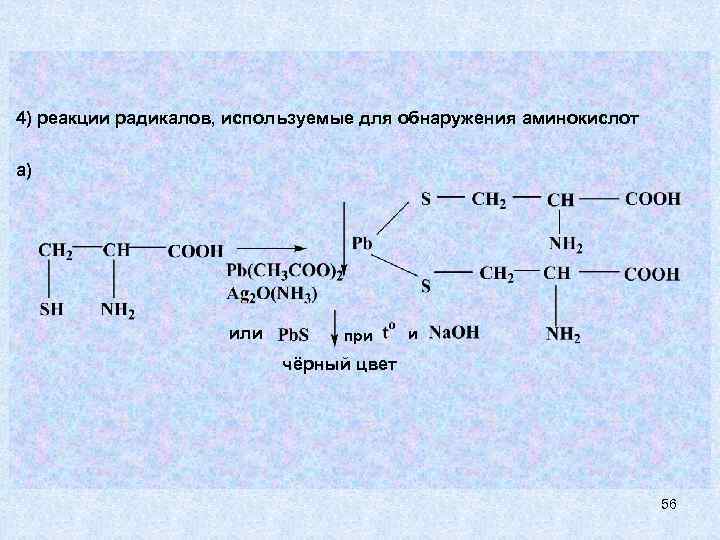
4) реакции радикалов, используемые для обнаружения аминокислот а) или при и чёрный цвет 56

б) ксантопротеиновая реакция для ароматических и гетероциклических аминокислот (фен, тир, гис, три) – окрашивание в жёлтый цвет (конц. ) тирозин (тир) 57

СПАСИБО ЗА ВНИМАНИЕ! 58

Лекция 9 Биополимеры 59
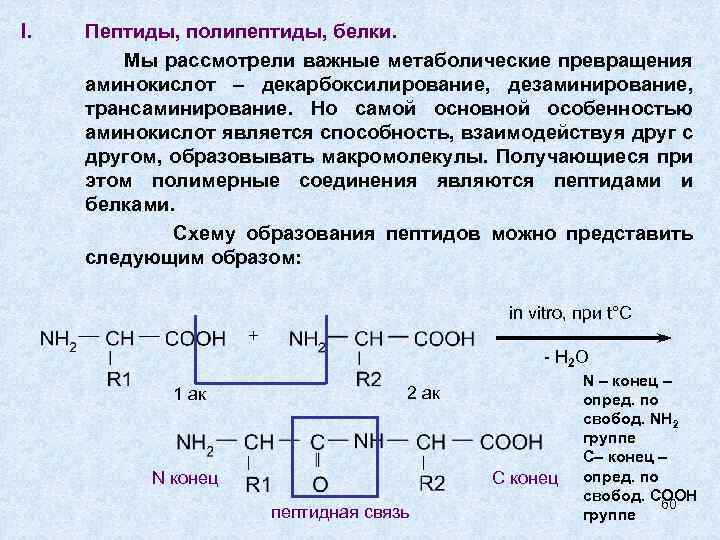
I. Пептиды, полипептиды, белки. Мы рассмотрели важные метаболические превращения аминокислот – декарбоксилирование, дезаминирование, трансаминирование. Но самой основной особенностью аминокислот является способность, взаимодействуя друг с другом, образовывать макромолекулы. Получающиеся при этом полимерные соединения являются пептидами и белками. Схему образования пептидов можно представить следующим образом: in vitro, при t°C + - H 2 O 1 ак 2 ак N конец С конец пептидная связь N – конец – опред. по свобод. NH 2 группе С– конец – опред. по свобод. COOH 60 группе
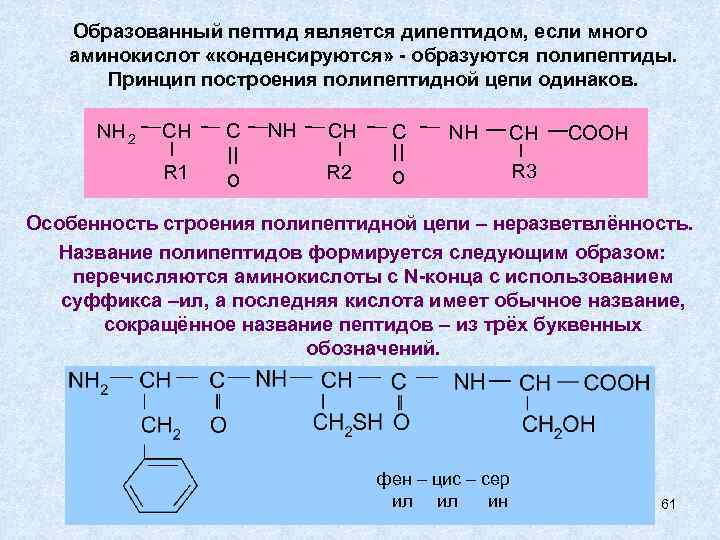
Образованный пептид является дипептидом, если много аминокислот «конденсируются» - образуются полипептиды. Принцип построения полипептидной цепи одинаков. NH 2 CH R 1 C II o NH CH R 2 C II o NH CH COOH R 3 Особенность строения полипептидной цепи – неразветвлённость. Название полипептидов формируется следующим образом: перечисляются аминокислоты с N-конца с использованием суффикса –ил, а последняя кислота имеет обычное название, сокращённое название пептидов – из трёх буквенных обозначений. фен – цис – сер ил ил ин 61
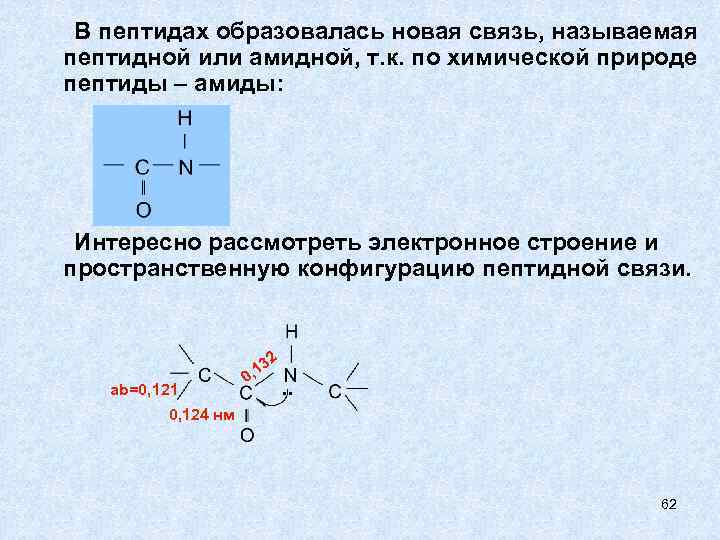
В пептидах образовалась новая связь, называемая пептидной или амидной, т. к. по химической природе пептиды – амиды: Интересно рассмотреть электронное строение и пространственную конфигурацию пептидной связи. 2 ab=0, 121 0 3 , 1 . . 0, 124 нм 62
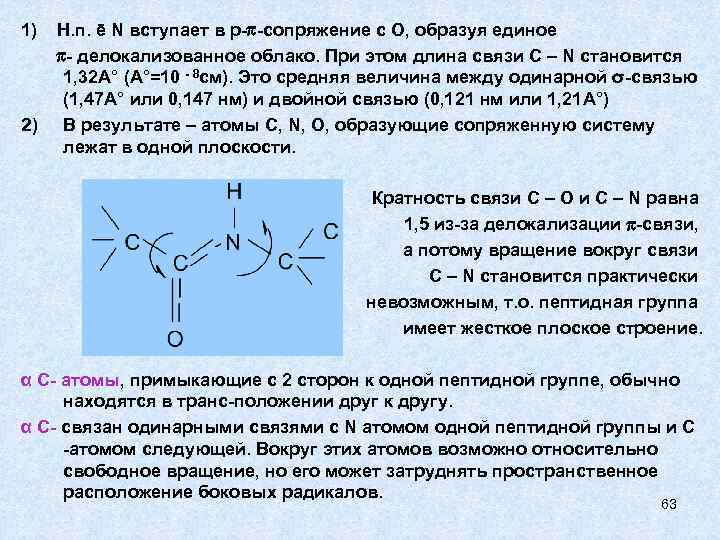
1) 2) Н. п. ē N вступает в р- -сопряжение с О, образуя единое - делокализованное облако. При этом длина связи C – N становится 1, 32 А° (А°=10 - 8 см). Это средняя величина между одинарной σ-связью (1, 47 А° или 0, 147 нм) и двойной связью (0, 121 нм или 1, 21 А°) В результате – атомы C, N, O, образующие сопряженную систему лежат в одной плоскости. Кратность связи C – O и C – N равна 1, 5 из-за делокализации -связи, а потому вращение вокруг связи C – N становится практически невозможным, т. о. пептидная группа имеет жесткое плоское строение. α С- атомы, примыкающие с 2 сторон к одной пептидной группе, обычно находятся в транс-положении друг к другу. α С- связан одинарными связями с N атомом одной пептидной группы и С -атомом следующей. Вокруг этих атомов возможно относительно свободное вращение, но его может затруднять пространственное расположение боковых радикалов. 63

В результате p- сопряжения ослабляется связь N-H и может происходить лактим-лактамная таутомерия. лактамная форма лактимная форма В лактимной форме пептидная связь малоактивна. В зависимости от числа ак-остатков различают: олигопептиды – мелкие пептиды (ди-, три-, тетра- до 10 ак) и полипептиды – до 100 ак 64

Прежде всего: пептиды играют важную роль в работе нервной системы человека. Недавние исследования показали, что они служат важным «средством общения» между собой нервных клеток наряду с давно известными медиаторами – дофамином, норадреналином, ацетилхолином. Многие современные исследования посвящены изучению пептидов, регулирующих состояния голода, боли, агрессии, страха. Многие из них работают в системе удовольствия, моделируя поведение нервных импульсов по тем нервным путям, которые создают чувство радости, веселья, обезболивания. К последним относятся т. н. оплоидные нейропептиды – энкефалины и эндорфины. Они образуются в мозге и оказывают на ЦНС действие, сходное с дейстивием морфина. Однако, к ним не возникает наркотического привыкания, о чем свидетельствует их физиологически управляемых синтез. Нейропептиды влияют на процессы обучения и 65 запоминания (вазопрессин), регулируют сон.

Примеры конкретных пептидов: 1) Трипептид – γ - глутатион (γ-глу –сци – гли) Присутствуют в Er человека, обеспечивают N – функции, без него человек может погибнуть 2) Вазопрессин – 9 ак. 3) Окситоцин 4) Инсулин – 51 ак – гормон поджелудочной железы, с недостатком инсулина связано нарушение УВ обмена и сахарный диабет, как его последствие. Впервые бычий инсулин был расшифрован Фредериком Сегером, за что в 1958 году ему была вручена Нобелевская премия. Расшифровка первичной структуры пептидов – мощный стимул для развития работ по их синтезу. 66

Каскадный синтез пептидов. Все операции - в определенной, запрограммированной последовательности. 1) Защита NH 2 группы I компонента 2) 3) 4) 5) Активация СООН-группы I компонента Защита СООН-группы II компонента NH 2 - COOH Синтез (SN) Снятие защиты 67

1) Защита NH 2 – группы I компонента С ацилирующим реагентом , (RCO)2 O, R - COOH 68

2) Защита СООН – группы II компонента Реакция этерификации сухой 69

3) Активация СООН – группы I компонента Образование галогенпроизводных! 70

4) Синтез 71

5) Снятие защиты Сложный процесс! 72

Структура белка Белковые молекулы – полимерные, неразветвлённые цепи из -аминокислот (> 100 аминокислот), структурные единицы – 20 аминокислот. 2 характеристики белка: 1) Аминокислотный состав – это природа и количественное соотношение входящих в белковую молекулу аминокислот. 2) Аминокислотная последовательность – порядок чередования аминокислот. 73

I Аминокислотная последовательность – первичная структура белка. II Вторичная структура описывается конформацией полипептидной цепи, она фиксируется водородными связями между пептидными группами. Наиболее выгодная конформация - -спираль (правозакрученная): цилиндр обвивает полипептидная цепь (степень спирализации от 5 до 80 %). Вторая структура – складчатый слой ( -структура): полипептидные цепи лежат антипараллельно или параллельно другу (водородные связи соединяют 2 различные цепи). 74

III Третичная структура – трёхмерная структура всей белковой молекулы в пространстве. Основные виды взаимодействия: - Взаимодействие боковых радикалов, которые при изгибе цепи сближаются - Водородные связи - Дисульфидные ковалентные связи и другие IV Четвертичная структура – при образовании единых белковых комплексов из нескольких полипептидных цепей. 75

СПАСИБО ЗА ВНИМАНИЕ! 76
2 Лекция. аминокислоты.пептиды. белки.ppt