Lek__9khim1.pptx
- Количество слайдов: 25
 ЛЕКЦИЯ № 9 ХИМИЧЕСКИЕ КОНЦЕПЦИИ ЕСТЕСТВОЗНАНИЯ План: 1. Химия как наука. Эволюция химических знаний. 2. Реакционная способность. 3. Химическое равновесие.
ЛЕКЦИЯ № 9 ХИМИЧЕСКИЕ КОНЦЕПЦИИ ЕСТЕСТВОЗНАНИЯ План: 1. Химия как наука. Эволюция химических знаний. 2. Реакционная способность. 3. Химическое равновесие.
 1. Химия как наука. Эволюция химических знаний. Химия – важнейший раздел естествознания. Она изучает превращение одних веществ в другие. Химическим превращением называют такое, когда в результате взаимодействия веществ меняется их химический состав и структура. Например, природный газ (СН 4) С 2 Н 2 СН 3 ОН
1. Химия как наука. Эволюция химических знаний. Химия – важнейший раздел естествознания. Она изучает превращение одних веществ в другие. Химическим превращением называют такое, когда в результате взаимодействия веществ меняется их химический состав и структура. Например, природный газ (СН 4) С 2 Н 2 СН 3 ОН
 Химические процессы лежат в основе жизнедеятельности всех живых организмов. Вещество – это вид материи, обладающий при определенных условиях постоянными физическими свойствами (плотность, Тпл, Ткип, теплоемкость…). Вещество состоит из одного или нескольких химических элементов. Химический элемент – совокупность атомов с одинаковым зарядом ядра.
Химические процессы лежат в основе жизнедеятельности всех живых организмов. Вещество – это вид материи, обладающий при определенных условиях постоянными физическими свойствами (плотность, Тпл, Ткип, теплоемкость…). Вещество состоит из одного или нескольких химических элементов. Химический элемент – совокупность атомов с одинаковым зарядом ядра.
 Химия, как и другие науки, возникла в процессе практической деятельности людей (выплавка металлов, производство красок, лекарств – патрохимия, обработка кожи…). Химия прошла следующие этапы развития: v. I этап (1 – 12 в. в) – зарождение химических знаний. v II этап (12 – 17 в. в. ) – алхимия. v III этап (17 – 19 в. в. ) становление химии как науки. v IV этап (с 20 в. по наст время)
Химия, как и другие науки, возникла в процессе практической деятельности людей (выплавка металлов, производство красок, лекарств – патрохимия, обработка кожи…). Химия прошла следующие этапы развития: v. I этап (1 – 12 в. в) – зарождение химических знаний. v II этап (12 – 17 в. в. ) – алхимия. v III этап (17 – 19 в. в. ) становление химии как науки. v IV этап (с 20 в. по наст время)
 Различают следующие уровни химических знаний: 1 уровень (1660 – 1800)– учение о составе вещества (Роберт Бойль). Суть: свойства вещества зависят от входящих в его состав химических элементов. 2 уровень (1800 – 1950) – развитие структурной химии (А. М. Бутлеров). 3 уровень (1950 – 1970) – учение о химических процессах. 4 уровень (с 1970 по наст. время) – развитие эволюционной химии. - науки о самоорганизации, саморазвитии хим. систем. Происходит биологизация химии. Главная задача освоение каталитического опыта живой природы.
Различают следующие уровни химических знаний: 1 уровень (1660 – 1800)– учение о составе вещества (Роберт Бойль). Суть: свойства вещества зависят от входящих в его состав химических элементов. 2 уровень (1800 – 1950) – развитие структурной химии (А. М. Бутлеров). 3 уровень (1950 – 1970) – учение о химических процессах. 4 уровень (с 1970 по наст. время) – развитие эволюционной химии. - науки о самоорганизации, саморазвитии хим. систем. Происходит биологизация химии. Главная задача освоение каталитического опыта живой природы.
 САМОСТОЯТЕЛЬ НО!!! по методичке: «Химические концепции естествознания»
САМОСТОЯТЕЛЬ НО!!! по методичке: «Химические концепции естествознания»
 2. Реакционная способность. Все вещества обладают способностью участвовать в хим. реакциях т. е. им присуща реакционная способность (РС). РС – характеристика хим. активности веществ, учитывающая как разнообразие реакций, возможных для данного вещества, так и их скорость. Например, благородные металлы (Au, Pt) и инертные газы (He, Ar, Xe) химически инертны т. е. у них низкая РС. Щелочные металлы(Li, Na, K) и галогены (F, Cl, Br) химически активны, т. е. обладают высокой РС.
2. Реакционная способность. Все вещества обладают способностью участвовать в хим. реакциях т. е. им присуща реакционная способность (РС). РС – характеристика хим. активности веществ, учитывающая как разнообразие реакций, возможных для данного вещества, так и их скорость. Например, благородные металлы (Au, Pt) и инертные газы (He, Ar, Xe) химически инертны т. е. у них низкая РС. Щелочные металлы(Li, Na, K) и галогены (F, Cl, Br) химически активны, т. е. обладают высокой РС.
 Современные представления о РС основаны на электронной теории валентности и на рассмотрении распределения электронной плотности молекулы (строения молекулы).
Современные представления о РС основаны на электронной теории валентности и на рассмотрении распределения электронной плотности молекулы (строения молекулы).

 Количественно РС выражают константами скорости реакций или константами равновесия в случае обратимых реакций. Наука, которая изучает скорости и особенности хим. превращений в зависимости от условий их проведения, называется химической кинетикой. С практической точки зрения большое значение имеет регуляция РС т. е. управление скоростью хим. реакции.
Количественно РС выражают константами скорости реакций или константами равновесия в случае обратимых реакций. Наука, которая изучает скорости и особенности хим. превращений в зависимости от условий их проведения, называется химической кинетикой. С практической точки зрения большое значение имеет регуляция РС т. е. управление скоростью хим. реакции.
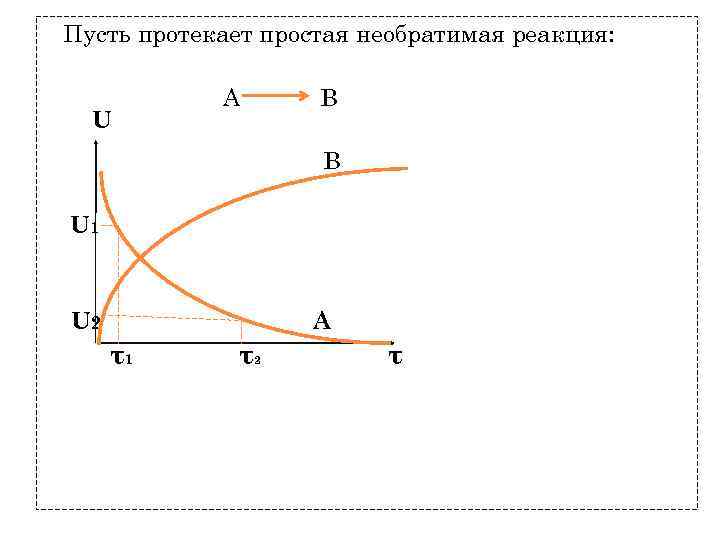 Пусть протекает простая необратимая реакция: U А В В U 1 U 2 А τ1 τ2 τ
Пусть протекает простая необратимая реакция: U А В В U 1 U 2 А τ1 τ2 τ
 Средняя скорость процесса определяется как изменение концентрации вещества, произошедшее за определенный промежуток времени:
Средняя скорость процесса определяется как изменение концентрации вещества, произошедшее за определенный промежуток времени:
 Закон действующих масс: «Скорость химической реакции пропорциональна концентрации реагирующих веществ» . Для необратимой реакции: a. A + b. B d. D
Закон действующих масс: «Скорость химической реакции пропорциональна концентрации реагирующих веществ» . Для необратимой реакции: a. A + b. B d. D
 - константа хим. реакции. Скорость хим реакции значительно возрастает с повышением температуры. При повышении t°C на 10°C скорость реакции увеличивается в 2 - 4 раза. Количественно влияние t°C на константу скорости реакции определяется уравнением Аррениуса:
- константа хим. реакции. Скорость хим реакции значительно возрастает с повышением температуры. При повышении t°C на 10°C скорость реакции увеличивается в 2 - 4 раза. Количественно влияние t°C на константу скорости реакции определяется уравнением Аррениуса:
 Здесь - константа для данной реакции. Е - энергия активации реагирующих веществ т. е. наименьшая энергия, которой должны обладать молекулы, чтобы произошла реакция. R - газовая постоянная. Т – температура. Величина зависит от природы реагирующих веществ, от t°C, но не зависит от концентрации веществ. Увеличить скорость реакции можно также уменьшением величины энергии активации Е. Это достигается применением катализаторов.
Здесь - константа для данной реакции. Е - энергия активации реагирующих веществ т. е. наименьшая энергия, которой должны обладать молекулы, чтобы произошла реакция. R - газовая постоянная. Т – температура. Величина зависит от природы реагирующих веществ, от t°C, но не зависит от концентрации веществ. Увеличить скорость реакции можно также уменьшением величины энергии активации Е. Это достигается применением катализаторов.
 Катализ – изменение скорости хим. реакций в результате действия какого – либо вещества или смеси веществ, количество которых практически не изменяется в ходе реакции. Эти вещества – катализаторы. На применении катализаторов основано около 90 % процессов хим. промышленности. Они позволяют проводить процессы при более низких t°, что снижает расход энергии. Механизм катализа можно представить сл. образом:
Катализ – изменение скорости хим. реакций в результате действия какого – либо вещества или смеси веществ, количество которых практически не изменяется в ходе реакции. Эти вещества – катализаторы. На применении катализаторов основано около 90 % процессов хим. промышленности. Они позволяют проводить процессы при более низких t°, что снижает расход энергии. Механизм катализа можно представить сл. образом:
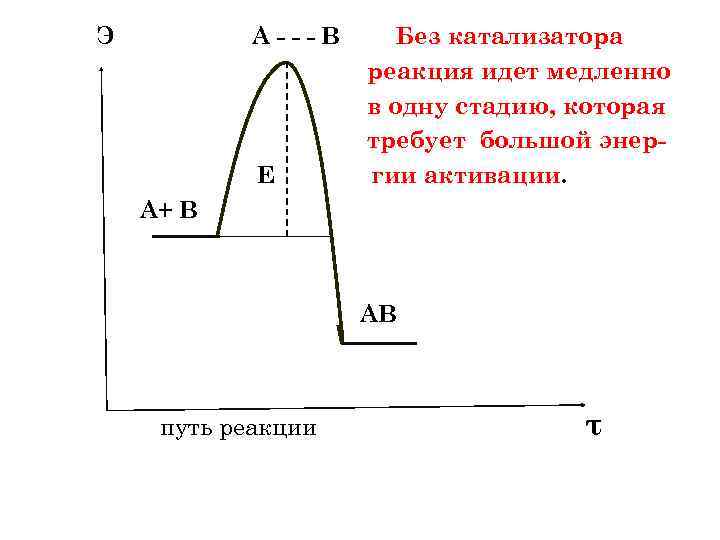 Э А---В Е Без катализатора реакция идет медленно в одну стадию, которая требует большой энергии активации. А+ В АВ путь реакции τ
Э А---В Е Без катализатора реакция идет медленно в одну стадию, которая требует большой энергии активации. А+ В АВ путь реакции τ
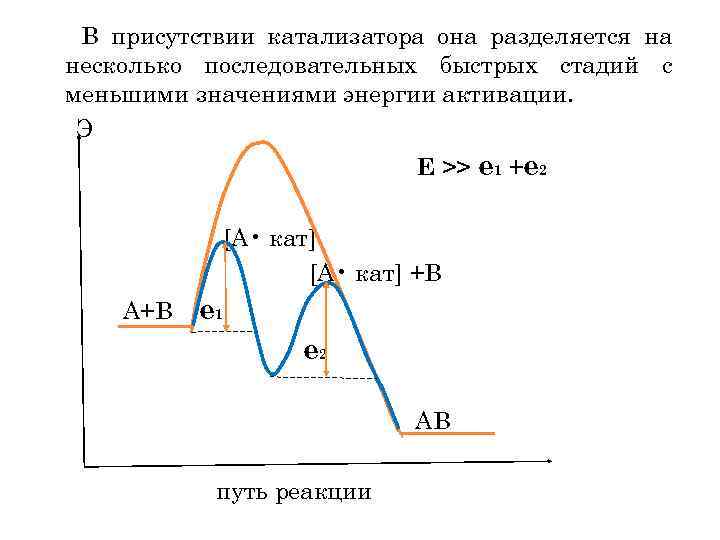 В присутствии катализатора она разделяется на несколько последовательных быстрых стадий с меньшими значениями энергии активации. Э Е >> е 1 +е 2 [А • кат] +В А+В е 1 е 2 АВ путь реакции
В присутствии катализатора она разделяется на несколько последовательных быстрых стадий с меньшими значениями энергии активации. Э Е >> е 1 +е 2 [А • кат] +В А+В е 1 е 2 АВ путь реакции
 Активность катализатора – мера его ускоряющего действия по отношению к данной реакции. Количественно она может определяться относительным увеличением. Чем активнее катализатор, тем при меньшей t° можно вести процесс, что несомненно выгодно. Для удлинения сроков службы катализаторов в промышленности проводят очистку реагентов от контактных ядов. Процессы, в которых катализаторами являются сами исходные вещества или продукты реакции называются автокаталитическими (горение, полимеризация, разложение взрывчатых в -в).
Активность катализатора – мера его ускоряющего действия по отношению к данной реакции. Количественно она может определяться относительным увеличением. Чем активнее катализатор, тем при меньшей t° можно вести процесс, что несомненно выгодно. Для удлинения сроков службы катализаторов в промышленности проводят очистку реагентов от контактных ядов. Процессы, в которых катализаторами являются сами исходные вещества или продукты реакции называются автокаталитическими (горение, полимеризация, разложение взрывчатых в -в).
 Вещества, повышающие активность катализаторов называются промоторами. Вещества, замедляющие реакции называются ингибиторами.
Вещества, повышающие активность катализаторов называются промоторами. Вещества, замедляющие реакции называются ингибиторами.
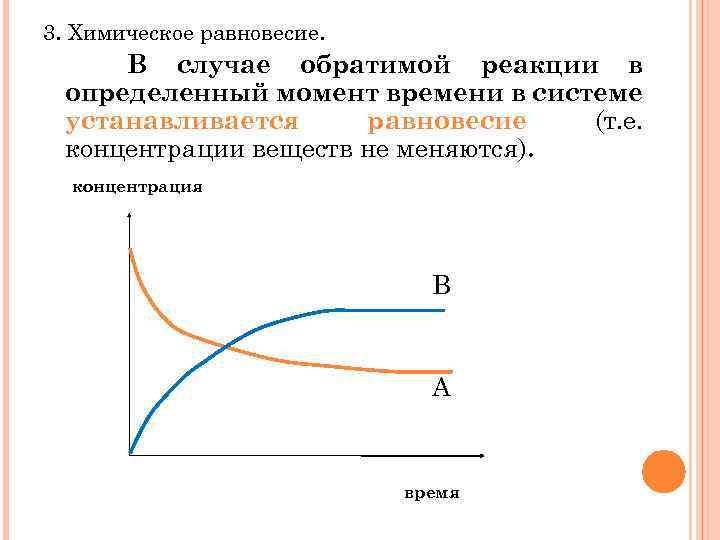 3. Химическое равновесие. В случае обратимой реакции в определенный момент времени в системе устанавливается равновесие (т. е. концентрации веществ не меняются). концентрация В А время
3. Химическое равновесие. В случае обратимой реакции в определенный момент времени в системе устанавливается равновесие (т. е. концентрации веществ не меняются). концентрация В А время
 Подвижное равновесие наступает тогда, когда скорость прямой и обратной реакции становятся равными. а. А + b. B d. D + e. E Скорость прямой реакции: Скорость обратной реакции: В момент равновесия:
Подвижное равновесие наступает тогда, когда скорость прямой и обратной реакции становятся равными. а. А + b. B d. D + e. E Скорость прямой реакции: Скорость обратной реакции: В момент равновесия:
 Константа равновесия: - величина постоянная, зависящая от t. По величине можно рассчитать состав продуктов реакции, а также равновесную степень превращения при различных параметрах процесса.
Константа равновесия: - величина постоянная, зависящая от t. По величине можно рассчитать состав продуктов реакции, а также равновесную степень превращения при различных параметрах процесса.
 Влияние технологических параметров на равновесие хим. реакций качественно определяется принципами Ле – Шателье: 1. Если обратимая реакция протекает с выделением тепла, то для сдвига равновесия слева направо необходимо отводить тепло. (1) И, наоборот, если реакция протекает с поглощением тепла, то для сдвига реакции в сторону образования продуктов следует подводить тепло.
Влияние технологических параметров на равновесие хим. реакций качественно определяется принципами Ле – Шателье: 1. Если обратимая реакция протекает с выделением тепла, то для сдвига равновесия слева направо необходимо отводить тепло. (1) И, наоборот, если реакция протекает с поглощением тепла, то для сдвига реакции в сторону образования продуктов следует подводить тепло.
 (2) 2) Если реакция протекает с уменьшением объема (1), то необходимо повышение давления для смещения равновесия вправо, если же с увеличением объема (2) – то его уменьшение. Если реакция идет без изменения объема, то давление не влияет на состояние равновесия. 3) Для увеличения степени превращения следует или увеличивать концентрацию взаимодействующих веществ, или снижать концентрацию получаемых продуктов.
(2) 2) Если реакция протекает с уменьшением объема (1), то необходимо повышение давления для смещения равновесия вправо, если же с увеличением объема (2) – то его уменьшение. Если реакция идет без изменения объема, то давление не влияет на состояние равновесия. 3) Для увеличения степени превращения следует или увеличивать концентрацию взаимодействующих веществ, или снижать концентрацию получаемых продуктов.


