lection_9_Yanukovich.ppt
- Количество слайдов: 26
 Лекция 9. Реальные жидкости и твердые тела 1. 2. 3. 4. 5. Поверхностное натяжение жидкости. Явление смачивания. Избыточное давление. Капиллярные явления. Кристаллическое строение твердых тел. Теплоемкость твердых тел. Закон Дюлонга Пти. 6. Фазовые переходы в веществе. Диаграмма состояний. 7. Жидкие кристаллы.
Лекция 9. Реальные жидкости и твердые тела 1. 2. 3. 4. 5. Поверхностное натяжение жидкости. Явление смачивания. Избыточное давление. Капиллярные явления. Кристаллическое строение твердых тел. Теплоемкость твердых тел. Закон Дюлонга Пти. 6. Фазовые переходы в веществе. Диаграмма состояний. 7. Жидкие кристаллы.
 1. Поверхностное натяжение жидкости • Жидкость является агрегатным промежуточным между газообразным и твердым состоянием вещества. • Для твердых тел наблюдается дальний порядок в расположении частиц, т. е. их упорядоченное расположение, повторяющееся на больших расстояниях. • В жидкостях имеет место ближний порядок в расположении частиц, т. е. их упорядоченное расположение на сравнимых с межатомными расстояниях.
1. Поверхностное натяжение жидкости • Жидкость является агрегатным промежуточным между газообразным и твердым состоянием вещества. • Для твердых тел наблюдается дальний порядок в расположении частиц, т. е. их упорядоченное расположение, повторяющееся на больших расстояниях. • В жидкостях имеет место ближний порядок в расположении частиц, т. е. их упорядоченное расположение на сравнимых с межатомными расстояниях.
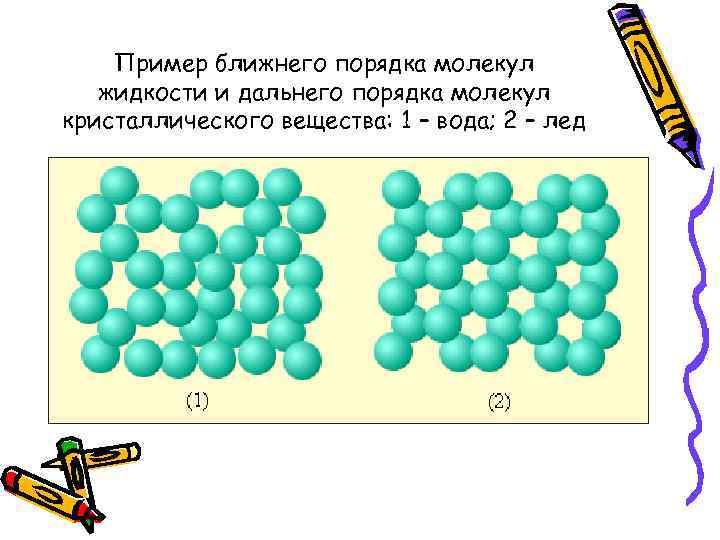 Пример ближнего порядка молекул жидкости и дальнего порядка молекул кристаллического вещества: 1 – вода; 2 – лед
Пример ближнего порядка молекул жидкости и дальнего порядка молекул кристаллического вещества: 1 – вода; 2 – лед
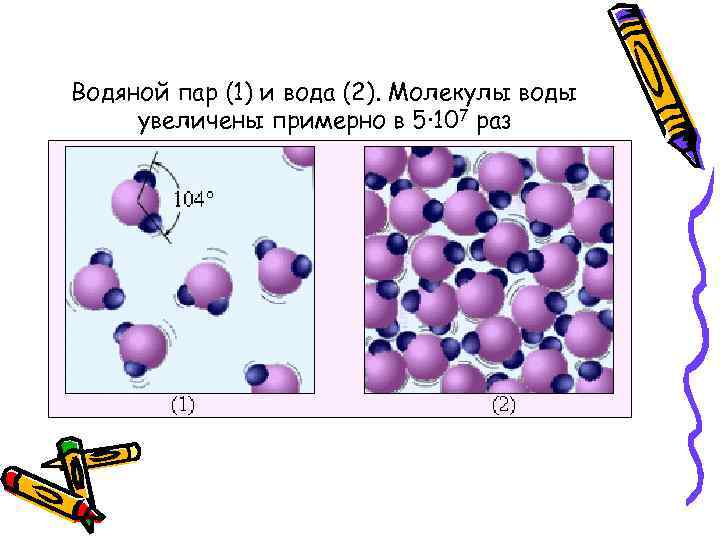 Водяной пар (1) и вода (2). Молекулы воды увеличены примерно в 5· 107 раз
Водяной пар (1) и вода (2). Молекулы воды увеличены примерно в 5· 107 раз
 • Суммарная энергия частиц складывается из энергии их теплового движения и потенциальной энергии, обусловленной силами межмолекулярного взаимодействия. • Для перемещения молекулы из глубины жидкости в поверхностный слой надо затратить работу • чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (т. е. увеличить площадь поверхности жидкости), внешние силы должны совершить положительную работу ΔAвнеш, пропорциональную изменению ΔS площади поверхности: ΔAвнеш = σΔS.
• Суммарная энергия частиц складывается из энергии их теплового движения и потенциальной энергии, обусловленной силами межмолекулярного взаимодействия. • Для перемещения молекулы из глубины жидкости в поверхностный слой надо затратить работу • чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (т. е. увеличить площадь поверхности жидкости), внешние силы должны совершить положительную работу ΔAвнеш, пропорциональную изменению ΔS площади поверхности: ΔAвнеш = σΔS.
 • Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу. • В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м 2) или в ньютонах на метр (1 Н/м = 1 Дж/м 2). • Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия Eр поверхности жидкости пропорциональна ее площади: Eр = Aвнеш = σS.
• Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу. • В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м 2) или в ньютонах на метр (1 Н/м = 1 Дж/м 2). • Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия Eр поверхности жидкости пропорциональна ее площади: Eр = Aвнеш = σS.
 • При отсутствии внешних сил жидкость стремится уменьшить поверхность, а минимальной поверхностью при заданном объеме является форма шара. • Условием устойчивого равновесия жидкости является минимум поверхностной энергии. • Поверхностное натяжение равно силе поверхностного натяжения , приходящегося на единицу длины контура, ограничивающего поверхность • σ=f/l • Вещества, ослабляющие поверхностное натяжение в жидкости, называются поверхностно активными. Например, мыло по отношению к воде (с 7, 5 10 -2 до 4, 5 10 -2 Н/м), спирты, эфиры, нефть.
• При отсутствии внешних сил жидкость стремится уменьшить поверхность, а минимальной поверхностью при заданном объеме является форма шара. • Условием устойчивого равновесия жидкости является минимум поверхностной энергии. • Поверхностное натяжение равно силе поверхностного натяжения , приходящегося на единицу длины контура, ограничивающего поверхность • σ=f/l • Вещества, ослабляющие поверхностное натяжение в жидкости, называются поверхностно активными. Например, мыло по отношению к воде (с 7, 5 10 -2 до 4, 5 10 -2 Н/м), спирты, эфиры, нефть.
 2. Явление смачивания. Избыточное давление
2. Явление смачивания. Избыточное давление
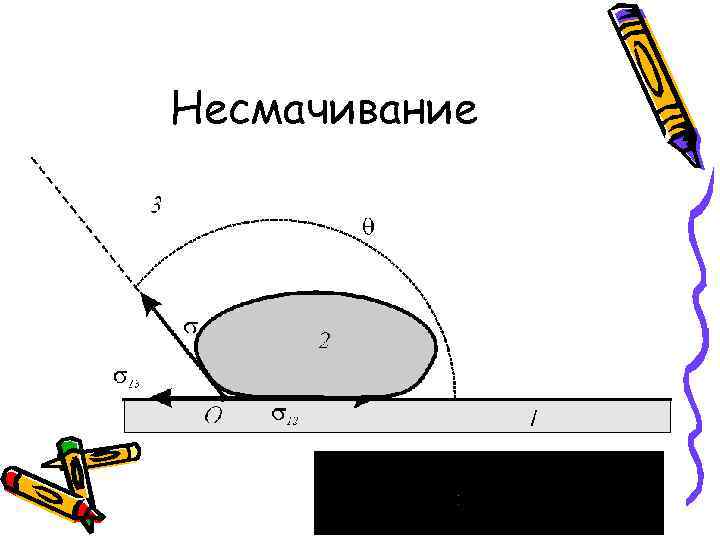 Несмачивание
Несмачивание
 Избыточное давление • Если поверхность жидкости не плоская, а искривленная, то она оказывает на жидкость избыточное давление. Это давление, обусловленное силами поверхностного натяжения, для выпуклой поверхности, положительно, а для вогнутой поверхности, отрицательно.
Избыточное давление • Если поверхность жидкости не плоская, а искривленная, то она оказывает на жидкость избыточное давление. Это давление, обусловленное силами поверхностного натяжения, для выпуклой поверхности, положительно, а для вогнутой поверхности, отрицательно.
 Сечение сферической капли жидкости
Сечение сферической капли жидкости
 Избыточное давление • Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости. • Для вогнутой сферической поверхности результирующая сила поверхностного натяжения направлена из жидкости
Избыточное давление • Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости. • Для вогнутой сферической поверхности результирующая сила поверхностного натяжения направлена из жидкости
 3. Капиллярные явления • Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. • Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести действующая на столб жидкости в капилляре, не станет равной по модулю результирующей Fн сил поверхностного натяжения, действующих вдоль границы соприкосновения жидкости с поверхностью капилляра: Fт = Fн,
3. Капиллярные явления • Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. • Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести действующая на столб жидкости в капилляре, не станет равной по модулю результирующей Fн сил поверхностного натяжения, действующих вдоль границы соприкосновения жидкости с поверхностью капилляра: Fт = Fн,
 Подъем смачивающей жидкости в капилляре
Подъем смачивающей жидкости в капилляре
 4. Кристаллическое строение твердых тел • Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия, и сохраняют объем и форму. • Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. • Точки, в которых расположены частицы или, точнее, средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки.
4. Кристаллическое строение твердых тел • Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия, и сохраняют объем и форму. • Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. • Точки, в которых расположены частицы или, точнее, средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки.
 Монокристаллы и поликристаллы • Монокристаллы – твердые тела, частицы которых образуют единую кристаллическую решетку. • Большинство твердых тел, имеющих мелкокристаллическую структуру, называются поликристаллами. • Характерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств – упругих, тепловых и т. д. от направления. Поликристаллы – изотропны. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов (зерен).
Монокристаллы и поликристаллы • Монокристаллы – твердые тела, частицы которых образуют единую кристаллическую решетку. • Большинство твердых тел, имеющих мелкокристаллическую структуру, называются поликристаллами. • Характерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств – упругих, тепловых и т. д. от направления. Поликристаллы – изотропны. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов (зерен).
 Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка
Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка
 Физический признак кристаллов. Ионные кристаллы • В ионных кристаллах в узлах кристаллической решетки находятся ионы противоположного знака. • Связь, обусловленная кулоновскими силами между противоположно заряженными ионами, ионная или гетерополярная.
Физический признак кристаллов. Ионные кристаллы • В ионных кристаллах в узлах кристаллической решетки находятся ионы противоположного знака. • Связь, обусловленная кулоновскими силами между противоположно заряженными ионами, ионная или гетерополярная.
 Атомные кристаллы • В атомных кристаллах в узлах кристаллической решетки расположены нейтральные атомы, удерживающиеся ковалентными связями квантово – механического происхождения.
Атомные кристаллы • В атомных кристаллах в узлах кристаллической решетки расположены нейтральные атомы, удерживающиеся ковалентными связями квантово – механического происхождения.
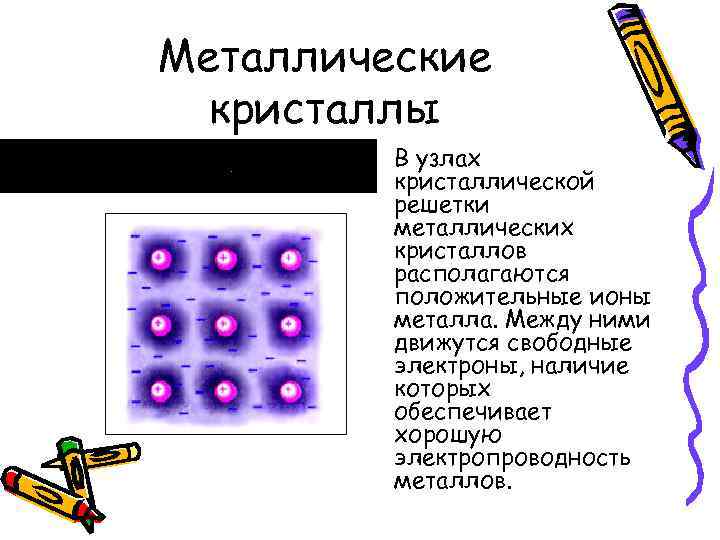 Металлические кристаллы • В узлах кристаллической решетки металлических кристаллов располагаются положительные ионы металла. Между ними движутся свободные электроны, наличие которых обеспечивает хорошую электропроводность металлов.
Металлические кристаллы • В узлах кристаллической решетки металлических кристаллов располагаются положительные ионы металла. Между ними движутся свободные электроны, наличие которых обеспечивает хорошую электропроводность металлов.
 Молекулярные кристаллы • В молекулярных кристаллах в узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены взаимным смещением электронов в электронных оболочках атомов. Молекулярными кристаллами является ряд соединений (парафин, спирт, лед).
Молекулярные кристаллы • В молекулярных кристаллах в узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены взаимным смещением электронов в электронных оболочках атомов. Молекулярными кристаллами является ряд соединений (парафин, спирт, лед).
 5. Теплоемкость твердых тел. Закон Дюлонга – Пти • Пусть в качестве модели твердого тела используется правильно построенная кристаллическая решетка, в узлах которой колеблются около своих положений равновесия материальные точки. • У каждой частицы три колебательных степени свободы. • Согласно закону распределения энергии по степеням свободы, каждая из них обладает энергией k. T
5. Теплоемкость твердых тел. Закон Дюлонга – Пти • Пусть в качестве модели твердого тела используется правильно построенная кристаллическая решетка, в узлах которой колеблются около своих положений равновесия материальные точки. • У каждой частицы три колебательных степени свободы. • Согласно закону распределения энергии по степеням свободы, каждая из них обладает энергией k. T
 Закон Дюлонга - Пти • Внутренняя энергия моля твердого тела • Дж/(моль К). Молярная теплоемкость химически простых тел в кристаллическом состоянии одинакова и не зависит от температуры
Закон Дюлонга - Пти • Внутренняя энергия моля твердого тела • Дж/(моль К). Молярная теплоемкость химически простых тел в кристаллическом состоянии одинакова и не зависит от температуры
 6. Фазовые переходы в веществе. Диаграмма состояний • Фазой называется термодинамически равновесное состояние вещества, отличающееся от других возможных равновесных состояний того же вещества, по физическим свойствам. • Переход вещества из одной фазы в другую, фазовый переход, связан с качественным изменением свойств вещества. • Фазовый переход первого рода сопровождается поглощением или выделением теплоты (например: плавление, кристаллизация).
6. Фазовые переходы в веществе. Диаграмма состояний • Фазой называется термодинамически равновесное состояние вещества, отличающееся от других возможных равновесных состояний того же вещества, по физическим свойствам. • Переход вещества из одной фазы в другую, фазовый переход, связан с качественным изменением свойств вещества. • Фазовый переход первого рода сопровождается поглощением или выделением теплоты (например: плавление, кристаллизация).
 • Фазовые переходы второго рода не связаны с выделением, поглощением теплоты или изменением объема.
• Фазовые переходы второго рода не связаны с выделением, поглощением теплоты или изменением объема.
 Фазовая диаграмма
Фазовая диаграмма


