Лекция 1.9.pptx
- Количество слайдов: 13
 Лекция № 9 Первое начало термодинамики и его применение к процессам в идеальном газе. План лекции. 9. 1. Теплообмен. Количество теплоты. Уравнение теплового баланса. Первое начало термодинамики. 9. 2. Работа газа при изотермическом расширении и сжатии. Работа газа за цикл. Количество теплоты, поглощаемое газом в циклическом процессе. 9. 3. Применение первого начала термодинамики к процессам в идеальном газе: вы– числение для изотермического, изохорического и изобарического процес – сов. 9. 4. Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и. Уравнение Майера. Физический смысл универсальной газовой постоянной. 9. 5. Адиабатический процесс. Уравнение Пуассона. 1
Лекция № 9 Первое начало термодинамики и его применение к процессам в идеальном газе. План лекции. 9. 1. Теплообмен. Количество теплоты. Уравнение теплового баланса. Первое начало термодинамики. 9. 2. Работа газа при изотермическом расширении и сжатии. Работа газа за цикл. Количество теплоты, поглощаемое газом в циклическом процессе. 9. 3. Применение первого начала термодинамики к процессам в идеальном газе: вы– числение для изотермического, изохорического и изобарического процес – сов. 9. 4. Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и. Уравнение Майера. Физический смысл универсальной газовой постоянной. 9. 5. Адиабатический процесс. Уравнение Пуассона. 1
 9. 1. Теплообмен. Количество теплоты. Уравнение теплового баланса. Первое начало термодинамики. Теплообмен – обмен теплом – осуществляется тремя способами: теплопроводность, конвекция, излучение. Обмен теплом – форма энергообмена: одно тело может передавать энергию другому телу в виде тепла. Количество теплоты – мера энергообмена. Количество теплоты , полученное телом, – алгебраическая величина: – тело получает энергию в виде тепла; – тело отдает энергию в виде тепла; – тело ни получает ни отдает энергии в виде тепла. Количество теплоты , отданное телом, – алгебраическая величина: – тело получает энергию в виде тепла; – тело отдает энергию в виде тепла; – тело ни получает ни отдает энергии в виде тепла. Уравнение теплового баланса: 2
9. 1. Теплообмен. Количество теплоты. Уравнение теплового баланса. Первое начало термодинамики. Теплообмен – обмен теплом – осуществляется тремя способами: теплопроводность, конвекция, излучение. Обмен теплом – форма энергообмена: одно тело может передавать энергию другому телу в виде тепла. Количество теплоты – мера энергообмена. Количество теплоты , полученное телом, – алгебраическая величина: – тело получает энергию в виде тепла; – тело отдает энергию в виде тепла; – тело ни получает ни отдает энергии в виде тепла. Количество теплоты , отданное телом, – алгебраическая величина: – тело получает энергию в виде тепла; – тело отдает энергию в виде тепла; – тело ни получает ни отдает энергии в виде тепла. Уравнение теплового баланса: 2
 Теплообмен. Количество теплоты. Уравнение теплового баланса. Первое начало термодинамики. – количество теплоты, полученное телом за некоторый промежуток времени – работа, совершенная телом (над внешними телами) за тот же , – изменение внутренней энергии тела за тот же. , Первое начало термодинамики – закон сохранения энергии для механических и тепловых процессов : В дифференциальной форме: – бесконечно малые величины. Внутренняя энергии тела – функция состояния макроскопической системы: Изменение внутренней энергии тела не зависит от процесса и определяется начальным и конечным состояниями макроскопической системы: – полный дифференциал, – нет. 3
Теплообмен. Количество теплоты. Уравнение теплового баланса. Первое начало термодинамики. – количество теплоты, полученное телом за некоторый промежуток времени – работа, совершенная телом (над внешними телами) за тот же , – изменение внутренней энергии тела за тот же. , Первое начало термодинамики – закон сохранения энергии для механических и тепловых процессов : В дифференциальной форме: – бесконечно малые величины. Внутренняя энергии тела – функция состояния макроскопической системы: Изменение внутренней энергии тела не зависит от процесса и определяется начальным и конечным состояниями макроскопической системы: – полный дифференциал, – нет. 3
 9. 2. Работа газа при изотермическом расширении и сжатии. Работа газа за цикл. Количество теплоты, поглощаемое газом в циклическом процессе. Изобарическое расширение или сжатие: Общий случай – : Работа газа при конечном изменении объема: Изотермический процесс: 4
9. 2. Работа газа при изотермическом расширении и сжатии. Работа газа за цикл. Количество теплоты, поглощаемое газом в циклическом процессе. Изобарическое расширение или сжатие: Общий случай – : Работа газа при конечном изменении объема: Изотермический процесс: 4
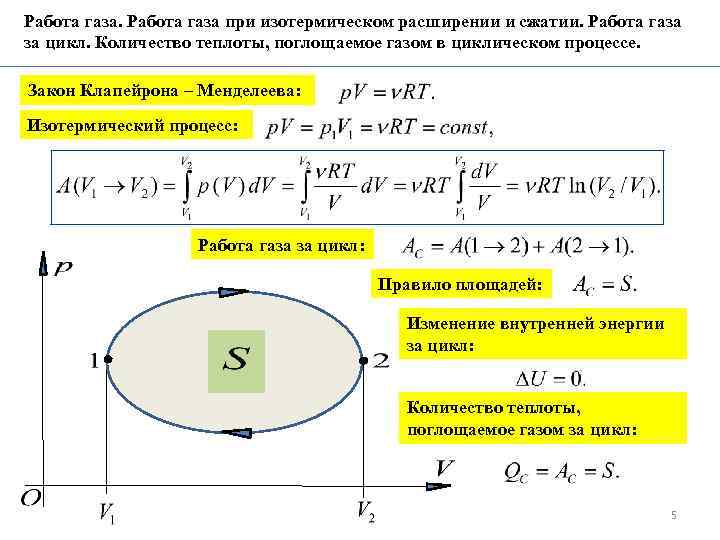 Работа газа при изотермическом расширении и сжатии. Работа газа за цикл. Количество теплоты, поглощаемое газом в циклическом процессе. Закон Клапейрона – Менделеева: Изотермический процесс: Работа газа за цикл: Правило площадей: Изменение внутренней энергии за цикл: Количество теплоты, поглощаемое газом за цикл: 5
Работа газа при изотермическом расширении и сжатии. Работа газа за цикл. Количество теплоты, поглощаемое газом в циклическом процессе. Закон Клапейрона – Менделеева: Изотермический процесс: Работа газа за цикл: Правило площадей: Изменение внутренней энергии за цикл: Количество теплоты, поглощаемое газом за цикл: 5
 9. 3. Применение первого начала термодинамики к процессам в идеальном газе: вычисление для изотермического, изохорического и изобарического процессов. Изотермический процесс: Изохорический процесс: Изобарический процесс: 6
9. 3. Применение первого начала термодинамики к процессам в идеальном газе: вычисление для изотермического, изохорического и изобарического процессов. Изотермический процесс: Изохорический процесс: Изобарический процесс: 6
 Применение первого начала термодинамики к процессам в идеальном газе: вы– числение для изотермического, изохорического и изобарического процессов. Изотермический процесс: Изохорический процесс: Изобарический процесс: 7
Применение первого начала термодинамики к процессам в идеальном газе: вы– числение для изотермического, изохорического и изобарического процессов. Изотермический процесс: Изохорический процесс: Изобарический процесс: 7
 9. 4. Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и Уравнение Майера. Физический смысл универсальной газовой постоянной . . Теплоемкость тела: Удельная теплоемкость вещества: Молярная теплоемкость вещества: Связь между удельной и молярной теплоемкостями вещества: Единицы измерения: Дж / К; Дж / (кг. К); Дж / (моль. К). 8
9. 4. Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и Уравнение Майера. Физический смысл универсальной газовой постоянной . . Теплоемкость тела: Удельная теплоемкость вещества: Молярная теплоемкость вещества: Связь между удельной и молярной теплоемкостями вещества: Единицы измерения: Дж / К; Дж / (кг. К); Дж / (моль. К). 8
 Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и. Уравнение Майера. Физический смысл универсальной газовой постоянной. – не зависит от процесса; – зависит от процесса; Теплоемкость газа C – зависит от процесса. Причина – большая сжимаемость газа В общем случае при совершении газом процесса теплоемкость газа непрерыв – но изменяется от состояния к состоянию. Существуют процессы, при которых теплоемкость газа остается постоянной. Эти процессы называются политропическими. Примеры – изохорический и изобарический процессы. Изохорический процесс: 9
Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и. Уравнение Майера. Физический смысл универсальной газовой постоянной. – не зависит от процесса; – зависит от процесса; Теплоемкость газа C – зависит от процесса. Причина – большая сжимаемость газа В общем случае при совершении газом процесса теплоемкость газа непрерыв – но изменяется от состояния к состоянию. Существуют процессы, при которых теплоемкость газа остается постоянной. Эти процессы называются политропическими. Примеры – изохорический и изобарический процессы. Изохорический процесс: 9
 Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и. Уравнение Майера. Физический смысл универсальной газовой постоянной. Изохорический процесс: Изобарический процесс: 10
Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и. Уравнение Майера. Физический смысл универсальной газовой постоянной. Изохорический процесс: Изобарический процесс: 10
 Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и. Уравнение Майера. Физический смысл универсальной газовой постоянной. Молярные теплоемкости вещества: Уравнение Майера: Физический смысл универсальной газовой постоянной : помимо уравнения Майера, для определения физсмысла можно использовать след. уравнения: Показатель адиабаты: 11
Теплоемкость тела, удельная и молярная теплоемкости вещества. Теплоемкость газа и ее зависимость от процесса. Теплоемкости газа и. Уравнение Майера. Физический смысл универсальной газовой постоянной. Молярные теплоемкости вещества: Уравнение Майера: Физический смысл универсальной газовой постоянной : помимо уравнения Майера, для определения физсмысла можно использовать след. уравнения: Показатель адиабаты: 11
 9. 5. Адиабатический процесс. Уравнение Пуассона. Адиабатический процесс: Уравнение процесса (в дифференциальной форме): Уравнение Пуассона (уравнение адиабатического процесса в переменных Уравнение адиабатического процесса в переменных ): 12
9. 5. Адиабатический процесс. Уравнение Пуассона. Адиабатический процесс: Уравнение процесса (в дифференциальной форме): Уравнение Пуассона (уравнение адиабатического процесса в переменных Уравнение адиабатического процесса в переменных ): 12
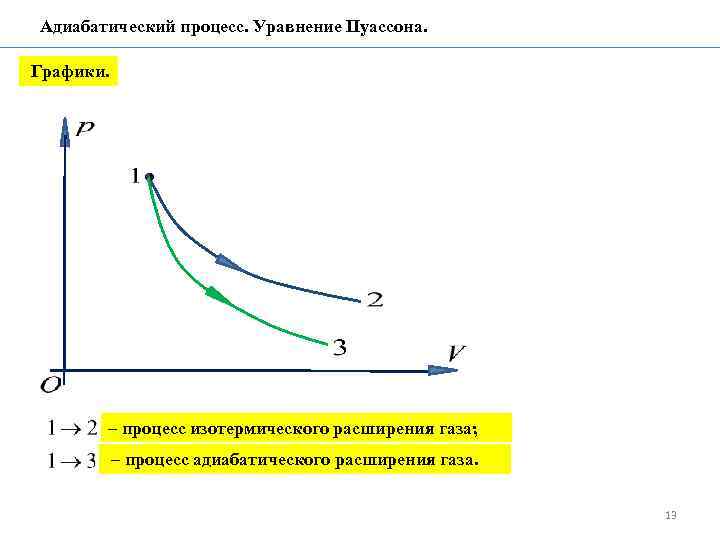 Адиабатический процесс. Уравнение Пуассона. Графики. – процесс изотермического расширения газа; – процесс адиабатического расширения газа. 13
Адиабатический процесс. Уравнение Пуассона. Графики. – процесс изотермического расширения газа; – процесс адиабатического расширения газа. 13


