бх. лекция. Обмен белков и аминокислот..ppt
- Количество слайдов: 102

Лекция № 9 n ТЕМА: Обмен белков и аминокислот. Промежуточный обмен простых белков

ЦЕЛЬ: n Ознакомить студентов с основными представлениями обмена белков и аминокислот. n Охарактеризовать промежуточный обмен простых белков

ПЛАН ЛЕКЦИИ n n n 1. Белки пищи и их значение, понятие об азотистом балансе. 2. Переваривание белков в ЖКТ и всасывание аминокислот. 3. Промежуточный обмен простых белков. Образование и использование креатина. 4. Декарбоксилирование аминокислот и роль биогенных аминов. 5. Пути образования аммиака. 6. Пути обезвреживания аммиака. 7. Конечные продукты обмена простых белков. Выделение.

n белки в организме не откладываются про запас, n исключением является аварийный запас белков плазмы крови, находящийся в печени;
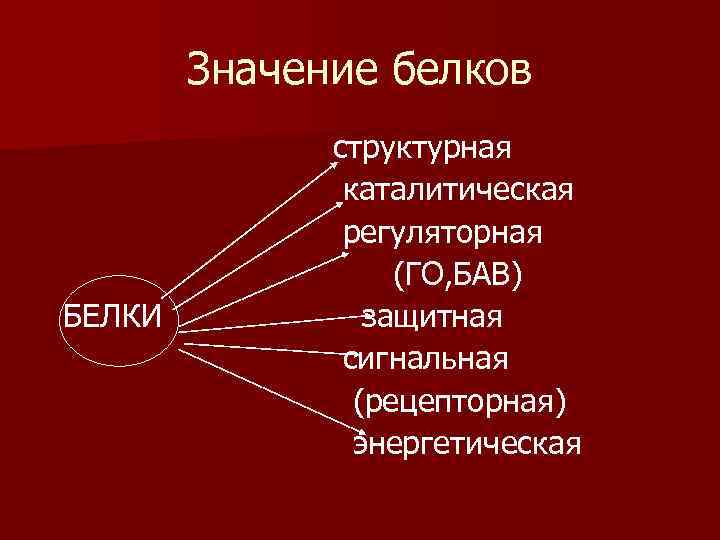
Значение белков БЕЛКИ структурная каталитическая регуляторная (ГО, БАВ) защитная сигнальная (рецепторная) энергетическая

Потребность в белке n n зависит от возраста: для здорового человека с пищей должно вводиться 0, 8 г белка на кг веса в день; для новорожденных — 2, 0 г; для пятилетних детей — 1, 0 г.

Потребность в белке зависит и от энергозатрат. n При затрате 10500 к. Дж (умственный труд, механизированный труд) требуется 106— 120 г белков. n При увеличении энергозатрат на каждые 2100 к. Дж следует добавлять 10 г белка. n

Избыточное потребление белка ведет к повышенному дезамининированию и усилению метаболизма аминокислот с предоставлением энергии и ацетил-Ко. А для синтеза жиров. n За сутки в организме за счет повторного использования аминокислот синтезируется примерно 500 г белка, т. е. в 5 раз больше потребляемого с пищей. n Недостаточное введение белка и тем более исключение белков из пищи ведет к необратимым патологическим явлениям. n

Азотистый баланс n Для того, чтобы судить о достаточности поступления белков с пищей введено понятие азотистого баланса – это соотношение поступающего азота белков и азота, выделяемого из организма.
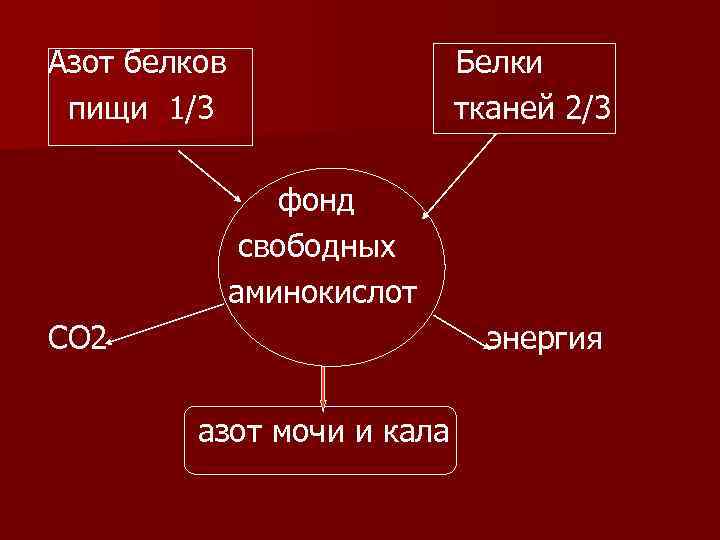
Азот белков пищи 1/3 Белки тканей 2/3 фонд свободных аминокислот СО 2 энергия азот мочи и кала

положительный азотистый баланс n такое состояние, когда потребление белков превышает их экскрецию. n Это наблюдается в ситуациях, когда наблюдается рост тканей, например у детей, у женщин во время беременности, у больных в период выздоровления, и свидетельствует о достаточном поступлении белка.

отрицательный азотистый баланс. n Если азота пищи меньше азота мочи, говорят об отрицательном азотистом балансе. n При недостаточном поступлении белков с пищей наблюдается квашиоркор (у детей) n и алиментарный маразм у взрослых

Азотистое равновесие n. У здорового взрослого человека вне состояний, отмеченных выше, отмечается нулевой азотистый баланс.
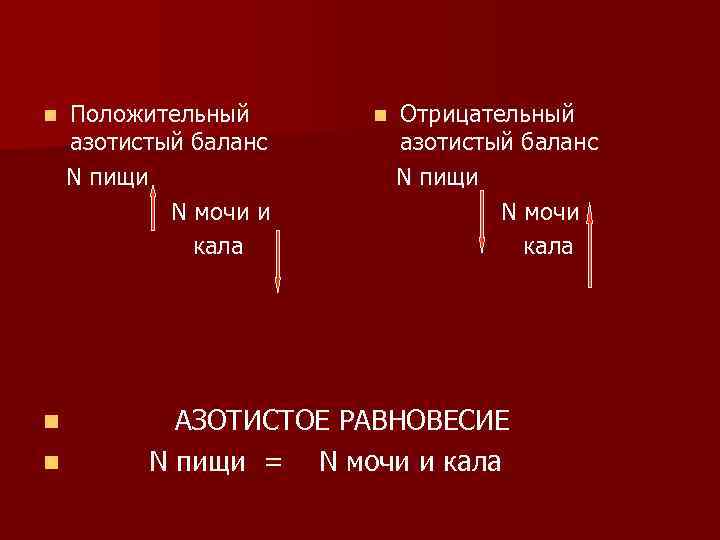
n n n Положительный азотистый баланс Ν пищи Ν мочи и кала n Отрицательный азотистый баланс Ν пищи Ν мочи кала АЗОТИСТОЕ РАВНОВЕСИЕ Ν пищи = Ν мочи и кала

Переваривание белков n. В ротовой полости происходит механическое измельчение пищи.

В желудке n пищевой комок подвергается действию соляной кислоты, при этом он набухает и увеличивается поверхность для действия пептидгидролаз желудка пепсина и гастриксина.
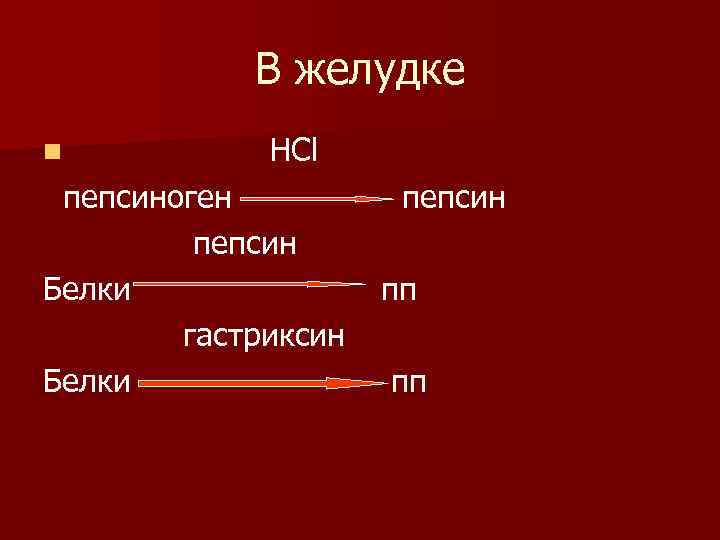
В желудке n НСl пепсиноген пепсин Белки гастриксин Белки пепсин пп пп
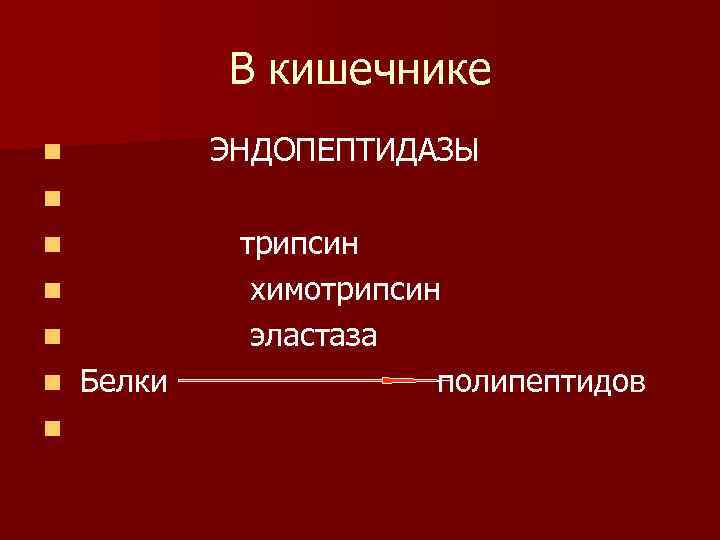
В кишечнике ЭНДОПЕПТИДАЗЫ n n n n Белки трипсин химотрипсин эластаза полипептидов

экзопептидазы карбоксипептидаза аминопептидаза трипептидаза дипептидаза n n n ПП АК

n. В результате переваривания белков в просвете тонкого кишечника образуется смесь аминокислот, которые начинают всасываться.

Всасывание аминокислот n Аминокислоты всасываются с различной скоростью. n Известно 5 транспортных систем, которые переносят различные группы аминокислот.

n Существует пять транспортных систем, переносящих аминокислоты из просвета в клетки кишечника: n 1) для нейтральных аминокислот; n 2) для кислых аминокислот; n 3) для основных аминокислот; n 4) для циклических аминокислот; n 5) для цистеина, орнитина, аргинина, лизина.
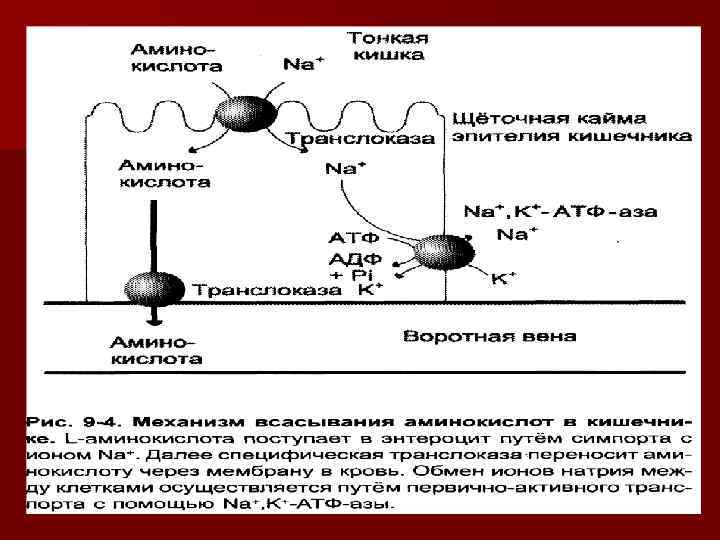

n Аминокислоты могут всасываться активно (натрий-зависимый транспорт) и пассивно (натрий-независимый транспорт). n Активно всасываются нейтральные аминокислоты, фен, мет, про, оксипро. n Пассивно всасываются лей, фен, полярные аминокислоты (лиз, арг, асп, глу). n

Гниение белков в кишечнике n Часть аминокислот, не успевших всосаться, поступают в толстый кишечник, где подвергаются процессу, который называется – гниение белков n Гниение белков – это распад аминокислот под влиянием ферментов микроорганизмов
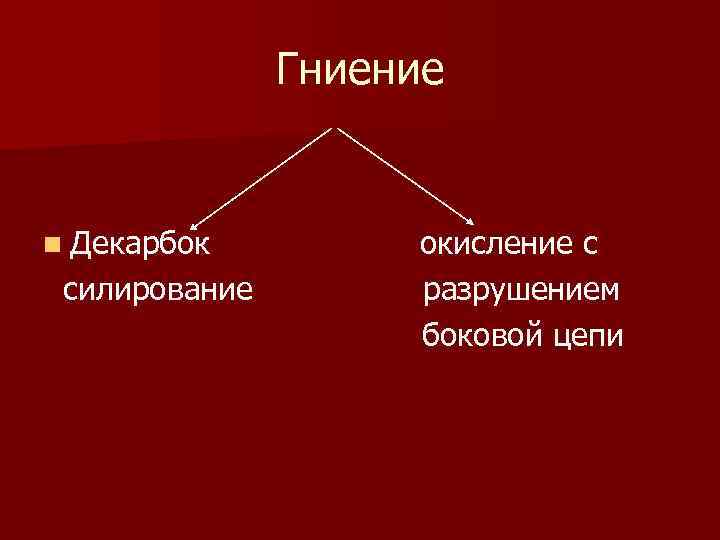
Гниение n Декарбок силирование окисление с разрушением боковой цепи
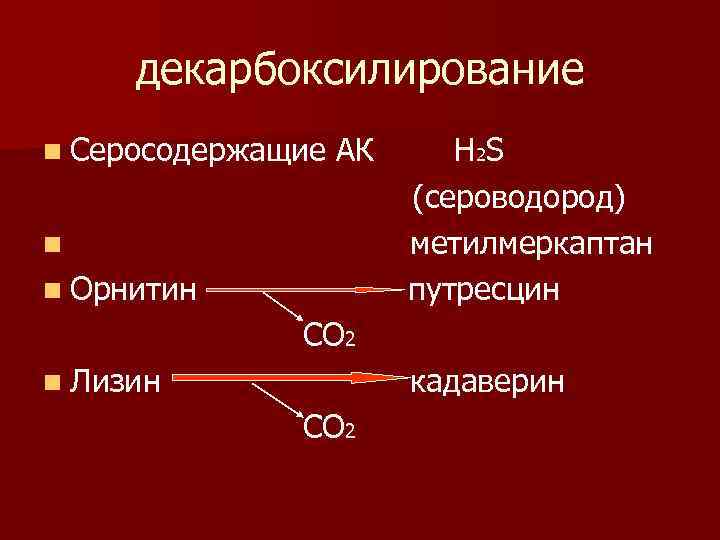
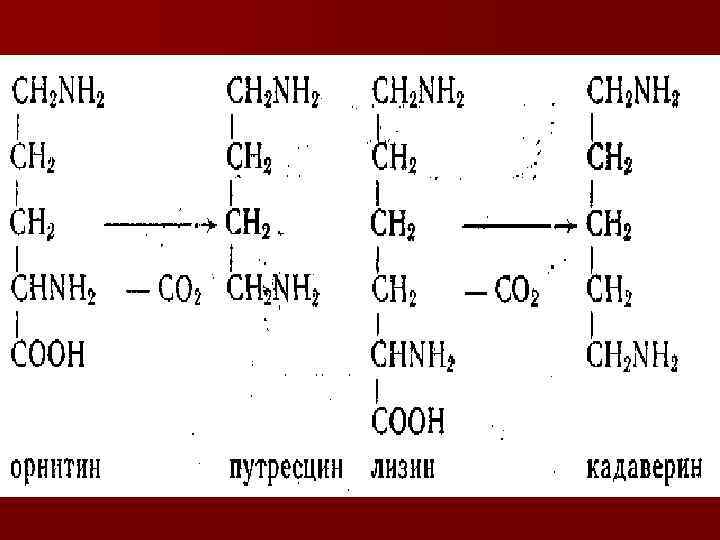
декарбоксилирование n Серосодержащие АК n n Орнитин Н 2Ѕ (сероводород) метилмеркаптан путресцин СО 2 n Лизин кадаверин СО 2
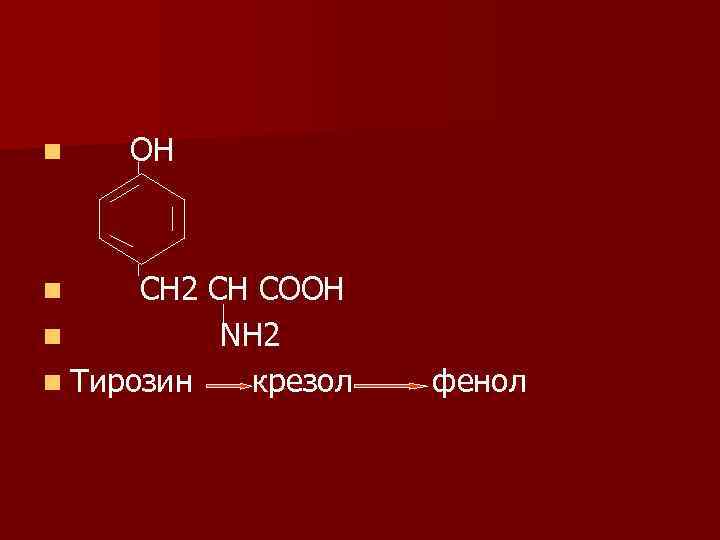
n ОН СН 2 СН СООН n ΝН 2 n Тирозин крезол n фенол
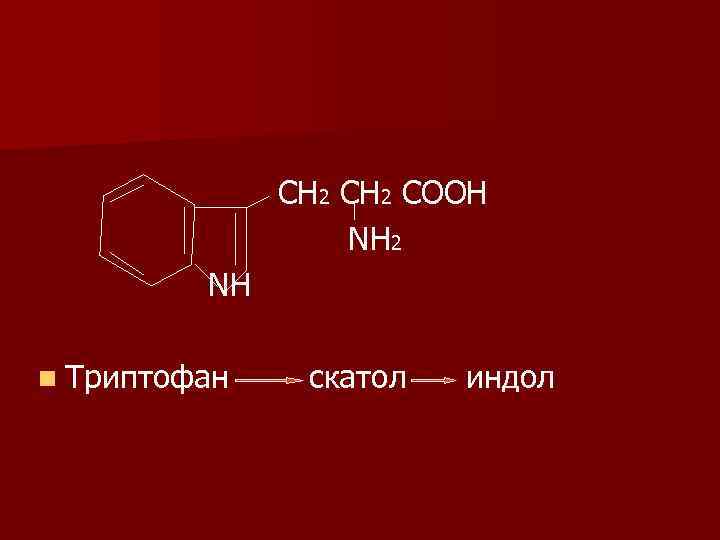
СН 2 СООН Ν Н 2 ΝН n Триптофан скатол индол
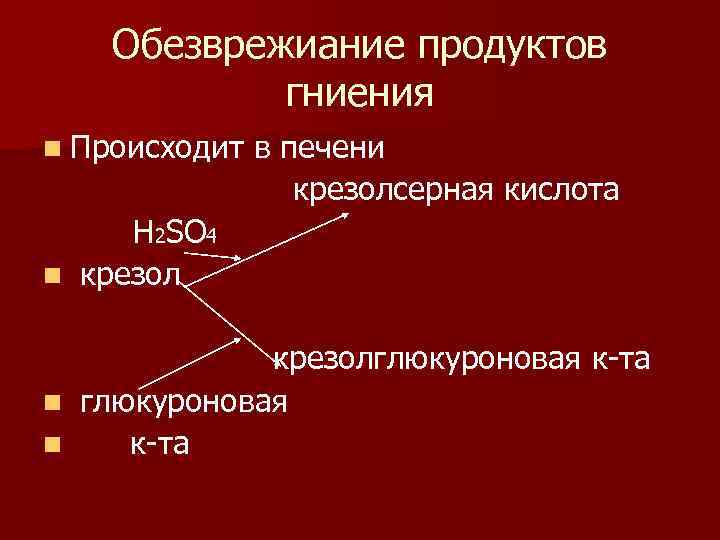
Обезврежиание продуктов гниения n Происходит в печени крезолсерная кислота Н 2ЅО 4 n крезолглюкуроновая к-та n глюкуроновая n к-та
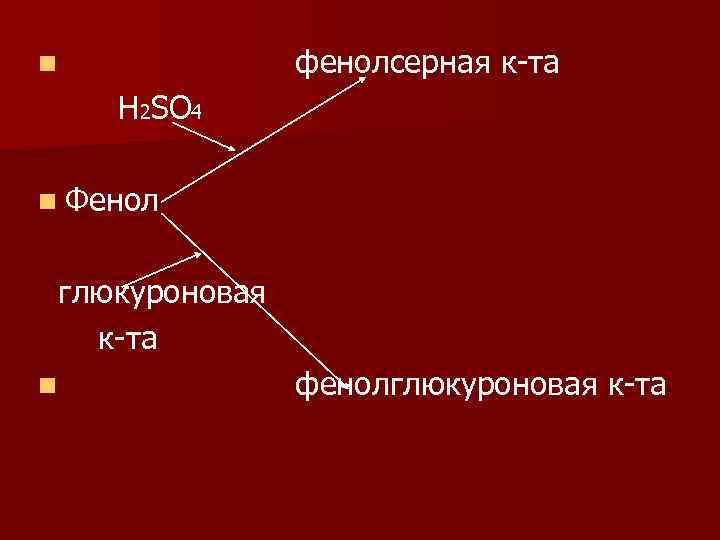
фенолсерная к-та n Н 2ЅО 4 n Фенол глюкуроновая к-та n фенолглюкуроновая к-та
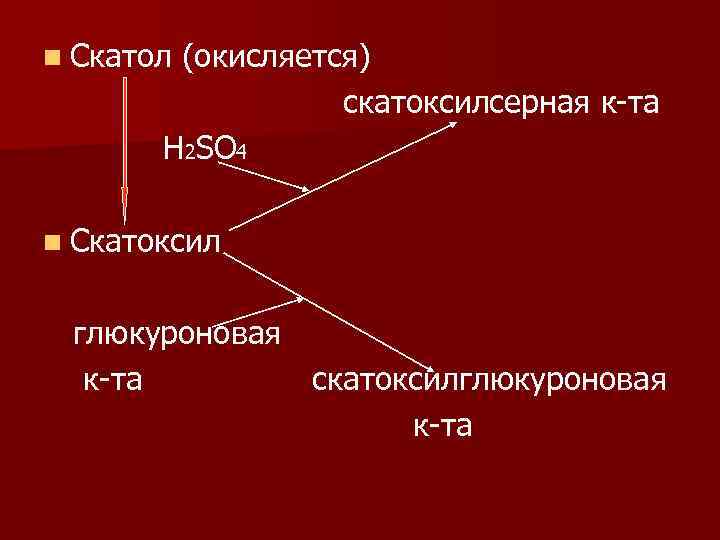
n Скатол (окисляется) скатоксилсерная к-та Н 2ЅО 4 n Скатоксил глюкуроновая к-та скатоксилглюкуроновая к-та
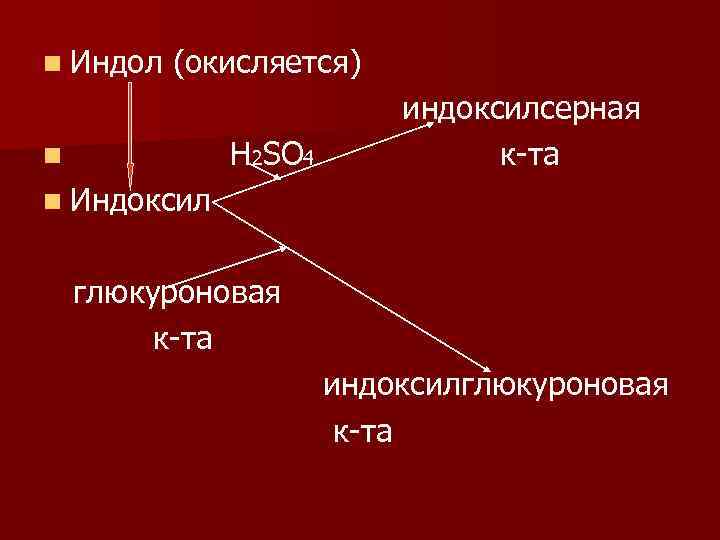
n Индол (окисляется) Н 2ЅО 4 n индоксилсерная к-та n Индоксил глюкуроновая к-та индоксилглюкуроновая к-та

n Калиевая соль индоксилсерной кислоты называется животный индикан

Использование аминокислот в тканях n n 90% аминокислот используется на синтетические (анаболические) процессы: 80% идет на биосинтез белка, в том числе ферментов и гормонов; остальная часть (10%) используется для: 1) синтеза биологически-активных пептидов, например, нейропептидов; 2) для синтеза небелковых БАВ - креатина, коферментов, аминокислот, пуринов, пиримидинов, холина, парных Жч. К и др. ;

n Аминокислоты, как и белки, не накапливаются n и на запасаются в тканях n Неиспользованные аминокислоты подвергаются распаду путем: n - декарбоксилирования n - дезаминирования


Переаминирование АК

Синтез креатина (в почках)

n. С током крови гуанидинуксусная кислота (гуанидинацетат) доставляется в печень n В печени гуанидинацетат подвергается процессу метилирования за счет АК метионина с образованием креатина


В печени

n ЅАМ – Ѕ-аденозилметионин n ЅАГ - Ѕ-аденозилгомоцистеин

n Образовавшийся креатин доставляется в мышцы, где подвергается фосфорилированию за счет АТФ, с образованием креатинфосфата
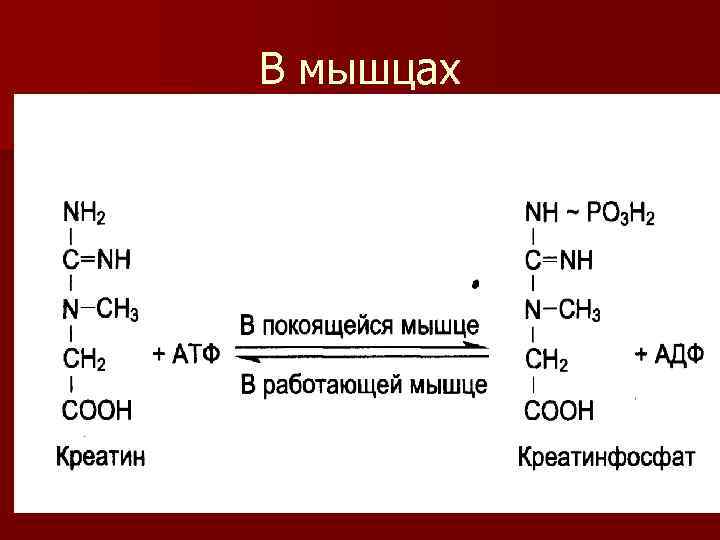
В мышцах

Значение образования креатинфосфата (КФ) n Реакция имеет большое значение в химизме мышечного сокращения. В миокарде и скелетных мышцах образование креатинфосфата - это реакция депонирования остатка фосфорной кислоты с макроэргической связью.

n При необходимости, когда уменьшается количество АТФ происходит обратная реакция и образуется АТФ (ресинтез АТФ). n В сердечной мышце энергия креатинфосфата служит непосредственно для сокращения. n В мышцах возможна реакция образования креатинина - конечного продукта обмена простых белков.

Образование креатинина

n Креатинин – это конечный продукт обмена белков

n 3) для реакций обезвреживания -чаще используются гли, асп, глу. n Гли участвует в обезвреживании бензоата, n асп и глу в обезвреживании аммиака. n II. 10% аминокислот подвергаются распаду - путем дезаминирования и декарбоксилирования

Декарбоксилирование аминокислот и роль биогенных аминов. n При декарбоксилировании аминокислот образуются биогенные или протеиногенные амины (моноамины), а также полиамины. Всего в организме человека образуется более 40 биогенных аминов.

Декарбоксилирование n n особенно интенсивно идет в печени, мозге, хромафинной ткани.

Декарбоксилирование АК


Значение гистамина n n n n Стимулирует секрецию желудочного сока Повышает проницаемость капилляров вызывает отеки Снижает АД, но повышает внутричерепное давление Сокращает гладкую мускулатуру легких Участвует в формировании воспалительной реакции Вызывает аллергическую реакцию Выполняет роль нейромедиатора Является медиатором боли
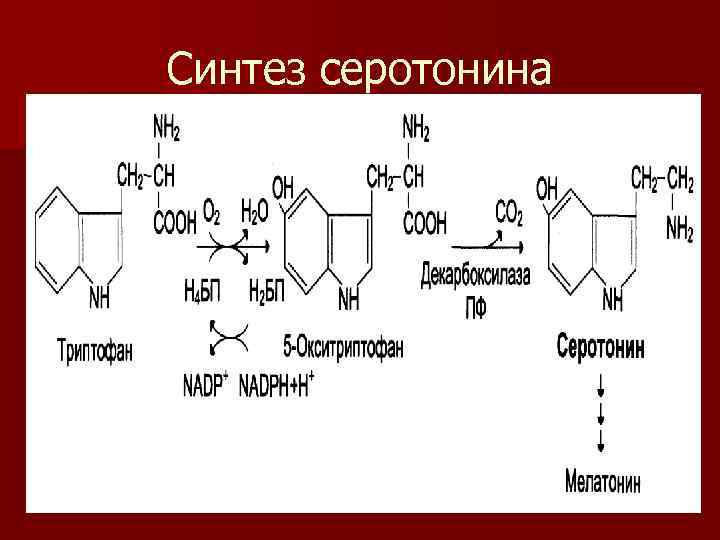
Синтез серотонина

Значение серотонина n n n Серотонин биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры Оказывает сосудосуживающий эффект Регулирует АД, температуру тела, дыхание Обладает антидепрессантным действием может принимать участие в аллергических реакциях, т. к. синтезируется в тучных к-ках

n Серотонин может превращаться в гормон мелатонин n Мелатонин – регулирует суточные и сезонные изменения метаболизма организма n Участвует в репродуктивной функции
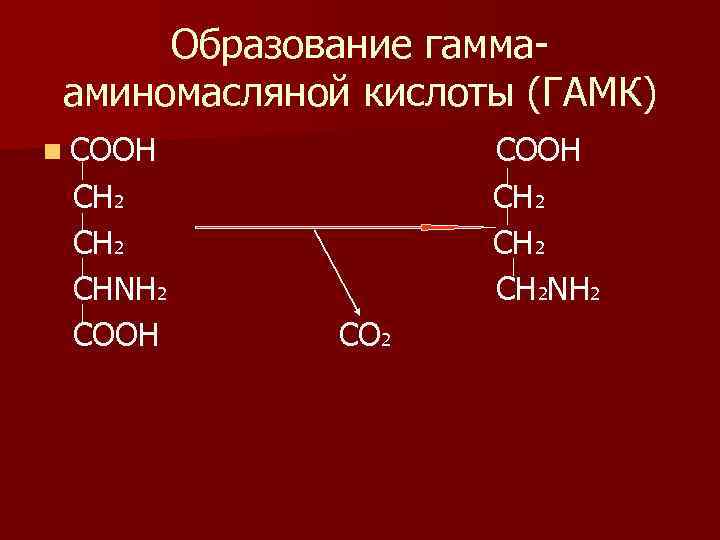
Образование гаммааминомасляной кислоты (ГАМК) n СООН СН 2 СНΝН 2 СООН СН 2ΝН 2 СО 2


n При декарбоксилировании глу образуется -глу – ГАМК. Очень много этого амина образуется в головном мозге. n ГАМК является тормозным медиатором. Кроме этого под влиянием ГАМК улучшается кровоснабжение мозга. n Циклическое производное ГАМК – пирацетам используется для улучшения метаболизма в нейронах и улучшения памяти.

n При декарбоксилировании асп образуется -ала. n -ала является составной частью НSКо. А. , n входит в состав специфических пептидов мышц: карнозина и ансерина.
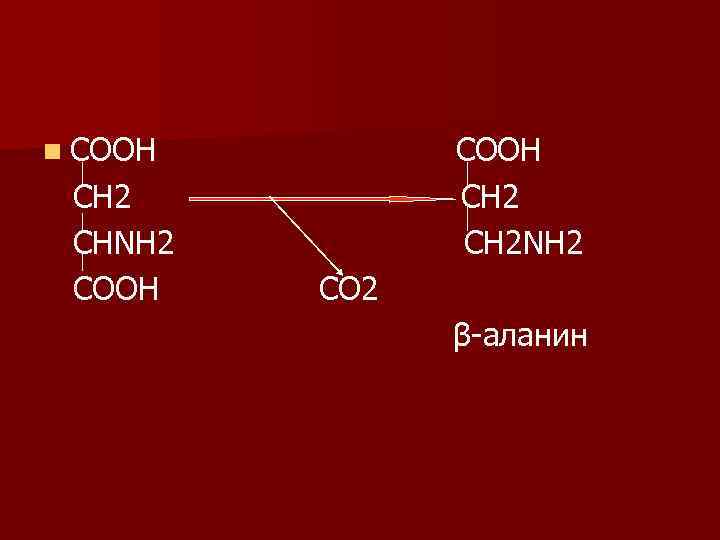
n СООН СН 2 СНΝН 2 СООН СН 2ΝН 2 СО 2 β-аланин

n При декарбоксилировании цистеиновой кислоты образуется таурин, который используется для образования парных Жч. К. n При декарбоксилировании лизина образуется кадаверин, орнитина – путресцин

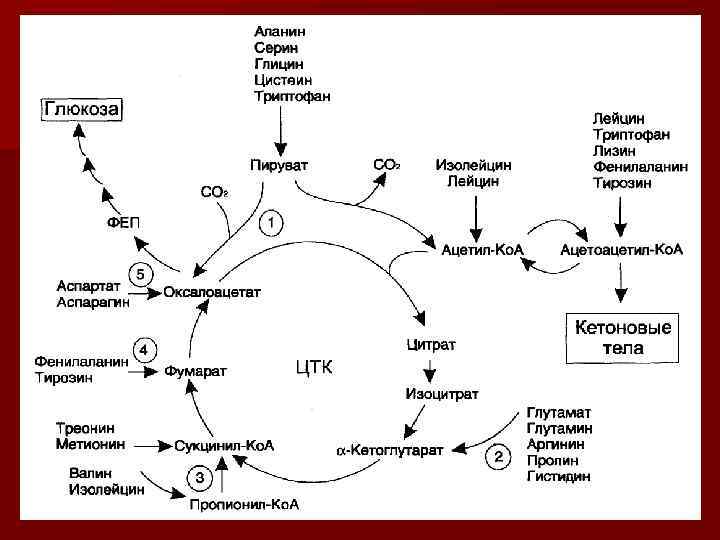
Дезаминирование аминокислот n. В результате дезаминирование выделяется аммиак n и образуется безазотистый остаток аминокислот

Пути образования аммиака n Аммиак образуется во всех тканях, особенно в головном мозге, а обезвреживается преимущественно в печени и почках.

Пути образования аммиака n n n 1) дезаминирование аминокислот; 2) дезаминирование пуриновых оснований; 3) распад пиримидиновых оснований; 4) дезамидирование амидов; 5) дезаминирование биогенных аминов; 6) распад гексозаминов.

Дезаминирование n Основная масса АК, неиспользованных для нужд организма, подвергается окончательному распаду путем ДЕЗАМИНИРОВАНИЯ (около 70%) n Различают следующие виды дезаминирования:

Виды дезаминирования n 1) гидролитическое дезаминирование n 2) восстановительное дезаминирование n 3) внутримолекулярное дезаминирование. Этому виду дезаминирования подвергаются асп, асн и гис n 4) окислительное непрямое дезаминирование.
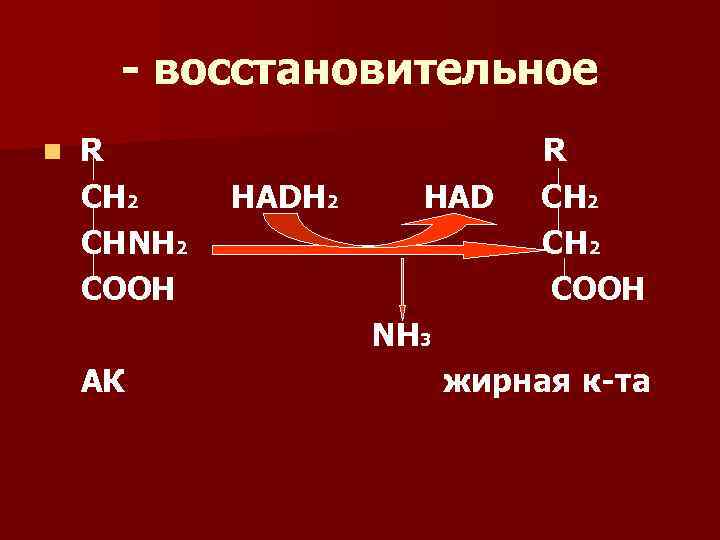
- восстановительное n R СН 2 СНNH 2 COOH HADH 2 HAD R СН 2 COOH Ν Н 3 АК жирная к-та
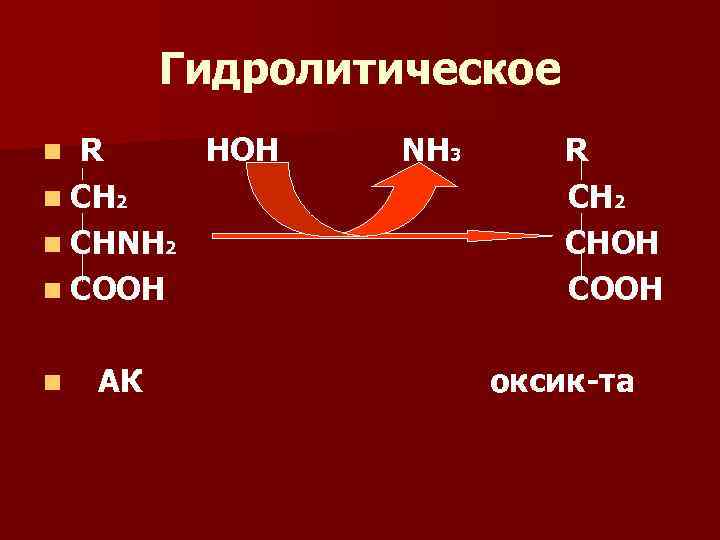
Гидролитическое R HOH n СН 2 n СНNH 2 n COOH n n АК NH 3 R C Н 2 СНОН СООН оксик-та
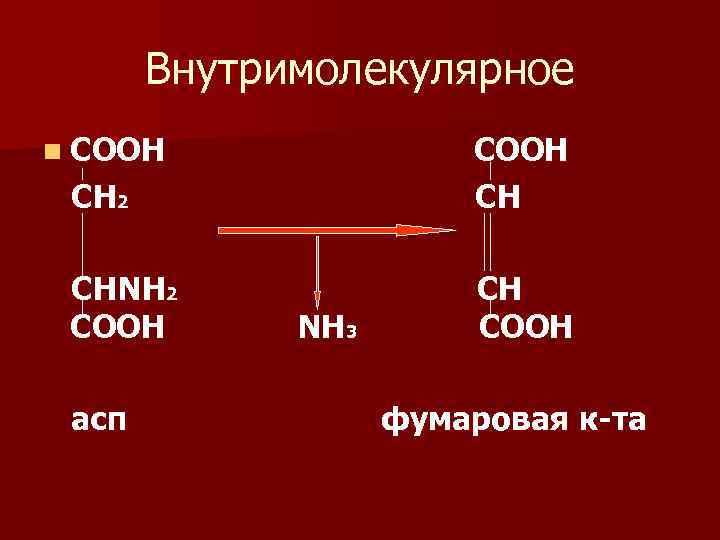
Внутримолекулярное n СООН СН 2 СООН СН СНNH 2 CООH СН СООН асп Ν Н 3 фумаровая к-та
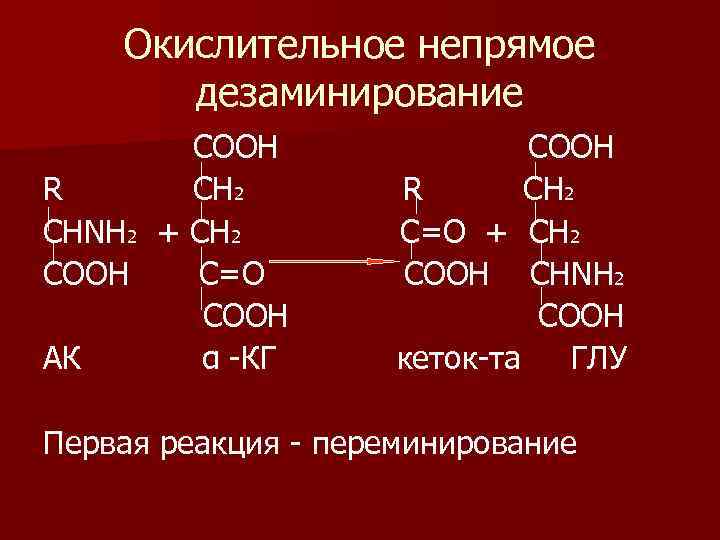
Окислительное непрямое дезаминирование СООН R C Н 2 СНΝН 2 + СН 2 СООН С=О СООН АК α -КГ СООН R СН 2 С=О + СН 2 СООН СНΝН 2 СООН кеток-та ГЛУ Первая реакция - переминирование
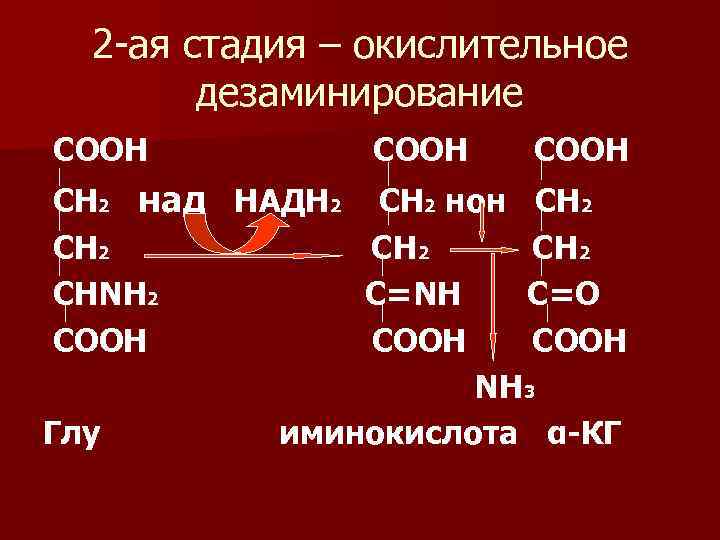
2 -ая стадия – окислительное дезаминирование COOH CH 2 над НАДН 2 CH 2 СНΝН 2 СООН Глу СООН СН 2 нон СН 2 С=ΝН С=О СООН Ν Н 3 иминокислота α-КГ

n Окислительное непрямое дезаминирование является основным, ему подвергается только глу.

n Процесс происходит под действием фермента – глутамат. ДГ, которая находится в активном виде, а все остальные оксидазы аминокислот неактивны при физиологическом значении р. Н. Поэтому аминокислоты, оксидазы которых неактивны, должны вначале перебросить аминогруппу в глу путем переаминирования с -КГ. Отсюда второе название этого вида дезаминирования – непрямое окислительное

n При дезаминировании аминокислот получаются безазотистые остатки аминокислот, преимущественно кетокислоты n и выделяется аммиак.

Судьба безазотистого остатка АК n Поступают в ЦТК. n Глюконеогенез n Липонеогенез n при необходимости часть безазотистых остатков аминокислот можно использовать для синтеза аминокислот.

Судьба аммиака
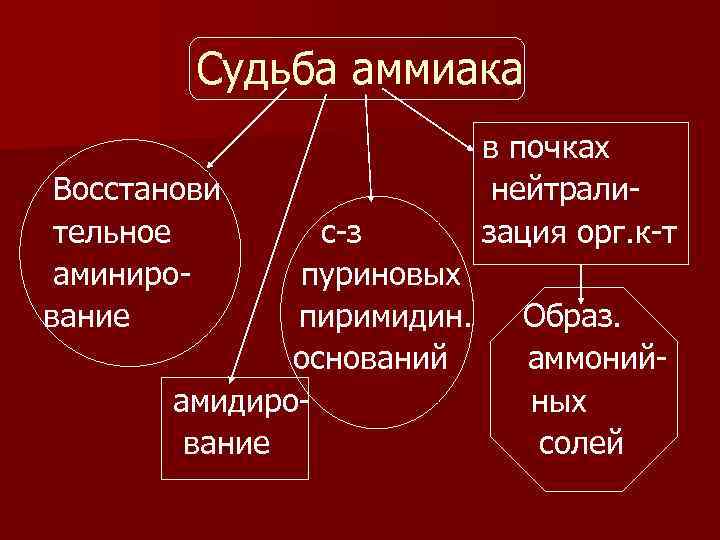
Судьба аммиака Восстанови тельное аминирование с-з пуриновых пиримидин. оснований амидирование в почках нейтрализация орг. к-т Образ. аммонийных солей

Восстановительное аминирование
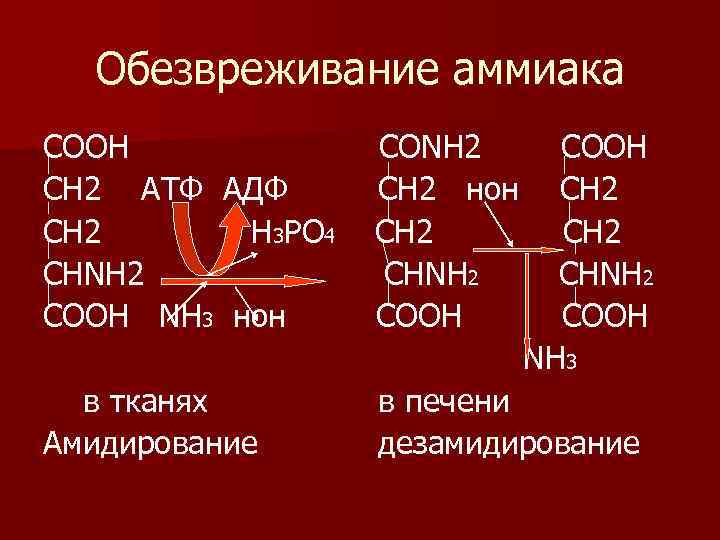
Обезвреживание аммиака СООН СН 2 АТФ АДФ СН 2 Н 3 РО 4 СНΝН 2 СООН ΝН 3 нон СОΝН 2 СН 2 нон СН 2 СНΝН 2 СООН Ν Н 3 в тканях Амидирование в печени дезамидирование

Синтез мочевины n Мочевина – основной конечный продукт азотистого обмена, в составе которого выделяется до 90% всего выводимого азота n Экскреция мочевины в норме составляет до 25 г/сутки n Мочевина синтезируется в печени


Синтез мочевина n Образование мочевины или орнитиновый цикл или цитруллиновая теория. n Синтез мочевины протекает в митохондриях печени. n Процесс начинается с образования карбомоилфосфата. Реакция конденсации идет между СО 2, NН 3, Н 2 О. Требуется энергия 2 молекул АТФ.
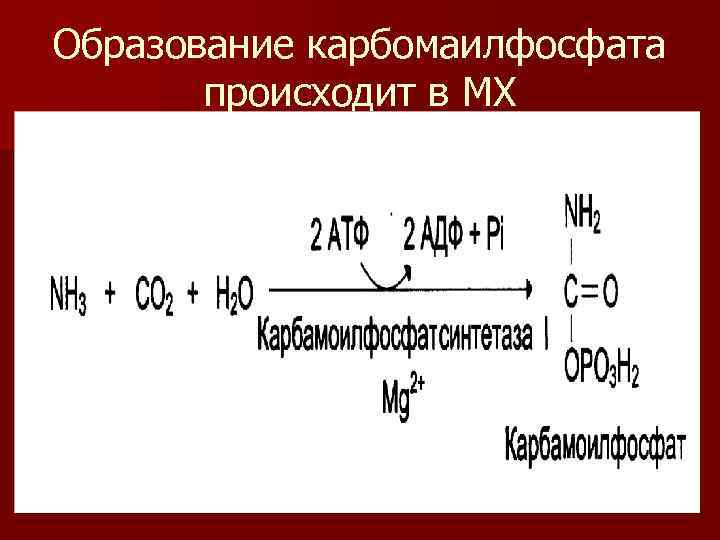
Образование карбомаилфосфата происходит в МХ

Образование цитруллина n 2 реакция – образование цитруллина. Реакция идет между орнитином и карбомоилфосфатом. В результате получается цитруллин и выделяется молекула фосфорной кислоты

Образование цитруллина (в МХ)

n 3 реакция – образование аргининянтарной кислоты. Реакция идет между асп и цитруллином, используется энергия АТФ.

Образование аргининянтарной кислоты (в ЦП)

n 4 реакция – расщепление аргининянтарной кислоты на аргинин и фумарат.

Образование аргинина

n 5 реакция – гидролиз аргинина под действием аргиназы до мочевины и орнитина – цикл замыкается.
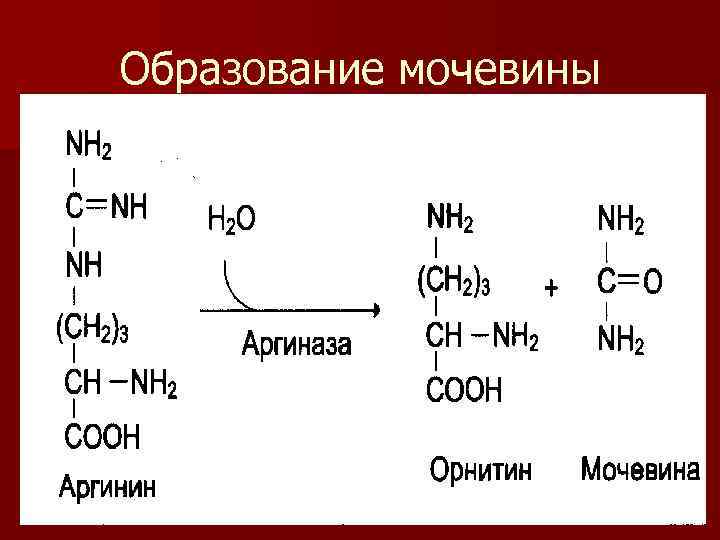
Образование мочевины

Суммарное уравнение синтеза мочевины

n Т. о. , азот мочевины взят на 50% от аммиака и 50% от аспарагинговой к-ты. Т. о. , для синтеза мочевины необходима молекула асп, убыль которой можно восстановить, используя цикл, который также был открыт Кребсом. Фумарат, гидратируясь, дает малат, который, окисляясь, дает ЩУК. При переаминировании ЩУК образуется асп.

Конечные продукты обмена простых белков n n n n Мочевина Креатинин Эфиросерные и эфироглюкуроновые кислоты СО 2 и Н 2 О Аммонийные соли Гиппуровая кислота Альдегиды и кетоны при обезвреживании биогенных аминов.

ЛИТЕРАТУРА: n n n Основная: Т. Ш. Шарманов, С. М. Плешкова «Метаболические основы питания с курсом общей биохимии» , Алматы, 1998 г. С. Тапбергенов «Медицинская биохимия» , Астана, 2001 г. С. Сеитов «Биохимия» , Алматы, 2001 г. В. Дж. Маршал «Клиническая биохимия» , 2000 г.

n n n n n Дополнительная: Б. Гринстейн, А. Гринстейн «Наглядная биохимия» , 2000 г. Т. Т. Березов, Б. Ф. Коровкин «Биологическая химия» , 2005 г. Д. Г. Кнорре, С. Д. Мызина «Биологическая химия» , Москва, 2002 г. Р. Марри, Д. Греннер «Биохимия человека» , I-II том, 1993 г. А. Ш. Зайчик, Л. Г. Чурилов «Основы патохимии» , Москва, 2001 г. Полосухина Т. Я. , Аблаев Н. Р. «Материалы к курсу биологической химии» , 1977 – С. 3, 30 -33, 47 -49, 59 -62. Бышевский А. Ш. , Терсенов О. А. «Биохимия для врача» , 1994 – С. 34 -54, 75, 95, 108, 214 -216, 224, 249. Н. Р. Аблаев Биохимия в схемах и рисунках, Алматы 2005 г. Биохимия. Краткий курс с упражнениями и задачами. Под ред. проф. Е. С. Северина, А. Я. Николаева, М. , 2002 г.

n n n n КОНТРОЛЬНЫЕ ВОПРОСЫ: 1. Особенности обмена белков, понятие об азотистом балансе. 2. Переваривание и всасывание белков. 3. Декарбоксилирование аминокислот, образование биогенных аминов, их значение. 4. Дезаминирование аминокислот, виды дезаминирования. 5. Пути образования и утилизации аммиака. 6. Синтез мочевины. 7. Конечные продукты обмена белков.
бх. лекция. Обмен белков и аминокислот..ppt