d -элем I и II группы.ppt
- Количество слайдов: 105
 Лекция № 9 Лекарственные средства d -элементов I группы ПСЭ 31. 10. 11 1
Лекция № 9 Лекарственные средства d -элементов I группы ПСЭ 31. 10. 11 1
 d- элементы: медь, серебро и золото. В образовании химических связей принимают участие ns-электроны и (n-1)d-электроны. В некоторых своих соединениях элементы 1 группы одновалентны. 1 особенность. Ø Медь в соединениях проявляет степень Медь окисленности +1, +2 (редко +3), Ø Cеребро - +1, (реже +2), Ø Золото образует устойчивые соединения со степенью окисленности +3 и неустойчивые 2 соединения золота +1 и +2.
d- элементы: медь, серебро и золото. В образовании химических связей принимают участие ns-электроны и (n-1)d-электроны. В некоторых своих соединениях элементы 1 группы одновалентны. 1 особенность. Ø Медь в соединениях проявляет степень Медь окисленности +1, +2 (редко +3), Ø Cеребро - +1, (реже +2), Ø Золото образует устойчивые соединения со степенью окисленности +3 и неустойчивые 2 соединения золота +1 и +2.
 2 особенность Высокая склонность к комплексообразованию, особенно у меди, 3 особенность Способность восстанавливаться из соединений до свободного металла (легче восстанавливается серебро, чем медь). Относятся к неактивным металлам. Основные и восстановительные свойства убывают от меди к золоту. В медицинской практике применяют меди (II) сульфат, серебра нитрат, коллоидные препараты серебра и некоторые комплексные соединения золота. 3
2 особенность Высокая склонность к комплексообразованию, особенно у меди, 3 особенность Способность восстанавливаться из соединений до свободного металла (легче восстанавливается серебро, чем медь). Относятся к неактивным металлам. Основные и восстановительные свойства убывают от меди к золоту. В медицинской практике применяют меди (II) сульфат, серебра нитрат, коллоидные препараты серебра и некоторые комплексные соединения золота. 3
 Препараты меди Ø Медь относится к жизненно необходимым элементам. ØОбщее содержание меди в организме человека составляет около 100 мг. Ø В основном медь концентрируется в головном мозге, печени и крови. Известно около 25 медьсодержащих белков и ферментов. 1. катализируют взаимодействие кислорода с субстратом. - гидроксилазы (присоединяют один атом кислорода), -оксигеназы (присоединяют оба атома кислорода с образованием пероксидной цепочки). O[E 1. Cu+] + O 2 E 1. Cu 2+ O - 4
Препараты меди Ø Медь относится к жизненно необходимым элементам. ØОбщее содержание меди в организме человека составляет около 100 мг. Ø В основном медь концентрируется в головном мозге, печени и крови. Известно около 25 медьсодержащих белков и ферментов. 1. катализируют взаимодействие кислорода с субстратом. - гидроксилазы (присоединяют один атом кислорода), -оксигеназы (присоединяют оба атома кислорода с образованием пероксидной цепочки). O[E 1. Cu+] + O 2 E 1. Cu 2+ O - 4
 2. Катализируют окислительно-восстановительные реакции с переносом протонов или электронов от окисляемого вещества на молекулярный кислород. Это- оксидазы (цитохромоксидаза). 3. Церулоплазмин. ЦП содержит 8 атомов меди на 1 ерулоплазмин молекулу белка и выполняет транспортную функцию. 4. СОД ускоряет реакцию разложения супероксид-иона кислорода, который вступая во взаимодействие с органическими компонентами клетки, разрушает ее. СОД переводит супероксид-иона кислорода в водородпероксид, который быстро разлагается в организме под действием каталазы: [СОД. Cu+] + О 2 - + 2 Н+ - [СОД. Cu 2+] + Н 2 О 2 5
2. Катализируют окислительно-восстановительные реакции с переносом протонов или электронов от окисляемого вещества на молекулярный кислород. Это- оксидазы (цитохромоксидаза). 3. Церулоплазмин. ЦП содержит 8 атомов меди на 1 ерулоплазмин молекулу белка и выполняет транспортную функцию. 4. СОД ускоряет реакцию разложения супероксид-иона кислорода, который вступая во взаимодействие с органическими компонентами клетки, разрушает ее. СОД переводит супероксид-иона кислорода в водородпероксид, который быстро разлагается в организме под действием каталазы: [СОД. Cu+] + О 2 - + 2 Н+ - [СОД. Cu 2+] + Н 2 О 2 5
 Меди сульфат (медный купорос) может вызватть сильное ) отравление с возможным смертельным исходом: отравление медь образует с белками нерастворимые бионеорганические хелаты-альбуминаты, т. е. свертывает белки. Ионы меди образуют прочную связь с аминным азотом и с группой – SН белков, что приводит к инактивации тиоферментов: 6
Меди сульфат (медный купорос) может вызватть сильное ) отравление с возможным смертельным исходом: отравление медь образует с белками нерастворимые бионеорганические хелаты-альбуминаты, т. е. свертывает белки. Ионы меди образуют прочную связь с аминным азотом и с группой – SН белков, что приводит к инактивации тиоферментов: 6
 РАСПРОСТРАНЕНИЕ МЕДИ В ПРИРОДЕ 1. В виде самородного металла 2. В виде различных руд, чаще всего серных: серных • медный колчедан Cu. Fe. S 2, • медный блеск Cu 2 S. 3. В виде кислородсодержащие соединения меди: меди • красная медная руда (куприт) Cu 2 O, • малахит Сu 2(ОН)2 СО 3, • тенорит Сu. О. 4. В воде некоторых минеральных источников и в морской воде. 7
РАСПРОСТРАНЕНИЕ МЕДИ В ПРИРОДЕ 1. В виде самородного металла 2. В виде различных руд, чаще всего серных: серных • медный колчедан Cu. Fe. S 2, • медный блеск Cu 2 S. 3. В виде кислородсодержащие соединения меди: меди • красная медная руда (куприт) Cu 2 O, • малахит Сu 2(ОН)2 СО 3, • тенорит Сu. О. 4. В воде некоторых минеральных источников и в морской воде. 7
 Cu. SO 4. 5 H 2 O Меди сульфат Cupri sulfas Mr 249, 68 г/моль Синонимы: медный купорос, Медь сернокислая Получение: 1. Окислители: кислород и азотная кислота: 1 а). 2 Сu + 2 Н 2 SO 4 + O 2 2 Cu. SO 4 + 2 Н 2 О (при нагрев) 1 б). ЗСu + ЗН 2 SO 4 + 2 HNO 3 3 Cu. SO 4 + 2 NO + 4 Н 2 О Раствор упаривают досуха. Остаток растворяют в воде, из которой выпадают прозрачные кристаллы синего цвета: Cu. SO 4. 5 H 2 O. 2). Растворением оксида меди в серной кислоте: Сu. О + Н 2 SO 4 Cu. SO 4 + Н 2 О 8
Cu. SO 4. 5 H 2 O Меди сульфат Cupri sulfas Mr 249, 68 г/моль Синонимы: медный купорос, Медь сернокислая Получение: 1. Окислители: кислород и азотная кислота: 1 а). 2 Сu + 2 Н 2 SO 4 + O 2 2 Cu. SO 4 + 2 Н 2 О (при нагрев) 1 б). ЗСu + ЗН 2 SO 4 + 2 HNO 3 3 Cu. SO 4 + 2 NO + 4 Н 2 О Раствор упаривают досуха. Остаток растворяют в воде, из которой выпадают прозрачные кристаллы синего цвета: Cu. SO 4. 5 H 2 O. 2). Растворением оксида меди в серной кислоте: Сu. О + Н 2 SO 4 Cu. SO 4 + Н 2 О 8
 ОПИСАНИЕ И свойства меди сульфата. Синие кристаллы или синий кристаллический порошок без запаха, металлического вкуса. Медленно выветривается на воздухе. 105 о. С - Cu. SO 4. 3 H 2 O, 150 о. С - Cu. SO 4. H 2 O(слегка голубоватые), 250 о. С - Cu. SO 4(обесцвечивание) голубоватые), (обесцвечивание Меди сульфат легко растворим в воде (1: 3 в холодной, 1: 8 в кипящей воде), практически не растворим в спирте. Водные растворы имеют слабокислую реакцию. Аква-ионы меди [Cu(H 2 O)n]2+ окрашены в голубой цвет. 9
ОПИСАНИЕ И свойства меди сульфата. Синие кристаллы или синий кристаллический порошок без запаха, металлического вкуса. Медленно выветривается на воздухе. 105 о. С - Cu. SO 4. 3 H 2 O, 150 о. С - Cu. SO 4. H 2 O(слегка голубоватые), 250 о. С - Cu. SO 4(обесцвечивание) голубоватые), (обесцвечивание Меди сульфат легко растворим в воде (1: 3 в холодной, 1: 8 в кипящей воде), практически не растворим в спирте. Водные растворы имеют слабокислую реакцию. Аква-ионы меди [Cu(H 2 O)n]2+ окрашены в голубой цвет. 9
 Определение подлинности меди сульфата 1. ГФ: Реакция восстановления меди до металлической 1. ГФ: меди: Cu. SO 4 + Fe Fe. SO 4 + Сu 2. ГФ, ЕР: 2 Cu. SO 4 + 2 NH 3. H 2 O (NH 4)2 SO 4 + Cu 2(OH)2 SO 4 2. ГФ, ЕР: голубой осадок Осадок растворяется в избытке аммиака с образованием комплексной медноаммиачной соли серной кислоты Cu 2(OH)2 SO 4 + 6 NH 3. H 2 O + (NH 4)2 SO 4 2[Сu(NН 3)4]SO 4 +8 H 2 O комплекс синего цв. Число молекул (NН 3) в аммиакатах меди = 1 -4 В кислой среде: комплексный катион меди разрушается и окраска раствора из ярко-синей переходит в голубую (цвет аквокомплекса меди (II)): [Сu(NН 3)4]2+ + 4 Н 3 О+ [Cu(H 2 O)4]2+ + 4 NH 4+ 10 Чувствительность реакции: 1 : 25000.
Определение подлинности меди сульфата 1. ГФ: Реакция восстановления меди до металлической 1. ГФ: меди: Cu. SO 4 + Fe Fe. SO 4 + Сu 2. ГФ, ЕР: 2 Cu. SO 4 + 2 NH 3. H 2 O (NH 4)2 SO 4 + Cu 2(OH)2 SO 4 2. ГФ, ЕР: голубой осадок Осадок растворяется в избытке аммиака с образованием комплексной медноаммиачной соли серной кислоты Cu 2(OH)2 SO 4 + 6 NH 3. H 2 O + (NH 4)2 SO 4 2[Сu(NН 3)4]SO 4 +8 H 2 O комплекс синего цв. Число молекул (NН 3) в аммиакатах меди = 1 -4 В кислой среде: комплексный катион меди разрушается и окраска раствора из ярко-синей переходит в голубую (цвет аквокомплекса меди (II)): [Сu(NН 3)4]2+ + 4 Н 3 О+ [Cu(H 2 O)4]2+ + 4 NH 4+ 10 Чувствительность реакции: 1 : 25000.
 Подлинность: • 2. ЕР: потеря в весе при высушивании при 250 ± 10 °C : от 35. 0 % дo 36. 5 % (потеря кристализационной воды) • 3. Реакции на сульфаты 11
Подлинность: • 2. ЕР: потеря в весе при высушивании при 250 ± 10 °C : от 35. 0 % дo 36. 5 % (потеря кристализационной воды) • 3. Реакции на сульфаты 11
 нефармакопейные реакции: 1. Соли меди в присутствии хлороводородной кислоты окрашивают бесцветное пламя горелки в зеленый цвет. 2. Cu. SO 4 + Na 2 S Cu. S + Na 2 SO 4 (черный осадок Cu. S ) Осадок не растворим в HCl, но растворим в горячей HNO 3; при этом выделяется бурый газ: Cu. S + 10 HNO 3 Сu(NО 3)2 + Н 2 SО 4 + 8 NO 2 + 4 H 2 O 12
нефармакопейные реакции: 1. Соли меди в присутствии хлороводородной кислоты окрашивают бесцветное пламя горелки в зеленый цвет. 2. Cu. SO 4 + Na 2 S Cu. S + Na 2 SO 4 (черный осадок Cu. S ) Осадок не растворим в HCl, но растворим в горячей HNO 3; при этом выделяется бурый газ: Cu. S + 10 HNO 3 Сu(NО 3)2 + Н 2 SО 4 + 8 NO 2 + 4 H 2 O 12
![3. USP: При действии раствора ферроцианида калия K 4[Fe(CN)6] выделяется красно-коричневый осадок гексоцианоферрата (ферроцианида) 3. USP: При действии раствора ферроцианида калия K 4[Fe(CN)6] выделяется красно-коричневый осадок гексоцианоферрата (ферроцианида)](https://present5.com/presentation/20700012_242516262/image-13.jpg) 3. USP: При действии раствора ферроцианида калия K 4[Fe(CN)6] выделяется красно-коричневый осадок гексоцианоферрата (ферроцианида) меди Cu 2[Fe(CN)6]: 2 Cu. SO 4+K 4[Fe(CN)6] Cu 2[Fe(CN)6] + 2 K 2 SO 4 красно-коричневый При небольшой концентрации меди осадок может не образоваться, и раствор окрашивается в розовый цвет. Эта реакция очень чувствительна: ион Сu 2+ может быть обнаружен при разбавлении 1 : 1 000. Осадок не растворяется в разбавленных кислотах, но растворяется в 25% водном аммиаке: Cu 2[Fe(CN)6] + 12 NH 3 + 4 H 2 O (NH 4)4[Fe(CN)6] + 13 2[Cu(NH 3)4](OH)2
3. USP: При действии раствора ферроцианида калия K 4[Fe(CN)6] выделяется красно-коричневый осадок гексоцианоферрата (ферроцианида) меди Cu 2[Fe(CN)6]: 2 Cu. SO 4+K 4[Fe(CN)6] Cu 2[Fe(CN)6] + 2 K 2 SO 4 красно-коричневый При небольшой концентрации меди осадок может не образоваться, и раствор окрашивается в розовый цвет. Эта реакция очень чувствительна: ион Сu 2+ может быть обнаружен при разбавлении 1 : 1 000. Осадок не растворяется в разбавленных кислотах, но растворяется в 25% водном аммиаке: Cu 2[Fe(CN)6] + 12 NH 3 + 4 H 2 O (NH 4)4[Fe(CN)6] + 13 2[Cu(NH 3)4](OH)2
 4. Для ионов меди характерно взаимодействие с органическими кислотами, многоатомными спиртами, имеющими несколько гидроксильных групп. Cu. SO 4 + 2 Na. OH Cu(OH)2 + Na 2 SO 4 14
4. Для ионов меди характерно взаимодействие с органическими кислотами, многоатомными спиртами, имеющими несколько гидроксильных групп. Cu. SO 4 + 2 Na. OH Cu(OH)2 + Na 2 SO 4 14
 ЧИСТОТА ЕР: -Хлориды (100 ppm) • Методом ААS определяют: -Железо (102 ppm) -Свинец (50 ppm) 15
ЧИСТОТА ЕР: -Хлориды (100 ppm) • Методом ААS определяют: -Железо (102 ppm) -Свинец (50 ppm) 15
 Количественное определение меди сульфата (ГФ, ЕР) Йодометрический метод: основан на восстановлении катиона меди (II) до меди (I). 2 Cu. SO 4 + 4 KI тв. 2 Cu. I 2 + 2 K 2 SO 4 2 Cu. I 2 2 Cu. I + I 2_________________ 1). 2 Cu. SO 4 + 4 KI 2 Cu. I + I 2 + 2 K 2 SO 4 белый осадок 2). I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 (индикатор – крахмал в конце титрования) ГФХ: Содержание меди сульфата в ЛП не менее 98% и 98% не более 101, 0% (предел выветривания). ЕФ: от 99% до 101, 0% 101% 16
Количественное определение меди сульфата (ГФ, ЕР) Йодометрический метод: основан на восстановлении катиона меди (II) до меди (I). 2 Cu. SO 4 + 4 KI тв. 2 Cu. I 2 + 2 K 2 SO 4 2 Cu. I 2 2 Cu. I + I 2_________________ 1). 2 Cu. SO 4 + 4 KI 2 Cu. I + I 2 + 2 K 2 SO 4 белый осадок 2). I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 (индикатор – крахмал в конце титрования) ГФХ: Содержание меди сульфата в ЛП не менее 98% и 98% не более 101, 0% (предел выветривания). ЕФ: от 99% до 101, 0% 101% 16
 I Применение меди сульфата. 1. Наружно как антисептическое и вяжущее средство в виде 0, 25% раствора при конъюктивитах. 2. При ожогах кожи фосфором обильно смачивают обожженный участок 5% раствором меди сульфата. При работе с элементарным фосфором в цехах установлены ванны с с р-ром меди сульфата, в ванны сульфата которых можно смыть загрязнения фосфором. Реакция между фосфором и р-ром меди сульфата : меди сульфата фосфор покрывается черным фосфидом меди, и медленно выделяет кристаллическую медь. Черное покрытие на фосфоре предупреждает его воспламенение на воздухе. 11 P 4 + 96 H 2 O + 60 Cu. SO 4 = 24 H 3 PO 4 + 20 Cu 3 P↓ + 60 H 2 SO 4 P 4 + 16 H 2 O + 10 Cu. SO 4 = 4 H 3 PO 4 + 10 Cu ↓ + 10 H 2 SO 4 17
I Применение меди сульфата. 1. Наружно как антисептическое и вяжущее средство в виде 0, 25% раствора при конъюктивитах. 2. При ожогах кожи фосфором обильно смачивают обожженный участок 5% раствором меди сульфата. При работе с элементарным фосфором в цехах установлены ванны с с р-ром меди сульфата, в ванны сульфата которых можно смыть загрязнения фосфором. Реакция между фосфором и р-ром меди сульфата : меди сульфата фосфор покрывается черным фосфидом меди, и медленно выделяет кристаллическую медь. Черное покрытие на фосфоре предупреждает его воспламенение на воздухе. 11 P 4 + 96 H 2 O + 60 Cu. SO 4 = 24 H 3 PO 4 + 20 Cu 3 P↓ + 60 H 2 SO 4 P 4 + 16 H 2 O + 10 Cu. SO 4 = 4 H 3 PO 4 + 10 Cu ↓ + 10 H 2 SO 4 17
 3. При дефиците меди (ЕР) 4. Ранее ЛП назначали внутрь, как рвотное средство. 5. Меди сульфат, как микроэлемент включен в состав ряда комплексных поливитаминных препаратов: «Глутамевит» , «Компливит» и др. 6. Малые дозы меди назначают при анемиях (5 -15 капель 1% р-ра ЛП в молоке) 7. Имеются данные об эффективности меди сульфата при лечении больных витилиго. Хранение меди сульфата. В условиях, исключающих потери кристаллизационной воды, что может привести к передозировкам приготовлении лекарственных 18 форм. Относится к списку Б.
3. При дефиците меди (ЕР) 4. Ранее ЛП назначали внутрь, как рвотное средство. 5. Меди сульфат, как микроэлемент включен в состав ряда комплексных поливитаминных препаратов: «Глутамевит» , «Компливит» и др. 6. Малые дозы меди назначают при анемиях (5 -15 капель 1% р-ра ЛП в молоке) 7. Имеются данные об эффективности меди сульфата при лечении больных витилиго. Хранение меди сульфата. В условиях, исключающих потери кристаллизационной воды, что может привести к передозировкам приготовлении лекарственных 18 форм. Относится к списку Б.
 Серебра нитрат Argenti nitras Ag. NO 3 Мr 169, 87 Синонимы: Ляпис, Argentum nitricum. 19
Серебра нитрат Argenti nitras Ag. NO 3 Мr 169, 87 Синонимы: Ляпис, Argentum nitricum. 19
 • Ляпис -- нитрат серебра впервые применили врачи-алхимики голландец Гельмонт (1579 -1644) и немец Сильвий (1614 --1672), которые научились получать нитрат серебра взаимодействием металла с азотной кислотой: Ag + 2 HNO 3 = Ag. NO 3 + NO 2 + H 2 O. • Обнаружили, что прикосновение к кристаллам Ag. NO 3 не проходит бесследно: на коже остаются черные пятна, а при длительном контакте -- глубокие ожоги. 20
• Ляпис -- нитрат серебра впервые применили врачи-алхимики голландец Гельмонт (1579 -1644) и немец Сильвий (1614 --1672), которые научились получать нитрат серебра взаимодействием металла с азотной кислотой: Ag + 2 HNO 3 = Ag. NO 3 + NO 2 + H 2 O. • Обнаружили, что прикосновение к кристаллам Ag. NO 3 не проходит бесследно: на коже остаются черные пятна, а при длительном контакте -- глубокие ожоги. 20
 • ОПИСАНИЕ И СВОЙСТВА СЕРЕБРА НИТРАТА • Характерная форма кристаллов: бесцветные прозрачные кристаллы в виде пластинок или цилиндрических палочек лучисто-кристаллического строения в изломе. • Очень легко растворим в воде (1: 0. 6), трудно растворим в спирте. На свету кристаллы темнеют. Ag. NO 3 Ag + NO + O 2 21
• ОПИСАНИЕ И СВОЙСТВА СЕРЕБРА НИТРАТА • Характерная форма кристаллов: бесцветные прозрачные кристаллы в виде пластинок или цилиндрических палочек лучисто-кристаллического строения в изломе. • Очень легко растворим в воде (1: 0. 6), трудно растворим в спирте. На свету кристаллы темнеют. Ag. NO 3 Ag + NO + O 2 21
 Ag. NO 3 + HCl Ag. Cl + НNO 3 Хлорид серебра промывают и восстанавливают цинком: 2 Ag. Cl + Zn + H 2 SO 4 2 Ag + Zn. SO 4 + 2 HCl Ag, освобожденное от примесей, растворяют в HNO 3 : 3 Ag + 4 HNO 3 3 Ag. NO 3 + NO + 2 H 2 O Раствор концентрируют до кристаллизации. 22
Ag. NO 3 + HCl Ag. Cl + НNO 3 Хлорид серебра промывают и восстанавливают цинком: 2 Ag. Cl + Zn + H 2 SO 4 2 Ag + Zn. SO 4 + 2 HCl Ag, освобожденное от примесей, растворяют в HNO 3 : 3 Ag + 4 HNO 3 3 Ag. NO 3 + NO + 2 H 2 O Раствор концентрируют до кристаллизации. 22
 Получение серебра нитрата 2. Растворяют медносеребряный сплав в азотной кислоте с последующим нагреванием. Ag. Cu + 4 HNO 3 Ag. NO 3 + Cu(NO 3)2 + NO + 2 Н 2 O Cu(NO 3)2 Cu. O + 2 NO + 2 O 2 23
Получение серебра нитрата 2. Растворяют медносеребряный сплав в азотной кислоте с последующим нагреванием. Ag. Cu + 4 HNO 3 Ag. NO 3 + Cu(NO 3)2 + NO + 2 Н 2 O Cu(NO 3)2 Cu. O + 2 NO + 2 O 2 23
 Определение подлинности серебра нитрата 1. (ГФ, ЕР) Ag. NO 3 + НСl Ag. Cl _ + HNO 3 Ag. Cl + NH 3. H 2 O [Ag(NH 3)2]Cl + 2 H 2 O 2. (ГФ) Метод восстановления серебра из аммиачного раствора серебра нитрата при нагревании с раствором формальдегида (реакция образования серебряного зеркала). Ag. NO 3 + 3 NH 3. H 2 O [Ag(NH 3)2]OH + NH 4 NO 3 + 2 H 2 O НСOH +4 [Ag(NH 3)2]OH 4 Ag + (NH 4)2 СО 3+ 6 NH 3 + 2 H 2 O 24
Определение подлинности серебра нитрата 1. (ГФ, ЕР) Ag. NO 3 + НСl Ag. Cl _ + HNO 3 Ag. Cl + NH 3. H 2 O [Ag(NH 3)2]Cl + 2 H 2 O 2. (ГФ) Метод восстановления серебра из аммиачного раствора серебра нитрата при нагревании с раствором формальдегида (реакция образования серебряного зеркала). Ag. NO 3 + 3 NH 3. H 2 O [Ag(NH 3)2]OH + NH 4 NO 3 + 2 H 2 O НСOH +4 [Ag(NH 3)2]OH 4 Ag + (NH 4)2 СО 3+ 6 NH 3 + 2 H 2 O 24
 Нефармакопейная реакция обнаружения серебра Реакция с хромат-ионами. в нейтральной среде (р. Н 6, 5 -7, 5) выпадает осадок хромата серебра кирпично-красного цвета: 2 Ag+ +Cr. O 42 - Ag 2 Cr. O 4 Осадок растворим в растворах кислот и в концентрированном аммиаке: Ag 2 Cr. O 4 + 4 NH 3 [Ag(NH 3)2]2 Cr. O 4 В щелочной среде, выпадет осадок оксида серебра Ag 2 O. В уксуснокислой среде 25 образуется Ag 2 Cr 2 O 7 красно-бурого цвета
Нефармакопейная реакция обнаружения серебра Реакция с хромат-ионами. в нейтральной среде (р. Н 6, 5 -7, 5) выпадает осадок хромата серебра кирпично-красного цвета: 2 Ag+ +Cr. O 42 - Ag 2 Cr. O 4 Осадок растворим в растворах кислот и в концентрированном аммиаке: Ag 2 Cr. O 4 + 4 NH 3 [Ag(NH 3)2]2 Cr. O 4 В щелочной среде, выпадет осадок оксида серебра Ag 2 O. В уксуснокислой среде 25 образуется Ag 2 Cr 2 O 7 красно-бурого цвета
 ОПРЕДЕЛЕНИЕ НИТРАТ-ИОНА 1. (ГФ) по реакции с дифениламином (синее окрашивание). 26
ОПРЕДЕЛЕНИЕ НИТРАТ-ИОНА 1. (ГФ) по реакции с дифениламином (синее окрашивание). 26
 ВР: Нитробензол + серная к-та + нитраты динитробензол. охладить медленно добавить воду + NAOH. + ацетон верхний слой в фиолетовый цвет 27
ВР: Нитробензол + серная к-та + нитраты динитробензол. охладить медленно добавить воду + NAOH. + ацетон верхний слой в фиолетовый цвет 27
 ИСПЫТАНИЯ НА ЧИСТОТУ. По ГФ и ЕР недопустимой примесью являются свинец, медь, висмут ( по ЕР еще алюминий). Определяются одним реактивом - раствором аммиака (ГФ) или концентрированным раствором аммиака (ЕР): А). Белый осадок гидроксида висмута Bi 3+ + 3 NH 3. H 2 O Bi(OH)3 + NH 4+ Белый осадок В). Белый осадок основной соли свинца: Pb. Cl 2 + NH 3. H 2 O [Pb. OH]Cl + NH 4+ Pb Белый осадок С). Cu 2+ + 4 NH 3. H 2 O [Сu(NН 3)4] 2+ + 4 H 2 O комплекс синего цв. D). Белый аморфного осадок гидроксида алюминия: Al 3+ + 3 NH 3. H 2 O Al(OH)3 + 3 NH 4+ Белый осадок 28
ИСПЫТАНИЯ НА ЧИСТОТУ. По ГФ и ЕР недопустимой примесью являются свинец, медь, висмут ( по ЕР еще алюминий). Определяются одним реактивом - раствором аммиака (ГФ) или концентрированным раствором аммиака (ЕР): А). Белый осадок гидроксида висмута Bi 3+ + 3 NH 3. H 2 O Bi(OH)3 + NH 4+ Белый осадок В). Белый осадок основной соли свинца: Pb. Cl 2 + NH 3. H 2 O [Pb. OH]Cl + NH 4+ Pb Белый осадок С). Cu 2+ + 4 NH 3. H 2 O [Сu(NН 3)4] 2+ + 4 H 2 O комплекс синего цв. D). Белый аморфного осадок гидроксида алюминия: Al 3+ + 3 NH 3. H 2 O Al(OH)3 + 3 NH 4+ Белый осадок 28
 Количественное определение серебра нитрата Метод осадительного титрования по Фольгарду (тиоцианатометрия или роданометрия). Титрант - водный раствор тиоцианата аммония NH 4 NCS. Индикатор - железоаммонийный квасцы Fe. NH 4(SO 4)2 в азотнокислой среде. При титровании ЛП выпадает осадок тиоцианата серебра, не ратсворимый в кислой среде : Ag. NO 3 + NH 4 NCS Ag. NCS +NH 4 NO 3 В ТЭ избыток титранта - тиоцианата аммония взаимодействует с индикатором, окрашивая смесь титрования в розовый цвет: 6 NH 4 NCS + Fe. NH 4(SO 4)2 (NH 4)3[Fe(NCS)6] + 2(NH 4)2 SO 4 Красный цвет 29 99. 0 % - 100. 5 %.
Количественное определение серебра нитрата Метод осадительного титрования по Фольгарду (тиоцианатометрия или роданометрия). Титрант - водный раствор тиоцианата аммония NH 4 NCS. Индикатор - железоаммонийный квасцы Fe. NH 4(SO 4)2 в азотнокислой среде. При титровании ЛП выпадает осадок тиоцианата серебра, не ратсворимый в кислой среде : Ag. NO 3 + NH 4 NCS Ag. NCS +NH 4 NO 3 В ТЭ избыток титранта - тиоцианата аммония взаимодействует с индикатором, окрашивая смесь титрования в розовый цвет: 6 NH 4 NCS + Fe. NH 4(SO 4)2 (NH 4)3[Fe(NCS)6] + 2(NH 4)2 SO 4 Красный цвет 29 99. 0 % - 100. 5 %.
 Применение. 1. Серебра нитрат оказывает вяжущее и противовоспалительное действие 2. В концентрированных растворах используется для прижигания ран и язв. ( серебра нитрат в виде палочек, ляписных карандашей (Stillius Argenti nitratis, Stillius Lapidis)). Ляписный карандаш - сплав серебра нитрата с нитратом калия. Раньше ляпис применяли для прижигания при удалении мозолей и бородавок. 1. Наружно при зрозиях, язвах, трещинах, остром конъюнктивите, трахоме. Назначают в виде водных растворов (2 -10%), мазей (1— 2%), 30
Применение. 1. Серебра нитрат оказывает вяжущее и противовоспалительное действие 2. В концентрированных растворах используется для прижигания ран и язв. ( серебра нитрат в виде палочек, ляписных карандашей (Stillius Argenti nitratis, Stillius Lapidis)). Ляписный карандаш - сплав серебра нитрата с нитратом калия. Раньше ляпис применяли для прижигания при удалении мозолей и бородавок. 1. Наружно при зрозиях, язвах, трещинах, остром конъюнктивите, трахоме. Назначают в виде водных растворов (2 -10%), мазей (1— 2%), 30
 • 4. Раньше назначали внутрь в виде 0, 05% раствора при язвенной болезни желудка и хроническом гастрите. • 5. Применяют для профилактики бленнореи у новорожденных. • Высшая разовая доза для взрослых - 0, 03 г, суточная — 0, 1 г. ХРАНЕНИЕ Ø Все соли серебра ядовиты. Ø В хорошо укупоренных банках с притертой пробкой в защищенном от света месте. Ø Карандаши ляписные – в пеналах из полиэтилена в прохладном, защищенном от света месте. 31
• 4. Раньше назначали внутрь в виде 0, 05% раствора при язвенной болезни желудка и хроническом гастрите. • 5. Применяют для профилактики бленнореи у новорожденных. • Высшая разовая доза для взрослых - 0, 03 г, суточная — 0, 1 г. ХРАНЕНИЕ Ø Все соли серебра ядовиты. Ø В хорошо укупоренных банках с притертой пробкой в защищенном от света месте. Ø Карандаши ляписные – в пеналах из полиэтилена в прохладном, защищенном от света месте. 31
 Коллоидные препараты серебра. - Колларгол (Collargolum), Синонимы: Ø серебро коллоидное, Ø Argentum colloidale; Ø SILVER, COLLOIDAL, FOR EXTERNAL USE(ЕР) -Протаргол (Protargolum), Синонимы: Ø Argentum proteinicum. Ø Серебра протеинат (Silver proteinate) 32
Коллоидные препараты серебра. - Колларгол (Collargolum), Синонимы: Ø серебро коллоидное, Ø Argentum colloidale; Ø SILVER, COLLOIDAL, FOR EXTERNAL USE(ЕР) -Протаргол (Protargolum), Синонимы: Ø Argentum proteinicum. Ø Серебра протеинат (Silver proteinate) 32
 • КОЛЛАРГОЛ (70% Ag в виде коллоидных КОЛЛАРГОЛ частиц, стабилизированных гидролизатом казеина) • ПРОТАРГОЛ (8 % Ag 2 О в виде коллоидных ПРОТАРГОЛ частиц, стабилизированных гидролизатом желатина). • При действии света окись серебра в протарголе разрушается, превращаясь в металлическое серебро, поэтому на свету растворы протаргола быстро темнеют. 33
• КОЛЛАРГОЛ (70% Ag в виде коллоидных КОЛЛАРГОЛ частиц, стабилизированных гидролизатом казеина) • ПРОТАРГОЛ (8 % Ag 2 О в виде коллоидных ПРОТАРГОЛ частиц, стабилизированных гидролизатом желатина). • При действии света окись серебра в протарголе разрушается, превращаясь в металлическое серебро, поэтому на свету растворы протаргола быстро темнеют. 33
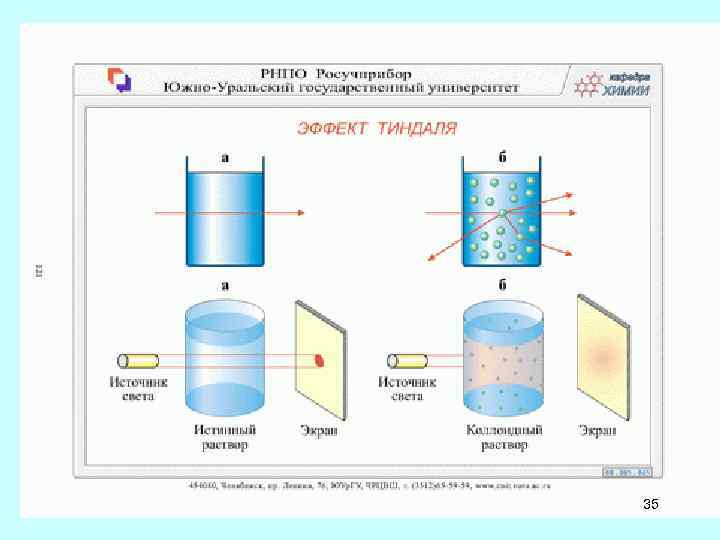
 • Коллоидные системы — дисперсные системы. Коллоидные системы Размеры коллоидных частиц варьируют в пределах от 10− 7 до 10− 5 см. • Основные свойства Ø Коллоидные частицы не препятствуют прохождению света. Ø В прозрачных коллоидах наблюдается рассеивание светового луча (эффект Тиндаля - рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося конуса). Ø Дисперсные частицы не выпадают в осадок. 34
• Коллоидные системы — дисперсные системы. Коллоидные системы Размеры коллоидных частиц варьируют в пределах от 10− 7 до 10− 5 см. • Основные свойства Ø Коллоидные частицы не препятствуют прохождению света. Ø В прозрачных коллоидах наблюдается рассеивание светового луча (эффект Тиндаля - рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося конуса). Ø Дисперсные частицы не выпадают в осадок. 34
 35
35
 • Принцип «защиты» коллоидов заключается в сочетании коллоида гидрофобного вещества, с высокомолекулярными веществами, обладающими высокими гидрофильными свойствами. • Связь между гидрофобными и гидрофильными компонентами достигается за счет адсорбции высокомолекулярных соединений на коллоидных частицах. • Адсорбируясь на коллоидных частицах, высокомолекулярные соединения уменьшают поверхностную энергию и способствуют агрегативной устойчивости коллоидной, системы. 36
• Принцип «защиты» коллоидов заключается в сочетании коллоида гидрофобного вещества, с высокомолекулярными веществами, обладающими высокими гидрофильными свойствами. • Связь между гидрофобными и гидрофильными компонентами достигается за счет адсорбции высокомолекулярных соединений на коллоидных частицах. • Адсорбируясь на коллоидных частицах, высокомолекулярные соединения уменьшают поверхностную энергию и способствуют агрегативной устойчивости коллоидной, системы. 36
 Способ получения колларгола: • 1. К казеину (основной белок молока. Присутствует в молоке в виде казеината кальция) или альбумину прибавляют 20%-ный водный раствор Na. OH и нагревают до образования гидролизата казеина (смесь натриевых солей лизальбиновой и протальбиновой кислот). • Эта смесь обладает двумя ценными свойствами – Ø способностью восстанавливать металлы из их соединений Ø сильным защитным действием, что позволяет в большинстве случаев получать коллоидные металлы в высокодисперсном и устойчивом состоянии. смесь натриевых солей БЕЛОК Na. OH ЛИЗАЛЬБИНОВОЙ и ПРОТАЛЬБИНОВОЙ К-Т 37
Способ получения колларгола: • 1. К казеину (основной белок молока. Присутствует в молоке в виде казеината кальция) или альбумину прибавляют 20%-ный водный раствор Na. OH и нагревают до образования гидролизата казеина (смесь натриевых солей лизальбиновой и протальбиновой кислот). • Эта смесь обладает двумя ценными свойствами – Ø способностью восстанавливать металлы из их соединений Ø сильным защитным действием, что позволяет в большинстве случаев получать коллоидные металлы в высокодисперсном и устойчивом состоянии. смесь натриевых солей БЕЛОК Na. OH ЛИЗАЛЬБИНОВОЙ и ПРОТАЛЬБИНОВОЙ К-Т 37
 2. К водному раствору нитрата серебра прибавляют 20%- ный водный раствор едкого натра до количественного выделения осадка окиси серебра. Ag. NO 3 + Na. OH Ag. OH + Na. NO 3 2 Ag. OH Ag 2 O + H 2 O 3. К окиси серебра прибавляют раствор гидролизата казеина и нагревают при перемешивании. Ag 2 O + лизальбинат натрия Ag (протальбинат натрия) 4. Очищают препараты от примесей ионов серебра (нитрат-ионов и щелочей путём диализа. Затем выпаривают в вакууме при 30 -40 о. С до получения сухого геля и измельчают. Сухой гель содержит не менее 70% коллоидного серебра. 38
2. К водному раствору нитрата серебра прибавляют 20%- ный водный раствор едкого натра до количественного выделения осадка окиси серебра. Ag. NO 3 + Na. OH Ag. OH + Na. NO 3 2 Ag. OH Ag 2 O + H 2 O 3. К окиси серебра прибавляют раствор гидролизата казеина и нагревают при перемешивании. Ag 2 O + лизальбинат натрия Ag (протальбинат натрия) 4. Очищают препараты от примесей ионов серебра (нитрат-ионов и щелочей путём диализа. Затем выпаривают в вакууме при 30 -40 о. С до получения сухого геля и измельчают. Сухой гель содержит не менее 70% коллоидного серебра. 38
 • Способ получения протаргола : • 1. Набухший желатин (продукт переработки соединительной ткани животных) гидролизуют в воде при 1, 5 -2 атм при 130 o. C до получения жидкого раствора желатозы. 2. Раствор желатозы упаривают и обрабатывают раствором Na. OH при 80 -85 o. C до прекращения выделения аммиака. 3. Затем упаривают до плотности 1, 12 г/см 3 и фильтруют. 4. К фильтрату добавляют водный раствор нитрата серебра и при 65 -70 o. C получают коллоидную окись серебра, стабиллизированную гидролизатором желатозы. 5. Водный раствор сушат. 39
• Способ получения протаргола : • 1. Набухший желатин (продукт переработки соединительной ткани животных) гидролизуют в воде при 1, 5 -2 атм при 130 o. C до получения жидкого раствора желатозы. 2. Раствор желатозы упаривают и обрабатывают раствором Na. OH при 80 -85 o. C до прекращения выделения аммиака. 3. Затем упаривают до плотности 1, 12 г/см 3 и фильтруют. 4. К фильтрату добавляют водный раствор нитрата серебра и при 65 -70 o. C получают коллоидную окись серебра, стабиллизированную гидролизатором желатозы. 5. Водный раствор сушат. 39
 • Протаргол представляет собой коллоидную окись Протаргол серебра, защищенную щелочным (натриевым) альбуминатом. Препарат содержит около 8% серебра; 90% протаргола составляет защитный коллоид. 40
• Протаргол представляет собой коллоидную окись Протаргол серебра, защищенную щелочным (натриевым) альбуминатом. Препарат содержит около 8% серебра; 90% протаргола составляет защитный коллоид. 40
 ОПИСАНИЕ И СВОЙСТВА КОЛЛАРГОЛА. Зеленовато-черные или синевато-черные пластинки с металлическим блеском. Растворим в воде с образованием коллоидного раствора (1: 50), который при разбавлении водой (1: 2000) имеет коричневый или красновато-бурый оттенок. Р-р прозрачен в проходящем и опалесцирует в отраженном свете. Практически не растворим в спирте. ОПИСАНИЕ И СВОЙСТВА ПРОТАРГОЛА. Коричнево-жёлтый или коричневый лёгкий порошок без запаха, слабогорького и слегка вяжущего вкуса, слегка гигроскопичен. Протаргол изменяется под действием света. Легко растворим в воде, практически нерастворим в этаноле и хлороформе. 41
ОПИСАНИЕ И СВОЙСТВА КОЛЛАРГОЛА. Зеленовато-черные или синевато-черные пластинки с металлическим блеском. Растворим в воде с образованием коллоидного раствора (1: 50), который при разбавлении водой (1: 2000) имеет коричневый или красновато-бурый оттенок. Р-р прозрачен в проходящем и опалесцирует в отраженном свете. Практически не растворим в спирте. ОПИСАНИЕ И СВОЙСТВА ПРОТАРГОЛА. Коричнево-жёлтый или коричневый лёгкий порошок без запаха, слабогорького и слегка вяжущего вкуса, слегка гигроскопичен. Протаргол изменяется под действием света. Легко растворим в воде, практически нерастворим в этаноле и хлороформе. 41
 Колларгол. ПОДЛИННОСТЬ (ЕР) • 1. Биуретовая реакция с меди сульфатом и натрия гидроксидом): появляется фиолетовая окраска 42
Колларгол. ПОДЛИННОСТЬ (ЕР) • 1. Биуретовая реакция с меди сульфатом и натрия гидроксидом): появляется фиолетовая окраска 42
 • 2. К 1 мл 2, 5% раствора ЛС в воде добавляют 2 мл Na. Cl. Образуется осадок, который растворяется в избытке воды. (Коагуляция под действием электролита Na. Cl) • Броуновское движение частиц коллоида, приводит к их столкновению, но не к их слиянию, т. к. внешний высокомолекулярный слой препятствует этому. Электролиты (Na. Cl) разрушают и деформируют этот слой. • Коагуляция идет с заметной скоростью лишь при концентрации электролита, превышающей некоторое критическое значение, называемое порогом коагуляции. . 43
• 2. К 1 мл 2, 5% раствора ЛС в воде добавляют 2 мл Na. Cl. Образуется осадок, который растворяется в избытке воды. (Коагуляция под действием электролита Na. Cl) • Броуновское движение частиц коллоида, приводит к их столкновению, но не к их слиянию, т. к. внешний высокомолекулярный слой препятствует этому. Электролиты (Na. Cl) разрушают и деформируют этот слой. • Коагуляция идет с заметной скоростью лишь при концентрации электролита, превышающей некоторое критическое значение, называемое порогом коагуляции. . 43
 • 3. Прокаливают 0. 05 г ЛС. Растворяют остаток в 10 мл азотной кислоты. Фильтрат дает реакции на ион серебра • Ag + 2 HNO 3 Ag NO 3 + NO 2 + H 2 O • Ag+ + Cl- Ag. Cl 44
• 3. Прокаливают 0. 05 г ЛС. Растворяют остаток в 10 мл азотной кислоты. Фильтрат дает реакции на ион серебра • Ag + 2 HNO 3 Ag NO 3 + NO 2 + H 2 O • Ag+ + Cl- Ag. Cl 44
 1. 2. 3. 4. • ЧИСТОТА Недопустимая примесь: ионы серебра (с HCl) Потеря в весе при высушивании при 80 о. С – не Потеря в весе более 8% Не растворимые в воде вещества – не более Не растворимые в воде вещества 1% Чувствительность к электролитам. 0, 1% Чувствительность к электролитам раствор ЛС в воде. Переносят раствор в тесттрубку. В горизантальном положении раствор кажется прозрачным, красно-коричневым, в красно-коричневым вертикальном - мутным с желеноватокоричневой флуоресценцией. К 5 мл раствора флуоресценцией добавляем 0, 05% раствор натрия хлорида И энергично смешиваем. В горизантальном положении раствор остается прозрачным, 45 красно-коричневым
1. 2. 3. 4. • ЧИСТОТА Недопустимая примесь: ионы серебра (с HCl) Потеря в весе при высушивании при 80 о. С – не Потеря в весе более 8% Не растворимые в воде вещества – не более Не растворимые в воде вещества 1% Чувствительность к электролитам. 0, 1% Чувствительность к электролитам раствор ЛС в воде. Переносят раствор в тесттрубку. В горизантальном положении раствор кажется прозрачным, красно-коричневым, в красно-коричневым вертикальном - мутным с желеноватокоричневой флуоресценцией. К 5 мл раствора флуоресценцией добавляем 0, 05% раствор натрия хлорида И энергично смешиваем. В горизантальном положении раствор остается прозрачным, 45 красно-коричневым
 • Количественное определение –метод Количественное определение Фольгарда: после минерализации ЛC путем прокаливания и последующего кипячения с азотной кислотой. Ø Титрант 0. 1 M аммония тиоцианат Ø Индикатор желепза сульфат Ø В т. э. – появляется красно-коричневое окрашивание. • В ЛС 70. 0 % - 80. 0 %Ag в пересчете на сухую субстанцию 46
• Количественное определение –метод Количественное определение Фольгарда: после минерализации ЛC путем прокаливания и последующего кипячения с азотной кислотой. Ø Титрант 0. 1 M аммония тиоцианат Ø Индикатор желепза сульфат Ø В т. э. – появляется красно-коричневое окрашивание. • В ЛС 70. 0 % - 80. 0 %Ag в пересчете на сухую субстанцию 46
 • • Протаргол JP 15: “Silver Protein” р. Н 10% раствора 7, 0 -10, 5 Мало гидроскопичен Подлинность: 1. Биуретовая реакция: К 1% р-ру добавить 8% HCl трясти 5 мин, отфильтровать. К фильтрату + 10% Na. OH и 8% Cu. SO 4 развивается фиолетовая окраска 47
• • Протаргол JP 15: “Silver Protein” р. Н 10% раствора 7, 0 -10, 5 Мало гидроскопичен Подлинность: 1. Биуретовая реакция: К 1% р-ру добавить 8% HCl трясти 5 мин, отфильтровать. К фильтрату + 10% Na. OH и 8% Cu. SO 4 развивается фиолетовая окраска 47
 • 2. К 1% р-ру добавить по каплям железа хлорида (III): окраска исчезает и постепенно формируется осадок. • 3. Прокаливают 0, 2 г ЛС. Растворяют остаток в 1 мл азотной кислоты при нагревании, добавляют 10 мл воды. Раствор дает реакции на ион серебра 48
• 2. К 1% р-ру добавить по каплям железа хлорида (III): окраска исчезает и постепенно формируется осадок. • 3. Прокаливают 0, 2 г ЛС. Растворяют остаток в 1 мл азотной кислоты при нагревании, добавляют 10 мл воды. Раствор дает реакции на ион серебра 48
 • • Чистота: Недопустимая примесь: Соли серебра Растворяют 0, 1 г ЛС в 10 мл воды, фильтруют. К фильтрату добавляют калия хромат. Не должно быть помутнения раствора. 2 Ag+ +Cr. O 42 - Ag 2 Cr. O 4 Количественное определение –метод Количественное определение Фольгарда: после минерализации ЛC путем кипячения с серной кислотой и последующего нагревания с азотной кислотой. 49 В ЛС 7. 5 % - 8. 5 % Ag
• • Чистота: Недопустимая примесь: Соли серебра Растворяют 0, 1 г ЛС в 10 мл воды, фильтруют. К фильтрату добавляют калия хромат. Не должно быть помутнения раствора. 2 Ag+ +Cr. O 42 - Ag 2 Cr. O 4 Количественное определение –метод Количественное определение Фольгарда: после минерализации ЛC путем кипячения с серной кислотой и последующего нагревания с азотной кислотой. 49 В ЛС 7. 5 % - 8. 5 % Ag
 ХРАНЕНИЕ. Коллоидные препараты серебра хранят в хорошо укупоренных банках оранжевого стекла в защищённом от света месте, чтобы не допустить разложения с образованием ионов серебра 50
ХРАНЕНИЕ. Коллоидные препараты серебра хранят в хорошо укупоренных банках оранжевого стекла в защищённом от света месте, чтобы не допустить разложения с образованием ионов серебра 50
 Протаргол применяют: Протаргол применяют Ø для смазывания слизистых оболочек верхних дыхательных путей (1 -5%), Ø 1 -5% растворы для промывания мочевого пузыря при хроническом уретрите, Ø 1 -3% растворы в виде глазных капель для лечения конъюнктивитов и бленнореи. Ø Раньше назначали внутрь при язве желудка в пилюлях по 0, 1 г. 51
Протаргол применяют: Протаргол применяют Ø для смазывания слизистых оболочек верхних дыхательных путей (1 -5%), Ø 1 -5% растворы для промывания мочевого пузыря при хроническом уретрите, Ø 1 -3% растворы в виде глазных капель для лечения конъюнктивитов и бленнореи. Ø Раньше назначали внутрь при язве желудка в пилюлях по 0, 1 г. 51
 • Колларгол применяют: • 0. 2 -1% растворы для промывания гнойных ран; • 1 -2% растворы для промывания мочевого пузыря при хронических циститах и уретритах, • 2 -3 -5% растворы в виде глазных капель для лечения гнойных конъюнктивитов и бленнореи. • При рожистых воспалениях назначают иногда 15% мази. 52
• Колларгол применяют: • 0. 2 -1% растворы для промывания гнойных ран; • 1 -2% растворы для промывания мочевого пузыря при хронических циститах и уретритах, • 2 -3 -5% растворы в виде глазных капель для лечения гнойных конъюнктивитов и бленнореи. • При рожистых воспалениях назначают иногда 15% мази. 52
 ПРЕПАРАТЫ СЕРЕБРА 1. Препарат «Повиаргол» содержит 7 -8% металлического серебра в виде высокодисперсных частиц, адсорбированных поливинилпирролидоном. Повиаргол обладает широким спектром антимикробного действия в отношении грамм-положительных и грамм-отрицательных бактерий, в том числе устойчивых к антибиотикам. К препарату чувствительны золотистый стафилококк, синегнойная палочка, протей, сальмонелла и др. 2. Сульфазина серебряная соль (сульфаргин, ), который сочетает антибактериальное действие серебра и сульфаниламидного препарата и используется для лечения инфицированных ран в виде 1% мази: 53
ПРЕПАРАТЫ СЕРЕБРА 1. Препарат «Повиаргол» содержит 7 -8% металлического серебра в виде высокодисперсных частиц, адсорбированных поливинилпирролидоном. Повиаргол обладает широким спектром антимикробного действия в отношении грамм-положительных и грамм-отрицательных бактерий, в том числе устойчивых к антибиотикам. К препарату чувствительны золотистый стафилококк, синегнойная палочка, протей, сальмонелла и др. 2. Сульфазина серебряная соль (сульфаргин, ), который сочетает антибактериальное действие серебра и сульфаниламидного препарата и используется для лечения инфицированных ран в виде 1% мази: 53
 РОССИЙСКАЯ АКАДЕМИЯ НАУК ИНСТИТУТ ЭНЕРГЕТИЧЕСКИХ ПРОБЛЕМ ХИМИЧЕСКОЙ ФИЗИКИ РАН г. МОСКВА 54
РОССИЙСКАЯ АКАДЕМИЯ НАУК ИНСТИТУТ ЭНЕРГЕТИЧЕСКИХ ПРОБЛЕМ ХИМИЧЕСКОЙ ФИЗИКИ РАН г. МОСКВА 54
 ИСПОЛЬЗОВАНИЯ НАНОЧАСТИЦ МЕТАЛЛОВ В БИОЛОГИИ И ФАРМАЦИИ Отсутствие или недостаток металлов в организме приводит к нарушению всех жизненно важных функций и возникновению целого ряда патологий. Например: • при недостатке кобальта, меди, цинка, железа к развитию анемии; • при недостатке марганца и цинка – к деформации суставов, повреждению кожи, ухудшению аппетита; • при дефиците меди – к возникновению раковых заболеваний. Коррекцию микроэлементного обмена в клинике проводят: органическими, неорганическими солями и координационными соединениями металлов. Мы предложили металлотерапию проводить 55 металлами-микроэлементами в виде наночастиц.
ИСПОЛЬЗОВАНИЯ НАНОЧАСТИЦ МЕТАЛЛОВ В БИОЛОГИИ И ФАРМАЦИИ Отсутствие или недостаток металлов в организме приводит к нарушению всех жизненно важных функций и возникновению целого ряда патологий. Например: • при недостатке кобальта, меди, цинка, железа к развитию анемии; • при недостатке марганца и цинка – к деформации суставов, повреждению кожи, ухудшению аппетита; • при дефиците меди – к возникновению раковых заболеваний. Коррекцию микроэлементного обмена в клинике проводят: органическими, неорганическими солями и координационными соединениями металлов. Мы предложили металлотерапию проводить 55 металлами-микроэлементами в виде наночастиц.
 Ø Основные особенности биологического действия наночастиц металлов на организм наночастицы металлов в 7 -50 раз менее токсичны, чем в ионной форме; Ø наночастицы оказывают пролонгированное действие, благодаря своей способности осуществлять роль депо элементов в организме; Ø наночастицы, введенные в биотических дозах, стимулируют обмен веществ; Ø наночастицы обладают многофункциональным действием; Ø наночастицы действуют на уровне ферментов, регуляторных биосистем, клетки, органа, организма в целом. 56
Ø Основные особенности биологического действия наночастиц металлов на организм наночастицы металлов в 7 -50 раз менее токсичны, чем в ионной форме; Ø наночастицы оказывают пролонгированное действие, благодаря своей способности осуществлять роль депо элементов в организме; Ø наночастицы, введенные в биотических дозах, стимулируют обмен веществ; Ø наночастицы обладают многофункциональным действием; Ø наночастицы действуют на уровне ферментов, регуляторных биосистем, клетки, органа, организма в целом. 56
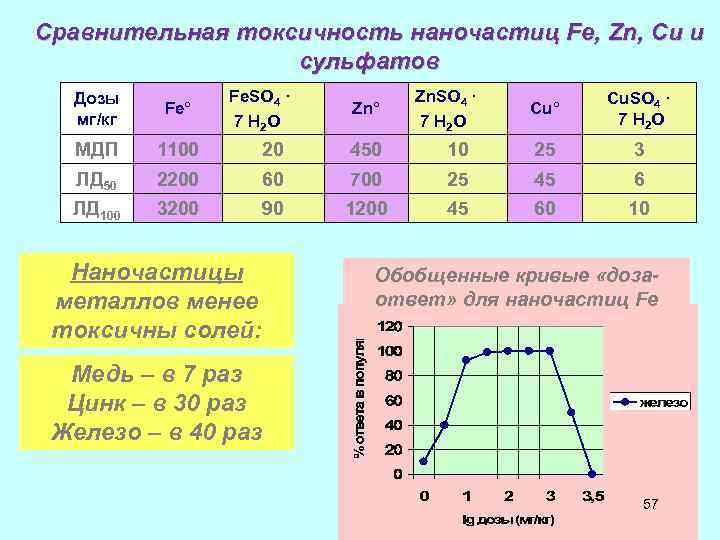 Сравнительная токсичность наночастиц Fe, Zn, Cu и сульфатов Fe. SO 4 · 7 H 2 O Дозы мг/кг Fe° МДП 1100 20 450 ЛД 50 2200 60 ЛД 100 3200 90 Наночастицы металлов менее токсичны солей: Zn. SO 4 · 7 H 2 O Cu° Cu. SO 4 · 7 H 2 O 10 25 3 700 25 45 6 1200 45 60 10 Zn° Обобщенные кривые «дозаответ» для наночастиц Fe Медь – в 7 раз Цинк – в 30 раз Железо – в 40 раз 57
Сравнительная токсичность наночастиц Fe, Zn, Cu и сульфатов Fe. SO 4 · 7 H 2 O Дозы мг/кг Fe° МДП 1100 20 450 ЛД 50 2200 60 ЛД 100 3200 90 Наночастицы металлов менее токсичны солей: Zn. SO 4 · 7 H 2 O Cu° Cu. SO 4 · 7 H 2 O 10 25 3 700 25 45 6 1200 45 60 10 Zn° Обобщенные кривые «дозаответ» для наночастиц Fe Медь – в 7 раз Цинк – в 30 раз Железо – в 40 раз 57
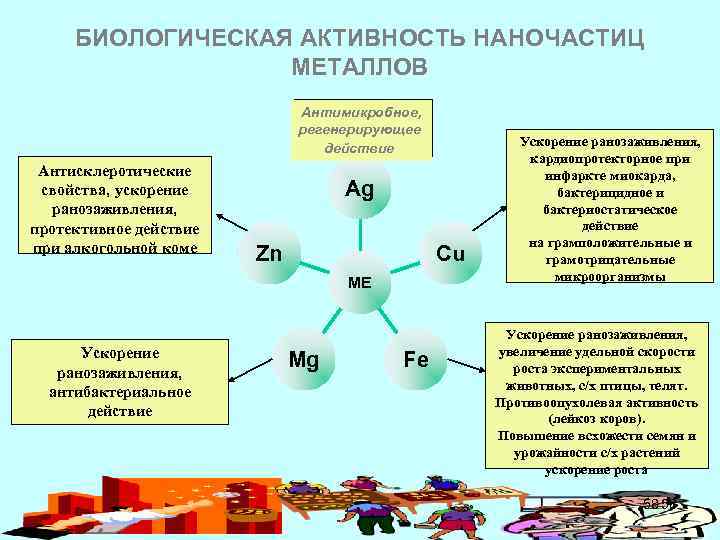 БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ НАНОЧАСТИЦ МЕТАЛЛОВ Антимикробное, регенерирующее действие Антисклеротические свойства, ускорение ранозаживления, протективное действие при алкогольной коме Ag Cu Zn МЕ Ускорение ранозаживления, антибактериальное действие Mg Fe Ускорение ранозаживления, кардиопротекторное при инфаркте миокарда, бактерицидное и бактериостатическое действие на грамположительные и грамотрицательные микроорганизмы Ускорение ранозаживления, увеличение удельной скорости роста экспериментальных животных, с/х птицы, телят. Противоопухолевая активность (лейкоз коров). Повышение всхожести семян и урожайности с/х растений ускорение роста 58 58
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ НАНОЧАСТИЦ МЕТАЛЛОВ Антимикробное, регенерирующее действие Антисклеротические свойства, ускорение ранозаживления, протективное действие при алкогольной коме Ag Cu Zn МЕ Ускорение ранозаживления, антибактериальное действие Mg Fe Ускорение ранозаживления, кардиопротекторное при инфаркте миокарда, бактерицидное и бактериостатическое действие на грамположительные и грамотрицательные микроорганизмы Ускорение ранозаживления, увеличение удельной скорости роста экспериментальных животных, с/х птицы, телят. Противоопухолевая активность (лейкоз коров). Повышение всхожести семян и урожайности с/х растений ускорение роста 58 58
 Патенты на антимикробные и ранозаживляющие лекарственные средства на основе наночастиц меди В разработках участвовали: Н. Н. Глущенко, О. А. Богословская, А. А. Рахметова, М. Н. Овсянникова, И. П. Ольховская, А. Н. Жигач 59 59
Патенты на антимикробные и ранозаживляющие лекарственные средства на основе наночастиц меди В разработках участвовали: Н. Н. Глущенко, О. А. Богословская, А. А. Рахметова, М. Н. Овсянникова, И. П. Ольховская, А. Н. Жигач 59 59
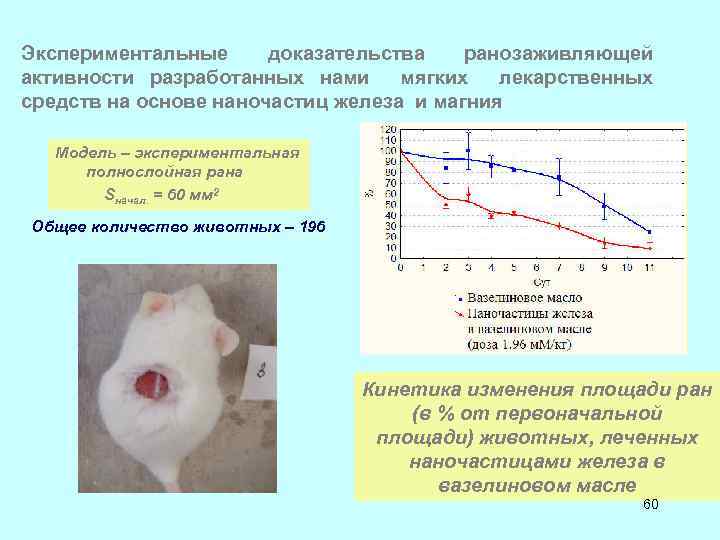 Экспериментальные доказательства ранозаживляющей активности разработанных нами мягких лекарственных средств на основе наночастиц железа и магния Модель – экспериментальная полнослойная рана Sначал. = 60 мм 2 Общее количество животных – 196 Кинетика изменения площади ран (в % от первоначальной площади) животных, леченных наночастицами железа в вазелиновом масле 60
Экспериментальные доказательства ранозаживляющей активности разработанных нами мягких лекарственных средств на основе наночастиц железа и магния Модель – экспериментальная полнослойная рана Sначал. = 60 мм 2 Общее количество животных – 196 Кинетика изменения площади ран (в % от первоначальной площади) животных, леченных наночастицами железа в вазелиновом масле 60
 ЭЛЕКТРОННОМИКРОСКОПИЧЕСКИЙ АНАЛИЗ БИОЛОГИЧЕСКИ АКТИВНЫХ НАНОЧАСТИЦ меди ( ПЭМ, СЭМ) 61 61
ЭЛЕКТРОННОМИКРОСКОПИЧЕСКИЙ АНАЛИЗ БИОЛОГИЧЕСКИ АКТИВНЫХ НАНОЧАСТИЦ меди ( ПЭМ, СЭМ) 61 61
 ЭЛЕКТРОННОМИКРОСКОПИЧЕСКИЙ АНАЛИЗ БИОЛОГИЧЕСКИ АКТИВНЫХ НАНОЧАСТИЦ МАГНИЯ ( РЭМ, СЭМ) 62 62
ЭЛЕКТРОННОМИКРОСКОПИЧЕСКИЙ АНАЛИЗ БИОЛОГИЧЕСКИ АКТИВНЫХ НАНОЧАСТИЦ МАГНИЯ ( РЭМ, СЭМ) 62 62
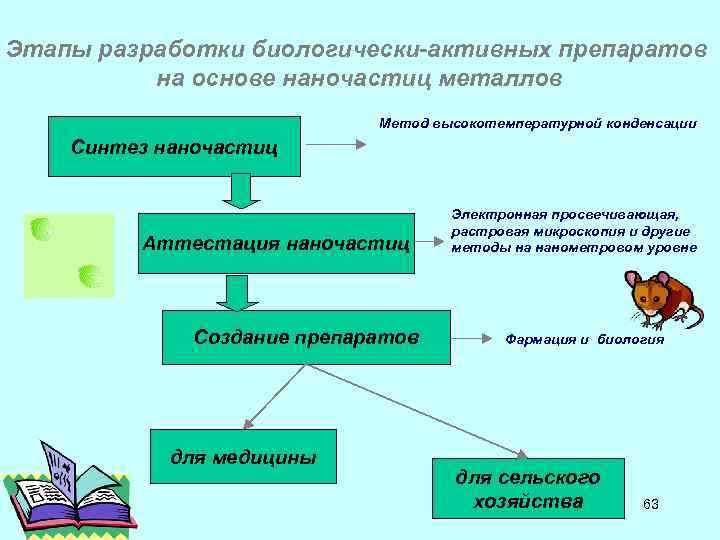 Этапы разработки биологически-активных препаратов на основе наночастиц металлов Метод высокотемпературной конденсации Синтез наночастиц Аттестация наночастиц Создание препаратов для медицины Электронная просвечивающая, растровая микроскопия и другие методы на нанометровом уровне Фармация и биология для сельского хозяйства 63
Этапы разработки биологически-активных препаратов на основе наночастиц металлов Метод высокотемпературной конденсации Синтез наночастиц Аттестация наночастиц Создание препаратов для медицины Электронная просвечивающая, растровая микроскопия и другие методы на нанометровом уровне Фармация и биология для сельского хозяйства 63
 «ЛС на основе d-элементов IIБ группы ПСЭ» 64 64
«ЛС на основе d-элементов IIБ группы ПСЭ» 64 64
 d-элементы IIБ группы ПСЭ: Ø ЦИНК Ø КАДМИЙ Ø РТУТЬ Ø Строение внешних электронных оболочек атомов d-элементов описывается общей формулой (n-1)dansb, a=1 10, b=1 2. Предпоследний электронный слой dэлементов II группы состоит из 18 электронов, что определяет его высокую стабильность и особенности химических свойств этих элементов 65
d-элементы IIБ группы ПСЭ: Ø ЦИНК Ø КАДМИЙ Ø РТУТЬ Ø Строение внешних электронных оболочек атомов d-элементов описывается общей формулой (n-1)dansb, a=1 10, b=1 2. Предпоследний электронный слой dэлементов II группы состоит из 18 электронов, что определяет его высокую стабильность и особенности химических свойств этих элементов 65
 Общая характеристика d-элементов IIБ группы ØХарактерно комплексообразование за счет свободных орбиталей ионов металлов и за счет неподеленных пар d-электронов (n-1)слоя. – Координационное число цинка 4 (очень редко – 6) K 2 Zn(OH)4 – Кадмия – 4 и 6 - Cd(NH 3)6 Cl 2 – Ртути - 4 - K 2 Hg. J 4 66 66
Общая характеристика d-элементов IIБ группы ØХарактерно комплексообразование за счет свободных орбиталей ионов металлов и за счет неподеленных пар d-электронов (n-1)слоя. – Координационное число цинка 4 (очень редко – 6) K 2 Zn(OH)4 – Кадмия – 4 и 6 - Cd(NH 3)6 Cl 2 – Ртути - 4 - K 2 Hg. J 4 66 66
 Кадмий Cd открыт в 1817 г. немецким Cd химиком Ф. Штромейером— элемент II гр. ПСЭ; ат. н. 48, атомная масса =112, 40; серебристо-белый металл; Ø Токсичный микроэлемент, один из основных поллютантов окружающей среды. Ø В организм взрослого человека в течение суток поступает до 20 мкг кадмия. Ø Пищевые источники кадмия: морепродукты (особенно мидии и устрицы), злаки (зерновые) 67 и листовые овощи.
Кадмий Cd открыт в 1817 г. немецким Cd химиком Ф. Штромейером— элемент II гр. ПСЭ; ат. н. 48, атомная масса =112, 40; серебристо-белый металл; Ø Токсичный микроэлемент, один из основных поллютантов окружающей среды. Ø В организм взрослого человека в течение суток поступает до 20 мкг кадмия. Ø Пищевые источники кадмия: морепродукты (особенно мидии и устрицы), злаки (зерновые) 67 и листовые овощи.
 Ø Дефицит кадмия в организме может развиться при недостаточном поступлении этого элемента (менее 0, 5 мкг/сутки), а порог токсичности равен 30 мкг/сутки Ø В организме человека кадмий аккумулируется в основном в почках, печени и двенадцатиперстной кишке. С печени и двенадцатиперстной кишке возрастом содержание кадмия в организме увеличивается, особенно у мужчин. Средняя концентрация кадмия у мужчин в почках 44 мкг/г, печени – 4, 2 мкг/г. 68
Ø Дефицит кадмия в организме может развиться при недостаточном поступлении этого элемента (менее 0, 5 мкг/сутки), а порог токсичности равен 30 мкг/сутки Ø В организме человека кадмий аккумулируется в основном в почках, печени и двенадцатиперстной кишке. С печени и двенадцатиперстной кишке возрастом содержание кадмия в организме увеличивается, особенно у мужчин. Средняя концентрация кадмия у мужчин в почках 44 мкг/г, печени – 4, 2 мкг/г. 68
 Ø Физиологическая роль кадмия изучена недостаточно. Кадмий обнаруживается в составе "металлотионеина" – белка, металлотионеина связывающего и транспортирующего тяжелые металлы. Ø In vitro кадмий активирует несколько цинкзависимых ферментов (триптофан ферментов оксигеназу, карбоксипептидазу). Однако ферментов, которые бы активировались только кадмием, не обнаружено. Ø Токсическая доза для человека: 3 -330 мг. Ø Летальная доза для человека: 1, 5 -9 г 69
Ø Физиологическая роль кадмия изучена недостаточно. Кадмий обнаруживается в составе "металлотионеина" – белка, металлотионеина связывающего и транспортирующего тяжелые металлы. Ø In vitro кадмий активирует несколько цинкзависимых ферментов (триптофан ферментов оксигеназу, карбоксипептидазу). Однако ферментов, которые бы активировались только кадмием, не обнаружено. Ø Токсическая доза для человека: 3 -330 мг. Ø Летальная доза для человека: 1, 5 -9 г 69
 Ø Основные проявления дефицита кадмия: замедление роста (при экспериментальном дефиците кадмия у лабораторных животных). Ø Повышенное содержание кадмия в организме: Описано массовое отравление кадмием жителей Японии, вызвавшее остеомаляцию, нефропатию, болезненность и переломы костей, получившее название "болезни «Итай» ( «болезнь „ой-ой больно“» ): очень сильная боль в костях, суставах и 70 позвоночнике
Ø Основные проявления дефицита кадмия: замедление роста (при экспериментальном дефиците кадмия у лабораторных животных). Ø Повышенное содержание кадмия в организме: Описано массовое отравление кадмием жителей Японии, вызвавшее остеомаляцию, нефропатию, болезненность и переломы костей, получившее название "болезни «Итай» ( «болезнь „ой-ой больно“» ): очень сильная боль в костях, суставах и 70 позвоночнике
 Ø При хроническом кадмиозе: v в первую очередь поражаются мочевыводящая и половая системы. v Поражение бронхолегочной системы. v Отмечаются остеопластические и остеопорозные изменения костной ткани. Ø Выкуривание всего одной сигареты увеличивает поступление кадмия в организм на 0, 1 мкг. Доказана роль кадмия в индукции рака легких и рака почек у курящих, развитии патологии предстательной железы. 71
Ø При хроническом кадмиозе: v в первую очередь поражаются мочевыводящая и половая системы. v Поражение бронхолегочной системы. v Отмечаются остеопластические и остеопорозные изменения костной ткани. Ø Выкуривание всего одной сигареты увеличивает поступление кадмия в организм на 0, 1 мкг. Доказана роль кадмия в индукции рака легких и рака почек у курящих, развитии патологии предстательной железы. 71
 Ø При остром и хроническом отравлении кадмием назначают комплексообразователи (Ca. Na 2 ЭДТА), в комбинации с гемодиализом и введением глютатиона, а также симптоматические средства - диуретики, стероиды и пр. Ø Гомеопатическое ЛС: CADMIUM ЛС: SULFURICUM — КАДМИУМ СУЛЬФУРИКУМ v Исходное вещество. Сульфат кадмия 3 Cd. SO 48 H 2 O. 72
Ø При остром и хроническом отравлении кадмием назначают комплексообразователи (Ca. Na 2 ЭДТА), в комбинации с гемодиализом и введением глютатиона, а также симптоматические средства - диуретики, стероиды и пр. Ø Гомеопатическое ЛС: CADMIUM ЛС: SULFURICUM — КАДМИУМ СУЛЬФУРИКУМ v Исходное вещество. Сульфат кадмия 3 Cd. SO 48 H 2 O. 72
 • Ртуть - элемент II группы периодической Ртуть системы; атомный номер 80, атомная масса 201. Назван в честь планеты Меркурий, от лат. hydrargyrum (жидкое серебро). • Ртуть -жидкий металл серебристого цвета. Hg Ртуть жидкий металл серебристого цвета устойчива к действию воздуха и воды, не реагирует с кислотами и щелочами. Природным источником ртути служат сернистые соединения. • В качестве лечебных средств ртутные соединения использовались с древних времен. Hg. Cl 2 использовались как антисептик (сулема), сулема Hg 2 Cl 2 – как слабительное (каломель). каломель 73
• Ртуть - элемент II группы периодической Ртуть системы; атомный номер 80, атомная масса 201. Назван в честь планеты Меркурий, от лат. hydrargyrum (жидкое серебро). • Ртуть -жидкий металл серебристого цвета. Hg Ртуть жидкий металл серебристого цвета устойчива к действию воздуха и воды, не реагирует с кислотами и щелочами. Природным источником ртути служат сернистые соединения. • В качестве лечебных средств ртутные соединения использовались с древних времен. Hg. Cl 2 использовались как антисептик (сулема), сулема Hg 2 Cl 2 – как слабительное (каломель). каломель 73
 • Мертиолят (орто-этилртутьтиосалицилат натрия, Мертиолят C 9 H 9 Hg. Na. O 2 S) - консервант для вакцин. Высокая токсичность: • LD 50 для мышей составляет 66 мг/кг при подкожном введении. • В России в вакцинах мертиолят содержится в концентрации 1: 10000 (в одной прививочной дозе (0, 5 мл) содержится 0, 05 мг мертиолята). • При попадании в организм мертиолят распадается на этилртуть и тиосалицилат (thiosalicylate). Период полураспада ртути после прививки у новорожденных 3 — 7 дней. Через 30 дней количество ртути в крови возвращается к норме 74
• Мертиолят (орто-этилртутьтиосалицилат натрия, Мертиолят C 9 H 9 Hg. Na. O 2 S) - консервант для вакцин. Высокая токсичность: • LD 50 для мышей составляет 66 мг/кг при подкожном введении. • В России в вакцинах мертиолят содержится в концентрации 1: 10000 (в одной прививочной дозе (0, 5 мл) содержится 0, 05 мг мертиолята). • При попадании в организм мертиолят распадается на этилртуть и тиосалицилат (thiosalicylate). Период полураспада ртути после прививки у новорожденных 3 — 7 дней. Через 30 дней количество ртути в крови возвращается к норме 74
 • Амальгаму серебра(cплав Hg с Ag) Амальгаму серебра применяют в стоматологии для зубных пломб. • Применяется в зубоврачевании более 100 лет. Состоит из ртути, серебра, олова, и др. Ag придает амальгаме твёрдость, олово замедляет процесс твердения. • Достоинства амальгамы: твёрдость, Достоинства амальгамы пластичность, свойство не изменять цвет зуба (амальгамы последних поколений), не разрушается и не изменяется в полости рта Недостатки амальгамы: плохая прилипаемость, Недостатки амальгамы: высокая теплопроводимость, усадка и наличие ртути 75
• Амальгаму серебра(cплав Hg с Ag) Амальгаму серебра применяют в стоматологии для зубных пломб. • Применяется в зубоврачевании более 100 лет. Состоит из ртути, серебра, олова, и др. Ag придает амальгаме твёрдость, олово замедляет процесс твердения. • Достоинства амальгамы: твёрдость, Достоинства амальгамы пластичность, свойство не изменять цвет зуба (амальгамы последних поколений), не разрушается и не изменяется в полости рта Недостатки амальгамы: плохая прилипаемость, Недостатки амальгамы: высокая теплопроводимость, усадка и наличие ртути 75
 p Ртутная серная мазь (содержит около 30% металлической ртути), до 2002 г применялась наружно при кожных паразитарных заболеваниях (педикулез) и при сифилисе. p Фарм-Группа - антисептические средства, содержащие ртуть: РТУТИ ДИХЛОРИД (СУЛЕМА) Ø РТУТИ ОКИСЬ ЖЕЛТАЯ Ø РТУТИ ОКСИЦИАНИД РТУТИ ЦИАНИД Ø РТУТНАЯ МАЗЬ БЕЛАЯ (ртути аминохлорид) Ø РТУТНАЯ МАЗЬ ЖЕЛТАЯ Ø РТУТНАЯ МАЗЬ СЕРАЯ Ø РТУТНО-ВИСМУТОВАЯ МАЗЬ Ø РТУТНЫЙ ПЛАСТЫРЬ 76 Ø РТУТИ САЛИЦИЛАТ
p Ртутная серная мазь (содержит около 30% металлической ртути), до 2002 г применялась наружно при кожных паразитарных заболеваниях (педикулез) и при сифилисе. p Фарм-Группа - антисептические средства, содержащие ртуть: РТУТИ ДИХЛОРИД (СУЛЕМА) Ø РТУТИ ОКИСЬ ЖЕЛТАЯ Ø РТУТИ ОКСИЦИАНИД РТУТИ ЦИАНИД Ø РТУТНАЯ МАЗЬ БЕЛАЯ (ртути аминохлорид) Ø РТУТНАЯ МАЗЬ ЖЕЛТАЯ Ø РТУТНАЯ МАЗЬ СЕРАЯ Ø РТУТНО-ВИСМУТОВАЯ МАЗЬ Ø РТУТНЫЙ ПЛАСТЫРЬ 76 Ø РТУТИ САЛИЦИЛАТ
 • Ртуть поступает в организм человека с морской рыбой, морепродуктами и рисом, общим количеством до 0, 2 мг/кг в сутки. • В организм человека ртуть обычно поступает через легкие или желудочно-кишечный тракт. Соединения ртути хорошо растворяются в липидах, поэтому легко проникают через альвеолярную мембрану, стенку кишечника, плацентарный барьер, кожу. 77
• Ртуть поступает в организм человека с морской рыбой, морепродуктами и рисом, общим количеством до 0, 2 мг/кг в сутки. • В организм человека ртуть обычно поступает через легкие или желудочно-кишечный тракт. Соединения ртути хорошо растворяются в липидах, поэтому легко проникают через альвеолярную мембрану, стенку кишечника, плацентарный барьер, кожу. 77
 • При хроническом отравлении ртутью развивается синдром меркуриализма с нарушениями деятельности нервной системы и пищеварительного тракта, возникновением дерматозов (меркуриализм кожи). В Японии описано массовое отравление ртутью населения, получившее название «болезнь Минамата» . • Летальная доза для человека: 150 -300 мг. 78
• При хроническом отравлении ртутью развивается синдром меркуриализма с нарушениями деятельности нервной системы и пищеварительного тракта, возникновением дерматозов (меркуриализм кожи). В Японии описано массовое отравление ртутью населения, получившее название «болезнь Минамата» . • Летальная доза для человека: 150 -300 мг. 78
 • Обнаружение • В апреле 1956 года врачи местной больницы столкнулись со странным заболеванием, проявившимся у пятилетней девочки. Симптомы — затруднённые движения, вялая речь, припадки — позволяли говорить о неизвестном нервном заболевании. Двумя днями позже её сестра тоже попала в больницу с аналогичными симптомами. Опросы выявили ещё несколько подобных случаев в городе. 1 мая главный врач заявил об обнаружении нового нервного заболевания. С этого момента власти принялись за изучение этой эпидемии. Был образован специальный комитет (яп. 奇病対策委員会 кибё: Тайсаку Иинкай? , «комитет по борьбе со странной болезнью» ), в который вошли медики и представители местной администрации. Поначалу предполагалось, что заболевание является инфекционным. Постепенно стали обнаруживаться примеры странного поведения животных. Коты вели себя странно, дергались в конвульсиях, часто умирали, что было названо (яп. 猫踊り病 нэко одори ямай? , «болезнь кошачьего танца» ). Нередко с неба падали вороны, пропали водоросли, можно было часто видеть плавающую к верху брюхом рыбу. 24 апреля была сформирована комиссия с участием специалистов из университета Кумамото. 79
• Обнаружение • В апреле 1956 года врачи местной больницы столкнулись со странным заболеванием, проявившимся у пятилетней девочки. Симптомы — затруднённые движения, вялая речь, припадки — позволяли говорить о неизвестном нервном заболевании. Двумя днями позже её сестра тоже попала в больницу с аналогичными симптомами. Опросы выявили ещё несколько подобных случаев в городе. 1 мая главный врач заявил об обнаружении нового нервного заболевания. С этого момента власти принялись за изучение этой эпидемии. Был образован специальный комитет (яп. 奇病対策委員会 кибё: Тайсаку Иинкай? , «комитет по борьбе со странной болезнью» ), в который вошли медики и представители местной администрации. Поначалу предполагалось, что заболевание является инфекционным. Постепенно стали обнаруживаться примеры странного поведения животных. Коты вели себя странно, дергались в конвульсиях, часто умирали, что было названо (яп. 猫踊り病 нэко одори ямай? , «болезнь кошачьего танца» ). Нередко с неба падали вороны, пропали водоросли, можно было часто видеть плавающую к верху брюхом рыбу. 24 апреля была сформирована комиссия с участием специалистов из университета Кумамото. 79
 • Постепенно начали обнаруживаться новые особенности. Болезнь начиналась внезапно, пострадавшие лишь жаловались на снижение чувствительности в конечностях, ослабление зрения и слуха. У пациентов наблюдались нарушения координации, в результате пациенты с трудом могли брать маленькие предметы или застёгивать пуговицы, начинали спотыкаться при ходьбе, у них менялся тон голоса. После чего начинались припадки, потеря сознания. Смертность достигала 36 % — из 40 пациентов, обнаруженных к декабрю 1956 года 14 умерли. • Установление причины • Проанализировав информацию о пострадавших, учёные из университета Кумамото обнаружили, что они происходили из рыбацких деревень на побережье залива Минамата. Их основная пища состояла из морепродуктов, выловленных в этом заливе. Кроме того, обнаружилось, что у котов в этих деревнях наблюдались похожие симптомы. Это навело учёных на мысль об отравлении морепродуктов тяжелыми металлами. завод компании «Chisso» . Болезнь Минамата (яп. 水俣病 минамата-бё: ? ) — синдром, вызываемый отравлением органическими соединениями ртути, преимущественно метилртутью 80
• Постепенно начали обнаруживаться новые особенности. Болезнь начиналась внезапно, пострадавшие лишь жаловались на снижение чувствительности в конечностях, ослабление зрения и слуха. У пациентов наблюдались нарушения координации, в результате пациенты с трудом могли брать маленькие предметы или застёгивать пуговицы, начинали спотыкаться при ходьбе, у них менялся тон голоса. После чего начинались припадки, потеря сознания. Смертность достигала 36 % — из 40 пациентов, обнаруженных к декабрю 1956 года 14 умерли. • Установление причины • Проанализировав информацию о пострадавших, учёные из университета Кумамото обнаружили, что они происходили из рыбацких деревень на побережье залива Минамата. Их основная пища состояла из морепродуктов, выловленных в этом заливе. Кроме того, обнаружилось, что у котов в этих деревнях наблюдались похожие симптомы. Это навело учёных на мысль об отравлении морепродуктов тяжелыми металлами. завод компании «Chisso» . Болезнь Минамата (яп. 水俣病 минамата-бё: ? ) — синдром, вызываемый отравлением органическими соединениями ртути, преимущественно метилртутью 80
 • Степень отравления человека ртутью определяется путем анализа мочи, волос, ногтей и других биосубстратов • В РФ биологически допустимыми считаются следующие значения содержания ртути: в крови – 5 мкг/100 мл, моче – 10 мкг/л, волосах – 0, 9 мкг/г (по другим источникам – 0, 5 мкг/г). Основные проявления избытка ртути: психические нарушения; нарушения зрения и слуха, тремор кистей рук, век, губ, всего тела; Ø "ртутная" токсидермия (выпадение волос, ломкость ногтей); высокая лихорадка; "ртутный" стоматит; Ø язвенно-некротические гастроэнтериты; Ø язвенно-некротический нефрозо-нефрит; Ø расстройства менструального цикла, 81 выкидыши, внутриутробная гибель плода;
• Степень отравления человека ртутью определяется путем анализа мочи, волос, ногтей и других биосубстратов • В РФ биологически допустимыми считаются следующие значения содержания ртути: в крови – 5 мкг/100 мл, моче – 10 мкг/л, волосах – 0, 9 мкг/г (по другим источникам – 0, 5 мкг/г). Основные проявления избытка ртути: психические нарушения; нарушения зрения и слуха, тремор кистей рук, век, губ, всего тела; Ø "ртутная" токсидермия (выпадение волос, ломкость ногтей); высокая лихорадка; "ртутный" стоматит; Ø язвенно-некротические гастроэнтериты; Ø язвенно-некротический нефрозо-нефрит; Ø расстройства менструального цикла, 81 выкидыши, внутриутробная гибель плода;
 • Бойд Хейли, доктор наук, заведующий Хейли кафедрой химии в Университете Кентукки с 1996 по 2005 гг. : • Исследования биохимических нарушений при болезни Альцгеймера привели его к выводу, что основной причиной болезни является отравление ртутью. • Ртуть может быть причиной аутизма. Так, ртуть попадает внутрь и вызывают те же изменения, которые наблюдаются при болезни Альцгеймера и аутизме. 82
• Бойд Хейли, доктор наук, заведующий Хейли кафедрой химии в Университете Кентукки с 1996 по 2005 гг. : • Исследования биохимических нарушений при болезни Альцгеймера привели его к выводу, что основной причиной болезни является отравление ртутью. • Ртуть может быть причиной аутизма. Так, ртуть попадает внутрь и вызывают те же изменения, которые наблюдаются при болезни Альцгеймера и аутизме. 82
 • Цинк —Zn металл Zn голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем Zn. O). Сплав цинка с медью — латунь — был известен ещё в медью — латунь VII в. ). • Чистый цинк был получен А. С. Маргграфом в 1746 г. путём прокаливания смеси Zn. O с углём без доступа воздуха • Цинк от нем. Zinke, означающее «зубец» (кристаллы металлического 83 цинка похожи на иглы).
• Цинк —Zn металл Zn голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем Zn. O). Сплав цинка с медью — латунь — был известен ещё в медью — латунь VII в. ). • Чистый цинк был получен А. С. Маргграфом в 1746 г. путём прокаливания смеси Zn. O с углём без доступа воздуха • Цинк от нем. Zinke, означающее «зубец» (кристаллы металлического 83 цинка похожи на иглы).
 • Человек поглощает 10— 15 мг цинка в день. Наиболее высокая концентрация цинка (15 ммоль)обнаружена в предстательной железе. • Токсичность наблюдается при дозах более 150 мг в сутки. 84 84
• Человек поглощает 10— 15 мг цинка в день. Наиболее высокая концентрация цинка (15 ммоль)обнаружена в предстательной железе. • Токсичность наблюдается при дозах более 150 мг в сутки. 84 84
 • Цинк входит в состав ферментов и комплексов, обеспечивающие важнейшие физиологические функции организма: Ø образование, рост и метаболизм клеток, синтез белков, заживление ран; Ø активизация иммунных реакций; Ø усвоение углеводов и жиров; Ø поддержание и улучшение памяти; Ø поддержание обонятельной и вкусовой деятельности; Ø обеспечение стабильности сетчатки и прозрачности хрусталика глаза; Ø нормальное развитие и функционирование половых органов. 85 85
• Цинк входит в состав ферментов и комплексов, обеспечивающие важнейшие физиологические функции организма: Ø образование, рост и метаболизм клеток, синтез белков, заживление ран; Ø активизация иммунных реакций; Ø усвоение углеводов и жиров; Ø поддержание и улучшение памяти; Ø поддержание обонятельной и вкусовой деятельности; Ø обеспечение стабильности сетчатки и прозрачности хрусталика глаза; Ø нормальное развитие и функционирование половых органов. 85 85
 • Цинк является простетическим центром Цинк многих ферментов, связывается с гексамерами инсулина. • Ионы цинка в ферментах могут быть заменены ионами Mn 2+ и Co 2+ или некоторыми другими ионами без существенного снижения каталитической активности. С цинком конкурируют Cu 2+ и очень токсичный Cd 2+. • Является металлом–антиоксидантом и проявляет синергический эффект с 86 природным антиоксидантом – витамином Е
• Цинк является простетическим центром Цинк многих ферментов, связывается с гексамерами инсулина. • Ионы цинка в ферментах могут быть заменены ионами Mn 2+ и Co 2+ или некоторыми другими ионами без существенного снижения каталитической активности. С цинком конкурируют Cu 2+ и очень токсичный Cd 2+. • Является металлом–антиоксидантом и проявляет синергический эффект с 86 природным антиоксидантом – витамином Е
 Избыток цинка Ø нарушение всасывания железа и меди, способствуя развитию анемий; Ø снижение иммунитета; Ø нарушение функции поджелудочной железы, печени; Ø поражение кожи, волос, ногтей; Ø в токсических дозах вызывает рак; 87
Избыток цинка Ø нарушение всасывания железа и меди, способствуя развитию анемий; Ø снижение иммунитета; Ø нарушение функции поджелудочной железы, печени; Ø поражение кожи, волос, ногтей; Ø в токсических дозах вызывает рак; 87
 Ø Ø Ø Ø Дефицит цинка раздражительность, утомляемость, снижение памяти; бессонница; депрессия; снижение аппетита; потеря вкусовых ощущений; склонность к поносам, исхудание. высыпания на коже, угри, фурункулез; экзема, псориаз; плохое заживление ран; расслаивание ногтей, белые пятна на ногтях; тусклость, ломкость, выпадение волос; задержка роста у детей и позднее половое созревание (особенно у мальчиков); у мужчин возникает импотенция, увеличивается риск развития аденомы предстательной железы; у женщин преждевременные роды, рождение ослабленных детей; аллергические заболевания; снижение иммунитета; преждевременное старение; склонность к алкоголизму; 88 бесплодие;
Ø Ø Ø Ø Дефицит цинка раздражительность, утомляемость, снижение памяти; бессонница; депрессия; снижение аппетита; потеря вкусовых ощущений; склонность к поносам, исхудание. высыпания на коже, угри, фурункулез; экзема, псориаз; плохое заживление ран; расслаивание ногтей, белые пятна на ногтях; тусклость, ломкость, выпадение волос; задержка роста у детей и позднее половое созревание (особенно у мальчиков); у мужчин возникает импотенция, увеличивается риск развития аденомы предстательной железы; у женщин преждевременные роды, рождение ослабленных детей; аллергические заболевания; снижение иммунитета; преждевременное старение; склонность к алкоголизму; 88 бесплодие;
 Источники цинка Ø животные продукты – мясо, печень, рыба (особенно морская), яйца. Ø Наибольшее количество цинка содержится в устрицах. Ø орехи, бобовые, семена тыквы и подсолнечника, цельное зерно, однако, в растительных продуктах цинк находится в форме, плохо 89 всасывающейся в кишечнике.
Источники цинка Ø животные продукты – мясо, печень, рыба (особенно морская), яйца. Ø Наибольшее количество цинка содержится в устрицах. Ø орехи, бобовые, семена тыквы и подсолнечника, цельное зерно, однако, в растительных продуктах цинк находится в форме, плохо 89 всасывающейся в кишечнике.
 Цинка оксид • Zn. O Zinci oxydum Mr 81, 38 Получение 1. - прокаливание цинкового шпата: Zn. CO 3 Zn. O+CO 2 2. - прокаливание свежеосажденного основного карбоната цинка, который получают при взаимодействии горячего раствора кристаллической соды с водным раствором сульфата цинка: 5 Zn. SO 4 + 5 Na 2 СО 3 + ЗН 2 О 2 Zn. CO 3. 3 Zn(OH)2+ 5 Na 2 SO 4 + ЗСО 2 • Осадок основного карбоната цинка отстаивают и после слива жидкости отмывают от сульфат-ионов. После просушивания осадок основного карбоната цинка прокаливают до прекращения выделения CO 2: • 2 Zn. CO 3. 3 Zn(OH)2 ЗН 2 О + 2 CO 2 + 5 Zn. O 90 90
Цинка оксид • Zn. O Zinci oxydum Mr 81, 38 Получение 1. - прокаливание цинкового шпата: Zn. CO 3 Zn. O+CO 2 2. - прокаливание свежеосажденного основного карбоната цинка, который получают при взаимодействии горячего раствора кристаллической соды с водным раствором сульфата цинка: 5 Zn. SO 4 + 5 Na 2 СО 3 + ЗН 2 О 2 Zn. CO 3. 3 Zn(OH)2+ 5 Na 2 SO 4 + ЗСО 2 • Осадок основного карбоната цинка отстаивают и после слива жидкости отмывают от сульфат-ионов. После просушивания осадок основного карбоната цинка прокаливают до прекращения выделения CO 2: • 2 Zn. CO 3. 3 Zn(OH)2 ЗН 2 О + 2 CO 2 + 5 Zn. O 90 90
 Описание • Zn. O - белый или с желтоватым оттенком аморфный порошок, нерастворим в воде и спирте. Поглощает углекислый газ из воздуха. Zn. O + СО 2 Zn. СO 3 • Растворим в разведенных минеральных кислотах: Zn. O+2 HCl Zn. Cl 2+H 2 O 91 91
Описание • Zn. O - белый или с желтоватым оттенком аморфный порошок, нерастворим в воде и спирте. Поглощает углекислый газ из воздуха. Zn. O + СО 2 Zn. СO 3 • Растворим в разведенных минеральных кислотах: Zn. O+2 HCl Zn. Cl 2+H 2 O 91 91
 Определение подлинности • Перед испытанием на подлинность Zn. O, его переводят в растворимое соединение, добавляя кислоту или щелочь, так как это амфотерный оксид. Обычно добавляют разведенную хлороводородную кислоту, а далее – проводят реакции на ион цинка по «Общим реакциям подлинности» . • ГФ: 1. Реакция с раствором ферроцианида калия: выпадает белый осадок двойной соли, нерастворимый в кислотах, но растворимый в щелочах: 3 Zn. SO 4 + 2 K 4[Fe(CN)6] K 2 Zn 3[Fe(CN)6]2 + 3 K 2 SO 4 • 2. Na 2 S осаждает из солей цинка сульфид цинка (Zn. S) белого цвета: Zn 2+ + S 2 - Zn. S 92 92
Определение подлинности • Перед испытанием на подлинность Zn. O, его переводят в растворимое соединение, добавляя кислоту или щелочь, так как это амфотерный оксид. Обычно добавляют разведенную хлороводородную кислоту, а далее – проводят реакции на ион цинка по «Общим реакциям подлинности» . • ГФ: 1. Реакция с раствором ферроцианида калия: выпадает белый осадок двойной соли, нерастворимый в кислотах, но растворимый в щелочах: 3 Zn. SO 4 + 2 K 4[Fe(CN)6] K 2 Zn 3[Fe(CN)6]2 + 3 K 2 SO 4 • 2. Na 2 S осаждает из солей цинка сульфид цинка (Zn. S) белого цвета: Zn 2+ + S 2 - Zn. S 92 92
 ЕР: • 1. Изменение цвета цинка оксида при нагревании и последующим охлаждении: 0 t С охлаждение Zn. O белый желтый белый 93
ЕР: • 1. Изменение цвета цинка оксида при нагревании и последующим охлаждении: 0 t С охлаждение Zn. O белый желтый белый 93
 2. А). Добавляем Na. OH, образуется гидроксид цинка, который растворяется в избытке реактива с образованием гидроксокомплекса цинка: Zn. Cl 2 + 2 Na. OH 2 Na. Cl + Zn(OH)2 2 Na. OH Zn(OH)2 Na 2 [Zn(OH)4] белый тетрагидроксицинкат Na • Б) Добавляем NH 4 Cl +Na. OH = Na. Cl +NH 3 + H 2 O • Образуются аммиачные комплексы цинка: Na 2[Zn(OH)4] + 4 NH 3 [Zn(NН 3)4](ОН)2 + 2 Na. OH (комплексный аммиакат цинка) • 3. Добавляем Na 2 S. Образуется хлопьевидный белый осадок [Zn(NН 3)4](ОН)2 + Na 2 S Zn. S + 2 Na. OH + 4 NH 3 94
2. А). Добавляем Na. OH, образуется гидроксид цинка, который растворяется в избытке реактива с образованием гидроксокомплекса цинка: Zn. Cl 2 + 2 Na. OH 2 Na. Cl + Zn(OH)2 2 Na. OH Zn(OH)2 Na 2 [Zn(OH)4] белый тетрагидроксицинкат Na • Б) Добавляем NH 4 Cl +Na. OH = Na. Cl +NH 3 + H 2 O • Образуются аммиачные комплексы цинка: Na 2[Zn(OH)4] + 4 NH 3 [Zn(NН 3)4](ОН)2 + 2 Na. OH (комплексный аммиакат цинка) • 3. Добавляем Na 2 S. Образуется хлопьевидный белый осадок [Zn(NН 3)4](ОН)2 + Na 2 S Zn. S + 2 Na. OH + 4 NH 3 94
 Оценка чистоты • ГФ: Недопустимые примеси: железо, алюминий, медь, свинец, карбонаты. • 1. Для обнаружения примесей ионов железа, меди и алюминия используют общий реактив – раствор аммиака NH 3. Н 2 О : Fe(ОН)3 (бурый осадок) Сu(NH 3)4 2+ (синий цвет) Al(OH)3 (белый осадок) При этом не должно быть помутнения или окрашивания раствора. • Катионы цинка не мешают определению, т. к. с аммиаком образуют бесцветный раствор аммиаката цинка - Zn(NH 3)4 2+. 95
Оценка чистоты • ГФ: Недопустимые примеси: железо, алюминий, медь, свинец, карбонаты. • 1. Для обнаружения примесей ионов железа, меди и алюминия используют общий реактив – раствор аммиака NH 3. Н 2 О : Fe(ОН)3 (бурый осадок) Сu(NH 3)4 2+ (синий цвет) Al(OH)3 (белый осадок) При этом не должно быть помутнения или окрашивания раствора. • Катионы цинка не мешают определению, т. к. с аммиаком образуют бесцветный раствор аммиаката цинка - Zn(NH 3)4 2+. 95
 • 2. Для обнаружения примеси свинца используют реакцию получения нерастворимого в уксусной кислоте желтого хромата свинца: Рb(СН 3 СОО)2 + К 2 Сr. О 4 + CH 3 COOH Рb. Сr. O 4 + 2 CH 3 COOK желтый • 3. Карбонаты определяют по выделению Карбонаты углекислого газа прибавлении хлороводородной кислоты: Zn. СO 3 +НСl Zn. Сl 2 + СO 2 + Н 2 О • 4. Мышьяк : не более 0, 002%. Мышьяк • 5. Потеря в весе при прокаливании не 5. Потеря в весе при прокаливании 96
• 2. Для обнаружения примеси свинца используют реакцию получения нерастворимого в уксусной кислоте желтого хромата свинца: Рb(СН 3 СОО)2 + К 2 Сr. О 4 + CH 3 COOH Рb. Сr. O 4 + 2 CH 3 COOK желтый • 3. Карбонаты определяют по выделению Карбонаты углекислого газа прибавлении хлороводородной кислоты: Zn. СO 3 +НСl Zn. Сl 2 + СO 2 + Н 2 О • 4. Мышьяк : не более 0, 002%. Мышьяк • 5. Потеря в весе при прокаливании не 5. Потеря в весе при прокаливании 96
 • Оценка чистоты (ЕР): 1. Карбонаты и нерастворимые вещества в кислотах. Добавляем HCl: вещества в кислотах. раствор бесцветный и по мутности не превосходит эталон мутности II. Допустимые примеси: • 2. Кадмий: не более 10. 0 ppm. (Atomic Кадмий absorption spectrometry) • 3. Железо: не более 200 ppm. Железо • 4. Свинец : не более 50. 0 ppm. (Atomic Свинец absorption spectrometry) • 5. Потеря в весе при прокаливании при Потеря в весе при прокаливании 97 500 ± 50 °C не более 1%
• Оценка чистоты (ЕР): 1. Карбонаты и нерастворимые вещества в кислотах. Добавляем HCl: вещества в кислотах. раствор бесцветный и по мутности не превосходит эталон мутности II. Допустимые примеси: • 2. Кадмий: не более 10. 0 ppm. (Atomic Кадмий absorption spectrometry) • 3. Железо: не более 200 ppm. Железо • 4. Свинец : не более 50. 0 ppm. (Atomic Свинец absorption spectrometry) • 5. Потеря в весе при прокаливании при Потеря в весе при прокаливании 97 500 ± 50 °C не более 1%
 • Количественное определение оксида цинка в Количественное определение препарате проводят комплексонометрическим методом. • Предварительно препарат растворяют в хлороводородной кислоте. • В качестве индикатора, используют кислотный хром черный специальный в аммиачном буферном растворе. Аммиачный буфер добавляют для связывания ионов водорода, которые образуются при титровании трилоном Б Zn О + HCl → Zn. Cl 2 Ind 2 - + Zn 2+ → Zn. In Красно-фиолетовый Zn 2+ + H 2 Y 2 - → Zn. Y 2 - + 2 Н+ Zn. Ind + H 2 Y 2 - → Zn. Y 2 - +Ind 2 - + 2 H+ 98
• Количественное определение оксида цинка в Количественное определение препарате проводят комплексонометрическим методом. • Предварительно препарат растворяют в хлороводородной кислоте. • В качестве индикатора, используют кислотный хром черный специальный в аммиачном буферном растворе. Аммиачный буфер добавляют для связывания ионов водорода, которые образуются при титровании трилоном Б Zn О + HCl → Zn. Cl 2 Ind 2 - + Zn 2+ → Zn. In Красно-фиолетовый Zn 2+ + H 2 Y 2 - → Zn. Y 2 - + 2 Н+ Zn. Ind + H 2 Y 2 - → Zn. Y 2 - +Ind 2 - + 2 H+ 98
 • Титруют трилоном Б до синего окрашивания (от краснофиолетового до синего). • В пересчете на Zn. O должно быть 99100, 5% вещества. 99
• Титруют трилоном Б до синего окрашивания (от краснофиолетового до синего). • В пересчете на Zn. O должно быть 99100, 5% вещества. 99
 Применение и хранение • Применяется оксид цинка наружно как вяжущее, адсорбирующее, подсушивающее, антисептическое средство в виде присыпок, мазей и паст. • Входит в состав готовых лекарственных средств, например детская присыпка, цинковая мазь. • Содержится в специальных бинтах для перевязки ног при венозных ранах. • Хранить препарат следует в плотно Хранить закрытой таре без доступа воздуха, чтобы оксид цинка не поглощал СО 2 с образованием цинка карбоната: Zn. O + СО 2 Zn. СO 3 100
Применение и хранение • Применяется оксид цинка наружно как вяжущее, адсорбирующее, подсушивающее, антисептическое средство в виде присыпок, мазей и паст. • Входит в состав готовых лекарственных средств, например детская присыпка, цинковая мазь. • Содержится в специальных бинтах для перевязки ног при венозных ранах. • Хранить препарат следует в плотно Хранить закрытой таре без доступа воздуха, чтобы оксид цинка не поглощал СО 2 с образованием цинка карбоната: Zn. O + СО 2 Zn. СO 3 100
 Цинка сульфат Zn. SO 4. 7 Н 2 O Zinci sulfas Mr 287, 54 Сульфат цинка применялся в медицине под Сульфат цинка названием белого купороса. Такое название объясняется тем, что эта соль бесцветна в отличие от медного и железного купороса. Получение. • Сульфат цинка получают растворением цинка или его оксида в разбавленной серной кислоте: Zn + H 2 SO 4 Zn. SO 4 + H 2 Zn. O + H 2 SO 4 Zn. SO 4 + H 2 O • Обычно сырье для получения сульфата цинка бывает загрязнено такими примесями, как медь, свинец, кадмий, железо. 101
Цинка сульфат Zn. SO 4. 7 Н 2 O Zinci sulfas Mr 287, 54 Сульфат цинка применялся в медицине под Сульфат цинка названием белого купороса. Такое название объясняется тем, что эта соль бесцветна в отличие от медного и железного купороса. Получение. • Сульфат цинка получают растворением цинка или его оксида в разбавленной серной кислоте: Zn + H 2 SO 4 Zn. SO 4 + H 2 Zn. O + H 2 SO 4 Zn. SO 4 + H 2 O • Обычно сырье для получения сульфата цинка бывает загрязнено такими примесями, как медь, свинец, кадмий, железо. 101
 • Медь, свинец и кадмий не растворяются Медь, свинец и кадмий в разбавленой серной кислоте. • А для освобождения от примеси железа, железа раствор обрабатывают пероксидом водорода: 2 Fe. SO 4 + Н 2 SО 4 + Н 2 О 2 Fe 2(SO 4)3 + 2 Н 2 O • К раствору образующегося сульфата железа(III) добавляют оксид цинка в присутствии воды. Fe 2(SO 4)3 +3 Zn. O +3 Н 2 O 2 Fe(OH)3 + 3 Zn. SO 4 • Осадок гидроксида железа(III) отфильтровывают, а раствор, содержащий Zn. SO 4, упаривают до образования кристаллов соли. 102
• Медь, свинец и кадмий не растворяются Медь, свинец и кадмий в разбавленой серной кислоте. • А для освобождения от примеси железа, железа раствор обрабатывают пероксидом водорода: 2 Fe. SO 4 + Н 2 SО 4 + Н 2 О 2 Fe 2(SO 4)3 + 2 Н 2 O • К раствору образующегося сульфата железа(III) добавляют оксид цинка в присутствии воды. Fe 2(SO 4)3 +3 Zn. O +3 Н 2 O 2 Fe(OH)3 + 3 Zn. SO 4 • Осадок гидроксида железа(III) отфильтровывают, а раствор, содержащий Zn. SO 4, упаривают до образования кристаллов соли. 102
 Описание. • Цинка сульфат представляет собой бесцветные прозрачные кристаллы или мелкокристаллический порошок вяжущего металлического вкуса без запаха. • Очень легко растворим в воде, практически не растворим в спирте. Медленно растворим в глицерине (1: 10). На воздухе выветривается. 103
Описание. • Цинка сульфат представляет собой бесцветные прозрачные кристаллы или мелкокристаллический порошок вяжущего металлического вкуса без запаха. • Очень легко растворим в воде, практически не растворим в спирте. Медленно растворим в глицерине (1: 10). На воздухе выветривается. 103
 Оценка чистоты • ЕР: Ø p. H: 4. 4 - 5. 6 (5% раствор). Ø Хлориды: не более 300 ppm. Ø Железо: не более 100 ppm. • ГФ: • Недопустимые примеси: Ø Алюминий, железо, медь (с растворм аммиака) Ø Нитраты (с дифениламином) Ø Тяжелые металлы (с натрия сульфидом) Ø Магний, кальций (с натрия фосфатом) • Допустимые примеси: примеси Ø Хлориды 104 Ø мышьяк
Оценка чистоты • ЕР: Ø p. H: 4. 4 - 5. 6 (5% раствор). Ø Хлориды: не более 300 ppm. Ø Железо: не более 100 ppm. • ГФ: • Недопустимые примеси: Ø Алюминий, железо, медь (с растворм аммиака) Ø Нитраты (с дифениламином) Ø Тяжелые металлы (с натрия сульфидом) Ø Магний, кальций (с натрия фосфатом) • Допустимые примеси: примеси Ø Хлориды 104 Ø мышьяк
 Количественное определение Комплексонометрия. Содержание вещества - 99 -101%. ПРИМЕНЕНИЕ Цинка сульфат - антисептическое, вяжущее, иммуномодулирующее средство. Применяют при коньюктивите, ларингите в виде 0, 1 -0, 5% растворов. Внутрь применяют при дефиците цинка в организме. Таблетки, капсулы, глазные капли (0, 25% раствор – ВР). 105
Количественное определение Комплексонометрия. Содержание вещества - 99 -101%. ПРИМЕНЕНИЕ Цинка сульфат - антисептическое, вяжущее, иммуномодулирующее средство. Применяют при коньюктивите, ларингите в виде 0, 1 -0, 5% растворов. Внутрь применяют при дефиците цинка в организме. Таблетки, капсулы, глазные капли (0, 25% раствор – ВР). 105


