 Лекция № 9 Комплексные соединения
Лекция № 9 Комплексные соединения
 Что такое комплексные соединения? Как они образуются? валентнонасыщенные мол-лы (соединения первого порядка): NH 3, H 2 O, CO 2, KI, Hg. Cl 2, Co. Cl 2, … 1. молекулярные соединения (соединения высшего порядка): гидраты, аммиакаты, двойные соли, … Hg. Cl 2 + 2 KI =Hg. I 2 + 2 KCl Hg. I 2 + 2 KI = K 2 Hg. I 4 2. 3. Co. Cl 3 + 6 NH 3 = Co. Cl 3 · 6 NH 3 Cu. SO 4 · 5 H 2 O 4. K 2 SO 4 · Al 2(SO 4)3
Что такое комплексные соединения? Как они образуются? валентнонасыщенные мол-лы (соединения первого порядка): NH 3, H 2 O, CO 2, KI, Hg. Cl 2, Co. Cl 2, … 1. молекулярные соединения (соединения высшего порядка): гидраты, аммиакаты, двойные соли, … Hg. Cl 2 + 2 KI =Hg. I 2 + 2 KCl Hg. I 2 + 2 KI = K 2 Hg. I 4 2. 3. Co. Cl 3 + 6 NH 3 = Co. Cl 3 · 6 NH 3 Cu. SO 4 · 5 H 2 O 4. K 2 SO 4 · Al 2(SO 4)3
 Основные положения координационной теории Вернера Что такое комплексная частица ? • Комплексообразователь: атом металла в положительной СО • СО комплексообразователя + суммарный заряд лигандов = заряд комплексной частицы • Этот заряд компенсируется внешнесферными ионами • Связь комплексообразователя с лигандами более прочная нежели с внешнесферными ионами • Координационное число комплексообразователя: число лигандов на внутренней сфере. Обычно равно удвоенной СО комплексообразователя. Определяет структуру комплекса.
Основные положения координационной теории Вернера Что такое комплексная частица ? • Комплексообразователь: атом металла в положительной СО • СО комплексообразователя + суммарный заряд лигандов = заряд комплексной частицы • Этот заряд компенсируется внешнесферными ионами • Связь комплексообразователя с лигандами более прочная нежели с внешнесферными ионами • Координационное число комплексообразователя: число лигандов на внутренней сфере. Обычно равно удвоенной СО комплексообразователя. Определяет структуру комплекса.
 От эмпирических формул КС к координационным: Pt. Cl 4 • 6 NH 3 [Pt. IV(NH 3)6]Cl 4 Pt. Cl 4 • 5 NH 3 [Pt. IV(NH 3)5 Cl]Cl 3 Pt. Cl 4 • 4 NH 3 [Pt. IV(NH 3)4 Cl 2]Cl 2 Pt. Cl 4 • 3 NH 3 [Pt. IV(NH 3)3 Cl 3]Cl Pt. Cl 4 • 2 NH 3 [Pt. IV(NH 3)2 Cl 4]
От эмпирических формул КС к координационным: Pt. Cl 4 • 6 NH 3 [Pt. IV(NH 3)6]Cl 4 Pt. Cl 4 • 5 NH 3 [Pt. IV(NH 3)5 Cl]Cl 3 Pt. Cl 4 • 4 NH 3 [Pt. IV(NH 3)4 Cl 2]Cl 2 Pt. Cl 4 • 3 NH 3 [Pt. IV(NH 3)3 Cl 3]Cl Pt. Cl 4 • 2 NH 3 [Pt. IV(NH 3)2 Cl 4]
![6 III [Co(NH 3)6]3+ NH 3 x+0=3 NH 3 Co. III NH 3 Октаэдр 6 III [Co(NH 3)6]3+ NH 3 x+0=3 NH 3 Co. III NH 3 Октаэдр](https://present5.com/presentation/140522884_167921628/image-5.jpg) 6 III [Co(NH 3)6]3+ NH 3 x+0=3 NH 3 Co. III NH 3 Октаэдр
6 III [Co(NH 3)6]3+ NH 3 x+0=3 NH 3 Co. III NH 3 Октаэдр
![4 F– III [BF 4]– Ј x – 4 = – 1 F–Ј BIII 4 F– III [BF 4]– Ј x – 4 = – 1 F–Ј BIII](https://present5.com/presentation/140522884_167921628/image-6.jpg) 4 F– III [BF 4]– Ј x – 4 = – 1 F–Ј BIII F–Ј Тетраэдр
4 F– III [BF 4]– Ј x – 4 = – 1 F–Ј BIII F–Ј Тетраэдр
![II [Pt. Cl 4 4 ]2– x – 4 = – 2 Сl– ◒ II [Pt. Cl 4 4 ]2– x – 4 = – 2 Сl– ◒](https://present5.com/presentation/140522884_167921628/image-7.jpg) II [Pt. Cl 4 4 ]2– x – 4 = – 2 Сl– ◒ ◒– Сl Сl– ◒ Ј ● Pt II ◒– Сl Квадрат
II [Pt. Cl 4 4 ]2– x – 4 = – 2 Сl– ◒ ◒– Сl Сl– ◒ Ј ● Pt II ◒– Сl Квадрат
![2 I [Ag(CN)2]– x – 2 = – 1 СN– ◑ Ag. I ● 2 I [Ag(CN)2]– x – 2 = – 1 СN– ◑ Ag. I ●](https://present5.com/presentation/140522884_167921628/image-8.jpg) 2 I [Ag(CN)2]– x – 2 = – 1 СN– ◑ Ag. I ● CN– ◐ Линейная стуктура
2 I [Ag(CN)2]– x – 2 = – 1 СN– ◑ Ag. I ● CN– ◐ Линейная стуктура
 Полидентатные лиганды: СH 2 – СH 2 ╱ ╲ H 2 N NH 2 Этилендиамин (en) C 2 O 4 2– Оксалатион [Co(en)3]3+ [Fe(C 2 O 4)3]3 -
Полидентатные лиганды: СH 2 – СH 2 ╱ ╲ H 2 N NH 2 Этилендиамин (en) C 2 O 4 2– Оксалатион [Co(en)3]3+ [Fe(C 2 O 4)3]3 -
 Номенклатура КС Na. Cl, K 2 SO 4, … ⇦ Порядок перечисления фрагментов комплексной частицы: Заряженные лиганды (Cl — хлоро, ОН– — гидроксо, CN– — циано) с указанием их числа (ди-, три-, тетра- …) Нейтральные лиганды (Н 2 О — аква, NH 3 — аммин и т. п. ) Комплексообразователь (в катионе — русское название, в анионе — латинское с окончанием -ат) СО комплексообразователя
Номенклатура КС Na. Cl, K 2 SO 4, … ⇦ Порядок перечисления фрагментов комплексной частицы: Заряженные лиганды (Cl — хлоро, ОН– — гидроксо, CN– — циано) с указанием их числа (ди-, три-, тетра- …) Нейтральные лиганды (Н 2 О — аква, NH 3 — аммин и т. п. ) Комплексообразователь (в катионе — русское название, в анионе — латинское с окончанием -ат) СО комплексообразователя
![[Zn(NH 3)4]SO 4 Сульфат тетраамминцинка (II) III [Co(H 2 O)2(NH 3)3 Cl]Cl 2 x– [Zn(NH 3)4]SO 4 Сульфат тетраамминцинка (II) III [Co(H 2 O)2(NH 3)3 Cl]Cl 2 x–](https://present5.com/presentation/140522884_167921628/image-11.jpg) [Zn(NH 3)4]SO 4 Сульфат тетраамминцинка (II) III [Co(H 2 O)2(NH 3)3 Cl]Cl 2 x– 1=2 Хлорид хлоротриамминдиаквакобальта (III) [Al(H 2 O)3(OH)3] Тригидроксотриакваалюминий II K 4 [Fe(CN)6] Гексацианоферрат (II) калия (жёлтая кровяная соль) III NH 4[Cr(NH 3)2(SCN)4] x – 4 = – 1 Тетрароданодиамминхромат (III) аммония
[Zn(NH 3)4]SO 4 Сульфат тетраамминцинка (II) III [Co(H 2 O)2(NH 3)3 Cl]Cl 2 x– 1=2 Хлорид хлоротриамминдиаквакобальта (III) [Al(H 2 O)3(OH)3] Тригидроксотриакваалюминий II K 4 [Fe(CN)6] Гексацианоферрат (II) калия (жёлтая кровяная соль) III NH 4[Cr(NH 3)2(SCN)4] x – 4 = – 1 Тетрароданодиамминхромат (III) аммония
![Диссоциация КС в водных растворах α =1 [Cu(NH 3)4]SO 4 = [Cu(NH 3)4]2+ +SO Диссоциация КС в водных растворах α =1 [Cu(NH 3)4]SO 4 = [Cu(NH 3)4]2+ +SO](https://present5.com/presentation/140522884_167921628/image-12.jpg) Диссоциация КС в водных растворах α =1 [Cu(NH 3)4]SO 4 = [Cu(NH 3)4]2+ +SO 42– α << 1 [Cu(NH 3)4]2+ ⇄ Cu 2+ + 4 NH 3 Скомпл≫ Спрод. дисс [Cu 2+] [NH 3]4 Kн = ——————— = 2 · 10– 13 [ [Cu(NH 3)4]2+]
Диссоциация КС в водных растворах α =1 [Cu(NH 3)4]SO 4 = [Cu(NH 3)4]2+ +SO 42– α << 1 [Cu(NH 3)4]2+ ⇄ Cu 2+ + 4 NH 3 Скомпл≫ Спрод. дисс [Cu 2+] [NH 3]4 Kн = ——————— = 2 · 10– 13 [ [Cu(NH 3)4]2+]
 О связи Кн с устойчивостью комплексной частицы Двойные соли: (NH 4)2 SO 4 ∙ Fe. SO 4 ∙ 6 H 2 O (соль Мора) KAl(SO 4)2 ∙ 12 H 2 O (алюмокалиевые квасцы) (NH 4)2[Fe(SO 4)2](k)= 2 NH 4+ + Fe 2+ + 2 SO 42– K[Al(SO 4)2](k) = K+ + Al 3+ + 2 SO 42– Скомпл < Спрод. дисс
О связи Кн с устойчивостью комплексной частицы Двойные соли: (NH 4)2 SO 4 ∙ Fe. SO 4 ∙ 6 H 2 O (соль Мора) KAl(SO 4)2 ∙ 12 H 2 O (алюмокалиевые квасцы) (NH 4)2[Fe(SO 4)2](k)= 2 NH 4+ + Fe 2+ + 2 SO 42– K[Al(SO 4)2](k) = K+ + Al 3+ + 2 SO 42– Скомпл < Спрод. дисс
 Важнейшие типы КС 1. Аквакомплексы Если лигандами является вода комплексы называются аквакомплексами [Co(H 2 O)6]2+ [Ni(H 2 O)6] 2 + Как правило, аквакомплексы неустойчивы Аквакомплексы образуются при выделении солей из водных растворов в виде кристаллогидратов Al. Cl 3 ∙ 6 H 2 O ≡ [Al(H 2 O)6]Cl 3
Важнейшие типы КС 1. Аквакомплексы Если лигандами является вода комплексы называются аквакомплексами [Co(H 2 O)6]2+ [Ni(H 2 O)6] 2 + Как правило, аквакомплексы неустойчивы Аквакомплексы образуются при выделении солей из водных растворов в виде кристаллогидратов Al. Cl 3 ∙ 6 H 2 O ≡ [Al(H 2 O)6]Cl 3
![2. Амминокомплексы В амминокомплексах лигандами являются молекулы NH 3 [Cu(NH 3)4]2+ [Ni(NH 3)6]2+ Zn. 2. Амминокомплексы В амминокомплексах лигандами являются молекулы NH 3 [Cu(NH 3)4]2+ [Ni(NH 3)6]2+ Zn.](https://present5.com/presentation/140522884_167921628/image-15.jpg) 2. Амминокомплексы В амминокомплексах лигандами являются молекулы NH 3 [Cu(NH 3)4]2+ [Ni(NH 3)6]2+ Zn. SO 4 + 2 NH 3 ∙ H 2 O = Zn(OH)2↓ + (NH 4)2 SO 4 Zn(OH)2 + 4 NH 3 = [Zn(NH 3)4](OH)2 комплексный гидроксид цинка Комплексные гидроксиды относятся к сильным основаниям
2. Амминокомплексы В амминокомплексах лигандами являются молекулы NH 3 [Cu(NH 3)4]2+ [Ni(NH 3)6]2+ Zn. SO 4 + 2 NH 3 ∙ H 2 O = Zn(OH)2↓ + (NH 4)2 SO 4 Zn(OH)2 + 4 NH 3 = [Zn(NH 3)4](OH)2 комплексный гидроксид цинка Комплексные гидроксиды относятся к сильным основаниям
 3. Ацидокомплексы В ацидокомплексах лигандами являются анионы различных кислот. К ним относятся цианидные, галогенидные, карбонатные, оксалатные и другие комплексы. Na[Au(CN)2] - безцветный K 2[Si. F 6] H 2[Si. F 6] кремнефтористоводородная кислота Hg(NO 3)2 + 2 KI = Hg. I 2↓ + 2 KNO 3 Hg. I 2 + 2 KI = K 2[Hg. I 4] тетраиодомеркурат (II) калия (реактив Несслера) Комплексные кислоты относятся к сильным электролитам
3. Ацидокомплексы В ацидокомплексах лигандами являются анионы различных кислот. К ним относятся цианидные, галогенидные, карбонатные, оксалатные и другие комплексы. Na[Au(CN)2] - безцветный K 2[Si. F 6] H 2[Si. F 6] кремнефтористоводородная кислота Hg(NO 3)2 + 2 KI = Hg. I 2↓ + 2 KNO 3 Hg. I 2 + 2 KI = K 2[Hg. I 4] тетраиодомеркурат (II) калия (реактив Несслера) Комплексные кислоты относятся к сильным электролитам
![4. Гидроксокомплексы В гидроксокомплексах лигандами являются ионы ОН- Na 3[Al(OH)6] K 2[Sn(OH)6] Be. Cl 4. Гидроксокомплексы В гидроксокомплексах лигандами являются ионы ОН- Na 3[Al(OH)6] K 2[Sn(OH)6] Be. Cl](https://present5.com/presentation/140522884_167921628/image-17.jpg) 4. Гидроксокомплексы В гидроксокомплексах лигандами являются ионы ОН- Na 3[Al(OH)6] K 2[Sn(OH)6] Be. Cl 2 + 2 Na. OH = Be(OH)2↓ + 2 Na. Cl Be(OH)2 + 2 Na. OH = Na 2[Be(OH)4] Гидроксокомплексы образуют металлы, чьи гидроксиды амфотерны
4. Гидроксокомплексы В гидроксокомплексах лигандами являются ионы ОН- Na 3[Al(OH)6] K 2[Sn(OH)6] Be. Cl 2 + 2 Na. OH = Be(OH)2↓ + 2 Na. Cl Be(OH)2 + 2 Na. OH = Na 2[Be(OH)4] Гидроксокомплексы образуют металлы, чьи гидроксиды амфотерны
![Хелаты В хелатах комплексообразователь и лиганды образуют замкнутые циклы [Cu(NH 3)4]2+ H 3 N Хелаты В хелатах комплексообразователь и лиганды образуют замкнутые циклы [Cu(NH 3)4]2+ H 3 N](https://present5.com/presentation/140522884_167921628/image-18.jpg) Хелаты В хелатах комплексообразователь и лиганды образуют замкнутые циклы [Cu(NH 3)4]2+ H 3 N NH 3 Cu. II H 3 N NH 3 [Cu(en)2]2+ CH 2— NH 2 Cu. II CH 2— NH 2 H 2 N — CH 2 Хелаты отличаются повышенной прочностью Правило Чугаева: наиболее устойчивы хелаты с 5– 6 -членными циклами “Хелат” – клешни рака
Хелаты В хелатах комплексообразователь и лиганды образуют замкнутые циклы [Cu(NH 3)4]2+ H 3 N NH 3 Cu. II H 3 N NH 3 [Cu(en)2]2+ CH 2— NH 2 Cu. II CH 2— NH 2 H 2 N — CH 2 Хелаты отличаются повышенной прочностью Правило Чугаева: наиболее устойчивы хелаты с 5– 6 -членными циклами “Хелат” – клешни рака
![Природа химической связи в КС ? – Ионная связь [Zn(NH 3)4]Cl 2 Ковалентная связь Природа химической связи в КС ? – Ионная связь [Zn(NH 3)4]Cl 2 Ковалентная связь](https://present5.com/presentation/140522884_167921628/image-19.jpg) Природа химической связи в КС ? – Ионная связь [Zn(NH 3)4]Cl 2 Ковалентная связь
Природа химической связи в КС ? – Ионная связь [Zn(NH 3)4]Cl 2 Ковалентная связь
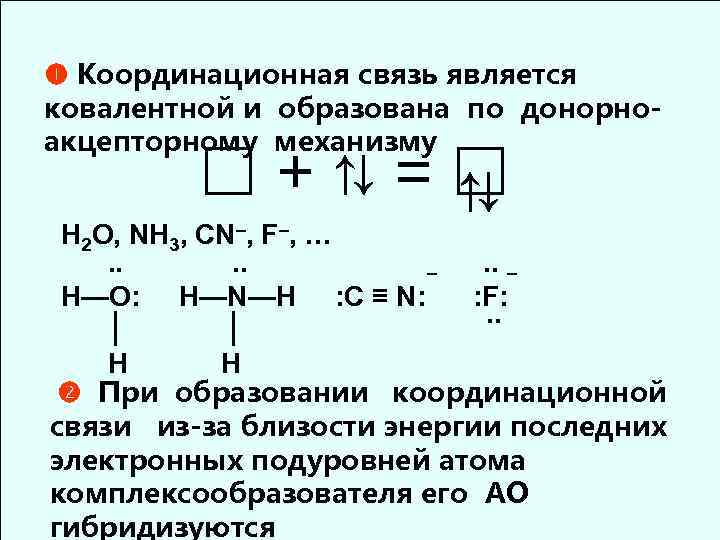 Координационная связь является ковалентной и образована по донорноакцепторному механизму +⇅= ⇅ H 2 O, NH 3, CN–, F–, …. . . – – H—O: H—N—H : С ≡ N: : F: . . │ │ H H При образовании координационной связи из-за близости энергии последних электронных подуровней атома комплексообразователя его АО гибридизуются
Координационная связь является ковалентной и образована по донорноакцепторному механизму +⇅= ⇅ H 2 O, NH 3, CN–, F–, …. . . – – H—O: H—N—H : С ≡ N: : F: . . │ │ H H При образовании координационной связи из-за близости энергии последних электронных подуровней атома комплексообразователя его АО гибридизуются
3 Cr 0 [Ar] 3 d 54 s 1 3 6 [Cr(H 2 O)6](NO 3)3 Cr 0 [Ar] 3 d 54 s 1 3](https://present5.com/presentation/140522884_167921628/image-21.jpg) 6 [Cr(H 2 O)6](NO 3)3 Cr 0 [Ar] 3 d 54 s 1 3 d 4 s 4 p Cr 3+ ↑↑↑ [Cr(H 2 O)6]3+ ↑↑↑ ⇅⇅ ⇅ d 2 sp 3 октаэдр [Cr(H 2 O)6](NO 3)3 - парамагнетик
6 [Cr(H 2 O)6](NO 3)3 Cr 0 [Ar] 3 d 54 s 1 3 d 4 s 4 p Cr 3+ ↑↑↑ [Cr(H 2 O)6]3+ ↑↑↑ ⇅⇅ ⇅ d 2 sp 3 октаэдр [Cr(H 2 O)6](NO 3)3 - парамагнетик
![K 4[Fe(CN)6] μ=0 Fe 0 [Ar] 3 d 64 s 2 3 d 6 K 4[Fe(CN)6] μ=0 Fe 0 [Ar] 3 d 64 s 2 3 d 6](https://present5.com/presentation/140522884_167921628/image-22.jpg) K 4[Fe(CN)6] μ=0 Fe 0 [Ar] 3 d 64 s 2 3 d 6 4 s 4 p Fe 2+ ⇅↑↑ ↑ ↑ [Fe(CN)6]4– ⇅⇅⇅ ⇅⇅ ⇅ d 2 sp 3 октаэдр K 4[Fe(CN)6] - диамагнетик
K 4[Fe(CN)6] μ=0 Fe 0 [Ar] 3 d 64 s 2 3 d 6 4 s 4 p Fe 2+ ⇅↑↑ ↑ ↑ [Fe(CN)6]4– ⇅⇅⇅ ⇅⇅ ⇅ d 2 sp 3 октаэдр K 4[Fe(CN)6] - диамагнетик
![6 [Ni(NH 3)6]Br 2 μ>0 Ni 0 [Ar] 3 d 84 s 2 3 6 [Ni(NH 3)6]Br 2 μ>0 Ni 0 [Ar] 3 d 84 s 2 3](https://present5.com/presentation/140522884_167921628/image-23.jpg) 6 [Ni(NH 3)6]Br 2 μ>0 Ni 0 [Ar] 3 d 84 s 2 3 d 4 s 4 p ⇅⇅⇅↑↑ Ni 2+ [Ni(NH 3)6]2+ 3 d 4 s 4 p 4 d ⇅⇅⇅↑↑ ⇅ ⇅⇅⇅ ⇅ ⇅ sp 3 d 2 октаэдр …
6 [Ni(NH 3)6]Br 2 μ>0 Ni 0 [Ar] 3 d 84 s 2 3 d 4 s 4 p ⇅⇅⇅↑↑ Ni 2+ [Ni(NH 3)6]2+ 3 d 4 s 4 p 4 d ⇅⇅⇅↑↑ ⇅ ⇅⇅⇅ ⇅ ⇅ sp 3 d 2 октаэдр …
![4 Na 2[Zn(OH)4] Zn 0 [Ar] 3 d 104 s 2 3 d Zn 4 Na 2[Zn(OH)4] Zn 0 [Ar] 3 d 104 s 2 3 d Zn](https://present5.com/presentation/140522884_167921628/image-24.jpg) 4 Na 2[Zn(OH)4] Zn 0 [Ar] 3 d 104 s 2 3 d Zn 2+ [Zn(OH)4]2–Ј 4 s 4 p ⇅⇅⇅⇅⇅ ⇅⇅⇅⇅⇅ ⇅ ⇅⇅⇅ sp 3 тетраэдр
4 Na 2[Zn(OH)4] Zn 0 [Ar] 3 d 104 s 2 3 d Zn 2+ [Zn(OH)4]2–Ј 4 s 4 p ⇅⇅⇅⇅⇅ ⇅⇅⇅⇅⇅ ⇅ ⇅⇅⇅ sp 3 тетраэдр
![4 K 2[Ni(CN)4] μ=0 Ni 0 [Ar] 3 d 84 s 2 3 d 4 K 2[Ni(CN)4] μ=0 Ni 0 [Ar] 3 d 84 s 2 3 d](https://present5.com/presentation/140522884_167921628/image-25.jpg) 4 K 2[Ni(CN)4] μ=0 Ni 0 [Ar] 3 d 84 s 2 3 d Ni 2+ [Ni(СN)4]2–Ј 4 s 4 p ⇅⇅⇅↑↑ ⇅⇅ ⇅ ⇅⇅ dsp 2 квадрат
4 K 2[Ni(CN)4] μ=0 Ni 0 [Ar] 3 d 84 s 2 3 d Ni 2+ [Ni(СN)4]2–Ј 4 s 4 p ⇅⇅⇅↑↑ ⇅⇅ ⇅ ⇅⇅ dsp 2 квадрат
![[Ag(NH 3)2]Cl Ag 0 2 [Kr] 4 d 105 s 1 4 d 5 [Ag(NH 3)2]Cl Ag 0 2 [Kr] 4 d 105 s 1 4 d 5](https://present5.com/presentation/140522884_167921628/image-26.jpg) [Ag(NH 3)2]Cl Ag 0 2 [Kr] 4 d 105 s 1 4 d 5 s 5 p Ag+ ⇅⇅⇅⇅⇅ [Ag(NH 3)2]+ ⇅⇅⇅⇅⇅ ⇅ ⇅ sp линейная структура
[Ag(NH 3)2]Cl Ag 0 2 [Kr] 4 d 105 s 1 4 d 5 s 5 p Ag+ ⇅⇅⇅⇅⇅ [Ag(NH 3)2]+ ⇅⇅⇅⇅⇅ ⇅ ⇅ sp линейная структура


